Биоорганическая химия, 2019, T. 45, № 4, стр. 404-411
Ингибиторный эффект фактора транскрипции YB-1 при формировании сигнала от NOD2-рецептора врожденного иммунитета
Л. Г. Алексеева 1, *, А. Г. Ламан 2, А. О. Шепеляковская 2, Н. С. Плеханова 1, В. Т. Иванов 1
1 ФГБУН Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, ГСП-7, ул. Миклухо-Маклая, 16/10, Россия
2 ФГБУН Филиал Института биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН
142290 Пущино, проспект Науки, 6, Россия
* E-mail: luda.alekseeva@mail.ru
Поступила в редакцию 14.01.2019
После доработки 22.02.2019
Принята к публикации 12.03.2019
Аннотация
Установлено, что рекомбинантный фактор транскрипции YB-1 ингибирует ответ лейкемических моноцитов человека линии ТНР-1 на стимуляцию N-ацетилглюкозаминил-N-ацетилмурамоил-аланил-D-изоглутамином (GMDP) и липополисахаридом (LPS), что проявляется в уменьшении относительного содержания мРНК провоспалительного цитокина IL-1β, рецепторов врожденного иммунитета NOD2 и TLR4, их адапторных молекул RIP2 и MyD88 и субъединиц р105/р50 (NF-kB1) и р100/р52 (NF-kB2) комплекса фактора транскрипции NF-kB. Ингибирующий эффект YB-1 проявлялся также в снижении уровня белка р65 (RelA NF-kB) в ядрах клеток, стимулированных LPS и GMDP/LPS. Инактивация гена NOD2 в клетках ТНР-1 приводила к снижению мРНК IL-1β при ответе на GMDP, LPS и GMDP/LPS. В то же время инактивация гена YB-1 приводила к повышению относительного содержания мРНК IL-1β и остальных молекул под действием GMDP, но при стимуляции LPS и GMDP/LPS наблюдалось снижение уровня мРНК IL-1β по сравнению с исходными клетками, что свидетельствует о необходимости YB-1 для индукции оптимального иммунного ответа. Таким образом, полученные данные указывают на участие YB-1 в системе рецепторов врожденного иммунитета в качестве негативного регулятора активности NOD2-рецептора.
ВВЕДЕНИЕ
Рецептор врождeнного иммунитета NOD2 задействован во множестве процессов, протекающих в организме, и играет важнейшую роль при поддержании нормального гомеостаза тканей, развитии сердечно-сосудистых патологий (атеросклероза, ишемической болезни сердца) и диабета, инфекционных и онкологических заболеваниях, болезнях нервной системы и т.д [1–3]. Комплексность сигналов, транслируемых NOD2, объясняется наличием у данного рецептора множества партнеров – на сегодняшний день известно более 30 белков, способных непосредственно с ним взаимодействовать и соответственно регулировать его функциональную активность [4].
NOD2 распознает низкомолекулярные фрагменты пептидогликана клеточной стенки бактерий, в частности мурамоилдипептид (MDP) [5], а также его дисахаридсодержащий аналог глюкозаминилмурамоилдипептид (GMDP) [6]. При распознавании лиганда рецепторы олигомеризуются и взаимодействуют с адапторным белком RIP2 (от англ. receptor interacting serine/threonine protein kinase 2), что приводит к активации канонических NF-kB и MAPK сигнальных путей [7] и далее к продукции провоспалительных цитокинов и антимикробных пептидов (рис. 1).
Рис. 1.
Cхема сигнальных путей от рецепторов врожденного иммунитета NOD2 и TLR4. Серым цветом и жирным шрифтом показаны молекулы, анализируемые в настоящей работе.

Ранее мы показали, что в распознавание мурамоилпептида GMDP рецептором NOD2 вовлечен фактор транскрипции YB-1 [8, 9], причем YB-1 был способен специфически взаимодействовать как с GMDP, так и с NOD2-белком. При иммунопреципитации антитела к YB-1 реагировали с белковым комплексом, который при анализе методом иммуноблотинга давал четкую полосу продукта с молекулярной массой, соответствующей массе NOD2, распознаваемого также анти-NOD2-антителами. Анти-NOD2-антитела позволяли выявить белок с размером, соответствующим YB-1, реагирующий с анти-YB-1-антителами. Методом конкурентного ИФА со специфичными к YB-1 моноклональными антителами было определено, что белок YB-1 способен в присутствии GMDP формировать комплекс с рекомбинантным фрагментом NOD2-273-1040 (включающим NOD- и LRR-домены); константа диссоциации комплекса составила 4 × 10–8. С помощью конфокальной микроскопии была продемонстрирована совместная локализация белков NOD2 и YB-1 в клетке.
В работе [10] было обнаружено увеличение синтеза фактора транскрипции YB-1 в стабильно экспрессирующих рецептор NOD2 клетках при стимуляции их MDP. GMDP совместно с рекомбинантным белком YB-1 стимулировал экспрессию мРНК фактора Nf-kB2 (p52) и хемокина Cxcr4 в клеточной линии моноцитов мышей WEHI-3 [8]. Кроме того, добавление экзогенного YB-1 усиливало экспрессию Nf-kb2 в ответ на стимуляцию GMDP в клетках с NOD2-нокдаунами [9], что подтверждает участие YB-1 в NOD2- и MDP/GMDP-зависимом иммунном ответе, но его точная функция и механизм действия остаются до настоящего времени неизвестными.
С целью изучения роли фактора транскрипции YB-1 при формировании сигнала от NOD2-рецептора мы оценивали влияние рекомбинантного белка YB-1 на ответ лейкемических моноцитов человека линии ТНР-1 при стимуляции их GMDP, при этом анализировалось относительное содержание мРНК провоспалительного цитокина IL-1β и ряда молекул, участвующих в активации сигнального пути фактора транскрипции NF-kB. Также были получены клетки линии ТНР-1 с инактивированными генами, кодирующими молекулы NOD2 и YB-1. При анализе клеточного ответа было показано, что фактор транскрипции YB-1 ингибировал индуцированный GMDP иммунный ответ, что хорошо коррелировало с увеличением экспрессии практически всех исследованных молекул в нокаутных по YB-1 клетках.
Так как одной из наиболее хорошо охарактеризованных иммунологических реакций является сильный синергетический эффект между рецепторами NOD2 и TLR4 (лиганд LPS) [11], мы оценивали также влияние YB-1 на ответ, индуцированный при совместном действии GMDP и LPS. Важными адапторными молекулами для семейства TLR, обеспечивающими специфичность формируемого при этом сигнала, являются белки MyD88, TRIF, TRAM и MAL/TIRAM [12] (рис. 1). При активации комплекса MyD88-IRAK (от англ. interleukin-1 receptor-associated kinase) 1-IRAK4 рекрутируется и активируется TRAF6 (от англ. TNFR-associated factor 6). Далее TRAF6 катализирует присоединение полиубиквитиновых цепочек к регуляторной единице IKK (от англ. IκB kinase) комплекса NEMO (от англ. NF-kB essential regulator). Полиубиквитиновые цепочки рекрутируют TAK1 (от англ. TGF-β-activating kinase 1) и связанные с ней белки TAB1, TAB2 и TAB3, что приводит к фосфорилированию и активации IKKα/β-комплекса [13, 14] и последующему высвобождению компонентов NF-kB, которые в виде димеров транслоцируются в ядро и активируют транскрипцию и последующий синтез провоспалительных цитокинов [15].
Таблица 1.
Синтетические олигонуклеотиды, используемые для амплификации к ДНК
| Ген белка | Прямой праймер (5'-3') | Обратный праймер (5'-3') |
|---|---|---|
| HPRT1 | cctgctggattacatcaaagcactg | tccaacacttcgtggggtcct |
| B2M | atgagtatgcctgccgtgtg | ccaaatgcggcatcttcaaac |
| IL-1β | acagtggcaatgaggatg | tgtagtggtggtcggaga |
| NOD2 | caatgtcacccacagagttgtagtcc | ggcacctcaagttgacattttgc |
| RIP2 | ccattgagatttcgcatcct | atgcgccactttgataaacc |
| TLR4 | acagaagctggtggctgtg | tctttaaatgcacctggttgg |
| MyD88 | ttgaggaggattgccaaaag | ggggtcatcaagtgtggtg |
| p105/p50 | cagcagatggcccatacctt | ttgcagattttgacctgagggt |
| p100/p52 | acacgtaccgacagacaacc | ttccttcacctctgtgctgg |
Таблица 2.
Относительный уровень экспрессии мРНК (cм. экспериментальную часть) в клетках линии ТНР-1 при стимуляции их GMDP в присутствии рекомбинантного фактора транскрипции YB-1
| мРНК | Отношение мРНКэксп/мРНКконтр | ||
|---|---|---|---|
| GMDP | YB-1 | GMDP + + YB-1 | |
| IL-1β | 4.20 ± 0.21 | 2.07 ± 0.27 | 1.77 ± 0.11 |
| NOD2 | 1.24 ± 0.17 | 1.45 ± 0.10 | 1.25 ± 0.19 |
| TLR4 | 0.94 ± 0.08 | 1.17 ± 0.06 | 0.56 ± 0.05 |
| RIP2 | 1.06 ± 0.12 | 1.54 ± 0.12 | 0.95 ± 0.10 |
| MyD88 | 0.36 ± 0.03 | 0.35 ± 0.04 | 0.27 ± 0.02 |
| р105/р50 | 0.81 ± 0.05 | 1.05 ± 0.11 | 1.09 ± 0.08 |
| р100/р52 | 2.69 ± 0.30 | 2.57 ± 0.21 | 1.23 ± 0.15 |
Таблица 3.
Относительный уровень экспрессии мРНК (см. экспериментальную часть) в клетках линии ТНР-1 при стимуляции их LPS и GMDP в присутствии рекомбинантного фактора транскрипции YB-1
| мРНК | Отношение мРНКэксп/мРНКконтр | |||
|---|---|---|---|---|
| LPS | LPS + YB-1 | GMDP + LPS | GMDP + LPS + YB-1 | |
| IL-1β | 192.67 ± 21.19 | 99.04 ± 4.95 | 935.76 ± 46.79 | 66.25 ± 7.95 |
| NOD2 | 1.53 ± 0.09 | 0.92 ± 0.07 | 5.98 ± 0.60 | 0.49 ± 0.03 |
| TLR4 | 1.30 ± 0.17 | 0.66 ± 0.04 | 6.06 ± 0.48 | 0.64 ± 0.08 |
| RIP2 | 2.17 ± 2.20 | 2.58 ± 0.34 | 19.43 ± 1.75 | 1.21 ± 0.15 |
| MyD88 | 0.28 ± 0.04 | 0.11 ± 0.02 | 1.10 ± 0.12 | 0.05 ± 0.01 |
| р105/р50 | 3.10 ± 0.43 | 0.91 ± 0.08 | 29.04 ± 2.61 | 1.64 ± 0.11 |
| р100/р52 | 5.82 ± 0.57 | 2.30 ± 0.35 | 36.5 ± 4.38 | 1.27 ± 0.14 |
Как и в предыдущем случае, мы оценивали содержание мРНК IL-1β и ряда молекул сигнальных путей от NOD2- и TLR4-рецепторов в исходных клетках и клетках, нокаутированных по генам NOD2 и YB-1.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
YB-1 представляет собой эволюционно консервативный мультифункциональный белок [16, 17], присутствующий как во внутриклеточном, так и внеклеточном пространстве [18], при этом известно, что внеклеточный YB-1 эффективно интернализуется клетками. Важно отметить, что уровень YB-1 повышается при воспалении и очень сильно увеличен у больных с сепсисом [19].
В дополнение к хорошо изученным свойствам YB-1 взаимодействовать с ДНК и РНК, влияя на процессы транскрипции и трансляции, мы показали, что существует ассоциация между YB-1 и рецептором NOD2, и оба компонента комплекса необходимы для нормального развития иммунного ответа [9].
В данной работе на первоначальном этапе мы оценивали влияние рекомбинантного белка YB-1 на индуцированную GMDP экспрессию ряда факторов: мРНК провоспалительного цитокина IL-1β, рецепторов врожденного иммунитета NOD2 и TLR4, соответствующих их адапторных молекул RIP2 и MyD88 и субъединиц р105/р50 (NF-kB1) и р100/р52 (NF-kB2) транскрипционного комплекса NF-kB (см. рис. 1). Клетки линии лейкемических моноцитов человека ТНР-1 стимулировали GMDP в концентрации 10 мкг/мл в присутствии YB-1 (концентрация 1 мкг/мл) и через 2 ч оценивали изменение экспрессии мРНК методом количественного ПЦР-анализа, совмещeнного с обратной транскрипцией. Специфические олигонуклеотиды, используемые для амплификации фрагментов целевых молекул, приведены в табл. 1. Как можно видеть из результатов, приведенных в табл. 2, GMDP стимулировал продукцию IL-1β и белка р100/р52, в то время как YB-1 оказывал выраженный ингибирующий эффект на экспрессию мРНК данных молекул.
Для дальнейшего изучения функции YB-1 были получены клетки с отдельно инактивированными генами NOD2 и YB-1. Для этой цели с использованием плазмид RNAi-Ready pSYREN-RetroQ-TetH (технология Knockout Inducible RNAi Systems, Clontech Laboratories) была проведена стабильная трансфекция клеток ТНР-1. Последовательности олигонуклеотидов, кодирующие специфическую антисмысловую РНК, вводили после PolIII-промотера. Трансфекцию клеток проводили методом электропорации; для селекции клонов клетки культивировали в присутствии гигромицина в концентрации 250 мкг/мл. Ингибирование функции целевых генов NOD2 и YB-1 оценивали по снижению относительного содержания их мРНК методом ПЦР (данные не показаны).
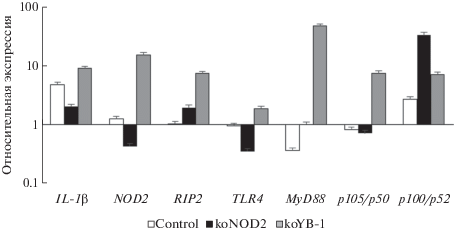
Нокаутные по NOD2 и YB-1 клетки аналогичным образом обрабатывали GMDP; полученные данные приведены на рис. 2. В то время как продукция IL-1β под действием GMDP в клетках с пониженным содержанием NOD2 была ожидаемо снижена, нокаутные по YB-1 клетки демонстрировали повышенный относительный уровень мРНК IL-1β, а также всех остальных проанализированных молекул.
Рис. 2.
Относительные уровни экспрессии мРНК провоспалительного цитокина IL-1β, рецепторов NOD2 и TLR4, адапторных молекул RIP2 и MyD88 и субъединиц р105/р50 и p100/p52 фактора транскрипции NF-kB при стимуляции GMDP в клетках линии ТНР-1 с инактивированными генами NOD2 (koNOD2) и YB-1 (koYB-1).
Известно, что GMDP совместно с LPS-лигандом TLR4-рецептора врожденного иммунитета, при продукции провоспалительных цитокинов проявляют ярко выраженную синергическую реакцию [11], что свидетельствует о взаимосвязи сигнальных путей NOD2- и TLR4-рецепторов, хотя точные механизмы их взаимодействия остаются неизвестными. C использованием клеточной линии макрофагов мыши J774 ранее мы показали, что GMDP и LPS взаимообразно влияют на экспрессию своих рецепторов и их белков-адапторов – RIP2 (NOD2) и MyD88 (TLR4), причем особенно значительными были стимулирующие эффекты LPS при экспрессии NOD2 и GMDP при экспрессии MyD88 [6]. В настоящей работе мы оценивали влияние YB-1 на клеточный ответ, индуцированный через сигнальный путь TLR4-рецептора, т.е. либо LPS, либо комбинацией лигандов GMDP/LPS. Аналогичный выявленному ранее при ответе на GMDP ингибиторный эффект YB-1 демонстрировал практически для всех исследованных молекул и в данном случае (табл. 3).
Подобное же действие мы наблюдали также при анализе методом ИФА концентрации еще одной субъединицы NF-kB – белка р65 (RelA) в ядерной фракции клеток ТНР-1 (табл. 4).
Таблица 4.
Концентрация белка р65 в ядерной фракции клеток линии ТНР-1 (3 × 106) при стимуляции их GMDP и LPS в присутствии рекомбинантного фактора транскрипции YB-1
| Время, мин | Концентрация р65, нг/мл | |||
|---|---|---|---|---|
| Контроль | LPS | LPS + GMDP | LPS + GMDP + YB-1 | |
| 30 | 4.2 ± 1.1 | 5.4 ± 1.6 | 10.9 ± 2.9 | 6.3 ± 1.9 |
| 45 | 5.3 ± 1.4 | 9.1 ± 1.8 | 7.5 ± 2.1 | |
Напротив, из данных, представленных на рис. 3, следует, что стимуляции LPS или GMDP/LPS в обоих типах нокаутных клеток приводит к снижению относительного уровня мРНК IL-1β по сравнению с исходными клетками, т.е. обе молекулы – NOD2 и/или YB-1 необходимы для индукции оптимального иммунного ответа. Важно отметить, что при стимуляции клеток либо только GMDP, либо только LPS, в обоих случаях оказывались задействованными рецепторы TLR4 и NOD2 и фактор транскрипции YB-1, а также адапторные молекулы RIP2 (NOD2) и MyD88 (TLR4).
Рис. 3.
Относительные уровни экспрессии мРНК провоспалительного цитокина IL-1β, рецепторов NOD2 и TLR4, адапторных молекул RIP2 и MyD88 и субъединиц р105/р50 и p100/p52 фактора транскрипции NF-kB при стимуляции LPS и GMDP/LPS в клетках линии ТНР-1 с инактивированными генами NOD2 (koNOD2) и YB-1 (koYB-1).
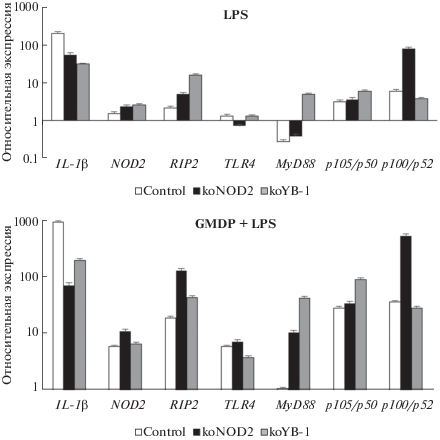
В целом, полученные результаты показывают, что инактивация YB-1 повышает чувствительность клеток к GMDP и LPS, проявляющуюся в увеличении уровней относительной экспрессии всех проанализированных молекул; единственными исключениями были мРНК p100/p52 при стимуляции LPS и мРНК TLR4 и p100/p52 при стимуляции GMDP/LPS. Таким образом, показано, что фактор транскрипции YB-1 участвует в процессе формирования сигнала от рецепторов врожденного иммунитета и влияет на уровень мРНК как рецепторов NOD2 и TLR4, так и их адапторных молекул RIP2 и MyD88. Мы предполагаем, что белок YB-1 может функционировать как негативный регулятор активности NOD2-рецептора, хотя данный вывод противоречит результатам предыдущей работы [8], где добавление YB-1 стимулировало продукцию фактора Nf-kB2 (p52) и хемокина Cxcr4 в клеточной линии моноцитов мышей WEHI-3; разрешение данного противоречия требует дополнительных исследований.
ЗАКЛЮЧЕНИЕ
Полученные нами данные подтверждают, что фактор транскрипции YB-1 ингибирует активацию синтеза провоспалительного цитокина IL-1β, индуцированную GMDP через NOD2-рецептор и LPS через TLR4-рецептор и связанные с ними молекулы. Но при пониженном уровне экспрессии YB-1 наблюдалось снижение иммунного ответа по сравнению с исходными клетками в ответ на стимуляцию LPS или GMDP/LPS. Конкретные механизмы взаимодействия всех указанных молекул требуют дальнейшего исследования.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. В работе были использованы: GMDP, предоставленный ЗАО “Пептек”; LPS, E. coli Serotype 055:B5, Sigma; рекомбинантный белок YB-1 был экспрессирован в Escherichia coli и очищен как описано ранее в [20].
Клетки. Работа выполнена на клеточной линии лейкемических моноцитов человека ТНР-1, полученной из коллекции Института цитологии РАН, Санкт-Петербург. Клетки культивировали в среде RPMI-1640, содержащей 10% эмбриональной фетальной сыворотки, при 37°С и 5% СО2.
Для проведения эксперимента клетки вносили в лунки 12-луночного планшета в концентрации 2 × 106 клеток в 3 мл среды на лунку. К клеткам добавляли GMDP в концентрации 10 мкг/мл, и/или LPS в концентрации 0.1 мкг/мл и/или рекомбинантный белок YB-1 в концентрации 1 мкг/мл и инкубировали клетки в течение 4 ч.
ПЦР. Тотальную РНК из клеток выделяли реагентом TRIzol® (Invitrogen, США) по протоколу фирмы-производителя.
Для синтеза кДНК осуществляли реакцию обратной транскрипции с использованием фермента Mint (Евроген, Россия) и poly(Т)-праймера по стандартному протоколу фирмы-производителя.
Полимеразную цепную реакцию проводили в термоциклере CX96 (BioRad, США). Реакционная смесь объемом 12.5 мкл содержала: 1 мкг кДНК, 2.5 мкл готовой 5-кратной реакционной смеси qPCRmix-HS SYBR (“Евроген”, Россия), в которую входят Taq-ДНК-полимеразы со специфическими моноклональными антителами, краситель SYBR Green I, смесь нуклеозидтрифосфатов, MgCl2, ПЦР-буфер, и по 10 пмоль каждого из двух специфичных олигонуклеотидов.
Протокол амплификации включал: 1 цикл продолжительностью 4 мин денатурации при 94°С, 40 циклов: по 20 с при 94°С для денатурации цепей ДНК, 20 с при 60°С для отжига праймеров с матрицей) и 40 с при 72°С для синтеза комплементарных цепей ДНК, и 1 цикл завершающего синтеза в течение 3 мин при 72°С. Расчет относительного уровня мРНК целевых генов был выполнен с использованием 2–ΔΔCt-метода [21]. Относительная концентрация субстрата была нормализована по усредненным данным амплификации двух эндогенных генов сравнения — HPRT1 и В2М: deltaCt = Ct(target gene) – Ct(reference gene), где Сt – количество циклов, требуемых для достижения порогового значения флуоресценции. Все реакции проводили в двух повторностях и включали негативный контроль без обратной транскриптазы.
ИФА. Для определения содержания белка р65 клетки вносили в лунки 12-луночного планшета из расчета 1 × 106 клеток/лунку в 1 мл среды. В лунки к клеткам добавляли различные комбинации лигандов, взятых в следующих концентрациях: LPS – 0.1 мкг/мл; GMDP – 10 мкг/мл; рекомбинантный белок YB-1 – 1 мкг/мл. Клетки инкубировали в течение 30 или 45 мин и далее определяли содержание белка р65 методом “сэндвич”-ИФА с помощью набора Imgenex (США) по протоколу фирмы-производителя.
Клетки с инактивированными генами NOD2 и YB-1. Клетки с инактивированными генами, кодирующими белки NOD2 и YB-1, получены с использованием технологии Knockout Inducible RNAi Systems, Clontech Laboratories, которая обеспечивает экспрессию малой интерферирующей РНК (миРНК) и ее эффективную доставку в клетки различных типов [22, 23]. Последовательности олигонуклеотидов, кодирующие специфическую антисмысловую РНК: 5'-GGGTCCTCCACGCAATTAC-3' для YB-1 [8] и 5'-TTGATCTCGCTGCGGTGAA-3' для NOD2 [9], вводили после Pol III-промотора. Полученные плазмиды были использованы для стабильной трансфекции клеток, которую проводили методом электропорации; для селекции клонов клетки культивировали в присутствии 250 мкг/мл гигромицина. Ингибирование функции целевых генов оценивали по снижению относительного содержания их мРНК методом количественного ПЦР-анализа.
ФОНДОВАЯ ПОДДЕРЖКА
Работа выполнена при финансовой поддержке РФФИ в рамках научного проекта 16-04-01152а.
Список литературы
Elinav E., Strowig T., Henao-Mejia J., Flavell R.A. // Immunity. 2011. V. 34. P. 665–679.
Motta V., Soares F., Sun T., Philpott D.J. // Physiol. Rev. 2015. V. 95. P. 149–178.
Negroni A., Pierdomenico M., Cucchiara S., Stronati L. // J. Inflamm. Res. 2018. V. 11. P. 49–60.
Boyle J.P., Parkhouse R., Monie T.P. // Open Biol. 2014. V. 4. pii: 140178.
Girardin S.E., Boneca I.G., Viala J., Chamaillard M., Labigne A., Thomas G., Philpott D.J., Sansonetti P.J. // J. Biol. Chem. 2003. V. 278. P. 8869–8872.
Мещерякова Е.А., Алексеева Л.Г., Андронова Т.М. // Российский иммунологический журнал. 2015. Т. 9. С. 301–323. [Meshcheryakova E.A., Alekseeva L.G., Andronova T.M. // Russ. J. Immunol. 2015. V. 9. P. 301–323.]
Chen G., Shaw M.H., Kim Y.G., Nuñez G. // Annu. Rev. Pathol. 2009. V. 4. P. 365–398.
Laman A.G., Lathe R., Savinov G.V., Shepelyakovskaya A.O., Boziev Kh.M., Baidakova L.K., Chulin A.N., Brovko F.A., Svirshchevskaya E.V., Kotelevtsev Y., Eliseeva I.A., Guryanov S.G., Lyabin D.N., Ovchinnikov L.P., Ivanov V.T. // FEBS Lett. 2015. V. 589. P. 1819–1824.
Laman A.G., Lathe R., Shepelyakovskaya A.O., Gartseva A., Brovko F.A., Guryanova S.V., Alekseeva L.G., Meshcheryakova E.A., Ivanov V.T. // Innate Immun. 2016. V. 22. P. 666–673.
Weichart D., Gobom J., Klopfleisch S., Häsler R., Gustavsson N., Billmann S., Lehrach H., Seegert D., Schreiber S., Rosenstiel P. // J. Biol. Chem. 2006. V. 281. P. 2380–2389.
Fritz J.H., Girardin S.E., Fitting C., Werts C., Mengin-Lecreulx D., Caroff M., Cavaillon J.M., Philpott D.J., Adib-Conquy M. // Eur. J. Immunol. 2005. V. 35. P. 2459–2470.
O’Neill L.A., Fitzgerald K.A., Bowie A.G. // Trends Immunol. 2003. V. 24. P. 286–290.
Deng L., Wang C., Spencer E., Yang L., Braun A., You J., Slaughter C., Pickart C., Chen Z.J. // Cell. 2000. V. 103. P. 351–361.
Wang C., Deng L., Hong M., Akkaraju G.R., Inoue J., Chen Z.J. // Nature. 2001. V. 412. P. 346–351.
Hayden M.S., Ghosh S. // Cell. 2008. V. 132. P. 344–362.
Eliseeva I.A., Kim E.R., Guryanov S.G., Ovchinnikov L.P., Lyabin D.N. // Biochemistry (Mosc). 2011. V. 76. P. 1402–1433.
Lyabin D.N., Eliseeva I.A., Ovchinnikov LP. // Wiley Interdiscip. Rev. RNA. 2014. V. 5. P. 95–110.
Frye B.C., Halfter S., Djudjaj S., Muehlenberg P., Weber S., Raffetseder U., En-Nia A., Knott H., Baron J.M., Dooley S., Bernhagen J., Mertens P.R. // EMBO Rep. 2009. V. 10. P. 783–789.
Hanssen L., Alidousty C., Djudjaj S., Frye B.C., Rauen T., Boor P., Mertens P.R., van Roeyen C.R., Tacke F., Heymann F., Tittel A.P., Koch A., Floege J., Ostendorf T., Raffetseder U. // J. Immunol. 2013. V. 191. P. 2604–2613.
Savinov G.V., Shepelyakovskaya A.O., Boziev Kh.M., Brovko F.A., Laman A.G. // Biochemistry (Mosc). 2014. V. 79. P. 131–138.
Livak K.J., Schmittgen T.D. // Methods. 2001. V. 25. P. 402–408.
Gossen M., Bujard H. // Proc. Natl. Acad. Sci. U S A. 1992. V. 89. P. 5547–5551.
Gossen M., Freundlieb S., Bender G., Müller G., Hillen W., Bujard H. // Science. 1995. V. 268. P. 1766–1769.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


