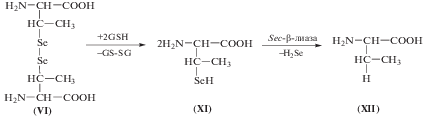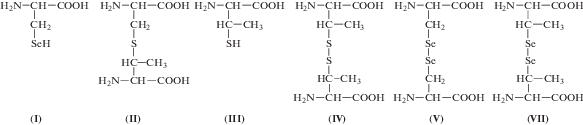Биоорганическая химия, 2019, T. 45, № 4, стр. 365-373
Синтез и биологическая активность нового 3,3'-диметилпроизводного L-селеноцистина
П. А. Полубояринов 1, *, Н. А. Голубкина 2, А. А. Аниськов 3, И. Я. Моисеева 4, Н. Н. Глебова 4, В. И. Швец 5
1 ФГБОУ ВО “Пензенский государственный университет архитектуры и строительства”
440028 Пенза, ул. Германа Титова, 28, Россия
2 ФГБНУ “Федеральный научный центр овощеводства”
Саратов, Россия
3 ФГБОУ ВО “Саратовский национальный исследовательский государственный университет имени Н.Г. Чернышевского”
Саратов, Россия
4 ФГБОУ ВО “Пензенский государственный университет”
Пенза, Россия
5 Московский технологический университет (Институт тонких химических технологий имени М.В. Ломоносова)
Москва, Россия
* E-mail: poluboyarinovpavel@yandex.ru
Поступила в редакцию 06.12.2018
После доработки 29.01.2019
Принята к публикации 22.02.2019
Аннотация
С использованием известной методики получения из β-хлораланина L-селеноцистина (3,3'-диселено-бис(2-аминопропионовая кислота)), имеющего свойство
аккумулировать селен в организме и являющегося структурным аналогом природных серосодержащих
аминокислот, из α-амино-β-хлормасляной кислоты, была синтезирована новая селенсодержащая
аминокислота – 3,3'-диметил-L-селеноцистин,  . Показано, что селен из 3,3'-диметил-L-селеноцистина, также как и из природной аминокислоты – L-селеноцистина аккумулируется в тканях печени, мышцах и сыворотке крови крыс и его
концентрация превышает контроль на 40.6, 14.0, 23.0% соответственно, а близкая степень
накопления селена в тканях говорит о сходном пути метаболизма аминокислот и биологической
доступности микроэлемента из новой аминокислоты. L-Селеноцистин и 3,3'-диметил-L-селеноцистин при введении крысам уменьшают концентрацию свободных аминокислот в их
сыворотке крови на 12. 2 и 11. 8% соответственно, особенно концентрацию маркера стресса
организма – пролина, на 74.6 и 66.4% соответственно.
. Показано, что селен из 3,3'-диметил-L-селеноцистина, также как и из природной аминокислоты – L-селеноцистина аккумулируется в тканях печени, мышцах и сыворотке крови крыс и его
концентрация превышает контроль на 40.6, 14.0, 23.0% соответственно, а близкая степень
накопления селена в тканях говорит о сходном пути метаболизма аминокислот и биологической
доступности микроэлемента из новой аминокислоты. L-Селеноцистин и 3,3'-диметил-L-селеноцистин при введении крысам уменьшают концентрацию свободных аминокислот в их
сыворотке крови на 12. 2 и 11. 8% соответственно, особенно концентрацию маркера стресса
организма – пролина, на 74.6 и 66.4% соответственно.
ВВЕДЕНИЕ
Являясь природным аналогом серы, селен активно замещает ее в природных соединениях, обусловливая существование значительного количества биологически активных белков, содержащих селеноцистеин [1]. Высокая биологическая активность органических форм селена, их уникальная антиоксидантная активность, способность защищать организм человека от онкологических, сердечно-сосудистых и нейрогенных заболеваний (болезнь Альцгеймера, болезнь Паркинсона), определяют важность разработки эффективных методов синтеза селенсодержащих аминокислот и их производных, а также пептидов на их основе [2].
Селеноцистеин ((2R)-2-амино-3-селанилпропановая кислота, (Sec)) (I) – 21-ая протеиногенная аминокислота, которую на матричной РНК кодирует терминирующий
кодон UGA при условии, что за ним следует особая стимулирующая последовательность
нуклеотидов [3]. Окисленной формой селеноцистеина, устойчивой в хранении, удобной в получении и
применении, является аминокислота селеноцистин ( ). Селеноцистин содержится в различных растениях [4, 5] и является неотъемлемым компонентом органов и тканей животных [6].
). Селеноцистин содержится в различных растениях [4, 5] и является неотъемлемым компонентом органов и тканей животных [6].
Селеноцистин демонстрирует мощный защитный эффект от γ-излучения, предотвращая повреждение ДНК [7], обладает антигемолитической и антирадикальной активностью [8]. Особый интерес представляет противоопухолевая активность селеноцистина. Было доказано, что это соединение ингибирует пролиферацию клеток MCF7 в аденокарциноме молочной железы человека путем индукции остановки клеточного цикла и апоптоза [9] и вызывает апоптоз клеток меланомы человека А375 [10]. Показано, что селеноцистин эффективен для обогащения растений селеном [11], в пчеловодстве (для повышения выхода маток пчел) [12], птицеводстве (для производства перепелиных яиц и мяса с повышенным содержанием селена) [13, 14].
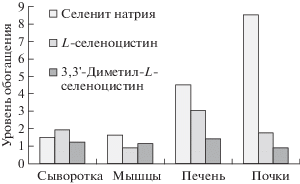
Рис. 1.
Уровни обогащения органов и тканей селеном при использовании разных химических форм элемента.
Учитывая высокую антиканцерогенную активность известных метилированных производных селеноцистеина – L-метилселеноцистеина (MSC) и γ-глутамил-Se-метилселеноцистеина (GGMSC) [15–17], представляет интерес получение соответствующих производных селеноцистина. Высокая биологическая активность метилированных форм серосодержащих аминокислот также известна. Так, метиллантионин (II) – нестандартная серосодержащая аминокислота, является компонентом пептидных антибиотиков субтилина [18, 19] и низина [20], а также присутствует в дрожжах (Saccharomyces cerevisiae) [21]. Эта же аминокислота обнаружена в составе пептидного ингибитора ангиотензинпревращающего фермента – анковенина.
Фрагментом метиллантионина является остаток трео-3-метил-D-цистеина ((2S,3S)-2-амино-3-меркаптобутановая кислота) (III), окисленной формой которого 3,3'-диметил-D-цистин (IV) [22]. Данные серосодержащие аминокислоты были синтезированы из треонина [23]. Селенсодержащий аналог соединения (IV), до наших исследований, был неизвестен науке.
Целью настоящего исследования был синтез L-селеноцистина (V) и 3,3'-диметил-L-селеноцистина (3,3'-диcелено-бис(2-аминобутановая к-та) (VI), из доступных L-аминокислот: серина и треонина. Важным аспектом является изучение биологической активности новой аминокислоты, как источника биодоступного селена и ее влияния на концентрацию свободных протеиногенных аминокислот и особенно маркера стресса –пролина, в сыворотке крови лабораторных крыс.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтез селенсодержащих аминокислот
Синтез 3,3'-диметил-L-селеноцистина (VI) проводили по аналогии с известным методом синтеза L-селеноцистина [24], характеризующимся сравнительной простотой и высоким выходом продукта.
Исходным веществом синтеза L-селеноцистина был L-серин (VII). Из него, согласно работе [25], синтезировали β-хлор-L-аланин (VIII), его вводили в реакцию с диселенидом натрия (схема 1 ), который получали восстановлением элементного селена боргидридом натрия [24].
Схема 1 . Метод синтеза L-селеноцистина (V).
Для синтеза 3,3'-диметил-L-селеноцистина (VI) в качестве исходного соединения использовали L-треонин (IX), из которого по методике работы [25] синтезировали α-амино-β-хлормасляную кислоту (X). Посредством реакции между α‑амино-β-хлормасляной кислотой с диселенидом натрия (при рН = 9) получали 3,3'-диметил-L-селеноцистин (VI) (схема 2 ).
Схема 2 . Синтез 3,3'-диметил-L-селеноцистина (VI).
В отличие от L-селеноцистина, осаждение которого из реакционной среды достигалось изменением рН от 2 до 6.2, 3,3'-диметил-L-селеноцистин оказался гораздо лучше растворим в воде. Для его выделения рН раствора доводили до рН 2 соляной кислотой, полученный раствор пропускали через хроматографическую колонку с катионитом КУ-2-8 в H+-форме, и конечный продукт элюировали раствором аммиака. Структуры 3,3'-диметил-L-селеноцистина (VI) и L-селеноцистина (V) были подтверждены элементным анализом и с помощью 1Н- и 13С-ЯМР-спектроскопии и хроматографии (табл. 1).
Таблица 1.
Физико-химические характеристики 3,3'-диметил-L-селеноцистина и L-селеноцистина
| Показатель | 3,3'-Диметил- L-селеноцистин Mr (C8H16N2Se2O4) = = 362.15 г/моль |
L-селеноцистин Mr (C6H12N2Se2O4) = = 334.09 г/моль |
Литературные
данные для L-селеноцистина |
|---|---|---|---|
| Выход, % | ≥50 | ≥60 | 60 [24] |
| Угол вращения плоскости поляризации 1% раствора в 1 N NaOH | −103° ± 3° | −28° ± 2° | −28° ± 2°** |
| Хроматографическая подвижность: Rf Сорбфил (изопропиловый спирт– 25% аммиак, 7 : 3) | 0.36 | 0.25 | – |
| Время выхода при электрофорезе, мин | 12.52 ± 0.30 tЭОП = 7.12 ± 0.15*** |
16.77 ± 0.30 tЭОП = 7.51 ± 0.15*** |
– |
| С, % | 25.97 (26.53)* | 22.30 (21.58) | 20.30–22.70** 21.19 [24] |
| Н, % | 4.63 (4.45) | 3.61 (3.59) | 3.70 [24] |
| N, % | 7.32 (7.74) | 8.64 (8.38) | 7.90–8.80** 8.37 [24] |
| Спектр 1Н-ЯМР (δ, м.д.) |
СН3 1.31 (3Н, д., J 8 Гц, СН), 3.58–3.64 (1Н м, CH (СН-${\text{NH}}_{3}^{ + }$)), 4.06 (1Н, д, J 7.25 Гц) | 3.18 (2Н дд , J 14 и 8 Гц, СН2), 3.32 (дд, J 14 и 5 Гц, CH-группы), 4.18 (1Н, д.д., J 8 и 5 Гц) | |
| Спектр 13С-ЯМР | 18.2 (СН3), 37.6 (СН), 57.7 (СН), 170.1 (СООН) | 26.6 (СН2), 52.9 (СН), 170.5 (СООН) |
Данные ТСХ показали отсутствие примесей для L-селеноцистина (Rf = 0.25, изопропиловый спирт–25% раствор аммиака (7 : 3), ТСХ 3,3'-диметил-L-селеноцистина (Rf = 0.36) также показал наличие лишь одного пятна.
Подвижность фенилтиокарбамоильных производных (FTC-производные) синтезированных L-селеноцистина и 3,3'-диметил-L-селеноцистина при капиллярном электрофорезе была разной: 16.77 ± 0.30 и 12.52 ± 0.30 мин сответственно.
Раствор 3,3'-диметил-L-селеноцистина в 1 М NaOH характеризуется значительно большим углом поворота плоскости поляризации, чем раствор L-селеноцистина: $[\alpha ]_{D}^{{20}}$ = −103° ± 3°, и $[\alpha ]_{D}^{{20}}$ = = −28° ± 2° соответственно. Следует отметить, что серосодержащая аминокислота – L-цистин, также характеризуется большим углом поворота плоскости поляризации, особенно вблизи изоэлектрической точки, что связано с образованием хелатной эндоциклической структуры [26].
Спектры 1Н- и 13С-ЯМР подтверждают структуру синтезированных аминокислот. Из-за дейтерообмена сигналы амино- и карбоксильных групп в 1Н-ЯМР синтезированных соединений были неразличимы.
Аккумулирование селена органами и тканями крыс
Биологическая доступность селена из органических соединений является одной из важнейших характеристик и определяется по степени аккумулирования микроэлемента органами, тканями и в сыворотке крови лабораторных животных. Особый интерес в этом отношении представляет аминокислота 3,3'-диметил-L-селеноцистин как новый источник микроэлемента селена (табл. 2).
Таблица 2.
Аккумулирование селена (мкг/кг) органами и тканями крыс при его введении в разных формах
| Ткань/орган | Контроль | Селенит натрия | L-Селеноцистин | 3,3'-Диметил- L-cеленоцистин |
|---|---|---|---|---|
| Сыворотка крови, мкг/л | 235 ± 20 | 353 ± 20 | 453 ± 12 | 289 ± 12 |
| Мышцы | 270 ± 11a* | 438 ± 24a | 242 ± 10a | 308 ± 20a |
| Печень | 475 ± 25b | 2143 ± 113b | 1444 ± 86b | 668 ± 40b |
| Почки | 754 ± 26c | 6416 ± 131c | 1322 ± 115b | 670 ± 29b |
Как следует из данных табл. 2, содержание селена у крыс, получавших селенит натрия, убывало в ряду: почки > печень > мышечная ткань, в то время как для L-селеноцистина и 3,3'-диметил-L-селеноцистина уровни накопления селена в печени и почках статистически не различались.
Сравнение уровней обогащения селеном органов и тканей крыс при использовании разных химических форм элемента (рис. 1) показывает принципиальные различия усвоения органических форм селена и селенита натрия. Так, наибольшее увеличение уровня селена в сыворотке крови наблюдалось при использовании L-селеноцистина (в 1.9 раз). Меньшую степень накопления селена сывороткой крови давал селенит натрия (1.4 раза), в то время как 3,3'-диметил-L-селеноцистин обеспечивал возрастание уровня селена в сыворотке крови всего в 1.2 раза. Уровень обогащения селеном мышечной ткани убывал в ряду: селенит натрия > 3,3'-диметил-L-селеноцистин > L-селеноцистин.
Особенно мощные различия в обогащении селеном при использовании различных производных микроэлемента наблюдались для печени и почек. Наибольшие уровни обогащения оказались характерны для неорганической формы селена, составившие 4.51 и 8.51 раз соответственно. В отличие от селенита натрия L-селеноцистин способствовал более интенсивному накоплению селена печенью, чем почками (3.04 раза по сравнению с 1.75 раз). Та же закономерность наблюдалась для 3,3'-диметил-L-селеноцистина, однако эта метилированная форма достоверно не влияла на содержание селена в почках и увеличивала содержание микроэлемента в печени в 1.41 раз.
Выявленные закономерности накопления селена в печени и сыворотке крови говорят о возможно близких путях метаболизма L-селеноцистина и 3,3'-диметил-L-селеноцистина. Известно, что после перорального введения животным, L-селеноцистин взаимодействует с восстановленным глутатионом с образованием Se,S-селеноцистеинглутатион (Sec-SG). Отмечается, что данная реакция проходит в тонком кишечнике [27, 28].
На втором этапе, Seс-SG не ферментативно восстанавливается до L-селеноцистеина избытком глутатиона в печени. И только на третьем этапе, L-селеноцистеин расщепляется селеноцистеин-β-лиазой (КФ 4.4.1.16), до селеноводорода (H2Se) и аланина [29].
Можно предположить, что 3,3'-диметил-L-селеноцистин также восстанавливается до 3-метилселеноцистеина (XI) восстановленным глутатионом, а затем расщепляется ферментом селеноцистеин-β-лиазой до селеноводорода и α-аминомасляной кислоты (AABA, бутирин (XII)) – предшественника синтеза офтальмовой кислоты, являющейся аналогом глутатиона в хрусталике глаза.
Схема 3 . Возможный путь метаболизма 3,3'-диметил-L-селеноцистина.
Таким образом, если предложенный механизм метаболизма аминокислоты подтвердится в дальнейших исследованиях, то 3,3'-диметил-L-селеноцистин, как и L-селеноцистин будет физиологически совместимым источником микроэлемента селена.
Влияние на аминокислотный профиль сыворотки крови
Известно, что большинство аминокислот при их введении в организм в более высоких дозах, чем они поступают с пищей, оказывает фармакологическое действие [30]. Во многом это обусловлено регуляторными функциями, которыми наделены многие из свободных аминокислот, а в нашем исследовании регуляторными функциями обладает, по-видимому, еще и микроэлемент селен.
Влияние селенита натрия и селенсодержащих аминокислот на свободные аминокислоты сыворотки крови лабораторных крыс представлены в табл. 2.
Исследование аминокислотного профиля сыворотки крови при воздействии различных химических форм селена показывает (табл. 3), что все химические производные селена достоверно снижают уровень серина (в 1.8–2.2 раза). Содержание глутаминовой кислоты и глутамина снижается под действием селенита натрия и 3,3'-диметил-L-селеноцистина в 3.2–3.4 раза, в то время как селеноцистин достоверно не изменяет уровень этих аминокислот.
Таблица 3.
Содержание аминокислот (мкмоль/л) в сыворотке крови лабораторных крыс при введении им per os селенита натрия и селенсодержащих аминокислот в дозе 2.44 мг Se/кг
| Аминокислота | Концентрация аминокислот, мкМ | |||
|---|---|---|---|---|
| контроль | селенит натрия | L-cеленоцистин | 3,3'-диметил-L-селеноцистин | |
| Аргинин* | 37.89 ± 1.52a | 33.24 ± 1.33b | 28.99 ± 1.16c | 21.01 ± 0.84d |
| Лизин* | 47.20 ± 1.61a | 68.81 ± 2.34b | 35.98 ± 1.22c | 47.13 ± 1.60a |
| Тирозин | 31.57 ± 0.95ab | 22.63 ± 0.68c | 30.63 ± 0.92a | 32.12 ± 0.96b |
| Фенилаланин* | 11.50 ± 0.35a | 10.17 ± 0.31b | 9.50 ± 0.28b | 9.99 ± 0.30b |
| Гистидин* | 15.79 ± 0.79a | 19.21 ± 0.96bc | 17.40 ± 0.87b | 19.53 ± 0.98c |
| Лейцин+* Изолейцин |
23.25 ± 0.60a | 21.65 ± 0.56a | 22.56 ± 0.59a | 34.69 ± 0.90b |
| Метионин* | 29.76 ± 1.01a | 29.02 ± 0.99a | 32.84 ± 1.12b | 39.54 ± 1.34с |
| Валин* | 15.71 ± 0.63a | 24.93 ± 1.00b | 18.52 ± 0.74c | 25.78 ± 1.03b |
| Пролин | 77.30 ± 2.01a | 53.07 ± 1.38b | 51.33 ± 1.34b | 57.67 ± 1.50c |
| Треонин* | 104.10 ± 4.16a | 115.01 ± 4.60b | 119.70 ± 4.79b | 107.96 ± 4.32a |
| Серин | 122.47 ± 3.18a | 59.66 ± 1.55b | 54.62 ± 1.42c | 68.04 ± 1.77d |
| Аланин | 60.05 ± 1.56a | 70.83 ± 1.84b | 57.02 ± 1.48a | 56.68 ± 1.42c |
| Глицин | 4.0 ± 0.14 | –** | –** | –** |
| Глутаминовая кислота и глутамин |
24.74 ± 0.99a | 7.27 ± 0.29b | 40.10 ± 1.60c | 7.81 ± 2.0b |
| ∑ аминокислот | 605.33 ± 19.49a | 535.50 ± 17.83b | 519.19 ± 17.53b | 527.95 ± 17.16b |
В присутствии селенсодержащих соединений, происходит снижение уровня свободных аминокислот в сыворотке крови на 10.7–12.2%, и это явление характерно для всех исследованных форм селена.
В ряде исследований показано, что воздействие теплового стресса, экспериментального гипотиреоза [31] и индуцированного аллоксаном диабета [32], сопровождается возрастанием концентрации свободных аминокислот в сыворотке крови крыс. Вероятно, что одним из механизмов стрессорного повреждения органов и тканей является преобладание процессов гидролиза белков над скоростью их ресинтеза.
В нашем исследовании основным стрессовым фактором является рацион контрольного варианта опыта без добавления селена. Введение в организм крыс per os селена (2.44 мг Se/кг) в виде селенита натрия и селенсодержащих аминокислот приводит к снижению воздействия стрессирующего фактора, что выражается в уменьшении содержания свободных аминокислот в сыворотке крови.
Анализ содержания индивидуальных аминокислот в сыворотке крови показал, что использование селенита натрия, L-селеноцистина и 3,3'-диметил-L-селеноцистина в качестве источника селена, приводит к разнонаправленному изменению их концентрации. Увеличились концентрации: гистидина соответственно на 21.3, 23.6, 10.2%; валина – на 58.5, 64.1 18.0%; треонина – на 8.4, 3.5, 14.8%, уменьшились концентрации аргинина на 12.2, 55.4, 23.6%; фенилаланина – на 13.5, 13.5, 17.5%; пролина – на 31.3, 74.6, 66.4%; серина – на 47.8, 55.5, 44.6%. Интересно, что уровень метионина в сыворотке крови не изменяется под действием селенита натрия и достоверно возрастает при действии органических форм селена, причем этот эффект выражен максимально при использовании 3,3'-диметил-L-селеноцистина.
Одним из маркеров стресса является концентрация пролина, так как это единственная протеиногенная аминокислота, которая метаболизируется собственной группой ферментов, реагирующих на метаболический стресс и участвующих в метаболической сигнализации [33].
Концентрация пролина в варианте с селенитом натрия ниже контроля на 31.3%. Более активны селеноаминокислоты: снижение концентрации пролина в варианте с L-селеноцистином составляет 74.6%, а в варианте с 3,3'-диметил-L-селеноцистином – 66.4%, что говорит об их близком механизме метаболизма.
В целом, все селенсодержащие препараты снижают общую концентрацию аминокислот в сыворотке крови и маркера стресса – аминокислоты пролина, но более активны в этом отношении L-селеноцистин и новая селенсодержащая аминокислота 3,3'-диметил-L-селеноцистин.
Выводы
Таким образом, на основе известной методики синтеза L-селеноцистина была синтезирована новая селенсодержащая аминокислота – 3,3'-диметил-L-селеноцистин (VI), являющаяся структурным аналогом природных серосодержащих аминокислот. Селен из 3,3'-диметил-L-селеноцистина, также как и из L-селеноцистина, биологически доступен и аккумулируется в тканях и сыворотке крови крыс. Обе аминокислоты уменьшают концентрацию свободных аминокислот в сыворотке крови крыс и особенно маркер стресса организма – аминокислоту пролин. По результатам исследования был получен патент [34].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Хроматографические тесты проводили на пластинах “Sorbfil” (фирма “ИМИД”) методом восходящей ТСХ. После элюирования в системе растворителей изопропиловый спирт–25% аммиак (7 : 3) и высушивания пластины пятна L-селеноцистина и 3,3'-диметил-L-селеноцистина обнаруживали опрыскиванием 0.5% раствором нингидрина в изопропиловом спирте.
Анализ чистоты L-селеноцистина и 3,3'-диметил-L-селеноцистина проводили методом капиллярного электрофореза на приборе “Капель 105М” фирмы “Люмекс” (Россия) в виде фенилтиокарбамоильных производных. Пробоподготовка и анализ проводится по методике [35].
Также проводился анализ образцов аминокислот без дериватизации в боратном буфере по собственному поглощению аминогрупп (детектирование при длине волны 190 нм).
Элементный анализ выполняли на приборе “Vario El cube” (Elementar Analysensysteme, Германия).
Углы вращения измеряли на поляриметре СМ-3 (Россия).
Синтез L-селеноцистина ((R,R)-3,3'-диселено-бис(2-аминопропионовая кислота), осуществлен согласно модифицированной методике [24].
1 M раствор диселенида натрия (Na2Se2) получали добавлением элементарного селена (4.5 г, 56 ммоль) к 10 мл 1 М раствора NaOH и 15 мл дистиллированной воды в закрытой трехгорлой колбе с магнитной мешалкой. Раствор 4.5 г (119 ммоль) боргидрида натрия в воде (25 мл) добавляли по каплям к суспензии элементарного селена до момента, когда раствор становится бесцветным. Дополнительное количество элементарного селена (4.5 г, 56 ммоль) добавляется к этому раствору (раствор становится красновато-коричневым, цвет который характерен для диселенида натрия). Раствор 5 г (31 ммоль) β-хлор-L-аланина (VIII) доводили до рН 9 добавлением 1 М раствора гидроксида натрия и в течение 30 мин добавляли в раствор диселенида натрия, находящийся в трехгорлой колбе, и перемешивали в течение 12–16 ч при температуре 37°С. Добавляли в полученный раствор по каплям 6 М НСl до рН 2. Для удаления следов селеноводорода раствор барботировали воздухом в течение 2–3 ч. Раствор фильтровали для удаления осадка элементного селена и доводили 10 М раствором гидроксида натрия до рН 6–6.5. Раствор охлаждали до 5°С, с выходом желтых кристаллов L-селеноцистина не менее 60% чистотой не менее 97% (ТСХ).
3,3'-Диметил-L-селеноцистин ((2R)-3,3'-диселено-бис(2-аминомасляная кислота). 1 M раствор диселенида натрия (Na2Se2) получали как описано выше. Раствор 4.2 г (31 ммоль) α-амино-β-хлормасляной кислоты (X) доводили до рН 9 добавлением 1 М раствора гидроксида натрия. В течение 30 мин полученный раствор α-амино-β-хлормасляной кислоты добавляли в раствор диселенида натрия и перемешивали в течение 12–16 ч при температуре 37°С. Добавляли в полученный раствор по каплям хлороводородную кислота до рН 2. Осуществляли продувку воздухом в течение 2–3 ч. Раствор фильтровали и пропускали со скоростью 1 мл/мин через хроматографическую колонку (20–25) × (1–2) см с катионитом КУ-2-8 в H+-форме. Колонку промывали 50 мл дистиллированной воды. Элюирование 3,3'-диметил-L-селеноцистина проводили, пропуская через колонку 50 мл 6 М NH4OH со скоростью 1 мл/мин и промывали 20–30 мл воды. Раствор концертировали в вакууме и доводили рН до 6.2 раствором НСl. Осаждение аминокислоты из охлажденного раствора проводили избытком метанола (1 : 7) с добавлением 1–2% диэтилового эфира для понижения растворимости аминокислоты. Осадок промывали охлажденной смесью метанола и диэтилового эфира и высушивали в эксикаторе над молекулярными ситами 4А. Выход 3,3'-диметил-L-селеноцистина составляет не менее 50%, чистотой не менее 95% (ТСХ).
Изучение влияние различных форм селена на аккумулирование микроэлемента органами и тканями проводили на самцах беспородных белых крыс, массой 180–200 г. Все животные были получены из сертифицированных питомников и содержались в условиях вивария ФГБОУ ВО “Пензенский государственный университет” при свободном доступе к воде и корму. Животных разделили на группы – контрольную (1 группа – 0.1 М раствор соляной кислоты) и опытные (2 группа – селенит натрия, 3 группа – L-селеноцистин, 4 группа – 3,3'-диметил-L-селеноцистин) по 10 животных в группе. Содержание и кормление животных опытных и контрольных групп было одинаковым, без добавок селена в рацион. Животные получали стандартный полусинтетический рацион (по МУ 1.2.2520-09). Все препараты растворяли в 0.1 М соляной кислоте и вводили в желудок с помощью металлического зонда с оливой на конце. Препараты вводили крысам 1 раз в сутки в течение 1 месяца в дозе 1/10 от среднелетальной дозы (LD50): для L-селеноцистина [36] – 5.17 мг/кг (2.44 мг Se/кг), селенит натрия – 5.34 мг/кг (2.44 мг Se/кг), 3,3'-диметил-L-селеноцистин – 5.60 мг/кг (2.44 мг Se/кг). За экспериментальными животными следили в течение 30 сут.
По окончании опыта был проведен убой животных, путем забора крови из сонной артерии с последующей декапитацией, под эфирным наркозом. Кровь для исследования аминокислотного состава забиралась в пробирку без консерванта и через 2 ч центрифугировалась в течение 10 мин при 3000 об./мин для получения сыворотки.
Общее содержание селена определяли флуориметрическим методом с диаминонафталином [37]. В качестве референс-стандартов в каждом определении использовали образцы яичного порошка и лиофилизованной мышечной ткани с регламентированным содержанием селена соответственно 630 и 394 мкг/кг.
При определении свободных аминокислот в сыворотке крови, получали концентрированный безбелковый экстракт по методике [38]. Дериватизация аминокислот проводилась фенилизотиоцианатом, а анализ фенилтиокарбамоильных аминокислот по методике [35], с использованием системы капиллярного электрофореза “Капель 105М”.
Блок формул.
Список литературы
Pilon-Smits E.A.H. Selenium in plants. Springer International Publishing: Switzerland, 2015. P. 93–107.
Fairweather-Tait S.J., Bao Y., Broadley M.R., Collings R., Ford D., Hesketh J.E., Hurst R. // Antioxidants and Redox Signal. 2011. V. 14. P. 1337–1383.
Berry M.J., Banu L., Harney J.W., Larsen P.R. // EMBO J. 1993. V. 12. P. 3315–3322.
Yuan L., Zhu Y., Lin Z.Q., Banuelos G., Li W., Yin X. // PLoS One. 2013. V. 8. P. 1–9.
Block E. // ACS Webinars: New York, 2014. P. 39.
Johansson L., Gafvelin G., Amer E.S. // Biochim Biophys Acta. 2005. V. 1726. P. 1–13.
Kunwar A., Jayakumar S., Bhilwade H.N., Bag P.P., Bhatt H., Chaubey R.C., Priyadarsini K.I. // Rad. Environ. Biophys. 2011. V. 50. P. 271–280.
Kumar B.S., Kunwar A., Singh B.G., Ahmad A., Priyadarsini K.I. // Biol. Trace. Elem. Res. 2011. V. 140. P. 127–138.
Chen T., Wong Y.S. // J. Agric. Food Chem. 2008. V. 56. P. 10574–10581.
Chen T., Wong Y.S. // Cell Mol. Life Sci. 2008. V. 65. P. 2763–2775.
Шумилин А.О., Серегина И.И., Хрунов А.А., Белецкий С.Л., Полубояринов П.А. // Проблемы агрохимии и экологии. 2016. № 1. С. 24–28.
Полубояринов П.А., Невитов М.Н., Остапчук А.В., Цыганов С.В. // Пчеловодство. 2016. № 3. С. 16–18.
Полубояринов П.А., Воронин С.П., Егоров И.А., Андрианова Е.Н. // Птицеводство. 2015. № 8. С. 9–12.
Полубояринов П.А., Голубкина Н.А., Глебова Н.Н. // Вестник Оренбургского государственного университета. 2016. № 10. С. 74–78.
Dong Y., Lisk D., Block E., Ip C. // Cancer Res. 2001. V. 61. № 7. P. 2923–2928.
Kim T., Jung U., Cho D.Y., Chung A.S. // Carcinogenesis. 2001. V. 22. P. 559–565.
Weekley C.M., Aitken J.B., Finney L., Vogt S., Witting P.K., Harris H.H. // Nutrients. 2013. № 5. P. 1734–1756.
Alderton G. // J. Am. Chem. Soc. 1953. V. 75. P. 2391–2392.
Gross E., Kiltz H.H., Nebelin E. // Hoppe Seylers Z. Physiol. Chem. 1973. V. 354. P. 810–812.
Gross E., Morell J.L. // J. Am. Chem. Soc. 1971. V. 93. P. 4634–4635.
Downey P.F., Black S. // J. Biol. Chem. 1957. V. 228. P. 171–179.
Kido Y., Hamakado T., Yoshida T., Anno M., Motoki Y., Wakamiya T., Shiba T. // J. Antibiot. 1983. V. 36. P. 1295–1299.
Wakamiya T., Fukase K., Shimbo K., Shiba T. // Chem. Soc. Jap. 1983. V. 56. P. 1559–1560.
Chocat P., Esaki N., Tanaka H., Soda K. // Anal. Biochem. 1985. V. 148. P. 485–489.
Walsh C.T., Schonbrunn A., Abeles R.H. // J. Biol. Chem. 1971. V. 246. P. 6855–6866.
Физер Л., Физер М. // Органическая химия. Углубленный курс. Том 2. М.: Издательство “Химия”, 1966. 783 с.
Hasegawa T., Mihara M., Okuno T., Nakamuro K., Sayato Y. // Arch. Toxicol. 1995. № 69. P. 312–317.
Hasegawa T., Okuno T., Nakamuro K., Sayato Y. // Arch. Toxicol. 1996. V. 71. P. 39–44.
Esaki N., Nakamura T., Tanaka H., Soda K. // J. Biol. Chem. 1982. V. 257. P. 4386–4391.
Lubec C., Rosental J.A. // N.Y. Escom. 1990. P. 1196.
Глинник С.В., Ринейская О.Н., Романовский И.В., Красненкова Т.П. // Медицинский журнал. 2007. № 3. С. 47–49.
Scharff R., Wool I.G. // Bioch. J. 1966. V. 99. P. 173.
Phang J.M., Pandhare J., Liu Y. // The Journal of Nutrition. 2008. V. 138. P. 2008–2015.
Полубояринов П.А. Патент № 2669771 РФ // Бюл. 2017. № 17.
М–04–38–2009. Методика определения протеиногенных аминокислот в кормах и сырье. ООО “Люмэкс–маркетинг”. СПб., 2014. 49 с.
Полубояринов П.А., Дерягина В.П., Глебова Н.Н., Моисеева И.Я., Швец В.И. // Биофармацевтический журнал. 2018. Т. 10. № 3. С. 76–81.
МУК 4.1.033–95. Определение селена в продуктах питания.
Карпищенко А.И., Алексеев В.В., Алипов А.Н. // Медицинские лабораторные технологии: руководство по клинической лабораторной диагностике. Т.2. М.: 2013. 792 с.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия