Биоорганическая химия, 2019, T. 45, № 5, стр. 555-559
Оценка противовоспалительной активности производных 4'-O-метилхонокиола на модели нейровоспаления
К. В. Сивак 1, К. И. Стосман 1, А. А. Мужикян 1, А. Г. Александров 1, Н. Б. Викторов 2, Д. Д. Ваулина 3, Н. А. Гомзина 3, *
1 Федеральное государственное бюджетное учреждение “Научно-исследовательский институт гриппа им. А.А. Смородинцева” Министерства здравоохранения Российской Федерации
197376 Санкт-Петербург, ул. профессора Попова, 15/17, Россия
2 Санкт-Петербургский государственный технологический институт (Технический университет)
190013 Санкт-Петербург, Московский пр., 26, Россия
3 Федеральное государственное бюджетное учреждение науки Институт мозга человека им. Н.П. Бехтеревой Российской академии наук
197376 Санкт-Петербург, ул. академика Павлова, 9, Россия
* E-mail: gomzina@ihb.spb.ru
Поступила в редакцию 09.01.2019
После доработки 25.01.2019
Принята к публикации 15.02.2019
Аннотация
Описан синтез двух производных лигнана 4'-О-метилхонокиола (МН): 4'-метокси-5-пропил-1,1'-бифенил-2-ола и 4'-(2-фторэтокси)-2-гидрокси-5-пропил-1,1'-бифенила. На модели индуцированного липополисахаридом нейровоспаления у мышей показано, что наибольшей противовоспалительной активностью обладает 4'-(2-фторэтокси)-2-гидрокси-5-пропил-1,1'-бифенил: его влияние на степень морфологических изменений в мозге сравнимо с эффектом целекоксиба, известного нестероидного противовоспалительного препарата и селективного ингибитора циклооксигеназы-2.
Известно, что нейровоспаление играет ключевую роль в развитии заболеваний, связанных с повреждением и гибелью нейронов (церебральная ишемия, травма, болезни Альцгеймера и Паркинсона, эпилепсия, шизофрения и т.д.) [1, 2]. Нейровоспаление включает ряд процессов, основным из которых является активация микроглии (фагоцитарных глиальных клеток), сопровождаемая возрастающей продукцией цитокинов, экспрессией интегринов, повышенной активностью протеаз и ферментов [3, 4]. Фермент циклооксигеназа 2 (СОХ2), участвующая в синтезе простагландинов, представляет большой интерес в качестве биомаркера нейровоспаления, поскольку его экспрессия в здоровом мозге низка, а при воспалении резко возрастает [5]. Применение селективных ингибиторов СОХ2 снижает риск развития заболеваний, связанных с воспалением, но может повышать агрегацию тромбоцитов и быть причиной закупорки сосудов [6]. Поэтому поиск новых ингибиторов на основе природных соединений, в частности производных 4'-O-метилхонокиола (МН) (схема 1а), выделенного из растений Magnolia officinalis, представляется актуальным [7]. Лигнан МН обладает высокой селективностью к СОХ2 (IC50 СОХ1 – 2400, а IC50 СОХ2 – 62 нМ) [8], для сравнения: соответствующие значения для целекоксиба, селективного ингибитора СОХ2, равны 17000 и 40 нМ [9]. Показано также, что МН снижает экспрессию синтазы оксида азота (iNOS) и скорость образования β-амилоидных бляшек в мозге мышей c индуцированным нейровоспалением [10]; подавляет активность фактора NF-κB в макрофагах и клетках колоректального рака [11].
Работа посвящена синтезу двух производных лигнана МН, одно из которых получено впервые, и оценке их противовоспалительной активности в сравнении с целекоксибом на модели индуцированного липополисахаридом (ЛПС) нейровоспаления у мышей.
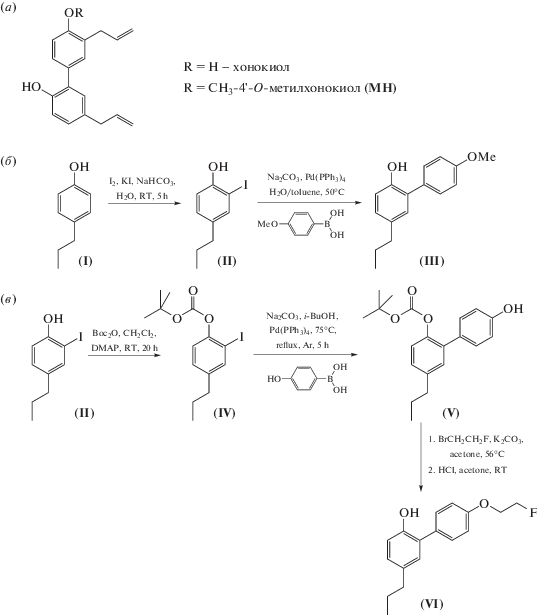
Ключевая стадия синтеза производных (III) и (VI) – реакция кросс-сочетания Судзуки-Мияура арилиодидов (II) или (IV) и арилбороновой кислоты, катализируемая тетракис(трифенилфосфин)палладием(0), Pd(PPh3)4 (схема 1б, 1в). Нейровоспаление моделировали у мышей линии С57BL/6 (ФГУП “ПЛЖ “Рапполово”, Ленинградская обл.) путем внутрибрюшинного однократного введения ЛПС из E. coli О111:В4 (Sigma-Aldrich) в дозе 2 мг/кг через час после введения соединений (III), (VI), целекоксиба или плацебо. Через 4 дня животных подвергали декапитации под наркозом ксилазин-золетила (50 мг/кг). К этому времени у мышей из всех опытных групп наблюдалось нейровоспаление, сопровождаемое снижением массы тела и развитием отека мозга (увеличением МК мозга) (табл. 1). На фоне введения соединений (III), (VI) и целекоксиба отмечалось уменьшение выраженности этих показателей.
Cхема 1. (а) – Cтруктуры хонокиола и 4'-O-метилхонокиола (MH); (б) – синтез 4'-метокси-5-пропил-1,1'-бифенил-2-ола (III); (в) – синтез 4'-(2-фторэтокси)-2-гидрокси-5-пропил-1,1'-бифенила (VI).
Гистологическому анализу были подвергнуты гиппокамп и ассоциативная кора как наиболее чувствительные к нейровоспалению отделы мозга (рис. 1). Полуколичественный морфометрический анализ показал, что линейная плотность нормальных нейронов в контрольной группе была снижена по сравнению с этим показателем у интактных особей, относительное содержание поврежденных (пикноморфных и гиперхромных) нейронов составляло до 40%, наиболее тяжелые повреждения выявлялись в зонах CA1 и DG.
Соединение (III) способствовало уменьшению числа поврежденных нейронов в зоне DG, но не приводило к существенному изменению процесса в других регионах мозга, тогда как соединение (VI) существенно уменьшило выраженность глиальной реакции и количество поврежденных нейронов во всех исследованных областях: их осталось 20% в области СА1 и 5% в области DG и коры. По влиянию на степень морфологических изменений в мозге соединение (VI) статистически не отличалось от препарата сравнения целекоксиб с учетом того, что вводимая доза целекоксиба была в 4 раза больше.
Наличие в структурах (III) и (VI) алкоксигрупп позволяет использовать метку изотопа 11С (T1/2 = = 20.4 мин) или 18F (T1/2 = 109.8 мин) для изучения биораспределения радиоактивных аналогов в органах и тканях лабораторных животных на следующем этапе исследований.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры 1Н-, 13С- и 19F-ЯМР (δ, м.д; J, Гц) регистрировали на спектрометре Bruker Avance 400 (400.13, 100.61, 376.54 МГц соответственно) при 25°С в CDCl3. Масс-спектры высокого разрешения (HRMS) регистрировали на спектрометре Bruker micrOTOF в режиме электроспрей-ионизации (ESI).
2-Иод-4-пропилфенол (II), выход 32%, бесцветное масло; 1H-ЯМР: 0.95т (3H, CH3, J 7.2); 1.62м (2H, CH2CH3); 2.51 (2H, т, J 7.6, –CH2Ar); 5.19 (1Н, с, ОН); 6.93 (1H, д, J 8.4, –CHAr;); 7.07 (1H, дд, J 8.4; 2.0, –CHAr ); 7.49 (1H, д, J 2.0, CHAr). 13С-ЯМР: 13.6, 24.6, 36.6, 85.5, 114.7, 130.2, 136.9, 137.7, 152.7. HRMS(ESI), найдено: m/z 260.9773 [M – H]–. C9H11IO. Вычислено: [M – H]– = = 260.9782. Соединение (II) было получено ранее с выходом 11% [12], без приведения спектральных данных.
4'-Метокси-5-пропил-1,1'-бифенил-2-ол (III). Соединение (II) (0.52 г, 2 ммоль), 4-метоксифенилбороновую кислоту (0.30 г, 2 ммоль) и Na2CO3 (1.06 г, 10 ммоль) нагревали до 50°C в смеси воды и толуола, добавляли Pd(PPh3)4 (0.116 г, 0.1 ммоль), кипятили под аргоном при перемешивании 9 ч. Смесь разбавляли водой и экстрагировали этилацетатом. Экстракт сушили Na2SO4, продукт выделяли на колонке с силикагелем, гептан–этилацетат, 10 : 1, с выходом 0.30 г (62%). Соединение (III), светло-желтое масло, данные ЯМР-спектров соответствуют данным, приведенным в работе [13]: 1H-ЯМР: 0.97 (3H, т, J 7.2, CH3,); 1.66 (2H, м, CH2CH3); 2.57 (2H, т, J 7.6, CH2Ar); 3.89 (3Н, с, СH3O); 5.04 (1Н, с, ОН); 6.91 (1H, д, J 8.0, CHAr); 7.01–7.10 (4H, м, 4× CHAr); 7.42 (2H, м, 2× CHAr). 13С-ЯМР: 13.8, 24.8, 37.2, 55.4, 114.7, 115.4, 127.4, 128.7, 129.5, 130.1, 130.2, 134.9, 150.4, 159.2. HRMS(ESI), найдено: m/z 241.3088 [M – H]–. C16H18O2. Вычислено: [M – H]– = 241.3100.
2-Иод-1-((1,1-диметилэтоксикарбонил)окси)-4-пропилбензол (IV), светло-желтая жидкость; 1H-ЯМР: 0.96 (3H, т, J 7.2, CH3); 1.60 (9Н, с, tBu); 1.64 (2H, м, CH2CH3); 2.56 (2H; т, J 7.6, CH2Ar); 7.08 (1H, д, J 8.4, CHAr); 7.17 (1H, д, J 8.4, CHAr); 7.65 (1H, д, J 2.0, CHAr). 13С-ЯМР: 13.6, 24.3, 27.7, 36.8, 83.9, 90.2, 122.2, 129.5, 139.0, 142.4, 149.2, 151.1. HRMS(ESI), найдено: m/z 385.0273 [M + Na]+. C14H19IO3. Вычислено: [M + Na]+ = 385.0271.
4'-Гидрокси-2-((1,1-диметилэтоксикарбонил)окси)-5-пропил-1,1'-бифенил (V), белые кристаллы, т. пл. 95–97°С (разл.); 1H-ЯМР: 0.98 (3H, т, J 7.2, CH3,); 1.36 (9H; с, tBuOC(O)O); 1.68 (2H, м, CH2CH3); 2.63 (2H; м, CH2Ar); 4.60–5.00 (1Н; уш.с, ОН); 6.89 (2H, д, J 8.8, 2× CHAr); 7.10 (1H, д, J 8.4, CHAr); 7.15 (1H, дд, J 8.4; 2.0, CHAr); 7.19 (1H, д, J 2.0, CHAr); 7.36 (2H; д, J 8.8, 2× CHAr). 13С-ЯМР: 13.8, 24.5, 27.4 ((CH3)3), 37.5, 83.0, 115.1, 122.0, 128.1, 130.3, 130.6, 134.1, 140.8, 146.1, 151.7, 154.9. HRMS(ESI), найдено: m/z 351.1581 [M + Na]+. C20H24O4. Вычислено: [M + Na]+ = 351.1567.
4'-(2-Фторэтокси)-2-гидрокси-5-пропил-1,1'-бифенил (VI). Соединение (V) (0.33 г, 1.0 ммоль), 1-бром-2-фторэтан (0.30 г, 2 ммоль), K2CO3 (0.25 г, 1.8 ммоль) кипятили 24 ч в 8 мл абс. ацетона, градиентным элюированием гептан–дихлорметаном от 10 : 1 до 4 : 1 на колонке с силикагелем выделяли интермедиат. Boc-группу удаляли конц. HCl, продукт выделяли на колонке с силикагелем смесью гептан–дихлорметан (4 : 1) с выходом 0.05 г (16%). Соединение (VI): бесцветное масло; 1H-ЯМР: 1.01 (3H, т, J 7.2, CH3); 1.70 (2H, м, CH2CH3); 2.60 (2H, м, CH2Ar); 4.30 (2Н, д.м, 3JH-F 28, OCH2); 4.82 (2Н, д.м, 2JH-F 47, FCH2); 5.16 (1Н; уш.с, ОН); 6.93(1Н, д, J 8.8); 7.06–7.11(4H, м); 7.46 (2H, д, J 8.8, 2×CHAr). 13С-ЯМР: 13.9, 24.8, 37.3, 67.3 (2Н; д, 2JC-F 20, OCH2); 82.0 (2Н, д, 1JC-F 170, FCH2); 115.3, 115.6, 127.4, 128.8, 130.2, 130.3, 130.4, 135.0, 150.5, 158.1. 19F-ЯМР: –223.6. HRMS(ESI), найдено: m/z 297.1273[M + Na]+. C17H19FO2. Вычислено: [M + Na]+ = 297.1261.
Рис. 1.
Гистологические препараты мозга мышей: гиппокамп (регионы CA1, CA3, зубчатая извилина DG), ассоциативная кора – задняя теменная область коры полушарий. Срезы мозга окрашивали по Нисслю крезиловым фиолетовым, вычисление линейной плотности клеток и относительного содержания поврежденных нейронов проводили в светооптическом микроскопе Leica DM1000.

Таблица 1.
Изменение массы тела и массового коэффициента мозга (МК) у мышей с индуцированным нейровоспалением
| Показатели (М ± SE)а | Экспериментальные группы, в каждой n = 5 | ||||
|---|---|---|---|---|---|
| интактная | c ЛПС-индуцированным нейровоспалением | ||||
| плацебо (контроль) | целекоксиб, 20 мг/кг | (III), 5 мг/кг | (VI), 5 мг/кг | ||
| Масса тела, г | 19.5 ± 0.2 | 15.7 ± 0.2* | 16.5 ± 0.4* | 16.6 ± 0.3* | 16.8 ± 0.6* |
| МК мозгаб × 102 | 196.7 ± 4.2 | 259.6 ± 3.6* | 226.3 ± 3.7*˄ | 235.7 ± 6.0*˄ | 234.1 ± 5.7*˄ |
ФОНДОВАЯ ПОДДЕРЖКА
Работа выполнена при финансовой поддержке Российского Фонда Фундаментальных Исследований, номер проекта 17-04-02119.
Список литературы
Perry V., Nicoll J., Holmes C. // Nat. Rev. Neurol. 2010. V. 6. P. 193–201.
Prata J., Santos S., Almeida M., Coelho R., Barbosa M.A. // J. Neuroinflammation. 2017. V. 14. P. 179–212.
Jacobs A.H., Tavitian B. // J. Cereb. Blood Flow Metab. 2012. V. 32. P. 1393–1415.
Ory D., Celen S., Verbruggen A., Bormans G. // Current Pharmaceutical Design. 2014. V. 20. P. 5897–5913.
Laube M., Kniess T., Pietzsch J. // Molecules. 2013. V. 18. P. 6311–6355.
Rayar A.M., Lagarde N., Ferroud C., Zagury J.-F., Montes M., Veitia M.S.-I. // Curr. Top. Med. Chem. 2017. V. 17. P. 2935–2956.
Yuan Y., Subedi L., Lim D., Jung J.K., Kim S.Y., Seo S.Y. // Bioorg. Med. Chem. Lett. 2019. V. 29. P. 3329–3339.
Kim H.S., Ryu H.S., Kim J.S., Kim Y.G., Lee H.K., Jung J.K., Kwak Y.S., Lee K., Seo S.Y., Yun J., Kang J.S., Hong J.T., Kim Y., Han S.-B. // Arch. Pharm. Res. 2015. V. 38. P. 813–825.
Penning T.D., Talley J.J., Bertenshaw S.R., Carter J.S., Collins P.W., Docter S., Graneto M.J., Lee L.F., Malecha J.W., Miyashiro J.M., Rogers R.S., Rogier D.J., Yu S.S., Anderson G.D., Burton E.G., Cogburn J.N., Gregory S.A., Koboldt C.M., Perkins W.E., Seibert K., Veenhuizen A.W., Zhang Y.Y., Isakson P.C. // J. Med. Chem. 1997. V. 40. P. 1347–1365.
Lee B., Kwak J.-H., Huang S.-W., Jang J.Y., Lim S., Kwak Y.S., Lee K., Kim H.S., Han S.B., Hong J.T., Lee H., Song S., Seo S.Y., Jung J.K. // Bioorg. Med. Chem. 2012. V. 20. P. 2860–2868.
Zhang P., Liu X., Zhu Y., Chen S., Zhou D., Wang Y. // Neurosci. Lett. 2013. V. 534. P. 123–127.
Suter C.M., Schuetz R.D. // J. Org. Chem. 1951. V. 16. P. 1117–1120.
Fuchs A., Baur R., Schoeder C., Sigel E., Mueller C.E. // Bioorg. Med. Chem. 2014. V. 22. P. 6908–6917.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия