Биоорганическая химия, 2019, T. 45, № 5, стр. 488-501
Липидом плазмы крови человека: возможности и перспективы его анализа в медицинской химии
Т. И. Торховская 1, 2, *, Т. С. Захарова 1, Е. И. Короткевич 1, О. М. Ипатова 1, С. С. Маркин 1
1 ФГБНУ Научно-исследовательский институт биомедицинской химии имени В.Н.Ореховича
119221 Москва, ул. Погодинская, 10, Россия
2 Федеральный научно-клинический центр физико-химической медицины
119435 Москва, Малая Пироговская ул., 1А, Россия
* E-mail: torti@mail.ru
Поступила в редакцию 24.01.2019
После доработки 02.04.2019
Принята к публикации 15.04.2019
Аннотация
Интенсивное развитие новых аналитических масс-спектрометрических (МС) технологий привело к возможности детального фракционирования биологически важных соединений, что, в применении к липидам, способствовало развитию возможностей идентификации и количественного анализа всей совокупности молекулярных видов липидов – липидома биологического объекта. В обзоре обобщены подходы и результаты анализа липидома плазмы крови человека в медицинских исследованиях. Рассмотрены основные принципиальные подходы МС анализа: направленная, “таргетная” липидомика после предварительной ВЭЖХ или непосредственная МС цельного липидного экстракта (называемая в последние годы “shotgun lipidomics”). Показано выявляемое этими методами многообразие (более 1000 видов) индивидуальных липидов плазмы крови – за счет разнообразных вариантов сочетаний полярных и жирнокислотных участков липидных молекул. Их представленность может по-разному проявляться при заболеваниях. Кратко освещены также аналитические и физиологические факторы, влияющие на липидомный анализ, включая пробоподготовку образца, нормирование результатов, а также влияние генов, сопряженных с липидным метаболизмом. Отмечается перспективность липидомного анализа в клинических исследованиях, для чего необходима стандартизация используемых методов и условий. В связи с вовлеченностью липидов во многие клеточные и метаболические процессы такой анализ будет способствовать выявлению новых биомаркеров, а также расширению представлений о патогенетических механизмах ряда заболеваний.
1. ЛИПИДОМИКА И ЕЕ МЕСТО В СОВРЕМЕННЫХ “МУЛЬТИОМНЫХ” ИССЛЕДОВАНИЯХ
Проблеме исследования информативных специфических показателей (в последние годы обозначаемых термином “биомаркеры”), которые позволяли бы выявлять конкретное заболевание и оценить ответ организма на терапию, уделялось много внимания практически с самого начала появления медицинской науки как таковой. Подходы к решению этой проблемы, их уровень, определялись достигаемой степенью развития имеющихся на данный момент аналитических процедур. Клиническая биохимия в течение многих лет своего существования создала определенный спектр биохимических показателей, в основном для плазмы и сыворотки крови, коррелирующих с теми или иными заболеваниями, которые и используются сейчас в современной медицинской практике. По мере расширения информации и проведения новых исследований, в том числе эпидемиологических, на больших группах лиц (называемых в литературе “когортами”) предлагались и затем вводились в практику новые дополнительные показатели.
Например, для выявления предрасположенности пациентов к сердечно-сосудистым заболеваниям и мониторинга терапевтических изменений у таких больных, в последние два десятилетия в клинической практике используется ранее не применявшийся показатель – уровень холестерина (ХС) липопротеинов высокой плотности, в дополнение к уровням общего ХС и триглицеридов (ТГ) [1, 2]. Обнаружение ассоциации риска этих заболеваний с определяемым в плазме (с использованием моноклональных антител) уровнем специфических липопротеинов, названных “липопротеином (а)”, также привело к его использованию в качестве информативного критерия во многих клинических исследованиях [3, 4]. Тем не менее, как для сердечно-сосудистых, так и для ряда других заболеваний, принятые показатели часто оказываются недостаточными, так как у ряда больных они имеют нормальные величины [5, 6]. Кроме этого, при анализе суммарных классов липидов не учитывается, что их различные молекулярные виды (внутри одного и того же класса) могут иметь разные биологические эффекты, и, в связи с вовлеченностью липидов, особенно окисленных, в ряд заболеваний, при их суммарном определении может быть упущена важная для конкретного больного информация [5].
В поиске новых чувствительных критериев заболеваний огромный скачок был сделан благодаря появлению и развитию масс-спектрометрических (МС) методов исследования, обладающих чрезвычайно высокой чувствительностью и разрешающей способностью и обеспечивающих разделение анализируемых соединений по величине отношения молекулярной массы к заряду (m/z). Это стимулировало развитие современных постгеномных технологий, в частности метаболомики, то есть, МС-анализа широкого круга метаболитов в поисках наиболее информативных из них, что позволило выявить ряд новых биомаркеров [7–9]. Объектом основных метаболических исследований был широкий набор относительно легко анализируемых низкомолекулярных соединений, и лишь небольшая доля работ была направленa на исследование липидома плазмы, что наглядно проиллюстрировано на рис. 1, где представлен приведенный в работе Хинтервирс с соавт. [5] анализ количества публикаций в области так называемых “-омных” исследований за период до 2014 г.
Рис. 1.
Рост количества публикаций в области метаболомики, включая липидомику, на фоне работ по геномике и протеомике. В верхней части – процент от общего количества исследований в 2013 г. (адаптировано по [5]).

Как видно из рис. 1, основные работы по метаболомике начались в 2003–2004 гг., причем в первые годы они практически не затрагивали липидных соединений. В течение последующих 10 лет количество метаболомных исследований постепенно возрастало, оставаясь, однако, существенно ниже числа работ в области геномики и протеомики. К 2013 году процент работ по метаболомике в целом возрос от 0 до 14%, но на липидомику приходилось только 2.1% от общего количества, несмотря на хорошо известную важную роль различных липидов в жизнедеятельности клетки и организма в целом. Это объясняется чрезвычайным многообразием отдельных молекулярных видов липидов, возможностью многих комбинаций и сочетаний различных частей их молекул – неполярных участков (цепей разных жирных кислот) и нескольких видов более полярных фрагментов, свойственных отдельным классам липидов. За счет этого в одном изучаемом биологическом образце, например, в плазме крови, может присутствовать несколько сотен отдельных молекулярных видов липидов.
Подходы к осуществлению такого сложного фракционирования стали практически осуществимыми лишь в последние годы – благодаря развитию отдельных вариантов масс-спектрометрической техники, иногда в сочетании с ВЭЖХ или, реже, с ГЖХ [10, 11]. Это позволило идентифицировать и количественно анализировать в образце не только классы липидов, но и индивидуальные молекулярные виды внутри каждого класса. Такие исследования, проводившиеся на различных биологических объектах, в том числе клетках и тканях экспериментальных животных или в модельных экспериментах, позволили получить в ряде случае новую информацию об участии ряда липидов в регуляции многих биологических процессов, в том числе в клеточной сигнализации и пролиферации [12–15]. Было выявлено участие отдельных видов липидов в патологических процессах, например в усиленном клеточном росте [16, 17], или в формировании атеросклеротических бляшек [18]; это указывало на возможность их клинической значимости.
Проводились работы по липидомному анализу образцов, в основном плазмы крови, взятых у больных с различными заболеваниями, в сопоставлении с теми или иными клиническими характеристиками, что привело к формированию отдельного нового направления исследований – клинической липидомики [19], параллельно с внедрением в клинику других “-омных” подходов (геномики, протеомики, метаболомики), в целом называемых сегодня “мультиомикой” [20, 21]. Данный термин включает в себя широкую область интегрированных исследований, проводимых на уровне клеток, тканей, органов и всего организма. Трансляцию их в клинику, с соответствующим включением и анализом сопряженности получаемых результатов с клиническими данными – т. е. клиническую мультиомику – иногда называют (в отличие от более общей, биологической мультиомики) “клинической транс-омикой” [20, 22]. Существенным ее направлением – в связи с неотъемлемым участием липидов в большинстве метаболических процессов – является клиническая липидомика.
В последние годы в этой области появился ряд работ и обзоров [19, 23–28], в том числе c включением эпидемиологических исследований [25]. Выявлялась роль таких факторов как возраст, пол, этническая принадлежность [29], особенность молекулярных видов липидов при ряде заболеваний – в частности сосудистой системы, метаболическом синдроме, болезни Альцгеймера, онкологических и ряде других [14, 15, 19, 23], включая преэклампсию [30] и респираторные заболевания [31]. Большое внимание уделяется также развитию самой процедуры липидомного анализа, особенно существенной для липидов, гидролизуемых присутствующими в образце липолитическими ферментами, а также содержащих легко окисляемые ненасыщенные жирные кислоты [10, 11, 32, 33].
В обзоре кратко рассмотрены основные результаты исследований в области клинической липидомики, с преимущественной направленностью на липидом плазмы крови – как чаще всего используемого в клинических исследованиях биологического материала. Вопросы, связанные с техническими аспектами проведения МС-анализа, используемыми для этой цели приборами, идентификацией и количественным определением молекулярных видов липидов, детально освещенные в ряде других работ и обзоров [10–12, 15, 28], практически не рассматриваются. Обзор направлен на биохимические аспекты липидомного фракционирования, включая основные принципы методических подходов, многообразие присутствующих в плазме крови индивидуальных молекулярных видов липидов и факторы, влияющие на получаемые результаты. Понимание этих вопросов необходимо для использования анализа липидома плазмы в медицинской химии и выявления новых информативных липидных биомаркеров [5, 14, 17].
2. ОСНОВНЫЕ ПОДХОДЫ МАСС-СПЕКТРОМЕТРИЧЕСКОГО АНАЛИЗА ЛИПИДОМА ПЛАЗМЫ КРОВИ
В первых работах по липидомике, в начале 2000-х гг., МС-анализу и детекции подвергали отдельные группы липидов, выделенных из биологического материала, в том числе плазмы, после предварительного их отделения с помощью ВЭЖХ. Впоследствии, с совершенствованием МС-методов, стал активно использоваться другой подход – непосредственная характеристика липидного экстракта, осуществляемая его прямой однократной инжекцией в систему. Это стало возможным благодаря введению различных методов мягкой ионизации: ионизации методом распыления в электростатическом поле (electrospray) [36], а также лазерно-десорбционной ионизации с использованием матрицы (MALDI) [28, 34], применяющейся первоначально для крупных лабильных молекул – белков, пептидов и, впоследствии, для липидов [14]. В ряде работ проводилась также химическая ионизация или фотоионизация при атмосферном давлении (“atmosphere pressure chemical ionization” (APCI) и “atmosphere pressure photo ionization” (АРРI)) [14]. Последующий МС-анализ проводится при регистрации положительных и отрицательных ионов, что создает возможность раздельного детектирования различных классов липидов.
В клинических липидомных исследованиях МС липидов образца (в основном, плазмы крови) осуществляют как после предварительного ВЭЖХ-фракционирования (ВЭЖХ-МС), так и без него. Эти подходы характеризуют соответственно или “таргетный” – направленный анализ липидома, детально характеризующий конкретную группу липидов, или глобальный, дающий максимально возможно полную информацию о наборе всех присутствующих в биологическом образце липидов [14].
В последние годы все больше стало появляться работ по непосредственному введению липидного экстракта в источник ионизации масс-спектрометра – подходу, называемому раньше прямой инфузионной МС (DIMS – direct infusion mass spectrometry) [28, 35], получившему также новый, но уже широко распространенный термин “shotgun lipidomics” [15, 36]. Термин введен в 2004 г. [37]. Дословно – “липидомика ружейного выстрела”, в русскоязычном варианте это та же “прямая липидомика”. Именно такой вид анализа, с использованием электроспрейной ионизации, в наибольшей степени применяется в клинических липидомных исследованиях, направленных в основном на детальный анализ липидов плазмы крови. Техническая его реализация осуществлялась в разных работах при помощи различных типов масс-спектрометров и их систем, включая тандемную масс-спектрометрию (МС/МС), с выявлением не только ионизированных липидных молекул, но и в ряде случаев их фрагментов, образующихся путем соударения при высокой энергии с молекулами газа (обычно аргона) – higher energy collision dissociation (HCD). Такие методы, как и упомянутая выше ВЭЖХ-МС, позволяют разделить и идентифицировать изобарные липиды, которые имеют одинаковые брутто-формулы, но разное строение молекул. Детально эти процессы и применяемые для их осуществления приборы описаны в обзорах П.Г. Лохова с соавторами [7, 8] и ряде других [5, 14, 36]
3. ЛИПИДЫ ПЛАЗМЫ КРОВИ КАК ОСНОВНОЙ ОБЪЕКТ КЛИНИЧЕСКОЙ ЛИПИДОМИКИ – МНОГООБРАЗИЕ ИНДИВИДУАЛЬНЫХ МОЛЕКУЛЯРНЫХ ВИДОВ ЛИПИДОВ
Для систематизации результатов исследований только зарождавшейся в те годы (2005–2007 г.) липидомики был создан (в Университете Сан-Диего, США) научный консорциум, названный Lipid MAPS (Lipid Metabolites And Pathways Strategy) [38], который совместно с международным комитетом по номенклатуре (ILCNC, International Lipids Classification and Nomenclature Committee) разработал несколько измененную, по сравнению с применявшейся ранее, “всеобъемлющую систему классификации липидов” [39, 40], группирующую все липиды различных природных источников в 8 основных категорий – “жирные кислоты, глицеролипиды, глицерофосфолипиды, сфинголипиды, стерины, пренолы, сахаролипиды и поликетиды” (поликарбонильные вторичные метаболиты, образующиеся в клетках бактерий, грибов, животных и растений) [39, 40]. В плазме крови присутствуют в различных соотношениях первые 6 из перечисленных категорий (рис. 2, по [41]).
Как видно из рисунка, особенности обновленной классификации относятся в основном, к фосфолипидам (ФЛ). Они заключаются в том, что из общего класса, называвшегося “фосфолипидами”, был отделен один, сфингозин-содержащий ФЛ, сфингомиелин (СМ) (второй по концентрации в плазме, после фосфатидихолина) и перенесен в другую группу – сфинголипидов (СЛ), вместе с другими липидами, также содержащими сфингозин. Оставшиеся ФЛ, на основе глицерина, образуют тем самым класс, называемый теперь глицерофосфолипидами. То есть, если в основе прежней классификации лежало наличие в липидной молекуле фосфата (определявшегося тогда по неорганическому фосфору после сжигания), то современная классификация основана на типе гидроксилсодержащего фрагмента – это глицерин в глицерофосфосфолипидах или длинноцепочечный спирт сфингозин в сфинголипидах.
Выделение СЛ в отдельную, в свою очередь, тоже гетерогенную группу, обусловлено существенным вниманием, уделяемым этим липидам в последние годы в связи с их вовлеченностью в патогенез ряда заболеваний, особенно нейродегенеративных, в частности болезни Альцгеймера, – за счет участия во многих клеточных и межклеточных процессах и взаимодействиях, таких как дифференцировка, передача сигналов и ряда других. Многообразие этого класса липидов, включающего сфингомиелин, церамиды, гликозилцерамиды, сфингозин и сфингозин-1-фосфат, привело к появлению сфинголипидомики как отдельного направления липидомных исследований [42].
Современные чувствительные МС-методы позволяют анализировать также пренолы, минорный класс липидов плазмы, содержащих изопреновую группу (3-метил-2-бутен-1-ол). Пренолы рассматривают лишь в немногих работах, поскольку их содержание чрезвычайно низкое (0.06–0.08% от общих липидов плазмы). Однако в поиске биомаркеров, по мнению ряда авторов [11, 32], именно минорные липиды, не оцениваемые ранее из-за отсутствия соответствующих методов, могут оказаться информативными. Отмечается также присутствие в липидах плазмы еще меньших количеств (~0.001%) эйкозаноидов, высоко активных медиаторов липидной природы (простагландины, лейкотриены, тромбоксаны) [32].
В табл. 1 представлены молекулярные виды категорий липидов, присутствующих в плазме крови здоровых лиц – оцененные как суммарно, так и в отдельности, для составляющих их подклассов, а также их весовые и молярные концентрации. Из представленных классов липидов ранее для медицинских целей определялись только общий ХС и ТГ, в исследовательских работах – в отдельности свободный и этерифицированный ХС (ЭХС), глицерофосфолипиды (иногда их отдельные подклассы), иногда – свободные (неэтерифицированные) жирные кислоты (ЖК). Эти липидные подклассы в течение десятилетий определяли суммарно, без разделения на составляющие их виды с различными углеводородными цепями, и только в отдельных исследованиях анализировали состав ЖК с использованием ГЖХ. При этом анализировался биологический объект в целом (плазма), или его конкретные липидные классы после их предварительного выделения, обычно колоночной или препаративной ТСХ.
Таблица 1.
Количества, суммарные концентрации и основные индивидуальные молекулярные виды липидов различных классов в плазме крови человека (по [32] и [50])
| Классы липидов | Концентрация в плазме1 | Общее количество молекулярных видов1 | Основные индивидуальные молекулярные виды2 | |
|---|---|---|---|---|
| нмоль/мл | мг/дл | |||
| Всего липидов | 8023 | 471 | 588 | |
| Из них: | ||||
| Стерины* (сумма) | 3780 | 146 | 36 | |
| свободные | 826 | 31.8 | 14 | |
| этерифицированные | 2954 | 114 | 22 | 18:2, 18:1, 20:4 |
| Глицерофосфолипиды (сумма) | 2596 | 201 | 160 | |
| фосфатидилхолин (ФХ) | 1974 | 157 | 31 | 34:2, 36:2, 38:4 |
| фосфатидилэтаноламин (ФЭ) | 435 | 32.7 | 38 | 38:5, 38:4, 38:4 – плазмалоген, 38:5 – плазмалоген |
| лизо-ФХ | 103 | 5.25 | 12 | 16:0, 18:0, 18:1 |
| лизо-ФЭ | 36.6 | 1.78 | 7 | 18:2, 18:0, 20:4 |
| фосфатидилинозит (ФИ) | 31.5 | 2.74 | 19 | 38:4, 36:2, 34:2 |
| фосфатидилглицерин (ФГ) | 6.12 | 0.480 | 16 | 36:1, 38:6, 38:5 |
| фосфатидная кислота (ФК) | 2.50 | 0.173 | 15 | 34:0, 36:2, 36:0 |
| фосфатидилсерин (ФС) | 7.0 | 0.559 | 20 | 36:0, 36:1, 40:6 |
| N-ацил-ФС | 0.013 | 0.001 | 2 | 52:1, 54:2 |
| Глицеролипиды | 1100 | 93.7 | 73 | |
| триглицериды (ТГ) | 1058 | 90.6 | 18 | (16:1/18:1/18:1), (16:1/18:0/18:2), (16:1/18:1/18:2) |
| 1,2-диглицериды (ДГ) | 39 | 2.36 | 28 | 36:3, 36:4, 36:2 |
| 1,3-диглицериды | 13 | 0.806 | 27 | 36:3, 36:4, 34:1 |
| Сфинголипиды (сумма) | 318 | 23.7 | 204 | |
| сфингомиелины (СМ) | 303.47 | 22.817 | 101 | (18:1/16:0), (18:1/24:1), (18:2/24:1) |
| моногексозилцерамиды | 2.31 | 0.180 | 56 | (18:1/22:0), (18:1/24:0), (18:1/16:0) |
| церамиды | 11.59 | 0.732 | 41 | (18:1/24:0), (18:0/24:0), (18:1/22:0) |
| сфингоидные основания | 0.57 | 0.02 | 6 | Сфингозин 18:1, сфингозин-1-фосфат (S1P) 18:0, S1P 18:1 |
| Свободные жирные кислоты | 214 | 5.82 | 31 | 18:1, 16:0 и 18:0 (в сумме 78%) |
| Эйкозаноиды (простагландины, лейкотриены, тромбоксаны) | 0.071 | 0.002 | 76 | 15-Дезокси-простагландин D2 и др. [32] |
| Пренолы (изопреноиды) | 4.62 | 0.397 | 8 | Убихиноны, долихолы [32] |
1 Данные работы [32] для “стандартного референсного материала”, приготовленного из образцов плазмы 100 человек 40–50 лет репрезентативной выборки из популяции США.
2 Данные работы [50]; указано суммарное количество атомов С и двойных связей в ЖК-цепях, включающее, в свою очередь, несколько возможных изобарических вариантов.
* В основном холестерин, с 2–3% промежуточных продуктов его биосинтеза или метаболизма (латостерин, десмостерин, 7‑дегидрохолестерин, ланостерин, ситостерин) [32].
При таком анализе долгое время исследователи ограничивались получаемыми сведениями в основном только о 9 преобладающих в липидах плазмы ацильных группах ЖК – С18–С22 с числом двойных связей до 4, т.е. анализ кончался на арахидоновой кислоте (20:4). Впоследствии, благодаря возросшему интересу к полиненасыщенным ЖК, спектр анализируемых ЖК увеличился до С24–С26, включая пентаеновые и гексаеновые ЖК – 20:5, 22:5, 22:6 (уровень которых в плазме составляет лишь доли процента, в 40–50 раз менее такового для основных ЖК, С14–С18). В результате – в лучшем случае можно было оценить суммарное процентное соотношение остатков ЖК в данном классе липидов, без информации об их сочетании в конкретных липидных молекулах (большинство из которых содержит две жирнокислотных цепи, присутствующие в разных комбинациях). Только МС-методы дали возможность – благодаря обусловленным углеводородными цепями отличиям в массе молекулы конкретного молекулярного вида липида – получить и идентифицировать его отдельный пик, отделив его от других, с той же полярной группой, но с другими ЖК. Согласно классификации Lipid MAPS [38–40], к жирным кислотам относят свободные ЖК (обычно транспортируемые в плазме альбумином) и эйкозаноиды, присутствующие в значительно меньших (более чем в1000 раз) количествах.
Эйкозаноиды образуются из арахидоновой и других С20-полиненасыщенных ЖК под действием ферментов – циклооксигеназы, липоксигеназы, цитохром-Р450–эпоксигеназы. Они обладают чрезвычайно высокой биологической активностью, и их уровень в плазме крови часто сопряжен с различными, в основном воспалительными, заболеваниями, поэтому, несмотря на очень низкие концентрации, эйкозаноиды рассматриваются как существенная – не по количеству, а по значимости – часть липидома плазмы [32].
Среди глицерофосфолипидов следует также отметить минорный (менее 0.04%), но функционально значимый лизофосфолипид – лизофосфатидную кислоту (лизо-ФК) [43], участвующую во многих биологических процессах через специфические рецепторы, сопряженные с G-белком (GPCR), приводя к активации ряда еще не полностью выясненных внутриклеточных эффекторов [44]. В ряде работ показано повышение уровня лизо-ФК при ряде онкологических и сосудистых заболеваний [13, 43, 45], в частности, молекулярных видов лизо-ФК/22:6, лизо-ФК/18:2 и лизо-ФК/20:4, то есть с докозагексаеновой, линолевой и арахидоновой кислотами [45].
Суммарное количество различных индивидуальных молекулярных видов липидов плазмы крови человека, по данным работы [32] на основе анализа стандартного референсного материала, составляло 588. В проведенном Вейр с соавт. [46] исследовании микрообразцов (10 мкл) плазмы 1430 человек (части популяционного исследования SAFHS (San Antonio Family Heart Study) генетических и других риск-факторов сердечно-сосудистых заболеваний) было выявлено 312 индивидуальных липида. По данным других авторов, количество молекулярных видов липидов в плазме выше [47] и может составлять более 1000 [14, 48], хотя в ряде работ цифра указана лишь ориентировочно, из теоретических рассмотрений. А в недавней работе Ким с соавт. [49] по исследованию липидома плазмы при деменциях сообщается о присутствии – с учетом и липидов диеты – 3225 индивидуальных молекулярных видов. Для каждого отдельного класса липидов число индивидуальных видов, по данным [32], варьирует, как видно из табл. 1, в среднем от 15 до 100. При этом преобладающими в каждом классе липидов являются обычно 3–5 основных вида [32, 50], которые, как отмечено [50], могут быть наиболее информативными липидными метаболитами в плане выявления биомаркеров в клинических липидомных исследованиях (табл. 1).
Как видно из таблицы, в липидах плазмы присутствуют в большей степени традиционные, хорошо известные ЖК с длиной цепи в основном от С16 до С20 и с числом двойных связей до 4, а многообразие видов создается за счет вариантов их позиций и положения двойных связей. Для глицеролипидов и глицерофосфолипидов суммарное четное количество атомов углерода в ЖК также создает несколько вариантов. Например, ФХ С36:2 могут содержать две цепи С18:1 (олеиновой кислоты) или сочетание стеариновой (С18:0) и линолевой (С18:2), или две цепи разной длины, но с одинаковым суммарным числом атомов С и двойных связей – т. е. всего для такого ФХ в плазме крови теоретически возможно существование 6 разных молекулярных видов, у которых совпадают пики молекулярных ионов.
Разделения таких (изобарных) молекулярных видов липидов одного класса можно достичь, как упоминалось выше (раздел 2), путем использования тандемной МС. При этом получаются разные спектры МС/МС, отражающие различные ионные фрагменты, которые образуются при индуцированной диссоциации исходных ионизированных липидов (при так называемой “bottom-up”-липидомике, принцип и проведение которой детально описаны в обзоре [5]).
Указанные в табл. 1 классы липидов анализируют МС в отдельности, после их предварительного разделения с помощью ВЭЖХ, либо суммарно – путем непосредственного введения общего липидного экстракта плазмы (раздел 2). Минорные классы липидов – такие как моногексозилцерамиды, сфингоидные основания, пренолы и, особенно, эйкозаноиды – детально исследуют в немногих исследовательских работах, для чего используют различные варианты направленных, “таргетных” аналитических подходов [32].
4. АНАЛИТИЧЕСКИЕ ФАКТОРЫ, ВЛИЯЮЩИЕ НА РЕЗУЛЬТАТЫ ЛИПИДОМНОГО АНАЛИЗА И ТРЕБУЮЩИЕ СТАНДАРТИЗАЦИИ ДЛЯ ТРАНСЛЯЦИИ ЛИПИДОМИКИ В КЛИНИЧЕСКУЮ ПРАКТИКУ
Ввиду высокой лабильности липидных соединений во многих работах и обзорах по проведению липидомного анализа плазмы существенное внимание уделяется, помимо не рассматриваемой здесь самой процедуры МС [10–12, 15], методическим условиям пробоподготовки, определяющим полноту экстракции тех или иных молекулярных видов или возможный риск окисления двойных связей ЖК и, естественно, влияющим на конечный результат [51–54]. Экстракция липидов из плазмы недостаточно гидрофобным органическим растворителем приведет к потере таких существенно важных липидов как ТГ и ЭХС, и, наоборот, недостаток полярности растворителя не даст полного извлечения лизо-ФХ и некоторых СЛ. На полноту экстракции могут повлиять также условия взятия и хранения образца плазмы или сыворотки, за счет возможных изменений липидно-белковых взаимодействий в липопротеинах. Длительное хранение образца может привести к разрушению или окислению двойных связей, что изменит основополагающее для последующего МС-фракционирования отношение массы к заряду (m/z). Кроме того, ввиду неодинаковости для разных липидов соотношений размера получаемого на МС-спектре пика с их присутствующим в образце количеством, неадекватный выбор внутреннего стандарта также может дать неверные результаты [14]. Эти вопросы, существенные для клинической липидомики, кратко рассмотрены ниже.
4.1. Тип биообразца, пробоподготовка и хранение
Для взятия и первичной обработки биообразцов – в основном плазмы или сыворотки крови, использовались различные протоколы, с сопоставлением разных условий процедуры свертывания крови (температура и время) и последующего центрифугирования. Так как при исследовании в больших клинических когортах не всегда возможно поддерживать на всех стадиях одни и те же условия, важно определить возможное влияние отдельных этапов этой процедуры, включая взятие, предварительную обработку и хранение образцов, на уровни молекулярных видов липидов.
Оказалось, что липидные профили для сыворотки и плазмы, полученные после действия разных коагулянтов, различаются. В большинстве работ общая концентрация липидов – особенно ФХ и ТГ – была в сыворотке выше, чем в плазме, хотя пока не ясна предпочтительность того или иного вида обработки для липидомного анализа [29, 51, 52].
Некоторые виды ФХ, ФЭ, СМ и ТГ обнаруживались в бóльшем количестве в цитратной плазме, чем в плазме после EDTA. Воспроизводимость липидомных данных оказывалась, по данным одних авторов, выше для сыворотки, других, – для плазмы. Допускают, что это может быть связано с выдерживанием крови при комнатной температуре, и предлагают держать ее на ледяной бане; при этом обработку EDTA считают более предпочтительной, особенно для анализа СЛ, в частности гексозилцерамидов [53].
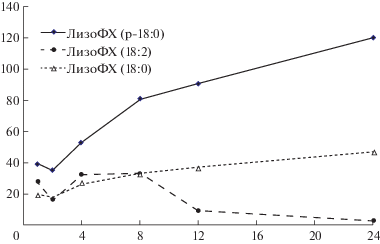
Показано также влияние условий хранения образца. Например, при выдерживании плазмы при 4°С в течение 24 ч наблюдались изменения в соотношении отдельных видов лизо-ФХ [50] – функционально важного фосфолипида, изменения отдельных видов которого фиксировались при различных заболеваниях [25, 46, 50] (рис. 3, по [50]). Это сопряжено с образованием лизо-ФХ в результате гидролиза фосфатидилхолинов фосфолипазой А2, параллельно с окислением двойной связи в его ненасыщенном молекулярном виде – лизо-ФХ (С18:2). Возрастание уровня лизо-ФХ в плазме через 48 ч показано и в других работах – как результат ферментолиза фосфолипазой А2, действующей также и на ФЭ [50, 52, 54]. К аналогичному результату приводила транспортировка нецентрифугированной крови [51]. Все остальные глицерофосфолипиды проявляли более высокую стабильность при стоянии на холоду и даже при комнатной температуре по крайней мере до 24 ч. Немаловажным фактором является количество процедур “замораживания – оттаивания”. Для большинства молекулярных видов липидов однократное замораживание не оказывает влияния, однако повторное – снижает уровень ряда липидов в плазме и в сыворотке [29]. На практике образцы плазмы замораживают и хранят в замороженном состоянии до проведения анализа [14].
Рис. 3.
Изменения уровней различных видов лизофосфатидилхолинов в образце плазмы в течение 24 ч при 4°С. По оси абсцисс – время (ч), по оси ординат – процент возрастания по сравнению с исходным уровнем (при непосредственной обработке взятой плазмы). Анализ проводили ВЭЖХ-МС после осаждения белков плазмы ацетонитрилом. ЛизоФХ (р-18:0) – лизо-ФХ плазмалоген (адаптировано по [50]).
4.2. Экстракция липидов из образца
Обязательной стадией перед введением анализируемой смеси в прибор для осуществления липидомного МС-анализа является экстракция из плазмы или сыворотки суммы присутствующих липидов органическими растворителями. Хранение экстрактов (при –20°С) считают более надежным, чем хранение исходной плазмы [55]. Для экстракции липидов из плазмы используют различные методы. В каждом методе перед экстракцией в образцы обычно добавляют доступные внутренние стандарты – для возможности количественной оценки получаемых на конечном этапе масс-спектров. Cуществует несколько методов экстракции липидов из биологического образца, сопровождающихся (для плазмы крови) преципитацией присутствующих белков. Количество используемой для анализа плазмы – от 5 до 100 мкл [14].
В большинстве работ применялись классические методы экстракции – смесью “хлороформ–метанол”. Чаще всего используют 20-кратный объем растворителя (по отношению к плазме) при соотношении “хлороформ–метанол” 2 : 1 , с промывкой экстракта 0.9% NaCl (0.2 объема) и с последующим расслаиванием образца на фазы (метод Folch). Верхний (метанольно-водный) слой удаляют, нижний берут для анализа после выпаривания и перерастворения в удобном для анализа растворителе. Например, такой метод использовали в работе [24], после добавления к плазме антиоксиданта бутилокситолуена.
Окончательное доведение образца до состояния, пригодного для введения в прибор, (выбор растворителя и его количество) определяется предполагаемым характером МС-анализа – непосредственное введение суммарного липидного экстракта образца в масс-спектрометр, без ВЭЖХ (shotgun lipidomics) или подход LC-MS (ВЭЖХ-МС) [32, 56].
Вариацией хлороформ-метанольной экстракции является использование смеси этих растворителей в равных объемах, 1 : 1 (метод Bligh и Dyer), взятой в отношении к плазме от 2 : 1 до 4 : 1 (в разных работах). После перемешивания и центрифугирования так же собирают нижний слой; верхний (водный) для более полной экстракции промывают хлороформом, объединяя затем нижние слои – с последующим упариванием и перерастворением для МС-анализа.
Недостатком этих методов является, по мнению ряда авторов, использование хлороформа, требующего (из-за его высокой плотности) отбора нижнего слоя, что не всегда удобно. Применяют и другие методы, детально описанные в работах [14, 15]. Один из них – “метод МТВЕ”, с использованием метил-трет-бутилового эфира (methyl tert-butyl ether, МТВЕ). При этом образец плазмы экстрагируют 4.5 объемами смеси “МТВЕ–метанол” (в соотношении 5 : 1.5).
Другой распространенный метод экстракции при липидомном анализе – “метод BUME”: обработка смесью бутанол–метанол, в разном соотношении с плазмой, от 3 : 1 до 10 : 1. При этом после обработки добавляли другую смесь растворителей – гептан–этилацетат (3 : 1), с последующим отбором (после расслаивания) верхней фазы. Этот прием считают более удобным, чем использование смесей с хлороформом, однако такая обработка имеет свои недостатки – возможность присутствия оставшихся водорастворимых компонентов, а также более трудное упаривание органической фазы из-за присутствия бутанола [14].
Поэтому в разных работах авторы вносили свои модификации, используя комбинации органических растворителей различной полярности – гексан, изопропанол, этилацетат, метанол, ацетонитрил и др. При этом следует иметь в виду зависимость растворимости липидов от длины цепей ЖК в их составе, определяющих гидрофобность молекулы, а также от наличия полярных функциональных групп фосфата или сахаров, придающих некоторую гидрофильность. Так, ТГ и ЭХС как нейтральные липиды хорошо растворяются в неполярных или слабо полярных растворителях (например, гексан, диэтиловый эфир, хлороформ), но имеют очень низкую растворимость в метаноле. Большинство полярных липидов – такие как глицерофосфолипиды и сфинголипиды, лучше растворяются в полярных растворителях. Поэтому наиболее полную экстракцию дают сочетания растворителей разной полярности. Хорошие результаты были показаны для экстракции изопропанолом, достоинство которого заключается также в возможности непосредственного его введения в прибор. Частичная оценка полноты экстракции липидов того или иного класса выбранным растворителем возможна при добавлении к плазме определенных концентраций внутренних стандартов, иногда радиоактивно меченных [14].
В ряде работ указанные методы использовали в сочетании с “твердофазной экстракцией” [14] – относительно новым методом, представляющим собой фактически не экстракцию липидов из биообразца, а разделение в суммарном экстракте конкретных групп аналитов (в данном случае, липидов), что является по сути современным вариантом колоночной хроматографии. При этом используют готовые колонки (картриджи), заполненные различными стационарными фазами на основе силикагеля и синтетических полимеров. Для липидных экстрактов это обычно сорбенты, содержащие аминогруппы, адсорбирующие липиды разной полярности, с разным содержанием ОН групп в молекуле. Перед проведением МС-анализа липидный экстракт либо разделяют на две части, анализируя в отдельности подвергнутый и не подвергнутый твердофазной экстракции образец, или экстрагируют адсорбированные липиды более полярным элюентом, с последующим их отдельным анализом. Такая обработка уменьшает количество пиков в получаемых масс-спектрах, облегчая их идентификацию, что особенно важно при прямой (shotgun) липидомике суммарного липидного экстракта. Кроме того, рядом авторов достигаемое при твердофазной экстракции частичное фракционирование липидов использовалось для последующего направленного МС-анализа их отдельных групп – стероидов, эйкозаноидов [57].
4.3. Нормирование уровней индивидуальных липидов
Получаемые масс-спектры вводимых в масс-спектрометр липидных экстрактов с большим числом пиков образующихся ионов или их фрагментов [14, 15] анализируют в плане идентификации пиков индивидуальных липидов по величинам m/z и их количественной оценки, для чего используют соответствующие базы данных и ряд специальных калибровочных программ (XCMS, MZmine и другие), описанных в обзоре [50]. На результат количественного анализа в МС влияет разная эффективность ионизации (и, следовательно, величина пика) разных молекул липидов, поэтому нормирование пиков проводят по их величинам для внутренних стандартов – т.е. исходно добавленных к образцу определенных количеств тех или иных липидов. Из-за невозможности иметь внутренний стандарт для каждого индивидуального вида (которых в образце плазмы может быть, как отмечено выше, более 1000 [46–49]), ненаправленное общее профилирование липидов – в основном используемое в клинической липидомике, считают полуколичественным.
Существуют наборы внутренних стандартов (Quality Control sample) [30, 50], содержащие контрольные образцы, специфичные для отдельных классов липидов. Чтобы они выходили отдельными пиками, в качестве внутренних стандартов включают липиды с нечетным числом атомов углерода в жирнокислотных цепях – С13, С15, С17, не свойственные эндогенным липидам плазмы, с последующей количественной обработкой масс-спектров с привлечением калибровочных программ [30]. Использование ограниченного числа внутренних стандартов не дает возможности идеально четкого, абсолютно правильного количественного липидомного анализа. Степень ионизации зависит от структуры липида, в частности – длины цепей ЖК и числа двойных связей. Однако наибольшее влияние в этом плане оказывает строение “полярных головок” липидов. Поэтому при проведении липидомного анализа наличие контрольных наборов, содержащих один внутренний стандарт для каждого класса липидов, считается достаточным [58].
5. ФИЗИОЛОГИЧЕСКИЕ ФАКТОРЫ, ВЛИЯЮЩИЕ НА ЛИПИДОМ ПЛАЗМЫ КРОВИ
При планировании клинико-липидомного анализа необходимо учитывать, помимо основного заболевания пациента, ряд влияющих на липидом плазмы физиологических факторов, которые могут помешать правильной интерпретации результатов – характер диеты, прием ряда лекарств, пол, возраст. Некоторые выявляемые особенности липидома, как и метаболома в целом, могут быть связаны с генетическими особенностями [59, 60], часто оказывающимися сопряженными с заболеванием [60].
5.1. Генетические факторы
В ряде работ по клинической липидомике, пока в небольшом их количестве по сравнению с другими метаболомными исследованиями, обнаружена связь изменений ряда показателей плазмы с генетическими особенностями. Как отмечено в работе [61], выявляемые липидомные изменения часто могут быть обусловлены нарушениями экспрессии генов белков, связанных с липидным метаболизмом. В проведенном Гигер с соавт. исследовании геномных ассоциаций (GWAS, genome-wide association study) у 284 мужчин было показано, что 12% наблюдаемых метаболомных, в том числе липидомных, вариаций связаны со случаями однонуклеотидных полиморфизмов (SNP, Single Nucleotide Polymorphism) в ряде генов. Так, содержание в липидных классах ЖК с определенной длиной цепи и количеством двойных связей сопряжено с полиморфизмами в ряде генов (обозначаемых как FADS1, LIPC, SCAD и MCAD), кодирующих конкретные десатуразы и дегидрогеназы, – через влияние на процессы синтеза и бета-окисления ряда жирных кислот [62]. Полиморфизм (SNP) одного из этих генов (rs174548) оказывает существенное влияние на уровень глицерофосфолипидов [59].
В другом исследовании (GWAS) 4400 обследованных лиц в европейской популяции было выявлено несколько конкретных генов (SPTLC3, LASS4, SGPP1, ATP10D и FADS1-3), экспрессия которых оказалась сопряженной с уровнем в плазме циркулирующих СМ, дигидро-СМ, церамидов и глюкозилцерамидов – через участие в регуляции метаболизма СЛ [63]. Выявленные в работе [64] особенности в содержании некоторых плазмалогенов у курящих лиц сопряжены, как показано, с экспрессией гена фермента алкил-дигидроксиацетонфосфат (alkyl-DHAP)-синтазы в клетках легких.
В недавней работе [60] исследовали липидом плазмы у больных c раком легких и сравнивали его с полученными ранее на таких больных геномными данными [65]. Найденный ряд отличий липидома по сравнению с таковым у здоровых лиц, в частности, выраженное повышение уровня фосфатидилсеринов – ФС/40:6 (содержащих, по всей вероятности, арахидоновую или более длинноцепочечную ЖК), ФС/34:5 (с ЖК с относительно короткими цепями) и лизо-ФС/22:6 (с докозагексаеновой кислотой), а также снижение лизо-ФЭ/20:4 и ряд других, авторы считают связанным с изменениями в семействах генов, сопряженных с ферментами липидного метаболизма – ACOT (ацил-CoA-тиоэстеразой), ACSL (ацил-CoA-синтетазой длинных цепей (long-chain), PKD (протеинкиназой D) [60], которое было показано ранее у больных некоторыми видами рака [65]. Такая информация может быть в дальнейшем существенной для интерпретации данных липидомного анализа в клинике.
5.2. Влияние других факторов
Естественно, что, как и при традиционном анализе липидов крови, меньшие вариации (и более правильные результаты) дает анализ крови натощак. При этом меньше проявляется и влияние характера диеты, липиды которой не могут не вносить вклад в липидом плазмы. При одних и тех же условиях анализа уровни основных липидов плазмы сохраняют постоянство – показано отсутствие изменений количества глицерофосфолипидов и сфинголипидов при повторном анализе в течение 14 дней (для плазмы 3 человек), при сохранении ряда межиндивидуальных различий [51].
Сообщается о ряде возрастных изменений: наряду с известным общим возрастанием ТГ в плазме с возрастом, у женщин показано также и увеличение ряда конкретных их видов. При этом в плазме (но не в сыворотке) наблюдались возрастные изменения некоторых лизо-ФХ. В большом популяционном исследовании у мужчин по сравнению с женщинами был показан больший уровень ЭХ, ТГ, лизо-ФХ и церамидов, наряду с меньшим содержанием СМ, тригексозилцерамидов и ФС. Семнадцать видов липидов оказались сопряженными с индексом массы тела, и некоторые виды ФХ и СФ отличались в плазме курящих лиц по сравнению с некурящими [46]. Отличия в плане влияния курения показаны и для некоторых видов ФХ-плазмалогенов [64]. Наблюдались и некоторые расовые различия – например, в работе [66] у лиц негритянской расы показан вдвое больший уровень плазмалогенов и низкий – ФХ (16:0/18:1).
Подобные особенности следует принимать во внимание при трактовке результатов клинико-липидомных исследований.
6. ПЕРСПЕКТИВЫ РАЗВИТИЯ КЛИНИЧЕСКОЙ ЛИПИДОМИКИ ПРИ ИССЛЕДОВАНИИ ЗАБОЛЕВАНИЙ
Для клинической трансляции липидомного анализа – т. е. внедрения и использования его в клинике с целью выявления новых диагностических липидных показателей (маркеров), необходимым этапом является выработка ряда стандартных методических процедур и протоколов его проведения. В настоящее время из-за крайне высокой вариации используемой аппаратуры, методов, протоколов, процедур пробоподготовки и хранения образцов данные различных лабораторий по “липидомному профилю” биообразцов больных с одной и той же патологией могут различаться. До сих пор мало исследований липидома плазмы в больших когортах больных, и отсутствие соответствующей базы данных пока не позволяет сформулировать определенные липидомные “нормативы” [5, 19], выявить возможные диапазоны величин, свойственных норме и патологии. Однако расширяющийся интерес к клинической липидомике и большое число исследований в этой области в последние годы дают основания предполагать ее интенсивное развитие и постепенное решение этих проблем, с перспективой клинического использования “липидомного профиля” [5, 19].
О значимости липидомных исследований в целом, включая медицинские аспекты, свидетельствует вышедшая недавно первая специальная монография, посвященная липидомике [67], написанная Ксианлин Ханом– автором многих публикаций в этой области, в том числе ряда упомянутых нами выше [12, 14, 15, 36, 37, 47, 56]. В ней, среди широкого рассмотрения липидомных исследований различных биологических объектов, отдельный большой раздел посвящен вопросам клинической липидомики. На основании имеющихся данных о роли липидов в клеточной сигнализации, в качестве вторичных мессенждеров, Кс. Хан подчеркивает важность исследований липидома при таких заболеваниях, как диабет, осложнения при ожирении, стеатоз, неалкогольный стеатогепатит, болезнь Альцгеймера, сердечно-сосудистые, онкологические и ряд других. При этом, из-за чувствительности липидов ко многим физиологическим и аналитическим факторам, автор подчеркивает необходимость стандартизации процедуры клинико-липидомных исследований как обязательного условия практического использования результатов анализа липидома плазмы.
Стандартизация всех этапов липидомного анализа, создание общей базы данных и проведение большего количества исследований позволит расширить понятие “дислипидемии”, наряду с выявлением различных сторон “липидной дисрегуляции”. На применение липидомики в клинической практике возлагают в настоящее время большие надежды – как на интеграцию клинической медицины с современной липидологией, развитие которой в последние десятилетия расширило информацию об участии липидов во многих биологических процессах, в том числе сопряженных с заболеваниями [19, 68]. Предполагают возможность выявления с помощью липидомики не только новых информативных маркеров для диагностики и контроля лечения, но и большего понимания механизмов нарушений ряда процессов с участием липидов и возможность обнаружения новых терапевтических мишеней. На них иногда могут указывать, в частности, выявляемые липидомные изменения, обусловленные, как отмечено выше (раздел 5.1), нарушениями экспрессии генов белков, связанных с липидным метаболизмом [59–64, 69].
Предполагают также возможность в будущем осуществления совокупного, интегрированного анализа липидомных данных вместе с результатами геномики и протеомики, хотя и допускают в ряде случаев их несопоставимость [20]. В целом клиническая липидомика становится неотъемлемой частью сформировавшейся в последние годы научной области, называемой клинической “мультиомикой” или “транс-омикой” [20, 22], представляющей собой трансляцию в клинику современных биохимических подходов, основанных на МС-анализе. В дальнейшем предполагают развитие автоматических систем для получения и анализа совокупности множества получаемых данных, с учетом одновременного анализа всех доступных на данный момент “-омных” исследований [19]. Это должно способствовать не только выявлению новых, в том числе липидных, биомаркеров, но и более углубленной расшифровке молекулярных механизмов патогенеза и прогрессирования заболеваний, ответа на терапию, и тем самым ее улучшению и развитию. По мнению Кс. Ванга [20], ожидаемый прогресс в данной области приведет к развитию новых терапевтических стратегий, улучшит понимание симптомов болезней и путей их лечения. При этом для липидомики, пока менее продвинутой по сравнению с другими областями, в ближайшие годы прогнозируется интенсивное развитие [70].
Детальный анализ имеющихся на сегодняшний данных по липидомному профилю плазмы при конкретных заболеваниях, ввиду возрастающего количества публикаций для ряда из них (например, сердечно-сосудистых, онкологических, диабета, преэклампсии и др.), а также некоторых различий данных отдельных работ, требует отдельного рассмотрения.
Список литературы
Reichl D., Miller N.E. // Arteriosclerosis. 1989. V. 9. P. 785–797.
Климов А.Н., Никульчева Н.Г. // Обмен липидов и липопротеидов и его нарушения: руководство для врачей. СПб.: Питер Ком, 1999.
Gencer B., Kronenberg F., Stroes E.S., Mach F. // Eur. Heart. J. 2017. V. 38. P. 1553–1560.
Maranhao R.C., Carvalho P.O., Strunz C.C., Pileggi F. // Arq. Bras. Cardiol. 2014. V. 103. P. 76–84.
Hinterwirth H., Stegemann C., Mayr M. // Circ. Cardiovasc. Genet. 2014. V. 7. P. 941–954.
Торховская Т.И., Кудинов В.А., Захарова Т.С., Маркин С.С. // Кардиология. 2018. Т. 58. С. 78–24.
Лохов П.Г., Арчаков А.И. // Биомед. химия. 2008. Т. 54. С. 497–511.
Лохов П.Г., Лисица А.В., Арчаков А.И. // Биомед. химия. 2017. Т. 63(3). С. 232–240.
Lokhov P.G., Kharibin O.N., Archakov A.I. // Int. J. Mass Spectrom. 2012. V. 309. P. 200–205.
Lee S.H., Williams M.V., DuBois R.N., Blair I.A. // Mass Spectrometry. 2003. V. 17. P. 2168–2176.
Zhao Y.Y., Wu S.P., Liu S., Zhang Y., Lin R.C. // Chem. Biol. Interact. 2014. V. 220. P. 181–192.
Han X., Gross R.W. // J. Lipid Res. 2003. V. 44. P. 1071–1079.
Торховская Т.И., Халилов Е.М., Коротаева А.А. // Бюлл. экспер. биол. мед. 2007. Приложение 2. С. 33–38.
Yang K., Han X. // Trends. Biochem. Sci. 2016. V. 41. P. 954–969.
Wang M., Wang C., Han RH., Han X. // Prog. Lipid. Res. 2016. V. 61. P. 83–108.
Budnik L.T., Mukhopadhyay A.K. // Biol. Reprod. 2002. V. 66. P. 859–865.
Perrotti F., Rosa C., Cicalini I., Sacchetta P., Del Boccio P., Genovesi D., Pieragostino D. // Int. J. Mol. Sci. 2016. V. 17. pii: E1992.
Stegemann C., Drozdov I., Shalhoub J., Humphries J., Ladroue C., Didangelos A., Baumert M., Allen M., Davies A.H., Monaco C., Smith A., Xu Q., Mayr M. // Circ. Cardiovasc. Genet. 2011. V. 4. P. 232–242.
Lv J., Zhang L., Yan F., Wang X. // Clin. Transl. Med. 2018. 7(1). 12.
Wang X. // Cell Biol. Toxicol. 2018. V. 34. P. 163–166.
Angione C., Conway M., Lió P. // BMC Bioinformatics. 2016. V. 17 (Suppl 4). 83.
Srivastava A., Kulkarni C., Mallick P., Huang K., Machiraju R. // Pac. Symp. Biocomput. 2018. V. 23. P. 377–387.
Hua C., van der Heijden R., Wang M., van der Greef J., Hankemeierb T., Xua G. // J. Chromatogr. B. Analyt. Technol. Biomed. Life Sci. 2009. V. 877. P. 2836–2846.
Meikle P.J., Wong G., Tsorotes D., Barlow C.K., Weir J.M., Christopher M.J., MacIntosh G.L., Goudey B., Stern L., Kowalczyk A., Haviv I., White A.J., Dart A.M., Duffy S.J., Jennings G.L., Kingwell B.A. // Arterioscler. Thromb. Vasc. Biol. 2011. V. 31. P. 2723–2732.
Stegemann C., Pechlaner R., Willeit P., Langley S.R., Mangino M., Mayr U., Menni C., Moayyeri A., Santer P., Rungger G., Spector T.D., Willeit J., Kiechl S., Mayr M. // Circulation. 2014. V. 129. P. 1821–1831.
Kolovou G., Kolovou V., Mavrogeni S. // Vasc. Health Risk Manag. 2015. V. 11. P. 333–342.
Zhao Y.Y., Cheng X.L., Lin R.C. // Int. Rev. Cell Mol. Biol. 2014. V. 313. P. 1–26.
Лохов П.Г., Маслов Д.Л., Балашова Е.Е., Трифонова О.П., Медведева Н.В., Торховская Т.И., Ипатова О.М., Арчаков А.И., Малышев П.П., Кухарчук В.В., Шестакова Е.А., Шестакова М.В., Дедов И.И. // Биомед. химия. 2015. Т. 61. С. 7–18.
Ishikawa M., Maekawa K., Saito K., Senoo Y., Urata M., Murayama M., Tajima Y., Kumagai Y., Saito Y. // PLoS One. 2014. V. 9. e91806.
Kenny L.C., Broadhurst D.I., Dunn W., Brown M., North R.A., McCowan L., Roberts C., Cooper G.J.S., Kell D.B., Baker P.N. // Hypertension. 2010. V. 56. P. 741–749.
Yan F., Wen Z., Wang R. // BMC Pulm. Med. 2017. V. 17(1):174.
Quehenberger O., Armando A.M., Brown A.H. // J. Lipid Res. 2010. V. 51. P. 3299–3305.
Yang L., Li M., Shan Y., Shen S., Shen S., Bai Y., Liu H. // J. Sep. Sci. 2016. V. 39. P. 38–50.
Pulfer M., Murphy R.C // Mass Spectrom. Rev. 2003. V. 22. P. 332–364.
Dettmer K., Aronov P.A., Hammock B.D. // Mass Spectrom. Rev. 2007. V. 26. P. 51–78.
Han X., Gross R.W. // Mass Spectrom. Rev. 2005. V. 24. P. 367–412.
Han X., Cheng H., Mancuso D.J., Gross R.W. // Biochemistry. 2004. V. 43. P. 15584–15594.
Schmelzer K., Fahy E., Subramaniam S., Dennis E.A. // Methods Enzymol. 2007. V. 432. P. 171–183.
Fahy, E., Subramaniam S., Brown H.A., Glass C. K., Merrill A.H., Jr., Murphy R.C., Raetz C.R., Russell D.W., Seyama Y., Shaw W., Shimizu T., Spener F., van Meer G., Van Nieuwenhze M.S., White S.H., Witztum J.L, Dennis E.A. // J. Lipid Res. 2005. V. 46. P. 839–862.
Fahy E., Subramaniam S., Murphy R.C., Nishijima M., Raetz C.R., Shimizu T., Spener F., van Meer G., Wakelam M.J., Dennis E.A. // J. Lipid Res. 2009. V. 50. Suppl. P. S9–S14.
Quehenberger O., Dennis E.A. // N. Engl. J. Med. 2011. V. 365. P. 1812–1823.
Алесенко А.В. // Биомед. химия. 2013. Т. 59. С. 25–50.
Sun Y., Wu Q., Yao C., Huang S., Tang Z., Li Z., Bao H., Li S., Zhou W. // Zhonghua Yi Xue Za Zhi. 2002. V. 82. P. 229–231 (Article in Chinese).
Saulnier-Blache J.S. // Med. Sci. (Paris). 2004. V. 20. P. 799–803 (Article in French).
Kurano M., Suzuki A., Inoue A., Tokuhara Y., Kano K., Matsumoto H., Igarashi K., Ohkawa R., Nakamura K., Dohi T., Miyauchi K., Daida H., Tsukamoto K., Ikeda H., Aoki J., Yatomi Y. // Arterioscler. Thromb. Vasc. Biol. 2015. V. 35. P. 463–470.
Weir J.M., Wong G., Barlow C.K. // J. Lipid Res. 2013. V. 54. P. 2898–2908.
Han X., Rozen S., Boyle S., Hellegers C. // PLoS One, 2011. V. 6. e21643.
Bowden J.A., Heckert A., Ulmer C.Z., Jones C.M. Koelmel J.P., Abdullah L., Ahonen L., Alnouti Y., Armando A.M., Asara J.M., Bamba T., Barr J.R., Bergquist J., Borchers C.H., Brandsma J., Breitkopf S.B., Cajka T., Cazenave-Gassiot A., Checa A., Cinel M.A., Colas R.A., Cremers S., Dennis E.A., Evans J.E., Fauland A., Fiehn O., Gardner M.S., Garrett T.J., Gotlinger K.H., Han J., Huang Y., Neo A.H., Hyötyläinen T., Izumi Y., Jiang H., Jiang H., Jiang J., Kachman M., Kiyonami R., Klavins K., Klose C., Köfeler H.C., Kolmert J., Koal T., Koster G., Kuklenyik Z., Kurland I.J., Leadley M., Lin K., Maddipati K.R., McDougall D., Meikle P.J., Mellett N.A., Monnin C., Moseley M.A., Nandakumar R., Oresic M., Patterson R., Peake D., Pierce J.S., Post M., Postle A.D., Pugh R., Qiu Y., Quehenberger O., Ramrup P., Rees J., Rembiesa B., Reynaud D., Roth M.R., Sales S., Schuhmann K., Schwartzman M.L., Serhan C.N., Shevchenko A., Somerville S.E., St John-Williams L., Surma M.A., Takeda H., Thakare R., Thompson J.W., Torta F., Triebl A., Trötzmüller M., Ubhayasekera S.J.K., Vuckovic D., Weir J.M., Welti R., Wenk M.R., Wheelock C.E., Yao L., Yuan M., Zhao X., Zhou S. // J. Lipid Res. 2017. V. 58. P. 2275–2288.
Kim W.S., Jary E., Pickford R., He Y. // Front. Neurol. 2018. V. 9. P. 104.
Hyötyläinen T., Orešič M. // Anal. Bioanal. Chem. 2015. V. 407. P. 4973–4993.
Breier M., Wahl S., Prehn C., Fugmann M., Ferrari U., Weise M., Banning F., Seissler J., Grallert H, Adamski J., Lechner A. // PLoS One. 2014. V. 9. e89728.
Jørgenrud B., Jäntti S., Mattila I., Fugmann M., Ferrari U., Weise M, Banning F., Seissler J., Grallert H., Adamski J., Lechner A. // Bioanalysis. 2015. V. 7. P. 991–1006.
Hammad S.M., Pierce J.S., Soodavar F., Smith K.J., Al Gadban M.M., Rembiesa B., Klein R.L., Hannun Y.A., Bielawski J., Bielawska A. // J. Lipid Res. 2010. V. 51. P. 3074–3087.
Zivkovic A.M., Wiest M.M., Nguyen U.T., Davis R., Watkins S.M., German J.B. // Metabolomics. 2009. V. 5. P. 507–516.
Wang M., Han X. // Methods Mol. Biol. 2014. V. 1198. P. 203–220.
Eggers L.F., Schwudke D. // Methods Mol. Biol. 2018. V. 1730. P. 163–174.
Flurkey W.H. // Biochem. Mol. Biol. Educ. 2005. V. 33. P. 357–360.
Zhao Z., Xu Y. // J. Lipid Res. 2010. V. 51. P. 652–659.
Homuth G., Teumer A., Völker U., Nauck M. // J. Endocrinol. 2012. V. 215(1). P. 17–28.
Lv J., Gao D., Zhang Y., Wu D., Shen L., Wang X. // J. Cell Mol. Med. 2018. V. 22. P. 5155–5159.
Wolf C., Quinn P.J. // Subcell. Biochem. 2008. V. 49. P. 567–588.
Gieger C., Geistlinger L., Altmaier E., Hrabé de Angelis M., Kronenberg F., Meitinger T., Mewes H.W., Wichmann H.E., Weinberger K.M., Adamski J., Illig T., Suhre K. // PLoS Genet. 2008. V. 4. e1000282.
Hicks A.A., Pramstaller P.P., Johansson A., Vitart V., Rudan I., Ugocsai P., Aulchenko Y., Franklin C.S., Liebisch G., Erdmann J., Jonasson I., Zorkoltseva I.V., Pattaro C., Hayward C., Isaacs A., Hengstenberg C., Campbell S., Gnewuch C., Janssens A.C., Kirichenko A.V., König I.R., Marroni F., Polasek O., Demirkan A., Kolcic I., Schwienbacher C., Igl W., Biloglav Z., Witteman J.C., Pichler I., Zaboli G., Axenovich T.I., Peters A., Schreiber S., Wichmann H.E., Schunkert H., Hastie N., Oostra B.A., Wild S.H., Meitinger T., Gyllensten U., van Duijn C.M., Wilson J.F., Wright A., Schmitz G., Campbell H. // PLoS Genet. 2009. V.5. e1000672.
Wang-Sattler R., Yu Y., Mittelstrass K., Lattka E. // PLoS One. 2008. V.3. e3863.
Lu J., Wang W., Xu M., Li Y., Chen C., Wang X. // Semin. Cancer Biol. 2017. V. 42. P. 31–38.
Cai X., Perttula K., Pajouh S., Hubbard A., Nomura D.K., Rappaport S.M. // Metabolomics. 2014. V. 4(1). 131.
Han X. // Lipidomics: Comprehensive Mass Spectrometry of Lipids. John Wiley & Sons, 2016.
Lydic T.A., Goo Y.H. // Clin. Trans. Med. 2018. V. 7(1). P. 4.
Lamaziere A., Wolf C., Quinn P.J. // Metabolites. 2012. V. 2. P. 1–18.
Sethi S., Brietzke E. // Prostaglandins Other Lipid Mediat. 2017. V. 128–129. P. 8–16.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия



