Биоорганическая химия, 2019, T. 45, № 5, стр. 502-509
Протеолитический гидролиз противоопухолевого пептида HLDF-6-AA в плазме крови
Ю. А. Золотарев 1, *, А. К. Дадаян 1, В. С. Козик 1, С. И. Шрам 1, И. Ю. Нагаев 1, В. Н. Азев 2, А. П. Богачук 3, В. М. Липкин 3, Н. Ф. Мясоедов 1
1 ФГБУН Институт молекулярной генетики РАН
123182 Москва, пл. Курчатова, 2, Россия
2 ФГБУН Филиал Института биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН
42290 Московская область, г. Пущино, проспект Науки, 6, Россия
3 ФГБУН Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова
117997 Москва, Россия
* E-mail: zolya@img.ras.ru
Поступила в редакцию 06.03.2019
После доработки 27.03.2019
Принята к публикации 15.04.2019
Аннотация
Гексапептид HLDF-6, соответствующий фрагменту 41–46 (TGENHR46) фактора дифференцировки лейкоцитов HLDF, обладает широким спектром нейропротекторной, нормализующей, анксиолитической, ноотропной и противоопухолевой активности. На основе его N-ацетил, C-амидной формы (Ac-TGENHR-NH2, HLDF-6-AA), полученной твердофазным методом, разрабатывается перспективный препарат с противоопухолевой активностью. Протеолитический гидролиз пептида HLDF-6-AA в плазме крови изучен с использованием его меченных изотопами водорода производных. Равномерно меченные тритием и дейтерием образцы пептида HLDF-6-AA были получены с использованием реакции высокотемпературного твердофазного каталитического изотопного обмена при 170°С. Пептид [3H]HLDF-6-AA был получен с молярной радиоактивностью 50 Ки/ммоль и пептид [2H]HLDF-6-AA со средним включением дейтерия равным 2.90 атомов на молекулу пептида. Протеолитический гидролиз пептида HLDF-6-AA в плазме крови крысы был исследован с использованием радиохроматографии. Результатом выполненного в данной работе исследования явилось установление основного пути его протеолитического гидролиза в плазме крови крысы – отщепление с C-конца амида дипептида His-Arg-NH2 (HR-NH2), с периодом полудеградации, составляющим 35 мин.
ВВЕДЕНИЕ
Нейропротекторные и противоопухолевые препараты пептидной природы характеризуются высокой эффективностью и чрезвычайно низкой токсичностью и по этой причине высоко перспективны. Особенностью пептидных препаратов является то, что в организме они подвергаются быстрому протеолитическому гидролизу и то, что образующиеся при этом пептидные фрагменты обладают собственными спектрами физиологической активности [1]. Это приводит к тому, что изменение пути протеолитического гидролиза пептида может изменить его физиологическую активность. Поэтому, актуальным является не только исследование фармакокинетики пептидов, но и количественный анализ образующихся из него фрагментов.
Одним из походов к исследованию метаболизма биологически активных пептидов в организме является использование их равномерно меченых образцов, содержащих изотопную метку во всех аминокислотных остатках [2, 3]. Использование таких пептидов позволяет выполнить количественный анализ не только исследуемого пептида, но и всех пептидных фрагментов, образующихся из него в тканях при протеолитическом гидролизе. Равномерно меченные тритием пептиды были с успехом использованы для радиорецепторного анализа, а также в in vivo- и in vitro-исследованиях их метаболизма. Для получения равномерно меченных изотопами водорода пептидов используется реакция высокотемпературного твердофазного каталитического изотопного обмена (ВТКИО), происходящая без растворителей при повышенной температуре под действием спилловер-водорода (СВ) [4, 5].
Реакция ВТКИО представляет несомненный интерес с точки зрения получения меченных изотопами водорода биоорганических соединений, так как позволяет проводить замещение по асимметрическим углеродным атомам без рацемизации и получать многократно меченные тритием пептиды, белки и селективные лиганды рецепторов [6–8] с полностью сохраненной биологической активностью [9–11]. С использованием реакции ВТКИО был получен целый ряд меченных тритием пептидов, имеющих молярную радиоактивность во много раз более, высокую, чем у селективно меченных тритием препаратов, полученных за счет реакции гидрирования или дегалоидирования соединений-предшественников [12]. Использование равномерно меченных тритием пептидов делает возможным значительно повысить чувствительность радиорецепторного анализа. Реакция ВТКИО позволяет с высокой эффективностью вводить дейтерий в физиологически активные пептиды с полным сохранением их свойств, что делает возможным использование этих равномерно меченных дейтерием пептидов для масс-спектрометрического анализа метаболизма пептидов [9, 11].
Ранее на экспериментальных моделях болезни Альцгеймера и ишемического инсульта было установлено, что пептид, соответствующий фрагменту 41–46 фактора дифференцировки лейкоцитов HLDF (TGENHR, HLDF-6) обладает высокой нейропротекторной активностью и обеспечивает практически полное восстановление когнитивных нарушений при этих патологиях [13, 14 ] . Пептид HLDF-6 превосходит современные нейропротекторные и ноотропные лекарственные средства (пирацетам, нейромидин, мемантин гидрохлорид, мексидол), как по выраженности терапевтического действия, так и по уровню и спектру комбинированной ноотропной и нейропротекторной активности. Пептид HLDF-6 обладает также высокой противотревожной активностью и свободен от нежелательных побочных эффектов, присущих бенздиазепинам [15 ] .
Объектом данного исследования является ацетил-амидное производное пептида HLDF-6 (Ac-GENHR-NH2, HLDF-6-AA), которое стало основой для создания нового фармацевтического препарата, обладающего противоопухолевой и нейропротекторной активностью [16]. Данное сообщение представляет часть проводимых нами фармакокинетических исследований пептида HLDF-6-AA в тканях экспериментальных животных и имеет своей целью установление свойств меченого пептида, и закономерностей его протеолитического гидролиза в плазме крови.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Использование равномерно меченных изотопами водорода пептидов, представляет интерес не только для фармакокинетических исследований, основанных на использовании меченных тритием соединений, но и для выполнения масс-спектрометрических исследований, основанных на использовании пептидов меченных дейтерием. В настоящее время для анализа пептидных пулов тканей наиболее широко используется масс-спектрометрия (МС). Однако этот метод имеет существенные ограничения при проведении фармакокинетических исследований. Это связано с тем, что для выполнения количественного МС-анализа метаболизма исследуемого пептида необходимо располагать в качестве внутренних стандартов меченными дейтерием или углеродом-13 образцами не только самого анализируемого пептида, но и всех его возможных протеолитических фрагментов. Также использование равномерно меченных дейтерием пептидов открывает новые возможности для выполнения МС-анализа метаболизма исследуемых пептидов, если в пептидном пуле тканей организма изначально присутствуют пептиды, соответствующие фрагментам протеолиза. Кроме того, значительную сложность представляет решение проблемы учета влияния пептидазной активности тканей на корректность результатов анализа. На стадии подготовки проб для анализа протеолитические ферменты тканей могут вызывать деградацию анализируемых пептидов и, в то же время, приводить к образованию дополнительного неконтролируемого количества искомых пептидов из белков исследуемых тканей. В тех случаях, когда пептидазная активность тканей при МС-анализе не известна или не учтена, это может привести к искаженной интерпретации результатов анализа [17].
Равномерно меченные тритием и дейтерием образцы пептида HLDF-6-AA были получены с использованием реакции ВТКИО при температуре 170°С. Выбранные условия реакции позволили получить меченые пептиды с высоким включением изотопов водорода и низким содержанием побочных продуктов (рис. 1). Меченный тритием пептид [3H]HLDF-6-AA и меченный дейтерием пептид [2H]HLDF-6-AA были получены с молярной радиоактивностью 50 Ки/ммоль и со средним включением дейтерия равным 2.90 атомов на молекулу пептида соответственно. Ранее было показано [18], что проведение реакции ВТКИО с дейтерием и тритием в одинаковых условиях приводит к одинаковому распределению изотопных атомов в органических соединениях. Это связано с тем, что в реакции ВТКИО дейтерий и тритий реагируют с органическими соединениями с одинаковой селективностью, а отношение скоростей этих реакций приближается к единице. Это свойство реакции ВТКИО позволило использовать данные о распределении атомов дейтерия по пептидной цепи меченного дейтерием пептида [2H]HLDF-6-AA для расчета молярной радиоактивности фрагментов, образующихся при протеолитическом гидролизе меченного тритием пептида [3H]HLDF-6-AA. Анализ распределения дейтерия в пептиде [2H]HLDF-6-AA был выполнен с использованием МС-спектроскопии (рис. 2, табл. 1).
Рис. 1.
Выделение меченного тритием пептида [3H]HLDF-6-AA из раствора продуктов реакции ВТКИО на колонке Кромасил С18 8 × 150 мм в градиенте концентрации метанола 20–35%, в присутствии 0.1% HFBA. Пик № 1 – HLDF-6-AA. Скорость подачи: 2.5 мл/мин. УФ детекция 225 нм, 1.0 A (Ch 1); 254 нм, 1.0 A (Ch 2).

Рис. 2.
Масс-спектрометрический анализ меченного дейтерием пептида [2H]HLDF-6-AA и его фрагментов, образующихся при МС-анализе. 754–764 – [2H]HLDF-6-AA (в); 311–317 – [2H]HR-NH2 (y2, а); 425–431 – [2H]NHR-NH2 (y3, б).

Таблица 1.
Распределение изотопомеров в меченном дейтерием пептиде [2H]HLDF-6-AA и его фрагментах NHR-NH2 и HR-NH2
| Изотопомеры, содержащие Dn атомов дейтерия |
[2H]HLDF-6-AA m/z 754–755 |
[2H]HR-NH2 y2, m/z 311–317 |
[2H]NHR-NH2 y3, m/z 425–431 |
|---|---|---|---|
| D0 | 0.0372 | 0.1327 | 0.0894 |
| D1 | 0.1597 | 0.3597 | 0.3024 |
| D2 | 0.2748 | 0.3037 | 0.3330 |
| D3 | 0.2477 | 0.1157 | 0.1916 |
| D4 | 0.1396 | 0.0488 | 0.0580 |
| D5 | 0.0670 | 0.0308 | 0.0238 |
| D6 | 0.0313 | 0.0102 | 0.0030 |
| D7 | 0.0195 | ||
| D8 | 0.0118 | ||
| D9 | 0.0080 | ||
| D10 | 0.0072 | ||
| Среднее замещение | 2.906 | 1.725 | 1.912 |
Установлено, что в меченом пептиде [2H]HLDF-6-AA в среднем содержится 2.906 атомов дейтерия, а в 2H-меченные фрагменты NHR-NH2 и HR-NH2 включено 1.912 и 1.724 атомов дейтерия соответственно. В образце [2H]HLDF-6-AA содержится 11 изотопомеров, различающихся количеством атомов дейтерия в молекуле. При этом доля изотопомеров, содержащих 2 и 3 атома дейтерия, превышает 50% от общего числа молекул меченного дейтерием пептида. В пептидных [2H]фрагментах NHR-NH2 и HR-NH2 содержится по 7 изотопомеров, при этом общая доля изотопомеров, содержащих 1 и 2 атома дейтерия на молекулу, превышает 60%. Установлено, что в реакции ВТКИО аминокислотные остатки фрагмента HR-NH2 обладают высокой реакционной способность, и в этом фрагменте содержится 59.3% всей изотопной метки пептида [2H]HLDF-6-AA. Исходя из данных по распределению дейтериевой изотопной метки в пептиде [2H]HLDF-6-AA для пептида [3H]HLDF-6-AA с молярной радиоактивностью 50 Ки/ммоль была рассчитана величина молярной радиоактивности пептида [3H]HR-NH2, которая составила 29 Ки/ммоль.
Анализ биотрансформации пептида [3H]HLDF-6-AA в гепариновой плазме крови был выполнен с помощью ВЭЖХ. Для этого использовали последовательно соединенные УФ-детектор и проточный детектор по радиоактивности. Для идентификации меченных тритием фрагментов исходного пептида [3H]HLDF-6-AA, образующихся при его протеолитическом гидролизе, были синтезированы немеченые пептидные фрагменты пептида HLDF-6-AA в качестве маркеров для УФ-детектора. Отнесение радиоактивных хроматографических пиков на радиохроматограмме было выполнено с использованием УФ-детектора и этих маркерных пептидов (рис. 3). Используя эти значения молярной радиоактивности и данные по количеству радиоактивности в ВЭЖХ-фракциях, содержащих пептидные фрагменты, был проведен количественный анализ состава пептидов, образовавшихся при биодеградации пептида [3H]HLDF-6-AA в плазме крови крысы (рис. 3 и 4). Таким образом, с использованием меченного тритием пептида [3H]HLDF-6-AA был проведен количественный анализ в плазме крови пептида HLDF-6-AA и его пептидных фрагментов, образующихся при протеолитическом гидролизе in vitro.
Рис. 3.
Радиохроматографический анализ продуктов протеолитического гидролиза пептида [3H]HLDF-6-AA, образовавшихся в плазме крови крысы в течение 8 (a) и 32 мин (б). Радиохроматография в градиенте метанола (10–40%) в смеси 0.08% TFA и 0.02% HFBA на колонке Kromasil C18 (4 × 150 mm). Пики: 4 – HLDF-6-AA; 3 – TGENHR-NH2; 2 – ENHR-NH2; и 1 – HR-NH2.
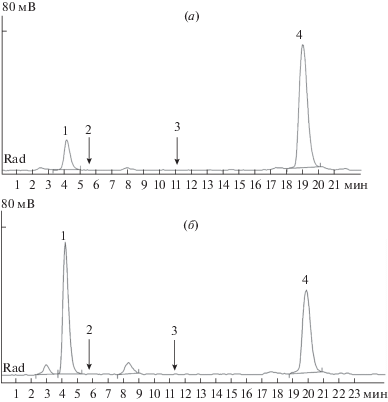
Рис. 4.
Кинетика протеолитического гидролиза пептида HLDF-6-AA в плазме крови крысы: 1 – HLDF-6-AA, 2 – HR-NH2.

Установлено, что основным направлением протеолитического гидролиза пептида HLDF-6-AA в плазме крови крысы является отщепление дипептида HR-NH2 с С-конца пептидной цепи. В пользу этого свидетельствует отсутствие на кинетической кривой образования HR-NH2 начального лаг-периода и отсутствие других продуктов, предшественников HR-NH2 (рис. 4). Установлено, что протеолитический гидролиз пептида HLDF-6-AA в плазме крови крысы происходит с периодом полудеградации составляющим 35 мин. Основным долгоживущим пептидным фрагментом пептида HLDF-6-AA, образующимся за счет ферментативного гидролиза в плазме крови, является дипептид HR-NH2.
В проведенном ранее исследовании, посвященном анализу фармакокинетики пептидов Н-TGENHR-NH2 и Н-TGENHR-ОН [12], было установлено, что амид пептида Н-TGENHR-NH2 обладает большей устойчивостью к протеолитическому гидролизу, чем кислотная форма. Биодеградация пептида TGENHR в плазме крови крысы происходит с отщеплением дипептида His-Arg с С-конца цепи, а пептида TGENHR-NH2 – с отщеплением дипептида TyrGly с N-конца пептидной цепи, с периодом полудеградации составляющим 20 мин [12]. В результате происходившего ферментативного гидролиза пептида TGENHR-NH2 основным долгоживущим пептидным фрагментом в плазме крови оказался дипептид HR-NH2, который образуется в результате последовательно протекающего гидролиза пептида ENHR-NH2, а не напрямую, в отличие от доказанного в данной работе для пептида Ac-TGENHR-NH2. Введение ацетильной защиты по N-концу пептидной цепи привело к изменению направления биодеградации пептида HLDF-6-AA с N- на С‑конец пептидной цепи и к увеличению протеолитической устойчивости, по сравнению с пептидом TGENHR-NH2.
Основным долгоживущим пептидным фрагментом пептида HLDF-6-AA, образующимся за счет ферментативного гидролиза в плазме крови является дипептид HR-NH2. Его вклад в противоопухолевую и антиметастатическую активность пептида HLDF-6-AA является предметом дальнейших фармакодинамических исследований.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Твердофазный синтез пептида – HLDF-6-AA
Твердофазный синтез пептида HLDF-6-AA и его фрагментов-маркеров был осуществлен с использованием Boc/Bzl-методологии и схемы неполного блокирования боковых функций аминокислот [19]. N-Концевую ацетильную группу вводили, используя N-ацетилбензотриазол, который был получен по методу Катрицкого [20, 21]. После завершения синтеза и удаления защитных групп, снятие пептид снимали с полимерной подложки с использованием безводного HF с добавкой 10%(по объему) м-крезола. Целевые пептиды очищали с помощью препаративной ВЭЖХ на колонке Phenomenex Synergy Hydro-RP (50 × 250 мм). Чистоту синтезированных пептидов определяли методом ВЭЖХ на колонке Phenomenex Sinergy HydroRP. Идентичность полученных препаратов оценивали масс-спектрометрически, а также с помощью аминокислотного анализа (подробный синтез будет опубликован отдельно).
Меченные дейтерием или тритием образцы пептида HLDF-6-AA получали с использованием реакции ВТКИО с газообразным тритием или дейтерием при температуре 170°С в твердой смеси, образованной немеченым пептидом, нанесенным на карбонат кальция, и высокодисперсным катализатором 5% палладий-на-карбонате кальция (Fluka). Пептид в количестве 1.0 мг растворяли в 1 мл воды и смешивали с 20 мг карбоната кальция, после чего при тщательном перемешивании замораживали жидким азотом. Воду удаляли лиофильной сушкой при –50°С. Неорганический носитель, с нанесенным препаратом, смешивали с 10 мг гетерогенного катализатора 5% палладий-на-карбонате кальция. В ампулу объемом 10 мл помещали полученную твердую смесь, вакуумировали, заполняли газообразным тритием до давления 250 торр и проводили реакцию ВТКИО при температуре 170°С в течение 15 мин. Ампулу охлаждали, вакуумировали, продували водородом. Пептид десорбировали 50% водным этанолом. Для удаления лабильного трития меченый пептид еще дважды растворяли в 50% водном этаноле и упаривали досуха. Хроматографическую очистку проводили с помощью ВЭЖХ на колонке Кромасил в градиенте метанола, в присутствии 0.1% гептафтормасляной кислоты (HFBA). Пептид упаривали и растворяли в этаноле до радиоактивной концентрации 1 мКи/мл.
Фармакокинетика пептида [3H]HLDF-6-AA в плазме крови с использованием радиохроматографии. В термостатированную при 37°С пробирку поместили 900 мкл плазмы крови крысы. Пептид [3H]HLDF-6-AA в количестве 340 мкКи растворили в 100 мкл физиологического раствора, добавили в плазму и перемешали встряхиванием. Пептид с плазмой инкубировали при 37°С. Через определенные промежутки времени отбирали по 100 мкл реакционного раствора и помещали в пробирки, в которых находилось 900 мкл 90% водного ацетонитрила, содержащего 1% TFA. В водно-ацетонитрильный раствор, использованный для экстракции, добавляли по 10 мкг немеченых пептидов-маркеров Ac-TGENHR-NH2, TGENHR-NH2, ENHR-NH2 и HR-NH2, предназначенных для идентификации радиохроматографических пиков при хроматографии. После центрифугирования раствор, содержащий меченные тритием пептиды и компоненты плазмы крови, подвергали сушке под уменьшенным давлением, реэкстракции метанолом и повторному центрифугированию. Полученный при этом раствор, содержащий меченные тритием пептиды, подвергали упариванию под уменьшенным давлением, реэкстракции 0.1% водным раствором TFA и последующему центрифугированию. Радиохроматографический анализ проводили на колонке Kromasil C18 (4 × 150 мм) в градиенте метанола (10–40%), содержащего смесь 0.08% TFA и 0.02% HFBA.
ЗАКЛЮЧЕНИЕ
С целью создания высокоактивных и низкотоксичных пептидных препаратов, предназначенных для профилактики и лечения онкологических заболеваний, проведено исследование инновационного лекарственного средства пептидной природы с противоопухолевым, антиметастатическим и протекторным действием на основе ацетил-амидной формы пептида HLDF-6. Для решения задач, связанных с исследованием фармакокинетики пептида HLDF-6-AA и молекулярных механизмов действия, были получены его равномерно меченный тритием пептид [3H]HLDF-6-AA с молярной радиоактивностью 50 Ки/ммоль и равномерно меченный дейтерием пептид [2H]HLDF-6-AA со средним включением дейтерия, равным 2.90 атомов на молекулу пептида. Кинетика протеолитического гидролиза пептида HLDF-6-AA в плазме крови крысы была исследована с использованием радиохроматографии. Установлено, что исследуемый пептид HLDF-6-AA обладает высокой протеолитической устойчивостью и основным направлением его протеолитического гидролиза в плазме крови крысы является отщепление дипептида HR-NH2 с С-конца пептидной цепи с периодом полудеградации, составляющим 35 мин. Установлено, что дипептид HR-NH2 образуется в результате первичного расщепления пептидной цепи и является основным долгоживущим продуктом протеолитического гидролиза в плазме крови. Установление этого факта делает целесообразным исследование вклада дипептида HR-NH2 в противоопухолевую активность пептида HLDF-6-AA.
Список литературы
Золотарев Ю.А., Ковалев Г.И., Дадаян А.К., Козик В.С., Кондрахин Е.А., Васильева Е.В., Липкин В.М. // Нейродегенеративные заболевания: от генома до целостного организма / Под ред. Угрюмова М.В. М: Научный мир, 2014. C. 763–777.
Золотарев Ю.А., Дадаян А.К., Долотов О.В., Козик В.С., Кост Н.В., Соколов О.Ю., Дорохова Е.М., Мешавкин В.К., Иноземцева Л.С., Габаева М.В., Андреева Л.А., Алфеева Л.Ю., Павлов Т.С., Бадмаева К.Е., Бадмаева С.Е., Бакаева З.В., Копылова Г.Н., Самонина Г.Е., Васьковский Б.В., Гривенников И.А., Зозуля А.А., Мясоедов Н.Ф. // Биоорган. химия, 2006. Т. 32. С. 183–191. [Zolotarev Yu.A., Dadayan A.K., Dolotov O.V., Kozik V.S., Kost N.V., Sokolov O.Yu., Dorokhova E.M., Meshavkin V.K., Inozemtseva L.S., Gabaeva M.V., Andreeva L.A., Alfeeva L.Yu., Pavlov T.S., Badmaeva S.E., Bakaeva Z.V., Kopylova G.N., Samonina G.E., Vaskovsky B.V., Grivennikov I.A., Zozulya A.A., Myasoedov N.F. // Russ. J. Bioorg. Chem. 2006. V. 32. P. 166–173.]
Zolotarev Yu.A., Dolotov O.V., Inozemtseva L.S., Dadayan A.K., Dorokhova E.M., Andreeva L.A., Alfeeva L.Yu., Grivennikov I.A., Myasoedov N.F. // Amino Acids. 2006. V. 30 (4). P. 403–408.
Zolotarev Yu.A., Dorokhova E.M., Nezavibatko V.N., Borisov Yu.A., Rosenberg S.G., Velikodvorskaia G.A., Neumivakin L.V., Zverlov V.V., Myasoedov N.F. // Amino Acids. 1995. V. 8. P. 353–365.
Zolotarev Yu.A., Dadayan A.K., Bocharov E.V., Borisov Yu.A., Vaskovsky B.V., Dorokhova E.M., Myasoedov N.F. // Amino Acids. 2003. V. 24. P. 325–333.
Золотарев Ю.А., Фирстова Ю.Ю., Абаимов Д.А., Дадаян А.К., В.С. Козик, Новиков А.В., Краснов Н.В., Васьковский Б.В., Назимов И.В., Ковалев Г.И., Мясоедов Н.Ф. // Биоорган. химия, 2009. Т. 35. С. 323–333. [Zolotarev Yu.A., Firsova Yu.Yu., Abaimov A.A., Dadayan A.K., Kosik V.S., Novikov A.V., Krasnov N.V., Vaskovskii B.V., Nazimov I.V., Kovalev G.I., Myasoedov N.F. // Russ. J. Bioorg. Chem. 2009. V. 35. P. 296–305.]
Zolotarev Yu.A., Dadayan A.K., Borisov Yu.A., Dorokhova E.M., Kozik V.S., Vtyurin N.N., Bocharov E.V., Ziganshin R.N., Lunina N.A., Kostrov S.V., Ovchinnikova T.V., Myasoedov N.F. // Bioorg. Chem. 2003. V. 31 (6). P. 453–463.
Zolotarev Yu.A., Dadayan A.K., Borisov Yu.A., Kozik V.S. // Chem. Rev. 2010. V. 110. P. 5425–5446.
Zolotarev Yu.A., Dadayan A.K., Kozik V.S., Ziganshin R.H., Vaskovsky B.V., Myasoedov N.F. // J. Label Compd. Radiopharm. 2007. V. 50. P. 483–486.
Золотарев Ю.А., Дадаян А.К., Козик В.С., Гасанов Е.В., Назимов И.В., Зиганшин Р.Х., Васьковский Б.В., Мурашов А.Н., Ксенофонтов А.Л., Харыбин О.Н., Николаев Е.Н., Мясоедов Н.Ф. // Биоорган. химия 2014. Т. 40. С. 31–41. [Zolotarev Yu.A., Dadayan A.K., Kozik V.S., Gasanov E V., Nazimov I.V., Ziganshin R.Kh., Vaskovsky B.V., Murashov A.N., Ksenofontov A.L., Kharybin O.N., Nikolaev E.N., Myasoedov N.F. // Russ. J. Bioorg. Chem. 2014. V. 40. P. 26–35.]
Kopylov A.T., Myasoedov N.F., Dadayan A.K., Zgoda V.G., Medvedev A.E., Zolotarev Yu.A. // Rapid Commun. Mass Spectrom. 2016. V. 30. P. 1283–1294.
Золотарев Ю.А., Дадаян А.К., Кост Н.В., Воеводина М.Э., Соколов О.Ю., Козик В.С., Шрам С.И., Азев В.Н., Бочаров Э.В., Богачук А.П., Липкин В.М., Мясоедов Н.Ф. // Биоорган. химия. 2015. Т. 41 (6). С. 644–656. [Zolotarev Yu.A., Dadayan A.K., Kost N. V., Voevodina M. E., Sokolov O.Yu., Kozik V.S., Shram S.I., Azev V N., Bocharov E.V., Bogachouk A.P., Lipkin V.M., Myasoedov N.F. // Russ. J. Bioorg. Chem. 2015. V. 41. P. 578–589.]
Bogachouk A.P., Storozheva Z.I., Solovjeva O.A., Sherstnev V.V., Zolotarev Yu.A., Azev V.N., Rodionov I.L., Surina E.A., Lipkin V.M. // J. Psychopharmacol. 2016. V. 30. P. 78–92.
Костанян И.А., Сторожева З.И., Семенова Н.А., Липкин В.М. // Доклады академии наук. 2009. Т. 428 (4). С. 418–422. [Kostanyan I.A., Storozheva Z.I., Semenova N.A., Lipkin V. M. // Dok. Biol. Sci. 2009. V. 428. P. 418–422.]
Zolotarev Yu.A., Kovalev G.I., Kost N.V., Voevodina M.E., Sokolov O.Y., Dadayan A.K., Kondrakhin E.A., Vasileva E.V., Bogachuk A.P., Azev V.N., Lipkin V.M., Myasoedov N.F. // J. Psychopharmacol. 2016. V. 30 (9). P. 922–935.
Богачук А.П., Золотарев Ю.А., Азев В.Н., Сурина Е.А., Смирнова Е.В., Липкин В.М. Патент Российской Федерации № 2018118939 14 марта 2019 г.
Che F-Y., Lim J., Pan H., Biswas R., and Fricker L.D. // Mol. Cell. Proteomics. 2005. V. 4 (9). P. 1391–1405.
Zolotarev Yu.A., Dadayan A.K., Borisov Yu.A., Kozik V.S., Nazimov I.V., Ziganshin R.H., Bocharov E.V., Chizhov A.O., Myasoedov N.F. // J. Phys. Chem. C. 2013. V. 117. P. 16878–16884.
Matsueda G.R., Stewart J.M. // Peptides. 1981. V. 2 (1). P. 45–50.
Katritzky A.R., Shobana N. // Tetrahedron. 1992. V. 48. P. 7817–7822.
Katritzky A.R., Zhang Y., Singh S.K. // Synthesis. 2003. V. 2003. P. 2795–2798.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


