Биоорганическая химия, 2019, T. 45, № 6, стр. 664-672
Синтез и гепатопротекторная активность производных бетулина и диптерокарпола
О. Б. Казакова 1, *, И. Е. Смирнова 1, Н. И. Медведева 1, Т. В. Лопатина 1, И. В. Чудов 2, А. Р. Шарипов 2, А. С. Зиганшин 2, Tran Thi Phuong Thao 3
1 Уфимский Институт химии Уфимского федерального исследовательского центра РАН
450054 Уфа, просп. Октября, д. 71, Россия
2 ФГБОУ ВО “Башкирский государственный аграрный университет”
450001 Уфа, ул. 50-летия Октября, 34, Россия
3 Institute of Chemistry, Vietnam Academy of Science and Technology
Hanoi, 18 Hoang Quoc Viet – Cau Giay district, Vietnam
* E-mail: obf@anrb.ru
Поступила в редакцию 04.02.2019
После доработки 02.04.2019
Принята к публикации 23.04.2019
Аннотация
Осуществлен синтез, в том числе региоселективный, 3,28-бис- и 28-моноацилатов бетулина (никотината, изоникотинатов), а также 3β-гемисукцинилдиптерокарпола с использованием дициклогексилкарбодиимидного метода. На основании данных морфологических и биохимических исследований крови на модели CCl4-индуцированного гепатита крыс установлено, что бисацилаты бетулина – 3β,28-ди-О-никотинат и 3β,28-ди-О-изоникотинат превосходят по своей активности моноацилат – 28-О-изоникотинат бетулина, 3β-гидроксидиптерокарпол наиболее активен в ряду даммарановых тритерпеноидов.
ВВЕДЕНИЕ
Тритерпеноиды и тритерпеноидные сапонины в течение многих лет являются привлекательными объектами для разработки препаратов для лечения заболеваний печени. Например, глицирризиновая кислота (ГК) в составе препарата “SNМС” используется в Японии для лечения пациентов с хроническим гепатитом и циррозом печени, снижая уровень трансаминаз [1]. 18α-Глицирретовая и олеаноловая кислоты применяются в Китае для лечения заболеваний печени [2, 3]. Препарат “Глицирам” (моноаммонийная соль ГК) обладает гепатозащитным эффектом, восстанавливая метаболическую функцию печени у животных, пораженных CCl4 [4]. Натриевая соль ГК входит в состав препарата “Фосфоглив”, который более эффективно, чем эссенциале, восстанавливает синтез белка и РНК в клетках печени при циррозе, вызванном действием CCl4 [4]. Препарат карбеноксолон (динатриевая соль гемисукцинилглицирретовой кислоты) считается одним из лучших средств для лечения язвы желудка и двенадцатиперстной кишки [5]. Гликозиды корня женьшеня Panax ginseng (гинзенозиды, агликонами которых являются протопанаксадиол, протопанаксатриол ) положительно влияют на регуляцию функций печени (острое и хроническое токсическое поражение печени, гепатит, фиброзирующий гепатит или цирроз, гепатоцеллюлярная карцинома) [6].
К наиболее известным представителям лупановых тритерпеноидов относятся лупеол, бетулин, бетулиновая кислота. Среди даммарановых тритерпеноидов широко известны протопанаксадиол, протопанаксатриол, даммареноловая кислота. Диптерокарпол (20(S)-гидроксидаммар-24-ен) – один из основных метаболитов живицы тропического дерева Dipterocarpus alatus.
Влияние лупановых и даммарановых тритерпеноидов на органы гепатобилиарной системы хорошо известно [7], однако лекарственные препараты на их основе до сих пор не внедрены в практику; на сегодняшний день получили распространение только БАДы отечественного и импортного производства [8]. К соединениям-лидерам по гепатопротекторной активности можно отнести различные ацилаты бетулина, превосходящие активность препаратов сравнения карсила и карбеноксолона [9, 10]. Данные по активности производных даммаранового тритерпеноида диптерокарпола в литературе практически не представлены.
Причинами отсутствия лекарственных препаратов на основе лупановых и даммарановых тритерпеноидов может быть недостаточное количество примеров их синтетических производных с выраженной фармакологической активностью и неэкологичность способов их синтеза и др.
В настоящей работе мы представляем данные по гепатопротекторной активности группы производных бетулина и диптерокарпола, синтез их ацилатов с использованием дициклогексилкарбодиимидного метода.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Экологичность и экономичность процессов синтеза лекарственных средств является одним из важных аспектов для фармпромышленности, что достигается сокращением количества стадий (в том числе за счет введения защитных групп, не входящих в состав конечного продукта), использованием нетоксичных растворителей и т.д. [11]. Наиболее распространенный метод получения ацилатов состоит из двух стадий и включает использование “агрессивных” хлорсодержащих реагентов (таких как оксалилхлорид, хлористый тионил, пентахлорид фосфора и др.) на стадии образования хлорангидридов и их последующее взаимодействие со спиртами [12]. Ангидридный метод требует использования сильного органического основания. Ранее хлорангидридным и ангидридным методами получены ацилаты бетулина (бисникотинат, бисизоникотинат, бисгемифталат) с выраженной гепатопротекторной активностью [10, 14, 15].
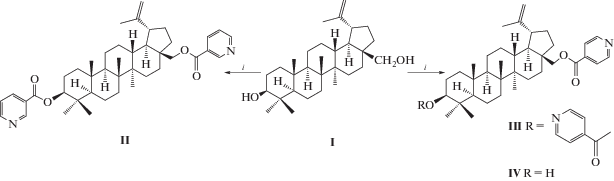
В настоящей работе мы провели ацилирование бетулина (I) никотиновой и изоникотиновой кислотами в среде СH2Cl2 с использованием в качестве дегидратирующего агента дициклогексилкарбодиимида (DCC) и каталитического количества 4-диметиламинопиридина (DMAP). В результате реакций получили 3,28-бисэфиры (II), (III) и 28-монопроизводное (IV) (схема 1 ). Селективность образования ди- и монопроизводного зависела от количества ацилирующего агента, температуры и времени реакции. Так, бисэфиры (II) и (III) получены с использованием 2.5-кратного избытка никотиновой или изоникотиновой кислот при перемешивании реакционной массы при комнатной температуре в течение 24 ч. Использование эквимольного количества изоникотиновой кислоты при 0–5°С и выдерживание в течение 6 ч позволило провести реакцию региоселективно с образованием 28-О-изоникотиноилбетулина (IV), количество минорных соединений (I) и (II), отделяемых перекристаллизацией, не превышало 10%. Таким образом, нами предложен дициклогексилкарбодиимидный экологичный метод получения бисацилатов бетулина (II) и (III), альтернативный описанному ранее [10, 14, 15], а также региоселективный способ получения 28-О-изоникотиноилбетулина (IV).
Схема 1 . Условия. i – никотиновая (для II)/изоникотиновая (для III, IV) кислота; DCC; CH2Cl2; DMAP; перемешивание 24 ч, 25°C (для II, III), перемешивание 6 ч, 5°C (для IV).
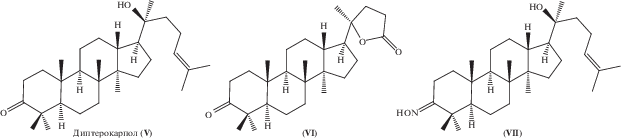
Вторая группа изученных соединений представляла собой производные диптерокарпола (V), модифицированные по положениям С3 и боковой цепи.
Ранее описанные соединения синтезировали в результате окисления диптерокарпола (V) озоном в среде ацетона [16] и взаимодействием с NH2OH · · HCl при кипячении в пиридине [17] (рис. 1).
Мы в данной работе синтезировали 3β-O-гемисукцинилдиптерокарпол (IX) с выходом 81% методом, разработанным для получения производных бетулина, который заключался в ацилировании 3β-гидроксидиптерокарпола (VIII) [17] янтарным ангидридом в течении 6 ч в присутствии DCC и DMAP (схема 2 ).
Схема 2 . Условия. i – янтарный ангидрид, DCC, CH2Cl2, DMAP, перемешивание 24 ч, 25°C.
Структура синтезированных соединений установлена методом ЯМР-спектроскопии. Спектры ЯМР отражали модификацию ацилатов (II)–(IV) по положениям структуры С3 и С28, о чем свидетельствовало изменение химических сдвигов указанных атомов и появление соответствующих сигналов никотиноильных фрагментов. Сигналы пиридинового кольца соединений (II)–(IV) проявлялись при δ 7.25–9.21 м.д. (ЯМР 1H) и при δ 122.8–153.4 м.д. (ЯМР 13C). Сигналы сложноэфирных связей обнаруживались в области δ 165.3–165.8 м.д. (ЯМР 13C). Об образовании С28-моноацилата судили по сигналам сложноэфирной связи при δ 165.3 м.д. и сигналу гидроксильной группы С3 при δ 78.0 м.д. В спектрe ЯМР 13С соединения (IX) наблюдались характерные сигналы ‒СH2–CH2– группы в области δ 29.1 и 29.4 м.д., а сигнал карбоксильной группы – при δ 171.8 м.д.
Задача фармакологических исследований соединений (II)–(IX) состояла в сравнении гепатопротекторной активности ранее изученных ацилатов бетулина (II), (III) [9, 10] с новым соединением – 28-изоникотиноатом бетулина (IV), а также оценить гепатопротекторную активность производных нативного диптерокарпола (V).
Гепатопротекторное действие соединений (II)–(IX) изучали на модели гепатитогепатоза, вызванного внутрибрюшинным введением крысам 50%-го масляного раствора тетрахлорметана. Результаты опытов представлены в табл. 1, 2.
Таблица 1.
Сравнительная характеристика гепатопротекторной активности производных бетулина (II)–(IV) (M ± s)
| Шифр соединения/ доза, мг/кг |
Эритроциты | Лейкоциты | Гемоглобин | Билирубин общий |
Глюкоза | Общий белок | АЛТ | АСТ | Коэффи-циент де Ритиса | ЩФ | Холестерин |
|---|---|---|---|---|---|---|---|---|---|---|---|
| ×1012/л | ×109/л | г/л | ммоль/л | ммоль/л | г/л | ед./л | ед./л | ед./л | моль/л | ||
| До начала исследований | |||||||||||
| СР | 5.84 ± 0.08 | 11.01 ± 0.12 | 112.18 ± 3.17 | 0.39 ± 0.07 | 8.76 ± 0.46 | 85.58 ± 2.36 | 55.68 ± 3.01 | 63.74 ± 3.36 | 1.15 ± 0.08 | 109.52 ± 2.85 | 2.14 ± 0.08 |
| Через 7 дней | |||||||||||
| Отрицательный контроль (плацебо) | 3.86 ± 0.14 | 8.21 ± 0.24 | 75.65 ± 3.72 | 1.83 ± 0.03 | 5.43 ± 0.19 | 69.45 ± 2.45 | 176.21 ± 14.02 | 132.50 ± 13.54 | 0.75 ± 0.02 | 19.35 ± 17.69 | 6.22 ± 0.08 |
| Положительный контроль /Карсил, 25 мг/кг) | 5.05 ± 0.05 | 10.8 ± 0.15 | 97.78 ± 1.52 | 0.71 ± 0.01 | 7.90 ± 0.07 | 78.73 ± 0.59 | 102.35 ± 1.2 | 129.98 ± 4.80 | 1.27 ± 0.03 | 130.44 ± 1.70 | 2.95 ± 0.04 |
| (II)/25 | 4.88 ± 0.10* | 9.57 ± 0.15* | 88.63 ± 1.96* | 1.17 ± 0.04* | 7.39 ± 0.09* | 75.06 ± 2.42* | 121.82 ± 8.27* | 155.69 ± 13.37* | 1.28 ± 0.02 | 142.45 ± 4.64* | 3.27 ± 0.05* |
| (II)/50 | 5.40 ± 0.08* | 10.76 ± 0.18 | 101.02 ± 4.03* | 0.56 ± 0.02* | 8.16 ± 0.16* | 80.84 ± 1.85* | 72.61 ± 13.08* | 86.31 ± 17.24* | 1.18 ± 0.02* | 112.61 ± 6.44* | 2.47 ± 0.14* |
| (II)/100 | 5.44 ± 0.05* | 10.84 ± 0.10 | 102.69 ± 2.33* | 0.56 ± 0.02* | 8.23 ± 0.09* | 81.61 ± 1.07* | 78.05 ± 7.55* | 93.24 ± 10.25* | 1.19 ± 0.02* | 115.29 ± 3.72* | 2.53 ± 0.08* |
| (III)/25 | 5.44 ± 0.04* | 10.85 ± 0.08 | 103.00 ± 1.80* | 0.57 ± 0.01* | 8.24 ± 0.07* | 81.75 ± 0.82* | 79.05 ± 5.84* | 94.65 ± 8.00* | 1.20 ± 0.01* | 115.78 ± 2.88* | 2.54 ± 0.06* |
| (III)/50 | 5.46 ± 0.03* | 10.88 ± 0.06 | 103.71 ± 1.43* | 0.57 ± 0.01 | 8.27 ± 0.06* | 82.07 ± 0.6* | 81.35 ± 4.63* | 97.79 ± 6.32* | 1.20 ± 0.01* | 116.91 ± 2.28* | 2.56 ± 0.05* |
| (III)/100 | 5.42 ± 0.10* | 10.80 ± 0.21 | 101.94 ± 4.83* | 0.56 ± 0.03* | 8.20 ± 0.19* | 81.26 ± 2.21* | 75.59 ± 15.67* | 90.21 ± 20.95* | 1.19 ± 0.03* | 114.08 ± 7.72* | 2.50 ± 0.16* |
| (IV)/25 | 4.80 ± 0.06* | 9.07 ± 0.15* | 83.93 ± 2.41* | 1.20 ± 0.03* | 7.45 ± 0.23* | 74.08 ± 1.83 | 120.55 ± 9.82* | 110.79 ± 14.35* | 0.92 ± 0.05* | 140.75 ± 3.60* | 2.94 ± 0.02* |
| (IV)/50 | 4.82 ± 0.03* | 9.14 ± 0.09* | 84.66 ± 1.94 | 1.22 ± 0.02* | 7.55 ± 0.13* | 74.84 ± 1.06 | 122.31 ± 8.47* | 114.98 ± 11.50 | 0.94 ± 0.03* | 140.13 ± 4.65* | 2.94 ± 0.03* |
| (IV)/100 | 4.83 ± 0.02* | 9.15 ± 0.06* | 84.91 ± 1.50 | 1.22 ± 0.02* | 7.56 ± 0.10* | 74.98 ± 0.82 | 123.43 ± 6.55* | 115.94 ± 9.05 | 0.94 ± 0.02* | 136.79 ± 8.06* | 2.92 ± 0.05* |
Таблица 2.
Сравнительная характеристика гепатопротекторной активности производных диптерокарпола (V)–(IX) (M ± s)
| Шифр соединения/ доза, мг/кг |
Эритро-циты | Лейкоциты | Гемоглобин | Билирубин общий |
Глюкоза | Общий белок | АЛТ | АСТ | Коэффи-циент де Ритиса |
ЩФ | Холестерин |
|---|---|---|---|---|---|---|---|---|---|---|---|
| ×1012/л | ×109/л | г/л | ммоль/л | ммоль/л | г/л | ед./л | ед./л | ед./л | моль/л | ||
| До начала исследований | |||||||||||
| СР | 5.84 ± 0.08 | 11.01 ± 0.12 | 112.18 ± 3.17 | 0.39 ± 0.07 | 8.76 ± 0.46 | 85.58 ± 2.36 | 55.68 ± 3.01 | 63.74 ± 3.36 | 1.15 ± 0.08 | 109.52 ± 2.85 | 2.14 ± 0.08 |
| Через 7 дней | |||||||||||
| Отрицательный контроль (плацебо) | 3.86 ± 0.14 | 8.21 ± 0.24 | 75.65 ± 3.72 | 1.83 ± 0.03 | 5.43 ± 0.19 | 69.45 ± 2.45 | 176.21 ± 14.02 | 132.50 ± 13.54 | 0.75 ± 0.02 | 19.35 ± 17.69 | 6.22 ± 0.08 |
| Положительный контроль (Карсил/25 мг/кг) | 5.05 ± 0.05 | 10.8 ± 0.15 | 97.78 ± 1.52 | 0.71 ± 0.01 | 7.90 ± 0.07 | 78.73 ± 0.59 | 102.35 ± 1.2 | 129.98 ± 4.80 | 1.27 ± 0.03 | 130.44 ± 1.70 | 2.95 ± 0.04 |
| (V)/25 | 4.28 ± 0.05* | 9.12 ± 0.07* | 81.94 ± 0.54* | 1.26 ± 0.02* | 6.89 ± 0.12* | 73.01 ± 1.20* | 121.78 ± 1.08* | 114.28 ± 3.24* | 0.94 ± 0.02* | 162.87 ± 7.23* | 3.85 ± 0.05* |
| (V)/50 | 4.61 ± 0.04* | 9.58 ± 0.08* | 85.77 ± 1.51* | 1.19 ± 0.01* | 7.10 ± 0.16* | 75.93 ± 1.60* | 115.53 ± 1.18* | 96.68 ± 3.58* | 0.84 ± 0.03* | 134.97 ± 7.23 | 3.35 ± 0.05* |
| (V)/100 | 4.63 ± 0.03* | 9.64 ± 0.03* | 87.10 ± 0.54* | 1.20 ± 0.01* | 7.24 ± 0.06* | 76.61 ± 1.20* | 114.04 ± 2.50* | 99.37 ± 3.25* | 0.87 ± 0.03* | 141.27 ± 2.56* | 3.29 ± 0.10* |
| (VI)/25 | 4.41 ± 0.04* | 8.59 ± 0.15* | 78.25 ± 2.92* | 1.28 ± 0.03* | 6.26 ± 0.13* | 72.95 ± 1.59* | 124.81 ± 8.21 | 98.68 ± 8.91* | 0.79 ± 0.03* | 149.46 ± 8.51* | 3.09 ± 0.11* |
| (VI)/50 | 4.41 ± 0.02* | 8.72 ± 0.12* | 78.88 ± 2.44* | 1.31 ± 0.02* | 6.37 ± 0.11* | 73.29 ± 1.34* | 116.38 ± 9.49* | 78.87 ± 36.12* | 0.68 ± 0.32* | 147.57 ± 9.51* | 3.00 ± 0.11 |
| (VI)/100 | 4.40 ± 0.04* | 8.63 ± 0.13* | 80.72 ± 2.34* | 1.28 ± 0.03* | 6.26 ± 0.12* | 72.99 ± 1.48* | 118.34 ± 8.57* | 93.99 ± 9.09* | 0.79 ± 0.03* | 149.53 ± 5.02* | 2.98 ± 0.12 |
| (VII)/25 | 4.39 ± 0.04* | 8.60 ± 0.14* | 78.32 ± 2.71* | 1.29 ± 0.03* | 6.29 ± 0.11* | 74.31 ± 1.28* | 116.15 ± 4.76* | 93.10 ± 5.08* | 0.80 ± 0.03* | 144.94 ± 10.07* | 2.97 ± 0.13 |
| (VII)/50 | 5.02 ± 0.09 | 10.02 ± 0.28 | 97.19 ± 2.89 | 0.70 ± 0.03 | 7.90 ± 0.12 | 78.60 ± 0.66 | 102.32 ± 0.64 | 129.84 ± 2.51 | 1.27 ± 0.02 | 130.48 ± 1.58 | 2.96 ± 0.04 |
| (VII)/100 | 5.04 ± 0.08 | 10.08 ± 0.25 | 97.76 ± 2.58 | 0.69 ± 0.03 | 7.87 ± 0.13 | 78.74 ± 0.35 | 102.75 ± 0.73 | 131.54 ± 2.88 | 1.28 ± 0.02 | 130.80 ± 1.42 | 2.95 ± 0.04 |
| (VIII)/25 | 4.41 ± 0.04* | 8.59 ± 0.15* | 78.25 ± 2.92* | 1.28 ± 0.03* | 6.26 ± 0.13* | 72.95 ± 1.59* | 124.81 ± 8.21 | 98.68 ± 8.91* | 0.79 ± 0.03* | 149.46 ± 8.51* | 3.09 ± 0.11* |
| (VIII)/50 | 4.81 ± 0.03* | 9.71 ± 0.26* | 87.90 ± 1.70* | 0.93 ± 0.01* | 7.16 ± 0.12* | 75.96 ± 1.56* | 128.35 ± 4.44* | 125.18 ± 5.63 | 0.97 ± 0.01* | 147.77 ± 5.77* | 2.97 ± 0.03 |
| (VIII)/100 | 5.00 ± 0.10 | 9.95 ± 0.30* | 96.39 ± 3.05 | 0.71 ± 0.03 | 7.84 ± 0.14 | 78.42 ± 0.70 | 102.69 ± 0.37 | 131.28 ± 1.46 | 1.28 ± 0.01 | 131.88 ± 1.37 | 2.99 ± 0.04 |
| (IX)/25 | 4.05 ± 0.12* | 8.55 ± 0.17* | 76.88 ± 2.91* | 1.62 ± 0.08* | 5.78 ± 0.14* | 71.61 ± 1.0* | 167.46 ± 6.39* | 125.56 ± 3.98 | 0.75 ± 0.01* | 186.61 ± 12.82* | 5.38 ± 0.15* |
| (IX)/50 | 4.08 ± 0.12* | 8.63 ± 0.08* | 77.63 ± 2.75* | 1.64 ± 0.04* | 5.81 ± 0.07* | 72.01 ± 1.44* | 164.95 ± 12.12* | 124.68 ± 11.42 | 0.75 ± 0.01* | 192.46 ± 6.39* | 5.41 ± 0.08* |
| (IX)/100 | 4.10 ± 0.06* | 8.63 ± 0.14* | 78.20 ± 1.45* | 1.64 ± 0.07* | 5.81 ± 0.12* | 72.30 ± 1.29* | 161.61 ± 12.82* | 122.21 ± 8.69 | 0.76 ± 0.01* | 192.37 ± 10.84* | 5.41 ± 0.13* |
Экспериментально установлено, что трехкратное (один раз в два дня) внутрибрюшинное введение 50%-го масляного раствора тетрахлорметана крысам из расчета 4 мл/кг живой массы тела без дополнительной фармакокоррекции (группа отрицательного контроля) приводит к развитию острого гепатитогепатоза, характеризующегося значительными изменениями морфологического и биохимического состава крови. Так, на седьмой день после первой инъекции тетрахлорметана в крови крыс группы отрицательного контроля отмечено выраженное увеличение уровня органоспецифических маркеров, представленных аланинаминотрансферазой, аспартатаминотрансферазой (АЛТ и АСТ) и щелочной фосфатазой, способных характеризовать цитолиз гепатоцитов [20]. Активность щелочной фосфатазы возросла на 78.37% (с 109.52 ± 2.85 ед./л в первый день до 195.35 ± 17.69 ед./л к седьмому дню исследований). Активность АЛТ и АСТ при этом увеличилась на 216.47 и 107.88% по сравнению с изначальными значениями, составлявшими 55.68 ± 3.01 и 63.74 ± 3.36 ед./л соответственно. Коэффициент де Ритиса [24] понизился до 0.75 ± 0.02 в сравнении с изначальным значением (1.15 ± 0.08), что также указывает на повышение гепато-цитолитических реакций, развивающихся в организме крыс группы “Отрицательный контроль”. Подтверждением гепатотоксического влияния CCl4 явилось также развитие холестатического синдрома, выразившегося в повышении уровня холестерина (в 2.9 раза) с 2.14 ± 0.08 до 6.22 ± ± 0.08 ммоль/л, и общего билирубина (в 4.69 раз) с 0.39 ± 0.01 до 1.83 ± 0.03 мкмоль/л. Одновременно с этим нами отмечено существенное нарушение глюкогенеза, отразившееся в понижении в 1.6 раза уровня глюкозы в сыворотке крови – с изначальных 8.76 ± 0.46 до 5.43 ммоль/л. Уровень общего белка в сыворотке крови крыс группы “Отрицательный контроль” понизился с 85.58 ± 2.36 до 69.45 ± 2.45 г/л, указывая, совокупно с предыдущими показателями, на нарушение белоксинтезирующей функции печени. Понижение числа эритроцитов с 5.84 ± 0.08 × 1012/л до 3.86 ± 0.14 × 1012/л, уровня гемоглобина с 112.18 ± 3.17 до 75.65 ± ± 3.72 г/л, а также числа лейкоцитов с 11.01 ± 0.12 × × 109/л до 8.21 ± 0.24 × 109/л, указывает как на ухудшение течения процессов гемопоэза, развивающегося на фоне гепатитогепатозного состояния, так и на явления общетоксического влияния тетрахлорметана, а также понижение осмотической резистентности клеток крови на фоне повышенного уровня общего билирубина.
Согласно полученным данным и с учетом предлагаемой нами фармакокоррекции, наиболее выраженные гепатозащитные свойства были выявлены при лечебно-профилактическом применении соединений (II), (III), (VIII) и препарата сравнения “Карсил” (положительный контроль). При этом выраженность гепатозащитных свойств соединения (II) в дозах 50 и 10 мг/кг, а также соединения (III) во всех испытуемых дозах, оказалась выше этих же свойств препарата “Карсил” в рекомендуемой дозе 25 мг/кг. Выраженность гепатопротекторных свойств соединения (VIII) в дозе 100 мг/кг, соединения (VI) в дозах 50 и 100 мг/кг была в достоверных пределах и сравнима с активностью препарата сравнения “Карсил” в дозе 25 мг/кг, а у остальных соединений гепатопротекторная активность была ниже.
Анализируя выраженность гепатозащитных свойств соединения (II) в дозе 100 мг/кг и соединения (III) в дозе 25 мг/кг, можно отметить, что активность органоспецифических ферментов АЛТ и АСТ, как и их соотношение, выраженное коэффициентом де Ритиса, не выходили за пределы допустимых референтных значений. При этом активность АСТ и АЛТ были соответственно на ~29.48 и ~37.33% ниже в сравнении с активностью этих же ферментов в крови крыс, получавших препарат “Карсил”. Уровень холестерина и билирубина в крови крыс, получавших соединение (II) в дозе 100 мг/кг и соединение (III) в дозе 25 мг/кг было на ~14.00 и ~24.56% ниже в сравнении с их уровнем в крови крыс, получавших препарат сравнения “Карсил” в тех же дозах. Гематологические исследования крови крыс при лечебно-профилактическом воздействии соединения (III) в дозе 25 мг/кг указали на более выраженное улучшение гемопоэза, глюкогенеза и белоксинтезирующей функции печени в сравнении с препаратом “Карсил”. Так, число эритроцитов, лейкоцитов и уровень гемоглобина в крови крыс, получавших соединения (II) в дозе 100 мг/кг и соединение (III) в дозе 25 мг/кг были соответственно на ~7.7, ~7.6 и ~5.3% выше аналогичных показателей в крови крыс положительного контроля и на столько же ниже, с учетом референтных значений, по сравнению со значениями морфологического и биохимического состава крови крыс до начала введения тетрахлорметана.
Активность соединения (II) в дозе 25 мг/кг; соединения (IV) в дозах 25, 50 и 100 мг/кг; соединения (VIII) в дозе 50 мг/кг с учетом анализа результатов морфологического и биохимического состава крови, оказалась на ~9.5–11.0% ниже активности препарата “Карсил” в дозе 25 мг/кг. Отметим, что повышение доз соединений (II), (V) и (VI) с 25 до 50 мг/кг, а также соединения (VIII) с 25 до 100 мг/кг способствует улучшению показателей крови, тем самым, повышая гепатопротекторный эффект. Повышение доз соединений (II), (V) и (VI) с 50 до 100 мг/кг, а также соединения (III) с 25 до 50 мг/кг не приводит к достоверному улучшению гематологических показателей. Морфологический и биохимический состав крови крыс опытных групп, получавших соединения (IV), (VII) и (IX), хотя и были лучше в сравнении с составом крови группы “Отрицательный контроль”, но не достигали значений группы “Положительный контроль” и не показывали положительной или отрицательной динамики при увеличении доз с 25 до 50 и 100 мг/кг.
Таким образом, с использованием дициклогексилкарбодиимидного метода синтезированы ранее описанные в литературе 3,28-бисникотинат и 3,28-бисизоникотинат бетулина, а также новые 28-моноизоникотинат бетулина и 3β-гемисукцинилдиптерокапрол. Показано, что бисацилаты бетулина (II), (III) превосходят по своей активности моноацилат (IV); 3β-гидроксидиптерокарпол (VIII) оказался наиболее активным в ряду изученных производных даммарановых тритерпеноидов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Температуры плавления определяли на микростолике “Boetius”. Оптическое вращение измеряли на поляриметре “Perkin-Elmer 241 MC” (Германия) в трубке длиной 1 дм. ТСХ-анализ проводили на пластинках Сорбфил (ЗАО Сорбполимер, Россия), используя систему растворителей хлороформ–этилацетат, 40 : 1. Вещества обнаруживали 10% раствором серной кислоты с последующим нагреванием при 100–120°С в течение 2–3 мин. Элементный анализ осуществляли на СHNS-анализаторе Eurо EA-3000, основной стандарт ацетанилид. Колоночную хроматографию проводили на Al2O3 (Реахим). Спектры ЯМР 2Н, 13С (δ, м.д.; J, Гц) зарегистрированы для растворов в CDCl3 на ЯМР-спектрометре высокого разрешения “Bruker” AvanceIII с рабочей частотой 500.13 МГц (1H) и 125.47 МГц (13C) с использованием 5-мм датчика с Z-градиентом PABBO при постоянной температуре образца 298 K. Химические сдвиги приведены в миллионных долях относительно сигнала внутреннего стандарта тетраметилсилана. Спектры 1H-, 13C-ЯМР соединений получены с использованием оборудования Центра коллективного пользования “Химия” УфИХ УФИЦ РАН.
Бетулин (I) и диптерокарпол (V) выделяли из Betula pendula и Dipterocarpus alatus в соответствии c работами [18, 19]. Соединения (VI) [16], (VII), (VIII) [17] синтезировали, как описано ранее.
Синтез соединений (II), (III) (IX). К раствору 1 ммоль (0.44 г) соединения (I) или (0.42 г) соединения (V) в 20 мл CH2Cl2 и 2 ммоль (0.42 г) DCC добавляли 2.6 ммоль (0.36 г) никотиновой кислоты (в синтезе (II)) или 2.5 ммоль (0.36 г) изоникотиновой кислоты (в синтезе (III)), 1.3 ммоль (0.13 г) янтарного ангидрида (в синтезе (IX)) и каталитическое количество DMAP, реакционную массу перемешивали 24 ч при 22°С, отфильтровывали, промывали водой (3 × 20 мл), сушили над MgSO4, растворитель упаривали в вакууме. Продукт реакции выделяли кристаллизацией из этанола.
3β,28-Ди-О-никотинат бетулина (II). Выход 0.59 г (95%). $[\alpha ]_{D}^{{20}}$ +12° (с 0.1, CHCl3). Т. пл. 119°C, Т. пл. 116–118°C [14], спектральные характеристики соответствуют [14].
3β,28-Ди-О-изоникотинат бетулина (III). Выход 0.58 г (93%). $[\alpha ]_{D}^{{20}}$ +37° (с 0.1, CHCl3). Т. пл. 121°C. Т. пл. 119°C [10], спектральные характеристики соответствуют [10].
3β-O-Гемисукцинилдиптерокарпол (IX). Выход 0.43 г (81%). Т. пл. 103–105 °С. $[\alpha ]_{D}^{{20}}$ +35° (c 0.01, CHCl3). Найдено C 74.58; H 10.15. C34H56O5. Вычислено C 74.96, H 10.36. (Mr 544.81). Спектр 1H-ЯМР: 0.82, 0.89, 0.85, 0.95, 1.12, 1.14 (18Н, 6с, 6СН3), 1.10–1.80 (25Н, м, СН2, СН), 2.53–2.71 (8H, м, СH, CH2), 2.67 (4Н, т, ООССН2СН2СООН, J 7.2, J 7.5, Н1', H2'), 5.12 (1H, уш.с, Н24). Спектр 13С-ЯМР: 15.5, 16.3, 16.5, 17.7, 18.1, 21.6, 22.6, 23.6, 24.8, 25.3, 25.7, 27.5, 27.9, 29.1 и 29.4 (‒СН2–СН2–), 31.2, 35.2, 37.0, 37.8, 38.7, 40.4, 40.5, 42.3, 49.8, 50.0, 50.6, 55.9, 64.6, 81.5, 124.7, 128.3, 131.5, 171.8 (СOOH), 177.3 (–О–С=О).
3β-Гидрокси-28-О-изоникотиноиллупа-20(29)-ен (IV). К раствору 1 ммоль (0.44 г) бетулина (I) в 20 мл CH2Cl2 и 1 ммоль (0.21 г) DCC добавляли 1.3 ммоль (0.18 г) изоникотиновой кислоты, каталитическое количество DMAP, реакционную массу перемешивали 6 ч при 5°C. Осадок отфильтровывали, органический слой промывали водой (3 × 20 мл), сушили CaCl2, растворитель упаривали в вакууме. Продукт реакции перекристаллизовывали из EtOH. Выход 0.53 г (90%). Т. пл. 118°C. $[\alpha ]_{D}^{{20}}$ +21° (с 0.1, CHCl3). Найдено C 77.67; H 8.89; N 2.01. C36H53N3O. Вычислено C 78.93; H 9.75; N 2.58. (Мr 547.81). Спектр 1H-ЯМР: 0.80, 0.81, 0.83, 0.97, 1.03 (15Н, 5с, 5СН3), 1.10–2.00 (26Н, м, СН2, СН), 1.67 (3Н, с, СН3), 4.09 и 4.54 (2Н, оба д, J 11.0, Н28), 4.49 (1Н, дд, J 5.4, J 9.6, Н3), 4.58 и 4.69 (2Н, оба уш сигнала, Н29), 7.36 (1Н, дд, J 3.0, J 4.9, H3'), 8.27 (1Н, ддд, J 4.9, J 1.8, J 1.9, Н4'), 8.74 (1Н, дд, J 1.6, J 4.8, Н2'), 9.21 (1Н, д, J 1.7, Н1'). Спектр 13C-ЯМР: 14.8, 16.0, 16.1, 16.5, 28.2, 20.8, 21.2, 23.7, 25.2, 27.1, 27.9, 29.6, 29.9, 34.2, 34.6, 37.1, 37.7, 37.8, 38.4, 40.9, 42.8, 46.7, 47.8, 48.9, 50.3, 55.4, 63.8, 78.0, 110.0, 123.2, 126.3, 136.9, 150.9, 153.4, 149.8, 165.3 (–О–С=О).
Гепатопротекторная активность
Гепатопротекторные свойства соединениий (II)–(IX) изучены на модели гепатитогепатоза, вызванного экспериментально внутрибрюшинным введением 50%-го масляного раствора тетрахлорметана у 182 крыс по принципу аналогов, распределенных на 26 групп [20]. Экспериментальные животные содержались в одинаковых зоогигиенических условиях вивария, соответствующих требованиям СанПИН № 1045-73 “Санитарные правила по устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)” [21], а также ГОСТ Р 53434-2009 “Принципы надлежащей лабораторной практики” [22], соответствующего международным стандартам GLP. Рацион лабораторных животных состоял из сбалансированного по питательности, витаминам и минеральным веществам, гранулированного корма “ПроКорм”, соответствующего ГОСТ Р 50258-92 “Комбикорма полнорационные для лабораторных животных” [23].
Гематологические исследования крови крыс опытных и контрольных групп осуществляли с использованием автоматического гематологического анализатора Abacus Junior 5 Vet (Diatron Messtechnik GmbH). Мониторинг изменений в основных биохимических показателях крови лабораторных животных осуществляли с помощью полуавтоматического биохимического анализатора (Stat Fax 1904 Plus (Awarenes Technology Inc.) и стандартизированных наборов реактивов “Витал Диагностика СПб”: гемоглобин – колориметрическим гемоглобин цианидным методом (инкубация 20 мин при температуре 20°C, λ 545 нм, длина оптического пути 10 мм, нижняя граница линейности 50 г/л, верхняя граница линейности 300 г/л в сравнении с холостой и калиброванной пробой гемоглобина 130 г/л); билирубин общий – методом Энраксика-Грофа (инкубация 20 мин при температуре 20°C, λ 545 нм, длина оптического пути 10 мм, нижняя граница линейности 8 мкмоль/л, верхняя граница линейности 410 мкмоль/л в сравнении с холостой и калиброванной пробой билирубина 171 мкмоль/л); глюкозу – энзиматическим колориметрическим методом (инкубация 10 мин при температуре 37°C, при λ 505 нм, длина оптического пути 10 мм, нижняя граница линейности 1 ммоль/л, верхняя – 30 ммоль/л в сравнении с холостой и калиброванной пробой глюкозы 10 ммоль/л); общий белок – биуретовым методом (инкубация 30 мин при температуре 20°C, λ 545 нм, длина оптического пути 10 мм, нижняя граница линейности 0 г/л, верхняя граница линейности 120 г/л в сравнении с холостой и калиброванной пробой белка крови 70г/л); АЛТ и АСТ– ферментативным кинетическим методом (без инкубации при температуре 37°C, λ 340 нм, длина оптического пути 10 мм, лаг-фаза 90 с, время считывания 60 с, фактор = –1746, против холостой пробы); щелочную фосфатазу оптимизированным кинетическим методом (без инкубации при температуре 20°C, λ = 405 нм, длина оптического пути 10 мм, лаг-фаза 30 с, время считывания 30 с, фактор = 2764, нижняя граница линейности 0 ед./л, против холостой пробы); холестерин – энзиматическим колориметрическим методом (инкубация 5 мин при температуре 20°C, λ 500 нм, длина оптического пути 10 мм, нижняя граница линейности 0.5 ммоль/л, верхняя граница линейности 25.8 ммоль/л, в сравнении с холостой и калиброванной пробой холестерина сыворотки крови 5.17 ммоль/л); коэффициент де-Ритиса [20] определяли расчетным методом как соотношение активности сывороточных аспартатамино- и аланинаминотрансфераз.
Статистическую обработку цифрового материала, полученного в экспериментах, проводили с использованием стандартного пакета статистической обработки данных прикладной программы MS Excel©, включающую подсчет средних величин (М), и стандартного отклонения (s) c учетом среднеквадратических отклонений выборки (δ). Для определения статистической значимости различий использовали t-критерий Стьюдента.
Список литературы
Kumada H. // Oncology. 2002. V. 62. P. 94–100.
Shibata S. // Yakugaku Zasshi. 2000. V. 120. P. 849–862.
Liu J. // J. Ethnopharmacol. 2005. V. 100. P. 92–94.
Арчаков А.И., Сельцовский А.П., Лисов В.И., Цыганов Д.И., Княжев В.А., Ипатова О.М., Торховская Т.И. // Вопросы медицинской химии. 2002. Т. 48. С. 139–153. (Archakov A.I., Sel’tsovskii A.P., Lisov V.I., Tsyganov D.I., Kniazhev V.A., Ipatova O.M, Torkhovskaia T.I. // Vopr. Med. Khim. 2002. V. 48. P. 139–153).
Толстиков Г.А., Балтина Л.А., Сердюк Н.Г. // Хим.-фарм. ж. 1998. Т. 32. С. 5–14. (Tolstikov G.A., Baltina L.A., Serdyuk N.G. // Pharm. Chem. J. 1998. V. 32. P. 402–412).
Tung N.H., Uto T., Morinaga O., Kim Y.H., Shoyama Y. // Evidence-Based Complementary and Alternative Medicine V. 2012. ID 173297.
Xu G.-B., Xiao Y.-H., Zhang Q.-Y., Zhou M., Liao S.-G. // Europ. J. Med. Chem. 2018. V. 145. P. 691–716.
Patel H., Desai S., Krishnamurthy R. // Res. Rev. BioSci. 2015. V. 10. P. 323–328.
Карачурина Л.Т. Биохимические механизмы гепатопротекторного действия тритерпеноидов группы лупана и их фармакологическая активность. автореферат дис. … канд. биол. наук. Уфа: Институт органической химии, 2004. 24 с.
Казакова О.Б., Лопатина Т.В., Смирнова И.Е., Чудов И.В., Шарипов А.Р., Исмагилова А.Ф. // Патент RU2538212 C1 от 10.01.2015.
Белецкая И.П., Кустов Л.М. // Рос. хим. ж. 2004. Т. XLVIII. № 6. С. 3–12.
Флехтер О.Б., Карачурина Л.Т., Поройков В.В., Нигматуллина Л.Р., Балтина Л.А., Зарудий Ф.С., Давыдова В.А., Спирихин Л.В., Байкова И.П., Галин Ф.З., Толстиков Г.А. // Биоорган. химия. 2000. Т. 26. № 3. С. 215–223. (Flekhter O.B., Karachurina L.T., Poroikov V.V., Nigmatullina L.P., Baltina L.A., Zarudii F.S., Davydova V.A., Spirikhin L.V., Baikova I.P., Galin F.Z., Tolstikov G.A. // Russ. J. Bioorg. Chem. 2000. V. 26. № 3. P. 215–223).
Флехтер О.Б., Медведева Н.И., Карачурина Л.Т., Балтина Л.А., Галин Ф.З., Зарудий Ф.С., Толстиков Г.А. // Хим.-фарм. журнал. 2005. Т. 39. № 8. С. 9–12. (Flekhter O.B., Medvedeva N.I., Karachurina L.T., Baltina L.A., Galin F.Z., Zarudii F.S., Tolstikov G.A. // Pharmaceutical Chemistry Journal. 2005. V. 39. P. 401–404).
Флехтер О.Б., Карачурина Л.Т., Нигматуллина Л. Р., Сапожникова Т.А., Балтина Л.А., Зарудий Ф.С., Галин Ф.З., Спирихин Л.В., Толстиков Г.А., Плясунова О.А., Покровский А.Г. // Биоорган. химия. 2002. V. 28. С. 543–550. (Flekhter O.B., Karachurina L.T., Nigmatullina L.R., Sapozhnikova T.A., Baltina L.A., Zarudii F.S., Galin F.Z., Spirikhin LV., Tolstikov G.A., Plyasunova O.A., Pokrovskii A.G. // Russ. J. Bioorg. Chem. 2002. V. 28. P. 494–500).
Флехтер О.Б., Карачурина Л.Т., Поройков В.В., Нигматуллина Л.Р., Балтина Л.А., Зарудий Ф.С., Давыдова И.А., Спирихин Л.В., Байкова И.П., Галин Ф.З., Толстиков Г.А. // Биоорган. химия. 2000. V. 26. С. 215–223. (Flekhter O.B., Karachurina L.T., Poroikov V.V., Nigmatullina L.R., Baltina L.A., Zarudii F.S., Davydova V.A., Spirikhin L.V., Baikova I.P., Galin F.Z., Tolstikov G.A. // Russ. J. Bioorg. Chem. 2000. V. 26. P. 215–223).
Смирнова И.Е., Do Thi Thu H., Казакова О.Б., Толстиков Г.А., Куковинец О.С., Лобов А.Н., Супониций К.Ю. // Ж. орган. химии. 2012. Т. 48. С. 1374–1379. (Smirnova I.E., Do Thi Thu H, Kazakova O.B., Tolstikov G.A., Kukovinets O.S., Lobov A.N., Suponitskii K.Yu. // Russ. J. Оrg. Chem. 2012. V. 48. P. 1370–1376).
Do Thi Thu Huong, Tran Thi Thu Thuy, Tran Thi Hien, Nguyen Thanh Tra, Nguyen Quyet Tien, Смирнова И.Е., Казакова О.Б., Миннибаева Э.М., Толстиков Г.А. // Химия природн.соедин. 2013. Т. 49. № 1. С. 58–65. (Do Thi Thu Huong, Tran Thi Thu Thuy, Tran Thi Hien, Nguyen Thanh Tra, Nguyen Quyet Tien, Smirnova I.E., Kazakova O.B., Minnibaeva E.M., Tolstikov G.A. // Chem. Nat. Comp. 2013. V. 49. № 1. P. 51–57).
Флехтер О.Б., Балтина Л.А., Спирихин Л.В., Байкова И.П., Толстиков Г.А. // Изв. РАН. Сер. хим. 1998. Т. 47. С. 531–534.
Tran L.Q., Tran K.Q. // J. Chem. 1998. V. 36. P. 8.
Хабриев Р.У. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М.: Медицина, 2005. С. 683–695.
Санитарные правила по устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев). СНИП 1045-73, утв. 06.04.1973. М.: Госстандарт, 2011. 15 с.
Принципы надлежащей лабораторной практики: ГОСТ Р 53434-2009. Введ. 2009-12-09. М.: Стандартинформ, 2009. 12 с.
Комбикорма полнорационные для лабораторных животных. Технические условия: ГОСТ Р 50258-92. Введ. 1994-01-01. М.: Госстандарт России, 1994. 8 с.
Бабак О.Я. Клиническое значение и диагностическая тактика при повышении уровня трансаминаз в сыворотке крови при отсутствии клинических проявлений // Искусство лечения. Мистецтво лікування. 2006. Вып. № 8(34). С. 1–15.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия