Биоорганическая химия, 2020, T. 46, № 1, стр. 47-55
Применение моноклональных антител и технологии фагового дисплея для анализа белка YB-1
А. Г. Ламан *, А. О. Шепеляковская *, Ф. А. Бровко *, С. В. Сизова *, М. В. Артемьев **, В. А. Олейников *
* Институт биоорганической химии им. акад. М.М. Шемякина и Ю.А. Овчинникова РАН, Россия, 117997, ГСП, Москва, В-437, ул. Миклухо-Маклая 16/10
** НИИ физико-химических проблем Белорусского государственного университета, Беларусь, 220030, Минск, ул. Ленинградская 14
Поступила в редакцию 28.07.2019
После доработки 19.08.2019
Принята к публикации 11.09.2019
Аннотация
Получены и охарактеризованы моноклональные антитела против рекомбинантного белка YB-1. Полученные антитела специфично выявляют белок YB-1 в твердофазном иммуноферментном анализе, вестерн-блотт-анализе и иммуноцитохимии. С применением технологии фагового дисплея найден пептид, взаимодействующий с белком YB-1. На основе моноклональных антител МАYB-1-2 и пептида в составе структурного белка бактериофага разработана тест-система для количественного определения белка YB-1 в сыворотке крови. Предел детекции разработанной тест-системы составляет 0.3 нг/мл.
ВВЕДЕНИЕ
Мультифункциональный белок YB-1 (Y-бокс-связывающий белок) входит в обширное семейство белков, содержащих эволюционно консервативный домен холодового шока. Впервые белки этого семейства были описаны как ДНК-связывающие белки, взаимодействующие с Y-бокс-мотивом промоторных участков генов главного комплекса гистосовместимости второго класса [1]. С точки зрения функциональности – это ДНК- и РНК-связывающий белок, который проявляет свойства шаперона нуклеиновых кислот, а также взаимодействует с большим количеством других белков. Связываясь с нуклеиновыми кислотами, YB-1 принимает участие практически во всех ДНК- и мРНК-зависимых процессах, включая репликацию и репарацию ДНК, транскрипцию, сплайсинг и трансляцию мРНК, реконструкцию хроматина, также он осуществляет глобальную и специфическую регуляцию экспрессии генов на разных уровнях [2–5].
YB-1 человека состоит из 324 а.о., среди которых преобладают Arg (11.7%), Gly (12.0%), Pro (11.0%) и Glu (8.3%). Рассчитанная по аминокислотной последовательности молекулярная масса белка равна ~35.9 кДа, однако при SDS-гель-электрофорезе YB-1 мигрирует как белок с массой около 50 кДа, то есть ведет себя аномально. Характерной особенностью YB-1 является очень высокая изоэлектрическая точка – около 9.5 [6]. Известно, что YB-1 подвергается фосфорилированию [7–10], ограниченному протеолизу 20S-протеасомой, убиквитинилированию [11] и ацетилированию [12].
Белок YB-1 регулирует транскрипцию и трансляцию многих генов, участвующих в клеточном делении и дифференцировке [13]. В процессе регуляции экспрессии генов YB-1 взаимодействует с другими транскрипционными факторами и коактиваторами, а именно, с р53 [14], YY1 [15], CBP/p300 [16], Smad3 и АР-1 [17]. В N-концевой области белка YB-1 имеется фрагмент, который обеспечивает белок-белковые взаимодействия с гетерогенными рибонуклеопротеинами (hnRNP) [18] и белком сплайсинга SRp30c [19]. В ответ на клеточные стрессовые сигналы, в том числе на понижение температуры, воздействие ДНК-модифицирующих препаратов, активных форм кислорода и УФ-облучение, YB-1 изменяет свою внутриклеточную локализацию: из цитоплазмы он перемещается в ядро, где участвует в регуляции экспрессии генов. YB-1 опосредует про-митогенную реакцию, положительно воздействуя на развитие эмбриона [20], однако в процессе онкогенеза про-митогенная реакция оказывает отрицательное воздействие на организм, так как способствует разрастанию опухоли и ее метастазированию [21–23].
Экспрессия самого YB-1 активно регулируется в ходе воспалительных заболеваний и инфекций [24]. В экспериментальной мышиной модели уровень экспрессии белка YB-1 в активированных лейкоцитах увеличивался в ответ на введение эндотоксина, а в активированных эозинофилах – после воздействия аллергена. Подобно таким воспалительным медиаторам, как IL-1, тиоредоксин-1 и фактор роста фибробластов, YB-1 реализует неклассической путь секреции [25]. Внеклеточный белок YB-1 обладает хемотаксическими и митогенными свойствами [26]. Показано участие белка YB-1 в отрицательной регуляции ряда генов, вовлеченных в протекание воспалительных реакций, в частности, гена фактора роста эндотелия сосудов [27], гена рецептора тиротропина [28], генов главного комплекса гистосовместимости класса II [29] и хемокина CCL5 [30–32].
Повышение концентрации YB-1 в цитоплазме препятствует онкогенной трансформации клеток по PI3K/Akt-киназному сигнальному пути, и, вместе с тем, оно может способствовать превращению дифференцированных эпителиальных клеток в мезенхимальные, обладающие повышенной миграционной активностью [33, 34]. Это благоприятствует распространению клеток по организму и метастазированию опухолей. Таким образом, YB-1 может служить в качестве маркера метастазирования раковых опухолей в отдаленные органы. Белок YB-1 снижает чувствительность клеток к химиопрепаратам разных классов, применяемым при лечении раковых заболеваний [35–37]. Механизм этого процесса до конца не ясен. Предполагается, что его действие либо осуществляется через белки, обеспечивающие множественную лекарственную устойчивость, либо он сам принимает непосредственное участие в репарации ДНК. Известно, что вероятность излечения различных видов рака без рецидивов после химиотерапии ниже, если YB-1 был оверэкспрессирован в опухоли и/или он локализован в ядре [38].
Наши последние исследования продемонстрировали исключительную важность белка YB-1 в развитии и регуляции реакций врожденного иммунитета [39–41]. Описанные в литературе свойства YB-1 и полученные нами данные делают его возможным кандидатом на роль белка посредника между эффекторными молекулами и NOD2 – одним из внутриклеточных рецепторов патогенассоциированных молекулярных паттеронов в процессе развития реакций врожденного иммунного ответа.
Такое многообразие выполняемых функций и чрезвычайная эволюционная консервативность белка [42] делает его приоритетным объектом исследований в области молекулярной, физико-химической и медицинской биологии. В связи с этим, актуальной является задача создания высокочувствительной тест-системы для количественного анализа белка YB-1 в различных биологических средах.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Моноклональные антитела против YB-1 (МАYB-1)
В качестве иммуногена при получении моноклональных антител был использован рекомбинантный белок YB-1, любезно предоставленный Л.П. Овчинниковым (институт белка РАН). Для получения иммунного ответа было сделано четыре инъекции мышам линии Balb/c препаратом белка в различных дозировках. Первую инъекцию проводили совместно с полным адъювантом Фрейнда (FCA), две последующие – с неполным адъювантом Фрейнда (FIA). После третьей инъекции анализировали иммунореактивность сывороток методами непрямого твердофазного иммуноферментного анализа и вестерн-блотт-анализа. По данным этих анализов было выбрано животное с наилучшим иммунным ответом, с титром сыворотки 1 : 32 000.
При проведении твердофазного иммуноферментного анализа нами были оптимизированы условия сорбирования белка YB-1 на иммунопланшет. Известно, что при физиологических значениях концентрации солей белок YB-1 в очищенном состоянии склонен к образованию агрегатов, что отрицательно сказывается на результатах его иммунохимического выявления, а именно – сокращается разница между фоновым и специфическим взаимодействием белка с антителами. Нами было обнаружено, что добавление к буферу для сорбирования антигена NaCl до концентрации 0.5 М существенно улучшает соотношение сигнал-фон при иммунохимическом выявлении белка YB-1.
В результате гибридизации лимфоцитов из иммунизированной мыши с клетками плазмоцитомы Sp2/0 было получено восемь клонов гибридом, продуцирующих антитела к белку YB-1. Все гибридомы были дважды реклонированы методом предельных разведений. Для препаративного выделения моноклональных антител в чистом виде гибридомы выращивали в виде асцитных опухолей мышей. Предварительную оценку содержания иммуноглобулинов в асцитных жидкостях делали путем определения их титров методом непрямого твердофазного ИФА, который был на уровне 1 : 500 000–1 : 1 000 000.
Полученные гибридомы продуцировали моноклональные антитела, принадлежащие к классу иммуноглобулинов G подклассов G2a и G2b и имеющие легкие цепи κ-типа. Определение констант аффинности проводили по методу Бити [43] и рассчитывали по формуле: Kaff = 1/(2(2[mAb'] – ‒ [mAb])), где [mAb] – концентрация антитела, соответствующая точке перегиба на кривой титрования при концентрации антигена [YB-1]0, равной 0.5 мкг/мл, [mAb'] – концентрация антитела, соответствующая точке перегиба на кривой титрования при концентрации антигена [YB-1]0/2, равной 0.25 мкг/мл. На рис. 1 представлены графики титрования для МАYB-1-2.
Для определения специфичности полученных моноклональных антител проводили вестерн-иммуноблотт-анализ суммарных лизатов, полученных из клеточной линии J774. Результат анализа представлен на рис. 2.
Рис. 2.
Вестерн-иммуноблотт-анализ суммарных лизатов, полученных из клеточной линии J774. Электрофорез в 12% ПААГ в восстанавливающих условиях. Обработка реплик МАYB-1-2 и антимышиными антителами, конъюгированными с пероксидазой хрена. Выявление иммунных комплексов с помощью набора иммунохемилюминесцентного анализа (Pierce ECL Western Blotting Substrate, Thermo Fisher Scientific).
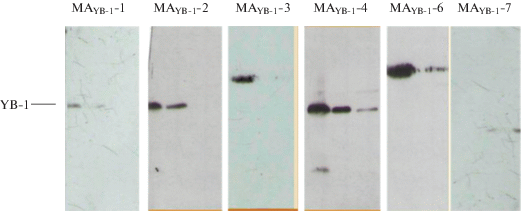
Оказалось, что наиболее специфично белок YB-1 узнают МАYB-1-1, -2 и -4. На автографе видно, что эти антитела выявляют полосу, соответствующую размеру белка YB-1. МАYB-1-3 и МАYB-1-6 выявляли полосу, соответствующую белку большей молекулярной массы, чем YB-1, возможно, эпитопы для этих антител имеют сходное строение с участками неких других белков.
Выявление белка YB-1 в клетках методом флуоресцентной микроскопии
В экспериментах по иммунофлуоресцентному выявлению белка YB-1 использовали клетки моноцитарного ряда линии J774, которые культивировали во флаконах в среде DMEM High glucose с 10% эмбриональной телячьей сыворотки. Поскольку белок YB-1 локализован внутри клеток, перед окрашиванием необходимо было провести процедуры фиксации и пермеабилизации цитоплазматической мембраны. Выбор моноклональных антител для проведения этой работы основывался на данных об их специфичности, полученных в результате вестерн-иммуноблотт-анализа суммарных лизатов клеток. Моноклональные антитела МАYB-1-2 были конъюгированы с флуоресцеин изотиоцианатом (FITC) и использовались для визуализации белка YB-1 в концентрации 1 мкг/мл. Для визуализации ядер применяли флуоресцентный краситель, имеющий специфическое сродство к ДНК Hoechst 33258. На рис. 3 представлена микрофотография клеток, окрашенных при помощи FITC-МАYB-1-2. Из рисунка видно, что белок YB-1 в большом количестве локализован в цитоплазме клеток.
Получение мини-антител в формате одноцепочечных вариабельных фрагментов scFv против белка YB-1
Для получения scFv-фрагментов против белка YB-1 было проведено два раунда аффинного обогащения комбинаторной библиотеки scFv-фрагментов человека в формате фагового дисплея. В работе была использована библиотека с репертуаром 109, полученная ранее в нашей лаборатории [44]. Было проведено три раунда аффинной селекции, после которых специфичными бактериофагами заражали культуру E. coli, клетки рассевали с плотностью 300 колоний на чашку Петри диаметром 85 мм. Колонии были протестированы на предмет продукции scFv-фрагментов, специфичных к YB-1, экспонируемых в составе структурного белка pIII бактериофага M13. Для данного иммуноанализа YB-1 сорбировали в лунки иммунопланшета из раствора с концентрацией 1 мкг/мл, после инкубации с клеточными супернатантами связывание с антигеном выявляли при помощи кроличьих антител против бактериофагов M13, конъюгированных с пероксидазой хрена. Было отобрано 10 клонов, однако последующий анализ последовательностей ДНК этих клонов показал, что все они идентичны. Полученные в результате проведенной работы scFv-фрагменты были использованы для выявления белка YB-1 методом вестерн-иммуноблоттинга (рис. 4).
Рис. 4.
Вестерн-иммуноблотт-анализ очищенного рекомбинантного белка YB-1 (1) и суммарного лизата клеток линии Sp2/0 (2). Электрофорез в 12% ПААГ в восстанавливающих условиях. Обработка реплик специфичными к YB-1 scFv-фрагментами в составе бактериофагов и кроличьими антителами против бактериофага M13, конъюгированными с пероксидазой хрена. Окрашивание иммунных комплексов раствором, содержащим 3 мг диаминобензидина (DAB) и 10 мкл 30% перекиси водорода в 10 мл 0.1 М Tрис-HCl, рН 7.6.

На рисунке видно, что полученные мини-антитела в формате одноцепочечных вариабельных фрагментов scFv хорошо выявляют рекомбинантный белок YB-1, в препарате клеточного лизата обнаруживаются три близко расположенные полосы, которые, по нашим предположениям, могут соответствовать YB-1 в разных вариантах модификации (фосфорилирования), а также полоса, соответствующая размеру полипептида 30 кДа. Поскольку у нас нет полной уверенности, имеет ли данный полипептид отношение к каким-либо формам YB-1, полученные scFv нежелательно использовать для определения внутриклеточной локализации белка.
Селекция специфичных к YB-1 клонов из библиотеки двенадцатичленных пептидов и создание тест-системы для определения YB-1 в сыворотке крови
Белок YB-1 способен секретироваться клетками в окружающую среду, поэтому для исследования его роли в конкретных биохимических процессах полезно иметь инструмент для количественного определения этого белка в различных биологических жидкостях (например, в сыворотке крови). Таким инструментом может быть тест-система в формате сэндвич-иммуноанализа. Мы проверили все полученные нами моноклональные антитела и их комбинации с scFv на способность образовывать сэндвич-пары, однако таких пар не было найдено. Мы решили создать тест-систему в формате сэндвич-иммуноанализа, в которой в качестве антител захвата используются МАYB-1-2, наиболее аффинные и специфичные из полученных нами моноклональных антител, а в качестве детектирующего компонента – бактериофаг, содержащий в составе одного из структурных белков пептид, взаимодействующий с неперекрывающимся участком белка YB-1 (рис. 5). Для поиска такого пептида мы использовали комбинаторную библиотеку двенадцатичленных пептидов в формате фагового дисплея.
Рис. 5.
Принципиальная схема, лежащая в основе обнаружения и количественного анализа белка YB-1. Моноклональные антитела МYB-1-2 (а) сорбировали на поверхность иммунопланшета, содержащийся в растворе белок YB-1 (б) связывался с антителами, затем в лунки иммунопланшета вносили отобранные бактериофаги, экспонирующие двенадцатичленный пептид (в), специфичный к другому участку белка YB-1. Сформированный комплекс выявляли с помощью антимышиных антител (г), конъюгированных с пероксидазой хрена (д).

Моноклональные антитела были иммобилизованы на иммунопланшете, после чего был добавлен YB-1. Образовавшийся комплекс являлся мишенью для аффинной селекции с использованием библиотеки додекапептидов, экспрессированных на поверхности бактериофага М13 (New England Biolab). После 3 раундов аффинной селекции, проведенной в соответствии с рекомендациями производителя библиотеки, было проанализировано 25 клонов бактериофагов методом непрямого иммуноферментного анализа. Четыре из них показали наибольший сигнал по отношению к YB-1 и не проявляли перекрестного взаимодействия с МАYB-1-2. Секвенирование ДНК этих бактериофагов показало, что все они содержали в N-концевой области белка pIII пептид следующей структуры: HLTHPHFSKSKS. Использование этих бактериофагов в варианте сэндвич-иммуноферментного анализа в системе антитела МАYB-1-2–белок YB-1–фаговые частицы– анти-М13-конъюгат с пероксидазой хрена и детекции с помощью орто-фенилендиамина позволяет выявлять YB-1 в концентрации вплоть до 300 пг/мл (рис. 6). Для построения концентрационной зависимости были использованы растворы YB-1 в 1% сухом молоке и буфер PBS-T.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. В работе использовали среду Игла в модификации Дульбекко (DMEM), фетальную телячью сыворотку (FCS), глутамин, раствор гипоксантин–аминоптерин–тимидин (HAT) – (Gibco-Invitrogen, США); неполный адъювант Фрейнда, пристан, бычий сывороточный альбумин (BSA), DMSO, орто-фенилендиамин, Tвин-20, полиакриламид – Amresco (США); нитроцеллюлозную мембрану ВА-85 – Schleicher & Schuell (Германия); и Bind Silane – GE-Healthcare (США); конъюгат кроличьих антител с пероксидазой хрена, тип Goat Anti-Mouse-HRP ThermoFisher Scientific; набор для изотипирования иммуноглобулинов (mouse immunoglobulin isotyping ELISA kit) – BD; Biosciences Pharmingen (США); культуральный пластик и планшеты для ИФА (Costar, США). Рентгеновскую пленку CL-XPosure Film (Thermo scientific); набор для иммунохепилюминесцентного анализа (Pierce ECL Western Blotting Substrate – Thermo Fisher Scientific). Остальные химические реактивы получены из коммерческих источников и использованы без предварительной очистки. Растворы готовили на деионизованной воде MilliQ.
Иммунизация. Для иммунизации использовали самок мышей инбредной линии BALB/c в возрасте 7–8 недель. Иммуноген вводили мышам в трех дозировках: 5, 10 и 20 мкг/животное. Каждая дозировка применялась в двух повторностях. Антиген разводили в 100 мкл фосфатно-солевого буфера (PBS) и смешивали с 100 мкл FCA до получения однородной эмульсии. Полученный препарат вводили подкожно в подушечки задних лап. Вторую и третью инъекции проводили аналогично, с интервалом 10 дней, но использовали FIA. Через 3 дня после второй и третьей иммунизации у животных брали кровь для анализа иммунного ответа. Последнюю инъекцию (бустирование) делали без адъюванта. Через четыре дня животные, у которых был выявлен наибольший титр антител в сыворотке, подвергались эвтаназии, после чего у них извлекали селезенку, выделяли спленоциты, которые далее использовали для гибридизации с клетками плазмоцитомы Sp2/0.
Определение титра сыворотки. Кровь для анализа брали из хвостовой вены. При помощи остро заточенных ножниц у исследуемых мышей отрезали кончик (0.5 см) хвоста, кровь (30–50 мкл) собирали в микропробирку, оставляли при комнатной температуре на 30 мин и отделяли сыворотку центрифугированием в течение 15 мин при 300 g и комнатной температуре. Далее проводили ИФА, используя в качестве исследуемого препарата сыворотку в разведении 1 : 1000 и ее двоичные разведения. Титр антител в сыворотке определяли как величину, обратную ее разведению, при котором в ИФА оптическая плотность в два раза превышала фоновый сигнал, полученный при использовании сыворотки неиммунизированных животных.
Гибридизацию проводили по методу Келлера и Мильштейна [45].
Наработка моноклональных антител в асцитной жидкости мышей. За 7–30 дней перед введением гибридомных клеток мышам линии BALB/c внутриперитонеально вводили по 0.2 мл пристана (2,6,10,14-тетраметилпентадекана (Sigma)). Клетки гибридом в логарифмической фазе роста суспендировали в 0.5 мл PBS и вводили в перитонеальную полость мыши (из расчета 6–30 × 105 кл/мышь). Рост асцита наблюдался через 10–15 дней примерно в 95% случаев. Асцитную жидкость собирали при помощи инъекционной иглы, прокалывая брюшину в паховой области и собирая имеющееся количество асцита в пробирку. Полученную асцитную жидкость центрифугировали в течение 15 мин при 500 g. Супернатант переливали во флакон и хранили при температуре –20°С до дальнейшего использования.
Выделение моноклональных антител из асцитной жидкости. Асцитную жидкость центрифугировали 30 мин при 12 000 g и 4°С. Надосадочную жидкость разбавляли PBS-буфером в 2–3 раза и добавляли равный объем насыщенного раствора сульфата аммония при постоянном перемешивании. Полученную смесь инкубировали в течение 30 мин во льду, затем центрифугировали 15 мин при 8000 g и 4°С. Осадок растворяли в PBS-буфере в объеме, равном исходному объему асцитной жидкости. Цикл высаливания и центрифугирования повторяли трижды. Затем осадок растворяли в небольшом количестве PBS и диализовали в течение ночи против буфера A (0.02 М NaH2PO4/Na2HPO4, pH 8.0). По окончании диализа белковые агрегаты удаляли центрифугированием в течение 40 мин при 12 000 g и 4°С. Супернатант фильтровали через мембраны с диаметром пор 0.22 мкм. Далее проводили ионообменную хроматографию на колонке Mono Q HR 10/10, предварительно уравновешенной буфером A, с использованием хроматографической системы FPLC. Подготовленный, как описано выше, препарат белка наносили на колонку со скоростью 1 мл/мин, используя устройство “super loop”. Процесс хроматографии вели под контролем проточного спектрофотометра “UV control unit” и регистрировали при помощи самописца. Элюцию белков с колонки осуществляли линейным градиентом концентрации NaCl (0–0.3 М) со скоростью подачи буфера 3 мл/мин и скоростью увеличения концентрации NaCl – 10 мM/мин.
Получение конъюгатов моноклональных антител с флуоресцеин изотиоцианатом (FITC). Для визуализации белка YB-1 в клетках методом флуоресцентной микроскопии полученные моноклональные антитела (МА) конъюгировали с FITC (Isomer I, Sigma, F4274). Путем диализа очищенные антитела с концентрацией 2 мг/мл переводили в 0.1 М натрий-карбонат-бикарбонатный буфер pH 7.6. FITC растворяли в безводном DMSO в концентрации 1 мг/мл. Непосредственно перед внесением FITC pH раствора антител доводили до 9.0 добавлением нескольких микролитров 1 М Na2CO3. Раствор FITC медленно, порциями по 5 мкл добавляли к антителам из расчета 50 мкл на 2 мг белка. После внесения необходимого количества FITC-реагента полученную смесь оставляли на 8 ч в темноте при 4°С. Далее к реакционной смеси добавляли NH4Cl до конечной концентрации 50 мМ и инкубировали еще 2 ч при аналогичных условиях. Несвязавшийся FITC-реагент удаляли из раствора путем диализа против PBS. Соотношение FITC–белок в полученных конъюгатах определяли спектрофотометрически путем измерения поглощения при 495 и 280 нм и вычисляли по формуле: $\frac{{[{\text{FITC}}]}}{{[{\text{MA}}]}} = \frac{{2.77{{A}_{{495}}}}}{{{{A}_{{280}}}(0.35{{A}_{{495}}})}}.$
Для всех полученных конъюгатов молярное соотношение FITC/МА лежало в диапазоне от 2 до 4.
Выявление белка YB-1 в клетках методом флуоресцентной микроскопии. Клетки J774 культивировали во флаконах в среде DMEM High glucose с 10% FBS. Для проведения экспериментов по окрашиванию клетки осаждали центрифугированием при 200 g в течение 5 мин при комнатной температуре. Клетки фиксировали 4% раствором формальдегида в фосфатно-солевом буфере (PBS) при 4°С в течение 30 мин. Затем клетки трижды отмывали PBS, после чего суспендировали в пермеабилизующем растворе (0.1% Triton X-100) и инкубировали 15 мин при комнатной температуре. Снова трижды отмывали клетки PBS, затем суспендировали в буфере для окрашивания (0.5% бычий сывороточный альбумин (BSA) в PBS), подсчитывали количество в камере Горяева, после чего распределяли по отдельным пробиркам порциями по 1–2 × 106 клеток в объеме по 100 мкл. Добавляли в каждую пробирку антитела, конъюгированные с FITC до конечной концентрации 1 мкг/мл и инкубировали в течение 2 ч при 4°С в темноте. Для визуализации ядер клеток за 15 мин до истечения времени инкубации с антителами к суспензии клеток добавляли раствор Hoechst 33258 до конечной концентрации 0.5 мкг/мл. После этого клетки трижды отмывали буфером для окрашивания, после последней отмывки осадок клеток суспендировали в минимальном объеме буфера для окрашивания (10 мкл) и переносили на предметное стекло, накрывали покровным стеклом и исследовали с помощью флуоресцентного микроскопа. На рис. 3 представлена микрофотография клеток, окрашенных при помощи FITC-МАYB-1-2.
Получение мини-антител в формате одноцепочечных фрагментов (scFv) против YB-1. YB-1 в концентрации 10 мкг/мл сорбировали на поверхность иммунопланшета, затем инкубировали с 1012 фаговых частиц в объеме 100 мкл библиотеки scFv человека в течение ночи при 4°С. Неспецифически сорбировавшиеся фаговые частицы отмывали 15 раз PBS-T, оставшимися фагами заражали культуру клеток E. coli штамма TG-1. Для второго раунда селекции инфицированные клетки растили до OD600, равного 0.6, заражали фагом-помощником M13-K07 и инкубировали в течение ночи при интенсивной аэрации. Клеточный супернантант, содержащий 1012 фаговых частиц в 1 мл, использовали для второго раунда. В этом случае на поверхность планшета сорбировали YB-1 в концентрации 1 мкг/мл, а инкубацию с фаговыми частицами проводили в течение 1 ч при комнатной температуре. Далее специфичными фагами заражали культуру E. coli и клетки рассевали до плотности 300 колоний на чашку Петри диаметром 85 мм. Отдельные колонии использовали для дальнейшего анализа. Клетки E. coli наращивали и заражали согласно описанной выше процедуре. Супернатанты использовали в иммуноферментном анализе. YB-1 наносили в концентрации 1 мкг/мл и после инкубации с клеточными супернатантами проявляли с помощью конъюгата кроличьих анти-M13-антител с пероксидазой хрена. Положительные колонии использовали для дальнейшей работы.
Селекция специфичных к YB-1 клонов из библиотеки двенадцатичленных пептидов. В работе была использована библиотека Ph.D.™-12 Phage Display Peptide Library от New England BioLabs, имеющая репертуар 109. Процедуру селекции специфичных клонов бактериофагов проводили в соответствии с инструкцией производителя с некоторыми модификациями. Вкратце, она была следующей: моноклональные антитела клона МАYB-1-2 сорбировали на поверхности иммунопланшета из раствора с концентрацией 10 мкг/мл. Затем в лунки вносили раствор, содержащий белок YB-1 с концентрацией 10 мкг/мл и инкубировали в течение ночи при 4°С для формирования иммунного комплекса. В отдельной пробирке смешивали моноклональные антитела клона МАYB-1-2 (50 мкг/мл) и 1012 фаговых частиц библиотеки Ph.D.™-12 в объеме 1 мл, инкубировали в течение ночи при 4°С. После этого для отделения сформировавшихся агрегатов раствор центрифугировали 30 мин при 12 000 g и 4°С. Супернатант переносили в лунки иммунопланшетов с предформированными иммунными комплексами моноклональных антител с белком YB-1. Дальнейшие процедуры элюции и амплификации аффинных клонов бактериофагов проводили в соответствии с инструкцией к библиотеке. Всего было проведено 3 раунда аффинной селекции, время инкубации библиотеки с иммунным комплексом на третьем раунде уменьшали до 2 ч, а количество фаговых частиц – до 1010.
Список литературы
Didier D.K., Schiffenbauer J., Woulfe S.L., Zacheis M., Schwartz B.D. // Proc. Natl. Acad. Sci. USA. 1988. V. 85. P. 7322–7326.
Ladomery M., Sommerville J. // Nucleic Acids Res. 1994. V. 22(25). P. 5582–5589.
Chernov K.G., Mechulam A., Popova N.V., Pastre D., Nadezhdina E.S., Skabkina O.V., Shanina N.A, Vasiliev V.D., Tarrade A., Melki J., Joshi V., Baconnais S., Toma F., Ovchinnikov L.P., Curmi P.A. // BMC Biochemistry. 2008. V. 9(23). P. 1471–2091.
Evdokimova V., Ovchinnikov L.P., Sorensen P.H.B. // Cell Cycle. 2006. V. 5(11). P. 1143–1147.
Kim E.R., Selyutina A.A., Buldakov I.A., Evdokimova V., Ovchinnikov L.P., Sorokin A.V. // Cell Cycle. 2013. V. 12(24). P. 3791–803.
Minich W.B., Maidebura I.P., Ovchinnikov L.P. // Eur. J. Biochem. 1993. V. 212. P. 633–638.
Rush J., Moritz A., Lee K.A., Guo A., Goss V.L., Spek E.J., Zhang H., Zha X., Polakiewicz R.D., Comb M.J. // Nat. Biotechnol. 2005. V. 23. P. 94–101.
Olsen J.V., Blagoev B., Gnad F., Macek B., Kumar C., Mortensen P., Mann M. // Cell. 2006. V. 127. P. 635–648.
Molina H., Horn D.M., Tang N., Mathivanan S., Pandey A. // Proc. Natl. Acad. Sci. USA. 2007. V. 104. P. 2199–2204.
Dephoure N., Zhou C., Villén J., Beausoleil S.A., Bakalarski C.E., Elledge S.J., Gygi S.P. // Proc. Natl. Acad. Sci. USA. 2008. V. 105. P. 10762–10767.
Lutz M., Wempe F., Bahr I., Zopf D., von Melchner H. // FEBS Lett. 2006. V. 580. P. 3921–3930.
Frye B.C., Halfter S., Djudjaj S., Muehlen berg P., Weber S., Raffetseder U., En-Nia A., Knott H., Baron J.M., Dooley S., Bernhagen J., Mertens P.R. // EMBO Rep. 2009. V. 10. P. 783–789.
Eliseeva I.A., Kim E.R., Guryanov S.G., Ovchinnikov L.P., Lyabin D.N. // Biochemistry. 2011. V. 76(13). P. 1402–1433.
Okamoto T., Izumi H., Imamura T., Takano H., Ise T., Uchiumi T., Kuwano M., Kohno K. // Oncogene. 2000. V. 19. P. 6194–6202.
Li W.W., Hsiung Y., Wong V., Galvin K., Zhou Y., Shi Y., Lee A.S. // Mol. Cell. Biol. 1997. V. 17. P. 61–68.
Higashi K., Inagaki Y., Fujimori K., Nakao A., Kaneko H., Nakatsuka I. // J. Biol. Chem. 2003. V. 278. P. 43470–43479.
Lasham A., Lindridge E., Rudert F., Onrust R., Watson J. // Gene. 2000. V. 252. P. 1–13.
Shnyreva M., Schullery D.S., Suzuki H., Higaki Y., Bomsztyk K. // J. Biol. Chem. 2000. V. 275. P. 15 498–15 503.
Raffetseder U., Frye B., Rauen T., Jurchott K., Royer H.D., Jansen P.L., Mertens P.R. // J. Biol. Chem. 2003. V. 278. P. 18241–18248.
Lu Z.H., Books J.T., Ley T.J. // Mol. Cell. Biol. 2005. V. 25 P. 4625–4637.
Schittek B., Psenner K., Sauer B., Meier F., Iftner T., Garbe C. // Int. J. Cancer. 2007. V. 120. P. 2110–2118.
Bargou R.C., Jurchott K., Wagener C., Bergmann S., Metzner S., Bommert K., Mapara M.Y., Winzer K.J., Dietel M., Dorken B., Royer H.D. // Nat. Med. 1997. V. 3. P. 447–450.
Basaki Y., Hosoi F., Oda Y., Fotovati A., Maruyama Y., Oie S., Ono M., Izumi H., Kohno K., Sakai K., Shimoyama T., Nishio K., Kuwano M. // Oncogene. 2007. V. 26. P. 2736–2746.
Liverman C.S., Kaftan H.A., Cui L., Hersperger S.G., Taboada E., Klein R.M., Berman N.E. // Neurosci. Lett. 2006. V. 399. P. 220–225.
Frye B.C., Halfter S., Djudjaj S., Muehlenberg P., Weber S., Raffetseder U., En-Nia A., Knott H., Baron J.M., Dooley S., Bernhagen J., Mertens P.R. // EMBO Rep. 2009. V. 10. P. 783–789.
Hassoun P.M., Mouthon L., Barbera J.A., Eddahibi S., Flores S.C., Grimminger F., Jones P.L., Maitland M.L., Michelakis E.D., Morrell N.W., Newman J.H., Rabinovitch M., Schermuly R., Stenmark K.R., Voelkel N.F., Yuan J.X., Humbert M. // J. Am. Coll. Cardiol. 2009. V. 54. P. S10–S19.
Coles L.S., Lambrusco L., Burrows J., Hunter J., Diamond P., Bert A.G., Vadas M.A., Goodall G.J. // FEBS Lett. 2005. V. 579. P. 5372–5378.
Ohmori M., Shimura H., Shimura Y., Kohn L.D. // Mol. Endocrinol. 1996. V. 10. P. 76–89.
MacDonald G.H., Itoh-Lindstrom Y., Ting J.P. // J. Biol. Chem. 1995. V. 270. P. 3527–3533.
Cavusoglu E., Eng C., Chopra V., Clark L.T., Pinsky D.J., Marmur J.D. // Arterioscler. Thromb. Vasc. Biol. 2007. V. 27. P. 929–935.
Rothenbacher D., Muller-Scholze S., Herder C., Koenig W., Kolb H. // Arterioscler. Thromb. Vasc. Biol. 2006. V. 26. P. 194–199.
von Hundelshausen P., Weber K.S., Huo Y., Proudfoot A.E., Nelson P.J., Ley K., Weber C. // Circulation. 2001. V. 103. P. 1772–1777.
Evdokimova V., Ruzanov P., Anglesio M.S., Sorokin A.V., Ovchinnikov L.P., Buckley J., Triche T.J., Sonenberg N., Sorensen P.H.B. // Mol. Cell. Biol. 2006. V. 26. P. 277–292.
Bader A.G., Vogt P.K. // Mol. Cell. Biol. 2005. V. 25. P. 2095–2106.
Ohga T., Koike K., Ono M., Makino Y., Itagaki Y., Tanimoto M., Kuwano M., Kohno K. // Cancer Res. 1996. V. 56. P. 4224–4228.
Shibahara K., Uchiumi T., Fukuda T., Kura S., Tominaga Y., Maehara Y., Kohno K., Nakabeppu Y., Tsuzuki T., Kuwano M. // Cancer Sci. 2004. V. 95. P. 348–353.
Goldsmith M.E., Madden M.J., Morrow C.S., Cowan K.H. // J. Biol. Chem. 1993. V. 268. P. 5856–5860.
Shibahara K., Sugio K., Osaki T., Uchiumi T., Maehara Y., Kohno K., Yasumoto K., Sugimachi K., Kuwano M. // Clin. Cancer Res. 2001. V. 7. P. 3151–3155.
Laman A.G., Lathe R., Shepelyakovskaya A.O., Gartseva A., Brovko F.A., Guryanova S., Alekseeva L., Meshcheryakova E.A., Ivanov V.T. // Innate Immun. 2016. V. 22(8). P. 666–673.
Laman A.G., Lathe R., Savinov G.V., Shepelyakovskaya A.O., Boziev Kh.M., Baidakova L.K., Chulin A.N., Brovko F.A., Svirshchevskaya E.V., Kotelevtsev Y., Eliseeva I.A., Guryanov S.G., Lyabin D.N., Ovchinnikov L.P., Ivanov V.T. // FEBS Lett. 2015. V. 589(15). P. 1819–1824.
Savinov G.V., Shepelyakovskaya A.O., Boziev Kh.M., Brovko F.A., Laman A.G. // Biochemistry. 2014. V. 79(2). P. 131–138.
Wolffe A.P., Tafuri S., Ranjan M., Familari M. // New Biol. 1992. V. 4(4). P. 290–298.
Beatty J.D., Beatty B.G., Vlahos W.G. // J. Immunol. Methods. 1987. V. 100. P. 173–179.
Ulitin A.B., Kapralova M.V., Laman A.G., Shepelyakovskaya A.O., Bulgakova E.V., Fursova K.K., Abbasova S.G., Volkov S.K., Brovko F.A., Nesmeyanov V.A. // Dokl. Biochem. Biophys. 2005. P. 405:437–440.
Kohler G., Milstein C. // Nature. 1975. V. 256. P. 495–499.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия





