Биоорганическая химия, 2020, T. 46, № 1, стр. 79-85
Амфифильные катионные производные β-циклодекстрина, содержащие остатки 2-(4-изобутилфенил)- и 2-(3-бензоилфенил)пропионой кислоты
М. А. Маленковская *, Д. А. Шипилов *, М. К. Грачев *
Московский педагогический государственный университет, Институт биологии и химии
129164 Москва, ул. Кибальчича 6/2, Россия
Поступила в редакцию 08.07.2019
После доработки 29.07.2019
Принята к публикации 27.08.2019
Аннотация
Предложен синтез амфифильных катионных производных β-циклодекстрина, содержащих остатки некоторых фармакологически важных кислот, присоединенные на “ножке” разной длины по первичным гидроксильным группам. При этом гидрофобные фрагменты пальмитиновой кислоты находятся как по первичным, так и по вторичным группам.
Ковалентное присоединение лекарственного соединения к циклодекстрину (конъюгирование) в ряду случаев дает возможность получать препараты пролонгированного и целенаправленного действия (targeting drug delivery) [1–7]. В ряду производных циклодекстринов (рис. 1) особое внимание уделяется его амфифильным соединениям, содержащим ковалентно связанные с первичными гидроксильными группами циклодекстрина гидрофобные фрагменты [8]. В медицинском аспекте важно, что конъюгирование (то есть ковалентное связывание) амфифильных циклодекстринов с лекарственными соединениями может приводить к повышению их способности проходить биологические барьеры, например гематоэнцефалический [9]. Поэтому, с целью создания фрагментов, близких по строению и природе находящейся в мембранах клетки липидной матрицы, были получены первые представители нового класса амфифильных циклодекстринов – β-циклодекстрин, ковалентно связанный с холестерином [9–11], фосфолипидоциклодекстрины [9–12], а также амфифильные производные α‑циклодекстрина, содержащие остатки некоторых фармакологически важных кислот [13].
Другая группа производных циклодекстринов представляет собой их катионные соединения, несущие положительный заряд на циклодекстриновой матрице. Благодаря повышенной растворимости и положительному заряду алкиламмониевые (“заряженные”) амфифильные циклодекстрины могут встраиваться и проникать через биологические барьеры, а также служить переносчиками для доставки (векторизации) ДНК при генной терапии [8]. Такие амфифильные катионные циклодекстрины, как гептакис[2-(ω-амино-олигоэтиленгликоль)-6-дезокси-6-гексилтио]-β-циклодекстрин и гептакис[2-(ω-амино-олигоэтиленгликоль)-6-дезокси-6-гексадецилтио]-β-циклодекстрин оценивали на предмет конденсации с плазмидной ДНК и трансфекции клеток [14]. Эти производные могут самоорганизовываться в катионные везикулы или наночастицы и, в отличие от их амфифильных неаминированных аналогов, образуют липоплексы с ДНК, которые эффективно трансфицируют клетки COS-7.
Кроме этого известно, что для структур на основе циклодекстринов эффективность доставки лекарств в биологических системах может быть повышена регулированием длины спейсера, соединяющего циклодекстрин и остаток лекарственного средства, за счет лучшего встраивания в липидную матрицу (так называемый “мембранный якорь”), что вызывает еt меньшие структурные изменения [9, 11].
Цель настоящей работы заключается в синтезе амфифильных катионных производных β‑циклодекстрина, содержащих присоединенные на “ножке” (линкере) разной длины остатки некоторых фармакологически важных кислот: 2-(4-изобутилфенил)пропионовой кислоты (НО–Y) (лекарственное соединение препарата “Ибупрофен”) и 2-(3-бензоилфенил)пропионовой кислоты (НО–Z) (лекарственное соединение препарата “Кетопрофен”). В качестве линкеров разной длины были выбраны остатки 2-(диметиламино)этанола, 3-(диметиламино)пропан-1-ола и 2-(метиламино)этанола. Ранее мы показали принципиальную возможность получения такого рода катионных производных [15]. Преимущества предложенной нами схемы синтеза заключаются в отсутствии необходимости постановки на вторичные гидроксильные группы защит и последующего их удаления.
Исходные катионные производные (I)–(IV) (рис. 2) получены, как описано нами в работе [16] алкилированием 6-монойод-6-дезокси-β-циклодекстрина и терминального диметиламиноалкиленпроизводного, несущего остаток лекарственного средства.
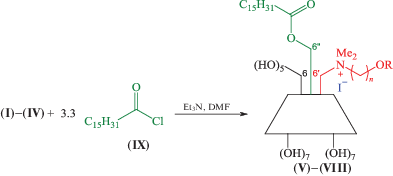
Для получения амфифильных катионных производных (V)–(VIII), содержащих гидрофобный остаток пальмитиновой кислоты при первичных гидроксильных группах, катионные производные (I)–(IV) мы обрабатывали 3.3 моль-экв. хлорангидрида пальмитиновой кислоты (IX) в DMF в присутствии триэтиламина в условиях регионаправленного ацилирования, приведенных нами в работе [17] (схема 1 ).
Схема 1. Получение амфифильных производных с гидрофобными фрагментами пальмитиновой кислоты по первичным гидроксильным группам β-циклодекстрина.
Степень замещения определяли, сравнивая интегральные интенсивности сигналов метильных протонов в спектрах ЯМР 1Н (δ 0.80–0.81 м.д.) и сигналов циклодекстриновых протонов Н2–Н6 (δ 3.25–3.70 м.д.). Как и ранее [13, 18, 19], ацилирование в этих условиях проходило только по первичным гидроксильным группам, что подтверждают данные ЯМР 13С. В спектрах ЯМР 13С соединений (V)–(VIII) присутствуют сигналы ядер незамещенных атомов С6 при δ 60.4 м.д. и характерный [18–23] слабопольный сигнал ядер С6' и С6'', СН2-групп, замещенных ацильными остатками, при δ 63.8 м.д. Смещения сигналов ядер С2 и С3 не наблюдалось, т.е. вторичные гидроксильные группы при ацилировании не затрагивались.
На следующем этапе нашей работы мы получили амфифильные катионные производные (X)–(XIII), содержащие гидрофобный остаток пальмитиновой кислоты при вторичных гидроксильных группах (схема 2 ). Для этого мы использовали схему синтеза, основанную на депротонировании вторичных гидроксильных групп в положении С2 гидридом натрия. Гидроксигруппы при С2 циклодекстринового остова имеют бóльшую кислотность вследствие стабилизации гидроксид-аниона водородной связью с гидроксильной группой при С3, а также из-за электроноакцепторного влияния ацетальной функции [24]. Соединения (I)–(IV) в присутствии гидрида натрия в диметилформамиде по стандартной схеме [25] регионаправленно ацилировали 3.3 моль-экв. хлорангидрида пальмитиновой кислоты (IX) по вторичным гидроксильным группам с образованием соответствующих производных (X)–(XIII) с ацильными группами при С2.
Схема 2. Получение амфифильных производных с гидрофобными фрагментами пальмитиновой кислоты на стороне вторичных гидроксильных групп β-циклодекстрина.
Степень замещения остатком пальмитиновой кислоты у соединений (X)–(XIII) определяли из анализа спектров ЯМР 1Н, а регионаправленность замещения пальмитиновой кислотой по вторичным гидроксильным группам подтверждали, как описано выше для соединений (V)–(VIII). Замещение остатком кислоты вторичных гидроксильных групп при С2 устанавливали с помощью ЯМР 13С. В спектрах соединений (X)–(XIII) наблюдали сигналы ядер атомов С2 с незамещенной гидроксильной группой в области δ 72.9 м.д. и характерный сильнопольный сигнал ядер атомов С2', замещенных остатком пальмитиновой кислоты, при δ 69.4 м.д.
Таким образом, нами предложены новые пути синтеза амфифильных катионных производных β-циклодекстрина, содержащих остатки фармакологически важных ароматических монокарбоновых кислот и гидрофобные фрагменты пальмитиновой кислоты по первичным или вторичным гидроксильным группам. Такие производные могут представлять интерес для медико-биологических исследований в разных направлениях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры ЯМР 1Н и 13C (δ, м.д.; J, Гц) регистрировали на приборе JEOL ECX-400 на частоте 399.78 и 100.53 МГц, соответственно. Химические сдвиги 1Н и 13C приведены относительно сигнала SiMe4, растворитель – DMSO-d6. Элементный анализ выполнен на приборе “FlashEA 1112HT”. Для ТСХ применяли алюминиевые пластинки с закрепленным слоем силикагеля (Silufol UV-254), элюент: хлороформ–метанол, 3 : 1. В работе использовали β-циклодекстрин фирмы “Wacker” (США).
6-O-Пальмитоил-6-[(2-{2-[4-(изобутил)фенил]-пропионилокси}этил)(диметил)аммонио]-6-дезокси-β-циклодекстриниодид (V). К раствору 1.00 г (0.65 ммоль) соединения (I) в 20 мл DMF в присутствии 0.20 г (1.97 ммоль) триэтиламина при перемешивании в течение 15 мин при 0°С прибавляли раствор 0.60 г (2.17 ммоль) хлорангидрида пальмитиновой кислоты (IX) в 10 мл бензола, перемешивали и выдерживали 10 ч при 20°С. Раствор концентрировали до 2 мл и выливали в 30 мл диэтилового эфира. Выпавший осадок отфильтровывали, промывали диэтиловым эфиром (3 × 5 мл), сушили, растирали с 20 мл гексана, отфильтровывали, остаток промывали гексаном (3 × 2 мл) и сушили в вакууме (1 мм рт. ст.) 5 ч при 80°С. Выход 0.65 г (56%), т. пл. 350°С (разл.), Rf 0.89. Спектр ЯМР 1Н: 0.80 м [9Н, CH2CH3, CH(CH3)2], 1.19 м [22Н, (CH2)11CH3], 1.28 м [2Н, CH2(CH2)11CH3], 1.32 д (3Н, CHCH3, J 7.0), 1.44 м [2Н, CH2(CH2)12CH3], 1.75 м [1H, CH(CH3)2], 2.16 уш. с [6Н, N(CH3)2], 2.27 м [2Н, CH2(CH2)13CH3], 2.34 д (2H, CHCH2, J 7.3), 2.47 м (2Н, NCH2), 3.25–3.71 м [43Н, Н2–Н5, С6Н2, CHC(O)], 4.32 м (2Н, OCH2), 4.45 уш. с (5H, С6ОН), 4.78 с (7Н, Н1), 5.70 уш. с (14Н, С2ОН, С3ОН), 7.06 д (2Н, м-СН, J 7.8), 7.13 д (2Н, о-СН, J 8.0). Спектр ЯМР 13C: 14.5 (CH2CH3), 19.0 (CHCH3), 22.6 [CH(CH3)2, CH2CH3], 24.9 [CH2(CH2)12CH3], 28.7–29.5, 31.8, 34.2 [(CH2)11CH2CH3], 30.1 (CH(CH3)2), 33.7 [CH2(CH2)13CH3], 44.6 (СНС(О)), 44.7 (CH2), 45.1 [N(CH3)2], 57.1 (NCH2), 60.4 (C6), 62.0 (OCH2), 63.8 (C6'), 72.5 (C5), 73.0 (C2), 73.6 (C3), 82.0 (C4), 102.1 (C1), 127.6 (м-CH), 129.5 (о-CH), 138.3 [ArCипсоC(O)], 140.3 (п-CH), 174.4 (CH2C=O), 175.0 (C=O). Найдено, %: C 51.43; H 7.09; N 0.83. С75Н126INО37. Вычислено, %: C 51.16; H 7.21; N 0.80.
Соединения (VI)–(VIII) получены аналогично.
6-O-Пальмитоил-6-[(3-{2-[4-(изобутил)фенил]пропионилокси}пропил)(диметил)аммонио]-6-дезокси-β-циклодекстриниодид (VI) получен из 1.00 г (0.65 ммоль) соединения (II) в 20 мл DMF в присутствии 0.20 г (1.95 ммоль) триэтиламина и 0.59 г (2.15 ммоль) хлорангидрида пальмитиновой кислоты (IX). Выход 0.58 г (50%), т. пл. 350°С (разл.), Rf 0.88. Спектр ЯМР 1Н: 0.80 м [9Н, CH2CH3, CH(CH3)2], 1.18 м [22Н, (CH2)11CH3], 1.28 м [2Н, CH2(CH2)11CH3], 1.32 д (3Н, CHCH3, J 7.0), 1.44 м [2Н, CH2(CH2)12CH3], 1.63 м (2H, NCH2CH2), 1.75 м [1H, CH(CH3)2], 2.13 уш. с [6Н, N(CH3)2], 2.23 м [2Н, CH2(CH2)13CH3], 2.35 д (2H, CHCH2, J 7.3), 3.25–3.65 м (42Н, Н2–Н5, С6Н2), 3.68 м (2Н, NCH2), 3.76 м [1H, CHC(O)], 3.99 м (2Н, OCH2), 4.45 уш. с (5H, С6ОН), 4.79 с (7Н, Н1), 5.70 уш. с (14Н, С2ОН, С3ОН), 7.06 д (2Н, м-СН, J 7.8), 7.13 д (2Н, о-СН, J 8.0). Спектр ЯМР 13C: 14.5 (CH2CH3), 19.0 (CHCH3), 22.6 [CH(CH3)2, CH2CH3], 24.9 [CH2(CH2)12CH3], 26.0 (NCH2CH2), 28.7–29.5, 31.8, 34.2 [(CH2)11CH2CH3], 30.2 (CH(CH3)2), 33.7 [CH2(CH2)13CH3], 44.6 (СНС(О)), 44.7 (CH2), 44.8 [N(CH3)2], 55.3 (NCH2), 60.4 (C6), 62.0 (OCH2), 63.8 (C6′), 72.5 (C5), 72.9 (C2), 73.6 (C3), 82.0 (C4), 102.5 (C1), 127.6 (м-CH), 129.5 (о-CH), 138.4 [ArCипсоC(O)], 140.3 (п-CH), 174.4 (CH2C=O), 175.0 (C=O). Найдено, %: C 51.65; H 7.15; N 0.83. С76Н128INО37. Вычислено, %: C 51.44; H 7.27; N 0.79.
6-O-Пальмитоил-6-[{2-[2-(3-(бензоилфенил) пропионилокси]этил}(диметил)аммонио]-6-дезокси-β-циклодекстриниодид (VII) получен из 1.00 г (0.64 ммоль) соединения (III) в 20 мл DMF в присутствии 0.19 г (1.91 ммоль) триэтиламина и 0.58 г (2.10 ммоль) хлорангидрида пальмитиновой кислоты (IX). Выход 0.60 г (52%), т. пл. 350°С (разл.), Rf 0.88. Спектр ЯМР 1Н: 0.80 м (3Н, CH2CH3), 1.19 м [22Н, (CH2)11CH3], 1.27 м [2Н, CH2(CH2)11CH3], 1.37 д (3Н, CHCH3, J 7.0), 1.44 м [2Н, CH2(CH2)12CH3], 2.05 уш. с [6Н, N(CH3)2], 2.26 м [2Н, CH2(CH2)13CH3], 2.40 м (2Н, NCH2), 3.26–3.70 м (42Н, Н2–Н5, С6Н2), 3.91 м (1Н, CHCH3), 4.07 м (2Н, OCH2), 4.47 уш. с (5H, С6ОН), 4.79 с (7Н, Н1), 5.71 уш. с (14Н, С2ОН, С3ОН), 7.53–7.70 м (9H, Ar). Спектр ЯМР 13C: 14.5 (CH2CH3), 19.0 (CHCH3), 22.6 (CH2CH3), 24.9 [CH2(CH2)12CH3], 28.7–29.5, 31.8, 34.2 [(CH2)11CH2CH3], 33.7 [CH2(CH2)13CH3], 44.8 (СНС(О)), 45.6 [N(CH3)2], 57.5 (NCH2), 60.4 (C6), 62.8 (OCH2), 63.8 (C6′), 72.5 (C5), 72.9 (C2), 73.6 (C3), 82.0 (C4), 102.5 (C1), 128.8–140.8 (Ar), 174.0 (CH2C=O), 175.0 (C=O), 196.2 (PhC=O). Найдено, %: C 51.53; H 6.92; N 0.81. С78Н122INО38. Вычислено, %: C 51.80; H 6.80; N 0.77.
6-O-Пальмитоил-6-[{3-[2-(3-(бензоилфенил) пропионилокси]пропил}(диметил)аммонио]-6-дезокси-β-циклодекстриниодид (VIII) получен из 1.00 г (0.63 ммоль) соединения (IV) в 20 мл DMF в присутствии 0.19 г (1.89 ммоль) триэтиламина и 0.57 г (2.08 ммоль) хлорангидрида пальмитиновой кислоты (IX). Выход 0.55 г (48%), т. пл. 350°С (разл.), Rf 0.88. Спектр ЯМР 1Н: 0.81 м (3Н, CH2CH3), 1.19 м [22Н, (CH2)11CH3], 1.27 м [2Н, CH2(CH2)11CH3], 1.37 д (3Н, CHCH3, J 7.0), 1.44 м [2Н, CH2(CH2)12CH3], 1.60 м (2H, NCH2CH2), 2.01 уш. с [6Н, N(CH3)2], 2.26 м [2Н, CH2(CH2)13CH3], 3.26–3.70 м (42Н, Н2–Н5, С6Н2), 3.68 м (2Н, NCH2), 3.99 м (1Н, CHCH3), 4.02 м (2Н, OCH2), 4.47 уш. с (5H, С6ОН), 4.79 с (7Н, Н1), 5.71 уш. с (14Н, С2ОН, С3ОН), 7.53–7.70 м (9H, Ar). Спектр ЯМР 13C: 14.5 (CH2CH3), 18.8 (CHCH3), 22.6 (CH2CH3), 24.9 [CH2(CH2)12CH3], 26.4 (NCH2CH2), 28.7–29.5, 31.8, 34.2 [(CH2)11CH2CH3], 33.7 [CH2(CH2)13CH3], 44.8 (СНС(О)), 45.3 [N(CH3)2], 55.6 (NCH2), 60.4 (C6), 63.1 (OCH2), 63.8 (C6′), 72.5 (C5), 72.9 (C2), 73.6 (C3), 82.0 (C4), 102.5 (C1), 128.8–140.8 (Ar), 174.0 (CH2C=O), 175.0 (C=O), 196.2 (PhC=O). Найдено, %: C 52.31; H 6.75; N 0.73. С79Н124INО38. Вычислено, %: C 52.06; H 6.86; N 0.77.
2-O-Пальмитоил-6-[(2-{2-[4-(изобутил)фенил]пропионилокси}этил)(диметил)аммонио]-6-дезокси-β-циклодекстриниодид (X). К раствору 1.00 г (0.66 ммоль) соединения (I) в 20 мл DMF при перемешивании прибавляли 0.1214 г (5.06 ммоль) гидрида натрия. Через 1 ч по каплям прибавляли раствор 1.26 г (4.60 ммоль) хлорангидрида пальмитиновой кислоты (IX) в 20 мл DMF, перемешивали и выдерживали 24 ч при 20°С. К полученному раствору прибавляли 2 мл метилового спирта и выливали в 40 мл ацетона. Выпавший осадок отфильтровывали, промывали 5 мл воды, сушили, растирали с 10 мл гексана, отфильтровывали, остаток промывали гексаном (3 × 2 мл) и сушили в вакууме (1 мм рт. ст.) 5 ч при 80°С. Выход 0.56 г (48%), т. пл. 350°С (разл.), Rf 0.85. Спектр ЯМР 1Н: 0.80 м [9Н, CH2CH3, CH(CH3)2], 1.19 м [22Н, (CH2)11CH3], 1.28 м [2Н, CH2(CH2)11CH3], 1.32 д (3Н, CHCH3, J 7.0), 1.44 м [2Н, CH2(CH2)12CH3], 1.75 м [1H, CH(CH3)2], 2.15 уш. с [6Н, N(CH3)2], 2.27 м [2Н, CH2(CH2)13CH3], 2.36 д (2H, CHCH2, J 7.3), 2.55 м (2Н, NCH2), 3.25–3.65 м (42Н, Н2–Н5, С6Н2), 3.71 м [CHC(O)], 4.08 м (2Н, OCH2), 4.47 уш. с (6H, С6ОН), 4.79 с (7Н, Н1), 5.71 уш. с (13Н, С2ОН, С3ОН), 7.06 д (2Н, м-СН, J 7.8), 7.13 д (2Н, о-СН, J 8.0). Спектр ЯМР 13C: 14.5 (CH2CH3), 19.0 (CHCH3), 22.7 [CH(CH3)2, CH2CH3], 24.8 [CH2(CH2)12CH3], 28.7–29.5, 31.8, 34.2 [(CH2)11CH2CH3], 30.1 (CH(CH3)2), 33.8 [CH2(CH2)13CH3], 44.6 (СНС(О)), 44.7 (CH2), 45.1 [N(CH3)2], 57.1 (NCH2), 60.3 (C6), 62.1 (OCH2), 63.8 (C6′), 69.4 (C2′), 72.5 (C5), 72.9 (C2), 73.6 (C3), 82.0 (C4), 102.5 (C1), 127.6 (м-CH), 129.6 (о-CH), 138.3 [ArCипсоC(O)], 140.3 (п-CH), 174.4 (CH2C=O), 176.2 (C=O). Найдено, %: C 50.89; H 7.32; N 0.84. С75Н126INО37. Вычислено, %: C 51.16; H 7.21; N 0.80.
Соединения (XI)–(XIII) получены аналогично.
2-O-Пальмитоил-6-[(3-{2-[4-(изобутил)фенил]пропионилокси}пропил)(диметил)аммонио]-6-дезокси-β-циклодекстриниодид (XI) получен из 1.00 г (0.65 ммоль) соединения (II) в 20 мл DMF в присутствии 0.1203 г (5.01 ммоль) гидрида натрия и 1.25 г (4.56 ммоль) хлорангидрида пальмитиновой кислоты (IX). Выход 0.53 г (46%), т. пл. 350°С (разл.), Rf 0.88. Спектр ЯМР 1Н: 0.80 м [9Н, CH2CH3, CH(CH3)2], 1.16 м [22Н, (CH2)11CH3], 1.27 м [2Н, CH2(CH2)11CH3], 1.32 д (3Н, CHCH3, J 7.0), 1.43 м [2Н, CH2(CH2)12CH3], 1.63 м (2H, NCH2CH2), 1.74 м [1H, CH(CH3)2], 2.13 уш. с [6Н, N(CH3)2], 2.25 м [2Н, CH2(CH2)13CH3], 2.33 д (2H, CHCH2, J 7.3), 3.25–3.65 м (44Н, Н2–Н5, С6Н2, NCH2), 3.76 м [CHC(O)], 4.00 м (2Н, OCH2), 4.45 уш. с (6H, С6ОН), 4.79 с (7Н, Н1), 5.70 уш. с (13Н, С2ОН, С3ОН), 7.06 д (2Н, м-СН, J 7.8), 7.13 д (2Н, о-СН, J 7.0). Спектр ЯМР 13C: 14.4 (CH2CH3), 19.0 (CHCH3), 22.6 [CH(CH3)2, CH2CH3], 24.9 [CH2(CH2)12CH3], 25.8 (NCH2CH2), 28.6–29.5, 31.8, 34.2 [(CH2)11CH2CH3], 30.1 (CH(CH3)2), 33.7 [CH2(CH2)13CH3], 43.8 (СНС(О)), 44.7 [N(CH3)2], 45.4 (CH2), 55.3 (NCH2), 60.2 (C6), 62.6 (OCH2), 63.8 (C6′), 69.4 (C2′), 72.4 (C5), 72.9 (C2), 73.5 (C3), 82.0 (C4), 102.5 (C1), 127.6 (м-CH), 129.6 (о-CH), 138.4 [ArCипсоC(O)], 140.4 (п-CH), 174.5 (CH2C=O), 176.9 (C=O). Найдено, %: C 51.59; H 7.18; N 0.82. С76Н128INО37. Вычислено, %: C 51.44; H 7.27; N 0.79.
2-O-Пальмитоил-6-[{2-[2-(3-(бензоилфенил)пропионилокси]этил}(диметил)аммонио]-6-дезокси-β-циклодекстриниодид (XII) получен аналогично соединению из 1.00 г (0.64 ммоль) соединения (III) в 20 мл DMF в присутствии 0.1177 г (4.90 ммоль) гидрида натрия и 1.23 г (4.46 ммоль) хлорангидрида пальмитиновой кислоты (IX). Выход 0.51 г (44%), т. пл. 350°С (разл.), Rf 0.88. Спектр ЯМР 1Н: 0.82 м (3Н, CH2CH3), 1.21 м [22Н, (CH2)11CH3], 1.27 м [2Н, CH2(CH2)11CH3], 1.37 д (3Н, CHCH3, J 7.0), 1.60 м [2Н, CH2(CH2)12CH3], 2.03 уш. с [6Н, N(CH3)2], 2.25 м [2Н, CH2(CH2)13CH3], 2.40 м (2Н, NCH2), 3.26–3.70 м (42Н, Н2–Н5, С6Н2), 3.91 м (1Н, CHCH3), 4.07 м (2Н, OCH2), 4.47 уш. с (6H, С6ОН), 4.79 с (7Н, Н1), 5.71 уш. с (13Н, С2ОН, С3ОН), 7.53–7.70 м (9H, Ar). Спектр ЯМР 13C: 14.5 (CH2CH3), 19.0 (CHCH3), 22.6 (CH2CH3), 24.9 [CH2(CH2)12CH3], 28.7–29.5, 31.8, 34.2 [(CH2)11CH2CH3], 33.7 [CH2(CH2)13CH3], 44.8 (СНС(О)), 45.7 [N(CH3)2], 57.5 (NCH2), 60.4 (C6), 62.9 (OCH2), 63.8 (C6'), 69.4 (C2'), 72.5 (C5), 72.9 (C2), 73.6 (C3), 82.1 (C4), 102.5 (C1), 128.8–140.8 (Ar), 174.0 (CH2C=O), 175.0 (C=O), 196.1 (PhC=O). Найдено, %: C 52.02; H 6.69; N 0.73. С78Н122INО38. Вычислено, %: C 51.80; H 6.80; N 0.77.
2-O-Пальмитоил-6-[{3-[2-(3-(бензоилфенил)пропионилокси]пропил}(диметил)аммонио]-6-дезокси-β-циклодекстриниодид (XIII) получен аналогично соединению из 1.00 г (0.63 ммоль) соединения (IV) в 20 мл DMF в присутствии 0.1166 г (4.86 ммоль) гидрида натрия и 1.21 г (4.42 ммоль) хлорангидрида пальмитиновой кислоты (IX). Выход 0.47 г (41%), т. пл. 350°С (разл.), Rf 0.88. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 0.80 м (3Н, CH2CH3), 1.18 м [22Н, (CH2)11CH3], 1.27 м [2Н, CH2(CH2)11CH3], 1.37 д (3Н, CHCH3, J 7.0), 1.44 м [2Н, CH2(CH2)12CH3], 1.60 м (2H, NCH2CH2), 2.02 уш. с [6Н, N(CH3)2], 2.26 м [2Н, CH2(CH2)13CH3], 3.26–3.70 м (42Н, Н2–Н5, С6Н2), 3.68 м (2Н, NCH2), 3.99 м (1Н, CHCH3), 4.02 м (2Н, OCH2), 4.47 уш. с (6H, С6ОН), 4.79 с (7Н, Н1), 5.71 уш. с (13Н, С2ОН, С3ОН), 7.53–7.70 м (9H, Ar). Спектр ЯМР 13C: 14.5 (CH2CH3), 18.8 (CHCH3), 22.6 (CH2CH3), 24.9 [CH2(CH2)12CH3], 26.4 (NCH2CH2), 28.7–29.5, 31.8, 34.2 [(CH2)11CH2CH3], 33.8 [CH2(CH2)13CH3], 44.8 (СНС(О)), 45.3 [N(CH3)2], 55.7 (NCH2), 60.4 (C6), 63.1 (OCH2), 63.8 (C6'), 69.4 (C2'), 72.5 (C5), 72.9 (C2), 73.6 (C3), 82.1 (C4), 102.5 (C1), 128.8–140.8 (Ar), 174.0 (CH2C=O), 175.0 (C=O), 196.1 (PhC=O). Найдено, %: C 52.29; H 6.76; N 0.72. С79Н124INО38. Вычислено, %: C 52.06; H 6.86; N 0.77.
Список литературы
Parrot-Lopez H., Djedaïni F., Perly B., Coleman A.W., Galons H., Miocque M. // Tetrahedron Lett. 1990. V. 31. P. 1999.
Djedaïni-Pilard F., Désalos J., Perly B. // Tetrahedron Lett. 1993. V. 34. P. 2457.
Hristova-Kazmierski M.K., Horan P., Davis P., Yamamura H.I., Kramer T., Horvath R., Kazmierski W.M., Porreca F., Hruby V.J. // Bioorg. Med. Chem. Lett. 1993. V. 3. P. 831.
Uekama K., Minami K., Hirayama F. // J. Med. Chem. 1997. V. 40. P. 2755.
Minami K., Hirayama F., Uekama K. // J. Pharm. Sci. 1998. V. 87. P. 715.
Uekama K., Hirayama F., Irie T. // Chem. Rev. 1998. V. 98. P. 2045.
Tavornvipas S., Arima H., Hirayama F., Uekama K., Ishiguro T., Oka M., Hamayasu K., Hashimoto H. // J. Inclusion Phenom. Macr. Chem. 2002. V. 44. P. 391.
Cyclodextrins in Pharmaceutics, Cosmetics, and Biomedicine: Current and Future Industrial Applications / Ed. by Bilensoy E., Hoboken, New Jersey: John Wiley & Sons, Inc., 2011. 395 p.
Perly B., Moutard S., Djedaïni-Pilard F. // PharmaChem: Fine, Specialty & Performance Chemicals. 2005. V. 4. P. 4–9.
Javierre I., Nedyalkov M., Petkova V., Benattar J.-J., Weisse S., Auzely-Velty R., Djedaïni-Pilard F., Perly B. // J. Colloid Interface Sci. 2002. V. 254. P. 120.
Moutard S., Perly B., Gode P., Demailly G., Djedaïni-Pilard F. // J. Incl. Phen. Macrocycl. Chem. 2002. V. 44. P. 317–322.
Грачев М.К., Сипин С.В., Кононов Л.О., Нифантьев Э.Е. // Изв. АН. Cер. хим. 2009. С. 221.
Грачев М.К., Едунов А.В., Курочкина Г.И., Соболева Н.О., Васянина Л.К., Нифантьев Э.Е. // Изв. АН. Сер. хим. 2012. С. 178.
Cryan S.A., Donohue R., Ravoo B.J., Darcy R., O’Driscoll C.M. // J. Drug Deliv. Sci. Technol., 2004. V. 14. P. 57–62.
Грачев М.К., Чараев А.А., Курочкина Г.И., Васянина Л.К., Шмелёва В.Н., Нифантьев Э.Е. // Журн. общ. химии, 2010. Т. 80. С. 1494–1500. [Grachev M.K., Charaev A.A., Kurochkina G.I., Vasyanina L.K., Shmelev V. N., Nifant’ev E.E. // Russ. J. Gen. Chem. 2010. V. 80. P. 1812–1818.
Шипилов Д.А., Маленковская М.А., Кутяшева Н.В., Курочкина Г.И., Сергиевич А.А., Грачев М.К. // Изв. АН. Сер. хим. 2012. С. 862–866.
Маленковская М.А., Грачев М.К., Левина И.И., Нифантьев Э.Е. // Журн. орган. химии. 2013. Т. 49. С. 1796–1801.
Глазырин А.Е., Сырцев А.Н., Курочкина Г.И., Кононов Л.О., Грачев М.К., Нифантьев Э.Е. // Изв. АН. Cер. хим. 2003. С. 225.
Грачев М.К., Едунов А.В., Курочкина Г.И., Попков А.В., Левина И.И., Нифантьев Э.Е. // Журн. орган. химии. 2011. Т. 41. С. 290.
Грачев М.К., Едунов А.В., Курочкина Г.И., Левина И.И., Нифантьев Э.Е. // Журн. общ. химии. 2011. Т. 81. С. 222.
Takeo K., Mitoh H., Uemura K. // Carbohydr. Res. 1989. V. 187. P. 203.
Baer H.H., Shen Ya., González F.S., Berenguel A.V., García J.I. // Carbohydr. Res. 1992. V. 235. P. 129.
Hanessian S., Benalil A., Laferrière C. // J. Org. Chem. 1995. V. 60. P. 4786.
Menger F.A., Dulany M.A. // Tetrahedron Lett. 1985. V. 26. P. 267.
Rong D., D’Souza V.T. // Tetrahedron Lett. 1990. V. 31. P. 4275.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия