Биоорганическая химия, 2020, T. 46, № 2, стр. 133-139
Модификация олигопептидов с целью повышения эффективности их взаимодействия с интерлейкином-8 в плазме крови человека
О. В. Грибовская 1, В. П. Мартинович 1, Д. А. Макаревич 1, В. П. Голубович 1, Т. В. Рябцева 2, В. В. Кирковский 2
1 Институт биоорганической химии НАН Беларуси
220141, Минск, ул. Ак. Купревича, 5/2, Беларусь
2 Белорусский государственный медицинский университет
220116, Минск, пр. Дзержинского, 83, Беларусь
Поступила в редакцию 21.06.2019
После доработки 02.09.2019
Принята к публикации 24.10.2019
Аннотация
С целью поиска соединений, способных уменьшать концентрацию интерлейкина-8 в плазме крови человека проведено молекулярное моделирование, позволившее выявить ряд пептидных последовательностей. Показано, что замена остатка глутаминовой кислоты в пептидах Glu-His-OMe и Glu-His-Trp-OMe на ее циклическую форму, а также введение остатков DTyr и DAla в последовательность Asp-Tyr-Ala-Pro, приводит к двукратному увеличению способности их связывания интерлейкина-8.
ВВЕДЕНИЕ
Интерлейкин 8 (IL-8) – альфа-хемокин, продукт многих клеток, включая кератиноциты, фибропласты и макрофаги, который стимулирует хемотаксис нейтрофилов, базофилов, лимфоцитов, кератиноцитов, а также стимулирует освобождение ферментов нейтрофилами [1, 2]. В настоящее время он включается в семейство хемокинов. Основные биологические эффекты хемокинов связаны с их хемоаттрактантной активностью, особенно это касается IL-8. Так, у больных идиопатическим фиброзом легких была обнаружена повышенная экспрессия mRNA для IL-8, что коррелировало с содержанием IL-8, числом нейтрофилов в бронхоальвеолярной жидкости и с тяжестью заболевания. Высокий уровень IL-8 в легких обнаружен при остром воспалении. У больных респираторным дистресс-синдромом содержание IL-8 и количество нейтрофилов коррелировало со смертностью. Хемокины также являются медиаторами аллергического воспаления. У больных бронхиальной астмой наблюдается повышенная экспрессия IL-8 эпителиальными клетками бронхов [3, 4]. В научной литературе имеется также информация об участии IL-8 в патогенезе сепсиса [5, 6].
Таким образом, поиск способов регулирования концентрации IL-8 в плазме крови является актуальной и перспективной задачей современной медицинской науки. Это подтверждается результатами эффективного применения следующих известных ингибиторов:
1. Репариксин (химическая формула – (αR)-α-метил-4-(2-метилпропил)-N-(метилсульфонил)-бензенеацетамид L-лизина) является неконкурентным аллостерическим ингибитором активации рецепторов хемокинов CXCR1 и CXCR2 под действием IL-8 (IC50 = 1 и 100 нМ соответственно). Он блокирует ряд активностей, связанных с передачей сигналов IL-8, включая рекрутирование лейкоцитов (IC50 = 1 нМ) и другие воспалительные реакции [7].
2. HuMax-IL8 – полностью гуманизированное моноклональное антитело, которое связывает и ингибирует IL-8 [8]. Сейчас проходит 1-я фаза клинических испытаний данного препарата.
3. Пептидные ингибиторы [9]. Находятся на стадии доклинических испытаний.
Пептидные ингибиторы наиболее предпочтительны из соображений безопасности и стоимости продукции. Однако применение синтетических пептидных ингибиторов имеет существенный недостаток: пептидные молекулы чрезвычайно быстро метаболизируются пептидазами в организме человека. Поэтому необходима разработка способов защиты пептидных молекул от ферментативного разрушения.
РЕЗУЛЬТЫТЫ И ОБСУЖДЕНИЕ
Целью настоящей работы являлся поиск и исследование пептидов, способных уменьшать концентрацию IL-8 в плазме крови человека, а также разработка способов их защиты от разрушения пептидазами.
Этапы исследований включали анализ структуры комплексов IL-8 с лигандами и выбор возможных участков связывания, модификацию, синтез отобранных соединений, изучение их биологической активности.
На первом этапе работы в ProteinDataBank осуществили поиск пространственных структур IL-8 и его комплексов с лигандами различной природы. Отобрали структуру, которая по своим свойствам наилучшим образом подходила для расчетов и прогноза потенциальных участков связывания белка-лиганда с IL-8 (1ILQ, комплекс IL-8 с цитокинсвязывающей областью CXCR-1). С использованием программного комплекса были рассчитаны предполагаемые участки связывания белка-лиганда и цитокинов. На основании этих расчетов были смоделированы олигопептиды, потенциально способные связывать IL-8. Молекулярный докинг (или молекулярные стыковки) — это метод молекулярного моделирования, который позволяет предсказать наиболее выгодную для образования устойчивого комплекса ориентацию и положение одной молекулы по отношению к другой. Для докинга указывается область структуры белка, в которой будет происходить поиск места для связывания. Задают его как куб с центром. Координаты центра и размеры куба определяются визуально исходя из структуры изучаемого цитокина. В данной работе использовали pdb-файл 1IKL – мономерная форма IL-8. Координаты центра – Cx:0 Cy:-5 Cz:0. Размеры куба – Sx:60 Sy:60 Sz:50. В табл. 1 представлены результаты математических расчeтов свободной энергии связывания IL-8 с пептидами.
Таблица 1.
Значения свободной энергии связывания экспериментальных олигопептидов с IL-8
| Пептид | Структура | Энергия связывания IL-8, ккал/моль |
|---|---|---|
| (1) | Gly-Ser | 6.05 (5.57; 6.25) |
| (2) | Glu-His | 6.30 (6.02; 6.47)* |
| (3) | Pro-Gly | 5.40 (5.40; 5.50) |
| (4) | Glu-His-Trp | 6.45 (6.30; 6.52)* |
| (5) | Tyr-Phe-Val | 5.90 (5.55; 6.30) |
| (6) | Phe-Glu-Gly | 5.40 (5.27; 5.42) |
| (7) | Phe-Gly-Gln-Gly | 5.90(5.55; 6.30) |
| (8) | Trp-Ala-Thr-His | 6.20 (6.00; 6.22)* |
| (9) | Asp-Tyr-Ala-Pro | 5.40 (5.20; 5.40) |
Для дальнейшей модификации и химического синтеза были выбраны следующие пептидные последовательности: Glu-His (2), Glu-His-Trp (4), Asp-Tyr-Ala-Pro (9). Модификацию пептидов (2) и (4) осуществляли заменой остатка глутаминовой кислоты Glu на остаток пироглутаминовой кислоты, что согласно работе [10], является известным способом защиты против атак протеаз. Последовательность Asp-Tyr-Ala-Pro (9) модифицировали введением D-аминокислот – DTyr и DAla вместо их L-аналогов.
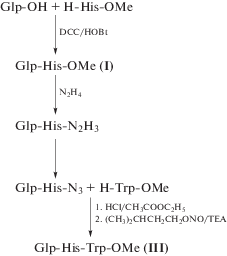
Основными моментами, которые должны быть учтены при синтезе модифицированных олигопептидов Glp-His-OMe (I) и Glp-His-Trp-OMe (III), являются специфические свойства гистидина и пироглутаминовой кислоты: повышенная склонность остатка His к рацемизации и возможность протекания побочных реакций по имидазольному кольцу, лабильность пирролидонового цикла при кислых и сильно щелочных значениях pH [11]. Приемлемыми растворителями для исходных включаемых соединений (пироглутаминовая кислота и метиловый эфир гистидина) оказались ацетонитрил и хлористый метилен. Использование гидроксибензотриазола (HOBt) совместно с DCC позволило обеспечить высокий выход дипептида Glp-His-OMe (I) и высокий уровень его удельного оптического вращения (80%) и –17°…–19°. Очистка дипептида (I) состояла в избирательном растворении компонентов смеси, содержащей неочищенный дипептид. Выделенный из реакционной смеси осадок, состоящий в основном из Glp-His-OMe и дициклогексилмочевины, промывали метанолом для перевода дипептида в раствор. Полученный после упаривания метанола кристаллический осадок дипептида обрабатывали хлороформом и смесью эфир-метанол для очистки от примесей исходных соединений. Такие процедуры позволили получить хроматографически однородный дипептид. При синтезе трипептида (III) для конденсации N-концевого дипептида с метиловым эфиром триптофана мы выбрали азидный способ, который обеспечивает отсутствие рацемизации, позволяет избежать стадии щелочного гидролиза Glp-His-OMe для отщепления метильной защиты (схема 1 ).
Схема 1 . Схема синтеза Glp-His-OMe (I) и Glp-His-Trp-OMe (III).
Вторая стадия синтеза трипептида Glp-His-Trp-OMe – получение гидразида Glp-His-N2H3. Для полного перевода метилового эфира в гидразид использовали пятикратный избыток гидразингидрата, выход продукта практически количественный. Азидную конденсацию Glp-His-N3 и Trp-OMe проводили в DMF – растворителе, обеспечивающем хорошую растворимость всех компонентов и способствующем протеканию реакции. Для перевода гидразида в азид использовали изоамилнитрит, необходимую реакцию среды создавали добавлением HCl в этилацетате и триэтиламина. Реакцию проводили при температуре –15…–20°С. Для получения хроматографически однородного пептида (III) проводили очистку путем многократных переосаждений на первом этапе, заключительной стадией являлась колоночная хроматография на силикагеле с использованием в качестве элюэнта смеси хлороформ–метанол 2 : 1.
Тетрапептиды Asp-DTyr-Ala-Pro (IX) и Asp-DTyr-DAla-Pro (X) синтезировали по схеме 2 + 2 (схема 2 ).
Схема 2 . Схема синтеза тетрапептидов Asp-DTyr-Ala-Pro (IX) и Asp-DTyr-DAla-Pro (X).
Дипептид Boc-Asp(OBzl)-DTyr-OH (IV) получали методом активированных эфиров, пентафторфениловый эфир эфира β-бензилового эфира трет-бутилоксикарбонил-аспарагиновой кислоты вводили в реакцию с DTyr без выделения. С‑Концевой пролин в виде бензилового эфира вводили в синтез с Boc-Ala-OH или Boc-DAla-OH для получения Boc-Ala-Pro-OBzl и Boc-DAla-Pro-OBzl соответственно. В качестве основного конденсирующего агента использовали DCC с добавлением HOBt. Для блокирования α-аминогрупп применяли Вос-защитную группу. Ее отщепление проводили обработкой 4.5 М раствором HCl в этилацетате. Гидрохлориды пептидов после отщепления Вос-защитной группы, которое протекало с выходами, близким к количественным (93–98%), использовали в синтезе после определения их однородности методом тонкослойной хроматографии. Полной характеризации гидрохлоридов не проводили, так как кислотный гидролиз Вос-группы протекает, как правило, без рацемизации и изменения структуры пептидной цепи [12]. β-Бензильные группы аспарагиновой кислоты и С-концевого пролина удаляли гидрированием пептида над катализатором – палладиевой чернью, в растворе уксусной кислоты.
Идентификацию целевых соединений выполняли методом масс-спектрометрии, гомогенность подтверждали хроматографическими методами.
Иммунологическое тестирование пептидов заключалось в исследовании их связывания с IL-8. Оценку связывания пептидов проводили с использованием плазмы крови 5 условно здоровых доноров (N = 35) с IL-8 в концентрации >300.00 нмоль/мл. Концентрацию IL-8 определяли методом ИФА с применением иммуноферментного набора Интерлейкин-8-ИФА-Бест (Вектор Бест, Россия). Работу проводили согласно утвержденной для набора инструкции от 30.06.2017. Эффективность олигопептидов оценивали как процент уменьшения концентрации интерлейкина в опытной пробе по сравнению с контролем. Результаты представлены в табл. 2.
Таблица 2.
Эффективность связывания IL-8 из плазмы крови экспериментальными олигопептидами in vitro (результаты представлены в виде Ме (25‰; 75‰)
| № п/п | Олигопептид | Эффективность связывания IL-8, % |
|---|---|---|
| 1 | Glu-His-OMe | 12.36 (10.47; 15.38) |
| 2 | Glu-His-Trp-OMe | 13.25 (8.35; 15.46) |
| 3 | pGlu-His-OMe | 35.72 (23.11; 37.24)* |
| 4 | pGlu-His-Trp-OMe | 21.54 (8.33; 48.51)* |
| 5 | Asp-Tyr-Ala-Pro | 44.41 (32.60; 51.47) |
| 6 | Asp-DTyr-Ala-Pro | 46.63 (40.12; 50.32) |
| 7 | Asp-DTyr-DAla-Pro | 84.00 (75.14; 88.11)* |
Из табл. 2 следует, что модификация пептидов существенно увеличивает их эффективность связывания IL-8. Замена двух аминокислот в последовательности Asp-Tyr-Ala-Pro на D-форму увеличивает процент связывания в 2 раза. Аналогичный результат наблюдается при замене в пептиде Glu-His-OMe глутаминовой кислоты на ее циклическую форму.
Таким образом, полученные результаты позволяют считать доказанным связывание синтезированных соединений с IL-8. Мы предполагаем, что на основе исследуемых соединений возможно создание эффективного гемосорбента, способного элиминировать IL-8 при ряде патологических процессов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез пептидов
В работе были использованы аминокислоты, реагенты, растворители (Sigma, США, Fluka, Швейцария, Acros Organics, Бельгия). Процессы синтеза соединений, удаления защитных групп контролировали методом ТСХ на пластинках с закрепленным слоем силикагеля (Sorbfil, Россия) в системах растворителей: хлороформ–метанол–20%-ный аммиак, 60 : 40 : 10 (А); бутанол–уксусная кислота–вода, 40 : 10 : 10 (Б), этилацетат–пиридин–уксусная кислота–вода, 50 : 30 : 30 : 10 (В). Вещества обнаруживали на пластинках с помощью хлор-бензидинового реагента.
Аналитическую ВЭЖХ проводили на хроматографе Agilent 1200 с масс-детектором QQQ (Triple Quadrupole) Agilent 6410, колонка Vydac 201HS52 RP C18 (2.1 × 250 мм). Использовали градиент концентраций ацетонитрила от 10 до 95% в 8 мM растворе ацетата аммония. Скорость потока 1 мл/мин.
Масс-спектры c химической ионизацией при атмосферном давлении (APCI-MS) регистрировали на масс-хроматографе Accela-LCQ Fleet (Thermo Scientific, США).
Температуры плавления (некорректируемые) определяли на приборе Кофлера. Удельное вращение соединений измеряли на спектрополяриметре J-20 “Jasco” (Япония). Аминокислотный состав пептидов, гидролизированных 6 М HCl в запаянных ампулах при 110°С в течение 20 ч, проводили на автоматическом аминокислотном анализаторе LMV (Швеция).
Glp-His-OMe (I). К охлажденной до 3°С взвеси 0.65 г (5.0 ммоль) пироглутаминовой кислоты в 18.0 мл хлористого метилена прибавляли 0.68 г (5.0 ммоль) HOBt и охлажденный раствор 1.24 г (6.0 ммоль) DCC в 2.5 мл хлористого метилена. После перемешивания в течение 30 мин к реакционной смеси добавляли 1.21 г (5.0 ммоль) His-OMe ⋅ 2HCl и прикапывали 1.38 мл (10.0 ммоль) ТEА, продолжали перемешивание при 4–8°С в течение 1 и 15 ч при комнатной температуре. Осадок отфильтровывали, промывали хлористым метиленом (2 × 3.0 мл), затем метанолом (5 × 3.0 мл). Метанольный фильтрат упаривали, твердый остаток переносили на фильтр и промывали хлороформом (5 × 3.0 мл), смесью эфир–метанол, 3 : 1 (4 × 3.0 мл). Сушили в вакууме над P2O5. Выход Glp-His-OMe – 0.91г (65%) с т. пл. 193–195°С, $[\alpha ]_{D}^{{20}}$– 20° (c 1, MeOH), Rf 0.45 (A), 0.62 (B). Данные аминокислотного анализа: Glu 1.02 (1), His 0.97 (1).
Glp-His-N2H3 (II). К раствору 0.84 г (3.0 ммоль) соединения (I) в 6.0 мл этанола, охлажденному до 3–5°С, прибавляли по каплям при перемешивании 0.73 мл (15.0 ммоль) гидразингидрата. Реакционную смесь перемешивали 2 ч при охлаждении и оставили на 15 ч в холодильнике при 5°С. Выпавший осадок отделяли фильтрованием, промывали его изопропанолом, метанолом, эфиром. Получили 0.75 г (89%) Glp-His-N2H3 с т. пл. 241–244°С, $[\alpha ]_{D}^{{20}}$ – 15° (c 1, вода), Rf 0.14 (A), 0.28 (В).
Glp-His-Trp-OMe (III). К взвеси 0.56 г (2.0 ммоль) Glp-His-N2H3 в 15.0 мл DMF, охлажденной до –20°С, прибавляли по каплям 3.0 мл (12.0 ммоль) 4 М HCl в этилацетате при интенсивном перемешивании, при этом происходило растворение взвеси, затем 0.38 мл (2.8 ммоль) изоамилнитрита. Реакционную смесь перемешивали 30 мин при –15…–20°С, затем прибавляли 1.66 мл (14.0 ммоль) ТEА и 0.94 г (2.0 ммоль) Н-Trp-OMe ⋅ HCl, следя за температурными границами. Реакционную смесь перемешивали при –10…–15°С 1 ч и 1 ч при –5°С. Осадок соли триэтиламина отделяли фильтрованием, к фильтрату прибавляли 55.0 мл эфира до полного осаждения продукта реакции. Выпавший осадок промывали эфиром, затем переосаждали из метанола эфиром и сушили в вакууме. Высушенный трипептид с примесями растворяли в 1.5 мл метанола и наносили на колонку с силикагелем Merk 40–60 mesh. В качестве элюента использовали смесь хлороформ–метанол, 2 : 1. Фракции, содержащие трипептид, объединяли, упаривали, переосаждали из метанола эфиром и сушили до постоянного веса. Выход Glp-His-Trp-OMe 0.57 г (59%), т. пл. 241–244°С, $[\alpha ]_{D}^{{20}}$ – 20° (c 1, вода, Rf 0.34 (A), 0.48 (В). Масс-спектр ESI, m/z: 485.2 [M + H]+. Данные аминокислотного анализа: Glu 1.01 (1), His 0.98 (1), Trp не определяли.
Boc-Asp(OBzl)-DTyr-OH (IV). К раствору 1.61 г (5.0 ммоль) Boc-Asp(OBzl)-OH в 7.0 мл диоксана прибавляли 1.01 г (5.5 ммоль) пентафторфенола. После охлаждения до 0°С в реакционный сосуд прибавляли 1.23 г (6.0 ммоль) DCC. Перемешивали 1 ч при охлаждении и 2 ч при комнатной температуре. После окончания реакции осадок дициклогексилмочевины отфильтровали, а полученный раствор пентафторфенилового эфира β-бензилового эфира трет-бутилоксикарбониласпарагиновой кислоты добавляли к 6.0 мл охлажденного водного раствора, содержащего 0.72 г (4.0 ммоль) D-тирозина и 1.0 мл 1 М NaOH. После окончания реакции (12 ч) диоксан упаривали, реакционную смесь нейтрализовали до рН 4–5 9% лимонной кислотой. Продукт экстрагировали этилацетатом трижды по 5.0 мл. Этилацетатный раствор сушили над Na2SO4. После сушки этилацетат упаривали, а к маслообразному остатку добавляли 10.0 мл петролейного эфира. После сушки в вакууме над P2O5 получили 1.51 г (78%) кристаллического соединения (IV) с т. пл. 135–138°С, Rf 0.86 (В), 0.79 (Б).
Boc-Ala-Pro-OBzl (V). К раствору 1.21 г (5.0 ммоль) хлоргидрата бензилового эфира пролина в 5.5 мл DMF прибавляли 0.73 мл (6.0 ммоль) TEA. Реакционную смесь перемешивали в течение 20 мин и затем добавляли 0.94 г (5.0 ммоль) Вос-Ala-ОН. После охлаждения до 0°С в реакционный сосуд прибавляли последовательно 0.70 г (5.2 ммоль) HOBt и 1.23 г (6.0 ммоль) DCC. Реакционную смесь перемешивали в течение 3 ч при 0°С и 4 ч при комнатной температуре, осадок отфильтровывали, промывали на фильтре 1.0 мл DMF. В фильтрат добавляли 15.0 мл этилацетата, и полученный раствор промывали 9% раствором лимонной кислоты, 5% раствором NaHCO3, насыщенным раствором NaCl, водой, затем сушили над Na2SO4. После сушки этилацетат упаривали, а образовавшийся маслообразный остаток дважды переосаждали из эфира метанолом и сушили над Р2О5. После сушки в эксикаторе получили 1.58 г (84%) маслообразного соединения (V). Rf 0.93 (A), 0.74 (Б). Масс-спектр ESI, m/z: 276.93 [M – 100]+, 377.4 [M + H]+, 399.0 [M + Na]+.
Boc-DAla-Pro-OBzl (VI). К раствору 1.21 г (5.0 ммоль) хлоргидрата бензилового эфира пролина в 5.5 мл DMF прибавляли 0.73 мл (6.0 ммоль) TEA. Реакционную смесь перемешивали в течение 20 мин и затем добавляли 0.94 г (5.0 ммоль) Вос-DAla-ОН. После охлаждения до 0°С в реакционный сосуд прибавляли последовательно 0.70 г (5.2 ммоль) HOBt и 1.23 г (6.0 ммоль) DCC. Реакционную смесь перемешивали в течение 3 ч при 0°С и 4 ч при комнатной температуре. Очистку и выделение дипептида (VI) проводили аналогично описанному для соединения (V). Выход маслообразного продукта составил 1.45 г (77%). Rf 0.94 (A), 0.70 (Б). Масс-спектр ESI, m/z: 276.93 [M – 100]+, 377.40 [M + H]+, 399.00 [M + Na]+.
Boc-Asp(OBzl)-DTyr-Ala-Pro-OBzl (VII). К раствору 0.34 г (1.1 ммоль) хлоргидрата бензилового эфира аланилпролина (получен обработкой соединения (V) 4.5 М HCl в этилацетате) в 3.0 мл DMF добавляли 0.19 мл (1.4 ммоль) ТЕА, перемешивали в течение 20 мин и вносили 0.55 г (1.1 ммоль) соединения (IV). Охладив реакционную колбу до 0°С, в реакционный сосуд добавляли последовательно 0.13 г (1.1 ммоль) HOBt и 0.29 г (1,4 ммоль) DCC. Реакционную смесь перемешивали в течение 3 ч при 0°С и 10 ч при комнатной температуре. Очистку и выделение тетрапептида (VII) проводили как описано для соединения (V). Выход продукта составил 0.61 г (74%), т. пл. 86–89°С, Rf 0.93 (A), 0.74 (Б). Масс-спектр ESI, m/z: 643.68 [M – 100]+, 743.08 [M-H]+, 767.04 [M + Na]+.
Boc-Asp(OBzl)-DTyr-DAla-Pro-OBzl (VIII). К раствору 0.45 г (1.4 ммоль) хлоргидрата бензилового эфира D-аланил-пролина (получен обработкой соединения (VI) 4.5 М HCl в этилацетате) в 3.5 мл DMF добавляли 0.23 мл (1.7 ммоль) ТЕА, перемешивали в течение 20 мин и внесли 0.68 г (1.4 ммоль) соединения (IV). Охладив реакционную колбу до 0°С, в реакционный сосуд вносили последовательно 0.20 г (1.5 ммоль) HOBt и 0.35 г (1.7 ммоль) DCC. Реакционную смесь перемешивали в течение 3 ч при 0°С и 4 ч при комнатной температуре. Очистку и выделение тетрапептида (VIII) проводили как описано для соединения (V). Выход продукта составил 0.78 г (75%) с т. пл. 90–92°С, Rf 0.93 (A), 0.74 (Б). Масс-спектр ESI, m/z: 643.68 [M – 100]+, 743.08 [M – H]+, 767.04 [M + Na]+.
HCl · H-Asp-DTyr-Ala-Pro-OH (IX). Через раствор 0.22 г (0.3 ммоль) соединения (VII) в смеси 1.0 мл уксусной кислоты и 2.0 мл метанола пропускали в течение 2 ч ток водорода в присутствии катализатора – 2.5 мг палладиевой черни – при постоянном перемешивании. После деблокирования пептида (контроль ТСХ) катализатор отделяли фильтрованием, фильтрат упаривали, а к остатку добавляли 1.0 мл этилацетата и 1.7 мл 4.5 М раствора HCl в этилацетате. Перемешивали взвесь в течение 45 мин, растворитель упаривали, а остаток промывали этилацетатом, эфиром, сушили в эксикаторе над NaOH. Выход соединения (IX) составил 0.14 г (94%), Rf 0.90 (А), 0.82 (Б). По данным ВЭЖХ содержание целевого пептида (IX) – 96%. Масс-спектр ESI, m/z: 465.16 [M + H]+, 463.35 [M – Н]+, 929.54 [2M]+, 950.00 [2M – Н + Na]+. Данные аминокислотного анализа: Asp 1.06 (1), Ala 1.00 (1), DTyr 0.94 (1), Pro 1.02(1).
HCl · H-Asp-DTyr-DAla-Pro-OH (X). Получали аналогично соединению (IX). Выход тетрапептида (X) составил 0.16 г (82.5%) в перерасчете на 0.23 г (0.4 ммоль) исходного соединения (VIII), Rf 0.60 (А), 0.86 (Б). По данным ВЭЖХ содержание целевого пептида (X) – 98%. Масс-спектр ESI, m/z: 465.16 [M + H]+, 463.35 [M – Н]+, 501.35 [M + НCl]+, 929.54 [2M]+, 950.00 [2M – Н + Na]+. Данные аминокислотного анализа: Asp 1.04 (1), DAla 1.02 (1), DTyr 0.96 (1), Pro 0.98 (1).
Молекулярное моделирование
Построение пептидной последовательности экспериментальных пептидов в PDB-формате проводили в программе PyMol. Визуализацию комплекса лиганд-рецептор – в программе Chimera. Молекулярный докинг осуществляли в программе Chimera с помощью программного обеспечения AutodockVina. Для решения задач докинга использовали модели белковых молекул, находящиеся в базе данных NCBI [13]. Для изучения и анализа использовали следующие структуры: 1ILQ (комплекс IL-8 с цитокинсвязывающей областью CXCR-1), 1IKL (мономерная форма IL-8) и 1IL8 (димерная форма IL-8).
Иммуноферментный анализ
Поскольку концентрация IL-8 в плазме крови практически здоровых доноров низкая, проводили предварительную активацию продукции IL-8 нейтрофилами крови человека. Для этого к 2.0 мл цельной крови человека добавляли 1.0 мл дрожжевого экстракта (гликопротеин клеточной стенки пекарских дрожжей), инкубировали в течение 90 мин при 37°С, затем центрифугировали, отбирали надосадок, содержащий плазму крови с высокой концентрацией IL-8, и замораживали для дальнейших исследований. Для определения эффективности олигопептидов размораживали заготовленную заранее фракцию, содержащую плазму крови человека с IL-8 в концентрации >300.00 нмоль/мл. Затем в опытной пробе к 100 мкл фракции добавляли 100 мкл раствора олигопептида (1.0 мг/мл), в контрольной – к 100 мкл фракции добавляли 100 мкл 0.9% раствора NaCl. Инкубировали 1 ч при 37°С и 18 ч при 20°С (для достижения термодинамического равновесия). Изменение концентрации IL-8 оценивали методом ИФА до и после контакта надосадочной фракции с исследуемыми пептидами на спектрофотометре Bio-rad T100 Termal (США). Статистическую обработку и построение графиков проводили с помощью программы Statistica 10.0 и Graph PadPrism 6. Разницу считали статистически достоверной при р < 0.05. Все данные представлены медианой (25–75 квартили).
Список литературы
Pease J.E., Sabroe I. // Am. J. Respir. Med. 2002. V. 1. P. 19–25.
Caroline A.H., Baker J.B. // Cancer Investigation. 1993. V. 6. P. 743–750.
Baggiolini M., Clark-Lewis I. // FEBS Letter. 1992. V. 307. P. 97–101.
Baggiolini M. // J. Intern. Med. 2001. V. 250. P. 91–104.
Fujishima S., Sasaki J., Shinozawa Y., Takuma K., Kimura H., Suzuki M., Kanazawa M., Hori Sh., Aikawa N. // Intensive Care Med. 1996. V. 22. P. 1169–1175.
Charalampos P., Jean-Louis V. // Critical Care. 2010. V. 14. P. 1–18.
Bertini R., Allegretti M., Bizzarri C., Moriconi A., Locati M., Zampella G., Cervellera M.N., Di Cioccio V., Cesta M.C., Galliera E., Martinez F.O., Di Bitondo R., Troiani G., Sabbatini V., D’Anniballe G., Anacardio R., Cutrin J.C., Cavalieri B., Mainiero F., Strippoli R., Villa P., Di Girolamo M., Martin F., Gentile M., Santoni A., Corda D., Poli G., Mantovani A., Ghezzi P., Colotta F. // Proc. Natl. Acad. Sci. USA. 2004. V. 32. P. 11 791–11 796.
Collins J. M., Heery C.R., Donahue R.N., Palena C., Madan R.A., Strauss J., Gatti-Mays M.E., Schlom J., Gulley J.L., Bilusic M. // J. Clinical Oncology. Supp. 2018. V. 36. P. 3091.
Tekamp-Olson P., Mullenbach G., Wernette-Hammond M.E. Пaтeнт US, no. 6436390B1, 2002.
Якубке Х.-Д., Ешкайт Х. Аминокислоты, пептиды, белки: Пер. с нем. М.: Мир, 1985. 456 с. [Jakubke H.-D., Jeschkeit H. Aminosäuren Peptide Protein. Berlin: Academie, 1982].
Гершкович А.А., Кибирев В.К. Синтез пептидов. Реагенты и методы. Киев: Навукова думка, 1987. 264 с.
Крит Н.А., Филатова Н.П., Ковальчук О.В., Бесчастная Н.В. // Биоорган. химия. 1981. Т. 7. С. 965–970. [Krit N.A., Filatova M.P., Kovalchuk O.V. Beschastnaya N.V. // Russ. J. of Bioorganic Chem. 1981. V. 7. P. 965–970.]
Sotriffer C.A., Flader W., Winger R.H. Rode B.M., Liedl K.R., Varga J.M. // Methods. 2000. V. 20. P. 280–291.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия