Биоорганическая химия, 2020, T. 46, № 2, стр. 140-150
Особенности пространственной структуры мутантной формы L-аспарагиназы Wolinella succinogenes в комплексах с аспарагиновой и глутаминовой аминокислотами
В. И. Тимофеев 1, 2, Н. Е. Жухлистова 1, И. П. Куранова 1, 2
1 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
119333 Москва, Ленинский пр., 59, Россия
2 НИЦ “Курчатовский институт”
123098 Москва, пл. Академика Курчатова, 1, Россия
Поступила в редакцию 08.08.2019
После доработки 21.10.2019
Принята к публикации 31.10.2019
Аннотация
Мутантная форма L-аспарагиназы Wolinella succinogenes (WASm), содержащая две замены V23Q и K24T в N-концевой подвижной петле, ограничивающей активный центр, имеет на порядок меньшую глутаминазную активность по сравнению с исходным ферментом (WAS). Пространственная структура WASm определена для апо-формы и комплексов WASm c L-аспарагиновой и L-глутаминовой аминокислотами при разрешении 1.70, 1.65 и 2.0 Å соответственно. Аминокислотные остатки подвижной петли локализованы на картах электронной плотности только частично. В активных центрах тетрамерной молекулы фермента в соответствующих комплексах локализованы с полной заселенностью аспарагиновая и глутаминовая аминокислоты и описано их окружение; их расположение в исходном и мутантном ферменте совпадает. Описано состояние активных центров в исследованных молекулах. Показано, что во всех субъединицах апо-фермента WASm и комплекса WASm/Glu активный центр находится в открытой конформации, в то время как в комплексе WASm/Asp активные центры трех субъединиц закрыты, а одной – открыты. Сравнение строения комплексов исходного и мутантного фермента позволяет предположить, что уменьшение глутаминазной активности WASm вызвано увеличением подвижности остатков N-концевой петли, что затрудняет образование каталитически активной закрытой формы при связывании менее специфичного субстрата (глутамина).
ВВЕДЕНИЕ
Белки семейства аспарагиназ, широко распространенные среди микроорганизмов, относятся к классу амидогидролаз (КФ 3.5.1.1) и катализируют гидролиз аспарагина до аспарагиновой кислоты и аммиака [1]. При физиологических условиях эта реакция практически необратима. Большинство известных бактериальных аспарагиназ способно также гидролизовать L-глутамин с активностью, в некоторых случаях сравнимой с аспарагиназной [2, 3].
Замечательной особенностью L-аспарагиназ является их ярко выраженная антиопухолевая активность, связанная с тем, что в ряде опухолевых клеток отсутствует фермент аспарагинсинтетаза, вследствие чего этот тип клеток не способен синтезировать аспарагин и зависит от доставки данной аминокислоты из внешних источников [4, 5]. Поэтому ряд представителей семейства L-аспарагиназ (E. coli, E. chrisanthemi, E. сarotovora) находит широкое применение в качестве эффективных противоопухолевых агентов при лечении острых лимфобластных лейкозов, лимфо- и ретикулосарком [6, 7]. Однако антиопухолевая активность аспарагиназ сопровождается рядом побочных эффектов. Существенным недостатком аспарагиназ в качестве медицинских препаратов является их токсичность, частично связанная с присутствием глутаминазной активности. L-Глутамин играет важную роль в транспорте азота в крови, и длительное отсутствие этой аминокислоты при аспарагиназной терапии приводит к серъезным нарушениям в организме. Другим недостатком препарата аспарагиназ является относительно низкая стабильность фермента в условиях применения [8, 9].
L-Аспарагиназа Wolinella succinogenes (WAS) отличается от ферментов из E. coli и E. chrisanthemi предельно низкой глутаминазной активностью, демонстрирует низкие побочные эффекты и высокую антиопухулевую активность, что делает ее наиболее пригодной для создания на ее основе оптимального фермента для медицинского применения [10–14].
Е.П. Санниковой и др. были проведены эксперименты по созданию на основе WAS аспарагиназы, сочетающей низкую иммуногенность с продолжительным действием [15]. Введением двух мутаций (V23Q, K24T) в N-концевую подвижную петлю молекулы WAS, ограничивающую активный центр и содержащую два каталитически важных остатка (Thr14, Tyr27), был получен фермент, устойчивый к действию трипсина (в данной работе обозначен как WASm) [15]. Мутантный фермент практически полностью сохранил исходную аспарагиназную активность, имел большую устойчивость к трипсину, а его глутаминазная активность оказалась на порядок ниже исходной [15].
В настоящей работе, с целью исследования особенностей строения мутантной формы, приводящих к изменению соотношения глутаминазной и аспарагиназной активности, были установлены пространственные структуры аспарагиназы WASm в апо-форме и в комплексах с продуктами реакции: L-аспарагиновой и L-глутаминовой кислотами. Проведен анализ полученных структур и их сравнение с соответствующими структурами исходной формы фермента WAS.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Пространственная структура L-аспарагиназы Wolinella succinogenes, установленная в 1996 г., была первой для бактериальных L-аспарагиназ [16]. В настоящее время пространственные структуры аспарагиназ, в том числе и в комплексах с продуктами реакции – L-аспарагиновой и L-глутаминовой аминокислотами – известны для ферментов из разных источников [17–21]. Недавно была установлена пространственная структура комплексов с продуктами реакции для двух форм L-аспарагиназы W. succinogenes, которые отличаются только одной заменой в полипептидной цепи (WASPro121 и WASSer121), но имеют разную глутаминазную активность [22].
Интерес к изучению структуры и функции L-аспарагиназ в значительной степени связан с широким применением этих белков в медицине. Однако задача получения идеального фермента, обладающего повышенной устойчивостью и минимальной токсичностью, частично связанной с побочной глутаминазной активностью, до сих пор не решена.
На рис. 1 приведено сравнение аминокислотных последовательностей ряда аспарагиназ. В ферменте, рассматриваемом в данной работе (WASm), аминокислотные остатки валина и лизина в положениях 23 и 24 заменены соответственно на глутамин и треонин. Аминокислотные последовательности аспарагиназ очень схожи и содержат консервативный участок TGGTIAG на N-конце молекулы. N-Концевые аминокислотные остатки (12–40 в WAS) образуют подвижную петлю, ограничивающую активный центр. В подвижной петле расположены два остатка, принимающие участие в катализе. В аспарагиназе W. succinogenes это Thr14 и Tyr27 [16].
Предполагается [5, 17], что гидролиз амидной связи осуществляется посредством нуклеофильной атаки амидного атома углерода аспарагина гидроксильной группой треонина (Thr14 для WAS) с образованием ацилированного фермента и последующим гидролизом промежуточного соединения молекулой воды, связанной в активном центре [5, 17]. Расположенный в петле консервативный остаток тирозина (Tyr27 в WAS) поддерживает ориентацию треонина, оптимальную для нуклеофильной атаки. Большая часть аминокислотных остатков активного центра, участвующих в связывании субстрата, расположены в строго фиксированных участках полипептидной цепи, в то время как ограничивающая активный центр петля (остатки 12–40) изменяет свое положение в процессе катализируемой реакции, обеспечивая переход между открытой и закрытой конформациями активного центра. При закрытой конформации каталитически важный остаток треонина сближается с субстратом, в то время как в открытом состоянии активного центра остаток треонина удаляется от субстрата, вследствие чего реакция прекращается. Таким образом, на последовательных стадиях катализируемой реакции подвижная петля закрывает активный центр, приближая атакующий нуклеофил к субстрату (закрытая активная конформация) или открывает его после гидролиза амидной связи, способствуя удалению образовавшегося продукта реакции.
До недавнего времени низкую по сравнению с аспарагиназной глутаминазную активность фермента связывали преимущественно с пространственными затруднениями, возникающими при связывании глутамина, имеющего больший объем по сравнению со специфическим субстратом – аспарагином. В работе [22] было показано, что глутаминазная активность L-аспарагиназы W. succinogenes зависит от природы аминокислотного остатка в положении 121. Две формы аспарагиназы, отличающиеся только этим остатком (WASPro121 и WASSer121), на порядок различаются по глутаминазной активности, несмотря на то, что остаток 121 не каталитический и не взаимодействует со связанным субстратом непосредственно. Авторы показали, что в WASPro121 закрытое состояние фермента дополнительно стабилизировано из-за CH/π-взаимодействия колец пролина 121 и каталитического тирозина [22, 23]. В результате повышается стабильность закрытой конформации активного центра и вероятность ее образования при связывании менее специфического субстрата глутамина, что и приводит к более высокой глутаминазной активности.
Е.Р. Санниковой и др. [15] в экспериментах по инженерии фермента, устойчивого к действию трипсина, на основе L-аспарагиназы Wolinella succinogenes (WAS, идентична WASPro121) было обнаружено, что замена двух аминокислотных остатков – V23Q и K24T в ограничивающей активный центр подвижной петле – не только обеспечивает бóльшую устойчивость фермента к гидролизу трипсином, но и на порядок уменьшает его глутаминазную активность, несмотря на присутствие пролина в положении 121. Мутантная форма L-acпарагиназы WASPro121, содержащая замены V23Q и K24T, обозначена здесь как WASm.
Чтобы исследовать возможные причины понижения глутаминазной активности при замене двух аминокислотных остатков в подвижной петле и проследить влияние замен на конформацию активного центра, мы установили пространственные структуры WASm в апо-форме и в комплексах c L-аспарагиновой и L-глутаминовой аминокислотами – WASm/Asp и WASm/Glu. Кристаллы вырастили методом диффузии паров растворителя; дифракционные наборы собрали на источнике синхротронного излучения SPring 8 [25].
Кристаллы апо-формы и обоих комплексов фермента, принадлежащие к пространственной группе Р21, содержали тетрамерную молекулу фермента в независимой части ячейки. Пространственные структуры апо-формы и обоих комплексов WASm установлены методом молекулярного замещения с использованием в качестве модели координат L-аспарагиназы Wolinella succinogenes (PDB_ID: 1WSA). Статистические параметры уточнения приведены в табл. 1.
Таблица 1.
Статистические характеристики набора и уточнения структур аспарагиназы в апо-форме и в комплексах с аспарагиновой и глутаминовой кислотами
| PDB ID | 6RUD | 6RUE | 6RUF |
|---|---|---|---|
| Разрешение, Å | 30.0–1.7 (1.74–1.7)* | 30.0–1.65 (1.69–1.65) | 30.0–2.0 (2.07–2.0) |
| Количество рефлексов | 119 054 (8759) | 138668 (10 211) | 76386 (5543) |
| Rcryst, % | 16.2 (17.2) | 16.9 (20.0) | 21.5 (26.4) |
| Rfree, % | 19.4 (20.4) | 19.9 (24.7) | 25.9 (31.1) |
| Средний B-фактор, A2 | 10.97 | 17.17 | 18.59 |
| Количество уточненных атомов | |||
| Белка | 9469 | 9412 | 9466 |
| Растворителя | 969 | 770 | 413 |
| Лигандов | – | 36 | 40 |
| RMS | |||
| По длинам связей, Å | 0.012 | 0.012 | 0.007 |
| По углам, град | 1.747 | 1.768 | 1.529 |
| Карта Рамачандрана | |||
| Наиболее благоприятные области, % | 98.5 | 99.0 | 98.0 |
| Допустимые области, % | 1.5 | 1.0 | 2.0 |
| Запрещенные области, % | 0.0 | 0.0 | 0.0 |
Гомотетрамерная молекула WASm (а именно эта форма фермента обладает биологической активностью) показана на рис. 2. При совмещении субъединиц тетрамера по Cα-атомам среднеквадратичное отклонение между субъединицами незначительно и колеблется от 0.08 до 0.117 Å. Молекула состоит из двух димеров, каждый из которых содержит два полностью сформированных активных центра (так называемые интимные димеры, в WASm это димеры AC и BD). Каждый активный центр включает аминокислотные остатки из обеих субъединиц димера.
Рис. 1.
Сравнение последовательностей некоторых бактериальных L-аспарагиназ. Стрелками и спиралями указаны соответствующие элементы вторичной структуры в L-аспарагиназе WASm.

Рис. 2.
Тетрамерная молекула мутантной формы L-аспарагиназы W. succinogenes (WASm). Темно-серым и светло-серым цветом обозначены два интимных домена, содержащих полностью сформированные активные центры. Сферами показан связанный в активных центрах лиганд (аспарагиновая кислота).

Как и в большинстве пространственных структур L-аспарагиназ, не все аминокислотные остатки подвижной петли были локализованы на картах электронной плотности. Не были локализованы и остатки Glu23 и Thr24, где произведены замены, а также каталитически важный остаток тирозина (Tyr27). Однако предполагаемый нуклеофил – Thr14 – виден во всех структурах.
Лиганды – L-аспарагиновая и L-глутаминовая аминокислоты, связанные в активных центрах соответствующих комплексов WASm/Asp и WASm/Glu, – локализованы с полной заселенностью (рис. 3). Конформация активного центра в каждой из субъединиц обоих комплексов была охарактеризована на основе анализа ближайшего окружения связанных лигандов.
Рис. 3.
Молекулы аспарагиновой (а) и глутаминовой (б) кислот, локализованные в активном центре L-аспарагиназы WASm. Электронная плотность рассчитана с коэффициентами |Fo|–|Fc| при σ = 2. Лиганд был исключен при расчете карт электронной плотности.

На рис. 4а, 4б показана аспарагиновая кислота в активных центрах субъединиц А и С интимного димера АС комплекса WASm/Asp. В обеих субъединицах в связывании кислородов α-карбоксильной группы участвуют атом азота основной цепи и γ-гидроксил Ser60. α-Аминогруппа лиганда, являющаяся главным детерминантом специфичности аспарагиназ, имеет водородную связь с карбонильным кислородом Gln61 и карбоксильной группой Asp94. В связывании α-аминогруппы участвует также карбоксильная группа Glu287 из соседней субъединицы димера.
Рис. 4.
Окружение лигандов в активном центре комплексов WASm с аспарагиновой (WASm/Asp) и глутаминовой (WASm/Glu) кислотой. (а) L-Аспартат в субъединице А (открытая конформация), (б) в субъединице С (закрытая конформация); (в) L-глутамат в субъединице А WASm/Glu (открытая конформация). Лиганды показаны утолщенными черными линиями. Черные сферы – молекулы воды. Светло серым показан аминокислотный остаток Thr14.
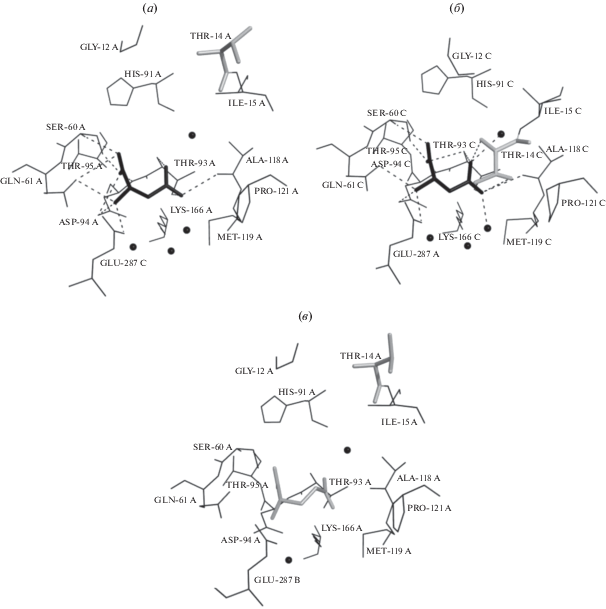
β-Карбоксильная группа связана с азотом основной цепи Ala118. Главное отличие в окружении лигандов в разных субъединицах касается расстояния между каталитически важным остатком треонина Thr14 и лигандом. В субъединице С, также как и в субъединицах B и D комплекса WASm/Asp, расстояние между OD2 атомом β‑карбоксильной группы аспарагиновой кислоты и OG1_Thr14 составляет 3.08 Å, т.е. лиганд и остаток треонина находятся на расстоянии водородной связи. В субъединице А соответствующее расстояние составляет 12.3 Å. Известно, что близкое расположение Thr14 и лиганда наблюдается только при закрытой конформации активного центра [22, 24]. Следовательно, в субъединицах В, C и D комплекса WASm/Asp активный центр находится в закрытой конформации и только в субъединице А – в открытой.
При совмещении субъединицы А комплекса WASm/Asp последовательно со всеми субъединицами комплекса WASm/Glu оказалось, что окружение глутаминовой кислоты во всех четырех активных центрах этого комплекса практически совпадает с окружением аспарагиновой кислоты в субъединице А, имеющей открытую конформацию активного центра, хотя из-за большего объема глутаминовой кислоты расстояния между лигандом и группами ближайшего окружения в двух комплексах несколько отличаются (рис. 4в). При этом расстояние между атомами OE1_Glu и OG1_Thr14Å во всех субъединицах превышает 12 Å, что говорит об открытой конформации активного центра в данном комплексе. Показано также, что все активные центры в апо-ферменте WASm находятся в открытой конформации.
Таким образом, в мутантном ферменте WASm, как и в других аспарагиназах, образование закрытой конформации активного центра при связывании глутаминовой кислоты и глутамина затруднено.
Установленное состояние активных центров подтверждается и сравнением данных структур со структурами комплексов L-аспарагиназы WAS (WASPro121и WASSer121), описанными в работе [22], где впервые на картах электронной плотности были локализованы все аминокислотные остатки подвижной петли. В подвижной петле авторы выделили три ключевых шарнирных аминокислотных остатка Gly12, Ile15, Thr33, которые обеспечивают повороты этого участка полипептидной цепи и контролируют переходы между открытой и закрытой конформациями активного центра. Два первых остатка входят в консервативную для аспарагиназ последовательность TGGTIAG. Первый шарнирный остаток Gly12 позволяет петле поворачиваться к лиганду или от него. Около Ile15, который действует как внешний шарнир, полипептидные цепи в открытой и закрытой формах встречаются и снова расходятся у следующего остатка.
На рис. 5а, 5б показаны участки N-концевой подвижной петли в совмещенных по Сα-атомам структурах исходной L-аспарагиназы (WAS) и мутантного фермента WASm, представляющих соответственно закрытую (а) и открытую (б) конформации петли. Несмотря на то, что в мутантном ферменте WASm ряд аминокислотных остатков петли не локализован, первый и второй реперные остатки, Gly12 и Ieu15, где меняет направление полипептидная цепь, следуя далее по открытому либо закрытому пути, хорошо видны. Как представлено на рис. 5, после реперного остатка Ieu15 направление полипептидной цепи в мутантном ферменте меняется и следует по направлению, приводящему соответственно к закрытой (a) и открытой (б) конформации активного центра.
Рис. 5.
Участки подвижных петель в совмещенных по Сα-атомам субъединицах соответствующих комплексов исходной (WSA) и мутантной (WSAm) L-аспарагиназы (а): WAS/Аsp и субъединица С WASm/Аsp (закрытые конформации); (б): WAS/Glu и субъединица А WASm/Glu (открытые конформации).

Сравнение структур комплексов мутантного фермента с соответствующими структурами исходной L-аспарагиназы (WAS), где локализованы все аминокислотные остатки подвижной петли, показывает, что замены в WASm расположены на участке, достаточно удаленном от связанного лиганда: расстояния между Сα-атомами Val23, Lys24 и ближайшим атомом кислорода β-карбоксильной группы аспарагиновой кислоты при закрытой конформации петли равны соответственно 16.00 и 14.65 Å. Следовательно, введенные замены не могут влиять на глутаминазную активность, непосредственно взаимодействуя с субстратом. Однако замены могут оказывать влияние на степень подвижности петли, поскольку изменяется характер взаимодействия остатков в положении 23 и 24 с ближайшим окружением.
Мутации остатков 23 и 24 были промоделированы с использованием координат L-аспарагиназы WAS. На рис. 6а–6г показано взаимодействие с ближайшим окружением остатков 23 и 24 в исходном ферменте и в модели мутантного фермента при открытой и закрытой конформации активного центра. Видно, что характер взаимодействия боковых цепей остатков 23 и 24 с ближайшим окружением в исходном и мутантном ферменте различны. Так, в закрытой форме при замене V23 на Q23 наблюдается короткий контакт (1.6 Å) с A43 из соседней субъединицы (рис. 6г), что делает невыгодной такую закрытую конформацию петли. Кроме того, после введения замен V23Q, K24T существенно меняется и электростатический потенциал поверхности на данном участке (рис. 7а–7б).
Рис. 6.
Ближайшее окружение (≥4 Å) фрагмента петли 21–26, содержащего аминокислотные остатки 23 и 24, в исходной и мутантной формах L-аспарагиназы W. succinogenes: (а, в) открытая конформация, (б, г) закрытая конформация. Остатки 23 и 24 обозначены утолщенными линиями черного цвета. Серым цветом показаны аминокислотные остатки из соседней субъединицы. Серые сферы – молекулы воды.

Рис. 7.
Электростатический потенциал поверхности в окружении аминокислотных остатков 23 и 24 при открытой (слева) и закрытой (справа) конформации активного центра: (а) в исходном ферменте WAS, (б) в модели мутантного фермента WASm. Участки с отрицательным потенциалом обозначены черным, участки с положительным потенциалом – серым цветом. Шкала оттенков представлена в единицах kT/e в интервале от −10 до +10.

Таким образом, перечисленные факторы могут увеличить подвижность гибкой петли в мутантном ферменте и тем самым затруднить образование закрытой конформации активного центра в присутствии глутамина, испытывающего стерические препятствия при связывании. Об увеличении подвижности петли после введения замен можно судить и по отсутствию на картах электронной плотности WASm консервативного остатка тирозина (Tyr27), обычно хорошо определяемого в структурах аспарагиназ. Возможно, большая подвижность каталитически важного остатка тирозина препятствует СН/π-взаимодействию между ароматическим кольцом тирозина и атомами водорода пролина 121. Отсутствие такого взаимодействия дестабилизирует закрытую форму и приводит к уменьшению глутаминазной активности мутантного фермента. Более точно определить поведение аминокислотных остатков подвижной петли в мутантном ферменте предполагается с использованием метода молекулярной динамики.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Мутантная L-аспарагиназа V23Q, L24T (WASm) получена, как описано в [15, 16].
Кристаллы апо-формы и комплексов WASm с L-аспарагиновой и L-глутаминовой аминокислотами выращены cокристаллизацией в присутствии соответствующих лигандов методом диффузии паров растворителя в висячей капле, как описано в [25]. Все кристаллы принадлежали пространственной группе Р21 и содержали одну тетрамерную молекулу фермента в независимой части ячейки. Дифракционные наборы экспериментальных данных от предварительно замороженных кристаллов свободного фермента и его комплексов были собраны в токе паров азота при температуре 100 К на источнике синхротронного излучения SPring-8 (Япония), как описано в [16].
Структуры аспарагиназы в апо-форме и в комплексах с L-аспарагановой и L-глутаминовой кислотами решены методом молекулярного замещения с использованием программы Phaser [26] и координат аспарагиназы (PDB_ID: 1WSA) в качестве стартовой модели. Для уточнения структуры использовали программу Refmac [27]. Ручную правку моделей проводили при помощи программы Coot [28], используя карты электронной плотности, рассчитанные с коэффициентами 2|Fo|–|Fc| и |Fo|–|Fc|. На картах электронной плотности локализованы молекулы воды, а в активных центрах комплексов на разностных синтезах найдена электронная плотность, соответствующая аспарагиновой или глутаминовой кислоте (рис. 1а, 1б). На картах электронной плотности во всех структурах не были локализованы аминокислотные остатки 1–2, в структуре апо-формы в соответствующих субъединицах аминокислотные остатки 18А-27А, 21В-27В, 18С-28С, 20D-28D; в комплексе с аспарагиновой кислотой – остатки 18А-27А, 18В-31В, 18С-30С, 20D-30D; в комплексе с глутаминовой кислотой – остатки 19–29 (субъединицы А, B, D), 17С-27С.
Статистические характеристики уточнения приведены в табл. 1. Координаты атомных моделей депонированы в Международный банк белковых данных (PDB_ID: 6RUD, 6RUE, 6RUF).
Анализ и сравнение пространственных структур проводили с использованием программ COOT, LSQ из пакета CCP4, PISA, PyMol [19–22]. Межмолекулярные и межсубъединичные контакты были определены с использованием программы CONTACT комплекса ССР4 и PISA [29, 30]. Моделирование замен 23 и 24-го остатков было проведено программой PyMol на основе координат исходного фермента [31]. Электростатический потенциал поверхности в окружении аминокислотных остатков 23 и 24 в открытой и закрытой конформации активного центра определен программой PyMol с использованием метода, описанного в [32].
Список литературы
Howard J.B., Carpenter F.J. // J. Biol. Chem. 1972. V. 217. P. 1020–1030.
Lubkowski J., Wlodawer A., Ammon H.L., Copeland T.D., Swain A.L. // Biochemistry. 1994. V. 33. P. 10 257–10 265.
Lubkowski J., Wlodawer A., Housset D., Weber T., Ammon H.L., Murphy K.C., Swain A.L. // Acta Crystallog. D. 1994. V. 50. P. 826–832.
Broom J.D. // J. Exp. Med. 1968. V. 127. P. 1055–1072.
Rohm K.H., Van Etten R.L. // Arch. Biochem. Biophys. 1986. V. 244. P. 128–136.
Mc Credie K.B., Ho D.H., Freireich E.J. // CA. Cancer J. Clin. 1953. V. 23. P. 220–227.
Chen S.-H. // Pediatr. Neonatol. 2014. V. 56. P. 1–7.
Parmentier J.H., Maggi M., Tarasco E., Scotti C., Avramis V.I., Mittelman S.D. // Leuk. Res. 2015. V. 39. P. 757–762.
Warrell R.P., Chou T.C., Gordon C., Tan C., Roberts J., Sternberg S.S., Philips F.S., Young C.W. // Cancer Res. 1980. V. 40. P. 4546–4551.
Durden D.L., Distasio J.A. // Cancer Research. 1980. V. 40. P. 1125–1129.
Durden D.L., Distasio J.A. // International Journal of Cancer. 1981. V. 27. P. 59–65.
Van den Berg H. // Leuk. Lymphoma. 2011. V. 52. P. 168–178.
Covini D., Tardito S., Bussolati O., Chiarelli L.R., Pasquetto M.V., Digilio R., Valentini G., Scotti C. // Recent Patents on Anti-Cancer Drug Discovery. 2012. V. 7. P. 4–13.
Shrivastava A., Khan A.A., Khurshid M., Kalam M.A., Jain S.K., Singhal P.K. // Critical Reviews in Oncology/Hematology. 2015. V. 100. P. 1–10.
Sannikova E.P., Bulushova N.V., Cheperegin S.E.,Gubaydullin I.I., Chestukhina G.G., Ryabichenko V.V., Zalunin I.A., Kotlova E.K., Konstantinova G.E., Kubasova T.S., Shtil A.A., Pokrovsky V.S., Yarotsky S.V., Efremov B.D., Kozlov D.G. // Mol. Biotechnol. 2016. V. 58. P. 528–539.
Lubkowski J., Palm G.J., Gilliland G.L., Derst Ch., Rohm K.H., Wlodawer K.-H.A. // Eur. J. Biochem. 1996. V. 241. P. 201–207.
Aghaiypour K., Wlodawer A., Lubkowski J. // Biochemistry. 2001. V. 40. P. 5655–5664.
Nguyen H.A., Su Y., Lavie A. // J. Biol. Chem. 2016. V. 291. P. 17 664–17 676.
Krasotkin Ju., Borisiva A.A., Gervaziev Yu.V., Sokolov N.N. // Biotechnol. Appl. Biochem. 2004. V. 39. P. 215–221.
Kravchenko O.V., Kislitsin Yu.A., Popov A.N., Nikonov S.V., Kuranova I.P. // Acta Cryst. 2008. V. D64. P. 248–256.
Miller M., Rao J.K.M., Wlodawer A., Gribskov M.R. // FEBS Lett. 1993. V. 328. P. 275–279.
Nguyen H.A., Durden D.L., Lavie A. // Scientific Reports. 2017. 7:41643.
Palm G.J., Lubkowski J., Derst C., Schleper S., Rohm K.H., Wlodawer A. // FEBS Lett. 1996. V. 390. P. 211–216.
Zondlo N.J. // Acc. Chem. Res. 2013. V. 46. P. 1039–1049.
Тимофеев В.И., Булушова Н.В., Жухлистова Н.Е., Куранова И.П. // Кристаллография. 2019. Т. 64. С. 897–900.
McCoy A.J., Grosse-Kunstleve R.W., Adams P.D., Winn M.D., Storoni L.C., Read R.J. // J. Appl. Cryst. 2007. V. 40. P. 658–674.
Murshudov G.N., Vagin A.A., Dodson E.J. // Acta Cryst. D. 1997. V. 53. P. 240–255.
Emsley P., Cowtan K. // Acta Cryst. D. 2004. V. 60. P. 2126–2132.
Collaborative Computational Project, Number 4. “The CCP4 Suite: Programs for Protein Crystallography” // ActaCryst. D. 1994. V. 50. P. 760–763.
Krissinel E., Henrick K. // J. Mol. Biol. 2007. V. 372. P. 774–797.
Schrödinger LLC. // The PyMOL Molecular Graphics System. Version 1.8. 2015.
Baker N.A. // Methods in Enzymology. 2004. V. 383 P. 94–118.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


