Биоорганическая химия, 2020, T. 46, № 2, стр. 189-200
Исследование фототоксического эффекта новых замещенных производных фуродигидрохинолина – потенциальных средств для фототерапии псориаза
Е. Н. Ходот 1, А. Б. Шевелев 2, 3, А. В. Шибаева 2, М. С. Смирнова 3, Н. В. Позднякова 4, О. О. Рябая 4, Е. С. Богданова 3, М. А. Гусева 3, В. А. Волнухин 5, В. А. Кузьмин 2
1 Институт органической химии имени Н.Д. Зелинского РАН
119991 Москва, Ленинский пр., 47, Россия
2 Институт биохимической физики имени Н.М. Эмануэля РАН
119334 Москва, ул. Косыгина, 4, Россия
3 Институт общей генетики имени Н.И. Вавилова РАН
117971 Москва, ул. Губкина, 3, Россия
4 Российский онкологический научный центр имени Н.Н. Блохина
115478 Москва, Каширское ш., 24, Россия
5 Московский научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения города Москвы
119071 Москва, Ленинский пр., 17, Россия
Поступила в редакцию 20.09.2019
После доработки 31.10.2019
Принята к публикации 14.11.2019
Аннотация
Ранее нами был предложен способ синтеза триметилзамещенного фуродигидрохинолина (ФДГХ) – нового потенциального фотосенсибилизатора для лечения псориаза методом фотохимиотерапии (ФХТ). Предполагалось, что ФДГХ способен заменить используемые в настоящее время производные псораленов: 8-метоксипсорален (8-МОП), 5-метоксипсорален (5-МОР) и триметилпсорален (ТМП). Преимуществом ФДГХ перед псораленами является его большая безопасность для больного. Однако практическое применение ФДГХ оказалось невозможным в связи с недостаточной растворимостью его в разрешенных к клиническому применению растворителях. Для решения этой проблемы был выполнен синтез шести ранее неизвестных производных ФДГХ с боковыми заместителями в 5 положении бензольного ядра, повышающими растворимость соединения: с карбаматной, ацетамидной и сульфогруппами: N-(6,8,8-триметил-8,9-дигидрофуро[3,2-h]хинолин-5-ил)ацетамид (W); трет-бутил (6,8,8-триметил-8,9-дигидрофуро[3,2-h]хинолин-5-ил)карбамат (К); трет-бутил ацетил (6,8,8-триметил-8,9-дигидрофуро[3,2-h]-хинолин-5-ил)-карбамат (WK); N-метил-N-(6,8,8-триметил-8,9-дигидрофуро[3,2-h] хинолин-5-ил) ацетамид (WС1); N-октил-N-(6,8,8-триметил-8,9-дигидрофуро[3,2-h] хинолин-5-ил) ацетамид (WС8); ацетил (6,8,8-триметил 8,9-дигидрофуро[3,2-h]хинолин-5-ил сульфамат натрия (S). Полученные на клеточных моделях T-клеточного лимфолейкоза (Jurkat), В-клеточной лимфомы (Raji) и иммортмализованных фибробластах человека данные показали наличие оптимальных фотосенсибилизирующих свойств у соединения S. По соотношению темновой и световой токсичности (облучение светом UVB диапазона с длиной волны 302 нм) на модельных линиях оно может рассматриваться в качестве кандидата на создание нового эффективного и безопасного соединения для фототерапии псориаза.
ВВЕДЕНИЕ
Псориаз представляет собой системное хроническое заболевание, встречающееся примерно у 2% представителей населения Земли [1]. Наиболее распространенной формой заболевания является обыкновенный (вульгарный) псориаз, на долю которого приходится 85–90% всех выявленных случаев [2].
Заболевание имеет системный характер: поражается не только кожа, но и суставы. Поражение кожи при псориазе характеризуется появлением очагов воспаления и гиперплазии эпидермиса. Одним из характерных патоморфологических признаков поражения кожи при обыкновенном псориазе является инфильтрация дермы лимфоцитами и нейтрофилами [3].
Предполагается, что в формировании псориатических высыпаний принимают участие кератиноциты, дендритные клетки, моноциты (макрофаги), нейтрофилы, тучные клетки и Т-лимфоциты типа Th-17 и Th-1 [4]. Псориаз нередко рассматривают в качестве аутоиммунного заболевания, индуктором которого служит перенесенная бактериальная инфекция. При этом в качестве кандидатных аутоантигенов называют антибактериальные пептиды кателицидин (LL37), β-дефензины (hBD2 и hBD3), а также лизоцим, экспрессируемые лимфоцитами типа Th-17 (ключевой компонент антибактериального ответа на прорыв бактериальных патогенов через базальную мембрану), а в качестве ключевого сигнального фактора – IL-22, представляющий собой один из основных регуляторов местного ответа на бактериальную инфекцию [5]. Показано, что стимуляция дендритных клеток больных псориазом катионными антибактериальными пептидами LL37, hBD2 и hBD3 в культуре повышает уровень экспрессии в них рецептора TLR9, что делает их более чувствительными к активации внеклеточной ДНК.
В работе [6] приводятся данные, полученные на модели трансгенных мышей, экспрессирующих ген фактора роста TGF-β1 человека, который в норме характерен исключительно для дермы. У этих животные наблюдаются поражения кожи, сходные с симптомами псориаза у человека. В частности, у них образуются субэпидермальные скопления лимфоцитов типа Th-17. Авторы высказывают гипотезу о том, что TGF-β1, в краткосрочных экспериментах проявляющий противовоспалительную активность, при длительном воздействии на лимфоциты типа Treg (отвечающие за поддержание иммунологической толерантности в отношении собственных антигенов) способен индуцировать их трансформацию в лимфоциты типа Th-17. Этот факт убедительно доказывает важную роль TGF-β1 в развитии псориаза. Авторы рассматривают также важную роль в развитии псориаза таких цитокинов, как IL-23 (продуцируется дендритными клетками миелоидного ряда), IL-17 и IL-22 (продукты лимфоцитов типа Th-17), IL-12, IFN-γ и TNF-α (продукты лимфоцитов типа Th-1).
Хотя псориаз считается заболеванием, опосредованным Т-клетками, некоторые авторы ставили вопрос о роли В-клеток в индукции этого заболевания. Авторы [7] сообщают о более высоком уровне B-клеток с фенотипом CD19+ в периферической крови пациентов с псориазом, по сравнению с пациентами без патологии. Более того, доля таких клеток положительно коррелировала с тяжестью заболевания. Однако, в исследовании, опубликованном в 2018 г. Томасом и др., сделан вывод, что повышение доли В-клеток в циркуляции является лишь эпифеноменом, который не должен рассматриваться в качестве этиотропного фактора развития псориаза [8].
Интересно, что ряд исследований показывает ключевую роль фибробластов кожи в инициации эпидермальных аномалий, наблюдаемых при псориатических поражениях [9, 10]. Так в работе [10] описывается роль фибробластов в дифференцировке кератиноцитов. На различных экспериментальных моделях показано, что фибробласты из пораженных псориатическими бляшками участков кожи, а в меньшей мере, фибробласты из непораженных участков кожи от пациентов с псориазом выделяют растворимый фактор, способствующий гиперплазии и гиперпродукции кератина кератиноцитами, повышению в них уровня экспрессии фактора внутриклеточного фактора STAT3 [10]. Кроме того, было обнаружено снижение активности cAMP-зависимой протеинкиназы [11, 12] и повышение активности супероксиддисмутазы (SOD) в фибробластах пациентов с псориазом, по сравнению с фибробластами здоровых доноров [13].
Одним из широко распространенных методов лечения псориаза является ФХТ (синоним PUVA-терапия – сокращение от “psoralen – ultraviolet A”), основанная на сочетанном использовании псораленовых фотосенсибилизаторов длинноволнового ультрафиолетового излучения (UVA) с длиной волны 320–400 нм. Реже псораленовые фотосенсибилизаторы сочетают с облучением кожи средневолновым ультрафиолетовым излучением (UVB) [14]. Помимо псориаза ФХТ применяется для лечения таких заболеваний кожи, как витилиго, склеродермия, грибовидный микоз, красный плоский лишай, реакция “трансплантат против хозяина” и др. [15]. Псоралены применяются перорально, местно путем нанесения на пораженные участки кожи крема или спиртового раствора, а также в виде ванн с водным раствором. Облучению могут подвергаться либо отдельные области тела, либо весь кожный покров. Используется также принцип фотофереза, представляющего собой экстракорпоральное облучение полученной от больного лейковзвеси (после предварительного введения псораленового фотосенсибилизирующего препарата) с последующим ее возвратом в кровоток.
Псоралены впервые были обнаружены в растениях, в частности в Ammi majus L. (Apiaceae). В настоящее время в фармакопею входят псорален-содержащие лекарственные средства как растительного (например, препарат Аммифурин производства ЗАО Фармцентр ВИЛАР), так и синтетического происхождения (препараты Оксорален и Меланоцил, Franco-Indian Pharmaceuticals Pvt Ltd).
Псоралены представляют собой линейные трициклические ароматические соединения класса кумаринов, состоящие из фуранового пятичленного цикла, конденсированного с кумариновым бициклом, содержащим гетероатомы азота и кислорода. Основными псораленами, используемыми в настоящее время в клинической практике, являются 8-метоксипсорален (8-МОР), 5‑метоксипсорален (5-МОР) и 4,5',8-триметилпсорален (ТМР) [16].
В ряде исследований установлено подавление пролиферации кератиноцитов и лимфоцитов периферической крови у больных, подвергавшихся облучению UVA после сенсибилизации 8-MOP [17–19].
В работе [18] показали, что ФХТ уменьшает инфильтрацию кожи иммунными клетками, в том числе T-клеток, несущих рецептор IL-2 (CD25). Сайто и соавт. [20] утверждают, что ФХТ применением 8-МОР в виде погружения в ванну с 0.0001% водным раствором вещества вызывает массированный выход из лимфоузлов в кровоток лимфоцитов типа Treg с фенотипом CD4+CD25+Foxp3+. При этом при умеренных (но не максимальных) дозах облучения наблюдалось повышение доли активированных лимфоцитов Treg, несущих поверхностный маркер CTLA4, при одновременном уменьшении доли наивных лимфоцитов Treg с фенотипом CD45RA. В работах [6] и [14] на мышиной модели и при испытаниях на пациентах показано, что PUVA-терапия снижает долю лимфоцитов Th-17 в периферической крови.
Кроме того, было показано, что клетки перевиваемой линии лимфобластной лимфомы в результате облучения в присутствии псоралена погибали преимущественно за счет апоптоза [21]. Сходные результаты были получены на линии клеток промиелоцитарного лейкоза человека HL-60: сочетанное воздействие псораленов и UVA-излучения индуцировало апоптоз клеток, в частности, вызывало активацию каспазы-3 [22]. В погибающих клетках наблюдался высокий уровень продукции ROS и продуктов окисления кардиолипина [23].
В последнее время опубликован ряд данных, доказывающих, что ФХТ с использованием фурокумаринов приводит к возникновению опасных побочных эффектов: индукции плоскоклеточного и базальноклеточного рака кожи. Этот механизм обусловлен фотогенотоксичностью. С биохимической точки зрения существование фотогенотоксичности обусловлено наличием в молекулах псораленов двух независимых фотоактивных центров, ответственных за образование кросс-сшивок между комплементарными цепями ДНК, а также конъюгатов ДНК с белками под действием UVA [16, 24]. Предпринятые рядом групп попытки поиска соединений, способных подобно псораленам избирательно вызывать гибель Т-лимфоцитов кожи, но не обладающих фотогенотоксичностью, привели к обнаружению таких свойств у производных фурохинолона. По строению они напоминают фурокумарины, но имеют в первом положении амидный атом азота вместо сложноэфирного кислорода. Испытания показали, что фурохинолоны незначительно отличаются от псораленов по механизму фотоиндуцированного действия: использование их в качестве фотосенсибилизаторов in vivo приводит к образованию конъюгатов белков с ДНК с ненулевой длиной линкера (DPC). Ввиду этого по показателям фотогенотоксичности они в 3–5 раз менее опасны для пациента, чем псоралены [16]. Кроме того, все известные фурохинолоны, в отличие от псораленов, отличаются высокой гидрофобностью, препятствующей их проникновению в очаги псориатического поражения кожи.
К соединениям, наиболее близким по строению к фурохинолонам, можно отнести фуродигидрохинолины (ФДГХ). В ходе изучения возможности использования фуродигидрохинолинов в качестве фотосенсибилизаторов в работе [25] впервые был разработан принцип получения производных фуродигидрохинолина, позволивший осуществить синтез 7,7,9-триметил-6,7-дигидрофуро[3,2-f]хинолина (ФДГХ-1). Предложенный принцип заключается в конденсации аминобензофурана с ацетоном в присутствии кислот Льюиса и Н+ кислот, при температуре 105–120°С. Описанный в этой работе способ синтеза ФДГХ-1 является прототипным: именно он использован в настоящей работе для получения новых производных ФДГХ-1.
Поскольку терапевтическая активность и псораленов, и ФДГХ-1 обусловлена генерацией активных форм кислорода, вызывающих гибель лимфоцитов в коже, мы поставили цель провести сравнение световой и темновой токсичности вновь созданных производных на модели Т-клеточного лимфобластного лейкоза человека – линия Jurkat (ATCC – TIB-152), В-клеточного лейкоза человека – линия Raji (ATCC – CCL-86) и иммортализованной линии фибробластов человека hFB-hTERT6, сопоставив ее с аналогичными эффектами 8‑МОР. Кроме того, была поставлена задача по оценке растворимости синтезированных соединений в воде, как наиболее доступном и безопасном растворителе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Методы синтеза и очистки производных ФДГХ-1
Получение N-(6,8,8-триметил-8,9-дигидрофуро[3,2-h]хинолин-5-ил)ацетамида (W)
Растворяли N-(7-амино-1-бензофуран-4-ил) ацетамида (3.8 г, 20 ммоль) в 30 мл сухого ацетона. К раствору прибавляли 1.0 г (2 ммоль) трифлата скандия и кипятили при перемешивании в течение 8 часов. Контролировали ход реакции методом ТСХ (силикагель sorbfil ПТСХ-АФ-В-УФ, этилацетат). Растворитель отгоняли при пониженном давлении. Продукт очищали методом колоночной хроматографии (силикагель, элюент – этилацетат). Выход продукта после перекристаллизации из этилацетата составил 1.48 г (выход 27.4%).
Получение трет-бутил (6,8,8-триметил-8,9-дигидрофуро[3,2-h]хинолин-5-ил)карбамата (К)
К раствору трет-бутил ацетил (6,8,8-триметил-8,9-дигидрофуро[3,2-h]-хинолин-5-ил)-карбамата (3.17 г, 8.56 ммоль) в 64 мл ацетонитрила прибавили 0.85 г 100% гидразин гидрата при комнатной температуре и перемешивали при 50°C. Когда ТСХ (петролейный эфир : этилацетат/3 : 1) показала отсутствие исходного, растворитель отогнали при пониженном давлении. Остаток обработали метиленхлоридом (60 мл) и промыли водой (3 × 20). Органический слой сушили над cульфатом магния. Растворитель отогнали при пониженном давлении.
Остаток перекристаллизовывали из петролейного эфира. Получили 2.1 г (выход 75%). Т пл. 125°C.
Получение трет-бутил ацетил (6,8,8-триметил-8,9-дигидрофуро[3,2-h]- хинолин-5-ил)-карбамата (WK)
Смесь 5.00 г (18.5 ммоль) N-(6,8,8-триметил-8,9-дигидрофуро[3,2-h]хинолин-5-ил)ацетамида, 8.08 г Boc2 и 190 мг DMAP в 250 мл метиленхлорида перемешивали при кипячении под аргоном 12 ч. Растворитель отгоняли при пониженном давлении, остаток обрабатывали петролейным эфиром. Выпавший осадок отфильтровывали и промывали петролейным эфиром. Получили 6.37 г (выход 93%). Т пл. 128°C.
Получение N-метил-N-(6,8,8-триметил-8,9-дигидрофуро[3,2-h]хинолин-5-ил) ацетамида (WС1)
К раствору N-(6,8,8-триметил-8,9-дигидрофуро[3,2-h](хинолин-5-ил)ацетамида (0.54 г, 2 ммоля) в 6 мл сухого ДМФА прибавляли 0.08 г 60% (0.02 моль) гидрида натрия после окончания выделения водорода смесь перемешивали еще 3 ч. К полученной Na соли прикапывали раствор метил иодида (0.284 г, 0.125 мл) в 3 мл метиленхлорида. Смесь перемешивали 25 ч, затем выливали в 30 мл воды, и экстрагировали этилацетатом. Экстракт троекратно промывали 10 мл воды, высушивали под вакуумом над сульфатом магния. После отгонки растворителя, Остаток вакуумировали при 70°C/1 мм.рт.ст. Получили 0.48 г (выход 84.5%). Т пл. 152–153°C.
Получение N-октил-N-(6,8,8-триметил-8,9-дигидрофуро[3,2-h]хинолин-5-ил)ацетамид (WС8)
К раствору N-(6,8,8-триметил-8,9-дигидрофуро[3,2-h](хинолин-5-ил)ацетамида (0.54 г, 2 ммоль) в 5 мл сухого ДМФА прибавляли 0.09 г 60% (1 ммоль) гидрида натрия после окончания выделения водорода смесь перемешивали еще 3 ч. К полученной Na соли прикапывали раствор 1-бромоктана (0.4 г, 2 ммоля) в 2 мл метиленхлорида. Смесь перемешивали 52 ч при комнатной температуре, затем выливали в 30 мл воды и экстрагировали петролейным эфиром, 20 мл. Экстракт промывали водой. Органический слой сушили над сульфатом магния. Растворитель отгоняли при пониженном давлении. В остатке слегка желтое густое масло, которое чистили методом КЖХ на силикагеле. Элюент петролейный эфир : этилацетат 2 : 1. Остаток вакуумировали при 70°C/1 мм.рт.ст. Получили 0.68 г (выход 88.9%).
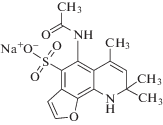
Получение ацетил (6,8,8-триметил 8,9-дигидрофуро[3,2-h]хинолин-5-ил сульфамата натрия (S)
К смеси N-(6,8,8-триметил-8,9-дигидрофуро[3,2-h]хинолин-5-ил)ацетамида [2] (2.70 г, 10 ммолей) и пиридина (0.8 мл, 10 ммоль) под аргоном, в 50 мл дихлорэтана, при 0°C прибавляли хлорсульфоновую кислоту (1.17 г, 10 ммоль). Смесь перемешивали при комнатной температуре 24 часа, затем обрабатывали 30 мл воды. Водный слой промывали метиленхлоридом и нейтрализовали бикарбонатом натрия до нейтральной реакции. Полученный раствор отфильтровывали, воду отгоняли при пониженном давлении. Остаток троекратно промывали 20 мл теплого этанола, высушивали в вакууме. Получили 1.2 г (выход 32%).
Подтверждение структуры производных ФДГХ-1 с помощью спектроскопии ядерного магнитного резонанса
Спектры ЯМР были зарегистрированы на приборе Bruker AM 300. Масс-спектры высокого разрешения были зарегистрированы на приборе BrukermicrOTOF II методом электрораспылительной ионизации (ESI). Измерения выполнены на положительных (напряжение на капилляре – 4500 B) или отрицательных (напряжение на капилляре 3200 В) ионах. Диапазон сканирования масс – m/z от 50 до 3000 Да, калибровка – внешняя или внутренняя (ElectrosprayCalibrantSolution, Fluka). Использовался шприцевой ввод вещества для растворов в ацетонитриле, метаноле или воде, скорость потока — 3 мкл/мин. Газ-распылитель – азот (4 л/мин), температура интерфейса – 180°C.
W
Элементный анализ: обнаружено С (71.15%), Н (6.92%), N (10.24%). Вычислено С (71.09%), Н (6.71%), N (10.36%).
1Н NMR (300 MHz, DMSO-D6) δ, ppm 1.24 (s, 6H), 1.97 (s, 3H), 2.03 (s, 3H), 5.24 (s, 1H), 6.04 (s, 1H), 6.59 (s, 1H), 6.78 (d, J = 2.4 Hz, 1H), 7.89 (d, J = 2.6, 1H), 9.38 (s, 1H).
13С NMR (500 MHz, DMSO-D6) δ, ppm 168.33, 145.65, 140.83, 130.43, 129.76, 129.45, 128.18, 126.07, 113.43, 107.03, 49.94, 29.05, 23.11, 21.60.
Масс-спектр [М + Н+] 271 (ESI).
K
Элементный анализ: найдено C (69.49%) H (7.37%) N (8.53%)).
Вычислено С (69.61%), Н (7.46%), N (8.38%).
1НNМR (300 МГц, d6-ДМСО) δ ppm 1.25 (s 6H), 1.42 (ws 9H), 2.05 (s 3H), 5.24 (s 1H), 6.00 (1H), 6.54 (1H), 6.78 (1H), 7.89 (1H), 8.47 (ws 1H).
HRMS 329.1858 (M + H+)/z, 351.1679 (M + Na+)/z, 367.1414 (M + K+)/z.
WK
Элементный анализ: найдено C (68. 09%) H (7.07%) N (7.56%).
Вычислено С (68.11%), Н (7.12%), N (7.52%).
1НNМR (300 МГц, d6-ДМСО) δ ppm 1.20 (s 3H), 1.30 (s 3H), 1.33 (s 3H), 2.46 (s 3H), 5.33 (1H), 6.07 (s 1H), 6.54 (s 1H), 6.82 (s 1H), 7.94 (s 1H).
HRMS 370.1877 (M), 393.1783 (M + Na+)/z, 409.1524 (M + K+)/z.
WC1
Элементный анализ: найдено C (71.81%) H (7.09%) N (9.85%).
Вычислено С (71.93%), Н (7.15%), N (9.72%).
1Н NМR (300 МГц, d6-ДМСО) δ ppm 1.21 (s 3H), 1.28 (s 3H), 1.72 (s 3H), 1.86(s 3H), 3.09 (s 3H), 5.39 (s 1H), 6.28 (s 1H), 6.71 (s 1H), 6.84 (s 1H), 7.97 (s 1H).
HRMS 420.1157 (M + H+)/z, 442.0975 (M + Na+)/z.
WC8
Элементный анализ: найдено C (75.35%) H (8.96%) N (7.32%).
Вычислено: С (75.28%), Н (9.07%), N (7.45%).
1НNМR (500 МГц, CDCl3) δ ppm 0.87 (J = 7.5 Гц, 3H), 1.25 (m, 13H), 1.39 (s 3H), 1.68 (m, 2H), 1.92 (3H), 2.00 (s 3H), 2.77 (m 1H), 4.24 (m 1H), 4.41 (s 1H), 5.43 (s, 1H), 6.65 (s 1H), 6.71 (J = 2.05 Гц), 7.61 (J = 2.05 Гц).
HRMS 383.2684 (M + H+)/z, 405.2500 (M + + Na+)/z.
S
1НNМR (500 МГЦ, d6-ДМСО) δ ppm 1.14 (s, 3H), 1.36 (s, 3H), 1.85 (s, 3H), 1.99 (s, 3H), 5.19 (s, 1H), 6.21 (1H), 7.22 (J = 1.95 Гц, 1H), 7.81 (d, J = 1.91 Гц, 1H), 9.61 (s, 1H).
13CNMR (500 МГц, d6-ДМСО) δ ppm 20.77, 23.90, 27.52, 29.53, 49.91, 109.09, 114.49, 121.15, 123.97, 127.81, 128.82, 129.53, 131.00, 139.49, 144.52, 168.68.
HRMS 373.0812 (M +Na+)/z, 395.0636 (M + + 2Na+ – H+)/z, 411,0380 (M + K+)/z.
Работа с клеточными культурами
В качестве модельных объектов для исследования токсичности производных ФДГХ-1 при облучении UVA и в отсутствии облучения использовали опухолевые клеточные линии: Т-клеточного лимфобластозного лейкоза – Jurkat (ATCC – TIB-152), В-клеточной лимфомы Беркитта – Raji (ATCC – CCL-86) и фибробласты кожи человека hFB-hTERT6.
Клеточные линии Jurkat (T-клеточный лимфолейкоз) и Raji (В-клеточная лимфома Беркитта) были получены из Американской типовой коллекции тканей и клеток (ATCC) и предоставлены О.С. Буровой (ФГБУ “НМИЦ онкологии им. Н.Н. Блохина” Минздрава России). Иммортализованная линия фибробластов кожи человека hFB-hTERT6 была получена путем лентивирусной трансдукции генно-инженерной ДНК-конструкции, содержащей полноразмерный ген TERT под контролем промотора CMV. Линия hFB-hTERT6 сконструирована и любезно предоставлена Э.Б. Дашинимаевым (институт молекулярной биологии им. В.А. Энгельгардта РАН) (https:// www.ncbi.nlm.nih.gov/pmc/articles/PMC2743981/).
Клеточные линии Jurkat и Raji культивировали на среде RPMI-1640 (Gibco, США), а фибробласты кожи человека линии hFB-hTERT6 – в среде DMEM с содержанием глюкозы 4.5 г/л (Gibco, США). Во всех случаях в среды добавляли также 10% телячьей эмбриональной сыворотки (HyClone, США), 2 мМ L-глутамина (Sigma, США), 10 МЕ/мл пенициллин-стрептомицина (ПанЭко, Россия). Клетки поддерживали в логарифмической фазе роста постоянным пересевом культуры через 3–4 дня при 37°C в атмосфере с содержанием CO2 5%.
Для исследования использовали конечные концентрации соединений ФДГХ в культуральной среде: 1, 10, 100, 1000 мкМ. Определение цитотоксической активности препаратов осуществлялось колориметрическим методом с использованием МТТ-теста [26].
Опухолевые клетки и фибробласты в концентрации 5 × 104 клеток/мл засевали в 96-луночные стерильные плоскодонные планшеты для культуральных работ (Sarstedt, Германия). В качестве растворителя для приготовления стоковых растворов использовали ДМСО. Стоковые растворы тестируемых соединений с концентрацией 0.5 М вносили в количестве 1/100 объема, затем разводили с шагом в 10 раз и инкубировали 1 ч в СО2 инкубаторе. Каждую концентрацию каждого препарата исследовали в трех независимых повторностях.
Один из планшетов подвергали облучению UVB светом, длиной волны 302 нм, в течение 10 мин с использованием трансиллюминатора TR-302 (Spectroline, США), имеющего в составе люминесцентные лампы и рассеивающий светофильтр. Источник света закрепляли в штативе над поверхностью бокса на таком расстоянии, чтобы доза облучения у дна планшета составляла 0.65 Дж/см2. Выбор такой дозы обусловлен обеспечением выживаемости клеток наиболее чувствительной линии Jurkat не менее 80%. В качестве контроля использовали три лунки, в которых клетки облучали светом в отсутствие фотосенсибилизирующего препарата. В ходе облучения контролировали изменение температуры в лунках с помощью ртутного термометра с точностью измерения 0.1°С. Клетки инкубировали в той же среде, в которой проводилось облучение, в течение 72 часов после его окончания. Со вторым планшетом выполняли все те же операции, что и с первым, за исключением стадии облучения.
По окончании инкубации проводили оценку доли выживших клеток с помощью МТТ-теста по стандартной методике [26]. Долю выживших клеток определяли по формуле (среднее значение ОП в опыте/среднее значение ОП в контроле) × 100%.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Подтверждение структуры новых соединений
Структура всех соединений была подтверждена с использованием масс-спектрометрического анализа, ЯМР и методом инфракрасной спектроскопии.
Оценка растворимости производных ФДГХ с целью приготовления растворов для тестирования биологической активности
Было установлено, что все тестируемые производные ФДГХ обладают хорошей растворимостью в диметилсульфоксиде, благодаря чему удалось добиться полного растворения каждого из них при концентрации 0.5 М. Эти растворы использовались в качестве маточных для проведения испытаний темновой и фотоиндуцированной фототоксичности на клеточных культурах.
Путем разведения маточных растворов в воде было установлено, что при концентрации 10 мМ все соединения кроме S, имеющего сульфогруппу в своей структуре, частично или полностью выпадают в осадок. При концентрации 1 мМ все соединения сохраняли стабильность в растворе, что было подтверждено сопоставлением A440 водных растворов соединений, имеющих номинальную концентрацию 1 и 0.1 мМ.
Таким образом, было установлено, что растворимость тестируемых соединений в водных растворителях низка: единственным исключением является соединение S. Растворимость соединения S в воде превышает 0.5 М, что было подтверждено получением устойчивого раствора с этой концентрацией, A440 которого пропорционально снижалось при разведении раствора до концентрации 0.05 М.
Исследования темновой и фотоиндуцированной фототоксичности производных ФДГХ на клеточных культурах
В качестве клеточной модели использовались линии Т-клеточного лимфобластозного лейкоза – Jurkat, В-клеточного лейкоза – Raji и иммортализованные фибробласты человека. Анализировалась как темновая токсичность препаратов, так и их фототоксический эффект после облучения светом длиной волны 302 нм в течение 10 минут. Поскольку температура среды может существенно влиять на жизнеспособность культивируемых клеток в стрессовых условиях и их физиологические реакции, в ходе облучения контролировали температуру в лунках планшета. До облучения она составляла 24 ± 0.5°С, после его окончания 34 ± 0.5°С, что не превышает допустимой физиологической нормы.
Эксперимент выявил наличие темновой токсичности 8-МОР в отношении клеток Т-клеточного лейкоза в диапазоне концентраций 100–1000 мкМ и фибробластов кожи – в концентрации 1000 мкМ. Клетки В-клеточного лейкоза были не чувствительны к 8-МОР даже при максимальной испытанной концентрации 1000 мкМ.
Ранее рядом авторов были опубликованы данные о гибели клеток лимфобластного лейкоза [21] и промиелоцетарного лейкоза человека HL-60 [22] в результате облучения UVA в присутствии псоралена. Результаты МТТ-теста, полученные нами на линии клеток Т-клеточного лейкоза при воздействии 8-МОР в сочетании с последующим облучением UVB светом (302 нм) (рис. 1), подтверждают сведения о высокой цитотоксической активности 8-МОР. Уже при концентрации 1 мкМ выживаемость клеток линии Jurkat составляла 62%, а при концентрациях 100 и 1000 мкМ в живых оставались только единичные клетки.
Рис. 1.
Воздействие 8-МОР на клеточные линии. Синие кривые – доля выживших клеток в присутствии препарата без облучения (определение темновой токсичности), красные – доля выживших клеток после обработки препаратом и облучения UVB светом (λ = 302 нм) в течение 10 мин (определение световой токсичности).

Чувствительность клеток Raji (В-клеточная лимфома Беркитта) к фотосенсибилизирующему действию 8-МОР оказалась значительно ниже, чем у клеток Jurkat. Выживаемость клеток Raji в отсутствии облучения оставалась неизменной при всех концентрациях псоралена, что говорит об отсутствии темнового токсического действия 8-МОР на клетки этого типа. При исследовании фотоиндуцированной токсичности IC50 8-МОР для клеток Raji соответствовала концентрации псоралена 10 мкМ. При концентрации 100 мкМ в живых оставалось только 25% клеток.
Результаты, полученные на фибробластах кожи человека, качественно сходны с данными, полученными на клетках линии Jurkat, но выживаемость клеток была несколько выше, как в эксперименте с облучением, так и в отсутствии облучения.
Далее нами был проведен анализ результатов МТТ-теста, для всех соединений, производных ФДГХ-1 на тех же клеточных линиях. Выживаемость клеточных линий Jurkat, Raji и фибробластов кожи человека при воздействии соединений WK и WC1 как после облучения, так и в его отсутствии была одинаковой, что не позволяет рассматривать их как фотосенсибилизаторы. При этом при концентрации выше 100 мкМ оба соединения вызывают гибель всех исследуемых клеточных линий Jurkat и фибробластов человека. Клеточная линия Raji продемонстрировала устойчивость к соединению WK. Динамика гибели всех клеточных линий в зависимости от концентрации WC1 была сходной.
Близкие между собой значения темновой и световой токсичности были получены для соединений K и WC8. Для соединения K только при концентрации выше 100 мкМ доля выживших клеток после облучения оказалась значительно ниже доли выживших клеток в отсутствии облучения. В линейке производных ФДГХ наиболее сильный цитотоксический эффект показало соединение WC8, но чувствительность к нему различных клеточных линий была неодинаковой. При концентрации WC8 10 мкМ после облучения UVB (302 нм) доля выживших клеток линии Jurkat составляла 37%, фибробластов кожи человека – 68%, цитотоксичность по отношению к Raji проявлялась только при концентрации WC8 >100 мкМ. При этом надо отметить, что доля выживших клеток после облучения с 8-МОР была ниже для всех анализируемых клеточных линий.
В отсутствии облучения в диапазоне концентраций 1–1000 мкМ соединения K и S не проявляли цитотоксического эффекта: при максимальной концентрации наблюдалась гибель не более 20% клеток. Это справедливо для всех анализируемых клеточных линий. Вместе с тем, соединение K даже после облучения вызывало гибель клеток Jurkat и фибробластов кожи человека только при концентрации выше 100 мкМ. Клетки линии Raji даже после облучения в присутствии соединения K демонстрировали выживаемость на уровне 70%.
Наиболее интересные результаты были получены при испытаниях фотоиндуцированной цитотоксичности соединения S. Как уже упоминалось, в отсутствии облучения наблюдалась совсем незначительная гибель клеток (или 100% выживаемость – в случае Raji). Вместе с тем, наблюдалась заметная гибель клеток Jurkat после сочетанного воздействия соединения S и облучения UVB светом: доля выживших клеток при концентрации 100 мкМ составляла ∼30%. Сопоставимый цитотоксический эффект 8-МОР отмечался при концентрации менее 10 мкМ. Однако, в отсутствии облучения гибель клеток наблюдалась уже при концентрации 8-МОР 100 мкМ.
Чувствительность фибробластов кожи человека к сочетанному воздействию соединения S и UVB (302 нм) оказалась промежуточной по сравнению с линями Jurkat и Raji: соединение S вызывало заметное снижение количества живых клеток лишь при концентрации фотосенсибилизатора >100 мкМ. Клетки Raji продемонстрировали полную устойчивость как к темновому, так и к фотосенсибилизирующему действию соединения S.
Соединения K, WK и WC1 обладали выраженной темновой токсичностью для фибробластов кожи человека при концентрации 1000 мкМ, а соединение WC8 – при концентрации 100 мкМ и 1000 мкМ. Однако, все эти четыре соединения не могут рассматриваться в качестве фотосенсибилизаторов, так как темновая цитотоксичность при облучении практически не увеличивалась по сравнению с контрольной группой, не получавшей облучения. Соединение W, в отличие от соединений K, WK, WC8 и WC1, не проявляло ни темновой цитотоксичности, ни фотосенсибилизирующей активности.
Самая низкая темновая токсичность среди всех испытанных соединений (не более 20% погибших клеток при концентрации 1000 мкМ) получена для соединения S. По этому показателю соединение S превосходило даже малотоксичное соединение W. Эффект фотосенсибилизации по отношению к клеточной линии Raji у соединения S не обнаружен, а по отношению к человеческим фибробластам и клеткам линии Jurkat он находился на сопоставимом уровне с другими производными ФДГХ.
Таким образом, согласно полученным нами данным, соединение S по фотосенсибилизирующей способности уступало 8-MOP. Однако, благодаря существенно меньшей темновой токсичности и безопасности для нелимфоидных клеток оно предположительно может быть использовано в клинической практике в более высоких дозировках, что позволит в конечном итоге добиваться более эффективного воздействия на Т-лимфоциты. Важным преимуществом соединения S над аналогами является его высокая растворимость в воде, что упрощает разработку лекарственной формы.
Проведенные эксперименты показали, что клетки линии Jurkat проявляли наибольшую чувствительность к 8-MOP и всем производным ФДГХ как без воздействия света, так и при облучении. Чувствительность фибробластов кожи человека к соединению S оказалась несколько выше, чем у клеток линии Jurkat. Клетки линии Raji продемонстрировали наименьшую чувствительность ко всем испытанным соединениям: ФДГХ S, WK и K, которые оказались безопасными для этих клеток даже в максимальных концентрациях.
В результате проведенных экспериментов разработан оригинальный высокоэффективный метод синтеза производных фуродигидрохинолина (ФДГХ), которые могут быть использованы в качестве фотосенсибилизирующих средств при проведении фотохимиотерапии псориаза. Выход синтеза соединений настолько высок, что они могут использоваться для проведения биологического тестирования без дополнительной очистки.
В отличие от существующих фотосенсибилизаторов с двумя фотоактивными центрами, традиционно применяемых для фотохимиотерапии псориаза (8-метоксипсорален, 5-метоксипсолрален, триметоксипсорален), новые производные ФДГХ имеют один фотоактивный центр. Благодаря этому, при фотоактивации в комплексе с ДНК и белками они не способны вызывать образование кросс-сшивок цепей ДНК и конъюгатов белков друг с другом и ДНК, что позволяет ожидать у них полного отсутствия фотогенотоксичности.
Большинство полученных и испытанных производных ФДГХ: K, WK, WC1 и WC8 обладают темновой токсичностью в линии фибробластов кожи человека, что делает их потенциально опасными при использовании в качестве средств для фотохимиотерапии псориаза. Хотя применяемое в практике соединение 8-МОР, подобно K, WK, WC1 и WC8, также обладает выраженной темновой токсичностью, при достаточно низких концентрациях оно остается пригодным к терапевтическому применению благодаря своей высокой фотосенсибилизирующей способности. Фотосенсибилизирующая способность соединений K, WK, WC1 и WC8 низка: цитотоксичность незначительно повышается при облучении UVB (302 нм). Соединение W существенно менее токсично, чем K, WK, WC1 и WC8, однако оно не обладает значительной фотосенсибилизирующей активностью, что не позволяет ожидать от него высокой эффективности в качестве средства для фотохимиотерапии псориаза.
Наиболее эффективным фотосенсибилизатором среди всех испытанных соединений оказалось соединение S. Оно обладает наименьшей темновой токсичностью ко всем трем испытанным типам клеток, существенно превосходя по этому показателю 8-MOP. При этом соединение S имеет наибольшую среди всех испытанных соединений избирательность действия к Т-клеткам по сравнению с фибробластами кожи человека: различие в IC50 составляет 15–20 раз (30 мкМ и 500 мкМ). Для сравнения, этот показатель для 8-MOP составляет всего 2–3 раза. Таким образом, можно ожидать, что соединение S будет безопаснее в применении в качестве средства для фотохимиотерапии псориаза, поскольку способно обеспечить гибель лимфоцитарных инфильтратов в дерме, не влияя на жизнеспособность кератиноцитов и фибробластов. Иными словами, терапевтический эффект будет заметен в случае применения дозы облучения кожи существенно ниже минимальной фототоксической. Следовательно, риск развития ожога кожи (эритемы) будет снижен.
Как для фурохинолонов, так и для большинства замещенных фуродигидрохинолинов характерна низкая растворимость в неполярных растворителях. Это не позволяет использовать их для создания готовых лекарственных форм фотосенсибилизирующих препаратов с применением фармацевтически приемлемых растворителей: 10% водного диметилсульфоксида, 20% водного этанола или воды. Эта физико-химическая особенность практически не позволяет ввести их в клиническую практику. В связи с этим, практически важной особенностью соединения S является его высокая растворимость в воде.
Существенным различием избирательности фотосенсибилизирующего действия соединения S по сравнению с 8-MOP является практически полная неспособность вызывать гибель клеток линии Raji. Можно предполагать, что соединение S, в отличие от 8-MOP окажется полностью безопасным для В-лимфоцитов при использовании в качестве фотосенсибилизатора. С учетом недостаточности сведений о вкладе Т- и В-лимфоцитов в этиологию псориаза, в частности, представленности лимфоцитов этих классов с субэпидермальных скоплениях псориатических повреждений, вопрос желательности такой избирательности фототоксического у соединения S остается открытым. Однако, необходимо отметить, что лимфоциты типа Th17, которые рассматриваются в качестве главного этиотропного фактора развития псориаза, относятся к классу Т-лимфоцитов, что позволяет надеяться на положительный результат испытаний соединения S in vivo.
Полученные данные позволяют рассматривать использованную модель трех клеточных линий (Jurkat, Raji и иммортализованные фибробласты человека) в качестве возможного прототипа универсальной тест-системы для экспресс-скрининга панелей перспективных средств терапии псориаза. Окончательный вывод о целесообразности использования такого подхода может быть сделан по результатам испытаний терапевтической эффективности соединения S в качестве средства фотохимиотерапии псориаза на животных моделях.
Рис. 2.
Воздействие производных ФДГХ-1 на различные клеточные линии. Синие кривые – доля выживших клеток в присутствии препарата без облучения (определение темновой токсичности), красные – доля выживших клеток в присутствии препарата после десятиминутного облучения UVB светом (λ = 302 нм) (определение световой токсичности).

Рис. 2.
Окончание

Список литературы
Christophers E. // Clin Exp Dermatol. 2001. V. 26. P. 314–320.
Griffiths C.E., Barker J.N. // Lancet 2007. V. 370. P. 263–271.
Kim J., Krueger J.G. // Dermatol. Clinics. 2015. V. 33 (1). P. 13–23.
Georgescu S.R., Tampa M., Caruntu C., Sarbu M.I., Mitran C.I., Mitran M.I., Matei C., Constantin C., Neagu M. // Int. J. Mol. Sci. 2019. V. 20 (3). pii: E739. https://doi.org/10.3390/ijms20030739
Lande R., Chamilos G., Ganguly D., Demaria O., Frasca L., Durr S., Conrad C., Schröder J., Gilliet M. // Eur. J. Immunol. 2015. 45 (1). P. 203–213. https://doi.org/10.1002/eji.201344277
Singh T.P., Schön M.P., Wallbrecht K., Michaelis K., Rinner B., Mayer G., Schmidbauer U., Strohmaier H., Wang X.J., Wolf P. // J. Immunol. 2010. V. 184 (12). P. 7257–7267. PMID: 20488788https://doi.org/10.4049/jimmunol.0903719
Lu J., Ding Y., Yi X., Zheng J. // Braz. J. Med. Biol. Res. 2016. P. 49. e5374.
Thomas J., Küpper M., Batra R., Jargosch M., Atenhan A., Baghin V., Krause L., Lauffer F., Biedermann T., Theis F.J. // J. Eur. Acad. Dermatol. Venereol. 2019. V. 33. P. 115–122.
Saiag P., B. Coulomb, Lebreton C., Bell E., Dubertret L. // Science. 1985. V. 230. P. 669–672.
Krueger G.G., Jorgensen C.M. // J. Invest Dermatol. 1990. V. 95. P. 56–58. ISSN 0022-202X. https://doi.org/10.1111/1523-1747.ep12505791
Evain-Brion D., Raynaud F., Laurent P., Plet A., Leduc B. // Proc. Natl. Acad. Sci. USA. 1986. V. 83. P. 5272–5276.
Raynaud F., Gerbaud P., Enjolras O., Gorin I., Anderson W.B., Evain-Brion D. // Lancet. 1989. V. 1. P. 1153–1156.
Thérond P., Gerbaud P., Dimon S., Anderson W.B., Evain-Brion D., Raynaud F. // J. Invest. Dermatol. 1996. V. 106. P. 1325–1328.
Kubo R., Muramatsu Sh., Sagawa Y., Saito Ch., Kasuya S., Nishioka A., Nishida E., Yamazaki S., Morita A. // J. Dermatol. Science. 2017. V. 86 (1). P. 46–53. ISSN 0923–1811. https://doi.org/10.1016/j.jdermsci.2017.01.001
Bethea D., Fullmer B., Syed S., Seltzer G., Tiano J., Rischko C., Gillespie L., Brown D., Gasparro F.P. // J. Dermatol. Science. 1999. V. 19. P. 78–88.
Marzano C., Chilin A., Bordin F., Baccichetti F., Guiotto A. // Bioorg. Med. Chem. 2002. V. 10 (9). P. 2835–2844.
Yoo E.K., Rook A.H., Elenitsas R., Gasparro F.P., Vowels B.R. // J. Invest. Dermatol. 1996. V. 107 (2). P. 235–242.
Vallat V.P., Gilleaudeau P., Battat L., Wolfe J., Nabeya R., Heftler N., Hodak E., Gottlieb A.B., Krueger J.G. // J. Exp. Med. 1994. V. 180. P. 283–296.
Wolf P., Nghiem D.X., Walterscheid J.P., Byrne S., Matsumura Y., Matsumura Y., Bucana C., Ananthaswamy H.N., Ullrich S.E. // Am. J. Pathol. 2006. V. 169. P. 795–805.
Saito C., Maeda A., Morita A. // J. Dermatol. Sci. 2009. V. 53 (3). P. 231–233. PMID: 19070466https://doi.org/10.1016/j.jdermsci.2008.09.01119070466
Canton M., Caffieri S., Dall’Acqua F., Di Lisa F. // FEBS Lett. 2002. V. 522 (1–3). P. 168–172. PMID: 12095639
Viola G., Facciolo L., Vedaldi D., Disarò S., Basso G., Dall’Acqua F. // Photochem Photobiol Sci. 2004. V. 3 (3). P. 237–239. PMID: 14993937
Viola G., Fortunato E., Cecconet L., Del Giudice L., Dall’Acqua F., Basso G. // Toxicol. Appl. Pharmacol. 2008. V. 227 (1). P. 84–96.
Dall’Acqua S., Viola G., Cappelletti E.M., Innocenti G. // Z. Naturforsch. C. 2004. V. 59 (5-6). P. 335–338. PMID: 18998397
Кузьмин В.А., Мазалецкая Л.И., Некипелова Т.Д., Ходот Е.Н. // Изв. Акад. наук. Сер. хим. 2008. № 11. С. 2356–2360.
Cory A.H., Owen T.C., Barltrop J.A., Cory J.G. // Cancer Com. 1991. V. 3 (7). P. 207–212. ISSN 0955-3541. PMID 1867954https://doi.org/10.3727/095535491820873191
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия