Биоорганическая химия, 2020, T. 46, № 2, стр. 201-206
Синтез и противомикробная активность бензилиденгидразидов глицирретовой кислоты
Л. А. Балтина 1, Р. М. Кондратенко 2, А. К. Булгаков 2
1 Уфимский институт химии Уфимского Федерального Научного Центра РАН
450054 Уфа, проспект Октября, 71, Россия
2 ФГБОУ ВО Башкирский государственный медицинский университет Минздрава России
450000 Уфа, ул. Ленина, 3, Россия
Поступила в редакцию 06.08.2019
После доработки 23.08.2019
Принята к публикации 21.10.2019
Аннотация
Осуществлен синтез и проведена оценка противомикробной активности новых производных глицирретовой кислоты, содержащих гидразидные фармакофорные группы. Наибольшую противомикробную активность проявил 3-О-ацетил-N'- (4-гидроксибензилиден)гидразид глицирретовой кислоты. Это соединение оказывало антибактериальное действие как в отношении бактерий Escherichia coli, Proteus vulgaris, Klebsiella pneumonia, Staphylococcus aureus, Citrobacter diversus, Enterobacter aerogenes, Pseudomonas aeruginosa, Ent. cloace, так и противогрибковую активность в отношении грибка вида Сandida albicans. Минимальные ингибирующие концентрации этого соединения и пимафуцина для С. albicans оказались аналогичны.
ВВЕДЕНИЕ
Поиск и разработка новых противомикробных препаратов остается одной из актуальных проблем современной медицинской химии и микробиологии, что обусловлено распространяющейся резистентностью патогенных микроорганизмов к существующим химиотерапевтическим препаратам, а также утратой клинической значимости ряда антибиотиков. Возникновение устойчивости к антибиотикам приводит к снижению эффективности и длительности лечения заболеваний, росту числа госпитализаций, и увеличению видов бактериальных инфекций, не поддающихся лечению известными антибиотиками [1, 2].
Одним из перспективных путей создания новых противомикробных препаратов служит химическая модификация структур известных антибиотиков, природных соединений, в том числе – выделенных из растений [3–6].
Показано, что основные биологически активные компоненты как самого экстракта корней солодки голой и уральской (Glycyrrhiza glabra L, Gl. uralensis Fisher) (Leguminosae), так и выделяемые из них индивидуальные природные соединения, проявляют разнообразную биологическую и фармакологическую активность – противовирусную, противоопухолевую, противовоспалительную, противоязвенную, антиоксидантную, гепатопротекторную, антимикробную и др. [7]. Экстракты и компоненты экстрактов солодкового корня обнаружили противомикробную активность в отношении ряда грамположительных и грамотрицательных патогенных микроорганизмов, а также противогрибковую активность в отношении ряда грибков, тких как Phytium ultimum, Trichophyton mentagrophytes и Candida albicans [8, 9].
Основной пентациклический тритерпеноид, выделенный из экстрактов солодкового корня, глицирретовая (глицирретиновая) кислота (ГЛК) (I), проявляет активность в отношении тест-микробов стафилококковой, кишечной и спорообразующей групп [7]. ГЛК обнаружила защитное действие при грибковой инфекции C. albicans в мышиных моделях [8], а также при стафилококковой пневмонии, вызванной бактериями Staphylococcus aureus [9].
Глицирренат натрия показал in vitro выраженную противомикробную активность относительно золотистого стаффилококка и микобактерий [7]. Установлена антибактериальная активность сульфонамидных производных ГЛК в отношении грамположительных (St. aureus, Bacillus antherasis, Crynibacteria bovis) и грамотрициательных (Klebsiella pheumonie, Proteus vulgaris, Escherichia coli) бактерий [7]. Однако использование ГЛК в качестве базовой структуры (скаффолда) для синтеза ее биологически активных производных, а также изучение зависимости структура–активность до сих пор остаются малоизученным направлением.
Настоящая работа посвящена синтезу ряда азотсодержащих производных ГЛК, модифицированных по карбоксильной группе гидразидными фармакофорными группами, а также оценке их противомикробной и противогрибковой активности на панели штаммов грамположительных и грамотрицательных бактерий и грибков. О противомикробных свойствах данной группы производных ГЛК в литературе не сообщалось.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
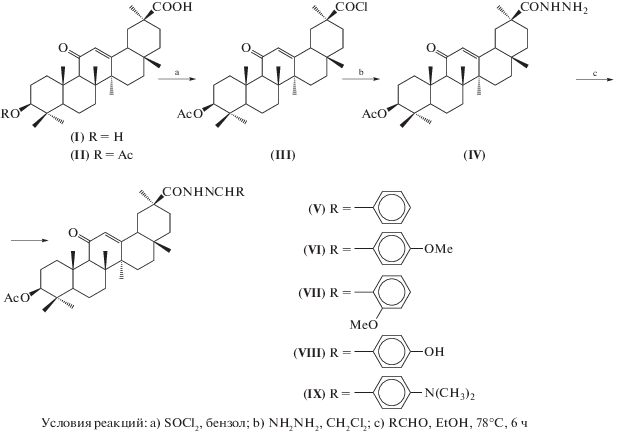
Синтез исходного гидразида ГЛК (IV) (схема 1) проводили обработкой гидразингидратом в хлористом метилене полученного хлорангидрида 3-О-ацетата глицирретовой кислоты (III), (выход 75%) [7]. Взаимодействием ацилгидразида (IV) с ароматическими альдегидами в этаноле при кипячении в течение 6 ч получены бензилиденгидразиды (V)–(IX) c выходами 70–75%, структура которых подтверждена спектрами ИК, ЯМР 1Н и 13С, а также элементным анализом. В спектрах ЯМР 1Н соединений (V)–(IX) в области слабого поля присутствуют дополнительные сигналы протонов CONH- и N=СН-групп и ароматических протонов (9.9–7.3 м.д.). В спектрах ЯМР 13С наблюдаются сигналы ароматических атомов углерода (132.2–111.0 м.д.). Для соединений (IV), (VI) и (VII) сняты ЯМР 1Н (500 МГц) и 13С спектры высокого разрешения и проведено полное отнесение сигналов протонов и атомов углерода. Так, в спектрах ЯМР 1Н соединений (VI) и (VII) протоны ОСН3-группы ароматических остатков обнаруживаются при 3.88 и 3.86 м.д., протоны N=CH находятся в слабом поле (8.88–8.76 м.д.). Протоны N(CH3)-группы в спектре соединения (IX) обнаруживаются при 3.07 и 2.99 м.д. соответственно.
Схема 1 .
Проведена оценка противомикробной активности ГЛК и ее производных в отношении грамположительных и граммотрицательных бактерий St. aureus, K. pneumonia, E. coli, Ps. aeruginosa, Pr. vulgaris, Citrobacter diversus, Ent. aerogenes, Ent. cloace и патогенных грибов C. albicans согласно [10, 11]. В качестве препаратов сравнения использовали антибиотик цефтриаксон (Шрея, Индия) и противогрибковый препарат пимафуцин (Астеллас, Нидерланды). В табл. 1 представлены полученные нами данные по противомикробной активности исследованных соединений.
Таблица 1.
Противомикробная (бактериостатическая и фунгиостатическая) активность ГЛК и ее производных
| Соединение | Минимальная ингибирующая концентрация (МИК) (мг/мл) | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Ec | Рv | Кp | Sa | Сd | Еa | Рa | Ecl | Сa | |
| ГЛК (I) | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 1.0 |
| (IV) | >10 | >10 | >10 | >10 | >10 | >10 | >10 | >10 | >10 |
| (V) | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 10 |
| (VI) | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 |
| (VII) | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 |
| (VIII) | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.001 |
| (IX) | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 10 |
| Цефтриоксон | 0.5 | 0.05 | 0.05 | 0.5 | 0.05 | 0.05 | 0.05 | – | 0.05 |
| Пимафуцин | – | – | – | – | – | – | – | – | 0.001 |
Результаты исследования показали, что модификация гидразида (IV) путем введения различных ароматических групп приводит к усилению противомикробной активности полученных бензилиденгидразидов. Наибольшей противомикробной активностью обладают ГЛК и N'-(4-гидроксибензилиденгидразид) (VIII). Соединение (VIII) оказывало как антибактериальное действие в отношении всех исследованных грамположительных и грамотрицательных бактерий, так и противогрибковую активность в отношении патогенных грибов C. albicans, что свидетельствует о широком спектре его действия. Величина минимальной ингибирующей концентрации (МИК) в отношении исследованных бактерий для ГЛК и соединения (VIII) оказалась выше, чем у препарата сравнения цефтриаксона. Величина МИК (VIII) в отношении грибов С. albicans (0.001 мг/мл) была равной величине МИК препарата сравнения – пимафуцина. Величины МИК гидразидов (V)–(VII) во всех случаях оказались значительно выше, чем соответствующая величина для ГЛК и соединения (VIII) (1 мг/мл). Исходный гидразид (IV) был неактивен (МИК > 10 мг/мл) как в отношении исследованных бактерий, так и грибков. Таким образом, введение бензилиденгидразидных фармакофорных групп по С30 положению ГЛК оказывает существенное влияние на противомикробную активность соединений. Выявленное соединение–лидер (VIII) перспективно для дальнейших исследований в качестве противогрибкового агента.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры ЯМР 1Н и 13С регистрировали на импульсном спектрометре Brüker Avance-III (Германия) с рабочей частотой 500.13 (1Н) и 125.47 МГц (13С) или Bruker АМХ-300 (Германия) с рабочей частотой 300 (1Н) и 75.5 (13С) МГц в CDCl3. Химические сдвиги приведены в м.д. относительно сигнала внутреннего стандарта – тетраметилсилана (TMC), J – в герцах. Отнесение сигналов в спектрах ЯМР проведены с использованием стандартного пакета программ спектрометра Bruker Avance-III и литературных данных для производных ГЛК и бензальгидразидов бетулиновой кислоты [12, 13]. ИК-спектры записаны на спектрофотометре IR Prestige-21 (Shimadzu, Япония) в пасте с вазелиновым маслом. Оптическую активность измеряли на поляриметре Perkin-Elmer 341 (США) в трубке длиной 1 дм при 20–22°С (λNa 546 нм). Температуры плавления определяли на микростолике Boetius (Германия) и не исправляли. Элементный анализ проводили на приборе CHNS-анализатор Hekatech (Германия).
Хроматографию в тонком слое проводили на пластинках Сорбфил (Сорбополимер), используя систему растворителей бензол–этанол, 10 : 1 (А). Пятна веществ обнаруживали 5% раствором Н2SO4 в этаноле с последующим нагреванием при 120–125°С в течение 2–3 мин. Для колоночной хроматографии использовали силикагель КСК (фракция 50–150, сухая классификация) (Сорбополимер). Очистку растворителей проводили по описанным методикам [14]. Растворители упаривали в вакууме при температуре 40–45°С. ГЛК (I) получали гидролизом глицирризиновой кислоты согласно методике [7]. Т. пл. 293–295°С, $[\alpha ]_{D}^{{20}}$ + 163° (с 0.04, CHCl3). (Лит. [7]: т. пл. 290–292°С, $[\alpha ]_{D}^{{20}}$ + 165° (с 0.04, CHCl3)). 3-О-ацетат ГЛК (II) синтезировали обработкой ГЛК уксусным ангидридом в пиридине [7]. Т. пл. 315–317°С. $[\alpha ]_{D}^{{20}}$ + 165° (c 0.4; CHCl3). (Лит. [7]: т. пл. 317–321°С; $[\alpha ]_{D}^{{20}}$ + 140–145° (CHCl3)). Хлорангидрид 3-О-ацетил-ГЛК (III) получали обработкой соединения (II) SOCl2 в бензоле и использовали без дальнейшей очистки [7].
Гидразид 3-О-ацетил-глицирретовой кислоты (IV). К раствору 2.0 г (3.8 ммоль) хлорангидрида 3-О-ацетил-ГЛК (III) в 50 мл хлористого метилена при перемешивании и охлаждении в бане со льдом (0–5°С) прибавляли по каплям 11.0 мл (36 ммоль) гидразин-гидрата (85%) и перемешивали 1 ч. Затем промывали смесь 5% раствором NaHCO3 (100 мл), водой (100 мл), сушили MgSO4 и упаривали. Остаток хроматографировали на колонке с СГ, элюируя смесью бензол–этанол, 300 : 1, 200 : 1, 100 : 1 (по объему). Выход 1.5 г, 75%. Rf 0.60 (А). $[\alpha ]_{D}^{{20}}$ + 175° (с 0.04, СН2Сl2). ИК (ν, см–1): 3387 (NH), 1733 (OAc), 1658 (C11=O). Спектр 1Н-ЯМР (500 МГц): 8.52 (уш.с., 1Н, CONH), 5.53 (c, 1H, H12), 4.50 (дд, 1H, J 11.6 и 4.5, H3), 2.80 (дд, 1H, J 10.6 и 3.4, H18), 2.32 (м, 1H, Н1b), 2.31 (с, 1Н, Н9), 2.18 (дт, 1Н, J 12.8 и 2.5, H1a), 2.06 (c, 3H, COCH3), 2.05–1.85 (м, 3H, Н16b, H2b ), 1.80 (тд, 1H, J 13.7 и 4.1, H2a), 1.70–1.52 (м, 7H, 2Н6, Н19b, H15b, H21b, H22b), 1.50–1.30 (м, 7H, Н7а, Н15а, Н16а, Н19а, Н22а, NH2), 1.31 (c, 3H, C27Н3), 1.25 (c, 3H, C26H3), 1.12 (c, 3H, C25H3), 1.09 (c, 3H, C29H3), 1.00 (м, 1Н, Н21а), 0.88, 0.87 (2 с, 6H, С23Н3, С24Н3), 0.80 (м, 1Н, Н5), 0.75 (с, 3Н, С28Н3). Спектр 13С-ЯМР (125 МГц): 200.1 (С11), 174.8 (С30), 171.0 (СОСН3), 170.0 (С13), 127.9 (С12), 80.6 (С3), 61.7 (С9), 55.0 (С5), 48.6 (С18), 45.4 (С20), 43.3 (С14), 43.2 (С8), 40.7 (С19), 38.8 (С1), 38.0 (С4), 37.4 (С22), 36.9 (С10), 32.7 (С7), 31.8 (С17), 31.3 (С21), 29.0 (С29), 28.5 (С38), 28.0 (С28), 26.5 (С16), 26.2 (С15), 23.5 (С2), 23.3 (С27), 21.4 (СОСН3), 18.9 (С26), 17.3 (С6), 16.6 (С24), 16.1 (С25). Найдено, %: С 72.65, Н 9.52, N 5.22. C32H50O4N2. Вычислено, %: С 72.96, Н 9.67, N 5.32. m/z 526.73 [М+].
Общая методика получения N'-бензилиденгидразидов (V)–(IX). Смесь 0.5 ммоль (0.26 г) гидразида (IV) и соответствующего ароматического альдегида (0.5–0.6 ммоль) в 10 мл этанола кипятили 6 ч. Затем реакционную смесь разбавляли 1% раствором соляной кислоты (10 мл), осадок отфильтровывали, промывали водой, сушили и хроматографировали на колонке с СГ, элюируя бензолом и смесью бензол–этанол, 300 : 1, 200 : 1, 100 : 1 (по объему). Индивидуальные по ТСХ фракции объединяли и упаривали.
N'-Бензилиденгидразид 3-ацетокси-18βН-олеан-12-ен-11-он-30-овой кислоты (V). Выход 0.22 г, 72%. Rf 0.60 (А), $[\alpha ]_{D}^{{20}}$ + 144° (с 0.06, CHCl3). ИК (ν, см–1): 3330 (NH), 1729 (Ac), 1652 (C11=O), 1647, 1620 (C6H5). Спектр 1Н-ЯМР (300 МГц): 8.95, 8.50 (оба с., 2Н, СОNH, N=CH), 7.54–7.26 (м, 5Н, С6Н5), 5.67 (c, 1H, H12), 4.52 (м, 1Н, Н3), 2.04 (с, 3Н, СОСН3), 1.85–1.1.50 (м, СН, СН2 в пентациклическом скелете), 1.30 (c, 3H, C27H3), 1.25 (c, 6H, C26H3, C25H3), 1.17 (c, 3H, C29H3), 1.00 (c, 3H, С28Н3), 0.86 (c, 6H, C23H3, С24Н3), 0.73 (с, 3Н, С28Н3). Спектр 13С-ЯМР (75.5 МГц): 200.2 (С11), 175.0 (С30), 171.1 (COCH3), 170.1 (C13), 149.0 (N=CH), 130.0–122.0 (С1'–С6', С12), 80.6 (С3), 61.6 (С9), 55.0 (С5), 48.4 (С18), 45.4 (С20), 43.3 (С14), 43.2 (С8), 40.7 (С19), 38.8 (С1), 38.0 (С4), 37.4 (С22), 36.8 (С10), 32.7 (С7), 31.9 (С17), 31.2 (С21), 29.2 (С29), 28.4 (С23), 28.0 (С28), 26.4, 26.3 (C16, С15), 23.5 (С2), 23.3 (С27), 21.8 (COCH3), 18.7 (С26), 17.3 (С6), 16.6 (С24), 16.3 (С25). Найдено, %: С 75.95, Н 8.72, N 4.42. С39Н54N2O4. Вычислено, %: С 76.18, Н 8.85, N 4.56. m/z 614.83 [М+].
N'-(4-Метоксибензилиден)гидразид 3-О-ацетокси-18βН-олеан-12-ен-11-он-30-овой кислоты (VI). Выход 0.22 г, 70%. Rf 0.52, $[\alpha ]_{D}^{{20}}$ + 152° (c 0.05, СНCl3). ИК-спектр, ν, см–1: 3360 (NH), 1729 (Ac), 1658 (C11=O), 1596, 1588 (C6H4). Спектр 1Н-ЯМР (500 МГц): 9.83, 8.76 (оба с., 2H, CONH, N=CH), 8.01, 7.83 (оба д, 2Н, J 8.6, Н2', Н6'), 7.01, 6.90 (оба д, 2Н, J 8.9, Н3', Н5'), 5.65 (с, 1Н, Н12), 4.50 (дд, 1Н, J 11.8 и 4.5, Н3), 3.88 (с, 3Н, ОСН3), 2.75 (дд, 1Н, J 11.6 и 3.5, Н18), 2.29 (с, 1Н, Н9), 2.17 (дд, 1Н, J 12.3 и 3.3, Н1b), 2.01 (c, 3H, COCH3), 2.00–1.90 (м, 4H, ${\text{H1}}_{{\text{a}}}^{'},$ Н2b, H16b), 1.73 (тд, 1H, J 13.1 и 4.5, Н2а), 1.70–1.50 (м, 7Н, 2Н6, Н7b, H19b, H15b, H21b, H22b), 1.45–1.30 (м, 5H, Н7а, Н15а, Н16а, Н22а, Н19а), 1.29 (с, 3Н, С27Н3), 1.23 (с, 3Н, С26Н3), 1.21 (с, 3Н, С25Н3), 1.15 (с, 3Н, С29Н3), 1.05 (с, 3Н, С28Н3), 0.95 (м, 1Н, Н21а), 0.83, 0.81 (оба с, 6Н, С23Н3, С24Н3), 0.75 (м, 1Н, Н5). Спектр 13С-ЯМР (75.5 МГц): 200.0 (С11), 174.7 (С30), 171.0 (СОCH3), 169.8 (С13), 164.5, 159.5 (N=CH, C4'), 131.9–114.3 (С1'–C3', C5', C6', C12), 80.6 (С3), 61.7 (С9), 55.5, 55.0 (C5, ОСН3), 48.4 (С18), 45.4 (С20), 43.3 (С14), 43.2 (С8), 40.8 (С19), 38.8 (С1), 38.0 (С4), 37.4 (С22), 36.9 (С10), 32.7 (С7), 31.8 (С17), 31.3 (С21), 29.0 (С29), 28.5 (С23), 28.0 (С28), 26.5 (С16), 26.2 (С15), 23.5 (C2), 23.3 (С27), 21.3 (СOCН3), 18.9 (С26), 17.3 (С6), 16.6 (С24), 16.1 (С25). Найдено, %: C 74.30, H 8.64, N 4.22. C40H56N2O6. Вычислено, %: C 74.49, H 8.76, N 4.34. М 644.86.
N'-(3-Метоксибензилиден)гидразид 3-О-ацетокси-18βН-олеан-12-ен-11-он-30-овой кислоты (VII). Выход 0.24 г, 75%. Rf 0.65(А), $[\alpha ]_{D}^{{20}}$ + 146° (с 0.08, CHCl3). ИК-спектр, ν, см–1: 3214 (NH), 1727 (Ас), 1658 (C11=O), 1609, 1600, 1586 (C6H4). Спектр 1Н-ЯМР (500 МГц): 9.97, 8.88 (оба с., 2Н, CONН, N=CH), 7.69 (д, 1H, J 7.7, H6''), 7.60 (c, 1H, H2'), 7.45 (д, 1H, J 7.5, H4'), 7.35 (т, 1H, J 7.9, H5'), 7.14 (д, 1H, J 7.8, H3'), 5.70 (c, 1H, H12), 4.50 (дд, 1H, J 11.5 и 4.7, Н3), 3.86 (с, 3Н, ОСН3), 2.78 (дд, 1Н, J 13.3 и 3.4, Н18), 2.30 (с, 1Н, Н9), 2.18 (м, 1H, Н1b), 2.04 (c, 3H, COCH3), 2.00-1. 93 (м, 3Н, Н1а, H2b, Н16b), 1.77 (тд, 1Н, Н2а, J 13.3 и 4.4), 1.70–1.50 (м, 7Н, 2Н6, Н7b, H19b, H15b, H21b, H22b), 1.45–1.30 (м, 5H, Н7а, Н15а, Н16а, Н19а, Н22а), 1.32 (с, 3Н, С27Н3), 1.25 (с, 3Н, С26Н3), 1.15 (3Н, с, С25Н3), 1.08 (с, 3Н, С29Н3), 0.86, 0.84 (оба с, 6Н, С23Н3, С24Н3), 0.79 (м, 1Н, Н5), 0.75 (с, 3Н, С28Н3). Спектр ЯМР 13С (125 МГц): 200.0 (С11), 175.2 (С30), 171.0 (СОСН3), 169.7 (С13), 160.2, 159.6 (N=CH, С3'), 130.9–114.5 (С1', С2', С4'–С6', C12), 80.7 (C3), 61.7 (C9), 55.4, 55.1 (C5, OCH3), 48.3 (C18), 45.4 (C20), 43.3 (C14), 43.2 (C8), 40.9 (C19), 38.8 (C1), 38.0 (C4), 37.4 (C22), 36.9 (C10), 32.7 (C7), 31.8 (C17), 31.5 (C21), 29.0 (C29), 28.5 (C23), 28.0 (C28), 26.5 (C16), 26.3 (C15), 23.5 (C2), 23.3 (C27), 21.2 (COCH3), 18.8 (C26), 17.3 (C6), 16.6 (C24), 16.2 (C25). Найдено, %: С 74.25, Н 8.73, N 4.25. C40H56N2O5. Вычислено, %: C 74.49, H 8.76, N 4.34. М 644.86.
N'-(4-Гидроксибензилиден)-гидразид 3-О-ацетокси-18βН-олеан-12-ен-11-он-30-овой кислоты (VIII). Выход 0.23 г, 74%. Rf 0.55 (А), $[\alpha ]_{D}^{{20}}$ + 162° (c 0.04, CHCl3). ИК-спектр, ν, см–1: 3408 (NH), 1733 (Ac), 1661 (C11=O), 1620, 1604 (C6H5). Спектр ЯМР 1Н (300 МГц, CDCl3, δ, м.д.): 9.82, 8.85 (оба c, 2H, CONH, N=CH), 7.75–6.98 (м, 4H, Н2', H3', H5', Н6'), 5.65 (c, 1H, H12), 4.51 (дд, 1H, J 11.1 и 4.6, Н3), 2.83 (д, 1Н, J 12.9, H18), 2.30 (c, 1H, H9), 2.04 (c, 3H, COCH3), 1.90–1.36 (м, СН, СН2 в пентациклическом скелете), 1.31 (с, 3Н, С27Н3), 1.27 (с, 3Н, С26Н3), 1.16 (с, 3Н, С25Н3), 1.08 (с, 3Н, С29Н3), 0.86, 0.84 (с, 6Н, С23Н3, С24Н3), 0.72 (с, 3Н, С28Н3). Спектр ЯМР 13С (75.5 МГц), 200.3 (С11), 175.0 (С30), 171.1 (СОCH3), 170.1 (С13), 162.8, 159.9 (N=CH, C4'), 132.2–116.1 (C1'–C3', C5', C6', C12), 80.7 (С3), 61.7 (С9), 55.1 (С5), 48.5 (С18), 45.5 (С20), 43.4 (С14), 43.2 (С8), 40.8 (С19), 38.8 (С1), 38.0 (С4), 37.4 (С22), 36.9 (С10), 32.7 (С7), 31.8 (С17), 31.3 (С21), 29.1 (С29), 28.5 (С23), 28.1 (С28), 26.5 (С16), 26.2 (С15), 23.5 (C2), 23.3 (С27), 18.9 (С26), 17.3 (С6), 16.6, 16.1 (С24, C25). Найдено, %: С 74.19, Н 8.62, N 4.26. C40H54N2O5. Вычислено, %: C 74.25, H 8.63, N 4.44. М 630.83. m/z, 631.5 [M + + H]+, 629.5 [M – H]–.
N'-(4,4-Диметиламино-бензилиден)гидразид 3-О-ацетокси-18βН-олеан-12-ен-11-он-30-овой кислоты (IX). Выход 0.23 г, 72%. Rf 0.58 (А), $[\alpha ]_{D}^{{20}}$ + + 150° (c 0.07, CHCl3). ИК-спектр, ν, см–1: 3408 (NH), 1733 (Ac), 1662 (C11=O), 1620, 1599 (Ph). Спектр ЯМР 1Н (300 МГц): 9.73, 8.55 (2Н, с, CONH, N=CH), 7.74–6.67 (2H, м, H2', H3', H5', H6'), 5.71 (1H, c, H12), 4.49 (1H, дд, J 11.0 и 4.0, Н3), 3.07, 2.99 (6H, оба с, N(CH3)2), 2.04 (3H, c, COCH3), 1.80–1.50 (м, СН, СН2 в пентациклическом скелете), 1.36 (3Н, с, С27Н3), 1.22 (3Н, с, С26Н3), 1.15 (3Н, с, С25Н3), 1.10 (3Н, с, С29Н3), 0.88 (6Н, с, С23Н3, С24Н3), 0.80 (3Н, с, С28Н3). Спектр ЯМР 13С (75.5 МГц), 200.1 (С11), 174.8 (С30), 171.0 (СОСН3), 169.4 (С13), 154.4, 144.5 (N=CH, С4'), 132.0–111.0 (C1'–C3', C12), 80.7 (C3), 61.7 (C9), 55.0 (C5), 48.1 (C18), 45.4 (C20), 43.3 (C14), 43.2 (C8), 40.1 (C19), 38.8 (C1), 38.0 (C4), 37.4 (C22), 36.9 (C10), 32.7 (C7), 31.8 (C17), 31.3 (C21), 29.2 (C29), 28.5 (C23), 28.1 (C28), 26.5 (C16), 26.4 (C15), 23.6 (C2), 23.3 (C27), 21.3 (CH3), 18.76 (C26), 17.4 (C6), 16.7 (C24), 16.3 (C25). Найдено, %: С 73.91, Н 8.82, N 6.50. C39H57N3O4. Вычислено, %: C 74.13, H 9.09, N 6.65. М 631.86.
Изучение противомикробной активности соединений
В работе были использованы депонированные штаммы микроорганизмов ГИСК (Государственный научно-исследовательский институт стандартизации и контроля медицинских биологических препаратов им. Тарасевича Минздрава России) музея кафедры микробиологии и вирусологии ГБОУ ВПО БГМУ Минздрава России: Escherichia coli, Proteus vulgaris, Klebsiella pneumonia, Staphylococcus aureus, Citrobacter diversus, Enterobacter aerogenes, Pseudomonas aeroginosa, Enterobacter cloace и Candida albicans.
Противомикробную активность исследуемых соединений определяли методом “диффузии в агар” и десятикратных серийных разведений в мясопептонном бульоне (МПБ) согласно [10, 11]. Предварительно готовили раствор, содержащий 100 мг изучаемого соединения в 1 мл DMSO с последующим разведением МПБ до рабочей концентрации 10 мг/мл. В ряд пробирок с последовательными десятикратно убывающими концентрациями исследованных соединений в МПБ вносили тестовые культуры микроорганизмов. При этом микробная нагрузка составила 2.0 × 106 микробных тел в 1 мл питательной среды. Посевы инкубировали при 37°С в течение 72 ч и при 25°С в течение 48 ч, после чего визуально оценивали наличие или отсутствие роста тест-культур. Данные МИК выражены как среднее значение двух измерений. В качестве препаратов сравнения использовали цефтриаксон (Шрея, Индия) и пимафуцин (Астеллас, Нидерланды).
Список литературы
Rice L.B. // Biochem. Pharmacol. 2006. V. 71. P. 991–995.
Barlocco D., Meneghetti F. // Molecules. 2017. V. 22. P. 1127.
Тевяшова А.Н., Олсуфьева Е.Н., Преображенская М.Н. // Успехи химии. 2015. Т. 84. С. 61–97.
Covan M.M. // Clin. Microbiol. Rev. 1999. V. 12. P. 564–582.
Cain R., Narramore S., McPhillie M., Simmons K., Fishwick C.W.G. // Bioorg. Chem. 2014. V. 55. P. 69–76.
Fontany S., Grare M., Mayer J., Finance Ch., Duval R.E. // J. Ethnopharm. 2008. V. 120. P. 272–276.
Толстиков Г.А., Балтина Л.А., Гранкина В.П., Кондратенко Р.М., Толстикова Т.Г. Солодка: биоразнообразие, химия, применение в медицине. Новосибирск: Акад. Изд-во “Гео”, 2007. 311 с.
Wang L., Yang R., Yaun B., Liu Y., Liu Ch. // Acta Pharm. Sinica B. 2015. V. 5. P. 310–315.
Li H.-E., Qiu J.-Zh., Yang Zh.-Q., Dong J., Wang J.-F., Luo M.-J., Pan J., Dai X.-H., Zhang Y., Song B.-L., Deng X.-M. // Fitoterapia. 2012. V. 83. P. 241–248.
Руководство по проведению доклинических исследований лекарственных средств / Под ред. Миронова А.Н. Часть первая. М.: Гриф и К, 2012. 672 с.
Балтина Л.А., Булгаков А.К., Губайдуллин А.Г., Кондратенко Р.М. // Евразийский Союз ученых. 2018. С. 36–39.
Baltina L.A., Jr., Khudobko M.V., Mikhailova L.R., Baltina L.A., Fedorova V.A., Orshanskaya Ya.A., Zarubaev V.V., Kiselev O.I. // Chem. Nat. Compd. 2014. V. 50. P. 473–477.
Flekhter O.B., Boreko E.I., Nigmatullina L.R., Pavlova N.I., Nikolaeva S.N., Savinova O.V., Eremin V.F., Baltina L.A., Galin F.Z., Tolstikov G.A. // Russian J. Bioorg. Chem. 2003. V. 29. P. 296–301.
Гордон А.Дж., Форд Р.А. Спутник химика. Пер. с англ. М.: Мир, 1976.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия