Биоорганическая химия, 2020, T. 46, № 2, стр. 220-224
Способ эмульсионной ПЦР-амплификации ДНК-библиотек с вырожденной центральной частью, предназначенный для селекции аптамеров
В. Е. Кузнецова , В. Е. Шершов , Р. А. Мифтахов , С. А. Лапа , А. С. Заседателев , Э. Н. Тимофеев , А. В. Чудинов
Институт молекулярной биологии им. В.А. Энгельгардта РАН
119991 Москва, ул. Вавилова, 32, Россия
Поступила в редакцию 27.09.2019
После доработки 07.10.2019
Принята к публикации 05.11.2019
Аннотация
Для эмульсионной ПЦР-амплификации комбинаторных библиотек олигонуклеотидов оптимизированы условия стабильной генерации эмульсий “вода-в-масле” с каплями оптимального размера при использовании 3% силиконового эмульгатора ABIL EM 180 с добавлением 0.5% Triton Х100 в минеральном масле в режиме контролируемого механического перемешивания.
Аптамерами называются короткие одноцепочечные олигонуклеотиды, обладающие определенной пространственной структурой и, благодаря этому, способные с высокой аффинностью и специфичностью связываться с молекулами-мишенями различной природы [1]. Аптамеры получают направленным отбором in vitro из комбинаторных библиотек олигонуклеотидов, содержащих вырожденные последовательности длиной 40 нт, фланкированные константными участками длиной около 20 нт, которые при селекции используют в качестве зон отжига праймеров для ПЦР-амплификации [2].
Важным этапом при селекции аптамеров из библиотеки олигонуклеотидов является проведение реакции амплификации после раунда отбора (SELEX) связавшихся с молекулой-мишенью вариантов аптамеров [3]. Применение традиционного метода ПЦР приводит к избирательному накоплению ампликонов, а также к появлению длинноцепочечных ПЦР-продуктов [4–6], образование которых можно минимизировать проведением ПЦР в водно-масляной эмульсии. Высокоэффективная ПЦР в эмульсии предполагает проведение процесса в миллионах изолированных микрореакторов и позволяет получить тысячи копий единственного фрагмента ДНК. Принцип проведения эмульсионной ПЦР заключается в добавлении водного раствора компонентов ПЦР в смесь минерального масла и эмульгатора с таким расчетом, чтобы каждая молекула ДНК оказалась в изолированной водной микрокапле [6]. Этот подход позволяет минимизировать потери отдельных исходных матриц [7]. Для того чтобы выполнять манипуляции с эмульсией, такие, как воспроизводимая генерация, амплификация при высокой температуре, перенос эмульсии, важно использовать эмульгаторы, дающие стабильные эмульсии воды в масле. В большинстве случаев такие эмульгаторы являются амфифильными молекулами с гидрофобными и гидрофильными группами [8]. Наиболее простым решением этих задач является использование высокоэффективных биосовместимых эмульгаторов (Span 80, Tween 20, Triton X100 [6, 9]; ABIL EM 90 и Triton X100 [6, 10, 11]; ABIL EM 180 [12]; Span 80 и brij 35 [13], Span 80 и brij L4 [14]) и минерального, а также синтетического (Tegosoft Dec, ABIL WE09) масла [15, 16]. Поверхностно-активные вещества (ПАВ) адсорбируются на границе раздела “масло–вода” и снижают поверхностное натяжение, что препятствует слиянию капель и придает им метастабильность [17]. Взаимодействие биологических молекул (белков, ДНК, РНК) с границей раздела “масло-вода” может привести к денатурации и локализации молекул на поверхности [18]. Диффузия молекул в масляную фазу может привести к потере ПЦР-продукта и перекрестной контаминации в микрокаплях [19].
В качестве непрерывной фазы применяли минеральное масло (Sigma-Aldrich Corp., США) с добавлением ПАВ, представленных в табл. 1. ABIL EМ 180 [12, 17] обладает хорошей термостабильностью и совместимостью с электролитами, а его применение в парфюмерной промышленности свидетельствует о хорошей биосовместимости. В качестве дисперсной фазы использовали раствор ПЦР-смеси постоянного состава. По результатам исследований определены режимы и условия стабильной генерации эмульсий с каплями оптимального размера, такие как температура, интенсивность перемешивания, концентрации ПАВ и дисперсной фазы.
Таблица 1.
Условия получения водно-масляной эмульсии
| Состав эмульсии | Емкость | Каталожный номер | Магнитный перемешивающий элемент, тефлон | Каталожный номер | Стабильность эмульсии после проведения ПЦР | ПЦР продукт |
|---|---|---|---|---|---|---|
| 3% ABIL EM 180– 0.5% Triton X100* | Пробирка 2 мл, типа Эппендорф, с замком Safe-Lock | Eppendorf-0030123344 | Круглый цилиндрический, 2 × 7 мм | Brand, 137106 | + | +/− |
| Эллиптический, 5 × 10 мм | Brand, 137300 | + | +/− | |||
| Треугольный, 5 × 10 мм | Sigma-Aldrich, 23226 | + | + | |||
| Вортекс Микроспин | FV-2400 | + | +/− | |||
| Пробирка 2 мл, с юбкой, с резьбой | SSI-2340-00 | Круглый цилиндрический, 3 × 8 мм | Brand, 137104 | + | +/− | |
| Криопробирка 2.0 мл, с юбкой, наруж. резьба, круглое дно | Nunc (Thermo Scientific) NC TSI-3-D2 | + | +/− | |||
| 3% ABIL EM 180– 0.05% Triton X100* | Пробирка 2 мл, типа Эппендорф, с замком Safe-Lock | Eppendorf-0030123344 | Треугольный, 5 × 10 мм | Sigma-Aldrich, 23226 | − | − |
| Криопробирка 2.0 мл, с юбкой, наруж. резьба, круглое дно | Nunc (Thermo Scientific) NC TSI-3-D2 | Круглый цилиндрический, 3 × 8 мм | Brand, 137104 | + | +/− | |
| 5% Span 80–0.5% brij L4* | Пробирка 2 мл, типа Эппендорф, с замком Safe-Lock | Eppendorf-0030123344 | Треугольный, 5 × 10 мм | Sigma-Aldrich, 23226 | − | − |
| Пробирка 2 мл, с юбкой, с резьбой | SSI-2340-00 | Круглый цилиндрический, 3 × 8 мм | Brand, 137104 | + | − | |
| Криопробирка 2.0 мл, с юбкой, наруж. резьба, круглое дно | Nunc (Thermo Scientific) NC TSI-3-D2 | + | − |
Воспроизводимые результаты при формировании эмульсии получены при использовании ABIL EM 180 с концентрацией 3% с добавлением 0.5% Triton Х100 в режиме механического перемешивания со скоростью 1400 об./мин. Было показано, что сочетание состава масляной фазы и разных видов магнитных перемешивающих элементов позволяет добиться устойчивой генерации эмульсии c микрокаплями оптимального размера (табл. 1).
Скорость перемешивания оказывает сильное влияние на размер микрокапель дисперсной фазы в эмульсиях, получаемых методом механического перемешивания. Экспериментально найдено, что при недостаточно высокой скорости перемешивания происходит коалесценция (слияние) капель в получаемой эмульсии, а увеличение интенсивности перемешивания (центрифуга – вортекс Микроспин FV-2400) приводит к уменьшению размера капель, что в свою очередь снижает выход продуктов амплификации ДНК в ходе эмульсионной ПЦР.
Нами изучено влияние концентрации эмульгатора и доли дисперсной фазы на эффективность амплификации комбинаторной библиотеки ДНК, которая непосредственно связана с размером микрокапель дисперсной фазы. С ростом концентрации ПАВ до определенного предела средний размер капель в эмульсиях уменьшается [20], в то время как низкая концентрация эмульгатора приводит к коалесценции капель. Такое же влияние оказывает высокая концентрация дисперсной фазы, при которой водные микрокапли находятся на более близком расстоянии друг от друга, что приводит к их слиянию и увеличению диаметра.
Для проведения эмульсионной ПЦР оптимизированы различные параметры, такие как начальная концентрация матрицы, температура отжига и концентрация праймеров, концентрация ДНК-полимеразы. Помимо температурной устойчивости капель начальная концентрация матрицы является наиболее важным параметром эмульсионной ПЦР. Слишком высокая концентрация ДНК-матрицы в реакционной смеси ингибирует ПЦР, а также приводит к неспецифической амплификации.
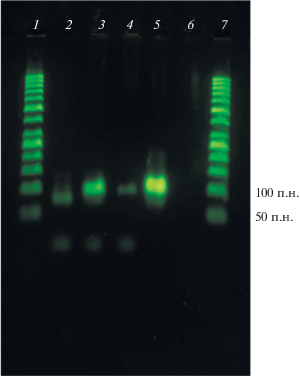
Другим важным параметром является концентрация бычьего сывороточного альбумина, (BSA), который добавляют к дисперсной фазе [11, 16]. Присутствие глобулярного белка в водной микрокапле необходимо для предотвращения сорбции ДНК-полимеразы на поверхности раздела фаз “масло-вода” и ее денатурации. Экспериментально определена оптимальная концентрация BSA, составившая 0.5 мг/мл, для проведения ПЦР-амплификации с высокой эффективностью (рис. 1). Отсутствие BSA или его высокая концентрация в дисперсной фазе привела к резкому уменьшению эффективности ПЦР-амплификации.
Рис. 1.
Гель-электрофорез в 2% агарозном геле продуктов эмульсионной ПЦР-амплификации ДНК-библиотеки, полученных с добавлением BSA в концентрации 0, 0.5, 1 мг/мл (дорожки 2–4 соответственно). Положительный контроль, продукты традиционной ПЦР-амплификации ДНК-библиотеки (дорожка 5), отрицательный контроль – результаты эмульсионной ПЦР-амплификации ДНК-библиотеки, полученные при отсутствии матрицы (дорожка 6); маркеры длин дцДНК GeneRuler 50 п.н. (дорожки 1 и 7).
Результаты исследований по изучению температурной стабильности эмульсии показали, что добавление 3% ABIL EM 180 и 0.5% Triton X100 в минеральное масло позволяет обеспечить температурную устойчивость эмульсии (72°С в течение, как минимум, 4 ч), что необходимо для реализации ПЦР-амплификации. Таким образом, в работе продемонстрированы преимущества и условия проведения ПЦР в водно-масляной эмульсии для амплификации комбинаторных библиотек олигонуклеотидов с высокой степенью эффективности.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Библиотеку одноцепочечных ДНК (оцДНК-библиотеку) получали стандартными методами синтеза однонитевых олигонуклеотидов, при синтезе вырожденной части в реакцию добавляли смесь всех четырех производных дезоксирибонуклеотидов. Для ферментативного получения немодифицированной универсальной инициирующей ДНК-библиотеки сконструированы и синтезированы матричные олигонуклеотиды с вырожденной центральной частью и взаимно комплементарными фланкирующими частями (5'–3'):
матрица GCT CCT GAC GAT CGA CGA CCG AG-(N)40-GCA ACT GCA GCA TGC TTC GCA TT;
прямой праймер GCT CCT GAC GAT CGA CGA CCG AG;
обратный праймер AAT GCG AAG CAT GCT GCA GTT GC.
Для создания органической фазы эмульсионной ПЦР использовали минеральное масло (Sigma-Aldrich, США), эмульгатор Abil EM 180 (Evonik, Германия), Triton X100 (Sigma Aldrich, США). Предварительно получали эмульсию ABIL EM 180 с концентрацией 3% с добавлением 0.5% Triton X100 в минеральном масле в режиме механического перемешивания со скоростью 1000 об./мин при 50°С в течение 8 ч. Полученную эмульсию хранили при 5°С, перед использованием тщательно перемешивали на магнитной мешалке в течение 15 мин при комнатной температуре. Водно-масляную эмульсию получали при использовании пробирки типа Эппендорф с замком объемом 2 мл и магнитного перемешивающего элемента (Sigma-Aldrich, 23226, США). Охлажденный до 5°С раствор ПЦР-смеси (100 мкл) в течение 2 мин добавляли порциями по 13 мкл к раствору масляной фазы (600 мкл) при перемешивании на магнитной мешалке (Heidolph MR Hai-tec, Германия) при 1400 об./мин на льду и продолжали перемешивание в течение 6 мин.
Водная фаза содержала 10-кратный ПЦР-буфер (Sibenzyme, США), 2.5 мМ MgSO4, dATP, dCTP, dGTP и dTTP (Thermo Scientific, США), каждый в концентрации 0.4 мМ, праймеры прямой и обратный, каждый в концентрации 0.6 мкМ, матрицу в концентрации 0.01 нМ, 0.5 мг/мл BSA (Fermentas, США) и ДНК-полимеразу Taq (Sibenzyme, США) в концентрации 0.1 ед. акт./мкл.
Амплификацию проводили на автоматическом термоциклере (Bio Rad DNA Engine DYAD Thermal Cycler, США) с использованием активного точного режима регулирования температуры и следующего температурно-временного профиля: предварительный прогрев при 95°С в течение 5 мин, за которым следовали 30 циклов: 95°С – 30 с, 65°С – 30 с, 72°С – 1 мин. Завершающую элонгацию проводили при 72°С в течение 5 мин.
Полученные продукты ПЦР выделяли из водно-эмульсионной смеси последовательной экстракцией диэтиловым эфиром и н-бутанолом с переосаждением 2% раствором перхлората лития в ацетоне [6].
Для проведения электрофореза использовали 2% агарозный гель в буфере ТВЕ (Sigma-Aldrich, США). Пробы смешивали с буфером для нанесения, содержащим краситель SYBRGreen (Sigma-Aldrich, США). Электрофорез проводили в буфере TBE при напряжении 110 В. По окончании электрофореза ДНК визуализировали в ультрафиолетовом свете при длине волны 254 нм на трансиллюминаторе (LKB, Швеция).
Список литературы
Vincent J.B. Ruigrok. Selection and characterization of DNA aptamers. 2013. 160 p.
Gold L., Ayers D., Bertino J., Bock C., Bock A., Brody E., Carter J., Dalby A., Eaton B., Fitzwater T., Flather D., Forbes A., Foreman T., Fowler C., Gawande B., Goss M., Gunn M., Gupta S., Halladay D., Heil J., Heilig J., Hicke B., Husar G., Janjic N., Jarvis T., Jennings S., Katilius E., Keeney T., Kim N., Koch T., Kraemer S., Kroiss L., Le N., Levine D., Lindsey W., Lollo B., Mayfield W., Mehan M., Mehler R., Nelson S., Nelson M., Nieuwlandt D., Nikrad M., Ochsner U., Ostroff R., Otis M., Parker T., Pietrasiewicz S., Resnicow D., Rohloff J., Sanders G., Sattin S., Schneider D., Singer B., Stanton M., Sterkel A., Stewart A., Stratford S., Vaught J., Vrkljan M., Walker J., Watrobka M., Waugh S., Weiss A., Wilcox S., Wolfson A., Wolk S., Zhang C., Zichi D. // PLoS One. 2010. V. 5. № 12. e15 004.
Sefah K., Shangguan D., Xiong X., O’Donoghue M.B., Tan W. // Nat. Protoc. 2010. V. 5. № 6. P. 1169–1185.
Nakano M., Komatsu J., Matsuura S., Takashima K., Katsura S., Mizuno A. // J. Biotechnol. 2003. V. 102. № 2. P. 117–124.
Musyanovych A., Mailänder V., Landfester K. // Biomacromolecules. 2005. V. 6. № 4. P. 1824–1828.
Williams R., Peisajovich S.G., Miller O.J., Magdassi S., Tawfik D.S., Griffiths A.D. // Nat. Methods. 2006. V. 3. № 7. P. 545–550.
Антонова О.С., Рудницкая Г.Е., Тупик А.Н., Буляница А.Л., Евстрапов А.А., Курочкин В.Е. // Научное приборостроение. 2011. Т. 21. № 4. С. 5–21.
Baret J.C. // Lab on a Chip. 2012. V. 12. № 3. P. 422–433.
Keke Shao, Weifeng Ding, Feng Wang, Haiquan Li, Da Ma, Huimin Wang // PLoS One. 2011. V. 6. № 9. e24 910.
Schaerli Y., Wootton R.C., Robinson T., Stein V., Dunsby C., Neil M., French P., Demello A., Abell C., Hollfelder F. // Analyt. Chem. 2008. V. 81. № 1. P. 302–306.
Murgha Yu. E., Rouillard J.-M., Gulari E. // PLoS One. 2014. V. 9. № 4. e94 752.
Terekhov S.S., Smirnov I.V., Stepanova A.V., Bobik T.V., Mokrushina Y.A., Ponomarenko N.A., Belogurov A.A., Jr., Rubtsova M.P., Kartseva O.V., Gomzikova M.O., Moskovtsev A.A., Bukatin A.S., Dubina M.V., Kostryukova E.S., Babenko V.V., Vakhitova M.T., Manolov A.I., Malakhova M.V., Kornienko M.A., Tyakht A.V., Vanyushkina A.A., Ilina E.N., Masson P, Gabibov A.G., Altman S. // PNAS. 2017. V. 114. № 10. P. 2550–2555.
Chang Y.T., Hung C.H., Chou H.L. // J. Environ. Sci. Health A Tox. Hazard Subst. Environ. Eng. 2014. V. 49. № 14. P. 1672–1684.
Pandit K.R., Rueger P.E., Calabrese R.V., Raghavan S.R., White I.M. // Colloids Surf. B Biointerfaces. 2015. V. 126. P. 489–495.
Diehl F., Li M., He Y., Kinzler K.W., Vogelstein B., Dressman D. // Nat. Methods. 2006. V. 3. № 7. P. 551–559.
Witt M., Phung N.L., Stalke A., Walter J.-G., Stahl F., von Neuhoff N., Scheper T. // Engineering in Life Sciences. 2017. V. 17. P. 953–958.
Белоусов К.И., Евстрапов А.А., Кухтевич И.В., Посмитная Я.С. Основы нанотехнологий. Часть 1, Часть 2. Учебное пособие. СПб: Университет ИТМО, 2015. 55 с.
Roach L.S., Song H., Ismagilov R.F. // Analyt. Chem. 2005. V. 77. № 3. P. 785–796.
Derkach S.R. // Adv. Colloid and Interface Sci. 2009. V. 151. № 1. P. 1–23.
Liu W., Sun D., Li C., Liu Q., Xu J. // J. Colloid Interface Sci. 2006. V. 303. P. 557–563.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


