Биоорганическая химия, 2020, T. 46, № 2, стр. 207-219
Влияние производных гидроксамовых кислот на васкулогенную мимикрию
А. А. Вартанян 1, Д. А. Хоченков 1, Ю. А. Хоченкова 1, Ю. С. Мачкова 1, Д. С. Хачатрян 2, А. В. Колотаев 2, А. Н. Балаев 3, К. А. Охманович 3, В. Н. Осипов 1
1 НМИЦ онкологии имени Н.Н. Блохина Министерства здравоохранения Российской Федерации
115478 Москва, Каширское шоссе, 24, Россия
2 НИЦ “Курчатовский институт” – Институт химических реактивов и особо чистых химических веществ
123098 Москва, пл. Академика Курчатова, 1, Россия
3 Акционерное общество “Фарм-синтез”
121357 Москва, ул. Вавилова, 15, Россия
Поступила в редакцию 25.09.2019
После доработки 08.11.2019
Принята к публикации 14.11.2019
Аннотация
Васкулогенная мимикрия – формирование васкулярных каналов, выстланных опухолевыми клетками с высоко злокачественным фенотипом – сегодня рассматривается как дополнительная система кровоснабжения опухоли. Экспериментальные исследования in vivo неоднократно демонстрировали, что васкулярные каналы формируются в областях опухоли c низкой плотностью кровеносных сосудов. Предполагается, что формирование сети таких каналов внутри опухоли поддерживают гомеостаз и предотвращает ранний некроз внутри опухоли. В работе исследовались бифункциональные соединения на основе сочетания в одной молекуле хиназолина и гидроксамовой кислоты на их способность ингибировать миграцию опухолевых клеток и васкулогенную мимикрию.
ВВЕДЕНИЕ
Концепция о том, что VEGF-индуцируемый ангиогенез действительно является фактором, лимитирующим рост опухоли, сегодня принята всеми. По данным ряда клинических исследований антиангиогенная терапия достоверно увеличивает общую выживаемость онкологических больных [1]. В то же время накапливаются факты, свидетельствующие о том, что большинство опухолей практически не отвечают на анти-VEGF терапию [2]. Одной из причин выживаемости опухолевых клеток в условиях антиангиогенной терапии может быть гетерогенность кровеносных сосудов. Формирование сосудов в опухоли происходит на фоне неконтролируемой митогенной стимуляции и измененного внеклеточного матрикса. Это приводит к замещению эндотелия в сосудах опухолевыми клетками, иногда эндотелиальные клетки могут и вовсе отсутствовать. Термин “васкулогенная мимикрия” (ВМ) – формирование опухолевыми клетками васкулярных каналов, покрытых базальной мембраной, был введен в самом конце 1999 года [3]. Образование васкулярных каналов, высланных опухолевыми клетками, является уникальной способностью клеток с высоко злокачественным клеточным фенотипом. Обнаружена высокая статистическая корреляция между появлением в опухоли ВМ и частотой метастазирования [4]. Детальное исследование роли ряда используемых в клинике антиангиогенных препаратов на модулирование ВМ in vitro показало, что эти препараты не влияют на формирование васкулярной сети опухолевыми клетками [5].
Сегодня не известно ни одного физиологического процесса – аналога ВМ у взрослых или детей. Единственным примером ВМ, встречающимся у человека, является формирование в плаценте в ходе эмбриогенеза васкулярных каналов цитотрофобластами – и потому процесс ВМ можно считать опухолеспецифичным. Этот факт открывает новые возможности блокирования роста опухоли с минимальным эффектом на нормальные физиологические процессы.
Одной из перспективных стратегий в создании новых фармацевтических препаратов в настоящее время является проектирование и синтез гибридных соединений, состоящих из двух или более различных биоактивных фрагментов, и действующих через активацию/блокирование нескольких мишеней. Совмещение двух активных групп в одной молекуле может приводить к более выраженному терапевтическому эффекту. Определенными преимуществами многоцелевые гибриды обладают также по сравнению с комбинированным терапевтическим подходом. Их отличает лучшая биодоступность, низкая токсичность, прогнозируемый фармакокинетический и фармакодинамический профиль, более простое соблюдение пациентом режима применения, более высокая эффективность лечения, а также снижение стоимости лечения (cм. обзор [6]). Обладая способностью образовывать комплексы с ионами железа, цинка, магния и кальция, гидроксамовые кислоты блокируют активность многих металлсодержащих белков. Производные гидроксамовых кислот также проявляют гипотензивное [7], антималярийное [8], противотуберкулезное [9] и фунгицидное действие [10]. С другой стороны хиназолиновый цикл присутствует в молекулах более 100 лекарственных препаратов. В настоящее время в клинической практике уже применяются различные производные хиназолина и дигидрохиназолина [11].
Современные методы химического синтеза позволяют вводить гидроксаматную группу в разнообразные природные и синтетические соединения, в том числе и в известные фармацевтические препараты [12], увеличивая их терапевтический эффект. Мы предположили, что объедение в одной молекуле хиназолинового фрагмента и гидроксамовой кислоты позволит создать новые перспективные противоопухолевые препараты.
Целью данной работы является скрининг соединений, сочетающих в одной молекуле хиназолиновый цикл и гидроксаматную группу, на их способность влиять на миграцию опухолевых клеток и ВМ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Формирование микрососудов на основе уже существующей в ткани сети сосудов, или неоангиогенез, – необходимое условие для роста опухоли [13]. Большое количество микрососудов в опухоли способствует ее быстрой пролиферации в результате постоянного поступления питания и кислорода и выведению токсических продуктов метаболизма. За последние годы более 40 антиангиогенных препаратов прошли II и III фазы клинических испытаний, и некоторые из них при комбинировании с химиотерапией оказались эффективными [1]. Однако большинство опухолей не отвечают на антиангиогенную терапию [2]. Гетерогенность опухолевых сосудов может быть ключевым фактором: в опухоли классический ангиогенез идет параллельно с формированием мозаичных сосудов, наблюдается также кооптация сосудов (vessel co-option), при которой опухоль растет вдоль уже существующих в ткани сосудов [14]. В многочисленных исследованиях, проводимых в последние годы, было показано, что присутствие компонентов ВМ в опухолевом материале больных коррелирует с быстрой прогрессией опухоли, повышением метастазирования и, как следствие, короткой выживаемостью больных [3]. Интересно отметить, что васкулярные каналы, выстланные опухолевыми клетками, обнаруживаются в тех участках опухоли, где низкая плотность кровеносных сосудов. Полученные нами за последние годы результаты позволили сформулировать концепцию, что антиангиогенная терапия активирует формирование васкулярных каналов и переводит опухоль в фазу более агрессивного роста [15]. Учитывая тот факт, что васкулярные каналы формируют опухолевые клетки с высоко злокачественным фенотипом (убивать такие клетки сегодня мы не можем), вопрос поиска низкомолекулярного ингибитора ВМ становится все более актуальным. Задачами нашего исследования явились синтез бифункциональных соединений и скрининг на их способность блокировать ВМ.
Синтез
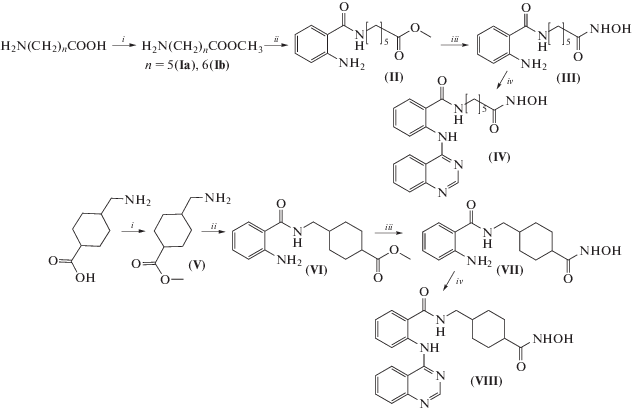
Мы предположили, что бифункциональные молекулы, состоящие из двух различных биоактивных фрагментов, и действующих через активацию/блокирование нескольких мишеней смогли бы эффективно ингибировать ВМ. Для этого нами синтезировано несколько групп соединений, содержащих хиназолиновый цикл и гидроксаматную функцию. Соединения (IV) и (VII) синтезированы общим методом (cхема 1). Из аминокислот на первом этапе получали эфиры, затем взаимодействием с изатовым ангидридом получали производные амидов антраниловой кислоты, далее метиловые эфиры кислот переводили в гидроксаматы реакцией с гидроксиламином. На заключительной стадии проводили конденсацию гидроксамовых кислот с 4-хлорхиназолином с образованием целевых соединений (IV) и (VIII).
Схема 1 . Реагенты и условия: (i) SOCl2/MeOH; (ii) изатовый ангидрид/Na2CO3/DMF/H2O; (iii) HCl × H2NOH/MeONa/MeOH; (iv) 4-хлорхиназолин/DMF/Δ.
Для синтеза соединений (XIIa, b) сначала конденсировали метил-4-аминобензоат с 4-хлорхиназолином, гидролизовали эфир, затем присоединяли аминоэфиры (Ia) и (Ib), и на завершающей стадии получали гидроксамовые кислоты (схема 2 ).
Схема 2 . Реагенты и условия: (i) 4-хлорхиназолин/DMF/Δ; (ii) LiOH/MeOH/H2O; (iii) (Ia) или (Ib)/TBTU/HOBt/NMM/DMF; (iv) HCl × H2NOH/MeONa/MeOH.
Соединения (XIIIa–c) получали конденсацией (III) с различными карбонильными соединениями (схема 3 ). Реакцию проводили в кипящем метаноле или этаноле в присутствии каталитических количеств пара-толуолсульфокислоты (PTSA).
Схема 3 . Реагенты и условия: MeOH или EtOH/PTSA.
Реакция 4,5-диметокси-2-формилбензойной кислоты с соединением (III) в этих условиях приводит к сложной смеси продуктов. Синтез в этом случае проводили в две стадии используя соединение (II) как исходный реагент, при этом образовывался конденсированный тетрацикл (XIIId) (схема 4 ), аналогичный описанным в работе [16].
Схема 4 . Реагенты и условия: (i) PhCl/PTSA/Δ; (ii) HCl × H2NOH/MeONa/MeOH.
Соединения (XVa–c) получали конденсацией гидроксиамида антраниловой кислоты с различными карбонильными соединениями, в результате получали производные циклической гидроксамовой кислоты (схема 5 ). При использовании производных 2-формилбензойной кислоты также образовывались конденсированные тетрациклы.
Схема 5 . Реагенты и условия: MeOH или PhCl/PTSA/Δ.
Определение цитотоксической активности
Васкулогенная мимикрия (ВМ) представлена неодинаково в разных типах опухолей. Так, при меланоме кожи более 60% кровоснабжения осуществляется через каналы ВМ; при тройном негативном раке молочной железы – 50%, при раке почки – около 40%, при саркоме мягких тканей – более 35%; при раке яичника более 15%; при раке толстой кишки – около 10% [15]. На фоне крайнего несовершенства циркуляции крови в опухоли каналы ВМ в количестве 10–15% вряд ли что-то изменят, однако 40–60% явно могут иметь существенное значение. Исходя из вышеизложенных аргументов, цитотоксическую активность соединений определяли для линий клеток меланомы, клеток рака молочной железы и клеток рака почки.
Соединения (IV), (XIIIa–d) с IС50 меньше 10 мкМ (табл. 1) были отобраны для дальнейших исследований функциональной активности.
Таблица 1.
Цитотоксическая активность соединений на клеточных линиях почечно-клеточного рака SN-12C, метастатической меланомы человека Mel Z и раке молочной железы MCF-7 in vitro
| Номера соединений | SN-12С | Mel Z | MCF-7 | |||
|---|---|---|---|---|---|---|
| IC50, мкМ | IC10, мкМ | IC50, мкМ | IC10, мкМ | IC50, мкМ | IC10, мкМ | |
| (IV) | 4.7 ± 1.5 | 2.1 ± 0.5 | 4.1 ± 0.8 | 0.9 ± 0.1 | 9.5 ± 1.58 | 2.8 ± 1.1 |
| (VIII) | >50 | >50 | >50 | >50 | >50 | >50 |
| (XIIa) | >50 | 25.0 ± 3.2 | >50 | 23.0 ± 4.8 | >50 | 28.6 ± 2.7 |
| (XIIb) | 41.7 ± 11.1 | 6.2 ± 0.6 | 28.7 ± 11.2 | 6.6 ± 2.7 | >50 | >50 |
| (XIIIa) | 3.8 ± 1.2 | 1.7 ± 0.2 | 8.1 ± 0.3 | 1.2 ± 0.3 | 7.6 ± 2.8 | 0.7 ± 0.2 |
| (XIIIb) | 4.8 ± 0.8 | 3.1 ± 0.9 | 8.9 ± 1.3 | >50 | 7.0 ± 0.1 | 0.7 ± 0.3 |
| (XIIIc) | 1.3 ± 0.6 | 0.7 ± 0.2 | 1.9 ± 0.3 | 0.9 ± 0.3 | 1.8 ± 0.5 | 0.7 ± 0.2 |
| (XIIId) | 5.7 ± 0.2 | 1.6 ± 0.3 | 5.7 ± 1.4 | 5.5 ± 1.2 | 24.4 ± 4.6 | 4.7 ± 1.8 |
| (XVa) | >50 | >50 | >50 | >50 | >50 | >50 |
| (XVb) | >50 | >50 | >50 | >50 | >50 | >50 |
| (XVc) | >50 | >50 | >50 | >50 | >50 | >50 |
| Сунитиниб | 2.4 ± 0.3 | 1.0 ± 0.5 | 2.7 ± 0.4 | 1.2 ± 0.3 | 2.9 ± 0.3 | 1.3 ± 0.2 |
Все остальные тесты (миграционный и формирование сосудоподобных структур) проводили на нецитотоксических концентрациях соединений – IC10 (90% живых клеток через 24 часа). Использование этого принципа позволяет избежать ложноположительного результата, когда, например, эффект блокирования миграции на 60% от контроля связан с гибелью клеток в течение 24 часов.
Ингибирование миграционной способности
В последние десятилетия усилия многих онкологов были направлены на исследование механизмов инициации и прогрессии злокачественной опухоли. Со временем стало понятно, что основная угроза рака – его распространение по всему организму. Больные со злокачественными опухолями умирают не от исходной опухоли, а от метастазов, дезорганизирующих функционирование пораженных ими тканей. Метастазирование, или процесс миграции клеток опухоли из первичного очага с последующим формированием вторичных опухолевых очагов (метастазов), – одна из главных трудностей в лечении онкологических заболеваний. Миграция опухолевых клеток сегодня рассматривается как ключевой этап процесса метастазирования. Поиск препаратов, ингибирующих перемещение опухолевых клеток из первичного очага в соседние или отдаленные органы, имеет фундаментальное значение и может позволить создание новых противоопухолевых препаратов, повышающих эффективность терапии.
Миграцию опухолевых клеток оценивали методом “заживления раны” с некоторыми модификациями. Монослой клеток разрушали соскабливанием и ширину миграционной поверхности анализировали через 24 часа после добавления соединений (IV), (XIIIa–d). В качестве положительного контроля использовали монослой клеток, инкубировавшихся в культуральной среде, содержащей 10% эмбриональной телячьей сыворотки (ЭТС). Отрицательным контролем, определяющим ширину “раны” – бесклеточного пространства на поверхности лунки, служили клетки, растущие в среде без сыворотки. Показано, что соединения (IV), (XIIIa–b, d) при нецитотоксических концентрациях (IC10) блокируют миграцию клеток в область “раны” всех трех типов опухолевых клеток по сравнению с контролем в диапазоне от 35 до 65%. В качестве препарата сравнения был использован таргетный ингибитор VEGFR2 cунитиниб (Selleckchem) в нецитотоксической концентрации 1 мкМ, вызывающей торможение миграционной активности на уровне 22.3% для клеток Mel Z, 28.9% – для MCF-7, 38.5% – для SN-12C. На клетках меланомы Mel Z и на клетках рака почки SN-12C наибольшей ингибирующей активностью обладало соединение (IV) – торможение миграционной активности составило 63.5 и 65.4 соответственно (рис. 1). На клетках РМЖ MCF-7 соединения (XIIIa) и (XIIId) вызывали торможение миграции 64.9 и 69.3% соответственно. Незначительное ингибирование миграции (28–30%) клеток меланомы и РМЖ наблюдалось соединением (XIIIc). На клетках рака почки SN-12C с соединением (XIIIc) ширина миграционной поверхности была сравнима с контрольным образцом (2.3%). Данные о влиянии соединений (IV), (XIIIa–d) на миграцию опухолевых клеток представлены в табл. 2. Блокирование миграции соединением (IV) было максимальным для клеток рака почки SN-12C (65.4%) и клеток меланомы Mel Z (63.5%). Эффективным ингибитором миграции клеток РМЖ MCF-7 оказалось соединение (XIIId) – 64.9%. По всей видимости, соединения (IV) и (XIIId) действуют на один из регуляторных путей, лежащих в основе перестроек актинового цитоскелета клетки. Полученные нами результаты позволяют сделать вывод о целесообразности создания новых аналогов на основе соединения (IV), и возможно, соединения (XIIId), как потенциальных ингибиторов миграции опухолевых клеток.
Рис. 1.
Ингибирование миграции клеток меланомы Mel Z, рака почки SN-12C и рака молочной железы MCF-7 (окраска трипановым синим). a – отрицательный контроль – ширина “раны”; б – положительный контроль – прирост монослоя клеток в полной среде через 24 ч, в – прирост монослоя клеток в полной среде c соединением (IV) в концентрации IC10 через 24 ч, г – прирост монослоя клеток в полной среде c сунитинибом в концентрации IC10 через 24 ч.

Таблица 2.
Торможение миграционной активности опухолевых клеток под действием производных гидроксамовой кислоты в концентрациях IC10 на клеточных линиях метастатической меланомы человека Mel Z, почечно-клеточного рака SN-12C, раке молочной железы MCF-7
| Соединение OVFV |
Торможение миграции для опухолевых клеточных линий (% от клеток без соединений) | ||
|---|---|---|---|
| SN-12С | Mel Z | MCF-7 | |
| (IV) | 65.4 | 63.5 | 55.8 |
| (XIIIa) | 58.6 | 48.5 | 64.9 |
| (XIIIb) | 14.1 | 35.5 | 54.1 |
| (XIIIc) | 2.3 | 34.1 | 28.0 |
| (XIIId) | 45.7 | 62.0 | 69.4 |
| Сунитиниб | 38.5 | 22.3 | 28.9 |
Ингибирование формирования сосудистоподобных структур
Формирование васкулярных каналов опухолевыми клетками характеризуется рядом последовательных событий: миграцией клеток, узнаванием себе подобных, формированием контактов клетка-клетка, вытягиванием клетки и образованием структур, подобным пчелиным сотам (honey-like comb). Тестом для ВМ in vitro служит формирование опухолевыми клетками сосудоподобных структур (СПС) в 3D-культуре [17]. В своих исследованиях мы в качестве гелевой матрицы использовали Матригель, лиофилизированный природный внеклеточный матрикс. Как отмечалось ранее, соединения (IV) и (XIIId) обладали наибольшей ингибирующей миграцию клеток активностью. Эти соединения в той или иной степени должны блокировать и формирование СПС, так как миграция – основной этап ВМ. Однако в многоступенчатом процессе ВМ могли участвовать и остальные три соединения. И поэтому мы исследовали влияние всех пяти соединений на формирование СПС в 3D-культуре. В контроле, на Матригеле, три типа выбранных нами опухолевых клеток формировали СПС. Когда клетки меланомы росли с соединениями (IV) и (XIIIa), формирование СПС ингибировалось на 54.4 и 47.4% соответственно. Сунитиниб ингибировал образование сети из клеток Mel Z – общая длина СПС 64.3% от контроля. На Матригеле можно было видеть наряду с формированием небольших кластеров клеток также “островки” сети, характерные для ВМ. Соединения (XIIIb–d) практически не влияли на способность клеток меланомы участвовать в ВМ. Несколько неожиданно сильным оказалось влияние соединения (IV) на формирование СПС клетками рака почки SN-12C, оно ингибировало формирование СПС на 72.7% (рис. 2). Соединения (XIIIa, b, d) на тех же клетках ингибировали формирование СПС от 56.4 до 5.3%. Сунитиниб вызывал блокирование СПС из клеток SN-12C – 47.2% от контроля (табл. 3).
Рис. 2.
Влияние соединения (IV) на формирование СПС на Матригеле клетками рака почки SN-12C и клетками меланомы Mel Z. а – клетки в полной среде RPMI-1640, б – клетки, в полной среде RPMI-1640 c соединением (IV) в концентрации IC10, в – клетки, в полной среде RPMI-1640 c сунитинибом в концентрации IC10.

Таблица 3.
Образование СПС под действием производных гидроксамовой кислоты
| Соединение OVFV |
Длина СПС в составе сети, (% от контроля) | |
|---|---|---|
| SN-12С | Mel Z | |
| (IV) | 27.3 | 45.6 |
| (XIIIa) | 43.6 | 52.6 |
| (XIIIb) | 71.8 | 77.2 |
| (XIIIc) | 94.7 | 80.3 |
| Сунитиниб | 47.2 | 64.3 |
Следует отметить, что ни одно из пяти соединений не влияло на формирование СПС клетками РМЖ (данные не приводятся).
Таким образом, синтезированы новые производные гидроксамовой кислоты, связанной с хиназолиновым циклом. Изучено их влияние на миграцию опухолевых клеток и формирование СПС. Нами показано, что соединение (IV) заметно блокирует миграцию клеток меланомы, РМЖ и рака почки, определенной по методу “заживления раны”. Также, в присутствии соединения (IV) значительно снижалось способность клеток рака почки к коммуникации, необходимой для формирования СПС. На клетках метастатической меланомы эффект этот был несколько ниже. Ни одно из пяти соединений не оказывало существенного влияния на формирования СПС клетками РМЖ. Становление ВМ – сложный биологический процесс, в котором кроме миграции и гомотипического узнавания клеток задействованы также несколько сигнальных путей. По всей видимости, соединение (IV) каким-то образом вовлекается в драйверные сигнальные пути, под контролем которых находится ВМ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все реактивы и растворители получены из коммерческих источников и использовались без дополнительной очистки. Спектры ЯМР регистрировали на Фурье ЯМР-спектрометре Bruker AVANCE III NanoBay 300 МГц (для 1H-ЯМР) и 76 МГц (для 13C ЯМР). Спектры регистрировали в режиме стабилизации по дейтерию, термостабилизация 25°С, внутренний стандарт – тетраметилсилан) в ДМСО-d6. Химические сдвиги приведены в миллионных долях (δ), КССВ – в герцах. Масс-спектры с ионизацией электроспреем (ESI-MS) получали на хроматографической системе Agilent LC/MS 1200 с масс-детектором Agilent Ion Trap 6310. Регистрацию масс-спектров высокого разрешения проводили с использованием аналитической станции ВЭЖХ-МС Agilent Infinity 1260/Thermo Scientific Orbitrap Fusion Lumos в режиме электрораспылительной ионизации. Температуру плавления определяли в открытом капилляре на анализаторе температуры плавления Mettler Toledo MP 90.
Метил (6-аминогексаноат) хлоргидрат (Ia). К 50 мл метанола при –5°С прикапывают 6.0 г (50 ммоль) хлористого тионила. Затем прибавляют 6.6 г (25 ммоль) 6-аминогексановой кислоты. Перемешивают при комнатной температуре 3 часа. Отгоняют растворитель в вакууме, добавляют 20 мл метанола и еще раз отгоняют растворитель. Выход 6.9 г (95.0%), белые кристаллы. 1H-ЯМР: 8.17 (с, 3H), 3.57 (с, 3H), 2.71 (т, J = 7.4, 2H), 2.28 (т, J = 7.4, 2H), 1.65 – 1.42 (м, 4H), 1.36 – 1.20 (м, 2H). ESI-MS, m/z: 146.1 [М + H+].
Метил(7-аминогептаноат) хлоргидрат (Ib). Получают аналогично из 7-аминогептановой кислоты. Выход 54.2%, белые кристаллы 1H-ЯМР: 8.11 (уш.с, 3H), 3.57 (с, 3H), 2.77–2.65 (м, 2H), 2.29 (т, 2H, J = 7.4), 1.61–1.44 (м, 4H), 1.36 – 1.18 (м, 4H). ESI-MS, m/z 160.1 [М + H+].
Метил trans-4-аминометилциклогексан-1-карбоксилат хлоргидрат (V). Получают аналогично из trans-4-аминометилциклогексанкарбоновой кислоты (транексамовой кислоты). Выход 93.4%, белые кристаллы. 1H ЯМР: 8.14 (уш.с, 3H), 3.57 (с, 2H), 2.60 (д, 2H, J = 6.9), 2.24 (тт, 1H, J = 12.2, 3.5), 1.97 – 1.75 (м, 4H), 1.64 – 1.47 (м, 1H), 1.28 (кд, 2H, J = 12.9, 3.2), 0.97 (кд, 2H, J = 12.9, 3.3). ESI-MS, m/z 172.1 [М + H+].
Метил 6-(2-аминобензамидо)гексаноат (II). Метиловый эфир 6-аминогексановой кислоты 15 г (83 ммоль) растворяют в 20 мл воды, 10%-ным раствором гидрокарбоната натрия доводят рН раствора до 7–8. Полученный раствор приливают к суспензии 10 г (61 ммоль) изатового ангидрида в 100 мл диметилформамида в плоскодонной колбе объемом 250 мл, полученную смесь перемешивают 2 часа при комнатной температуре. Смесь выливают в 200 мл воды, 10%-ным раствором лимонной кислоты доводят рН раствора до 3–4. Экстрагируют серным эфиром 2 по 100 мл, органический слой промывают 50 мл воды. Отгоняют растворитель, остаток кристаллизуют из 50 мл гексана. Выход 15.0 г (92%), белые кристаллы, т. пл. 53–55°С. 1H ЯМР: 8.16 (т, 1H, J = 5.7), 7.46 (дд, 1H, J = 7.9, 1.5), 7.15–7.08 (м, 1H), 6.68 (дд, 1H, J = 8.3, 1.2), 6.36 (уш. с, 2H, NH2), 3.58 (с, 3H), 3.26–3.13 (м, 2H), 2.30 (т, 2H, J = 7.4), 1.64–1.42 (м, 4H), 1.39–1.22 (м, 2H). ESI-MS, m/z 265.1 [М + H+].
Метил 4-((2-аминобензамидо)метил)циклогексан-1-карбоксилат (VI). Получают аналогично из метилового эфира транексамовой кислоты. Выход 14.3 г (89%), белые кристаллы, т. пл. 100–103°С. 1H ЯМР: 8.17 (т, 1H, J = 5.8), 7.47 (дд, 1H, J = 8.0, 1.5), 7.15 – 7.08 (м, 1H), 6.67 (дд, 1H, J = 8.2, 1.2), 6.54 – 6.46 (м, 1H), 6.36 (уш. с, 2H, NH2), 3.58 (с, 3H), 3.06 (т, 2H, J = 6.3), 2.33 – 2.17 (м, 1H), 1.90 (дд, 2H, J = 13.4, 3.5), 1.77 (дд, 2H, J = 13.2, 3.4), 1.59 – 1.40 (м, 1H), 1.28 (кд, 2H, J = 13.0, 3.3), 0.96 (кд, 2H, J = 12.9, 3.4). ESI-MS, m/z 292.2 [М + H+].
2-Амино-N-(6-(гидроксиамино)-6-оксогексил)бензамид (III). К раствору 2.64 г (0.01 моля) соединения (II) в 30 мл метанола прибавляют 30 мл раствора гидроксиламина в метаноле, полученного из 1.15 г (0.05 моля) натрия и 2.10 г (0.03 моля) хлоргидрата гидроксиламина. Перемешивают реакционную смесь 6 часов при комнатной температуре. Отгоняют метанол в вакууме, добавляют 20 мл воды, подкисляют 5%-ной лимонной кислотой до pH 4, отфильтровывают осадок, промывают 10 мл воды. Выход 2.20 г (83.3%), белые кристаллы, т. пл. 125–126°С. 1H ЯМР: 10.28 (с, 1H, NH-OH), 8.60 (с, 1H, NH-OH) 8.11 (т, 1H, CH2NH, J = 5.6), 7.44 (дд, 1H, Ar, J = 8.0, 1.5), 7.14 – 7.08 (м, 1H, Ar), 6.67 (дд, 1H, Ar, J = 8.2, 1.2), 6.55–6.45 (м, 1H, Ar), 6.30 (уш. с, 2H, NH2), 3.19 (тд, 2H, NCH2, J = 7.5, 5.6), 1.95 (т, 2H, COCH2, J = 7.5), 1.51 (м, 4H, 2CH2), 1.28 (п, 2H, CH2, J = 7.5). ESI-MS, m/z 266.2 [М+H+].
4-((2-аминобензамидо)метил)циклогексан-1-гидроксиаминокарбамид (VII). Получают аналогично соединению (III) из 164 мг (1 ммоль) соединения (VI). Выход 97.4%, белые кристаллы. 1H ЯМР: 10.33 (с, 1H, NH-OH), 8.62 (с, 1H, NH-OH), 8.16 (т, 1H, J = 5.5), 7.46 (дд, 1H, Ar, J = 7.9, 1.1), 7.12 (тд, 1H, Ar, J = 8.2, 1.4), 6.67 (дд, 1H, Ar, J = 8.1, 1.3), 6.50 (тд, 1H, Ar, J = 8.0, 1.1), 6.34 (уш. с, 2H, NH2), 3.05 (т, 2H, CH2, J = 5.5), 2.31–2.14 (м, 1H), 1.88 (дд, 2H, CH2, J = 13.2, 3.5), 1.75 (дд, 2H, CH2, J = 13.2, 3.5), 1.57–1.41 (м, 1H), 1.27 (кд, 2H, CH2, J = 13.0, 3.3), 0.95 (кд, 2H, CH2, J = 12.9, 3.4). ESI-MS, m/z 290.3 [М+H+].
N-(6-(Гидроксиамино)-6-оксогексил)-2-(хиназолин-4-иламино)бензамид (IV). К раствору 164 мг (1 ммоль) 4-хлорхиназолина в 5 мл ДМФА прибавляют раствор 265 мг (1 ммоль) соединения (III) в 5 мл ДМФА. Реакционную смесь перемешивают при температуре 40–50°С в течение 30 мин, охлаждают до комнатной температуры. Осадок отфильтровывают, промывают 5 мл ДМФА, 2 × 10 мл серного эфира. Выход 384 мг (97.6%), светло-бежевые кристаллы, т. пл. 180.8–187.5°С. 1H ЯМР: 12.60 (с, 1H, NH-OH), 10.33 (с, 1H, NH-OH), 8.98 (д, 1H, NH, J = 1.2), 8.90 (т, 1H, CH2NH, J = 5.6), 8.72 (с, 1H, Ar), 8.66 (с, 1H, Ar), 8.17 (д, 1H, Ar, J = 8.2), 7.95–7.81 (м, 3H, Ar), 7.75 (т, 1H, Ar, J = 7.5), 7.60 (т, 1H, Ar, J = 7.4), 7.19 (тд, 1H, Ar, J = 7.6, 1.2), 3.18 (тд, 2H, J = 6.9, 4.7), 1.94 (т, 2H, COCH2, J = 7.3), 1.62–1.45 (м, 4H, CH2), 1.38–1.21 (м, 2H, CH2). 13C ЯМР: 169.58, 169.24, 169.17, 157.23, 154.73, 149.78, 140.26, 140.11, 133.73, 132.38, 128.72, 128.55, 127.82, 122.73, 121.89, 121.34, 115.97, 32.65, 28.99, 26.54, 25.32. HRMS: m/z 394.1874 [M]+. Вычислено для (C21H23N5O3)+: 394.1877.
N-((4-(гидроксикарбамоил)циклогексил)метил)-2-(хиназолин-4-иламино)-бензамид (VIII). Получают аналогично соединению (IV) из 164 мг (1 ммоль) 4-хлорхиназолина и 291 мг (1 ммоль) соединения (VII). Выход 97.4%, белые кристаллы, т. пл. 200.6–201.8°С. 1H ЯМР: 12.48 (с, 1Н, NH-OH), 10.32 (с, 1Н, NH-OH), 8.94 (д, 1Н, NH, J = 1.2), 8.87 (т, 2Н, CH2NH, J = 5.0), 8.71 (с, 1H, Ar), 8.62 (с, 1H, Ar), 8.16 (д, 1Н, Ar, J = 7.8), 7.95– 7.80 (м, 3H, Ar), 7.75 (т, 1Н, Ar, J = 7.2), 7.60 (т, 1Н, Ar, J = 7.8), 7.20 (т, 1Н, Ar, J = 7.6), 3.18 (т, 2H, CH2, J = 6.3), 2.01–1.85 (м, 1H, CH), 1.79 (д, 2H, CH2, J = 12.7), 1.64 (д, 2H, CH2, J = 11.8), 1.34 (кв, 2H, CH2, J = 12.6), 0.95 (кв, 2H, CH2, J = 12.4). 13C ЯМР: 172.23, 172.15, 168.89, 156.87, 156.78, 154.36, 149.54, 139.72, 139.56, 133.22, 131.90, 128.33, 128.26, 127.29, 122.31, 121.38, 115.52, 45.33, 45.21, 41.18, 36.77, 29.67, 28.62. HRMS: m/z 420.2030 [M]+. Вычислено для (C23H25N5O3)+: 420.2034.
4-(Хиназолин-4-иламино)бензойная кислота (X). К раствору 230 мг (2 ммоль) 4-хлорхиназолина в 5 мл ДМФА прибавляют раствор 300 мг (2 ммоль) метил 4-аминобензоата в 5 мл ДМФА. Реакционную смесь перемешивают при температуре 40–50°С в течение 30 мин, охлаждают до комнатной температуры. Осадок отфильтровывают, промывают 5 мл ДМФА, 2 × 10 мл серного эфира. К полученному соединению (IX) добавляют раствор 120 мг (3 ммоль) NaOH в смеси 5 мл воды и 10 мл метанола. Смесь кипятят 2 часа, добавляют 10 мл воды, подкисляют 5%-ной лимонной кислотой до pH 4, отфильтровывают осадок, промывают 10 мл воды. Выход 416 мг (78.5%), белые кристаллы, т. пл. 296.1–299.2°С (разл.). 1H ЯМР: 10.67 (с, 1H, OH), 8.85 (с, 1H, NH), 8.68 (д, 1H, Ar, J = 8.3), 8.06–7.97 (м, 5H, Ar), 7.87 (д, 1H, Ar, J = 7.2), 7.79 (т, 1H, Ar, J = 7.7).
Метил 6-((4-(хиназолин-4-иламино)бензоил)амино)гексаноат (XIa). К раствору 642 мг (2 ммоль) TBTU, 304 мг (2 ммоль) гидрата гидроксибензтриазола и 606 мг (6 ммоль) N-метилморфолина в 20 мл ДМФА прибавляют 530 мг (2 ммоль) соединения (X), затем 362 мг (2 ммоль) хлоргидрата метил 6-аминогексаноата. Перемешивают 5 часов при комнатной температуре. Добавляют 30 мл воды и экстрагируют 2 × 25 мл этилацетата, органический слой промывают 20 мл 5%-ной лимонной кислоты, 10 мл воды, 10 мл 5%-ного раствора бикарбоната натрия, 10 мл воды. Отгоняют растворитель в вакууме. Выход 576 мг (73.5%) бежевые кристаллы. ESI-MS, m/z 393.2 [М + H+]. Без дополнительной очистки использовали в дальнейших синтезах.
Метил 7-((4-(хиназолин-4-иламино)бензоил)амино)гептаноат (XIb). Получали аналогично соединению (XIa) с использованием 390 мг (2 ммоль) хлоргидрата метил 7-аминогептаноата. Выход 610 мг (75.1%). ESI-MS, m/z 407.3 [М + H+]. Без дополнительной очистки использовали в дальнейших синтезах.
N-(6-(гидроксиамино)-6-оксогексил)-4-(хиназолин-4-иламино)бензамид (XIIa). К раствору метилата натрия, полученному растворением натрия (92 мг, 4.00 ммоль) в метаноле (10 мл) при 0°С, добавляют гидрохлорид гидроксиламина (208 мг, 3.00 ммоль), перемешивают при 0°C в течение 20 мин, затем прибавляют соединение (XIa) (392 мг, 1 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 5-ти часов (ТСХ контроль), добавляют 10 мл воды, подкисляют 5%-ной соляной кислотой до pH 4–5, отгоняют метанол. Выпавший осадок отфильтровывают, промывают водой, и сушат на воздухе. Выход 320 мг (81.2%), белые кристаллы, т. пл. 212.9°С. 1H ЯМР: 10.34 (с, 1Н, NH-OH), 9.94 (с, 1Н, NH-OH), 8.67 (уш. c, 2H, NH + Ar), 8.59 (д, 1H, Ar, J = 8.3), 8.37 (т, 1H, CH2NH, J = 5.5), 8.01 (д, 2H, Ar, J = 8.5), 7.93–7.79 (м, 4H, Ar), 7.67 (т, 1H, Ar, J = 7.5), 3.30–3.19 (м, 1H, CH2NH), 1.96 (т, 2H, COCH2, J = 7.3), 1.61 – 1.45 (м, 4H, CH2), 1.38– 1.20 (м, 2H, CH2). HRMS: m/z 394.1800 [M]+. Вычислено для (C21H23N5O3)+: 394.1877.
N-(7-(гидроксиамино)-7-оксогептил)-4-(хиназолин-4-иламино)бензамид (XIIb). Получают аналогично соединению XIIa из 406 мг (1 ммоля) соединения XIb. Выход 310 мг (76.1%), белые кристаллы, т. пл. 237.8–238.3°С. 1H ЯМР: 10.34 (c, 1H, NHOH), 9.95 (c, 1H, NHOH), 8.66 (уш. с, 2H, NH + Ar), 8.60 (д, 1H, Ar, J = 8.4), 8.37 (т, 1H, CH2NH, J = 5.6), 8.01 (д, 2H, Ar, J = 8.4), 7.93–7.79 (м, 4H, Ar), 7.67 (т, 1H, Ar), 3.30–3.18 (м, 2H, CH2), 1.95 (м, 2H, CH2, J = 7.3), 1.60–1.41 (м, 4H, 2CH2), 1.39–1.24 (м, 4H, 2CH2). 13C ЯМР: 169.19, 165.62, 157.49, 154.33, 149.74, 141.72, 133.21, 129.35, 127.88, 127.63, 126.47, 123.08, 121.00, 115.22, 32.25, 29.13, 28.39, 26.28, 25.12. HRMS: m/z 408.2030 [M]+. Вычислено для (C22H25N5O3)+: 408.2034.
N-Гидрокси-6-(2-(4-хлорфенил)-4-оксо-1,2-дигидрохиназолин-3(4H)-ил)гексамид (XIIIa). Раствор 265 мг (1 ммоль) соединения (III) и 147 мг (1.05 ммоль) 4-хлорбензальдегида в 5 мл этанола перемешивают при кипении в атмосфере аргона в течение 6 часов, отгоняют растворитель в вакууме. Полученный твердый остаток растирают в 5 мл диэтилового эфира и сушат на воздухе. Выход 289 мг (74.8%), т. пл. 111.4–112.3°С. 1H ЯМР: 10.31 (с, 1Н, NH-OH), 7.63 (д, 1Н, Ar, J = 7.4), 7.45–7.29 (м, 4Н, Ar), 7.19 (т, 1Н, Ar, J = 7.6), 6.70–6.57 (м, 2Н, Ar), 5.86 (с, 1Н, N-CH-N), 3.96–3.79 (м, 1H, NCH2), 2.79–2.64 (м, 1H, NCH2), 1.91 (т, 2Н, СОСН2, J = 7.3), 1.61–1.37 (м, 4H, 2CH2), 1.33–1.16 (м, 2H, CH2CH2-CO). HRMS: m/z 388.1422 [M]+. Вычислено для (C20H22ClN3O3)+: 388.1426.
N-Гидрокси-6-(2-(3-метоксифенил)-4-оксо-1,2-дигидрохиназолин-3(4H)-ил)гексамид (XIIIb). Раствор 265 мг (1 ммоль) соединения (III) и 147 мг (1.05 ммоль) 4-хлорбензальдегида в 5 мл этанола перемешивают при кипении в атмосфере аргона в течение 6 часов, отгоняют растворитель в вакууме. Полученный твердый остаток растирают в 5 мл диэтилового эфира и сушат на воздухе. Выход 299 мг (78.1%), т. пл. 119.0–120.2°С. 1H ЯМР: 10.31 (с, 1Н, NH-OH), 7.66 (дд, 1Н, Ar, J = 7.9, 1.6), 7.28 (тд, 1H, Ar, J = 8.2, 1.8), 7.18 (тд, 1H, Ar, J = 7.6, 1.4), 7.13 (д, 1H, Ar, J = 7.6), 7.05 (д, 1H, Ar, J = 8.2), 6.86 (т, 1H, Ar, J = 7.5), 6.70–6.60 (м, 2H, Ar), 6.14 (c, 1H, N-CH-N), 3.96–3.82 (м, 1H, NCH2), 3.70 (с, 3H, OCH3), 2.80–2.63 (м, 1H, NCH2), 1.91 (т, 2Н, СО-СН2, J = 7.3), 1.63–1.40 (м, 4H, 2CH2), 1.37–1.17 (м, 2H, CH2-CH2-CO). 13C ЯМР: 169.09, 162.22, 159.31, 146.18, 142.77, 133.13, 129.64, 127.34, 118.14, 117.15, 115.03, 114.22, 113.25, 112.36, 69.81, 55.05, 44.29, 32.17, 27.22, 25.94, 24.85. HRMS: m/z 384.1918 [M]+. Вычислено для (C21H25N3O4)+: 384.1922.
N-Гидрокси-6-(2-(4-метокси)-3-(2-фторфенокси)метилфенил)-4-оксо-1,2-дигидрохиназолин-3(4H)-ил)гексамид (XIIIc). Раствор 159 мг (0.60 ммоль) соединения (III) и 164 мг (0.63 ммоль) 4-метокси-3-(2-фторфенокси)метилбензальдегида в 5 мл метанола перемешивают при кипении в атмосфере аргона в течение 6 часов, отгоняют растворитель в вакууме. Полученный твердый остаток растирают в 5 мл диэтилового эфира и сушат на воздухе. Выход 301 мг (98.8%), т. пл. 102.8–104.7°С. 1H ЯМР: 10.30 (с, 1Н, NH-OH), 7.61 (дд, 1H, Ar, J = 7.8, 1.6), 7.42 (д, 1H, Ar, J = 2.3), 7.32– 7.06 (м, 6H, Ar), 7.03 (д, 1H, Ar, J = 8.6), 6.98–6.88 (м, 1H, Ar), 6.67–6.58 (м, 2H, Ar), 5.79 (s, 1H, N–CH–N), 5.06 (s, 2H, OCH2), 3.88–3.80 (м, 2H, NCH2), 3.79 (c, 3H, OCH3), 2.74–2.58 (м, 1H, NCH2), 1.90 (т, 2Н, СО–СН2, J = 7.3), 1.60–1.33 (м, 4H, 2CH2), 1.25–1.11 (м, 2H, 2CH2). 13C ЯМР: 169.11, 162.21, 157.04, 153.46, 150.24, 146.28, 146.23, 146.15, 133.06, 132.96, 127.41, 127.35, 124.78, 124.74, 124.23, 121.31, 121.22, 117.08, 116.15, 115.92, 115.42, 114.98, 114.19, 110.94, 69.64, 65.66, 55.68, 44.04, 32.19, 27.12, 25.97, 24.83. HRMS: m/z 508.2242 [M]+. Вычислено для (C28H30FN3O5)+: 508.2246.
Метил 6-(9,10-диметокси-5,11-диоксоиндоло[2,1-a]хиназолин-6(5H,6aH,11H)-ил)гексаноат (XIV). Раствор 264 мг (1.0 ммоль) соединения (IIa) и 242 мг (1.15 ммоль) 2,3-диметокси-6-формилбензойной кислоты в 5 мл хлорбензола в присутствии каталитического количества п-толуолсульфокислоты моногидрата кипятят в течение 4-х часов, охлаждают до комнатной температуры, добавляют 10 мл диэтилового эфира. Выпавший осадок отфильтровывают, сушат на воздухе. Выход 392 мг (89%), белые кристаллы, т. пл. 123.9–124.4°C. 1H ЯМР: 8.04–7.90 (м, 2H, Ar), 7.75–7.64 (м, 1H, Ar), 7.60 (д, 1H, Ar, J = 8.3), 7.46 (д, 1H, Ar, J = 8.3), 7.36 (т, 1H, Ar, J = 7.6), 6.40 (с, 1H, NCHN), 3.92 (с, 3H, OCH3), 3.91 (с, 3H, OCH3), 3.71–3.63 (м, 2H, NCH2), 3.56 (с, 3H, CO2CH3), 2.22 (т, 2H, CH2, J = 7.3), 1.56–1.35 (м, 4H, 2CH2), 1.34–1.07 (м, 2H, CH2). ESI-MS, m/z 439.5 [М + H+].
6-(9,10-диметокси-5,11-диоксоизоиндоло[2,1-a]хиназолин-6(5H,6aH,11H)-ил)-N-гидроксигексанамид (XIIId). К раствору метилата натрия, полученному растворением 69 мг (3 ммоля) натрия в метаноле (7 мл) при 0°С, добавляют 139 мг (2 ммоля) гидрохлорида гидроксиламина, перемешивают при 0°C в течение 20 мин, затем прибавляют 378 мг (0.86 ммоль) соединения (XIV). Реакционную смесь перемешивают при комнатной температуре в течение 3-х часов (ТСХ контроль), добавляют 5 мл воды, подкисляют 5%-ной соляной кислотой до pH 4–5, упаривают метанол. Выпавший осадок отфильтровывают, промывают водой, и сушат на воздухе. Выход 200 мг (52.9%), белые кристаллы, т. пл. 136.1–141.8°C. 1H ЯМР: 10.31 (с, 1H, NHOH), 8.65 (с, 1H, Ar), 7.97 (д, 1H, Ar, J = 6.9), 7.94 (д, 1H, Ar, J = 7.3), 7.68 (т, 1H, Ar, J = 7.9), 7.59 (д, 1H, Ar, J = 8.3), 7.47 (д, 1H, Ar, J = 8.3), 7.36 (т, 1H, Ar, J = 7.6), 6.40 (с, 1H, NCHN), 3.92 (с, 3H, OCH3), 3.91 (с, 3H, OCH3), 3.79–3.54 (м, 2H, NCH2), 1.88 (т, 2H, COCH2, J = 7.3), 1.54–1.36 (м, 4H, 2CH2), 1.34–1.10 (м, 2H, CH2). 13C ЯМР: 169.05, 162.71, 162.58, 153.83, 147.09, 136.51, 133.07, 130.75, 128.32, 124.99, 123.82, 121.64, 120.46, 120.24, 117.53, 68.85, 61.84, 56.44, 41.97, 32.13, 27.66, 25.80, 24.80. HRMS: m/z 440.1816 [M]+. Вычислено для (C23H25N3O6)+: 440.1819.
3-Гидрокси-2-(3-(4-метокси-(2-фторфенокси)метил)-фенил)-2,3-дигидрохиназолин-4(1H)-он (XVa). Смесь 0.30 г (2 ммоль) 2-аминобензгидроксамовой кислоты и 0.52 г (2 ммоль) 3-((2-фторфенокси)метил)-4-метоксибензальдегида в 7 мл метанола в присутствии каталитического количества пара-толуолсульфокислоты моногидрата кипятят с обратным холодильником в течение 4-х часов в атмосфере аргона, охлаждают до температуры ‒15°C и оставляют на 8 часов. Выпавший осадок отфильтровывают, фильтрат упаривают в вакууме, полученный остаток растирают с 10 мл диэтилового эфира, сушат на воздухе. Выход 0.62 г (79%), кристаллы телесного цвета, т. пл. 209.7°C (разл.). 1H NMR: 9.64 (с, 1H, NOH), 7.65 (дд, 1H, Ar, J = 8.0, 1.6), 7.54 (д, 1H, NH, J = 2.3), 7.41 (дд, 1H, Ar, J = 8.5, 2.3), 7.36 (д, 1H, J = 1.8), 7.28–7.15 (м, Ar, 4H), 7.15–7.03 (м, Ar, 2H), 7.01–6.88 (м, Ar, 1H), 6.76 – 6.63 (м, Ar, 2H), 5.87 (д, 1H, J = 1.7), 5.07 (с, 2H, CH2), 3.81 (с, 3H). 13C ЯМР: 162.94, 157.35, 153.41, 150.18, 146.48, 146.35, 146.22, 134.59, 133.35, 131.74, 131.70, 129.50, 128.52, 128.39, 127.28, 127.19, 127.10, 124.85, 124.80, 121.31, 121.23, 121.15, 117.34, 114.06, 110.75, 74.60, 65.80, 55.74. HRMS: m/z 395.1402 [M]+. Вычислено для (C22H19FN2O4)+: 395.1405.
6-Гидрокси-6,6a-дигидроизоиндоло[2,1-a]хиназолин-5,11-дион (XVb). Раствор 0.45 г (3.30 ммоль) гидроксиамида антраниловой кислоты и 0.50 г (3.30 ммоль) 2-формилбензойной кислоты в присутствии каталитического количества пара-толуолсульфокислоты моногидрата в 13 мл хлорбензола кипятят в течение 7-ми часов, реакционную смесь упаривают досуха и растирают с 10 мл диэтилового эфира. Осадок отфильтровывают, сушат на воздухе до постоянного веса. Выход 0.77 г (96%), белые кристаллы, т. пл. 198–199°C. 1H ЯМР: 9.41 (с, 1H, NOH), 8.08 (дд, 1H, Ar, J = 8.2, 0.6), 7.97 (дд, 1H, Ar, J = 7.8, 1.6), 7.89 (уш. д, 2H, Ar, J = 8.1), 7.79 (тд, 1H, Ar, J = 7.4, 1.3), 7.74–7.64 (м, 2H, Ar), 7.35 (тд, 1H, Ar, J = 7.6, 1.1), 6.52 (с, 1H, NCHN). 13C ЯМР: 165.26, 164.88, 139.55, 136.41, 133.68, 133.22, 131.27, 130.58, 128.22, 126.72, 125.24, 123.85, 120.00, 119.25, 72.72. HRMS: m/z 267.0764 [M]+. Вычислено для (C15H10N2O3)+: 267.0769.
6-Гидрокси-9,10-диметокси-6,6a-дигидроизоиндоло[2,1-a]хиназолин-5,11-дион (XVc). Раствор 0.45 г (3.30 ммоль) амида антраниловой кислоты и 0.80 г (3.80 ммоль) 6-формил-2,3-диметоксибензойной кислоты в присутствии каталитического количества пара-толуолсульфокислоты моногидрата в 15 мл хлорбензола кипятят в течение 7-ми часов, реакционную смесь упаривают досуха и растирают с 10 мл диэтилового эфира. Осадок отфильтровывают, сушат на воздухе до постоянного веса. Выход 0.94 г (92%), белые кристаллы, т. пл. 240°C (разл.). 1H ЯМР: 9.28 (с, 1H, NOH), 8.04 (д, 1H, Ar, J = 7.8), 7.95 (дд, 1H, Ar, J = 7.8, 1.6), 7.68 (тд, 1H, Ar, J = 7.8, 1.6), 7.52 (д, 1H, Ar, J = 8.3), 7.44 (д, 1H, Ar, J = 8.3), 7.33 (тд, 1H, Ar, J = 7.6, 1.1), 6.36 (с, 1H, NCHN), 3.91 (с, 3H, OCH3), 3.88 (с, 3H, OCH3). 13C ЯМР: 164.76, 163.40, 153.81, 146.70, 136.47, 133.51, 131.79, 128.13, 125.16, 123.26, 122.27, 120.25, 119.39, 117.80, 71.65, 61.76, 56.50. HRMS: m/z 327.0903 [M]+. Вычислено для (C17H14N2O5)+: 327.0979.
Культивирование клеточных линий
В работе были использованы линии клеток меланомы Mel Z, выведенных в клеточную линию из метастатических узлов больной меланомой кожи, проходившей лечение в “НМИЦ онкологии им. Н.Н. Блохина” Минздрава России [18]. Клетки рака молочной железы MCF-7 (ATCC® HTB-22™) и клетки рака почки SN-12C [19] были получены из банка клеточных культура “НМИЦ онкологии им. Н.Н. Блохина” Минздрава России.
Опухолевые клетки линии Mel Z и SN-12C культивировали на полной ростовой среде RPMI-1640 (Gibco), содержащей 10% ЭТС (HyClone), 2 мM глутамина, 50 мг/мл пенициллина-стрептомицина (“ПанЭко”, Россия) на культуральных флаконах (Eppendorf) при 37°С в атмосфере 5% CO2. Клетки MCF-7 культивировали на полной ростовой среде DMEM (Gibco), содержащей 10% ЭТС (HyClone), 2 мM глутамина, 50 мг/мл пенициллина-стрептомицина (“ПанЭко”, Россия) на культуральных флаконах (Eppendorf) при 37°С в атмосфере 5% CO2. Клетки поддерживали в логарифмической фазе роста постоянным пересевом культуры через 2–3 дня.
МТТ тест
Цитотоксическую активность соединений оценивали c помощью стандартного МТТ-теста с использованием МТТ-реагента (3,4,5-диметилтиазол-2-ил-2,5-дифенилтетразолиум бромид), основанного на способности дегидрогеназ живых метаболически активных клеток восстанавливать МТТ-реагент до голубых нерастворимых кристаллов формазана. Для каждого соединения строили график зависимости “концентрация–эффект” и определяли IС50 и IС10 при помощи программы GraphPad Prizm 5.0 (GraphPad). Ошибка измерений в экспериментах не превышала 5%.
Опухолевые клетки линий MCF-7, Mel Z и SN-12C (5 × 104 клеток/мл) вносили в лунки 96-луночного планшета (Nunc) в полной ростовой среде RPMI-1640 или DMEM (для MCF-7), содержащей 10% эмбриональной сыворотки теленка – ЭТС (HyClone), 2 мM глутамина, 50 мг/мл пенициллина-стрептомицина (“ПанЭко”, Россия). Спустя 24 часа наносили соединения в диапазоне концентраций 10–4–10–10 и инкубировали в течение 48 часов, затем добавляли в каждую лунку по 10 мкл раствора МТТ в конечной концентрации 0.5 мг/мл, (Sigma, Chemical Co, CША). Клетки инкубировали еще 4 часа, далее клетки осаждали центрифугированием планшетов при 1000 об./мин в течение 3 мин на центрифуге Hettich 460R (Hettich), среду отбирали и добавляли к клеткам 200 мкл ДМСО. Клетки ресуспендировали и инкубировали 10 мин при 37°С, после чего немедленно определяли оптическую плотность раствора формазана на микропланшетном фотометре Multiskan FC при 570 нм (Thermo Scientific), используя ДМСО как нулевой контроль.
Метод оценки блокирования миграционной способности клеток по методу “заживления раны”
Опухолевые клетки (3 × 105 клеток/мл) вносили в лунки 24-луночного планшета (Nunc) в среде RPMI-1640 или DMEM содержащей 10% эмбриональной сыворотки теленка – ЭТС (HyClone), 2 mM глутамина, 50 мг/мл пенициллина-стрептомицина (“ПанЭко”, Россия) и инкубировали до образования монослоя. Затем монослой нарушали путем соскабливания части клеток по прямой через центр лунки (наконечником 200 мкл). В течение 24 часов клетки инкубировали в полной культуральной среде RPMI-1640 или DMEM, содержащей 10% ЭТС, 2 мМ глутамина и нецитотоксические концентрации IC10 каждого из исследуемых соединений. В качестве отрицательного контроля, определяющего ширину “раны”, использовали клетки, культивируемые в бессыворотной среде RPMI-1640 или DMEM, положительным контролем, определяющим максимальный прирост монослоя клеток в область “раны”, являются клетки, растущие в полной среде RPMI-1640 или DMEM с 10% ЭТС без соединений. В качестве препарата сравнения использовали сунитиниб в нецитотоксической концентрации 1 мкМ (Selleckchem). После окончания инкубирования, монослой клеток на планшетах, дважды промывают PBS и окрашивают его красителем трипановым синим (“ПанЭко”). Результаты ингибирования миграционной активности определяли как соотношение (в процентах) прироста площади монослоя клеток под действием исследуемых соединений по отношению к приросту клеток в положительном контроле. Ширину раны в отрицательном контроле используют в качестве базового значения для расчета ширины “раны”.
Культивирование клеток в 3D-системе
Матригель (Corning) размораживали при 4°С и наносили по 100 мкл лунки 24-луночного планшета (Nunc) на льду и оставляли в стерильных условиях для полимеризации матрикса в течение 1 часа при комнатной температуре и 30 мин при 37°С в СО2 инкубаторе. Клетки линий Mel Z и SN-12C в концентрации 4 × 105 клеток/мл в полной ростовой среде RPMI-1640 (Gibco), содержащей 10% ЭТС, наносили на гель и инкубировали при 37°С в течение 12 ч с добавлением исследуемых соединений в нецитотоксических концентрациях (IС10). В качестве положительного контроля использовали клетки, инкубируемые в среде RPMI-1640 (Gibco), содержащей 10% ЭТС без добавления исследуемых соединений. После окончания инкубации делали серию фотоснимков образовавшейся сети сосудистоподобных структур при помощи цифровой фотокамеры (Canon) и оценивали длину сосудисто-подобных структур из опухолевых клеток в составе замкнутой сети при помощи программы Image J v.1.73 (NIH, USA, freeware).
Статистический анализ
Все эксперименты проводились 3 раза независимо друг от друга. Данные представлены как среднее значение ± стандартное отклонение. Различия считались статистически значимыми, когда значения P были менее 0.05. Все статистические анализы были выполнены с использованием программного обеспечения GraphPad Prism (GraphPad Software, La Jolla, Сан-Диего, Калифорния, США).
Список литературы
Persy I.S., Wick J.Y., Kaufman B. // Nature Rev. Clin. Onc. 2009. V. 6. P. 569–577.
Azam, F., Mehta, S., Harris, A.L. // Eur. J. Cancer. 2010. V. 46. P. 1323–1332.
Maniotis A., Folberg R., Hess A., Seftor E.A., Gardner L.M., Pe’er J., Trent J.M., Meltzer P.S., Hendrix M.J. // Am. J. Pathol. 1999. V. 55. P. 739–752.
Zhang S., Zhang D., Sun B. // Cancer Lett. 2007. V. 254. P. 157–164.
Van der Schaft W., Seftor R.E., Seftor E.A., Hess A.R., Gruman L.M., Kirschmann D.A., Yokoyama Y., Griffoen A.W., Hedrix M.J. // J. Natl. Cancer Inst. 2004. V. 96 (19). P. 1473–1477.
Berube G. // Expert Opinion on Drug Discovery. 2016. V. 11(3). P. 281–305.
Yoon S., Eom G. H. // Chonnam Medical Journal. 2016. V. 52 (1). P. 1–11.
Giannini G., Battistuzzi G., Vignola D. // Bioorganic & Medicinal Chemistry Letters. 2015. V. 25(3). P. 459–461.
Rao M., Valentini D., Zumla A., Maeurer M. // The International Journal of Infectious Diseases. 2018. V. 69. P. 78–84.
Muri E.M., Nieto M.J., Sindelar R.D., Williamson J.S. // Current Medicinal Chemistry. 2002. V. 9. P. 1631–1653.
Ahmad S., Ahmad I. // Medicinal Chemistry Communications. 2017. V. 8. P. 871–885.
Asif M. // International Journal of Medicinal Chemistry. 2014. Article ID 395637.
Folkman J. // Curr. Mol. Med. 2003. V. 3. P. 643–651.
Hillen F., Griffioen A.W. // Cancer Metastasis Rev. 2007. V. 26. P. 489–502.
Vartanian A., Golubeva I., Shprakh Z. // Horizons in Cancer Res. 2017. V. 65. P. 13–34.
Sashidhara K.V., Palnati G.R., Dodda R.P., Avula S.R., Swami P. // Synlett. 2013. V. 24. P. 105–113.
Vailhe B., Vittet D., Feige J. // Lab. Invest. 2001. V. 81. P. 439–452
Mikhailova I.N., Lukashina M.I., Baryshnikov A.Yu. et al. // Vest. Ross. Akad. Med. Nauk. 2005. V. 7. P. 37–40.
Naito S., von Eschenbach A.C., Giavazzi R., Fidler I.J. // Cancer Res. 1986. V. 46. P. 4109–4115.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия