Биоорганическая химия, 2020, T. 46, № 2, стр. 181-187
Оптимизация твердофазного синтеза бета-амилоида (1-40) и получение антител, выявляющих его в условиях иммуноблота
Т. Д. Волкова 1, Д. О. Короев 1, А. В. Камынина 1, М. П. Филатова 1, А. В. Аветисян 2, О. М. Вольпина 1
1 ФГБУН Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
117997 Москва, ул. Миклухо-Маклая, д. 16/10, Россия
2 НИЦ ФХБ имени А.Н. Белозерского Московского государственного университета имени М.В. Ломоносова
119234 Москва, ул. Ленинские Горы, 1с40, Россия
Поступила в редакцию 19.07.2019
После доработки 28.08.2019
Принята к публикации 14.10.2019
Аннотация
Оптимизирован метод твердофазного синтеза и очистки бета-амилоида человека последовательности 1-40, позволяющий получить продукт с высоким выходом и гомогенностью более 95%. Синтетический пептид способен формировать олигомеры, что подтверждено с помощью электрофореза в полиакриламидном геле с последующим иммуноблотом и методом флуоресцентной спектрофотометрии с использованием красителя тиофлавина Т. Предложен доступный метод, позволяющий получать с высоким титром антитела, специфичные к бета-амилоиду (1-40) и распознающие как мономер, так и олигомеры пептида в иммуноблоте.
ВВЕДЕНИЕ
Бета-амилоид (Аβ) — это общее название для группы пептидов, образующихся в результате протеолитического расщепления трансмембранного белка-предшественника, называемого APP (amyloid precursor protein), и проявляющих высокую способность к агрегации с образованием как растворимых олигомеров, так и нерастворимых фибрилл [1–4]. Фибриллы Аβ являются основными компонентами так называемых амилоидных бляшек – патологических образований, наблюдаемых при различных заболеваниях, таких как болезнь Альцгеймера, болезнь Паркинсона, синдром Дауна и др. [2]. Олигомеры Аβ считаются основным токсическим агентом, вызывающим гибель нейронов [5, 6]. Аβ продуцируется различными типами клеток, такими как нейроны, астроциты, фибробласты, тромбоциты, причем наиболее высокий уровень экспрессии наблюдается в нейронах и клетках гладкой мускулатуры. Это свидетельствует о важной роли Аβ в развитии клеток, при этом его функции в норме до конца не выяснены [1–3].
Для изучения механизма патологического действия бета-амилоида исследователям необходимо располагать достаточным его количеством. Бета-амилоидные пептиды содержат от 37 до 43 а. о., что делает привлекательным их получение с помощью химического синтеза [4]. Однако такой синтез представляет собой трудную задачу. Бета-амилоидные пептиды характеризуются последовательностью, в которой 28 N-концевых аминокислотных остатков, в основном, являются полярными, а неполярные остатки сосредоточены в оставшейся С-концевой части. В результате при нейтральном значении рН пептиды проявляют высокую склонность к агрегации. Мономеры бета-амилоидов могут самоорганизовываться в димеры, тримеры и более высокомолекулярные олигомеры, которые формируют устойчивую вторичную структуру с преобладанием β-складчатой структуры и, в конечном итоге, образуют нерастворимые фибриллы. Трудность синтеза бета-амилоидных пептидов заключается в том, что даже растущая пептидная цепь на полимерной основе в органических растворителях склонна к агрегации, но особенно быстро агрегация происходит в водных растворах после деблокирования пептида, что чрезвычайно затрудняет очистку продукта. Все это приводит к низкому выходу целевого продукта.
В литературе описано несколько примеров синтеза бета-амилоидных пептидов, как Аβ(1-40), так и наиболее фибриллогенного Аβ(1-42) [7–10], а также С-концевых гидрофобных фрагментов пептида Аβ(1-42) [11] и ковалентно сшитых гомодимеров его различных фрагментов [12], однако сложность методики или неудовлетворительная степень гомогенности полученных продуктов делает разработку эффективного способа синтеза и очистки бета-амилоидных пептидов с помощью ВЭЖХ по-прежнему актуальной. Нами был предпринят синтез Аβ(1-40) человека, который вместе с Аβ(1-42) входит в состав амилоидных бляшек и при этом является более подходящей аллоформой для использования в экспериментах in vitro, поскольку обладает менее высокой гидрофобностью и не такой высокой скоростью агрегации, как Аβ(1-42).
Для широкомасштабных исследований, направленных на изучение молекулярных процессов с участием Аβ, необходимо также располагать большими количествами антител, способных связываться с ним как в условиях ИФА или вестерн-блота, так и в срезах тканей или на клетках. В настоящей работе представлен доступный метод, позволяющий с высоким выходом получать антитела, специфичные к β-амилоидам.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Аβ(1-40) был синтезирован твердофазным методом в автоматическом режиме на п-алкоксибензильном полимере с низким содержанием гидроксильных групп (0.2 ммоль/г). Аминокислотная последовательность Аβ(1-40) приведена в табл. 1.
Таблица 1.
Аβ(1-40) и его укороченный фрагмент Аβ(1-17)
| Пептид | Аминокислотная последовательность |
|---|---|
| 1-40 | DAEFRHDSGYEVHHQKLVFFAEDVGSNKGAIIGLMVGGVV |
| 1-17 | DAEFRHDSGYEVHHQKL-G |
Использовали Fmoc-производные аминокислот с защитой боковых функций остатков Ser и Tyr с помощью But-группы, Asp и Glu – OBut-группы, Lys – Boc-группы, His – Trt- и Arg – Pbf-группы. Наращивание полипептидной цепи проводили при помощи однократных конденсаций TBTU-методом, применяя 7.5-кратные избытки защищенных аминокислот. Основной проблемой, обычно затрудняющей синтез Аβ-пептида, является его агрегация даже на полимере в органических растворителях. Для повышения солюбилизации растущей пептидной цепи и препятствия ее агрегации в растворитель для реакций конденсации, а также отщепления Fmoc-защитной группы, добавляли диметилсульфоксид. Кроме того, для минимизации агрегации молекул β‑амилоида и побочных реакций конденсацию проводили 30 мин вместо стандартных 2 ч. Таким образом, синтез 40-членного пептида при помощи автоматического синтезатора продолжался 2 сут.
Отщепление пептида от полимера с одновременным удалением боковых защитных групп проводили смесью TFA со стандартными добавками, предотвращающими протекание побочных реакций. Сырой продукт синтеза высаживали этилацетатом. Зачастую после деблокирования Аβ-пептиды не подвергают ВЭЖХ, ограничиваясь гель-фильтрацией или только осаждением [7–9]. Описана ВЭЖХ очистка Аβ(1-42) на специальной колонке (PLRP-S) в основных условиях (5 мМ ацетат аммония в ацетонитриле, рН 8.0) [10]. В настоящей работе была успешно проведена очистка методом обращенно-фазовой ВЭЖХ на стандартной колонке Jupiter С4 в градиенте концентрации ацетонитрила в 0.1% TFA. Для нанесения на колонку пептид растворяли в 50% DMSO в воде. Было получено, исходя из 100 мг полимера, 12.5 мг Аβ(1-40), то есть в расчете на содержание гидроксильных групп в исходном полимере выход составил 13%. Индивидуальность полученного пептида последовательности (1-40) была подтверждена данными масс-спектрометрии и аналитической обращенно-фазовой ВЭЖХ (табл. 2). Степень гомогенности по данным аналитической ВЭЖХ составила более 95%.
Таблица 2.
Характеристики синтетического Аβ(1-40) и фрагмента Аβ(1-17) по данным масс-спектрометрии и ВЭЖХ
| Пептид | Мтеор | [МН]+ | Время удерживания*, мин |
|---|---|---|---|
| 1-40 | 4327.15 | 4330.29 | 12.06 |
| 1-17 | 2124 | 2125 | 7.81 |
Следует отметить, что хроматография была результативной только для Аβ(1-40), осажденного этилацетатом после деблокирования. В случае попытки повторной ВЭЖХ лиофилизованного продукта происходила необратимая сорбция пептида на колонке, что говорит, вероятно, о том, что во время пребывания в водном растворе после очистки пептид переходит в агрегированное состояние. Синтетический Аβ(1-40) после лиофилизации дезагрегировали путем растворения в гексафторизопропаноле, делили на аликвоты и растворитель упаривали. Дезагрегированный пептид использовали для дальнейших опытов.
Таким образом, сокращение времени синтеза благодаря использованию 7.5-кратных избытков аминокислот, добавление DMSO как в реакционную смесь при конденсации и деблокировании в ходе синтеза (30%), так и при нанесении на колонку (50%), а также минимизация пребывания пептида в водных растворах (после хроматографии) позволили получить продукт с высокой степенью гомогенности и высоким выходом.
Следующей задачей было получение антител, распознающих Аβ(1-40)-пептид. Для этого был синтезирован N-концевой фрагмент 1-17 его последовательности(табл. 1). Синтез этого пептида проводили стандартным TBTU-методом на п-алкоксибензильном полимере со средним содержанием гидроксильных групп (0.5 ммоль/г), с использованием 3-кратных избытков Fmoc-производных аминокислот с соответствующими боковыми защитными группами. В качестве С-концевого аминокислотного остатка был использован дополнительный остаток Gly.
Отщепление пептида от полимера с одновременным удалением боковых защитных групп проводили смесью TFA со стандартными добавками, предотвращающими протекание побочных реакций. Сырой продукт синтеза осаждали диэтиловым эфиром. Очистку проводили методом обращенно-фазовой ВЭЖХ на колонке Jupiter С18 в градиенте концентрации ацетонитрила в 0.1% TFA. Индивидуальность Аβ(1-17)-фрагмента была подтверждена данными масс-спектрометрии и аналитической обращенно-фазовой ВЭЖХ (табл. 2). Степень гомогенности пептида составила более 98%.
Для получения антител к пептиду проводили иммунизацию кроликов его конъюгатом с гемоцианином улитки (KLH). У кроликов отбирали кровь и готовили иммунную сыворотку, которую анализировали на содержание противопептидных антител и подвергали аффинной хроматографии на сефарозе 4В с иммобилизованным пептидом Аβ(1-17). В результате выделяли фракцию антител с высоким титром (разведение 1/1 280 000), строго специфичных к пептиду (1-17). Способность очищенных антител связываться с Аβ(1-40)-пептидом была проверена в ИФА. Антитела связывались с синтетическим Аβ(1-40)-пептидом с таким же титром, как и с пептидом Аβ(1-17).
Известно, что β-амилоиды оказывают свое негативное воздействие при ряде нейропатологий за счет формирования олигомеров, проявляющих цитотоксические свойства в тканях головного мозга [13, 14]. Поэтому представляло интерес оценить способность синтетического Аβ(1-40) образовывать стабильные олигомеры.
В ряде работ показано, что амилоидные олигомеры устойчивы к денатурирующим условиям SDS-электрофореза и вестерн-блота, что делает возможным использование этих методов для изучения олигомеризации и детекции конкретных типов олигомеров [15]. Раствор Аβ(1-40) инкубировали в Tris-буфере рН 7.4 в течение 48 ч при 37°С, после чего подвергали электрофорезу и иммуноблоттингу с применением полученных антител к Аβ(1-17)-фрагменту. Проводили сравнение результатов с данными, полученными для свежеприготовленного раствора Аβ(1-40) (рис. 1).
Рис. 1.
Иммуноблот с антителам к Аβ(1-17)-фрагменту для Аβ(1-40) до инкубации (а) и после инкубации в Tris-буфере, рН 7.4 при 37°С в течение 48 ч (б).
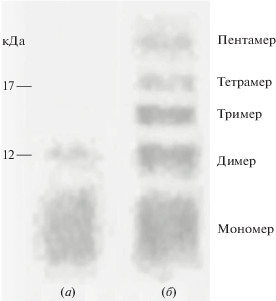
Анализ результатов показал, что полученные антитела против фрагмента (1-17) обнаруживают как мономер Аβ(1-40), так и его олигомеры. В результате иммуноблота исходного раствора Аβ(1-40) были получены две белковые полосы, находящиеся в области масс ниже 12 кДа (рис. 1а). Основная зона соответствует мономеру Аβ(1-40) (М 4.3 кДа). Размытость границ этой зоны обусловлена низкой разрешающей способностью стандартного SDS-электрофореза по Лэммли четко разделять белки с массой менее 10 кДа. Вторая полоса с меньшей интенсивностью окрашивания, вероятно, соответствует димеру Аβ(1-40) (М 9 кДа). Наличие этой зоны показывает, что синтетический Аβ(1-40) сразу после растворения в воде начинает агрегировать. Эти же полосы ниже уровня 12 кДа можно наблюдать и в результате иммуноблота раствора после инкубации в течение 48 ч (рис. 1б). Однако кроме этих зон обнаруживаются полосы с большей массой, которые соответствуют тримеру (М 13.5 кДа), тетрамеру (М 18 кДа) и пентамеру (М 22.5 кДа) Аβ(1-40). При этом интенсивность окрашивания зон падает постепенно от мономера к пентамеру.
Основываясь на результатах иммуноблота, можно сделать несколько выводов. Во-первых, синтетический Аβ(1-40) в водном растворе способен формировать олигомеры, стабильные в денатурирующих условиях. Во-вторых, аффинно очищенные поликлональные антитела против фрагмента (1-17) можно использовать для детекции мономера и олигомеров Аβ(1-40) с помощью иммуноблота.
Способность синтетического Аβ(1-40) агрегировать с образованием характерных для бета-амилоидов высокомолекулярных олигомеров с β-структурой была доказана в опытах с использованием флуоресцентного красителя тиофлавина Т (ThT). Этот краситель повышает интенсивность своей флуоресценции при встраивании в β-складчатые структуры, которые формируются при агрегации мономеров Аβ в олигомеры и далее до протофибрилл и фибрилл [16]. Перед добавлением буфера к Аβ(1-40) его растворяли в небольшом объеме DMSO, то есть содержание амилоидных олигомеров в начале эксперимента было минимальным. Как видно из рис. 2, через 2.5 ч после начала инкубации происходил резкий рост интенсивности флуоресценции, который к 4 ч достигал максимума и выходил на плато. Эти данные подтверждают, что синтетический Аβ(1-40) за 4 ч формирует в водном растворе агрегаты с β-структурой, характерной для протофибрилл и фибрилл Аβ.
Рис. 2.
Динамика агрегации Аβ(1-40) в Tris-буфере, рН 7.4 (анализ по реакции с тиофлавином Т). Каждая точка является средним значением, рассчитанным по результатам измерения флуоресценции для четырех проб, отобранных в одно время. Для каждого среднего показана стандартная ошибка (SEM).
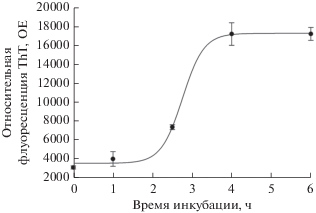
Таким образом, двумя методами было показано, что синтетический Аβ(1-40) образует как низкомолекулярные олигомеры (ди-, три-, тетра- и пентамеры), показанные на рис. 1, так и высокомолекулярные олигомеры, формирующие фибриллы, характерные для β-амилоидов.
В итоге, в настоящей работе представлен оптимизированный метод получения путем твердофазного химического синтеза Аβ-пептида человека последовательности (1-40) с высоким выходом и высокой гомогенностью. Кроме того, предложен метод получения очищенных антител, высоко специфичных к бета-амилоиду, распознающих как мономер, так и олигомеры Аβ(1-40) различными иммунохимическими методами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза пептидов использовали реактивы и производные аминокислот (Merck, ФРГ; Fluka, Швейцария). ВЭЖХ проводили при помощи хроматографа Стайер (Аквилон, Россия) с использованием колонок Jupiter 5μ C4 300A 4.6 × 250 мм и Jupiter 5μ C18 300A 4.6 × 250 мм (Phenomenex, США) для аналитической хроматографии, а также Jupiter 10μ C4 300A 10 × 250 мм и 10μ C18 300A 10 × × 250 мм (Phenomenex, США) – для препаративной хроматографии. Масс-спектрометрию осуществляли методом MALDI на приборе VISION 2000 (Bioanalysis, Великобритания). Аминокислотный анализ проводили на приборе Biotronik LC-3000 (ФРГ) после гидролиза пептидов смесью 6 M HCl–TFA (2 : 1) в течение 45 мин при 170°С.
Для иммунизации использовали самок кроликов породы Шиншила весом 2–3 кг (питомник “Алькона”, Россия).
Для аффинной хроматографии использовали колонку (Whatman, Англия) размером 10 × 100 мм, детектор (Uvicord LKB Bromma 2238, Швеция, λ 280 нм) и коллектор фракций (Multirack LKB Bromma 2111, Швеция).
Электрофорез проводили в мини-камере для гель-электрофореза (Hoefer-Mighty Small Vertical Electrophoresis system, США), перенос белков на мембрану осуществляли в камере для влажного электропереноса (Hoefer-TRANSPHOR, США), источник тока для электрофореза и электропереноса (Pharmacia Biotech, Швеция).
Твердофазный синтез и очистка пептидов. Синтез Аβ(1-40) проводили на пара-алкоксибензильном полимере с содержанием гидроксильных групп 0.2 ммоль/г. Наращивание пептидной цепи выполняли последовательно с использованием 7.5-кратных избытков защищенных аминокислот. Временную Fmoc-защиту удаляли 20% раствором 4-метилпиперидина в 30% DMSO–70% DMF. Конденсацию проводили при помощи TBTU, растворенного в такой же смеси DMSO–DMF. Время реакции конденсации составляло 30 мин.
Синтез фрагмента Аβ(1-17) проводили на пара-алкоксибензильном полимере с содержанием гидроксильных групп 0.5 ммоль/г. Для последовательного наращивания пептидной цепи применяли 3-кратные избытки защищенных аминокислот. Удаление временной Fmoc-защитной группировки и конденсацию выполняли так же, как для Аβ(1-40), но в чистом DMF, без добавления DMSO в реакционную смесь. Время реакции конденсации – 2 ч.
Отщепление пептидов от полимера с одновременным деблокированием функциональных групп боковых цепей проводили смесью TFA (94%), триизопропилсилана (1%), этандитиола (2.5%) и воды (2.5%) из расчета 1–2 мл смеси на 100 мг пептидилполимера. Сырой Аβ(1-40) высаживали этилацетатом, осадок промывали этилацетатом, затем эфиром. Сырой фрагмент Аβ(1-17) высаживали эфиром.
Пептиды очищали с помощью обращенно-фазовой ВЭЖХ в градиенте концентрации ацетонитрила 10–70% в 0.1% TFA за 1 ч при расходе элюента 3 мл/мин. Оптическое поглощение элюата измеряли при длине волны 226 нм. Очистку Аβ(1-40) выполняли на колонке Jupiter 10μ C4 300A 10 × 250 мм (Phenomenex, США). Для нанесения на колонку пептид растворяли в 50% DMSO в воде. Очистку фрагмента (1-17) выполняли на колонке Jupiter 10μ C18 300A 10 × 250 мм (Phenomenex, США). Пептид наносили на колонку в виде водного раствора.
Синтетические пептиды характеризовали данными аналитической ВЭЖХ, масс-спектрометрии MALDI и аминокислотного анализа. Аналитическую ВЭЖХ пептидов проводили в условиях, аналогичных препаративной ВЭЖХ, при расходе элюента 1 мл/мин.
Конъюгат пептида (1-17) с гемоцианином улитки KLH получали, как описано в работе [17]. К раствору 2.4 мг пептида в 2.1 мл раствора KLH в PBS (137 мМ NaCl, 2.7 мM KCl, 8 мM NaH2PO4, 1.5 мM KH2PO4, рН 7.4) с концентрацией белка 5.8 мг/мл при перемешивании в течение 1 ч добавляли 1.2 мл 0.25% раствора глутарового альдегида в PBS. Полученный раствор перемешивали 15 ч и диализовали против PBS в течение 20 ч с двукратной сменой буфера.
Противопептидные антитела к пептиду (1-17). Для получения антител к пептиду (1-17) двух кроликов иммунизировали двукратно с интервалом в 44 дня подкожно конъюгатами пептида с KLH в дозе 1 мг пептида на животное как описано ранее [18]. Для первой иммунизации суспензию KLH-конъюгата в PBS в концентрации 0.8–1.2 мг/мл (в пересчете на пептид) смешивали с равным объемом полного адъюванта Фрейнда до получения эмульсии, для второй иммунизации суспензию KLH-конъюгата смешивали c равным объемом неполного адъюванта Фрейнда. Кровь отбирали из ушной вены на 14-е сутки после второго введения препаратов. Приготовленные сыворотки хранили при температуре –20°С.
Конъюгат пептида (1-17) с овальбумином (OVA) получали как описано в работе [17]. К 1 мг пептида добавили 2 мл водного раствора, содержащего 0.5 мл OVA. В течение 1 ч при перемешивании добавляли 50 мкл 0.2% раствора 1-этил-3-(3-диметиламинопропил)-карбодиимида в PBS. Полученный раствор перемешивали 15 ч и диализовали против PBS в течение 20 ч.
Титр противопептидных антител определяли с помощью твердофазного ИФА как описано в работе [18]. На планшет наносили конъюгат пептида (1-17) с OVA либо Аβ(1-40) в объеме 0.1 мл на лунку в концентрации 30 мкг/мл в расчете на пептид. За титр антител принимали значения наибольшего разведения сыворотки или антител, дающего окрашивание более 0.1 ОЕ492 и превышающего поглощение контрольных антител в 3 раза. В качестве контроля при определении титров противопептидных сывороток использовали преиммунные сыворотки кроликов. При исследовании аффинно очищенных антител в качестве контроля использовали очищенные иммуноглобулины кролика.
Для получение аффинного сорбента с иммобилизованным (1-17)-пептидом 1 г CNBr-активированной сефарозы 4B суспендировали в 6 мл 1 мМ HCl в течение 15 мин до образования прозрачного геля и промывали 1 мМ HСl (5 × 10 мл). Пептид (2.8 мг) растворяли в 4 мл конденсирующего буфера (0.1 М NaHCO3, 0.1 M NaCl, pH 8.0), добавляли к сефарозе и при периодическом перемешивании оставляли на 1 ч при 20°С. После промывки конденсирующим буфером (5 × 3 мл) к сефарозе добавляли блокирующий буфер (0.2 M Gly, 0.1 M NaCl, pH 8.0) и выдерживали в течение 2 ч. Затем сефарозу промывали поочередно ацетатным (0.1 M NaOCOCH3, 0.1 M NaCl, pH 4.0) и боратным буферами (0.1 M Na2B4O7 · 10H2O, 0.1 M NaCl, pH 8.1) (5 × 10 мл).
Аффинная хроматография противопептидных сывороток. При проведении аффинной хроматографии 2 мл сыворотки наносили на колонку с 3.5 мл аффинного носителя, промытую PBS1 (0.15 М NaCl, 0.01 М Na2HPO4, pH 7.4), и инкубировали при комнатной температуре в течение 40–60 мин. Затем колонку промывали 35 мл PBS1 и 35 мл элюирующего буфера (0.2 М раствор глицина в 0.1 М NaСl, pH 2.5). В отобранных фракциях элюата значения рН доводили до 6.5–8.0 с помощью 1 М Tris, pH 10. Содержание белка определяли спектрофотометрически, измеряя ОЕ280 и исходя из того, что оптическое поглощение раствора IgG с концентрацией 1 мг/мл равно 1.4 ОЕ280.
Электрофорез в ПААГ и иммуноблот
Приготовление образцов. 0.12 мM раствор Аβ(1-40) в 200 мM Tris-HCl, 200 мM NaCl (pH 7.4) инкубировали 48 ч при 37°C либо использовали без инкубации. Для электрофореза образцы готовили стандартным образом по методу Леммли [19].
Электрофорез проводили на пластинках ПААГ (20% акриламида в разделяющем геле; 5% – в концентрирующем) в денатурирующих условиях при постоянной силе тока 10 мА/гель [19].
Электроперенос осуществляли на нитроцеллюлозные мембраны Immobilon-NC при 20°C и постоянной силе тока 400 мА в 0.025 М натрий-бикарбонатном буфере, pH 9.0, содержащем 20% метанола и 0.1% SDS, в течение 1 ч. Для иммуноокрашивания мембраны инкубировали в течение 10 ч с антителами к пептиду (1-17) в разведении 1 : 200 при 4°С. Затем мембраны обрабатывали овечьими антителами против суммарных иммуноглобулинов кролика, конъюгированными с пероксидазой хрена (Sigma, Aldrich, USA), в разведении 1 : 1500. Для окрашивания белковых полос к мембранам добавляли 25 мл раствора 50 мМ Tris-HCl (pH 7.6), содержащего 12.5 мг диаминобензидина и 30 мкл 50% раствора перекиси водорода. Проявляли в течение 5–10 мин в темноте.
Определение олигомеризации Аβ(1-40) с помощью тиофлавина Т. Синтетический Аβ(1-40) растворяли в DMSO из расчета 1 мг пептида в 0.05 мл DMSO. К 10 мкл раствора Аβ(1-40) в DMSO добавляли при перемешивании 1500 мкл буфера (20 мM Tris-Cl, 100 мM NaCl, pH 7.4) и вносили по 75 мкл этого раствора в лунки планшета немедленно после приготовления раствора, а также через 1 ч, 2 ч 30 мин, 4 и 6 ч инкубации при 37°С. В эти же лунки вносили по 25 мкл 50 мкМ тиофлавина Т (Sigma) в том же буфере. Итоговая концентрация бета-амилоида составила 25 мкМ, ThT – 12.5 мкМ. Флуоресценцию образцов измеряли при λвозб = 450 нм, λисп = 486 нм с помощью планшетного ридера Clariostar (BMG LABTECH).
Список литературы
Haass C., Selkoe D.J. // Cell. 1993. V. 75. P. 1039–1042.
Glenner G.G., Wong C.W. // Biochem. Biophys. Res. Communs. 2012. V. 425. P. 534–539 (reprinted from Biochemical and Biophysical Research Communications. 1984. V. 120. P. 885–890).
Selkoe D.J., Hardy J. // EMBO Mol. Med. 2016. V. 8. P. 595–608.
O’Brien R.J., Wong P.C. // Annu. Rev. Neurosci. 2011. V. 34. P. 185–204.
Gandy S., Simon A.J., Steele J.W., Lublin A.L., Lah J.J., Walker L.C., Levey A.I., Krafft G.A., Levy E., Checler F., Glabe C., Bilker W., Abel T., Schmeidler J., Ehrlich M.E. // Ann. Neurol. 2010. V. 68. P. 220–230.
Kayed R., Lasagna-Reeves C.A. // J. Alzheimers Dis. 2013. V. 33 (Suppl. 1). P. S67–S78.
Choi J.W., Kim H.Y., Jeon M., Kim D.J., Kim Y. // Amyloid. 2012. V. 19. P. 133–137.
Tickler A.K., Barrow C.J., Wade J.D. // J. Pept. Sci. 2001. V. 7. P. 488–494.
Сидорова М.В., Молокоедов А.С., Овчинников М.В., Беспалова Ж.Д., Бушуев В.Н. // Биоорган. химия. 1997. Т. 23. С. 46–55. [M.V. Sidorova, A.S. Molokoedov, M.V. Ovchinnikov, Zh.D. Bespalova, V.N. Bushuev // Russ. J. Bioorgan. Chem. 1997. V. 23. P. 41–50].
Crescenzi O., Tomaselli S., Guerrini R., Salvadori S., D’Ursi A.M., Temussi P.A., Picone D. // Eur. J. Biochem. 2002. V. 269. P. 5642–5648.
Condron M.M., Monien B.H., Bitan G. // Open Biotechnol. J. 2008. V. 2. P. 87–93.
Kok W.M., Scanlon D.B., Karas J.A., Miles L.A., Tew D.J., Parker M.W., Barnham K.J., Hutton C.A. // Chem. Commun. (Camb). 2009. V. 41. P. 6228–6230.
Kreutzer A.G., Yoo S., Spencer R.K., Nowick J.S. // J. Am. Chem. Soc. 2017. V. 139. P. 966–975.
Benilova I., Karran E., De Strooper B. // Nat. Neurosci. 2012. V. 15. P. 349–357.
Itkin A., Dupres V., Dufrene Y.F., Bechinger B., Ruysschaert J.-M., Raussens V. // PLoS One. 2011. V. 6 (3). e18250.
Xue C., Lin T.Y., Chang D., Guo Z. // R. Soc. Open Sci. 2017. V. 4 (1):160696.
Pfaff E., Mussgay M., Böhm H.O., Schulz G.E., Schaller H. // EMBO J. 1982. V. 1. № 7. P. 869–874.
Ахидова Е.В., Волкова Т.Д., Короев Д.О., Ким Я.С., Филатова М.П., Владимирова Н.М., Кармакова Т.А., Завалишина Л.Э., Андреева Ю.Ю., Вольпина О.М. // Биоорган. химия. 2010. Т. 36. № 2. С. 178–186. [Akhidova E.V., Volkova T.D., Koroev D.O., Kim Ia.S., Filatova M.P., Vladimirova N.M., Karmakova T.A., Zavalishina L.E., Andreeva Iu.Iu., Vol’pina O.M. // Russ. J. Bioorg. Chem. 2010. V. 36. № 2. P. 164–171].
Laemmli U.K. // Nature. 1970. V. 227. P. 680–685.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


