Биоорганическая химия, 2020, T. 46, № 3, стр. 294-301
Влияние этанольных экстрактов Silene roemeri, S. sendtneri на первичные моноциты/макрофаги человека
Е. С. Филоненко , Л. Н. Зибарева
Национальный исследовательский Томский государственный университет, Сибирский ботанический сад
634050 Томская область, Томск, просп. Ленина, 36, Россия
Поступила в редакцию 16.09.2019
После доработки 21.10.2019
Принята к публикации 25.10.2019
Аннотация
Иммуномодулирующая и иммунокоррегирирующая терапии являются важными подходами в укреплении иммунитета. Биологически активные вещества растений, проявляющие широкий спектр фармакологической активности, могут действовать как агенты, мобилизующие иммунную систему. Растения, принадлежащие к семейству Гвоздичных (Caryophyllaceae Juss.), включая виды Silene roemeri Friv., S. sendtneri Boiss, богаты экдистероидами и флавоноидами, которые характеризуются большим разнообразием биологических активностей, потенциально влияющих на иммунную систему. В настоящем исследовании изучали влияние действия нативных и бесхлорофильных экстрактов растений S. roemeri, S. sendtneri на макрофаги человека. Оценивали влияние экстрактов на продукцию цитокинов (с помощью ИФА), а также экспрессию дифференциально регулируемых генов (с помощью микрочипов и полимеразной цепной реакции в реальном времени с реакцией обратной транскрипции). Результаты экспериментов показали, что все исследуемые виды повышают продукцию M2-ассоциированного хемокина CCl-18, кроме того, представители рода Silene L., индуцируют продукцию провоспалительных цитокинов (TNF-α, IL-1β, IL-6). Выявленное действие обнаружено как для нативных, так и бесхлорофильных экстрактов. Кроме того, экстракты исследуемых растений влияли на экспрессию генов CCL2, MMP9, VEGFA и S100A9 в макрофагах человека. В целом, результаты показывают, что растительные экстракты видов Silene проявляют иммуномодулирующее действие, влияя на активацию макрофагов in vitro.
ВВЕДЕНИЕ
В здоровом организме врожденная иммунная система обеспечивает первую линию обороны против внешних или внутренних сигналов опасности. Система мононуклеарных фагоцитов, включающая циркулирующие моноциты, резидентные макрофаги и дендритные клетки, играет главные роли в воспалении и антипатогенной защите, а также в прямой ликвидации чужеродных агентов [1].
Макрофаги активируются в ответ на сигналы, присутствующие в пораженной ткани или связанные с патогенами, увеличивают производство цитокинов, хемокинов и других активных молекул. Поляризованные макрофаги имеют M1- или M2-фенотип. Макрофаги М1, или “классически активированные” провоспалительные макрофаги, индуцируются отдельно IFN-γ или в сочетании его с липополисахаридом (эндотоксин) или TNF-α. В противоположность этому, “альтернативно активированные” макрофаги М2 индуцируются под воздействием различных сигналов, включая цитокины IL-4, IL-13, IL-10, иммунные комплексы, глюкокортикоиды [2].
Выступая в качестве первой линии защиты организма от разнообразных патогенов, мононуклеарные фагоциты сами становятся их мишенями, что приводит к нарушению их функций. В связи с этим остро стоит вопрос об изучении возможностей иммунокорректирующей терапии, иммуномодуляции функций мононуклеарных фагоцитов [3]. В качестве возможных агентов, мобилизующих иммунитет, могут выступать растения, богатые вторичными метаболитами различных классов.
Виды рода Silene (Caryophyllaceae) характеризуются большим разнообразием входящих в них химических структур, особенно экдистероидов [4]. Растения этого рода проявляют широкий спектр фармакологических активностей [5–9] и используются в медицине разных стран для лечения гинекологических, кожных и желудочно-кишечных, онкологических и других заболеваний [10].
Фармакологические свойства видов семейства гвоздичных недостаточно изучены и представляют очевидный интерес. В течение долгого времени в лаборатории фитохимии Сибирского ботанического сада Томского государственного университета изучаются виды семейства гвоздичных. Более 100 новых продуцентов фитоэкдистероидов рекомендовано, десятки видов интродуцированы в Западную Сибирь, выделены и установлены структуры ряда индивидуальных вторичных метаболитов из растений, в том числе новых [4, 11], исследованы биологические активности экстрактов растений видов Silene [6, 11–13].
Благодаря разнообразному составу, высокому содержанию вторичных метаболитов и биологическим активностям, возможно использование экстрактов видов рода Silene в качестве модуляторов активации и функций макрофагов.
Целью данного исследования является изучение действия растительных экстрактов видов S. sendtneri и S. roemeri на продукцию цитокинов и генную экспрессию в дифференциально активированных первичных макрофагах человека.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Хроматографический анализ растительных экстрактов
В связи с тем, что имеются данные [14, 15] о проявлении хлорофиллами противовоспалительной активности, сделана попытка исключить их вклад в суммарную биологическую активность исследуемых растений. Предварительно проведено селективное их извлечение из сырья с целью оценки биологической активности БАВ исследуемых видов в составе бесхлорофильного комплекса. Удаление хлорофилла из экстрактов с помощью н-гексана позволило провести более точный ВЭЖХ-анализ состава флавоноидов и экдистероидов и исключить вклад пигментов в биологическую активность. Хроматографический профиль исследованных растительных экстрактов приведен в табл. 1.
Таблица 1.
Содержание БАВ в нативных и бесхлорофильных экстрактах (в процентах на абсолютно сухое сырье)
| Вид рода Silene | Соединения | Нативный экстракт, % (m ± SEM) |
Бесхлорофильный экстракт, % (m ± SEM) |
|---|---|---|---|
| S. sendtneri | Фитоэкдистероиды | 1.18 ± 0.01 | 1.02 ± 0.01 |
| Флавоноиды | 4.84 ± 0.03 | 5.24 ± 0.10 | |
| S. roemeri | Фитоэкдистероиды | 1.52 ± 0.01 | 1.18 ± 0.01 |
| Флавоноиды | 2.87 ± 0.01 | 2.37 ± 0.03 |
Состав и содержание БАВ в нативных и бесхлорофилльных экстрактах были одинаковыми. В экстрактах S. sendtneri были обнаружены: полиподин B, 20-гидроксиэкдизон (20E), виценин-2; в S. roemeri идентифицированы 20E, экдизон, 2-дезокси-20E, виценин-2. Большее содержание фитоэкдистероидов в нативных и бесхлорофильных экстрактах наблюдается у S. roemeri, тогда как преобладание флавоноидов – у S. sendtneri. 20E является мажорным компонентом фитоэкдистероидов, его количество в исследуемых экстрактах составляет 0.76–1.18% в пересчете на абсолютно сухое сырье. Во всех исследованных экстрактах наблюдали флавоноид с TR 13.8–14.3 мин (ВЭЖХ), содержание которого составляло 1.39–3.72%.
Продукция про- и противовоспалительных цитокинов макрофагами при действии исследуемых растительных экстрактов
Моноциты/макрофаги способны продуцировать и секретировать более 100 различных эффекторных и регуляторных молекул. Среди продуктов секреции макрофагов главное место занимают провоспалительные и противовоспалительные цитокины [3]. Чтобы охарактеризовать действие растительных экстрактов растений рода Silene, анализировали продукцию цитокинов TNF-α, IL-1β, IL-6, и CCl-18. Нестимулированные макрофаги (MFNS) и макрофаги, дифференцированные в присутствии IFN-γ (MFIFN-γ) или IL-4 (MFIL-4) инкубировали в среде с добавлением растительных экстрактов Silene sendtneri или S. roemeri (табл. 2) или этанола (контроль). Виды Silene индуцируют продукцию TNF-α, IL-1β, IL-6 в MFNS, MFIFN-γ и небольшое накопление IL-1β, IL-6 в MFIL-4. Все исследуемые виды индуцируют продукцию ССL-18 в MFIL-4, кроме того, виды Silene индуцируют небольшую продукцию ССL-18 в MFNS, MFIFN-γ. Так S. sendtneri повышает содержание TNF-α в MFIFN-γ в 16.2 раза по сравнению с контролем (этанол), IL-1β в MFIFN-γ в 10.9 раза, ССL-18 в MFNS в 95.8 раза, ССL-18 в MFIL-4 в 2.2 раза. S. roemeri повышает содержание TNF-α в MFIFN-γ в 13.5 раза; IL-1β в MFIFN-γ в 9.5 раза, ССL-18 в MFNS в 5 раз, ССL-18 в MFIL-4 в 2.5 раза.
Таблица 2.
Влияние растительных экстрактов на содержание цитокинов в супернатанте
| Содержание цитокинов, пг/мл Me (LQ; UQ) |
|||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Экстракты | TNF-α | IL-6 | IL-1β | CCL-18 | |||||||||
| ns | IFN-γ | IL-4 | ns | IFN-γ | IL-4 | ns | IFN-γ | IL-4 | ns | IFN-γ | IL-4 | ||
| Нативные | EtOH | 0.00 | 25.01 (0.00; 50.66) |
0.00 | 0.00 | 0.00 | 0.00 | 0.00 (0.00; 10.66) |
9.39 (0.00; 30.74) |
0.00 (0.00; 12.09) |
59.25 (44.55; 75.77) |
0.00 (0.00; 17.91) |
434560.27 (308104.23; 590532.78) |
| S.s. | 69.97 (0.00; 174.04) |
405.81 (109.87; 727.98) |
0.00 | 1181.50 (99.42; 11094.15) |
647.48 (89.29; 6728.80) |
24.45 (11.96; 273.74) |
20.67 (4.65; 148.03) |
102.06 (19.22; 429.96) |
4.04 (0.00; 17.00) |
5676.45 (549.34; 34768.04) |
49.92 (29.51; 246.64) |
946619.79 (686169.81; 1505746.02) |
|
| S.r. | 62.13 (0.00; 140.31) |
338.41 (83.48; 585.03) |
0.00 | 649.51 (47.59; 8408.90) |
582.44 (49.23; 6599.58) |
0.00 (0.00; 224.53) |
19.88 (4.31; 128.98) |
89.39 (15.46; 428.10) |
4.17 (0.00; 16.13) |
293.14 (228.08; 4130.43) |
58.79 (24.26; 97.99) |
1081398.51 (714279.90; 1739761.70) |
|
| P | 0.508 | 0.002* | 1.00 | ≤0.001* | ≤0.001* | 0.242 | 0.077 | 0.003* | 0.754 | 0.006* | 0.019* | 0.105 | |
| Бесхлорофильные | EtOH | 0.00 | 37.47 (0.00; 81.81) |
0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 (0.00; 11.00) |
0.00 | 66.46 (51.14; 167.97) |
17.35 (0.00; 54.95) |
470856.10 (370268.81; 525546.60) |
| S.s. | 19.70 (0.00; 40.03) |
337.50 (242.70; 572.55) |
0.00 | 682.35 (330.95; 945.95) |
950.37 (580.55; 1126.39) |
28.41 (0.00; 64.85) |
6.69 (0.00; 16.85) |
112.51 (77.61; 210.74) |
0.00 | 1844.23 (771.55; 3347.87) |
27.24 (12.19; 38.29) |
1419930.05 (1060132.31; 1779229.02) |
|
| S.r. | 0.00 | 207.56 (160.56; 247.27) |
0.00 | 161.60 (69.99; 348.01) |
196.08 (92.89; 513.48) |
36.24 (31.66; 48.45) |
4.84 (0.00; 13.55) |
39.11 (32.13; 48.59) |
0.00 | 1243.08 (423.02; 1853.86) |
26.22 (11.68; 39.76) |
1211310.42 (763866.18; 1636170.27) |
|
| P | 0.653 | 0.005* | 1.00 | 0.005* | 0.005* | 0.273 | 0.431 | 0.005* | 1.00 | 0.005* | 0.931 | 0.042* | |
Установлено, что после извлечения хлорофиллов из сырья экстракты S. sendtneri и S. roemeri сохраняют вызванный ими повышенный уровень продукции TNF-α, IL-1β, IL-6 в МFNS, MFIFN-γ, а также ССL-18 в MFIL-4. Кроме того, наблюдалось небольшое накопление IL-6 в MFIL-4 и ССL-18 в MFNS, MFIFN-γ. Так, бесхлорофильный экстракт S. sendtneri повышает содержание TNF-α в MFIFN-γ в 9 раз по сравнению с контролем, ССL-18 в MFNS в 27.8 раза, ССL-18 в MFIFN-γ в 1.6 раза, ССL-18 в MFIL-4 в 3 раза. Бесхлорофильный экстракт S. roemeri повышает содержание TNF-α в MFIFN-γ в 5.5 раза, ССL-18 в MFNS в 18.7 раза, ССL-18 в MFIFN-γ в 1.5 раза, ССL-18 в MFIL-4 в 2.6 раза.
Попарное сравнение с помощью критерия Тьюки показало, что нативный экстракт S. sendtneri вызывает достоверное увеличение продукции TNF-α и IL-1β в MFIFN-γ, IL-6 в MFNS и MFIFN-γ, а также CCL-18 в MFNS по сравнению с контролем (P < 0.05). При действии бесхлорофильного экстракта S. sendtneri попарное сравнение с помощью критерия Тьюки установило достоверное увеличение продукции TNF-α и IL-1β в MFIFN-γ, IL-6 в MFNS и MFIFN-γ, а также CCL-18 в MFNS и MFIL-4 по сравнению с контролем (P < 0.05). В остальных случаях достоверной разницы в продукции цитокинов между исследуемыми группами не было обнаружено из-за ограниченного числа доноров.
Поскольку фитоэкдистероиды и флавоноиды являются основными БАВ семейства Гвоздичных, по всей вероятности, выявленный эффект экстрактов перспективных видов обусловлен комплексом этих вторичных метаболитов.
Влияние экстрактов на экспрессию генов в первичных макрофагах человека
Для более детального анализа эффектов растительных экстрактов растений рода Silene на макрофаги, анализировали их действие на экспрессию генов. MFNS, MFIFN-γ, MFIL-4 инкубировали в среде с добавлением этанола (контроль) или растительных экстрактов S. sendtneri, S. roemeri; на 6-й день из клеток выделяли тотальную РНК.
С помощью использования микрочипов было выявлено 3988 генов, статистически значимо дифференциально регулируемых под влиянием экстрактов. Из всего массива генов в 157 наблюдается изменение экспрессии с уровнем экспрессии $\frac{ > }{ < }$ 2 $\left( {{\text{FC}}\frac{ > }{ < }2} \right),$ хотя бы в одной стимуляции. В табл. 3 и 4 представлены функциональные группы генов макрофагов, наиболее важных с иммунологической и онкологической точки зрения, экспрессия которых изменяется при действии экстрактов.
Таблица 3.
Функциональные группы генов, экспрессия которых повышается при действии экстрактов
| Функциональная группа | Ген | Оценка экспрессии (FC ≥ 2) | |||
|---|---|---|---|---|---|
| NS: S.r. vs Ctrl | NS: S.s. vs Ctrl | IFN-γ: S.r. vs Ctrl | IFN-γ: S.s. vs Ctrl | ||
| Цитокин-цитокиновый рецептор | CCL2 | 12.162* | 12.555* | 5.598* | 5.116* |
| IL1R2 | 2.386 | 1.875 | 5.265* | 7.212* | |
| CCL18 | 1.866 | 7.428* | 0.940 | 0.912 | |
| VEGFA | 0.912 | 1.061 | 2.777* | 3.134* | |
| Ангиогенез | |||||
| Металлопептидазная активность | MMP9 | 4.480 | 3.674 | 5.696* | 6.588* |
| MMP14 | 2.022* | 2.051* | 4.503* | 4.698* | |
| Заживление ран | TNFAIP3 | 2.487* | 1.722 | 3.482* | 3.295* |
| S100A9 | 9.225* | 8.005* | 3.353* | 4.774* | |
| PLAUR | 2.449* | 2.732* | 2.737* | 3.154* | |
| SERPINB2 | 3.380* | 2.512 | 1.007 | 1.017 | |
Таблица 4.
Функциональные группы генов, экспрессия которых снижается при действии экстрактов
| Функциональная группа | Ген | Оценка экспрессии (FC < 1) | |||
|---|---|---|---|---|---|
| NS: S.r. vs Ctrl | NS: S.s. vs Ctrl | IFN-γ: S.r. vs Ctrl | IFN-γ: S.s. vs Ctrl | ||
| Цитокин-цитокиновый рецептор | PDGFC | 0.414* | 0.346* | 0.849 | 0.808 |
| HGF | 0.292* | 0.239* | 0.526* | 0.499* | |
| TNFSF8 | 0.333* | 0.269* | 0.437* | 0.362* | |
| FLT3 | 0.175* | 0.145* | 0.283* | 0.251* | |
| Ангиогенез | STAB1 | 0.411 | 0.290* | 0.138* | 0.163* |
Примечание. Обозначения см. табл. 3.
В MFNS при действии растительных экстрактов S. sendtneri, S. roemeri наблюдалось статистически значимое повышение экспрессии генов CCL2, CCL18, S100A9, небольшое повышение экспрессии MMP14, TNFAIP3, PLAUR, SERPINB2, в остальных случаях статистически значимых различий в MFNS не обнаружено.
В отличие от этого, в MFIFN-γ при действии растительных экстрактов S. sendtneri и S. roemeri наблюдалось значимое повышение экспрессии CCL2, IL1R2, VEGFA, MMP9, MMP14, TNFAIP3, S100A9, PLAUR, в остальных случаях статистически значимых различий в MFIFN-γ не обнаружено.
Повышение экспрессии CCL2, ССL18, IL1R2, VEGFA, MMP9, MMP14 ассоциировано с активацией ангиогенеза, миграции макрофагов при воспалении, а также увеличением антимикробной активности [16].
Повышение экспрессии TNFAIP3, S100A9, PLAUR, SERPINB2 ассоциировано с активацией воспалительного ответа, бактерицидной активности и процессами свертывания крови [16].
В MFNS при действии растительных экстрактов S. sendtneri, S. roemeri наблюдалось статистически значимое снижение экспрессии генов: PDGFC, HGF, TNFSF8, FLT3, значимое снижение экспрессии STAB1 обнаружено только при действии Silene sendtneri.
В MFIFN-γ при действии растительных экстрактов S. sendtneri, S. roemeri значимое снижение экспрессии наблюдалось у генов: HGF, TNFSF8, FLT3, STAB1.
Снижение экспрессии PDGFC, HGF, TNFSF8, FLT3, STAB1 связано с модуляцией процессов заживления ран, ангиогенеза, регенерации тканей и бактерицидной активности [16].
Для подтверждения данных, полученных в эксперименте с микрочипами, среди идентифицированных генов были выбраны CCL2, CCL18, VEGFA, MMP9 и S100A9. Данные представлены на рис. 1.
Рис. 1.
Уровень экспрессии мРНК генов VEGFA (a), S100A9 (б), MMP9 (в), CCL2 (г) в макрофагах, культивируемых в течение 6 сут в присутствии растительных экстрактов. Примечание: EtOH – этанол (контроль), S.s. – S. sendtneri, S.r. – S. roemeri; NS – без стимуляции цитокинами, IFN – стимуляция интерфероном γ, * – статистически значимо по сравнению с контролем (P < 0.05, n = 4, тест Тьюки).
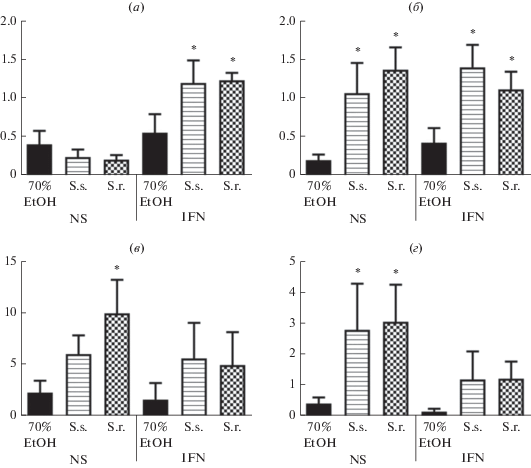
Согласно экспериментальным данным (рис. 1), под действием растительных экстрактов статистически значимое увеличение экспрессии CCL2 и MMP9 наблюдалось в MFNS. Экспрессия CCL2 в присутствии экстракта S. sendtneri увеличилась в 6.4 раза, а в присутствии S. roemeri в 7 раз, экспрессия MMP9 увеличилась под действием S. roemeri в 4.3 раза. Экспрессия VEGFA была значительно повышена в присутствии растительных экстрактов в MFIFNγ. Экспрессия VEGFA в присутствии экстракта S. sendtneri увеличилась в 2.1 раза, в присутствии S. roemeri – в 2.2 раза.
В присутствии растительных экстрактов статистически значимое увеличение экспрессии S100A9 наблюдалось в MFNS и MFIFNγ. Экспрессия S100A9 в присутствии S. sendtneri усиливалась в 5.1 раза в MFNS и в 3.2 раза в MFIFNγ. В присутствии S. roemeri экспрессия S100A9 увеличилась в 6.6 раза в MFNS и в 2.6 раза в MFIFNγ. В ходе эксперимента для CCL18 не наблюдалось статистически значимых изменений экспрессии в присутствии растительных экстрактов. В целом результаты ОТ-кПЦР подтвердили дифференциальную экспрессию CCL2, VEGFA, S100A9 в присутствии растительных экстрактов.
Среди цитокинов, которые были исследованы с помощью ИФА, в списке дифференциально экспрессированных генов обнаружен ген хемокина CCL18, что указывает на регуляцию этого фактора экстрактами на генетическом уровне. В то время как регуляция продукции других исследованных цитокинов (TNF-α, IL-1β и IL-6) экстрактами, вероятно, осуществляется на уровне трансляции или пост-трансляционном уровне. Также нельзя исключить, что изменения в экспрессии TNF-α, IL-1β и IL-6 могут наблюдаться на более ранних временных точках.
ЗАКЛЮЧЕНИЕ
1. Нативные экстракты S. sendtneri, S. roemeri оказывают стимулирующее влияние на продукцию TNF-α, IL-1β и IL-6, увеличивая их продукцию в 1.2–16.2 раза. Все изученные виды родa Silene увеличивают продукцию CCL18 в 2.2–95.8 раза по сравнению с контролем в первичных макрофагах человека.
2. Бесхлорофильные растительные экстракты S. sendtneri, S. roemeri сохраняют высокую биологическую активность и, подобно нативным экстрактам, увеличивают продукцию TNF-α, IL-1β и IL-6 в 5.5–9 раз, а CCL18 в 1.5–27.8 раза по сравнению с контролем. Таким образом, экстракты способствуют активации макрофагов.
3. Растительные экстракты S. sendtneri, S. roemeri влияют на экспрессию нескольких функциональных генов, кодирующих белки (цитокины, рецепторы, факторы роста), которые регулируют ангиогенез (образование новых кровеносных сосудов) и заживление ран.
Таким образом, полученные экспериментальные данные свидетельствуют о том, что экстракты S. sendtneri, S. roemeri проявляют иммуномодулирующую активность.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Растительный материал
Растительный материал S. sendtneri, S. roemeri был выращен и собран на коллекционном участке лаборатории фитохимии Сибирского ботанического сада, г. Томск. Растения были идентифицированы ботаниками Н.А. Ивановой, Л.П. Гашковой, А.Л. Эбелем. Ваучеры (TK-004020, TK-004016) были сданы на хранение в гербарий им. П.Н. Крылова Биологического института Томского государственного университета. Надземные части отобранных растений (в 3 повторностях) были собраны в фазу цветения.
Приготовление экстрактов
Навеску воздушно-сухого сырья массой 1 г троекратно экстрагировали 70% этиловым спиртом (15 мл × 3, время экстракции 24 ч) на водяной бане при температуре 55°С. Полученные экстракты фильтровали и объединяли.
Приготовление бесхлорофильных экстрактов
Воздушно-сухое сырье массой 1 г заливали 10 мл н-гексана, затем гексановое извлечение фильтровали. Экстрагирование хлорофиллов н‑гексаном производили до полного обесцвечивания растворителя. Контроль за полнотой экстракции хлорофиллов осуществляли с помощью спектрофотометра Shimadzu 1800 до отсутствия их максимумов поглощения, которые детектируются в области λ 662–665 нм. Затем сырье сушили и экстрагировали 70% водным этанолом по схеме, описанной выше.
Высокоэффективная жидкостная хроматография
Анализ БАВ проводился с использованием ВЭЖХ, жидкостной хроматограф с диодно-матричным детектором “Shimadzu LC20” (Япония). Хроматографическая колонка Perfect Sil Target ODS-3; 4.6 × 250 мм, с размером зерна сорбента 5 мкм. Элюент А: смесь ацетонитрила, изопропилового спирта (5 : 2 по объему), элюент В: 0.1% трифторуксусная кислота. Время анализа 60 мин. Скорость элюирования 1 мл/мин. Режим элюирования: градиент низкого давления; программа градиента: 0–40 мин 15–35% элюент А, 40–60 мин 35% элюент А. Объем пробы 10 мкл. Использованы аналитические длины волн 272 нм для регистрации флавоноидов, 254 нм – фитоэкдистероидов. Фенольные соединения были идентифицированы с использованием стандартов (Sigma-Aldrich, США; HWI group, Германия; чистота ≥95.0%). Выделенные фитоэкдистероиды из других растительных объектов идентифицированы с помощью масс-спектрометрии и ЯМР-спектроскопии [4] и использованы в качестве стандартов. Содержание БАВ рассчитывали по площадям пиков образца и соответствующих стандартов с помощью калибровочной кривой, построенной с использованием программного обеспечения LC Postrun Calibration Curve.
Выделение моноцитов
Моноциты выделяли из лейкоцитарной пленки как описано в работе [17]. Моноциты выделяли в градиенте плотности с последующей положительной магнитной селекцией с использованием шариков CD14 + MACS (Miltenyi Biotech, Bergisch Gladbach, Германия). Клетки ресуспендировали в бессывороточной среде Macrophage (GIBCO) в концентрации 2 × 106 клеток на мл с добавлением дексаметазона (Sigma) при 1 × 10–8 М и M-CSF 5 нг/мл (Peprotech). Клетки стимулировали с использованием следующих цитокинов: INF-γ (Peprotech) в концентрации 100 нг/мл, IL-4 (Peprotech) в концентрации 10 нг/мл. Клетки инкубировали при 37°C и 7.5% CO2 в течение 6 сут в среде в присутствии растительных экстрактов или этанола (контроль) в соотношении 1 мкл образца на 500 мкл среды. На 6-е сут собирали супернатант и выделяли РНК. Кровь для выделения моноцитов получена от здоровых доноров Службой крови Немецкого Красного Креста Баден-Вюртемберг-Гессен. (German Red Cross Blood Service Baden-Württemberg-Hessen).
Анализ продукции цитокинов
Продукцию цитокинов анализировали в супернатанте с помощью иммуноферментного анализа (ИФА), используя наборы для ИФА из R&D systems (Wiesbaden, Germany). ИФА проводили согласно рекомендациям производителя. Использовали Human TNF-α DuoSet Elisa (DY210), Human IL-1β DuoSet Elisa (DY201), Human IL-6 DuoSet Elisa (DY206), Human CCL 18/PARC DuoSet Elisa (DY394).
Анализ микрочипами
Тотальную РНК выделяли из клеток, используя набор E.Z.N.A.® Total RNA Kit (Omega Bio–Tek, США), в соответствии с рекомендациями производителя, на 6-й день культивирования. Мечение, гибридизация и сканирование GeneChip Human Gene 1.0 ST Array было выполнено в Медицинском исследовательском центре Медицинского факультета Мангейма (Medical Research Center of Medical Faculty Mannheim, Германия). Функциональные группы генов были выбраны с использованием базы данных Molecular Signatures Database, v5.2 (Broad Institute, США).
Полимеразная цепная реакция в реальном времени с реакцией обратной транскрипции (ОТ-кПЦР)
Относительную количественную оценку экспрессии генов проводили с помощью ОТ-кПЦР с использованием предварительно разработанных анализов генов TaqMan для MMP9 (идентификатор анализа Hs00234579_m1), VEGFA (Hs00900055_m1) и S100A9 (Hs00610058_m1) (ThermoFisher Scientific, Дармштадт, Германия), самоанализ CCL2, CCL18, в качестве гена-рефери использовали ген “домашнего хозяйства” GAPDH и уровень экспрессии каждого целевого гена нормализовали по отношению к экспрессии GAPDH (последовательности праймеров указаны в табл. 5).
Таблица 5.
Олигонуклеотиды, использованные для анализа ОТ-кПЦР
| Гены | Последовательность праймеров (5' > 3') |
|---|---|
| CCL2 | F: TCAAACTGAAGCTCGCACTC R: ATTGATTGCATCTGGCTGAG Probe: TCTCTGCCGCCCTTCTGTGC |
| CCL18 | F: ATACCTCCTGGCAGATTCCAC R: GCTGATGTATTTCTGGACCCAC Probe: CAAGCCAGGTGTCATCCTCCTAACCAAGAGAG |
| GAPDH | F: CATCCATGACAACTTTGGTATCGT R: CAGTCTTCTGGGTGGCAGTGA Probe: AAGGACTCATGACCACAGTCCATGCC |
Статистический анализ
Обработка данных по содержанию цитокинов выполнялась с использованием программы SigmaPlot 13.0. Данные представлены в виде медианы и межквартильного размаха. Значение Р статистической значимости определяли по критерию Фридмана. Тест Тьюки проводили для парных сравнений с контролем (Р < 0.05).
Анализ экспрессии генов выполнялся в Microsoft Excel 2007, уровень экспрессии (FC) рассчитывали как log2. Сравнительный анализ уровней экспрессии проводили между (vs) экстрактами и контролем.
Список литературы
Italiani P., Boraschi D. // Front. Immunol. 2014. V. 5. P. 514.
Brown B.N., Ratner B.D., Goodman S.B., Amar S., Badylak S.F. // Biomaterials. 2012. № 33. P. 3792–3802.
Фрейдлин И.С., Тотолян А.А. Клетки иммунной системы. В 2 т. СПб.: Наука, 2000. Т. 2. Моноциты. 231 с. ISBN 5-02-026131-9.
Zibareva L., Yeriomina V. I., Munkhjargal N., Girault J.-P., Dinan L., Lafont R. // Arch. Insect Biochem. Physiol. 2009. V. 72. № 4. P. 234–248.
Абубакиров Н.К. // Химия природных соединений. 1981. № 6. С. 685–702.
Зибарева Л.Н., Алиев О.И., Колтунов А.А., Плотников М.Б. Гемореологическое средство: пат. 2160592 Рос. Федерация : МПК7 А61К 31/575, А61Р 7/00, 7/02; заявитель и патенотообладатель Научно-исследовательский институт фармакологии ТНЦ РАМН, Сибирский ботанический сад ТГУ. № 96118150/14; заявл. 11.09.96; опубл. 20.12.00, Бюл. № 35. 5 с.
Zibareva L., Volodin V., Saatov Z., Savchenko T., Whiting P., Lafont R., Dinan L. // Phytochemistry. 2003. V. 64. № 2. P. 499–517.
Kim H.P., Son K.H., Chang H.W., Kang S.S. // J. Pharmacol. Sci. 2004. V. 96. № 3. P. 229–245.
Дармограй С.В., Фурса Н.С., Ерофеева Н.С. // Российский медико-биологический вестник имени академика И.П. Павлова. 2013. № 1. С. 123–132.
Смолякова И.М., Калинкина Г.И., Березовская Т.П., Дмитрук С.Е., Зибарева Л.Н., Свиридова Т.П. // Фармация. 2004. № 5. С. 20–22.
Зибарева Л.Н. Фитоэкдистероиды растений семейства Сaryophyllaceae / Л.Н. Зибарева. Саарбрюккен: Lambert Academic Publishing GmbH&Co, 2012. 195 с. ISBN 978-3-8473-1785-2.
Krylova S.G., Zueva E.P., Zibareva L.N., Amosova E.N., Razina T.G. // Bulletin Experiment. Biology and Medicine. 2014. V. 158. № 2. P. 225–228. https://doi.org/10.1007/s10517-014-2728-1
Chandra S., Rawat D.S. // Integrative Medicine Research. 2015. V. 4. № 3. P. 123–131. https://doi.org/10.1016/j.imr.2015.06.004
Subramoniam A., Asha V.V., Nair S.A., Sasidharan S.P., Sureshkumar P.K., Rajendran K.N., Karunagaran D., Ramalingam K. // Inflammation. 2012. V. 35. № 3. P. 959–966.
Park S., Choi J.J., Park B-K., Yoon S.J., Choi J.E., Jin M. // Life Sciences. 2014. V. 103. № 2. P. 59–67.
GeneCards®: The Human Gene Database [Электронный ресурс]. URL: http://www.genecards.org.
Kzhyshkowska J., Gratchev A., Martens J.H., Pervushina O., Mamidi S., Johansson S., Schledzewski K., Hansen B., He X., Tang J., Nakayama K., Goerdt S. // J. Leukocyte Biology. 2004. V. 76. № 6. P. 1151–1161. https://doi.org/10.1189/jlb.0504300
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


