Биоорганическая химия, 2020, T. 46, № 3, стр. 302-309
Синтез конъюгатов гранулоцитарно-макрофагального колониестимулирующего фактора с алендроновой кислотой и их свойства
Т. И. Есина 1, Е. А. Волосникова 1, Л. Р. Лебедев 1, Г. В. Кочнева 2, А. А. Гражданцева 2
1 Институт медицинской биотехнологии ФБУН ГНЦ ВБ “Вектор” Роспотребнадзора
633010 Новосибирская обл., г. Бердск, ул. Химзаводская, 9, Россия
2 ФБУН ГНЦ ВБ “Вектор” Роспотребнадзора
630559 Новосибирская обл., р.п. Кольцово, Россия
Поступила в редакцию 25.07.2019
После доработки 24.12.2019
Принята к публикации 24.12.2019
Аннотация
С целью создания препарата направленного действия изучены процессы конъюгации рекомбинантного человеческого гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) с алендроновой кислотой. Реакции конъюгирования проводили в растворе и на твердом носителе. Показано, что GM-CSF в составе конъюгатов сохраняет свои биологические свойства. Конъюгаты GM-CSF с алендроновой кислотой проявляют более высокое сродство к гидроксиапатиту, аналогу минерального матрикса кости, чем исходный белок.
ВВЕДЕНИЕ
Природный человеческий гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) является важнейшим регуляторным фактором – цитокином, обеспечивающим рост, созревание и функциональную активность многих клеток крови, в частности гранулоцитов и макрофагов. Лекарственные средства на основе GM-CSF активно применяют как стимуляторы кроветворения для восстановления числа нейтрофилов и лейкоцитов у больных нейтропенией, у онкологических больных, проходящих химиотерапию и лучевую терапию, при пересадках костного мозга, органов, тканей, для лечения тяжелых инфекционных заболеваний, в том числе ВИЧ. Применение GM-CSF при онкологических заболеваниях способствует стабилизации состояния больных и уменьшению метастатических опухолей, но его применение затруднено большой токсичностью препарата [1]. Создание адресных средств доставки GM-CSF в костный мозг позволит уменьшить дозу препарата и увеличить эффективность терапии.
Известны и описаны методы ковалентного присоединения молекул белков цитокинов к различным носителям (монометоксиполиэтиленгликоль, полиглюкин, поливинилпирролидон, дивиниловый эфир) [2–4]. В качестве средств, направляющих в костную ткань (клетки костного мозга), в ряде работ используются бифосфонаты (бифосфонаты, BPs), которые соединяются с кальцием костных клеток, что объясняет их высокую аффинность к костной ткани. Доказанным свойством бифосфонатов является быстрое и массированное накопление в костной ткани (около 55% от введенной дозы после однократного внутривенного введения) [5]. Исследованы также некоторые методы получения конъюгатов BPs с лекарственными средствами [6–9]. Результатом работ по созданию конъюгатов BPs с биологически активными соединениями разной природы и спектра биологического действия является увеличение длительности лекарственного воздействия в костном матриксе, времени полужизни активного вещества, повышение фармакологической эффективности и снижение системных побочных эффектов [10–13].
Целью исследования являлась разработка способов получения конъюгатов лекарственного препарата GM-CSF с представителем BPs – алендроновой кислотой для их направленной доставки к клеткам-мишеням костного мозга и определение их биологической активности.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ранее, на примере конъюгатов ФНО-альфа с алендроновой кислотой ((4-амино-1-гидроксибутилиден)дифосфоновая кислота, ALN), было показано их повышенное сродство к костному матриксу при сохранении биологической активности [14]. Необходимо было выбрать параметры реакций конъюгирования GM-CSF с ALN, позволяющие сохранять активность GM-CSF. При проведении реакции конъюгации для минимизации конформационных изменений молекул белка, способных влиять на их связывание с рецепторами, были использованы эквимольные количества компонентов.
Синтез конъюгатов в растворе
Синтез конъюгата аминобифосфоната с GM-CSF через карбоксильную группу белка с использованием 1-этил-3-[3-диметиламинопропил]карбодиимида (EDC). Субстанцию GM-CSF смешивали с раствором сшивающего агента в пропорции 1 : 1 (моль/моль) и инкубировали при перемешивании (6 ± 2)°С, 1 ч. Затем в реакционную среду вносили эквимолярное количество ALN и продолжали инкубацию при тех же условиях в течение 1 ч. По завершении инкубации полученный конъюгат диализовали против физиологического раствора.
При анализе продуктов синтеза с использованием EDC в образце с помощью электрофоретического анализа [15] в 15% ПААГ регистрировали две белковые фракции, с молекулярными массами 15.4 и 31.5 кДа, что соответствует молекулярной массе исходного GM-CSF и его димера соответственно (рис. 1). Гомогенность полученного препарата мономера составила 79.4%.
Рис. 1.
Анализ продуктов реакции конъюгирования GM-CSF и ALN в растворе с помощью ЕDC (3), 1 – маркеры молекулярных масс 10–250 кДа, 2 – GM-CSF, 20 мкг/лунка (контроль.) Электрофорез в 15% ПААГ в восстанавливающих условиях, окрашивание Кумасси R-250.

В случае коротких белков, таких как GM-CSF, подобные модификации в виде ди- и тримера могут быть критичны для сохранения специфической активности белка.
Синтез конъюгата аминобифосфоната с GM-CSF через аминогруппу белка с использованием в качестве сшивающего агента молекулы декстрана с помощью реакции Малапрада [16]. В раствор вносили декстран с молекулярной массой 40 кДа (“AppliChem” (Германия) и периодат натрия в соотношении 1 : 40 (моль/моль) перемешивали и инкубировали (22–24°С, 1 ч). Затем активированный декстран отделяли гель-фильтрацией на колонке с сефадексом G-25 и вносили растворы белка и ALN в эквимолярных соотношениях, на 1 моль декстрана 1 моль белка и 1 моль ALN, инкубировали 3 ч при 22–24°С, после чего полученный конъюгат отделяли гель-фильтрацией на колонке с сефадексом G-25.
На денситограмме продукты синтеза регистрируются рядом перекрывающихся пиков (рис. 2а). При проведении электрофоретического анализа полученного конъюгата в 15% ПААГ на электрофореграмме видно, что препарат гетерогенный, визуализируется в виде белковой фракции соответствующей GM-CSF (15.4 кДа, содержание которой – 57.5%) и спектра полос с молекулярными массами 16, 32, 80, 120, 250 кДа (рис. 2б).
Рис. 2.
Профиль гель-фильтрации конъюгата GM-CSF и ALN, полученного с использованием активированного декстрана, на колонке с сефадексом G-25 (а), на оси ординат: оптическое поглощение раствора при 280 нм, о.е., на оси абсцисс – время элюции, мин. Электрофореграмма образцов конъюгата в 15% ПААГ в восстанавливающих условиях, окрашивание Кумасси R-250 (б): конъюгат GM-CSF и ALN, полученный с использованием декстрана, 20 мкг (1); GM-CSF, 20 мкг (2); белковый маркер 10–250 кДа (3).

Синтез конъюгатов на твердой фазе
В качестве твердой фазы использовали гидроксилапатит (HAP). Синтез конъюгатов с помощью EDC осуществляли двумя способами: методом прямой (белок → EDC → ALN) и обратной (ALN → EDC → белок) последовательности нанесения компонентов на сорбент.
При проведении синтеза методом прямой последовательности на колонку с HAP, уравновешенную 2 мМ калий-фосфатным буфером, рН 7.0, наносили GM-CSF в объеме, соответствующем 1/3 объема колонки. После нанесения перекрывали выход раствора из колонки на 2 часа для сорбции GM-CSF на HAP. Затем сорбент отмывали 2 мМ калий-фосфатным буфером, рН 7.0 и наносили раствор сшивающего агента EDC в объеме, соответствующем 1/3 объема колонки. Выход раствора из колонки вновь перекрывали на 2 ч для проведения реакции, после чего на колонку отмывали тем же буфером и наносили раствор ALN в объеме, соответствующем 1/3 объему колонки. Длительность реакции на этой стадии составляла 2 часа. Элюцию конъюгатов проводили 0.2 М калий-фосфатным буфером, рН 7.0. Полученный конъюгат диализовали против физиологического раствора.
При проведении синтеза методом обратной последовательности на колонку с HAP, уравновешенную 2 мМ калий-фосфатным буфером, рН 7.0, первым наносили раствор ALN, вторым – EDC и последним – раствор белка GM-CSF. В остальном процедура проведения синтеза соответствовала описанной выше.
На рис. 3 приведены профиль хроматографии конъюгата GM-CSF c ALN на колонке с HAP и электрофореграмма хроматографических фракций. Видно, что конъюгат элюируется с колонки в виде одного узкого пика (рис. 3а). При прямой последовательности синтеза в полученном конъюгате присутствует основная белковая фракция соответствующая GM-CSF (15.4 кДа) и дополнительная фракция на уровне 32 кДа, что соответствует молекулярной массе его димера, гомогенность полученного препарата мономера – 86.5% (рис. 3б). При обратной последовательности синтеза дополнительные белковые фракции в составе образца отсутствуют, гомогенность полученного препарата – 98.1% (рис. 3б). Определение содержания неконъюгированного GM-CSF показало, что количество элюируемого 0.01 М калий-фосфатным буфером, рН 7.0, белка не превышало 5% от нанесенного на колонку. После снятия конъюгата с целью определения остаточных количеств белка колонку промывали 1–2 М калий-фосфатным буфером, рН 7.0. Дополнительной элюции белка при этом не наблюдали. Таким образом, выход конъюгата в реакции синтеза составлял около 95%.
Рис. 3.
Профиль элюции конъюгата GM-CSF-ALN, полученного EDC-методом, на колонке с HAP (a), на оси ординат: оптическое поглощение раствора при 280 нм, о.е. (левая ось), молярность элюирующего буфера, М (справа); на оси абсцисс – время элюции, мин. Электрофореграмма образцов конъюгатов, полученных прямой (белок → EDC → → ALN) и обратной (ALN → EDC → белок) последовательностью нанесения компонентов на сорбент в 15% ПААГ в восстанавливающих условиях, окрашивание Кумасси R-250 (б). Конъюгат GM-CSF с ALN, прям., 20 мкг/лунка (1); конъюгат GM-CSF с ALN, обратн., 20 мкг/лунка (2); белковый маркер 10–250 кДа (3); контроль, GM-CSF, 20 мкг/лунка (4).

В табл. 1 представлены характеристики конъюгатов GM-CSF с ALN, полученных разными методами. Для определения активности препаратов были взяты идентичные количества конъюгатов.
Таблица 1.
Характеристики конъюгатов GM-CSF и ALN, полученных разными методами
| Исследуемый образец | Активность GM-CSF, нг/мл | Гомогенность препарата, % | Молекулярные массы фракций, кДа | Сродство к гидроксиапатиту (концентрация буфера для элюции, моль/л) |
|---|---|---|---|---|
| Исходный GM-CSF | 0.28 | 98.2 | 15.4 | 0.010 ± 0.002 |
| Конъюгаты, полученные на твердой фазе | ||||
| Конъюгат, полученный методом прямой последовательности (белок → EDC → ALN) |
0.38 | 86.5 | 15.4; 32 | 0.025 ± 0.002 |
| Конъюгат, полученный методом обратной последовательности (ALN → EDC → белок) |
0.28 | 98.1 | 15.4 | 0.025 ± 0.002 |
| Конъюгаты, полученные в растворе | ||||
| Конъюгат, полученный с использованием декстрана | 0.24 | 57.5 | 15.4; 16; 32; 80; 120, 250 | 0.025 ± 0.002 |
| Конъюгат, полученный с использованием EDC | 0.41 | 79.4 | 15.4; 31.5 | 0.025 ± 0.002 |
Из результатов, приведенных в табл. 1 видно, что метод с использованием фиксации активных компонентов на твердой фазе позволяет получать конъюгаты высокой степени гомогенности (86.5–98.1%) и с высокой специфической активностью (0.24–0.38 нг/мл), что свидетельствует о сохранности структуры белка в их составе и возможности использования для создания лекарственных препаратов. Конъюгаты, полученные методом синтеза в растворе с использованием EDC обладает меньшей гомогенностью (79.4%) и активностью (0.41 нг/мл) и не представляют интереса для дальнейших исследований. Конъюгаты, полученные в растворе с использованием декстрана, несмотря на их гетерогенность (57.5%), являются перспективными для изучения, так как демонстрируют высокую специфическую активность (0.24 нг/мл).
Данные об уровне связывания конъюгатов GM-CSF и ALN с HAP in vitro
На примере конъюгатов ФНО-альфа с ALN было показано их накопление в костной ткани in vivo [17].
При проведении экспериментов по изучению тропности образцов конъюгатов к костномозговому окружению использовали HAP – аналог минерального вещества кости млекопитающих [18].
Определение сродства конъюгатов GM-CSF с ALN к HAP проводили методом хроматографии на колонке с HAP в сравнении со свободным GM-CSF. Было установлено, что все полученные образцы конъюгатов GM-CSF с ALN, также как GM-CSF, обладали способностью сорбироваться на HAP.
В ходе работы показано, что количественная десорбция свободного GM-CSF может быть достигнута с помощью элюирующего раствора калия фосфата с концентрацией соли 0.010 ± 0.002 М. Для конъюгата GM-CSF с ALN, полученных методом твердофазного синтеза, эта концентрация была в 2.5 раза выше (0.025 ± 0.002 М калия фосфата). Профили десорбции, представленные на рисунке (рис. 4а и 4б), подтверждают факт более прочного удержания гидроксиапатитом конъюгата GM-CSF c ALN в сравнении с GM-CSF.
Рис. 4.
Кривая десорбции с HAP свободного GM-CSF (а) GM-CSF в составе конъюгата, полученного с помощью EDC (б) и GM-CSF в составе конъюгата, полученного с помощью активированного декстрана (в). На оси ординат: оптическое поглощение раствора при 280 нм, о.е. (левая ось), молярность элюирующего буфера, М (справа); на оси абсцисс – время элюции, мин.
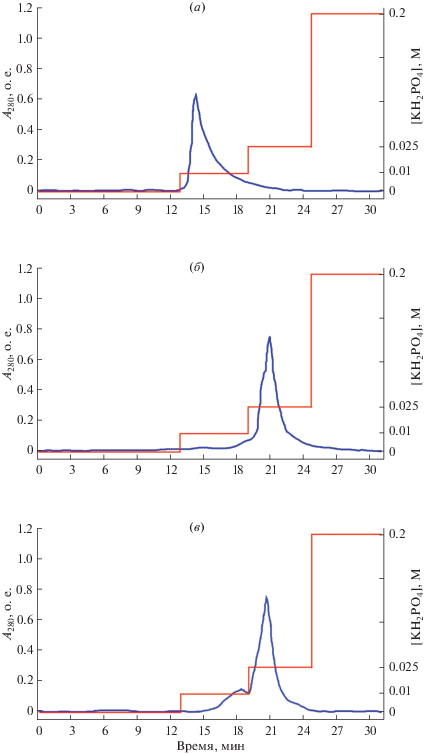
Конъюгаты, полученные с использованием в качестве сшивающего агента декстрана, также отличались повышенной способностью к связыванию с HAP (рис. 4в).
Таким образом, в ходе работы исследованы методы синтеза конъюгатов GM-CSF и ALN через карбоксильную и аминогруппу белка с помощью сшивающих агентов разных типов. Показано, что при проведении реакции конъюгирования в растворе, получаемые конъюгаты гетерогенны, тогда как метод с использованием фиксации активных компонентов на HAP позволяет получать конъюгаты высокой степени гомогенности (до 98.1%). Выход конъюгата по белку в реакции синтеза на твердой фазе составлял около 95%. Исследование специфической активности GM-CSF в составе конъюгатов подтвердило сохранность биологических свойств белка. Результаты исследования показали, что конъюгаты GM-CSF с ALN, полученные с помощью EDC и декстрана, обладают большим сродством к HAP – аналогу минерального матрикса кости, чем исходный белок. Полученные данные демонстрируют возможность создания препаратов на основе GM-CSF с повышенной тропностью к клеткам-мишеням кроветворной ткани, расположенной в костном мозге, что позволит снизить вводимые дозы препарата и его побочные эффекты.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали реактивы фирм “AppliChem” (Германия), “Sigma-Aldrich” (США), “Bio-Rad” (США), “Sample” (Япония), “Gerbu” (Германия). Для отработки методов синтеза использовали препарат рекомбинантного GM-CSF человека (субстанция) с концентрацией белка 1.15 мг/мл и удельной специфической активностью 0.28 нг/мл производства ИМБТ ФБУН ГНЦ ВБ “Вектор” [19].
Процесс получения конъюгатов проводили с помощью ковалентного присоединения алендроновой кислоты к молекуле GM-CSF двумя способами: через карбоксильную группу белка с использованием EDC и через аминогруппу белка с помощью реакции Малапрада с использованием в качестве сшивающего агента молекулы декстрана.
Синтез конъюгата аминобифосфоната с GM-CSF через карбоксильную группу белка с использованием EDC. Для проведения синтеза брали эквомольные количества субстанции GM-CSF, растворов EDC и ALN. Полученные конъюгаты диализовали против физиологического раствора, стерильно разливали и замораживали при минус 20°С.
Синтез конъюгата аминобифосфоната с GM-CSF через аминогруппу белка с помощью реакции Малапрада. Для проведения синтеза декстран (40 кДа) активировали периодатом натрия в соотношении 1 : 40 (моль/моль) и отделяли на колонке с сефадексом G-25, используя для гель-фильтрации 25 мМ натрий карбонатный буфер, рН 8.3. К активированному декстрану добавляли субстанцию белка GM-CSF и ALN в эквимолярных количествах. Реакцию проводили 3 ч при 22–24°С. Затем полученный конъюгат отделяли гель-фильтрацией на колонке с сефадексом G-25 в изотоническом растворе.
Синтез конъюгатов на твердой фазе
В качестве твердой фазы для конъюгирования использовали колонку с HAP. Компоненты реакционной смеси наносили на колонку последовательно. Элюцию конъюгатов проводили 0.2 М калий-фосфатным буфером, рН 7.0. Полученный раствор конъюгата стерильно разливали и замораживали при минус 20°С.
Для оценки гомогенности и молекулярной массы белковых компонентов конъюгатов GM-CSF с ALN использовали метод вертикального гель-электрофореза в 15% полиакриламидном геле в денатурирующих условиях с последующим окрашиванием красителем Кумасси R-250 [15]. Результаты электрофореза анализировали с помощью компьютерной программы GelPro 3.2.
Биологическую активность GM-CSF в конъюгатах оценивали in vitro по уровню стимуляции пролиферации цитокин-зависимых клеток эритролейкоза человека TF-1. Данный тест основан на способности клеток линии TF-1 пролиферировать в присутствии GM-CSF. Пролиферативную активность оценивали микрометодом на 96-луночных культуральных планшетах с использованием реагента XTT (2,3-бис-(2-метокси-4-нитро-5-сульфо-фенил)-2H-тетразолий-5-карбоксанилид). Метод основан на способности митохондриальных дегидрогеназ конвертировать водорастворимый ХТТ в формазан, который кристаллизуется внутри клетки. Перевод формазана в раствор с помощью феназин-метасульфата (PMS) и последующая фотометрия позволяют точно соотнести изменение оптической плотности раствора с изменением количества жизнеспособных клеток. Для калибровки активности GM-CSF в исследуемых субстанциях использовали очищенный и охарактеризованный препарат рекомбинантного GM-CSF, полученный в клетках E. coli [20, 21]. Для проведения эксперимента в среде RPMI (Invitrogen) с добавлением 10% эмбриональной телячьей сыворотки готовили 2-кратные разведения исследуемого и контрольного препаратов (калибровка) в диапазоне 8.0–0.25 нг/мл. В качестве контроля использовали среду RPMI (Invitrogen) с добавлением 10% эмбриональной телячьей сыворотки (HyClone). В лунки 96-ти луночного планшета вносили 50 мкл вышеуказанных разведений или контрольных образцов и добавляли 50 мкл суспензии клеток TF-1 в среде RPMI с добавлением 10% эмбриональной телячьей сыворотки по 104 клеток/лунка. Планшеты помещали в термостат при температуре 37°С, 5% СО2, влажности 85% и инкубировали 72 часа. После инкубации в каждую тестируемую лунку добавляли 50 мкл реагента ХТТ (Sigma) и PMS (Fluka), который получали добавлением к рабочему раствору с содержанием XTT 1 мг/мл раствора PMS 1.25 мМ из расчета: на каждый мл ХТТ – 20 мкл PMS. Планшет инкубировали еще 4 часа и определяли оптическую плотность ОП490/620 на планшетном спектрофотометре SpectraCount (Packard). Каждую точку делали в пяти повторностях, определяли среднее значение и дисперсию для различных концентраций GM-CSF, строили гистограмму зависимости ОП от разведений и концентрации. Стимуляцию пролиферации TF-1 клеток рассчитывали в процентах по отношению к контролю. За 100% принимали количество живых клеток в отрицательном контроле. Все расчеты проводили с использованием программного обеспечения LabView.
Накопление конъюгатов GM-CSF и ALN на модели костного матрикса (HAP) в условиях in vitro проводили методом хроматографии на HAP, как описано в [22]. Десорбцию проводили линейным градиентом соли 0.01–0.2 М калий фосфатный буфер, рН 7.0.
Список литературы
Steward W.P., Scarffe J.H., Austin R., Bonnem E., Thatcher N., Morgenstern G., Crowther D. // Br. J. Cancer. 1989. V. 59. № 1. P. 142–145.
Kamada H., Tsutsumi Y., Yamamoto Y., Kihira T., Kaneda Y., Mu Y., Tsunoda S., Nakagawa S., Mayumi T. // Cancer Res. 2000. V. 60. № 22. P. 6416–6420.
Li Y.P., Pei Y.Y., Zhang X.Y., Gu Z.H., Zhou Z.H., Yuan W.F., Zhou J.J., Zhu J.H., Gao X.J. // J. Control. Release. 2001. V. 71. № 2. P. 203–211.
Шмелев В.А. // Интерферон-гамма, фактор некроза опухолей, тимозин-альфа1 – противоинфекц. и противоопух. цитокины и препар. Медпрактика-М, 2008.
Caraglia M., Marra M., Naviglio S., Botti G., Addeo R., Abbruzzese A. // Expert Opin. Pharmacother. 2010. V. 11. № 1. P. 141–154.
Herczegh P., Buxton T.B., McPherson J.C., Kovács-Kulyassa Á., Brewer P.D., Sztaricskai F., Stroebel G.G., Plowman K., Farcasiu D., Hartmann J.F. // J. Med. Chem. 2002. V. 45. № 11. P. 2338–2341.
Doschak M.R., Kucharski C.M., Wright J.E., Zernicke R.F., Uludag H. // Mol. Pharm. 2009. V. 6. № 2. P. 634–640.
Hirabayashi H., Takahashi T., Fujisaki J., Masunaga T., Sato S., Hiroi J., Tokunaga Y., Kimura S., Hata T. // J. Control. Release. 2001. V. 70. № 1–2. P. 183–191.
Ora M., Lonnberg T., Florea-Wang D., Zinnen S., Karpeisky A., Lonnberg H. // J. Org. Chem. 2008. V. 73. № 11. P. 4123–4130.
Giger E.V., Puigmartí-Luis J., Schlatter R., Castagner B., Dittrich P.S., Leroux J.C. // J. Control. Release. 2011. V. 150. № 1. P. 87–93.
Yewle J.N., Puleo D.A., Bachas L.G. // Biomaterials. 2013. V. 34. № 12. P. 3141–3149.
Cheng T.L., Wang Y.U. // J. Colloid Interface Sci. 2013. V. 402. P. 267–278.
Даниленко Е.Д., Белкина А.О. // Биофарм. Ж. 2014. Т. 6. № 6. С. 44–53.
Волосникова Е.А., Демин И.Ф., Левагина Г.М., Лебедев Л.Р., Закабунин А.И., Даниленко Е.Д. // Биоорг. химия. 2016. Т. 42. № 6. С. 704–711. [Volosnikova E.A., Demin I.F., Levagina G.M., Lebedev L.R., Zakabunin A.I., Danilenko E.D. // Russ. J. Bioorg. Chem. 2016. V. 42. № 6. P. 638–645.]
Laemmli U.K. // Nature. 1970. V. 227. P. 680–685.
Мамаева С.А., Круппа И.С., Дятлов В.А., Кутергина И.Ю., Рустамов И.Р., Гумникова, В.И. // Успехи в химии и хим. технологии. 2014. Т. 28. № 3. С. 45–48.
Закабунин А.И., Даниленко Е.Д., Волосникова Е.А., Левагина Г.М., Демин И.Ф. // Патент РФ 2609871, заявл. 10.08.1994, опубл. 06.02.2017. Бюл. № 4.
Кирилова И.А., Садовой М.А., Подорожная В.Т. // Хирургия позвон. 2012. № 3. С. 72–83.
Есина Т.И., Лебедев Л.Р., Волосникова Е.А., Гилева И.П., Гогина Я.С., Терещенко, Т.А., Кочнева Г.В., Гражданцева А.А., Даниленко Е.Д. // Биотехнология. 2019. Т. 35. № 3. С. 68–73.
Гилева И.П., Бондарь Т.С., Коробко В.Г., Кравченко В.В., Сандахчиев Л.С // Патент РФ 2091488, заявл. 16.03.1994, опубл. 27.09.1997. Бюл. № 27.
Топоркова Л.Б., Орловская И.А., Сенников С.В., Сахно Л.В., Козлова Ю.Н., Лебедев Л.Р., Гилева И.П. // Иммунология. 2009. № 4. С. 203–206.
Скоупс Р. // Методы очистки белков. М.: Мир, 1985.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


