Биоорганическая химия, 2020, T. 46, № 3, стр. 247-260
Теоретические и прикладные аспекты эстеразной активности альбумина
Д. А. Белинская 1, Н. В. Гончаров 1, 2
1 ФГБУН Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
194223 Санкт-Петербург, проспект Тореза, 44, Россия
2 ФГУП “НИИ гигиены, профпатологии и экологии человека” ФМБА России
188663 Ленинградская обл., г.п. Кузьмоловский, ст. Капитолово, корп. 93, Россия
Поступила в редакцию 23.09.2019
После доработки 05.12.2019
Принята к публикации 12.12.2019
Аннотация
Молекула альбумина, в отличие от многих других плазменных белков, практически не гликозилирована, и может связывать и транспортировать различные лиганды эндогенного и экзогенного происхождения. Накапливаются данные о ферментативной активности альбумина: псевдоэстеразной (необратимое связывание субстрата с белком) и истинно эстеразной (связывание субстрата с активным центром белка с последующим распадом комплекса на фермент и продукт). В токсикологии наибольший интерес представляет проблема (псевдо)эстеразной активности альбумина по отношению к фосфорорганическим соединениям (ФОС) – эфирам фосфорной или фосфоновой кислот. В представленном обзоре собраны литературные данные и результаты наших собственных исследований, посвященных эстеразной активности белка. Рассмотрена возможность направленного воздействия на альбумин с помощью молекул, способных влиять на его связывающую и эстеразную активность. Обсуждаются перспективы практического применения некоторых методов воздействия на альбумин в токсикологии.
ВВЕДЕНИЕ
Альбумин – это главный белок крови млекопитающих, где его концентрация составляет 500–700 мкМ. Первые публикации, посвященные исследованию сывороточного альбумина, датируются концом XIX века [1]. К середине XX века ежегодно публиковали десятки работ, в 1960-х – сотни, а в 1970-х их счет перевалил за тысячу. Лигандами альбумина являются различные молекулы и ионы: вода, катионы металлов, жирорастворимые гормоны, свободные жирные кислоты, трансферрин, неконъюгированный билирубин, окись азота, аспирин и другие лекарственные средства, токсины [2]. Выявлены два первичных сайта взаимодействия альбумина с лигандами (Садлоу I и Садлоу II) [3], а также несколько вторичных сайтов. Накапливаются данные о ферментативной активности альбумина: псевдоэстеразной (необратимое связывание субстрата с белком) и истинно эстеразной (связывание субстрата с активным центром белка с последующим распадом комплекса на фермент и продукт) [4]. Установлена гидролитическая активность альбумина и по отношению к некоторым фосфорорганическим соединениям (ФОС) [5–8]. Способность альбумина взаимодействовать с отравляющими веществами, учитывая его количества в крови и в организме в целом, дают основания полагать, что связывающие и каталитические свойства белка по отношению к ФОС следует учитывать в клинической токсикологии при разработке адъювантной терапии отравлений и предупреждении их последствий.
В представленном обзоре собраны литературные данные и результаты наших собственных исследований, посвященных изучению эстеразной активности альбумина. Особое внимание уделено межвидовым различиям, а именно сравнительному анализу свойств сывороточных альбуминов человека (ЧСА), быка (БСА) и крысы (КСА). Для биохимических экспериментов часто используют недорогой бычий альбумин, тогда как доклинические токсикологические тестирования проводят, как правило, на грызунах [9], так что для решения задач трансляционной медицины и правильной экстраполяции полученных данных на человеческий организм необходимо знать обо всех структурных и функциональных особенностях альбуминов разных видов. Отдельно рассмотрена возможность направленного воздействия на альбумин с помощью молекул, способных влиять на связывающую и каталитическую активность белка по отношению к ФОС. Обсуждаются перспективы практического применения в токсикологии некоторых методов воздействия на альбумин.
СТРУКТУРНЫЕ ОСОБЕННОСТИ АЛЬБУМИНА
Молекула сывороточного альбумина образована одной полипептидной цепью, состоящей из 585, 584 и 583 аминокислотных остатков для альбумина человека, крысы и быка, соответственно [10]. Выравнивание первичных последовательностей аминокислотных остатков молекул ЧСA, КСA и БСA показало, что наибольшей идентичностью обладают молекулы ЧСA и БСA – 75.6%. Процент идентичности первичной структуры у молекул ЧСA и КСA составляет 73.0%, а у БСA и КСA – 69.9%. Структура альбумина консервативна для всех млекопитающих: молекула состоит из трех гомологичных доменов, каждый из которых состоит из десяти спиралей и может быть разделен на два субдомена, A и В, содержащих шесть и четыре спиралей, соответственно; эти два субдомена соединены длинной петлей. Трехмерная структура ЧСА была исследована с высоким разрешением довольно поздно, лишь в 1990х [11]. Аналогичная структура БСA получена в 2012 г. [12], а трехмерная структура КСA не получена до сих пор. При отсутствии данных рентгеноструктурного анализа (РСА), трехмерная структура белка может быть сконструирована с помощью гомологичного моделирования – построения 3d-модели белка по его первичной последовательности и известным трехмерным структурам гомологичных белков [13]. Впервые этим методом нами была построена трехмерная модель КСА [14].
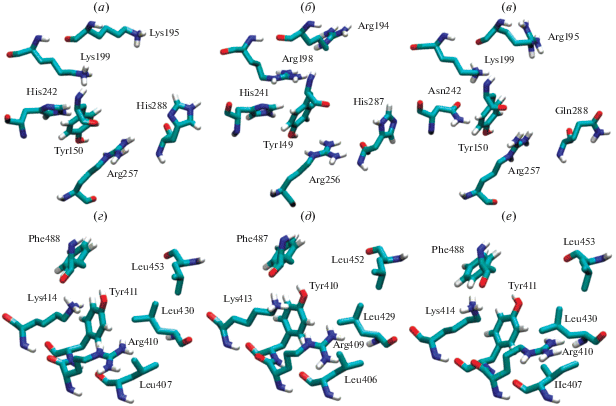
На рис. 1 приведены трехмерные структуры сайтов Садлоу I и II ЧСА, БСА и КСА. Видно, что сайт Садлоу II высоко консервативен, лишь в последовательности КСА присутствует одна гомологичная замена лейцина на изолейцин в позиции 407. Однако для сайта Садлоу I консервативность не характерна. Так, Lys195 и Lys199, входящие в структуру ЧСА, в молекуле БСА заменены на более разветвленные аргинины Arg194 и Arg198. В КСА Lys195 также заменен на аргинин. Гистидины His242(241) и His288(287) в первичной последовательности ЧСА и БСА заменены на Asn242 и Gln288 в структуре КСА. Следует ожидать, что межвидовые различия связывающих и каталитических свойств альбумина будут проявляться в характеристиках Садлоу I.
СВЯЗЫВАЮЩАЯ И ЭСТЕРАЗНАЯ АКТИВНОСТЬ АЛЬБУМИНА ПО ОТНОШЕНИЮ К ФОС
C альбумином способны связываться практически все известные лекарственные препараты и токсические вещества [15, 16]. Альбумин в значительной степени определяет их фармако- и токсикокинетику, транспортируя к тканям-мишеням или местам их биотрансформации. При разработке новых лекарств проверка их связывания с альбумином является стандартной процедурой [17–19]. Однако альбумин является не только пассивным, но и активным участником фармако- или токсикокинетических процессов. Можно выделить две группы ферментативных активностей альбумина, с которыми связано наибольшее количество исследований на протяжении десятков лет [4]. Первая группа – это карбоксилэстераза (КФ 3.1.1.1), арилэстераза (КФ 3.1.1.2), арилациламидаза (КФ 3.5.1.13). Вторая группа характеризует фосфатазную активность: это фосфомоноэстераза (КФ 3.1.3…?), РНК-гидролаза или фосфодиэстераза (КФ 3.1.4.16), фосфотриэстераза (КФ 3.1.8.1 и 3.1.8.2). К подподклассу 3.1.8 (гидролазы триэфиров фосфорной кислоты) относятся арилдиалкилфосфатаза (КФ 3.1.8.1) и диизопропилфторфосфатаза (КФ 3.1.8.2). Арилдиалкилфосфатаза более известна под названием параоксоназа, среди других названий – А-эстераза, арилтрифосфатаза, эстераза В1, эстераза Е4, пиримифос-метилоксонэстераза, параоксон-гидролаза, арилтрифосфат-диалкилфосфогидролаза. Гидролизует эфиры трехосновной фосфорной, двухосновной фосфоновой и одноосновной фосфиновой кислот. В многочисленных экспериментах была показана истинно- или псевдоэстеразная активность альбумина по отношению к α-нафтилацетату и n-нитрофенилацетату (НФА), эфирам жирных кислот, аспирину, глюкурониду кетопрофена, циклофосфамиду, эфирам никотиновой кислоты, октаноилгрелину, нитроацетанилиду, нитротрифторацетанилиду.
Первая публикация, в которой было обосновано существование в молекуле альбумина по меньшей мере двух разных центров (сайтов), отвечающих за два вида активности, – истинно- и псевдоэстеразную, – появилась в 1972 г. [20]. Взаимодействие альбумина с НФА имеет двухфазный характер: в течение первых минут наблюдается “всплеск” активности, т.е. происходит быстрое образование продукта, после чего система переходит в стационарный режим, но не выходит на плато. Первую фазу обеспечивают два процесса в двух разных сайтах: моноацетилирование альбумина в результате псевдоэстеразной активности одного сайта и альбумин-катализируемый “истинный” гидролиз во втором сайте. Вторая стадия обусловлена активностью только второго сайта. В токсикологии наибольший интерес представляет проблема (псевдо)эстеразной активности альбумина по отношению к ФОС – эфирам фосфорной или фосфоновой кислот. В разные годы показана эстеразная [6, 7, 21] и псевдоэстеразная [5, 22] активность альбумина по отношению к ФОС. Авторы работы [7] по нарастанию продуктов в ходе реакций гидролитического расщепления ФОС и карбарила альбумином рассчитали кинетические константы (табл. 1) и установили, что альбумин играет важную роль в детоксикации параоксона и карбарила и в меньшей степени в детоксикации хлорпирифосоксона. В других работах также получены константы взаимодействия альбумина с ФОС. Так, значение кажущейся константы Михаэлиса Km реакции гидролиза хлорпирифосоксона БСА составляет 0.41 мМ, а параоксона – 1.85 мМ [23]. Значения констант гидролиза диизопропилфторфосфата альбумином человека составляют: кажущаяся константа диссоциации Ks – 3.6 мМ, константа скорости k2 – 0.0045 с–1 [24].
Таблица 1.
Характеристики ферментативного гидролиза ФОС и карбаматов альбумином [7]
| Фермент | Субстрат | kcat (мин–1) | Km (мкМ) | Каталитическая эффективность kcat/Km (M–1 мин–1) |
|---|---|---|---|---|
| ЧСА | Параоксон | 1.5 × 10–3 | 377 | 3.9 |
| ЧСА | Хлорпирифосоксон | 4.0 × 10–2 | 2640 | 15 |
| БСА | Карбарил | 9.9 × 10–3 | 380 | 26 |
Следует отметить, что основными ферментами, участвующими в детоксикации ФОС и карбаматов, являются фосфотриэстеразы, к которым относится параоксоназа-1 (PON-1), а также карбоксилэстеразы (КЭ). В отличие от грызунов, в крови человека содержание КЭ крайне мало, и, по всей видимости, функции этого фермента в значительной степени выполняет альбумин. По этим причинам НФА (классический субстрат для изучения КЭ), и параоксон (субстрат PON-1) широко применяются для изучения эстеразной активности альбумина. Еще одним важным преимуществом данных соединений является тот факт, что продукт их гидролиза нитрофенол имеет желтую окраску с пиком поглощения при длине волны 400–412 нм и может быть детектирован спектрофотометрическими методами.
Одна из главных причин медленного гидролиза альбумином НФА и других эфиров – отсутствие каталитической триады и оксианионного центра, однако в ряде работ подчеркивается важная роль гуанидинового остатка соседнего Arg410 для псевдоэстеразной активности альбумина в сайте Tyr411. Полагают, что Arg410 выполняет роль оксианионного центра, образуя водородную связь с карбонильной группой субстрата [25], тогда как при связывании, например, негидролизуемого диазепама Arg410 особой роли не играет [26]. Кроме того, для эстеразной активности альбумина (по крайней мере, по отношению к такому эфиру как п-нитрофенил 4-гуанидинобензоат) необходим остаток гистидина [27], т.к. рН-профиль константы скорости k2 показал наличие двух ионизируемых каталитических групп в молекуле альбумина с рКа около 6 и 10, что свидетельствует об ионизации имидазольного остатка гистидина и гидроксильной группы тирозина соответственно. Имидазольная группа гистидина функционирует при гидролизе как общеосновной катализатор. Возможно, что для гидролиза альбумином некоторых субстратов необходима каталитическая “диада” His-Tyr или Lys-Tyr, в которой гистидин или лизин выполняют роль кислотного остатка; такие случаи описаны в литературе, с тем отличием, что два разных гистидина выполняют функции кислотного и основного остатков [28]. С учетом анализа этих и других литературных данных мы предположили, что из двух главных сайтов, взаимодействующих с НФА и ФОС, сайт Садлоу I с Tyr150 проявляет истинно эстеразную активность, а сайт Садлоу II с Tyr411 – псевдоэстеразную. Для проверки предположения были проведены эксперименты in vitro и in silico [8, 29–33].
Детали механизма псевдо(эстеразной) активности альбумина подробно описаны в нашем предыдущем обзоре [4]. В той же работе рассмотрены кинетические схемы взаимодействия альбумина с различными субстратами. В наших последующих биохимических исследованиях [8, 33] для количественной оценки кинетических параметров гидролиза НФА и параоксона альбумином мы прежде всего принимали во внимание модель, предложенную Ascenzi и Fasano [34], но также ацилферментативную модель расщепления НФА химотрипсином, предложенную Бендером и соавторами [35], модель гидролиза НФА липазой [36], модель ингибирования холинэстераз фосфорорганическими соединениями [37]. На первом этапе взаимодействия альбумина с субстратом (схема 1) происходит его адсорбция в сайте Садлоу II (ES), быстрое высвобождение продукта п-нитрофенола (P1), отмечаемое как “всплеск” активности, и ацетилирование тирозина Tyr411 (EA). На втором этапе субстрат связывается с альбумином в сайте Садлоу I, где происходит его гидролиз до ацетата (P2) и п-нитрофенола (P1). Важной особенностью схемы для интерпретации полученных нами данных является то, что она может и даже должна быть применима для описания взаимодействия субстрата не только с одним сайтом альбумина, и не только с каждым из двух (или более) сайтов в отдельности, но также с молекулой альбумина, в состав которой входит как минимум два сайта связывания и (псевдо)эстеразной активности.
ОПРЕДЕЛЕНИЕ КОНСТАНТ СВЯЗЫВАЮЩЕЙ И ЭСТЕРАЗНОЙ АКТИВНОСТИ АЛЬБУМИНА
Задачу определения кинетических констант ферментативных реакций можно разбить на два этапа. Первый этап – построение зависимости концентраций продукта и/или субстрата от времени, так называемой концентрационной кривой. Существует целый ряд походов для этой цели: спектрофотометрия в видимой и ультрафиолетовой областях, спектрофлуориметрические, люминесцентные, спектроскопические и радиоизотопные методы [38]. Каждый из подходов имеет свои достоинства и ограничения, свою точность и чувствительность к примесям и выбирается исходя из объектов исследования. Отдельной группой стоят подходы для анализа активности ферментов с высоким числом оборотов, для которых длительность предстационарного состояния составляет миллисекунды: методы остановленной струи, температурного скачка и др. Однако такой “медленный” фермент как альбумин не требует специальных манипуляций для замедления или остановки реакции.
Второй этап – применение математических моделей для вычисления кинетических констант из концентрационных кривых. Классическая кинетика Михаэлиса-Ментен и Бриггса-Холдейна [39, 40] не является универсальной, поскольку имеет ряд допущений: 1) избыток свободного субстрата, 2) стационарность (d[ES]/dt = 0), и 3) быстрое установление равновесия между ферментом и субстратом, что возможно при kcat$ \ll $ k–1 и kcat ≤ k+1, т.е. когда значения Km и Ks практически совпадают. Ситуации, когда kcat$ \gg $ k–1 и/или k+1, или когда мы не знаем a priori сколько свободного субстрата имеется в стационарном состоянии, означают серьезное отклонение от классической кинетики и требуют применения других моделей, например, ван Слайка-Каллена или Моррисона [41–43]. Совершенствование математического описания ферментативных реакций продолжается и в новейшее время [44–46].
Что касается альбумина, спектрометрические методы, основанные на мониторинге высвобождаемого продукта гидролиза, хорошо зарекомендовали себя в экспериментах, направленных на измерение кинетических констант ферментативной активности этого белка [47, 48]. В наших экспериментах активность альбумина относительно НФА и параоксона определяли по накоплению нитрофенола, образующегося в результате гидролиза этих субстратов (продукт P1 на схеме 1) [8]. Нитрофенол является продуктом псевдоэстеразной реакции в сайте Садлоу II и одним из продуктов эстеразной реакции в сайте Садлоу I. Для вычисления констант из полученных концентрационных кривых мы применяли следующий подход. Согласно используемой нами модели (схема 1), процесс выхода нитрофенола включает 2 этапа: предстационарное состояние (фаза “всплеска”, кинетика Садлоу II) и стационарное состояние (кинетика Садлоу I).
Схема 1. Взаимодействие между альбумином и субстратом (п-нитрофенилацетатом и параоксоном). S – субстрат, P1 – п-нитрофенол, P2 – ацильная или диэтилфосфатная группа.
Амплитуду фазы “всплеска” обозначим α. Константу скорости обозначим kobs. Выход продукта представляет собой реакцию (псевдо)первого порядка в течение почти 95% времени фазы “всплеска”. Константа скорости деацетилирования сайта Садлоу II k3 на два порядка ниже скорости ацетилирования тирозина, полученной даже на самых низких концентрациях субстрата.
Использованные нами аппроксимирующие функции имеют вид:
(1)
$\left[ {{{P}_{1}}} \right] = \alpha \left[ {{{E}_{0}}} \right]\left( {1 - {{e}^{{ - {{k}_{{{\text{obs}}}}}t}}}} \right),$(2)
$\alpha = {{\left[ {\frac{{{{k}_{2}}\left[ S \right]}}{{\left( {{{k}_{2}} + {{k}_{2}}} \right)\left( {{{k}_{m}} + \left[ S \right]} \right)}}} \right]}^{2}},$(3)
${{k}_{{{\text{obs}}}}} = \left( {\frac{{{{k}_{2}}\left[ S \right]}}{{{{K}_{s}} + \left[ S \right]}}} \right) + {{k}_{2}}.$Преобразуем уравнение (3) по методу двойных обратных величин. Скорость деацетилирования сайта Садлоу II очень низка, поэтому константой k3 можно пренебречь:
(4)
$\frac{1}{{{{k}_{{{\text{obs}}}}}}} = \frac{1}{{{{k}_{2}}}} + \frac{{{{K}_{s}}}}{{{{k}_{2}}}}\frac{1}{{\left[ {{{S}_{0}}} \right]}}.$Стационарное состояние описывается следующим уравнением:
Уравнения (4) и (5) имеют форму y = b + ax и могут быть использованы для линейного регрессионного анализа. Определив наклон прямой и ее пересечение с осью ординат, мы найдем k2, k3, Ks и $K_{m}^{{{\text{app}}}}.$
Отделить кинетику сайта Садлоу I от кинетики сайта Садлоу II и дополнить набор констант возможно, если наблюдать выход продукта эстеразной реакции в сайте Садлоу I (P2 на схеме 1). В случае гидролиза НФА – это ацетат, определить который с помощью спектрофотомерии невозможно. Одним из возможных способов детекции ацетата может стать метод ядерного магнитного резонанса (ЯМР). В литературе не описано применение ЯМР-спектроскопии для изучения ферментативной активности альбумина, и без сомнения такого рода эксперимент мог бы открыть его новые функциональные особенности.
Широкое применение для изучения взаимодействия белков с лигандами получили методы молекулярного моделирования, в первую очередь методы молекулярного докинга и классической молекулярной динамики, а также методы оценки свободной энергии образования белок-лигандных комплексов из траекторий молекулярной динамики [49]. Молекулярный докинг представляет собой так называемую “стыковку” молекулы лиганда в центре связывания белка [50]. С помощью компьютерной программы молекула лиганда виртуально помещается в центр связывания мишени, затем перебором конформаций лиганда и аминокислот сайта связывания ищется наиболее энергетически выгодное их взаимное расположение. Ранжирование конформаций лиганда в сайте связывания производится с помощью оценочной функции (ОФ). Основные проблемы поиска оптимальных конфигураций заключаются в следующем: 1) вычисления по всему конфигурационному пространству требуют много времени и существующие алгоритмы конформационного поиска не могут проверить все возможные конформации; 2) современные оценочные функции не могут с высокой точностью учесть все нюансы взаимодействия между белком и лигандом (влияние растворителя, энтропийный компонент). Поэтому результатом запуска процедуры докинга обычно является набор возможных конформаций, из которых на основе известных экспериментальных данных выбирается наиболее вероятная [51, 52].
Энергетическая характеристика белок-лигандного комплекса, полученного методом докинга, в идеале характеризует сродство лиганда к белку, то есть, по сути – константу диссоциации Ks = k–1/k1 (схема 1), пусть и не в абсолютном значении, а при сравнении разных лигандов. Но, во-первых, как было отмечено выше, докинг определяет лишь положение молекулы лиганда непосредственно в сайте связывания белка, не давая возможности проследить предшествующие стадии взаимодействия (связывание лиганда в периферических сайтах, конформационные изменения в молекуле белка в процессе “прохождения” лиганда к сайту связывания, движение молекул воды). Особенно это важно для сайта Садлоу I альбумина, в большой полости которого имеются две полярные микроструктуры из соответствующих аминокислот (в Садлоу II лишь одна подобная микроструктура), но что особенно важно – молекулы воды, которых нет в полости Садлоу II, которые довольно жестко структурированы под влиянием полярных микроструктур, и которые не учитывает метод молекулярного докинга. Во-вторых, из множества решений молекулярного докинга для анализа обычно выбирается конформация комплекса, которая соответствует геометрическим критериям продуктивной конформации: положение субстрата должно быть таким, чтобы могла состояться ферментативная реакция (в случае альбумина – нуклеофильная атака каталитического тирозина на карбонильный атом углерода НФА или атом фосфора параоксона). Не обязательно продуктивный фермент-субстратный комплекс является единственным решением и не всегда ранжируется как самый энергетически выгодный. По этой причине, мы полагаем, что в случае альбумина энергетические характеристики продуктивного фермент-субстратного комплекса, полученного методом молекулярного докинга, скорее характеризуют скорость ацетилирования белка: константа k2 из схемы 1.
Метод молекулярной динамики позволяет проследить конформационные изменения макромолекул во времени с помощью интегрирования уравнений движения атомов [53]. Период времени, в течение которого наблюдается поведение системы, называется длиной траектории или длиной симуляции. Метод MM-PBSA (molecular mechanics/Poisson–Boltzmann surface area), сочетающий использование молекулярной механики и решение уравнения Пуассона-Больцмана [49] позволяет оценить свободную энергию образования комплекса белок-лиганд ΔG из траекторий молекулярной динамики. В этом подходе учитывается энергия сольватации, а в некоторых программах оценивается и энтропийная составляющая. Более того, обычно значение свободной энергии рассчитывается во многих точках траектории, то есть для ряда возможных конформаций лиганда внутри сайта связывания, итоговое значение рассчитывается как среднее ± стандартное среднее отклонение [54]. Полученное этим методом значение свободной энергии образования комплекса с лучшим приближением (по сравнению с докингом) характеризует аффинность сайта к лиганду, и его можно сопоставить с константой диссоциации Ks.
Таким образом, совместно применяемые расчетные и экспериментальные методики, дополняя и уточняя друг друга, могут дать полное представление о взаимодействии биологических молекул.
МЕЖВИДОВЫЕ РАЗЛИЧИЯ В ЭСТЕРАЗНОЙ И СВЯЗЫВАЮЩЕЙ АКТИВНОСТИ АЛЬБУМИНА
Ранее мы исследовали возможные сайты эстеразной активности альбумина человека по отношению к зоману [30]. Проанализировав окружение всех возможных каталитических аминокислот (все серины, тирозины и треонины), для дальнейшего исследования были отобраны те аминокислоты, в окружении которых присутствовали возможные акцепторы протонов. Молекулярный докинг показал, что, помимо уже известного сайта псевдоэстеразного гидролиза зомана Садлоу II с каталитическим тирозином Tyr411 [5], зоман может продуктивно связываться только возле аминокислот Tyr150 (сайт Садлоу I) и Ser193. В окружении Tyr150 присутствует аминокислотный остаток гистидина His242, а в окружении Ser193 – гистидин His146. Логично было предположить, что эти сайты могут быть ответственными за эстеразную активность альбумина по отношению к зоману.
Однако при анализе новых литературных и собственных данных возникли новые вопросы. Как было отмечено, сайт Садлоу II высоко консервативен: диада Tyr411-Arg410 присутствует в альбуминах всех млекопитающих. Что касается аминокислот Tyr150, Ser193 и их окружения – такой консервативности не наблюдается. Так, His242(241), содержащийся в структуре ЧСА и БСА, заменен на Asn242 в структуре КСА. Ser193 присутствует в ЧСА и БСА, но в КСА заменен на остаток аланина. Lys199 в сайте Садлоу I человека отвечает за гидролиз аспирина [55], но в структуре БСА вместо лизина находится аргинин. Значит ли это, что эффективность (псевдо)эстеразной активности альбуминов разных видов будет различна?
Не так много исследований посвящено сравнительному анализу связывающей и ферментативной активности альбуминов разных видов, а в этих редких работах обычно проводится сравнение лишь двух видов белка. Для пары ЧСА-БСА накоплены данные о том, что эффективность взаимодействия различных ксенобиотиков различается для этих двух белков. Так, сравнительный анализ показал, что ЧСА эффективнее связывает капрофен и 2-антроцен-карбоксильную кислоту [56]. В работе [57] показано, что декстран голубой связывается только с ЧСА и не взаимодействует с БСА. Авторы другой работы [58] показали, что варфарин с большей эффективностью взаимодействует с БСА, чем с ЧСА, а его структурный аналог аценокумарол, содержащий дополнительную NO2 группу, наоборот, эффективнее связывается с ЧСА. Полифенолы куркумин и диацетилкуркумин намного эффективнее взаимодействуют с БСА, чем с ЧСА [59]. Выявлено, что пиридоксальфосфат связывается в 10 раз менее эффективно с БСА, чем с ЧСА [60], а метил-паратион при комнатной температуре в полтора раза лучше взаимодействует с ЧСА, чем с БСА [61]. В некоторых исследованиях показано, что ЧСА и КСА имеют схожие характеристики связывания биологически активных веществ [62]. Согласно другим данным, эффективность взаимодействия некоторых ксенобиотиков различается для ЧСА и КСА [63, 64].
Таким образом, согласно анализу литературных данных, по результатам исследования функциональных характеристик альбумина одного вида животных нельзя a priori утверждать, что альбумин другого вида будет обладать такими же характеристиками. В нашем недавнем исследовании мы изучили эстеразную и параоксоназную активность сывороточного альбумина человека, быка и крысы [8]. Для этого биохимическими методами были получены кинетические и равновесные характеристики взаимодействия ЧСА, БСА и КСА с двумя субстратами — НФА и параоксоном. Результаты сравнительного биохимического анализа представлены в табл. 2 и 3.
Таблица 2.
Кинетические характеристики карбоксилэстеразной активности разных видов альбумина [8]
| ЧСА | БСА | КСА | |
|---|---|---|---|
| Садлоу II Предстационарный режим |
|||
| k2 (с–1) | 0.48 ± 0.1 | 0.48 ± 0.01 | 0.47 ± 0.01 |
| Ks = k–1/k1 (мкМ) | 5.92 ± 0.99 | 2.77 ± 1.1 | 6.28 ± 0.67 |
| k2/Ks (мM–1 c–1) | 81.1 ± 7.7 | 173.3 ± 21.1 | 74.8 ± 4.45 |
| Садлоу I Стационарный режим |
|||
| k3 (с–1) | 0.020 ± 0.001 | 0.020 ± 0.003 | 0.019 ± 0.003 |
| $K_{m}^{{{\text{app}}}}$ (мкМ) | 761.9 ± 50.5 | 2208.3 ± 73.8 | 396.7 ± 95.1 |
| ${{{{k}_{3}}} \mathord{\left/ {\vphantom {{{{k}_{3}}} {K_{m}^{{{\text{app}}}}}}} \right. \kern-0em} {K_{m}^{{{\text{app}}}}}}$ (мM–1 c–1) | 0.026 ± 0.001 | 0.009 ± 0.001 | 0.051 ± 0.008 |
Таблица 3.
Кинетические характеристики параоксоназной активности разных видов альбумина в отношении параоксона [8]
| ЧСА | БСА | КСА | |
|---|---|---|---|
| Садлоу II Предстационарный режим |
|||
| k2 (с–1) | 0.43 ± 0.01 | 0.49 ± 0.02 | 0.48 ± 0.01 |
| Ks = k–1/k1 (мкМ) | 3.99 ± 1.7 | 0.86 ± 0.1 | 2.41 ± 0.8 |
| k2/Ks (мM–1 c–1) | 0.15 ± 0.06 | 0.58 ± 0.06 | 0.23 ± 0.08 |
| k3 (×10–6 с–1) | 0.82 ± 0.15 | 0.75 ± 0.21 | 0.50 ± 0.25 |
| Садлоу I Стационарный режим |
|||
| k3 (с–1) | 0.00032 ± 0.00001 | 0.00096 ± 0.00006 | 0.00072 ± 0.00007 |
| $K_{m}^{{{\text{app}}}}$ (мкМ) | 801.6 ± 7.8 | 447.7 ± 34.5 | 1361.6 ± 165.3 |
| ${{{{k}_{3}}} \mathord{\left/ {\vphantom {{{{k}_{3}}} {K_{m}^{{{\text{app}}}}}}} \right. \kern-0em} {K_{m}^{{{\text{app}}}}}}$ (мМ–1 с–1) | 0.00040 ± 0.00001 | 0.00216 ± 0.00029 | 0.00052 ± 0.00002 |
Данные сравнительного биохимического анализа трех видов альбумина с использованием НФА и параоксона в качестве субстратов свидетельствуют о том, что равновесные и кинетические характеристики обоих сайтов Садлоу ЧСА и КСА довольно близки между собой, но существенно отличаются от аналогичных характеристик бычьего альбумина. Карбоксилэстеразные характеристики сайта Садлоу II ЧСА и КСА практически одинаковы, тогда как параоксоназные характеристики лишь незначительно отличаются между ЧСА и КСА. Результаты наших исследований подтверждают предположение, основанное на данных об идентичности сайтов, об эволюционной консервативности сайта Садлоу II по сравнению с сайтом Садлоу I исследованных видов альбумина. Отметим, что сайт Садлоу I БСА отличается от ЧСА заменой Lys195 и Lys199 на Arg194 и Arg198, а сайт Садлоу I КСА от ЧСА заменой His242 и His288 на Asn242 и Gln288 (рис. 1). Следовательно, замена лизинов на аргинины более критична для работы сайта Садлоу I, чем замена гистидинов на аспарагины. Более того, замена Lys на Arg по-разному влияет на сродство сайта к НФА и параоксону: БСА хуже связывает НФА по сравнению с ЧСА и КСА, но лучше — параоксон, что влияет на эффективность карбоксилэстеразной и параоксоназной реакции в сайте Садлоу I БСА.
Следует отметить практическую значимость выявленных межвидовых различий эстеразной активности альбумина. Полученная информация позволяет сформулировать некоторые рекомендации использования альбумина в биологических экспериментах. Так, если альбумин используется исключительно для создания необходимого уровня осмотичности, например, в буферных растворах, или в культуральных средах при работе с клетками человека, то ничего плохого в использовании дешевого бычьего альбумина нет. При этом даже не обязательно применять БСА, свободный от жирных кислот. Если же речь идет о токсико- или фармакокинетических исследованиях препаратов для человека, не говоря уже об определении кинетических и равновесных констант, то, безусловно, надо использовать альбумин человека, причем ЧСА, свободный от жирных кислот, который на порядок дороже аналогичного бычьего альбумина. С другой стороны, если предполагается работа с клетками крысы или препаратами для крысы, требующая использования альбумина, то в таких исследованиях можно применять альбумин человека, так как КСА на порядок дороже ЧСА.
МОДУЛЯЦИЯ СВЯЗЫВАЮЩЕЙ И ЭСТЕРАЗНОЙ АКТИВНОСТИ АЛЬБУМИНА
Молекула альбумина может связать одновременно до десяти молекул лигандов, и по этой причине многие вещества конкурируют между собой за связывающие центры [65, 66]. Помимо прямой конкуренции, альбумин подвержен аллостерической модуляции: связывание лиганда в одном сайте может влиять на эффективность связывания в другом. Так, в молекуле альбумина происходят конформационные изменения после связывания ряда эндогенных соединений, таких как билирубин [67], мочевина [68], эстрадиол [69], глюкоза [70]. Экзогенные соединения также могут оказывать аллостерическое влияние. Например, связывание лоразепама с сайтом Садлоу II меняет эффективность связывания варфарина в Садлоу I [71], связывание теноксикама в Садлоу I усиливает связывание диазепама в Садлоу II, и наоборот [72]. Эти особенности позволяют предположить, что направленным воздействием на альбумин с помощью молекул, модулирующих его связывающие и/или эстеразные свойства, можно влиять на процесс взаимодействия белка с ФОС, что в свою очередь может стать вспомогательным вариантом детоксикации отравляющих веществ в кровеносном русле. В поисках вспомогательных средств отравления в последнее время стали уделять внимание нутрицевтикам, биологически активным веществам природного происхождения, как правило, компонентам продуктов питания, действие которых проявляется не сразу, но при продолжительном приеме, иногда в составе т.н. функционального питания [73]. Их преимущество заключается в доступности и дешевизне. В экспериментах с ФОС установлены превентивные эффекты омега-3-полиненасыщенных жирных кислот [74], экстракта корня имбиря Zīngiber officināle [75] и полифенолов Parquetina nigrescens, представителя семейства Кутровых [76]. Представляет интерес действие полифенолов декофеинизированного зеленого чая Camellia sinensis (ЭЗЧ) в силу его плейотропных эффектов [77, 78]. И жирные кислоты (ЖК), и полифенолы способны связываться с альбумином [79, 80], поэтому их возможное влияние на связывающие и эстеразные свойства белка представляет особый интерес.
Концентрация мажорных ЖК (олеиновая, пальмитиновая, стеариновая и линолевая) в плазме крови в норме составляет десятки или даже сотни мкМ [81]. Методом РСА было показано, что в молекуле альбумина существует семь сайтов связывания ЖК: FA1 (возле Ala158), FA2 (возле Leu22), FA3 (возле Asn391), FA4 (возле Tyr411), FA5 (возле Ala528), FA6 (возле Ala213), FA7 (возле Tyr150) [79]. Мажорные жирные кислоты обладают максимальным сродством к сайту FA5, и чуть меньшим сродством к сайту FA2 [82]. Альбумин человека при взаимодействии с ЖК в растворе обладает повышенной пластичностью и гибкостью [83]. Показано влияние ЖК на сродство альбумина к различным лигандам [84–86], поэтому мы предположили влияние ЖК на эффективность взаимодействия альбумина с ФОС.
В экспериментах in vitro мы установили, что олеиновая и пальмитиновая кислоты обладают ингибирующим действием на эстеразную активность альбумина быка по отношению к НФА в сайте Садлоу I, причем даже более выраженным по сравнению с выявленным ранее у ибупрофена и варфарина. Константа скорости ингибирования эстеразной реакции олеатом в концентрациях 20 и 30 мкМ составила, соответственно, 2.37 × 10–3 и 3.19 × 10–3 с–1, а пальмитатом 2.50 × 10–3 и 3.64 × × 10–3 с–1. Что касается параоксоназной активности, анализ экспериментальных данных не выявил выраженного ингибирующего действия пальмитата, в отличие от олеата, который незначительно, но подавлял ферментативную активность сайта Садлоу I БСА в отношении параоксона (аппроксимированная константа ингибирования Ki = 963.0 ± 157.8 мкМ). Применив математические и графические методы (методы Диксона и Корниш-Боудена), мы выявили неконкурентный тип ингибирования олеатом реакции гидролиза параоксона в сайте Садлоу I [87].
В нашем недавнем исследовании [88] методом молекулярной динамики были изучены геометрические характеристики комплексов параоксона с сайтами Садлоу I и Садлоу II ЧСА в отсутствие и в присутствии олеиновой кислоты в сайтах FA5 и FA2 (сайты с максимальной аффинностью к олеиновой кислоте). Были оценены стабильность продуктивных комплексов (в которых возможна атака гидроксила тирозина на атом фосфора лиганда) и значения свободной энергии образования этих комплексов. Согласно полученным данным, повышенная концентрация олеиновой кислоты в крови за счет аллостерической модуляции (неконкурентное ингибирование) будет снижать вероятность связывания параоксона с альбумином в обоих сайтах, а также уменьшать вероятность псевдоэстеразной реакции в сайте Садлоу II. Полученный результат не позволяет сделать однозначный вывод о том, будет ли связывание олеиновой кислоты в сайтах FA5 и FA2 влиять на эстеразную реакцию в сайте Садлоу I: и в отсутствие, и в присутствии олеиновой кислоты продуктивный комплекс параоксона с сайтом не стабилен. Мы полагаем, что для его стабилизации и возможности прохождения эстеразной реакции требуются какие-то дополнительные условия, не учтенные в процессе моделирования, например, депротонирование каталитического тирозина.
Таким образом, и эксперименты in vitro и in silico указывают на возможность модуляции жирными кислотами эстеразной и связывающей активности альбумина по отношению к ФОС. Во многих работах отмечается роль Arg410 в механизме псевдоэстеразной активности альбумина в сайте Садлоу II [25], пространственное отдаление Arg410 от Tyr411 ведет к ослаблению этой активности [89]. Согласно нашим данным, Arg257 играет ключевую роль в механизме аллостерической модуляции активности сайта Садлоу I [31]. Arg257 служит своего рода “заслонкой” между каталитическим тирозином Tyr150 и гистидинами из ближайшего окружения His242 и His288, способными принимать протон группы ОН тирозина в процессе возможной эстеразной реакции. Мы полагаем, что связывание модуляторов может влиять на положение этой “заслонки” и влиять на возможность протекания эстеразной реакции.
Что касается полифенолов, наши эксперименты in vitro с НФА в качестве субстрата показали, что декофеинизированный ЭЗЧ и его мажорный компонент галлат эпигаллокатехин (ЭГКГ) оказывал активирующее влияние на эстеразную активность альбумина быка, что выражалось в повышении скорости истинно эстеразной реакций в сайте Садлоу I. Анализ полученных данных показал, что полифенолы зеленого чая снижают кажущуюся константу Михаэлиса $K_{m}^{{{\text{app}}}}$ в 1.9 раза (при концентрации ЭГКГ 50 мкМ), а также повышают каталитическую константу kcat на 30% по сравнению с контролем. Влияние ЭЗЧ на псевдоэстеразную активность сайта Садлоу II выражается в незначительном увеличении константы диссоциации Ks и понижении кажущейся константы Михаэлиса $K_{m}^{{{\text{app}}}}$ по сравнению с контролем, однако данные изменения статистически недостоверны. Действие ЭЗЧ на скорость гидролиза параоксона бычьим альбумином оказалось схожим с НФА: активность обоих сайтов альбумина значительно усиливалась [87]. Последующие эксперименты in vivo показали, что применение ЭЗЧ обусловливает снижение индексов атерогенности, а также позитивную динамику целого ряда первичных и производных показателей за счет изменения уровней альбумина, триглицеридов, орозомукоида, мочевой кислоты, баланса клеток иммунной системы, способствуя регенерации организма экспериментальных животных после отравления ФОС [90].
ВЛИЯНИЕ МОЛЕКУЛЯРНОГО КРАУДИНГА НА СВЯЗЫВАЮЩУЮ И ЭСТЕРАЗНУЮ АКТИВНОСТЬ АЛЬБУМИНА
Отличительной особенностью живых систем является то, что биохимические процессы протекают в среде, содержащей высокие концентрации макромолекул (50–400 мг/мл). Такие условия называются молекулярным краудингом. За счет “плотной” среды уменьшается объем доступного растворителя, что приводит к увеличению эффективной концентрации макромолекул и повышению их химической активности. Это в свою очередь изменяет скорости и константы равновесия их реакций. В частности, этот эффект способствует ассоциации макромолекул, например, объединению белков в надмолекулярные структуры. Краудинг может также влиять на ферментативные реакции с участием малых молекул, если в процессе реакции изменяется конформация фермента [91]. К настоящему моменту экспериментально показано влияние молекулярного краудинга на структуру многих белков [92–94], связывающую и каталитическую активность ряда ферментов [95–97].
В плазме крови плотность макромолекул достигает 80 мг/мл, что обусловливает заметные краудинг-эффекты, влияет на конформационные и функциональные характеристики белков плазмы [98]. Краудинг-эффекты были выявлены, в том числе, и для альбумина. В работе [99] методом Рамановской спектроскопии было показано, что высокие концентрации БСА и среда с высокой концентрацией другого белка (высокостабильная производная рибонуклеазы термофильной археи Thermococcus kodakarensis) влияли на силу водородных связей внутри молекулы альбумина. Это в свою очередь приводило к тому, что молекула БСА принимала более компактную структуру. В работе [100] изучали влияние молекулярного краудинга на связывание насыщенных среднецепочечных и ненасыщенных длинноцепочечных ЖК с БСА. Для создания необходимых условий использовали полимер полиэтиленгликоль ПЭГ2000. Добавление в среду полимера улучшало связывание среднецепочечных ЖК, однако последующее повышение концентрации ПЭГ приводило к снижению аффинности. Проанализировав вторичную структуру БСА, авторы пришли к заключению, что с постепенным увеличением плотности среды молекула альбумина разрыхляется, но после определенной концентрации ПЭГ (5 wt %) процентное соотношение упорядоченных альфа-спиралей и бета-слоев снова возрастает, и альбумин принимает более компактную форму. Таким образом, чем “рыхлее” белок, тем лучше он связывает среднецепочечные ЖК. Что касается длинноцепочечных ЖК, при любой ненулевой концентрации полимера их связывание с БСА ухудшалось.
Таким образом, с учетом имеющихся литературных данных, можно предположить, что константы эстеразной и связывающей активности альбумина в кровеносном русле, где его концентрация существенно выше, чем в биохимических экспериментах, будут отличаться от констант, измеренных в “идеальном растворе” in vitro и/или рассчитанных с помощью методов молекулярного моделирования. Безусловно, требуются дополнительные эксперименты, моделирующие активность альбумина в условиях молекулярного краудинга.
ПЕРСПЕКТИВЫ ПРАКТИЧЕСКОГО ПРИМЕНЕНИЯ ВЗАИМОДЕЙСТВИЯ ФОС С АЛЬБУМИНОМ
В настоящее время антидотная терапия при отравлении ФОС направлена на блокаду ацетилхолиновых рецепторов с помощью атропина, на реактивацию АХЭ с помощью оксимов (карбоксим, пралидоксим, HI-6 и др.), а также на ослабление судорог с помощью агонистов бензодиазепиновых рецепторов (диазепам, мидазолам и т.д.) [101–104]. Базовый антидотный комплекс предназначен, прежде всего, для выживания организма в догоспитальный период, но не предназначен для предотвращения развития отставленных эффектов острого отравления, среди которых наиболее известными являются т.н. промежуточный синдром и ФОС-индуцированная отставленная полинейропатия [105]. Между тем, описаны и другие патологические состояния, обусловливающие отставленную патологию после острой интоксикации ФОС: это эпилептические припадки, воспалительные процессы в центральной нервной системе, периферических нервных волокнах и кровеносных сосудах, злокачественная гипертермия [106–109].
Эффективность существующей антидотной, симптоматической и профилактической терапии можно существенно повысить за счет усиления детоксикации ФОС на первом этапе поступления яда в организм – в кровеносном русле, что позволит уменьшить токсическое действие ФОС на АХЭ нервно-мышечных и нейрональных синапсов и избежать отставленных эффектов отравления. Исследования, связанные с разработкой средств детоксикации ФОС на первом этапе поступления яда в организм, направлены в основном на получение рекомбинантных биочистильщиков: бутирилхолинэстеразы для стехиометрического и параоксоназы для каталитического взаимодействия с ФОС [110, 111]. Несмотря на огромные затраты, связанные с разработкой биочистильщиков, перспективы получения на их основе эффективных и применимых на практике средств антидотной терапии весьма туманны, поскольку для достижения желаемого эффекта требуется существенная “перекройка” ферментов на молекулярном уровне [112, 113]. Высокоаффинное связывание ФОС в кровеносном русле можно также обеспечить с помощью ДНК- или РНК-аптамеров, представляющих собой короткие нити олигонуклеотидов [114]. Основная сложность в подборе аптамеров к ФОС состоит в том, что молекулы этих токсических веществ часто имеют схожую структуру. Это затрудняет выбор аптамера, который не просто хорошо связывает молекулу ФОС, но связывает ее с высокой специфичностью [115, 116]. Существуют и трудности в методологии, связанные с тем, что молекула аптамера в разы больше, чем молекула отравляющего вещества [117].
Что касается разрабатываемой нами возможности направленного воздействия на альбумин для усиления терапии отравления ФОС, основные преимущества этого подхода следующие: 1) альбумин является основным транспортным белком крови и его концентрация в плазме крайне высока, 2) трехмерная структура альбумина достаточно лабильна и легко подвержена аллостерической модуляции, 3) альбумин может связывать практические все биоактивные вещества, и влиять на его активность можно доступными и дешевыми соединениями.
Результаты наших экспериментов позволяют сделать вывод о том, что с помощью эндогенных и экзогенных лигандов альбумина возможно регулировать эффективность взаимодействия альбумина с ФОС. Другой вопрос, что в условиях in vivo качество этой модуляции зависит от многих факторов и не в последнюю очередь от количественного соотношения модуляторов и ФОС. Наши данные позволяют предположить, что позитивный результат с точки зрения выживания при остром отравлении ФОС можно получить лишь в случае менее токсичных ФОС с более высокой аффинностью к альбумину. Например, меньшая токсичность параоксона по сравнению с зоманом может быть связана не только с его меньшей ингибиторной активностью в отношении холинэстераз, но также с повышенной аффинностью параоксона к обоим сайтам Садлоу альбумина [33].
Еще одна задача, которую предстоит решить, заключается в том, что в условиях молекулярного краудинга в плазме крови альбумин, по всей видимости, становится чем-то вроде диффузного цитоскелета, поверхность которого покрыта маслом (жирные кислоты) и/или ледяной коркой (структурированная вода). По этой поверхности гораздо легче перемещаться, чем по воде (раствор без альбумина) или по рыхлому снегу (неструктурированная вода в окружении альбумина). По этой причине взаимодействие жирных кислот с альбумином может привести к тому, что молекулы ФОС будут проигрывать конкуренцию за связывание с сайтами Садлоу. Тогда альбумин будет служить для них лишь удобной платформой для более быстрого перемещения – с молекулы на молекулу – по кровеносному руслу и межклеточному пространству к основной мишени – ацетилхолинэстеразе нейромышечных или нейрональных синапсов. Выходом может стать создание аптамера к параоксону, который бы связывался с белком и закрывал его сайты от взаимодействия с ФОС и ЖК. Усовершенствованием этого решения может стать создание двойного аптамера, который бы мог одним фрагментом связаться с альбумином, другим – с ФОС. Более дешевым и при этом, может быть, даже более эффективным способом нарушения транспорта молекул ФОС в условиях молекулярного краудинга является ослабление сил “сцепления”, т.е. связывающих характеристик альбумина за счет транзиторного уменьшения его концентрации в крови с помощью регидратирующих солевых препаратов. Работа в этом направлении уже начата, получены первые обнадеживающие результаты и есть основания надеяться на то, что альбумин преподнесет нам еще немало сюрпризов в самом хорошем смысле этого слова.
Список литературы
Macwilliam J.A. // Br. Med. J. 1891. V. 1. P. 837–840.
Fasano M., Curry S., Terreno E., Galliano M., Fanali G., Narciso P., Notari S., Ascenzi P. // IUBMB Life. 2005. V. 57. P. 787–796.
Sudlow G., Birkett D.J., Wade D.N. // Mol. Pharmacol. 1975. V. 11. P. 824–832.
Гончаров Н.В., Белинская Д.А., Разыграев А.В., Уколов А.И. // Биоорган. химия. 2015. Т. 41. № 2. С. 131–144. [Goncharov N.V., Belinskaya D.A., Ukolov A.I., Razygraev A.V. // Russ. J. Bioorg. Chem. 2015. V. 41. P. 113–124.]
Li B., Nachon F., Froment M.T., Verdier L., Debouzy J.C., Brasme B., Gillon E., Schopfer L.M., Lockridge O., Masson P. // Chem. Res. Toxicol. 2008. V. 21. P. 421–431.
John H., Breyer F., Thumfart J.O., Höchstetter H., Thiermann H. // Anal. Bioanal. Chem. 2010. V. 398. P. 2677–2691.
Sogorb M.A., Vilanova E. // Chem. Biol. Interact. 2010. V. 187. P. 325–329.
Гончаров Н.В., ТерпиловскийМ.А., Шмурак В.И., Белинская Д.А., Авдонин П.В. // ЖЭБФ. 2017. Т. 53. № 4. С. 241–250. [Goncharov N.V., Terpilovskii M.A., Belinskaya D.A., Shmurak V.I., Avdonin P.V. // J. Evol. Biochem. Physiol. 2017. V. 53. P. 271–281.]
Гончаров Н.В., Терпиловский М.А., Шмурак В.И., Белинская Д.А., Авдонин П.В.// ЖЭБФ. 2019. Т. 55. № 2. С. 104–114. [Goncharov N.V., Terpilovsky M.A., Shmurak V.I., Belinskaya D.A., Avdonin P.V. // J. Evol. Biochem. Physiol. 2019. V. 55. P. 112–123.]
The UniProt Consortium // Nucleic Acids Res. 2015. V. 43. P. 204–212.
Ghuman J., Zunszain P.A., Petitpas I., Bhattacharya A.A., Otagiri M., Curry S. // J. Mol. Biol. 2005. V. 353. P. 38–52.
Bujacz A. // Acta Crystallogr. D Biol. Crystallogr. 2012. V. 68. P. 1278–1289.
Vyas V. K., Ukawala R.D., Ghate M., Chintha C. // Indian J. Pharm. Sci. 2012. V. 74. P. 1–17.
Таборская К.И., Белинская Д.А., Авдонин П.В., Гончаров Н.В. // ЖЭБФ. 2017. Т. 53. С. 342–350. [Taborskaya K.I., Belinskaya D.A., Goncharov N.V., Avdonin P.V. // J. Evol. Biochem. Physiol. 2017. V. 53. P. 384–393.]
Луйк А.И., Лукьянчук В.Д. Сывороточный альбумин и биотранспорт ядов. М.: Медицина, 1984.
Пшенкина Н.Н. // Российский биомедицинский журнал. 2011. Т. 12. С. 980–989.
Dömötör O., Pelivan K., Borics A., Keppler B.K., Kowol C.R., Enyedy É.A. // J. Pharm. Biomed. Anal. 2018. V. 154. P. 321–331.
Schenfeld E.M., Ribone S.R., Quevedo M.A. // Eur. J. Pharm. Sci. 2018. V. 115. P. 109–118.
Tang B., Tang P., He J., Yang H., Li H. // J. Photochem. Photobiol. B. 2018. V. 184. P. 18–26.
Tildon J.T., Ogilvie J.W. // J. Biol. Chem. 1972. V. 247. P. 1265–1271.
Radilov A., Rembovskiy V., Rybalchenko I., Savelieva E., Podolskaya E., Babakov V., Ermolaeva E., Dulov S., Kuznetsov S., Mindukshev I., Shpak A., Krasnov I., Khlebnikova N., Jenkins R., Goncharov N. // Handbook of the Toxicology of Chemical Warfare Agents / Ed. Gupta R.C. Amsterdam: Academic Press/Elsevier, 2009. P. 69–91.
Гладилович В.Д., Краснов И.А., Подольская Е.П., Дубровский Я.А., Войтенко Н.Г., Фиронов С.В., Бабаков В.Н., Гончаров Н.В., Краснов Н.В. // Научн. приборостр. 2010. Т. 20. С. 84–92.
Sultatos L.G., Basker K.M., Shao M., Murphy S.D. // Mol. Pharmacol. 1984. V. 26. P. 99–104.
Means G.E., Wu H.L. // Arch. Biochem. Biophys. 1979. V. 194. P. 526–530.
Sakurai Y., Ma S.F., Watanabe H., Yamaotsu N., Hirono S., Kurono Y., Kragh-Hansen U., Otagiri M. // Pharm. Res. 2004. V. 21. P. 285–292.
Watanabe H., Tanase S., Nakajou K., Maruyama T., Kragh-Hansen U., Otagiri M. // Biochem. J. 2000. V. 20. P. 813–819.
Kurono Y., Miyajima M., Tsuji T., Yano T., Takeuchi T., Ikeda K. // Chem. Pharm. Bull (Tokyo). 1991. V. 39. P. 1292–1294.
Ekici O.D., Paetzel M., Dalbey R.E. // ProteinSci. 2008. V. 17. P. 2023–2037.
Белинская Д.А., Шмурак В.И., Прокофьева Д.С., Гончаров Н.В. // Токсикол. вестник 2012. № 6. С. 13–19.
Белинская Д.А., Шмурак В.И., Прокофьева Д.С., Гончаров Н.В. // Биоорг. химия. 2014. Т. 40. № 5. С. 541–549. [Belinskaya D.A., Goncharov N.V., Shmurak V.I., Prokofieva D.S. // Russ. J. Bioorg. Chem. 2014. V. 40. P. 499–506.]
Белинская Д.А., Таборская К.И., Авдонин П.В., Гончаров Н.В. // Биоорг. химия. 2017. Т. 43. С. 347–356. [Belinskaia D.A., Taborskaya K.I., Goncharov N.V., Avdonin P.V. // Russ. J. Bioorg. Chem. 2017. V. 43. P. 359–367.]
Белинская Д.А., Шмурак В.И., Таборская К.И., Авдонин П.П., Авдонин П.В., Гончаров Н.В. // ЖЭБФ. 2017. Т. 53. С. 170–177. [Belinskaya D.A., Taborskaya K.I., Goncharov N.V., Shmurak V.I., Avdonin P.P., Avdonin P.V. // J. Evol. Biochem. Physiol. 2017. V. 53. P. 191–199.]
Goncharov N.V., Belinskaia D.A., Shmurak V.I., Terpilowski M.A., Jenkins R.O., Avdonin P.V. // Molecules 2017. V. 22. e1201.
Ascenzi P., Fasano M. // Biochem. Biophys. Res. Commun. 2012. V. 422. P. 219–223.
Bender M.L., Kezdy F.J., Wedler F.C. Alpha-Chymotrypsin: Enzyme concentration and kinetics // Journal of Chemical Education. 1967. V. 44. P. 84–88.
De Caro J.D., Rouimi P., Rovery M. // Eur. J. Biochem. 1986. V. 158. P. 601–607.
Main A.R. // Science 1964. V. 144. P. 992–993.
Wilson K., Walker J. Principles and Techniques of Biochemistry and Molecular Biology, 7th Edition. Cambridge: Cambridge University Press, 2010.
Michaelis L., Menten M. L. // Biochem. Z. 1913. V. 49. P. 333–369.
Briggs G.E., Haldane J.B.S. // Biochem. J. 1925. V. 19. P. 338–339.
Morrison J.F. // Biochim. Biophys. Acta. 1969. V. 185. P. 269–286.
Flach E.H., Schnell S. // Syst. Biol. (Stevenage). 2006. V. 153. P. 187–191.
Kuzmic P. // Anal. Biochem. 2009. V. 394. P. 287–289.
Галимова М.Х. Ферментативная кинетика: Справочник по механизмам реакций. М.: КомКнига, 2007.
Лянгузов А.Ю., Петрова Т.А., Стефанов В.Е. // ДАН. 2009. Т. 424. № 5. С. 692–695. [Lyangusov A.Yu., Petrova T.A., Stefanov V.E. // Dokl. Biochem. Biophys. 2009. V. 424. P. 49–52.]
Boeckx J., Hertog M., Geeraerd A., Nicolai B. // Plant Methods. 2017. V. 13. E69.
Furlong C.E., Richter R.J., Seidel S.L., Motulsky A.G. // Am. J. Hum. Genet. 1988. V. 43. P. 230–238.
Sogorb M.A., Díaz-Alejo N., Escudero M.A., Vilanova E. // Arch. Toxicol. 1998. V. 72. P. 219–226.
Genheden S., Ryde U. // Expert Opin. Drug. Discov. 2015. V. 10. P. 449–461.
Saikia S., Bordoloi M. // Curr. Drug. Targets. 2019. V. 20. P. 501–521.
Teodoro M.L., Phillips G.N., Jr., Kavraki L.E. // Proc. of the 2001 IEEE International Conference on Robotics and Automation (ICRA 2001). Seoul, Korea: IEEE press, 2001. P. 960–966.
Пырков Т.В., Озеров И.В., Балицкая Е.Д., Ефремов Р.Г. // Биоорг. химия. 2010. Т. 36. № 4. С. 482– 492.
Hospital A., Goñi J.R., Orozco M., Gelpí J.L. // Adv. Appl. Bioinform. Chem. 2015. V. 8. P. 37–47.
Kumari R., Kumar R., Open Source Drug Discovery Consortium, Lynn A. // J. Chem. Inf. Model. 2014. V. 54. P. 1951–1962.
Liyasova M.S., Schopfer L.M., Lockridge O. // Biochem. Pharmacol. 2010. V. 79. P. 784–791.
Kohita H., Matsushita Y., Moriguchi I. // Chem. Pharm. Bull. (Tokyo). 1994. V. 42. P. 937–940.
Antoni G., Casagli M.C., Bigio M., Borri G., Neri P. // Ital. J. Biochem. 1982. V. 31. P. 100–106.
Brown N.A., Müller W.E. // Pharmacology. 1978. V. 17. P. 233–238.
Mohammadi F., Bordbar A.K., Divsalar A., Mohammadi K., Saboury A.A. // Protein J. 2009. V. 28. P. 189–196.
Fonda M.L., Trauss C., Guempel U.M. // Arch. Biochem. Biophys. 1991. V. 288. P. 79–86.
Silva D., Cortez C.M., Cunha-Bastos J., Louro S.R. // Toxicol. Lett. 2004. V. 147. P. 53–61.
Han X., Snow T.A., Kemper R.A., Jepson G.W. // Chem. Res. Toxicol. 2003. V. 16. P. 775–781.
Aubry A.F., Markoglou N., McGann A. // Comp. Biochem. Physiol. C. Pharmacol. Toxicol. Endocrinol. 1995. V. 112. P. 257–266.
Frandsen P.C., Brodersen R. // Acta Chem. Scand. B. 1986. V. 40. P. 55–59.
Hossain M.K., Khatun A., Rahman M., Akter M.N., Chowdhury S.A., Alam S.M. // Adv. Pharm. Bull. 2016. V. 6. P. 589–595.
Schneider E.K., Huang J.X., Carbone V., Baker M., Azad M.A., Cooper M.A., Li J., Velkov T. // J. Mol. Recognit. 2015. V. 28. P. 339–348.
Jacobsen J., Brodersen R. // J. Biol. Chem. 1983. V. 258. P. 6319–6326.
Uchida H., Hanano M. // Chem. Pharm. Bull. (Tokyo) 1974. V. 22. P. 1571–1579.
Danesh N., Navaee Sedighi Z., Beigoli S., Sharifi-Rad A., Saberi M.R., Chamani J. // J. Biomol. Struct. Dyn. 2018. V. 36. P. 1747–1763.
Barzegar A., Moosavi-Movahedi A.A., Sattarahmady N., Hosseinpour-Faizi M.A., Aminbakhsh M., Ahmad F., Saboury A.A., Ganjali M.R., Norouzi P. // Protein Pept. Lett. 2007. V. 14. P. 13–18.
Fitos I., Visy J., Kardos J. // Chirality 2002. V. 14. P. 442–448.
Brée F., Urien S., Nguyen P., Tillement J.P., Steiner A., Vallat-Molliet C., Testa B., Visy J., Simonyi M. // J. Pharm. Pharmacol. 1993. V. 45. P. 1050–1053.
Chauhan B., Kumar G., Kalam N., Ansari S.H. // J. Adv. Pharm. Technol. Res. 2013. V. 4. P. 4–8.
Avci B., Bilge S.S., Arslan G., Alici O., Darakci O., Baratzada T., Ciftcioglu E., Yardan T., Bozkurt A. // Toxicol. Ind. Health. 2018. V. 34. P. 69–82.
Mukherjee S., Mukherjee N., Saini P., Roy P., Babu S.P. // Indian J. Exp. Biol. 2015. V. 9. 574–584.
Oyagbemi A.A., Omobowale T.O., Ochigbo G.O., Asenuga E.R., Ola-Davies O.E., Ajibade T.O., Saba A.B., Adedapo A.A. // J. Diet Suppl. 2018. V. 15. P. 269–284.
Sinha S., Du Z., Maiti P., Klärner F.G., Schrader T., Wang C., Bitan G. // ACS Chem. Neurosci. 2012. V. 3. P. 451–458.
Goncharov N., Maevsky E., Voitenko N., Novozhilov A., Kubasov I., Jenkins R., Avdonin P. // Nutraceuticals: Efficacy, Safety and Toxicity / Ed. Gupta R.C. Amsterdam: Academic Press. Elsevier, 2016. P. 177–188.
Van der Vusse G.J. // Drug Metab. Pharmacokinet. 2009. V. 24. P. 300–307.
Latruffe N., Menzel M., Delmas D., Buchet R., Lançon A. // Molecules. 2014. V. 19. P. 17066–17077.
Duran M. // Disorders of Mitochondrial Fatty Acid Oxidation and Ketone Body Handling / Eds Blau N., Duran M., Blaskovics M.E., Gibson K.M. Berlin; Heidelberg: Springer, 2003. P. 309–334.
Rizzuti B., Bartucci R., Sportelli L., Guzzi R. // Arch. Biochem. Biophys. 2015. V. 579. P. 8–25.
Reichenwallner J., Hinderberger D. // Biochim. Biophys. Acta. 2013. V. 1830. P. 5382–5393.
Dasgupta A., Crossey M.J. // Am. J. Med. Sci. 1997. V. 313. P. 75–79.
Takamura N., Shinozawa S., Maruyama T., Suenaga A., Otagiri M. // Biol. Pharm. Bull. 1998. V. 21. P. 174–176.
Vorum H., Honoré B. // J. Pharm. Pharmacol. 1996. V. 48. P. 870–875.
Баталова А.А., Белинская Д.А., Гончаров Н.В. // Сборник трудов Седьмой научной конференции с международным участием “Современные тенденции развития технологий здоровьесбережения” / Панин В.П. Москва: ФГБНУ ВИЛАР, 2019. С. 428–434.
Белинская Д.А., Баталова А.А., Гончаров Н.В. // Токсикол. вестник. 2019. № 3. С. 26–32.
Anraku M., Yamasaki K., Maruyama T., Kragh-Hansen U., Otagiri M. // Pharm. Res. 2001. V. 18. P. 632–639.
Гончаров Н.В., Терпиловский М.А., Кудрявцев И.В., Серебрякова М.К., Белинская Д.А., Соболев В.Е., Шмурак В.И., Корф Е.А., Авдонин П.В. // ЖЭБФ. 2019. Т. 55. С. 188–198. [Goncharov N.V., Terpilowski M.A., Kudryavtsev I.V., Serebryakova M.K., Belinskaya D.A., Sobolev V.E., Shmurak V.I., Korf E.A., Avdonin P.V. // J. Evol. Biochem. Physiol. 2019. V. 55. P. 208–221.]
Ellis R.J., Minton A.P. // Nature. 2003. V. 425. P. 27–28.
Kuzntesova I.M., Turoverov K.K., Uversky V.N. // Int. J. Mol. Sci. 2014. V. 15. P. 23090–23140.
Hirai M., Ajito S., Sugiyama M., Iwase H., Takata S., Shimizu N., Igarashi N., Martel A., Porcar L. // Physica B: Condensed Matter. 2018. V. 551. P. 212–217.
Антифеева Ю.А., Поварова О.И., Родина Н.П., Сулацкий М.И., Карасев М.М., Кузнецова И.М. // Цитология. 2018. Т. 60. С. 856–859.
Chebotareva N.A. // Biochemistry (Mosc). 2007. V. 72. P. 1478–1490.
Pozdnyakova I., Wittung-Stafshede P. // Biochim. Biophys. Acta. 2010. V. 1804. P. 740–744.
Hou S., Trochimczyk P., Sun L., Wisniewska A., Kalwarczyk T., Zhang X., Wielgus-Kutrowska B., Bzowska A., Holyst R. // Sci. Rep. 2016. V. 6. e22 033.
Чеботарева Н.А., Курганов Б.И., Ливанова Н.Б. // Биохимия. 2004. Т. 69. С. 1522–1536. [Chebotareva N.A., Kurganov B.I., Livanova N.B. // Biochemistry (Moscow). 2004. V. 69. P. 1239–1251.]
Ota C., Takano K. // Langmuir. 2016. V. 32. P. 7372–7382.
Zhu T.T., Zhang Y., Luo X.A., Wang S.Z., Jia M.Q., Chen Z.X. // J. Agric. Food Chem. 2018. V. 66. P. 1242–1250.
Watson A., Opresko D., Young R.A., Hauschild V., King J., Bakshi K. // Handbook of the Toxicology of Chemical Warfare Agents / Ed Gupta R.C. Amsterdam: Academic Press; Elsevier, 2015. P. 111–130.
Deshpande L.S., Phillips K., Huang B., De Lorenzo R.J. // Neurotoxicology. 2014. V. 44. P. 352–357.
Reddy S.D., Reddy D.S. // Epilepsia. 2015. V. 56. P. 813–821.
Reddy S.D., Younus I., Clossen B.L., Reddy D.S. // J. Pharmacol. Exp. Ther. 2015. V. 353. P. 517–528.
Lotti M., Moretto A. // Toxicol. Rev. 2005. V. 24. P. 37–49.
Чепур С. В. // Токсикол. вестник. 2010. № 3. С. 42–43.
de Araujo Furtado M., Rossetti F., Chanda S., Yourick D. // Neurotoxicology. 2012. V. 33. P. 1476–1490.
Goncharov N.V., Nadeev A.D., Jenkins R.O., Avdonin P.V. // Oxid. Med. Cell Longev. 2017. e9 759 735.
Oruch R., Pryme I.F., Engelsen B.A., Lund A. // Neuropsychiatr. Dis. Treat. 2017. V. 13. P. 161–175.
Masson P., Lockridge O. // Arch. Biochem. Biophys. 2010. V. 494. P. 107–120.
Bajaj P., Tripathy R.K., Aggarwal G., Pande A.H. // Scientific World Journal. 2014. e854 391.
Kirby S.D., Norris J.R., Richard Smith J., Bahnson B.J., Cerasoli D.M. // Chem. Biol. Interact. 2013. V. 203. P. 181–185.
Lushchekina S.V., Schopfer L.M., Grigorenko B.L., Nemukhin A.V., Varfolomeev S.D., Lockridge O., Masson P. // Front. Pharmacol. 2018. V. 9. e211.
Ku T.H., Zhang T., Luo H., Yen T.M., Chen P.W., Han Y., Lo Y.H. // Sensors (Basel). 2015. V. 15. P. 16 281–16 313.
Zhang C., Wang L., Tu Z., Sun X., He Q., Lei Z., Xu C., Liu Y., Zhang X., Yang J., Liu X., Xu Y. // Biosens. Bioelectron. 2014. V. 55. P. 216–219.
Belinskaia D.A., Avdonin P.V., Avdonin P.P., Jenkins R.O., Goncharov N.V. // Comput. Biol. Chem. 2019. V. 80. P. 452–462.
Белинская Д.А., Гончаров Н.В. // Доклады Международной конференции “Математическая биология и биоинформатика” / Лахно В.Д. Пущино: ИМПБ РАН, 2018. e83.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия