Биоорганическая химия, 2020, T. 46, № 6, стр. 593-665
Антибиотики из экстремофильных микромицетов
А. А. Баранова 1, В. А. Алферова 1, 3, В. А. Коршун 1, 3, 2, А. П. Тюрин 1, 3, *
1 Научно-исследовательский институт по изысканию новых антибиотиков им. Г.Ф. Гаузе
119021 Москва, ул. Большая Пироговская, 11/1, Россия
2 ФГБУН Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
3 НИУ “Высшая школа экономики”
101000 Москва, ул. Мясницкая, 20, Россия
* E-mail: anton2rin@gmail.com
Поступила в редакцию 30.04.2020
После доработки 08.05.2020
Принята к публикации 12.05.2020
Аннотация
Экстремофильные микроорганизмы, т.е. способные нормально функционировать при экстремально высоких или низких температурах, давлении и др. условиях внешней среды, уже несколько десятилетий находятся в фокусе внимания микробиологов из-за биотехнологического потенциала их ферментов. Последние (называемые также экстремозимами) нашли применение в производстве продуктов питания, моющих средств и других отраслях промышленности. При этом обитатели экстремальных экониш долгое время оставались практически неизученными с точки зрения химии природных соединений. В последние годы глобальной проблемой является появление все новых антибиотикорезистентных штаммов патогенов, поражающих человека и животных. Проблема усугубляется сильным снижением темпов разработки новых антибиотиков. В поисках новых активных веществ и скаффолдов для медицинской химии исследователи обращаются к малоисследованным природным источникам: в последнее время наблюдается резкий рост числа работ по изучению вторичных метаболитов, продуцируемых экстремофилами. С момента открытия пенициллина и до наших дней микромицеты, наряду с актинобактериями, являются одним из самых продуктивных источников антибиотических соединений, применяемых в медицине и сельском хозяйстве. Многие авторы рассматривают экстремофильные микромицеты как перспективный источник малых молекул с необычным механизмом действия или значительной структурной новизной. В предлагаемом обзоре обобщены новейшие (за 2018–2019 гг) экспериментальные данные об антибиотических соединениях, продуцируемых экстремофильными микромицетами с различными типами адаптации. Активные метаболиты классифицированы по типу структуры и биосинтетическому происхождению. Обобщены данные по биологической активности выделенных метаболитов.
ВВЕДЕНИЕ
Резистентность патогенов к используемым антимикробным средствам и появление “новых” патогенов, подобных коронавирусу, является глобальной угрозой современного здравоохранения. Проблема, вызванная ненадлежащим применением и утилизацией антимикробных средств (при самолечении, в животноводстве и т.д.), усугубляется сильным снижением темпов разработки новых антибиотиков из-за их низкой инвестиционной отдачи [1, 2]. Разработка новых анти-инфекционных средств и методов борьбы с распространением резистентных микроорганизмов названа приоритетной задачей как на международном, так и на национальном уровне и зафиксирована в ряде политических документов: Резолюция ООН A/RES/71/3 [3], Глобальный план действий по борьбе с устойчивостью к противомикробным препаратам ВОЗ [4], Стратегия предупреждения распространения антимикробной резистентности в Российской Федерации [5].
Как показывает анализ данных о внедрении низкомолекулярных соединений в медицинскую практику за период 1981–2019 гг., природные вещества, их полусинтетические производные и миметики являются важным источником новых терапевтических агентов. А в некоторых областях (например, антибактериальные и противоопухолевые средства) они являются основным источником новых лекарств [6]. Таким образом, поиск и исследование соединений из различных природных источников остается одним из ключевых направлений в разработке новых анти-инфекционных агентов.
Однако традиционный (фенотипический) подход к скринингу и выявлению активных веществ не позволяет серьезно расширить “химическое пространство” вторичных метаболитов. Один из путей решения данной проблемы – изучение труднодоступных и малоисследованных местообитаний. В частности, в последнее время наблюдается резкий рост числа работ по изучению вторичных метаболитов, продуцируемых экстремофилами. Экстремофильные микроорганизмы, т.е. способные нормально функционировать при экстремально высоких или низких температурах, давлении и др. условиях внешней среды, уже несколько десятилетий находятся в фокусе внимания микробиологов из-за биотехнологического потенциала их ферментов. Последние (называемые также экстремозимами) нашли применение в производстве продуктов питания, моющих средств и других отраслях промышленности. При этом обитатели экстремальных экониш долгое время оставались практически неизученными с точки зрения химии природных соединений. Современные тенденции в биотехнологии свидетельстуют о высоком потенциале обитателей таких экониш в качестве продуцентов новых специализированных метаболитов с самыми разнообразными свойствами [7].
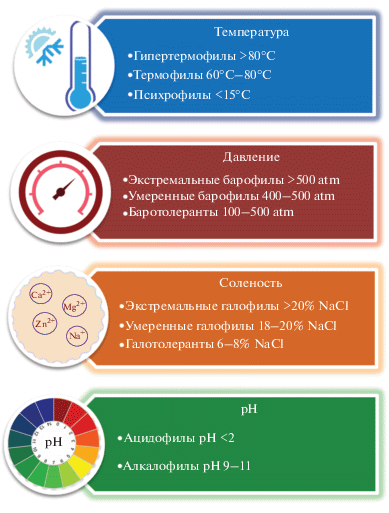
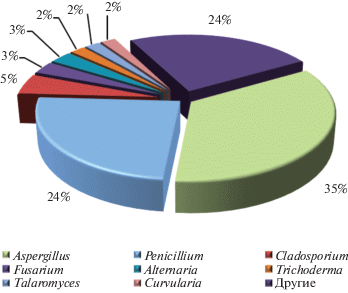
Как правило, экстремофилы классифицируют по факторам адаптации, спектр которых довольно широк. Для рассмотренных в данной работе продуцентов такими факторами являются температура, соленость, давление, солнечная радиация и уровень рН (рис. 1). Организмы, способные адаптироваться к нескольким факторам, называют полиэкстремофилами.
Грибы и грибоподобные микроорганизмы являются самыми многочисленными эукариотическими организмами на планете, а присутствие в самых разнообразных экстремальных экосистемах делает их важным объектом исследования [8]. С момента открытия пенициллина и до наших дней микромицеты, наряду с актинобактериями, являются одним из самых продуктивных источников антибиотических соединений, применяемых в медицине и сельском хозяйстве [9]. Многие авторы рассматривают экстремофильные микромицеты как перспективный источник малых молекул с необычным механизмом действия или значительной структурной новизной. Данная работа посвящена обобщению последних (за 2018–2019 гг.) литературных данных о вторичных метаболитах экстремофильных микромицетов с антибиотической активностью.
Природные соединения, в том числе и биоактивные, выделенные из экстремофильных грибов с различными типами адаптации, были рассмотрены в недавнем обзоре, охватывающем литературу до 2017 года [10]. Также существует ряд специализированных обзоров, посвященных биотехнологическому потенциалу грибов и других микроорганизмов с различными типами адаптации: психрофилов [11, 12], ацидофилов [13], галофилов [14].
Среди экстремофильных местообитаний в данном обзоре отдельно выделены несколько типов, предполагающих комбинацию различных факторов адаптации. Прежде всего, это микромицеты выделенные из морских местообитаний на глубине менее 200 м (из морских губок, отложений прибрежных зон – кроме арктического/антарктического шельфа, моллюсков, кораллов, водорослей, асцидий и пр.), обозначенные далее дескриптором “морские”. Морские экосистемы весьма разнообразны по температурным колебаниям (от −1.5°C в морском льду, до 400°C в глубоководных гидротермальных источниках), давлению (1–1000 атм.), освещенности (от полной темноты до эвфотических зон), составу и концентрации питательных веществ [15]. Грибы часто ассоциируются с различными морскими беспозвоночными, водорослями, растениями, способствуя круговороту питательных веществ и разложению органики [16]. В связи с уникальными особенностями полиэкстремофильной адаптации и широким спектром вторичных метаболитов, грибы морского происхождения являются интересным объектом с точки зрения расширения пространства фармакофоров [7, 17]. Высокий интерес к морским микромицетам нашел отражение в ряде обзоров, обобщающих литературу по их биоразнообразию и спектру метаболитов [18–35]. Вторичные метаболиты морских микромицетов упоминаются в обзорах, посвященных биотехнологическому потенциалу всего биооразнообразия морских микроорганизмов [18, 24, 26, 27, 33, 34], а также описаны в ряде специализированных обзоров. В частности, в последние годы обобщенны данные об активных вторичных метаболитах распространенных среди морских микроорганизмов родов микромицетов – Phoma [28], Penicillium [21] и Aspergillus [30]. Растущее число публикаций по новым соединениям с биологической активностью, выделенным из морских микромицетов, привело к появлению обзоров, посвященных как их активным метаболитам в целом [19, 20, 23, 29], так и конкретным химических классам соединений – антрахинонам [22] и пептидам [32].
Дескриптором “глубоководные” обозначены продуценты, отобранные из из морских местообитаний на глубине от 200 м и более (образцы донных отложений, воды и пр.). Глубоководная среда представляет собой одну из самых обширных экосистем на планете, поскольку 95% океанов Земли имеют глубину более 1000 м. Эти местообитания характеризуются температурами ниже 2°C, полной темнотой на глубинах более 250 м и низким уровнем кислорода. Глубоководные грибы, в основном, присутствуют в донных отложениях [15, 16]. Антибиотические вторичные метаболиты грибов, выделенных из глубоководных местобитаний, упоминаются в ряде недавних обзоров по биотехнологическому потенциалу и биоразнообразию глубоководных морских экониш [26], грибов аноксичных вод [31] и прочих глубоководных местообитаний [35].
Дескриптором “мангровые” обозначены микроорганизмы, выделенные из почв мангровых лесов; корней, ветвей, листьев, плодов мангровых растений. За последние 15 лет число вторичных метаболитов из грибов, ассоциированных с мангровыми растениями, неуклонно растет, что свидетельствует о большом потенциале этой экологической ниши. В последнее время была обобщена литература по некоторым биоактивным соединениям мангровых почвенных грибов и эндофитов мангровых растений [27], а также по характеристике вторичных метаболитов мангровых грибов рода Talaromyces [25].
Дескриптором “Арктика/Антарктида” выделены микромицеты, изолированные из донных отложений прибрежных районов, почв и почвоподобных образований арктических и антарктических зон.
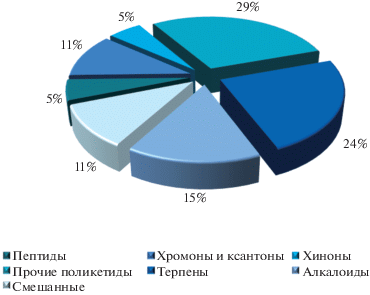
Вещества с различными типами антибиотической активности (противовирусная, антибактериальная, антифунгальная, цитотоксическая, антигельминтная) в обзоре сгруппированы по типу структур, с учетом их биосинтетического происхождения (пептиды, дикетопиперазины и родственые соединения; поликетиды, ксантоноиды и родственные соединения; алкалоиды; терпеноиды, стероиды и родственные соединения; соединения смешанного и неустановленного происхождения). Поликетидные соединения, ввиду большого количества, разбиты на несколько групп по типу химической структуры (хиноны; хромоны, бензофеноны и ксантоны; прочие поликетиды). Конфигурации стереоцентров указываются для тех соединений, для которых в оригинальных работах проведены соответствующие исследования. Для соединений, относительная конфигурация которых устанавливалась на основании спектров ЯМР, приведены планарные структурные формулы. Структуры и номера веществ, описаных ранее и выделенных повторно, в таблицах и на рисунках выделены серым.
1. ПЕПТИДЫ, ДИКЕТОПИПЕРАЗИНЫ И РОДСТВЕНЫЕ СОЕДИНЕНИЯ
Среди биологически активных метаболитов экстремофильных микромицетов был выделен ряд соединений пептидной природы разнообразных структурных типов: новое семейство циклических пептидов небольшого размера (1–5), серия дикетопиперазинов и родственных соединений (6–21), а также два типа линейных пептидов с выраженной цитотоксичностью (22–25, 26). Данные о биологической активности соединений обобщены в табл. 1.
Таблица 1.
Данные о происхождении и биологической активности пептидных антибиотиков
| В. | Продуцент/вид | Происхождение/тип экстремофильности | Активность/ токсичность |
EC50, IC50, MIC | С. |
|---|---|---|---|---|---|
| 1–5 | Acremonium persicinum SCSIO 115 |
Морской | AV | EC50 8.7–16 μM (Herpes Simplex Virus) |
[36] |
| 6 | Penicillium sp. | Морской | CT AB |
IC50 23.0–50 μM (HCT-116, HepG2, MCF-7) | [37] |
| 7 | IC50 38.9–102 μM (HCT-116, HepG2, MCF-7) | ||||
| 8 | Penicillium sp. Penicillium sp. SCSIO 06720 |
Морской Глубоководный 4762 м |
CT AB |
IC50 94.0–114 μM (HCT-116, HepG2, MCF-7) MIC 0.10–0.13 μg/mL (Vibrio anguillarum) [58] |
[37] [59] |
| 9 | Penicillium crustosum HDN153086 | Антарктида | CT | IC50 12.7 μM (K562) | [40] |
| 10 | Aspergillus ochraceus | Морской | CT | IC50 3.0 μM (A2780) | [42] |
| 11 | Aspergillus sydowii SP-1 | Антарктида | AB | MIC 0.12–1.0 μg/mL (Staphylococcus aureus, MRSA, S. epidermidis, MRSE) | [44] |
| 12 | Penicillium chrysogenum MCCC 3A00292 | Глубоководный 2076 м |
CT | IC50 7.81–8.34 μM (BEL-7402, BIU-87K562) | [46] |
| 13 | Talaromyces purpurogenus | Морской | CT | IC50 8.29–9.71 μM (A-549, HL-60) [55] | [54] |
| 14 | Penicillium granulatum MCCC 3A00475 |
Глубоководный 2284 м |
CT AB |
IC50 19.5 μM (HepG2) | [47] |
| 15 | Качественная AB активность (Bacillus coagulans IMM 311, B. licbeniformis IMM 308, B. megateriurn DSM 32, B. subtilis IMM 313, B. cereus IMM 307, B. stearotberrnopbilus DSM 22, Mycobacterium pblei IMM 255, S. aureus IMM 257, Micrococcus luteus DSM 348, M. caseolyticus) [48] | ||||
| 16 | IC50 13–33.6 μM (BEL-7402, A-549, MOLT-4, HL-60) [49] | ||||
| 17 | IC50 7 μM (HepG2) | ||||
| 18 | Penicillium sp. TJ403-1 | Морской | CT | IC50 18.41–21.77 μM (A-549, HL-60) | [51] |
| 20 | Eurotium sp. SCSIO F452 |
Морской | CT | IC50 12.5–15.0 μM (SF-268, HepG2) | [53] |
| 21 | IC50 30.1–37.3 μM (HepG2, SF-268) | ||||
| 22 | Trichoderma velutinum | На высоте около 800 м над уровнем моря, Индия/ Психротолерант | CT | IC50 30 μM (A549) | [56] |
| 23 | IC50 2–30 μM (HL-60, MDA-MB-231, A549) | ||||
| 24 | IC50 16–17 μM (HL-60, MDA-MB-231, A549) | ||||
| 25 | IC50 4–7 μM (HL-60, MDA-MB-231, A549, LS-180) | ||||
| 26 | Emericellopsis alkalina | Озеро Желтырь, Кулундинская степь, Россия/ Галоалкалофил | CT AB AF |
EC50 2.8 μM (HepG2) | [57] |
| MIC 4–32.5 μg/mL (Bacillus cereus ATCC 14893, S. aureus FDA 209 P, Listeria monocytogenes EGDe) | |||||
| MIC2–4μg/mL (Candida sp., Aspergillus sp.) |
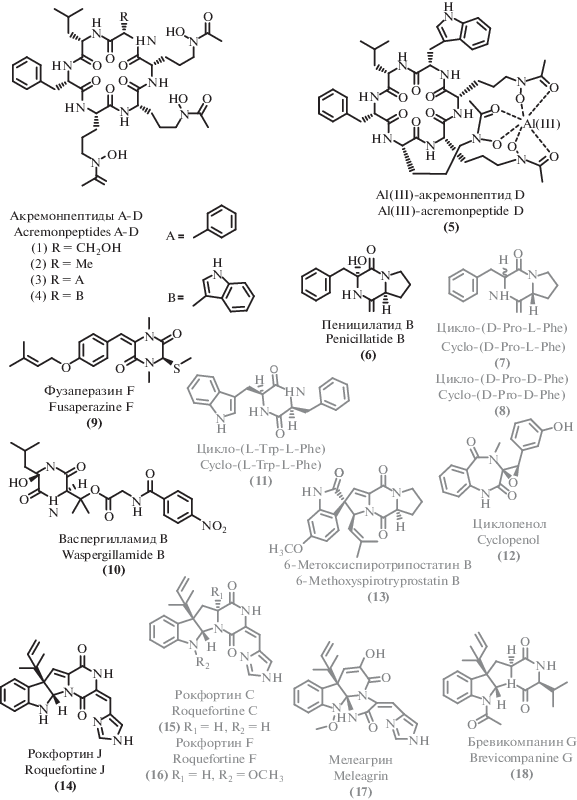
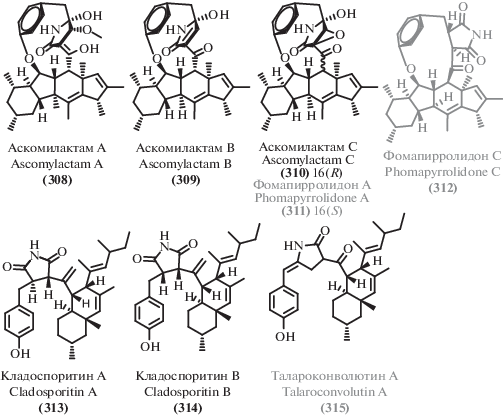
Циклические пептиды, названные акремонпептидами А–D (1–4), выделенные из морского микромицета [36], представляют собой природные сидерофоры. Хелатирующий структурный фрагмент молекул акремонпептидов имеет гидроксаматную природу и образован остатками N5-гидрокси-N5-ацетил-L-орнитина (рис. 2). Высокое сродство этих соединений к трехвалентным ионам металлов привело к выделению акремонпептида D также в виде комплекса с ионами алюминия(III) (5). Основной интерес представляет умеренная противовирусная активность, проявляемая акремонпептидами.
В последние годы экстремофильные микромицеты стали источником ряда новых соединений, относящихся к структурному классу дикетопиперазинов. Так, из морского гриба рода Penicillium [37] был выделен 2,5-дикетопиперазин, названный пенициллатид B (6), принадлежащий к семейству известных ранее пептидов, выделенных из других морских источников [38, 39]. Также недавно из экстремофильного микромицета [40] был выделен новый представитель семейства фузаперазинов – фузаперазин F (9), обладающий умеренной цитотоксичностью. Интересно, что выделенный вместе с ним известный аналог фузапераззин Е [41], отличающийся геометрией двойной связи, активности не проявил. Эти соединения являются типичными представителями структурных семейств антибиотиков, к которым относятся.
Дикетопиперазин васпердилламид В (10), содержащий необычную пара-нитробензойную группу был впервые получен при культивировании морского микромицета Aspergillus ochraceus [42].
Помимо новых соединений, был обнаружен ряд ранее известных активных метаболитов, относящихся к классу дикетопиперазинов, в том числе цикло-(D-Pro-L-Phe) (7) [38] и цикло-(D-Pro-L-Phe) (8) [39], для которых был уточнен спектр активности и обнаружена селективная цитотоксичность в отношении некоторых линий опухолевых клеток. Также была обнаружена антибактериальная активность известного дикетопиперазина цикло-(L-Trp-L-Phe) (11) [43], выделенного из психротолерантного микромицета [44]. Циклопенол (12), известный грибковый метаболит [45], выделенный из донного гриба вида Penicillium chrysogenum [46], проявил умеренную цитотоксическую активность.
Отдельного упоминания стоят выделенные представители класса дикетопиперазинов, имеющие алкалоидную природу. Химическое изучение вторичных метаболитов глубоководного донного микромицета Penicillium granulatum MC CC 3A00 475 [47] привело к обнаружению ранее неописанного дикетопиперазина, названного рокфортином J (14), наряду с 3 известными аналогами: нейротоксинами рокфортином С (15) [48]; рокфортином F (16) [49] и мелеагрином (17) [50]. Слабую цитотоксическую активность проявил выделенный из кораллового гриба Penicillium sp. TJ403-1 [51] известный дикетопиперазиновый алкалоид бревикомпанин G (18) [52], структурно напоминающий семейство рокфортинов.
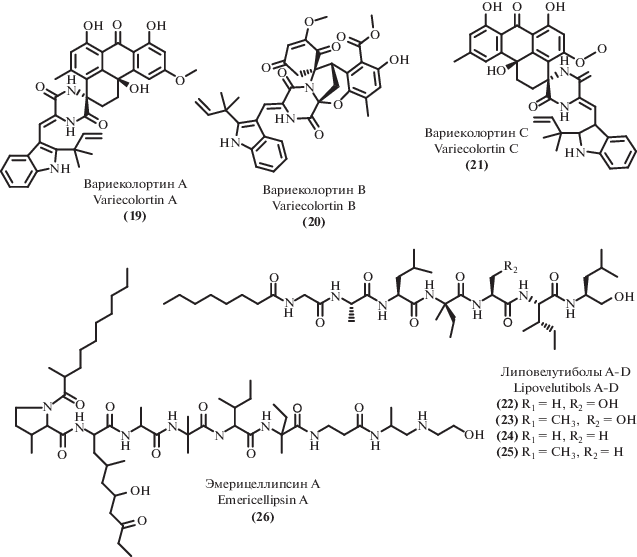
Три пары энантиомерных спироциклических дикетопиперазиновых алкалоида, названные вариеколортинами A–C (19–21, рис. 3), обладающие необычным спироциклическим скаффолдом, были выделены из морского микромицета Eurotium sp. SCSIO F452 [53].
Наряду с новыми терпеноидами, показавшими заметную активность, из культуральной жидкости штамма Talaromyces purpurogenus [54] были выделен дикетопиперазиновый алкалоид 6-метоксиспиротрипостатин B (13), ранее проявивший цитотоксическую активность [55].
Среди линейных пептидов пептаиболы (нерибосомные линейные олигопептиды с восстановленным С-концевым фрагментом, содержащие α-разветвленные аминокислоты – α-аминоизобутановую кислоту и/или изовалин) являются распространенным типом пептидных вторичных метаболитов микромицетов. В последние годы из экстремофильных микромицетов были выделены два новых представителя этого структурного типа – липовелутиболы A–D (22–25) [56] и эмерицеллипсин A (26) [57]. Особенностью липовелутиболов B (23) и D (25) является наличие непротеиногенной аминокислоты D-изовалина, наряду с отсутствием в их молекулах α-аминоизобутановой кислоты, ранее описанной во всех пептаиболах. Что особенно интересно, эти соединения проявляют более выраженную цитотоксическую активность, чем аналоги (23) и (25), содержащие α-аминоизобутановую кислоту (липовултиболы A и C). Еще один пептаибол, выделенный из экстремофильного микромицета, – эмерицеллипсин А (26), обладает заметной антифунгальной активностью наряду с выраженной цитотоксичностью. Интересной особенностью этого соединения является способность ингибировать образование бактериальных биопленок при практически полном отсутствии антибактериальных свойств.
2. ПОЛИКЕТИДЫ, КСАНТОНОИДЫ И РОДСТВЕННЫЕ СОЕДИНЕНИЯ
2.1. Хиноны
Поликетиды, которые можно отнести к хинонам, оказались достаточно широко представлены среди вторичных метаболитов экстремофильных микромицетов, выделенных за охваченный в данной работе период. Были выделены различные замещенные антрахиноны (27–29, 30–35, 38–41), димерные антрахиноны (42–44), серия периленхинонов (45–50, 37) и трициклических нафтохинонов (51–53). Данные об активности новых и известных хинонов обобщены в табл. 2.
Таблица 2.
Данные о происхождении и биологической активности хинонов
| В. | Продуцент/вид | Происхождение/тип экстремофильности | Активность/ токсичность |
EC50, IC50, MIC | С. |
|---|---|---|---|---|---|
| 27 | Aspergillus versicolor | Морской | CT АВ AF |
IC50 0.41–1.17 μg/mL (A549, SK-OV-3,
SK-MEL-2, XF498, HCT15) [84] MIC 6.25 μg/mL (Streptococcus pyogenes 308A) [84] |
[83] |
| 28 | IC50 3.04–3.88 μg/mL (A549, SK-OV-3,
SK-MEL-2, XF498, HCT15) [84] MIC 0.78, 3.13, 3.13, 3.13, 1.56 μg/mL (S. pyogenes 308A, S. pyogenes 77A, S. aureus SG511, S. aureus 285, S. aureus 503) [84] |
||||
| 29 | MIC 8–16 μg/mL (Bacillus subtilis) [85] MIC 16–32 μg/mL (Fusarium solani) [85] |
||||
| 42 | IC50 22.39 μg/mL (XF498) Качественная AB активность (S. aureus) |
||||
| 43 | Качественная AB активность (S. aureus) | ||||
| 44 | Aspergillus ochraceus | Морской | CT | IC50 5 μM (A2780) IC50 5.3 μM (L5178Y) |
[42] |
| 38 | Alternaria sp. (Р8) | Морские | AB AF |
MIC 3.91, 3.91, 7.81 μg/mL (P. syringae pv. lachrymans, Aphelenchus avenae, Erwinia carotovora) MIC 31.3 μg/mL (Pseudopestalotiopsis theae) |
[60] |
| 39 | MIC 15.6, 7.81, 7.81 μg/mL (E. carotovora,
P. syringae pv. lachrymans, A. avenae) MIC 31.3 μg/mL (P. theae) |
||||
| 51 | Fusarium napiforme | Мангровый | AB | MIC 6.3, 6.3 μg/mL (S. aureus NBRC 13276, P. aeruginosa ATCC 15442) | [93] |
| 52 | MIC 12.5, 6.3 μg/mL (S. aureus NBRC 13276, P. aeruginosa ATCC 15442) | ||||
| 53 | MIC 6.3, 6.3 μg/mL (S. aureus NBRC 13276, P. aeruginosa ATCC 15442) | ||||
| 40 | Aspergillus nidulans MA143 | Мангровый | AB | MIC 1, 32, 16, 4, 8, 1 μg/mL (E. coli, Micrococcus luteus, V. alginolyticus, V. anguillarum, Edwardsiella ictaluri, V. parahaemolyticus) | [63] |
| 41 | MIC 32, 16, 64, 1, 4, 32 μg/mL (E. coli, Micrococcus luteus, V. vulnificus, V. alginolyticus, Edwardsiella ictaluri, V. parahaemolyticus) | ||||
| 30 | Aspergillus versicolor | Глубоководный 2869 м |
AB CT |
MIC 3.9, 7.8, 31.3, 62.5, 15.6 μg/mL (MRSA ATCC 43300, MRSA CGMCC 1.12409, V. vulnificus MCCC E1758, V. rotiferianus MCCC E385, V. campbellii MCCC E333) | [61] |
| 31 | MIC 62.5, 31.3, 62.5, 125 μg/mL (MRSA ATCC 43300, MRSA CGMCC 1.12409, V. vulnificus MCCC E1758, V. rotiferianus MCCC E385, V. campbellii MCCC E333) | ||||
| 32 | MIC 62.5, 125, 62.5, 62.5, 125 μg/mL (MRSA ATCC 43300, MRSA CGMCC 1.12409, V. vulnificus MCCC E1758, V. campbellii MCCC E333, V. rotiferianus MCCC E385) | ||||
| 33 | IC50 1.3 μg/mL (PRL-3) [67] | ||||
| 34 | Aspergillus versicolor Penicillium sp. Cochliobolus lunatus Aspergillus fumigatus Aspergillus sydowii Penicillium sp. Aspergillus candidus Aspergillus sp. |
Глубоководный 2869 м Отложения горячего источника (45–65°C), Саудовская Аравия/Термофил Морской Морской Глубоководный 4950 м Морской Морской Морской |
AT AB CT |
MIC 1.25 μg/mL (BCG) [75] MIC 15.6, 15.6, 31.3, 62.5 μg/mL (MRSA ATCC 43300, MRSA CGMCC 1.12409, V. vulnificus MCCC E1758, V. campbellii MCCC E333, V. rotiferianus MCCC E385) [61] MIC 12.5 μg/mL (P. aeruginosa) [73] MIC 50 μg/mL (S. aureus, MRSA) [75] MIC 16.1, 15.4, 15.7 μg/mL (V. vulnificus MCCC E1758, S. aureus ATCC 43300 (MRSA), S. aureus CGMCC 1.12409 (MRSA)) [77] MIC 16, 64, 32 μg/mL (S. aureus ATCC 25923, E. faecalis ATCC 29212, S. aureus ATCC 25923) [71] IC50 2 μM (HTB-176) [73] IC50 1.7–5.6 μM (HepG-2, SGC7901) [76] IC50 27.1 μM (HeLa) [77] IC50 23.8–65.2 μM (HL-60, BEL-7402, A-549) [70] |
[61] [73] [76] [75] [77] [78] [79] [74] |
| 35 | Aspergillus sp. | Морской | СТ | IC50 73.2 μM (HL-60) [70] | [74] |
| 36 | Penicillium sp. ZZ901 | Морской | CT AB |
IC50 34.68 μM (клетки глиомы U87MG) IC50 30.22 μM (C6) |
[94] |
| 45 | Alternaria sp. SCSIO41014 | Морской | CT | IC50 8.75–26.58 μg/mL (K562, SGC-7901, BEL-7402) | [87] |
| 48 | IC50 19.67 μg/mL (K562) | ||||
| 49 | Alternaria sp. Alternaria alternata L3111' |
Морские | AB CT |
MIC 1.95μg/mL (Clavibacter michiganensis) [60] IC50 2.4–3.1 μg/mL (A-549, HCT-116, HeLa) [88] |
[60] [88] |
| 47 | Alternaria sp. SCSIO41014 Alternaria alternata L3111' |
Морские | AV | IC50 1.42–2.2 μM (HIV-1) [95] | [87] [88] |
| 50 | Alternaria sp. SCSIO41014 Alternaria sp. Alternaria alternata L3111' |
Морские | AF | MIC 7.81 μg/mL (P. theae) [60] MIC 125 μg/mL (A. brassicicola) [60] |
[87] [60] [88] |
| 37 | Aspergillus candidus KUFA0062 | Морской | AV | EC50 0.21, 0.02 μg/mL (Poliovirus type 2, Poliovirus type 3, Coxsackievirus type A21, Coxsackievirus type B4, Human rhinovirus type 2, Ross River virus, Herpes simplex virus type 1) [82] | [79] |
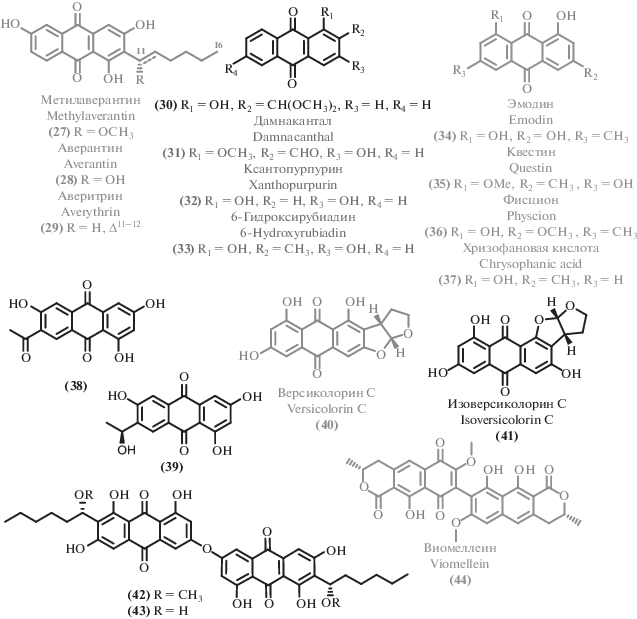
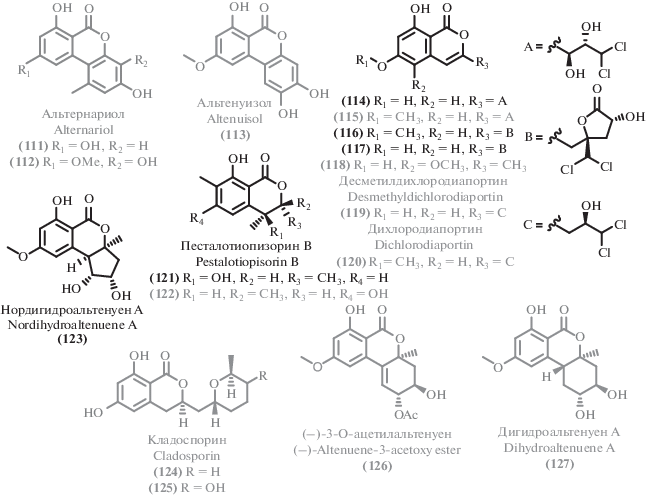
Среди новых и активных антрахинонов, следует отметить близкие по строению соединения (38) и (39), продуцент которых (Alternaria sp.) был выявлен в результате масштабного скрининга штаммов морского происхождения [60]. Несмотря на близость химических структур, соединение (38) проявило примерно в 4 раза меньшую антибактериальную активность, чем (39). При этом оба соединения проявили сходный умеренный уровень антифунгальной активности. Еще один новый антрахинон (30), выделенный из глубоководного микромицета [61], проявил заметную антибактериальную активность. Согласно молекулярному докингу, эти соединения способны ингибировать топоизомеразу IV и AmpC β-лактамазу. Интересным примером расширения химического пространства вторичных метаболитов и применения стратегии OSMAC (“One Strain – MAny Compounds”, “один штамм – множество соединений”, [62]) является получение нового антархинона изоверсиколорина С (41). Культивирование с применением этанольного стресса (добавка 0.1% этанола) мангрового гриба Aspergillus nidulans MA143 [63] привело к получению (41), наряду с близким аналогом – пигментом версиколорином С (40) [64].
Прочие выделенные антрахиноны оказались описанными ранее соединениями, для некоторых из которых была обнаружена или уточнена биологическая активность. Например, помимо нового антрахинона (30), из донного микромицета Aspergillus versicolor [61] были выделены дамнакантал (31) [65], ксантопурпурин (32) [66], 6-гидроксирубиадин (33) [67], эмодин (34) [68–72]. Эмодин (34) был выделен также и из множества других экстремофильных микромицетов: термофильного Penicillium sp. RO-11 [73], морских грибов рода Aspergillus [74, 75], морского Cochliobolus lunatus SCSIO41401 [76], глубоководного микромицета Aspergillus sydowii C1-S01-A7 [77], морского Penicillium sp. ZZ380 [78] и Aspergillus candidus KUFA0062 [79]. В некоторых случаях для эмодина (34) обнаружены новые типы биоактивности: цитотоксическая [76], противотуберкулезная [75]. Родственные эмодину известные антрахиноны квестин (35) [70], фиcцион (36) [80], хризофановая кислота (хризофанол) (37) [79, 81, 82] оказались существенно менее распространены.
Из культуральной жидкости морского штамма Aspergillus versicolor [83] были выделены димерные антрахиноны (42) и (43), содержащие необычную C–O–C эфирную связь. Эти новые биологически активные соединения проявили селективную антибактериальную активность против золотистого стафилококка. Также были выделены известные антрахиноны метилаверантин (27) [84], аверантин (28) [84], аверитрин (29) [85]. Еще одним примером димерного антрахинона является известный микотоксин – виомиеллеин (44) [86]. Источником этого соединения стал микромицет рода Aspergillus [42], выделенный из морской губки. Виомиеллин проявил высокую цитотоксичность в отношении линии клеток карциномы яичника человека A2780 и в отношении линии клеток мышиной лимфомы L5178Y.
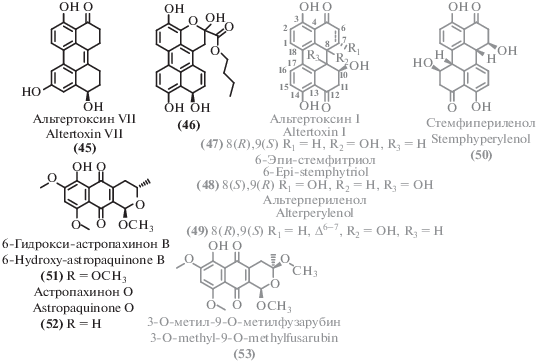
Изучение морских штаммов рода Alternaria (Alternaria sp. SCSIO41014 [87]; Alternaria sp. [60]; Alternaria alternata L3111′ [88]) привело к выделению ряда представителей структурного семейсва периленхинонов. В том числе, были выделены два новых периленхинона [87] альтертоксин VII (45) и новое производное (46), наряду с активными структурными аналогами: альтертоксином I (47) [89], стемфипериленолом (50) [60], 6-эпи-стемфитриолом (48) [90] и альтерпериленолом (49) [91]. Биологические свойства известных соединений были уточнены. Например, в исследовании [88] цитотоксические свойства проявил только альтерпериленол (49), но не его аналоги (47), (50). Тестирование цитототоксичности [87] показало заметную и селективную активность ранее описанного соединения 6-эпистемфитрола (48), что делает его перспективных для дальнейшего изучения в качестве противоопухолевого агента.
Еще одним струткурным семейством вторичных метаболитов экстремальных микромицетов оказались производные нафтохинона. Два новых нафтохиноновых производных 6-гидрокси-астропахинон B (51) и астропахинон D (52), наряду с известным 3-O-метил-9-O-метилфузарубином (53) [92], были выделены из культуральной жидкости мангрового эндофита Fusarium napiforme [93]. Выделенные соединения, помимо умеренной антибактериальной активности, проявили заметное фитотоксическое действие.
2.2. Хромоны, бензофеноны и ксантоны
Среди вторичных метаболитов экстремофильных микромицетов были обнаружены различные ароматические соединения, в том числе ксантоны (54–68) и дигидроксантеноны (69–71); хромоны и дигидрохромоны (72–84); димерные хромоны (85–89); бензохиноны (90–97) и ряд родственных соединений (98–110). Данные о происхождении и активности ароматических поликетидов обобщены в табл. 3.
Таблица 3.
Данные об активности и происхождении хромонов, бензофенонов и ксантонов
| В. | Продуцент/вид | Происхождение/тип экстремофильности | Активность/токсичность | EC50, IC50, MIC | С. |
|---|---|---|---|---|---|
| 54 | Aspergillus versicolor | Морской | CT | IC50 11.25–17.36 μg/mL (A-549, SK-OV-3,
SK-MEL-2, XF498) IC50 1.86–4.61 μg/mL (A-549, SK-OV-3, SK-MEL-2, XF498, HCT15) [84] |
[83] |
| 69 | Aspergillus versicolor MF160003 | Морской | AT | MIC 20 μg/mL (BCG) | [100] |
| 71 | MIC 40 μg/mL (BCG) | ||||
| 85 | Penicillium oxalicum | Морской | CT AB AF |
IC50 0.484–26.6 μM (BGC-823, SGC-7901, HGC-27, EC9706, KYSE450, CNE1, CNE2, SW620, SW480, LOVO, HuH-7,
PLC/PRF/5, SKHEP, A549, SKMES-1, SPC-A1, 95D,
Jeko-1, Raji, U937, A375, HFF, H22) MIC 3.1 μg/mL (Sarcina lutea ATCC 9341) [119] MIC 12.5 μg/mL (Bacillus subtilis CPI 219) [119] MIC 6.3 μg/mL (Corynebacterium diphtheria P.W.8) [119] MIC 12.5 μg/mL (Micrococcus flavus ATCC 10240) [119] MIC 1.6 μg/mL (Trichophyton metagrophytes IAM 8051) [119] |
[118] |
| 88 | Penicillium oxalicum Cladosporium sp. JS1-2 |
Морской Мангровый |
CT | IC50 0.833–24.1 μM (BGC-823, SGC-7901, HGC-27, EC9706, KYSE450, CNE1, CNE2, SW620, SW480, LOVO, HuH-7, PLC/PRF/5, SKHEP, A549, SKMES-1, SPC-A1, 95D Jeko-1, Raji, U937, A375, HFF, H22) | [118] [121] |
| 87 | Penicillium erubescens KUFA0220 | Морской | AB AF CT |
MIC 64.0, 64.0 μg/mL
(Enterococcus faecalis ATCC 29212, MRSA) MIC 12.5, 25.0, 12.5, 12.5 μg/mL (S. aureus ATCC 27154, E. coli ATCC 25922, Sarcina ventriculi ATCC 29068, P. aeruginosa ATCC 25668) [122] MIC 6.25, 6.25, 12.5 μg/mL (C. albicans ATCC 10231, A. niger ATCC 13496, F. oxysporum f. sp. cubense) [122] IC50 0.63, 1.05 μg/mL (KB, KBv200) |
[114] |
| 84 | MIC 64 μg/mL
(Enterococcus faecalis ATCC 29212) MIC 6.25, 6.25, 0.78, 6.25, 6.25, 3.13, 1.56, 3.13, 6.25 μg/mL (S. cerevisiae IFO 0203, C. albicans IFO 1061, C. utilis ATCC 42402, Schizosaccharomyces pombe IFO 0342, Hansenula anomala IFO 0136, Rhizopus chinensis IFO 4745, Mucor mucedo IFO 5776, Penicillium chrysogenum IFO 4626, A, niger ATCC 6275) [115] |
||||
| 102 | MIC 64 μg/mL
(Enterococcus faecalis ATCC 29212) LD99 0.1 μg/mL (NS-1) [129] |
||||
| 90 | Aspergillus sp. Penicillium citrinum HL-5126 |
Морской Мангровый |
AB CT AF |
MIC 7.53, 15.06, 30.12 μM (P. aeruginosa,
V. anguillarum, Aeromonas salmonicida) IC50 63.4, 83.1 μM (HL-60, BEL-7402) [70] MIC > 50 μg/mL (T. metagrophytes IFO-5811, Candida albicans IAM-4966, Pyricularia orysae IFO-5279, A. fumigatus IAM-2004, Helminthosporium sesamum IAM-5012) [125] |
[74] [124] |
| 91 | Pseudopestalotiopsis sp. PSU-AMF45 | Морской | AF | MIC 200μg/mL (Cryptococcus neoformans ATCC 90112) | [102] |
| 65 | MIC 200μg/mL (Cryptococcus neoformans ATCC 90112) | ||||
| 57 | Aspergillus sp. ZA-01 |
Морской | AB CT |
MIC 25 μM (V. parahemolyticus, V.anguillarum, V.alginolyticus) IC50 1.8 μM (A-549) [97] |
[96] |
| 58 | MIC 1.56, 1.56, 3.12 μM (V. parahemolyticus, V.anguillarum, V.alginolyticus) | ||||
| 59 | MIC 6.25, 25.0, 25.0 μM (V. parahemolyticus, V.anguillarum, V.alginolyticus) | ||||
| 60 | MIC 3.12, 25.0, 12.5 μM (V. parahemolyticus, V.anguillarum, V.alginolyticus) | ||||
| 61 | MIC 12.5, 25.0, 12.5 μM (V. parahemolyticus, V.anguillarum, V.alginolyticus) | ||||
| 62 | MIC 6.25, 6.25, 12.5 μM (V. parahemolyticus, V.anguillarum, V.alginolyticus) | ||||
| 63 | MIC 25.0, 6.25, 25.0 μM (V. parahemolyticus, V.anguillarum, V.alginolyticus) | ||||
| 72 | Penicillium sp. ZZ380 Penicillium citrinum SCSIO 41017 |
Морские | AF | Качественная AF активность (C. albicans, S. fimicola, A. furfuraceus) [109] | [78] [108] |
| 73 | Penicillium citrinum SCSIO 41017 | Морской | CT | IC50 16.0–46.4 μM (SF-268, MCF-7, HepG-2, A549) | [108] |
| 75 | Colletotrichum gloeosporioides | Мангровый | AB | MIC 12.5, 25.0, 25.0 μg/mL (B. cereus, B. subtilis, S. aureus) | [113] |
| 92 | Penicillium citrinum HL-5126 |
Мангровый | AB CT |
MIC 20.0 μg/mL (S. aureus) | [124] |
| 93 | IC50 15.7 μg/mL (A549) | ||||
| 97 | Nigrospora sphaerica | Мангровый | CT AB AF |
IC50 9.62 μM (HCT 116) MIC 4.0, 4.0, 4.0, 2.0, 2.0 μg/mL (B. subtilis UBC 344, B. subtilis TISTR 088, S. aureus ATCC 43300, B. cereus TISTR 688, MRSA ATCC 33591, E. coli UBC 8161, P. aeruginosa ATCC 27 853) MIC 2.0, 4.0, 8.0 μg/mL (C. albicans ATCC 90028, C. gloeosporioides UBC 3110, A. niger UBC 9214) |
[128] |
| 94 | Aspergillus sp. YQ-13 |
Осадок гидротермальных жерл, Куэйшаньтао, Тайвань/Термофил | AB | MIC 860.8, 40.93 μg/mL (P. aeruginosa, B. subtilis) | [126] |
| 95 | MIC 394.1, 191.67, 58.21, 58.21 μg/mL (P. aeruginosa, E. coli, B. subtilis, MRSA) | ||||
| 66 | Aspergillus sydowii C1-S01-A7 | Глубоководный 4950 м |
AB CT |
MIC 16.3, 16.1 μg/mL (MRSA ATCC 43300, MRSA CGMCC 1.12409) IC50 32.7 μM (HepG2) |
[77] |
| 67 | MIC 32.6, 31.8 μg/mL (MRSA ATCC 43300, MRSA CGMCC 1.12409) IC50 25.2–42.3 μM (A549, HepG2, HeLa) |
||||
| 68 | MIC 32.6 μg/mL (V. rotiferianus) | ||||
| 70 | IC50 1.5 μM (L5178Y) [107] | ||||
| 56 | IC50 37.7 μM (A549) | ||||
| 99 | Penicillium chrysogenum MCCC 3A00292 |
Глубоководный 2076 м |
CT | IC50 10.21 μM (BIU-87) | [46] |
| 55 | IC50 15.94 μM (BEL-7402) | ||||
| 80 | Penicillium sp. SCSIO 06720 | Глубоководный 4762 м |
CT AB AF |
IC50 11.7–99.0 μM (A375, A549, HeLa, HepG2, SW-620, L-02) [111] | [59] |
| 81 | MIC 10.4, 46.9 μg/mL (S. aureus ATCC 29213, MRSA-shh-1) | ||||
| 82 | IC50 40.0, 50.0 μg/mL (A549, HeLa) [112] | ||||
| 89 | Cochliobolus lunatus SCSIO41401 | Морской | CT AB |
IC50 41.3–47.9 μM
(SF-268, MCF-7, HepG-2, A549, 786-O) MIC 50.0, 25.0, 13.0 μg/mL (S. aureus, E. rhusiophthiae, P. multocida) IC50 31.36 μg/mL (L6) [123] IC50 8.07 μg/mL (P. falciparum NF54) [123] MIC 125.0, 62.5, 62.5, 62.5, 62.5, 250.0, 62.5, 125.0, 125.0, 125.0 μg/mL (B. cereus L. monocytogene, L. monocytogene, E. coli ATCC 8739, E. coli ATCC 8739, K. pneumoniae ATCC 11296, K. pneumoniae ATCC 11296, P. stuartii ATCC 29916, P. stuartii ATCC 29916, P. aeruginosa PA01, P. aeruginosa PA01) [123] IC50 0.633 μg/mL (L. donovani) [123] IC50 28.8 μg/mL (T. b. rhodesiense) [123] IC50 14.41 μg/mL (T. cruzi) [123] |
[121] |
| 109 | Penicillium pinophilum SCAU037 |
Мангровый | CT | IC50 0.2, 1.6 μM (HL-60, CCRF-CEM) [131] | [130] |
| 110 | IC50 20.0, 15.1 μg/mL (KB, KBv200) [132] | ||||
| 96 | IC50 60 μg/mL (HEp-2) [134] Качественная AF активность (R. solani RT23 R. solani RT20, F. solani (Mart.) Appel et Wollenw., Cylindrocladium scoparium Morgan, Alternaria alternata (Fries) Keissl.) [133] |
||||
| 79 | Cladosporium sp. OUCMDZ-302 | Мангровый | CT | IC50 40 μM (HL-60, SMMC-7721, A-549, MCF-7, SW480) [117] | [116] |
Таблица 4.
Данные о происхождении и биологической активности поликетидов различных структурных типов
| В. | Продуцент/вид | Происхождение/тип экстремофильности | Активность/ токсичность |
EC50, IC50, MIC | С. |
|---|---|---|---|---|---|
| 257 | Curvularia sp. | Морской | CT AB |
IC50 12.46 μM (BEL7402/5-Fu) MIC 62.5 μM (P. gingivalis) |
[219] |
| 161 | Zopfiella marina | Морской | AT AB CT |
MIC 25 μg/mL (M. tuberculosis H37Ra) MIC 12.5 μg/mL (B. cereus) IC50 13.6 μg/mL (Vero) |
[164] |
| 199 | Aspergillus fumigatus MF029 |
Морской | AB AT AF |
MIC 50, 50, 12.5, 1.25 μg/mL
(MRSA, S. aureus, B. subtilis) MIC 1.25 μg/mL (BCG) |
[75] |
| 240 | MIC 8, 32, 8, 16 μg/mL (Cryptococcus neoformans MY 1051, C.neoformans MY 1146, C. neoformans MY 2061, C. neoformans MY 2062) [207] MIC 128 μg/mL (C. albicans MY 1028, MY 1055, MY 1750) [207] MIC 128, 16, 128, 128 μg/mL (C. parapsilosis MY 1010, C. pseudotropicalis MY 2099, C. tropicalis MY 1012, S. cerevisiae MY 1976) [207] MIC 64 μg/mL (A. flavus MF 383) |
||||
| 201 | Aspergillus sp. | Морской | AB CT |
MIC 15.15, 30.30, 7.53 μM
(V. anguillarum, A. salmonicida, P. aeruginosa) IC50 3.56 – 10.69 μM (Jurkat, A549, HeLa) |
[74] |
| 248 | Aspergillus terreus S020 | Морской | CT | IC50 12.13, 22.53 μM (HCT-116, HepG2) IC50 1.1–66.8 μM (MCF-7, PANC-1, HepG2) [131] |
[226] |
| 111 | Alternaria sp. SCSIO41014 | Морской | CT AB |
EC50 1.7 µg/mL (L5178Y) [143] | [87] |
| 112 | EC50 7.8 µg/mL (L5178Y) [143] | ||||
| 155 | EC50 6.8 µg/mL (L5178Y) [143] EC50 0.67 μM (Soybean cell) [147] |
||||
| 126 | MIC 45μg/mL (S. aureus ATCC 25923) [146] | ||||
| 113 | IC50 85.4 μM (FabI S. aureus) [144] MIC 8–32μg/mL (S. aureus RN4220, S. aureus (MRSA) CCARM, S. aureus (QRSA) CCARM 3505, B. cereus KCTC 1661) [144] |
||||
| 127 | Качественная AB активность (S. aureus ATCC 29213, Bacillus subtilis ATCC 6051) [148] | ||||
| 147 | MIC 31.25μg/mL (S. aureus) MIC 17.1μg/mL (C. albicans ATCC 24433) [146] MIC 35.5μg/mL (Trichophyton rubrum 28189) [146] EC50 10 µg/mL (L5178Y) [143] |
||||
| 196 | Penicillium sp. ZZ901 | Морской | CT AB |
IC50 60.93 μM (клетки глиомы U87MG) IC50 60.81 μM (клетки глиомы C6) MIC 23, 35μg/mL (MRSA, E. coli) |
[94] |
| 197 | IC50 55.99 μM (клетки глиомы U87MG) IC50 44.65 μM (клетки глиомы C6) |
||||
| 198 | IC50 37.26 μM (клетки глиомы U87MG) IC50 23.24 μM (клетки глиомы C6) MIC 7, 9μg/mL (MRSA, E. coli) |
||||
| 207 | Penicillium sclerotiorum GDST-2013-0415 | Морской | AV | IC50 19.5–132 μM (HSV, EV71, RSV1) | [198] |
| 210 | Penicillium canescens | Морской | CT AF AB |
IC50 13.9 μM (L5178Y) | [176] |
| 211 | IC50 2.7, 8.9 μM (A2780, L5178Y) | ||||
| 200 | IC50 20, 35 μM (HeLa, SCC-114) [131] IC50 11.6 μg/mL (C. gloeosporioides) [195] IC50 2.68 μg/mL (A. solani) [195] |
||||
| 249 | IC50 8.9 μM (L5178Y) IC50 7.8–29.4 μM (POS1, AT6-1, L929) [217] MIC 111.1μg/mL (Agrobacterium tumefaciens, Clavibacter michiganensis subsp. michiganensis, Pectobacterium carotovorum subsp. carotovorum, Pseudomonas syringae pv. Actinidae, Xanthomonas arboricola pv. Pruni, X. axonopodis pv. citri) [218] MIC 37μg/mL (Acidovorax avenae subsp. cattlyae, Burkholderia glumae, X. euversicatoria, Streptomyces scabies) [218] MIC 12.3μg/mL (X. oryzae pv. oryzae) [218] |
||||
| 212 | Diaporthe sp. SCSIO 41011 | Мангровый | CT AP |
IC50 27–45 μM (ACHN, 786-O, -RC-2) | [200] |
| 214 | IC50 38, 44 μM (786-O, OS-RC-2) | ||||
| 215 | IC50 8.9–14 μM (ACHN, 786-O, OS-RC-2) | ||||
| 204 | IC50 10–38 μM (ACHN, 786-O, OS-RC-2) | ||||
| 216 | IC50 48, 4.9 μM (786-O, OS-RC-2) IC50 6.2–10.6 μg/mL (KB, NCI-H187, MCF-7) [201] IC50 7.8 μg/mL (Plasmodium falciparum) [201] |
||||
| 217 | IC50 8.5–30.2 μg/mL (KB, NCI-H187, MCF-7) [201] | ||||
| 205 | IC50 3.0–4.4 μM (ACHN, 786-O, OS-RC-2) | ||||
| 145 | Penicillium purpurogenum G59 | Морской | CT | IC50 124.3, 329.9μM (HL-60, K562) | [159] |
| 177 | Pseudopestalotiopsis sp. PSU-AMF45 | Морской | AF | MIC 200 μg/mL (Cryptococcus neoformans ATCC90112) | [102] |
| 178 | MIC 200 μg/mL (Cryptococcus neoformans ATCC90112) | ||||
| 136 | IC50 0.01 μM (HEP-G2) [154] | ||||
| 245 | Penicillium janthinellum | Морской | CT | GI50 9.3–31 μM (NUGC-3, HCT-15, NCI- H23, ACHN, PC-3, MDA-MB-231) | [208] |
| 139 | Curvularia sp. IFB-Z10 | Морской | CT | IC50 9.85, 2.46 μM (BEL7402, BEL7402/5-FU) | [155] |
| 124 | Penicillium piltunense KMM 4668 | Морской | CT AF |
IC50 71.74 μM (22Rv1) | [151] |
| 125 | IC50 30 μM (P. viticola) | ||||
| 252 | Cladosporium sp. OUCMDZ-1635 | Морской | CT | IC50 9.1–19.1 μM (MCF-7, HeLa, HCT-116, HL-60) | [220] |
| 255 | Aspergillus protuberus MUT 3638 | Морской | AB | MIC 30 μg/mL (S. aureus) | [222] |
| 148 | Colletotrichum gloeosporioides | Мангровый | AB | MIC 25, 12.5, 12.5, 12.5 μg/mL (B. cereus, B. subtilis, S. aureus, S. albus) | [113] |
| 166 | MIC 25 μg/mL (B. cereus, B. subtilis, S. aureus) | ||||
| 154 | Dothiorella sp. ML002 | Мангровый | AB CT AV |
MIC 50 μg/mL (S. aureus) | [165] |
| 151 | MIC 50 μg/mL (S. aureus) | ||||
| 149 | IC50 25–30 μg/mL (HEp-2, HepG2) [166] | ||||
| 153 | MIC 50 μg/mL (S. aureus) | ||||
| 160 | IC50 436–>600 μg/mL (S. epidermidis, E. coli, P. aeruginosa, M. smegmatis) [168] | ||||
| 150 | MIC 500 μg/mL (TMV) [227] | ||||
| 121 | Pestalotiopsis sp. | Мангровый | AB | MIC 12.5, 50 μg/mL (E. coli, P. aeruginosa) | [145] |
| 116 | Ascomycota sp. CYSK-4 | Мангровый | AB AF CT |
MIC 50 μg/mL (S. aureus, E. coli, Klebsiella pneumoniae) | [136] |
| 119 | MIC 25, 25, 25, 25, 50 μg/mL (S. aureus, B. subtilis, E. coli, K. pneumoniae, Acinetobacter calcoaceticus) | ||||
| 120 | MIC 25 μg/mL (S. aureus, B. subtilis) MIC 25–50 μg/mL (E. coli, Klebsiella pneumoniae, Acinetobacter calcoaceticus) MIC 150 μg/mL (R. solani) |
||||
| 115 | IC50 17.8 μg/mL (MCF-7) [137] IC50 39.6 μg/mL (HepG2) [137] |
||||
| 134 | Lasiodiplodia theobromae M4.2-2 | Мангровый | CT AB |
MIC 25, 25, 25 μg/mL (S. aureus ATCC 29213, S. aureus ATCC 700699 и E. faecium ATCC 35667) | [156] |
| 140 | IC50 7.3 μM (L5178Y) | ||||
| 142 | IC50 96.97 μM (HeLa) [157] GI50 1.67μM (HUVEC) [157] GI50 0.84μM (K-562) [157] MIC 26.03, 191.60 μM (A. terreus, F. oxysporum) [157] |
||||
| 143 | IC50 36.41 μM (HeLa) [157] GI50 0.07μM (HUVEC) [157] GI50 0.003μM (K-562) [157] MIC 49.7, 238.8 μM (A. terreus, F. oxysporum) [157] |
||||
| 118 | Phyllosticta сapitalensis | Мангровый | AB | MIC 25 μg/mL (P. aeruginosa) | [141] |
| 158 | MIC 25 μg/mL (P. aeruginosa) | ||||
| 247 | Cladosporium sp. JS1-2 | Мангровый | AB CT |
MIC 25, 25, 12.5 μg/mL (S. aureus, E. coli, B. cereus) | [121] |
| 170 | MIC 1.56, 12.5 μg/mL (S. aureus, M. luteus) | ||||
| 169 | MIC 6.25, 12.5 μg/mL (S. aureus, M. luteus) MIC 8–32 μg/mL (E. coli, V. harveyi, M. luteus) [173] IC50 4–14 μM (H446, A549) [173] |
||||
| 218 | Penicillium sp. ZZ380 Cladosporium sp. JS1-2 |
Морской Мангровый |
AB | MIC 6.25, 12.5, 12.5 μg/mL (S. aureus, E. coli, B. cereus) | [78] [121] |
| 208 | Penicillium pinophilum SCAU037 |
Мангровый | AB AF CT |
IC50 23.5, 2.6 μM (M. smegmatis, S. aureus) MIC 64 μg/mL (S. aureus) [203] MIC 8–64 μg/mL (S. cerevisiae PM503, C. albicans C43) [203] |
[130] |
| 138 | IC50 6.7–7.8 μM (Hep-2, RD) [161] | ||||
| 209 | IC50 62–68.8 μM (A549, BALL-1, HCT116, HeLa, NUGC-3) [202] IC50 90.4–99 μM (A549, BALL-1, HCT116, HeLa, NUGC-3) [202] |
||||
| 157 | Aspergillus sp. AV-2 |
Мангровый | CT | IC50 2.87 μM (Caco-2) | [170] |
| 241 | Fusarium solani H918 | Мангровый | AF | ED50 55 μM (P. theae) | [211] |
| 128 | Cladosporium cladosporioides MA-299 |
Мангровый | AB AF |
MIC 2 μg/mL (C. glecosporioides) MIC 1, 8 μg/mL (Edwardsiella tarda, E. ictarda) |
[152] |
| 129 | MIC 2, 8 μg/mL (C. glecosporioides, Bipolaris sorokiniana) | ||||
| 130 | MIC 2 μg/mL (C. glecosporioides) MIC 32 μg/mL (P. piricola Nose) MIC 1 μg/mL (Fusarium oxysporum f. sp. cucumerinum) |
||||
| 131 | MIC 1 μg/mL (C. glecosporioides) MIC 32 μg/mL (P. piricola Nose) MIC 32 μg/mL (Fusarium oxysporum f. sp. cucumerinum) |
||||
| 132 | MIC 1 μg/mL (E. ictarda) MIC 1 μg/mL (C. glecosporioides) MIC 32 μg/mL (P. piricola Nose) MIC 32 μg/mL (Fusarium oxysporum f. sp.cucumerinum) |
||||
| 224 | Совместное культивирование Penicillium crustosum PRB-2 и Xylaria sp. HDN13-249 |
Антарктида Мангровый |
AB | MIC 100 μM (B. subtilis) | [213] |
| 225 | MIC 6.25, 12.5 μM (M. phlei, V. parahemolyticus) | ||||
| 227 | MIC 25 μM (M. phlei) | ||||
| 228 | MIC 12.5, 25 μM (M. phlei, V. parahemolyticus) | ||||
| 246 | Penicillium sp. RO-11 |
Отложения горячего источника (45–65°C), Саудовская Аравия/Термофил |
AB CT |
MIC 9.3, 7.4 μg/mL (Enterobacter xiangfangensis, P. aeruginosa) | [73] |
| 162 | MIC 6.3, 5.7 μg/mL
(Escherichia fergusonii, P. aeruginosa) IC50 22 μM (HTB-176) |
||||
| 167 | Sarcopodium sp. FKJ-0025 | Глубоководный 200 м |
CT | IC50 47 μg/mL (Jurkat) | [169] |
| 168 | IC50 37–66 μg/mL (Jurkat, HL-60, Panc1) | ||||
| 233 | Cladosporium sp. OUCMDZ-302 | Мангровый | CT | IC50 10 μM (H1975) | [116] |
| 236 | Penicillium chrysogenum MCCC 3A00292 | Глубоководный 2076 м |
CT | IC50 7.70–13.75 μM (BIU-87, ECA109, BEL-7402) | [210] |
| 183 | Penicillium chrysogenum MCCC 3A00292 |
Глубоководный 2076 м |
CT AB AF |
IC50 16.41 μM (BIU-87) | [46] |
| 184 | MIC 200 μg/mL (E. coli) [179] MIC 50–200 μg/mL (B. subtilis, S. aureus, M. lysodeikticus) [179] MIC 19.531 μg/mL (S.aureus, S. saprophyticus, MRSA) [180] MIC 19.531, 156.25, 78.125 μg/mL (B. subtilis, B. cereus, Salmonella thyphimurium, Shigella sonneii) [180] |
||||
| 180 | IC50 9.95 μM (ECA109) MIC 39.062, 78.125, 39.062, 312.5 μg/mL (S.aureus, MRSA, B. subtilis, B. cereus, Salmonella thyphimurium, Shigella sonneii) [180] MIC ˂9.765 μg/mL (C. albicans) [180] |
||||
| 133 | IC50 12.95 μM (BEL-7402) | ||||
| 182 | Aspergillus sp. Pleosporales sp. SK7 |
Морской Мангровый |
CT | IC50 30.2–45 μg/mL (HepG2, HL-60, MOLT-3) [182] | [74] [186] |
| 250 | Penicillium chrysogenum MCCC 3A00292 |
Глубоководный 2076 м |
CT | IC50 12.49 μM (ECA109) | [46] |
| 251 | IC50 15.6 μM (ECA109) | ||||
| 122 | Penicillium sp. SCSIO 06720 | Глубоководный 4762 м |
CT AF |
IC50 18.9 μg/mL (K562) [149] | [59] |
| 256 | MIC 32, 32, 64 μg/mL (P. oryzae, C. albicans, A. niger) [221] | ||||
| 146 | Качественная AF активность (C. albicans, T. harzianum) [162] | ||||
| 181 | Penicillium
citrinum HL-5126 |
Мангровый | AB CT |
IC50 21.6 μg/mL (HeLa) | [124] |
| 219 | Penicillium
citrinum SCSIO 41017 |
Морской | CT AB AV |
IC50 13.0–49.3 μM (SF-268, MCF-7, HepG-2, A549) | [108] |
| 220 | IC50 16.1–55.4 μM (SF-268, MCF-7, HepG-2, A549) MIC 12.5 μg/mL (B. cereus ) [205] |
||||
| 221 | IC50 1.3–47.9 μM (SF-268, MCF-7, HepG-2, A549) | ||||
| 222 | IC50 16.41–115.3 μM (SF-268, MCF-7, HepG-2, A549) IC50 14.5 μM (EV71) [206] |
||||
| 137 | Penicillium citrinum SCSIO 41017 Aspergillus sydowii C1-S01-A7 |
Морской Глубоководный 4950 м |
AB | MIC 32.4 μg/mL (MR S. aureus ATCC 43300, MR S. aureus CGMCC) [77] | [108] [77] |
| 186 | Pleosporales sp. SK7 | Мангровый | CT | IC50 25.96 μM (MDA-MB-435) | [186] |
| 189 | Aspergillus sp. CUGB-F046 | Морской | AB CT AF |
MIC 3.125 μg/mL (S. aureus, MRSA) | [187] |
| 187 | MIC 6.25 μg/mL (S. aureus, MRSA) IC50 31.5–48.9 μM (HeLa, K562) [188] IC50 23.2–36.3 μM (PC3, A549, A2780, MDA-MB231, HEPG2) [189] MIC 32.0 μg/mL (C. albicans) [189] |
||||
| 188 | MIC 6.25 μg/mL (S. aureus, MRSA) IC50 29.8–31.6 μM (PC3, HEPG2) [189] MIC 8.0 μg/mL (C. albicans) [189] |
Таблица 5.
Данные о происхождении и биологической активности алкалоидов
| В. | Продуцент/вид | Происхождение/тип экстремофильности | Активность/ токсичность |
EC50, IC50, MIC | С. |
|---|---|---|---|---|---|
| 259 | Penicillium sp. ZZ380 | Морской | AB CT |
MIC 5 μg/mL (MRSA) IC50 11.32–29.1 μM (U87-MG, U251, SHG-44, C6) |
[229] |
| 258 | Penicillium sp. ZZ380 Penicillium erubescens KUFA0220 |
Морской Морской |
AB CT |
MIC 8, 16, 32, 8, 32 μg/mL
(E. faecalis ATCC 29212, E. faecium ATCC 19434,
S. aureus ATCC 29213, E. faecalis B3/101 (VRE),
E. faecium 1/6/63 (VRE)) [114] MIC 48.35 μM (M. tuberculosis H37Ra) [230] IC50 14.71–29.55 μM (KB, MCF-7, Vero) [230] |
[229] [114] |
| 260 | Penicillium sp. ZZ380 | Морской | CT AB |
IC50 10.03–22.12 μM (U87-MG, U251, SHG-44, C6) MIC 4.0, 5.0 μg/mL (MRSA, E. coli) |
[78] |
| 261 | IC50 9.95–22.39 μM (U87-MG, U251, SHG-44, C6) MIC 12.0, 3.0 μg/mL (MRSA, E. coli) |
||||
| 262 | IC50 15.76–26.64 μM (U87-MG, U251, SHG-44, C6) MIC 10.0, 11.0 μg/mL (MRSA, E. coli) |
||||
| 264 | IC50 8.93 – 22.82 μM (U87-MG, U251, SHG-44, C6) MIC 2.0, 3.0 μg/mL (MRSA, E. coli) |
||||
| 266 | IC50 1.06–8.52 μM (U87-MG, U251, SHG-44, C6) | ||||
| 267 | IC50 12.89–23.92 μM (U87-MG, U251, SHG-44, C6) MIC 19.0, 4.0 μg/mL (MRSA, E. coli) |
||||
| 268 | IC50 7.44–19.18 μM (U87-MG, U251, SHG-44, C6) MIC 4.0, 2.0 μg/mL (MRSA, E. coli) |
||||
| 292 | Совместное культивирование Aspergillus sulphureus и Isaria felina | Морские | CT | IC50 10.0 μM (22Rv1) | [240] |
| 299 | Aspergillus
alabamensis EN-547 |
Морской | AB | MIC 64.0, 32.0, 32.0, 64.0 μg/mL (E. coli, Ed. ictaluri, M. luteus, V. alginolyticus) | [234] |
| 300 | MIC 16.0, 64.0, 64.0 μg/mL (E. coli, Ed. ictaluri, M. luteus) | ||||
| 303 | MIC 32, 64, 32, 32 μg/mL (E. coli, Ed. ictaluri, M. luteus, V. alginolyticus) | ||||
| 328 | Aspergillus
candidus KUFA 0062 |
Морской | CT AB AF |
IC50 12.3–74.1 μM (HepG2, HT29, HCT116, A549, A375, MCF7, U251, T98G) MIC 32.0 μg/mL (S. aureus ATCC 29213, E. faecalis ATCC 29212) MIC 32 μg/mL (MRSA, VRE) MBC 64.0 μg/mL (VRE E. faecalis B3/101) MIC 3.1–25 μg/mL (Candida sp.) [236] MIC 1.6–12.5 μg/mL (T. menta SC2637, T. rubrum SC9199, M. canis SC9327, A. fumigatus SC 2100) [236] |
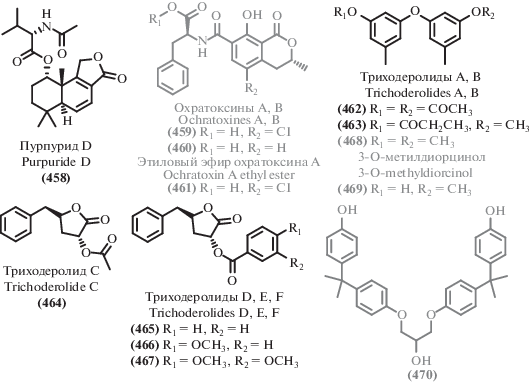
[79] |
| 329 | IC50 57.2–215.7 μM (HepG2, HT29, HCT116, A549, A375, MCF7, U251) | ||||
| 296 | IC50 73.2–212.5 μM (HepG2, HT29, HCT116, A549, A375, MCF7, U251) | ||||
| 295 | IC50 34.8–94.8 μM
(HepG2, HT29, HCT116, A549, A375, MCF7) IC50 33.2 μg/mL (NS-1 ATCC TIB-18) [235] |
||||
| 294 | IC50 28 μg/mL (NS-1 ATCC TIB-18) [235] | ||||
| 297 | IC50 43 μg/mL (NS-1 ATCC TIB-18) [235] | ||||
| 298 | IC50 72.9–146.4 μM
(HepG2, HT29, HCT116, A549, A375) IC50 59 μg/mL (NS-1 ATCC TIB-18) [235] |
||||
| 304 | IC50 26 μg/mL (NS-1 ATCC TIB-18) [235] | ||||
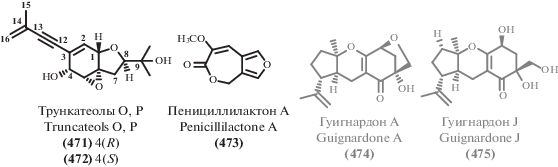
| 279 | Aspergillus sp. | Морской | CT | IC50 4.86–69.4 μM (PC-3, 22Rv1, LNCaP) | [231] |
| 291 | Aspergillus sp. SCSIO XWS03F03 | Морской | CT | IC50 3.1 μM (HL60) IC50 4.9 μM (LNCaP) |
[241] |
| 331 | Cladosporium sp. JS1-2 | Мангровый | AB | MIC 12.5 μg/mL (S. aureus) | [121] |
| 308 | Didymella sp. CYSK-4 | Мангровый | CT AT |
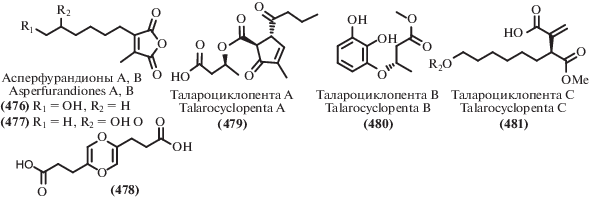
IC50 4.4–6.8 μM (MDA-MB-435, MDA-MB-231, SNB19, HCT116, NCI-H460, PC-3) | [244] |
| 309 | IC50 4.5–20.0 μM (MDA-MB-435, MDA-MB-231, SNB19, HCT116, NCI-H460, PC-3) | ||||
| 310 | IC50 4.2–7.8 μM (MDA-MB-435, MDA-MB-231, SNB19, HCT116, NCI-H460, PC-3) IC50 4.5–6.6 μM (MDA-MB-231, HCT116) |
||||
| 311 | IC50 12–29 μM (MDA-MB-435, MDA-MB-231, SNB19, HCT116, NCI-H460, PC-3) IC50 17.7 μM (Vero) [245] MIC 20.1–40.1 μg/mL (MABA, LORA) [245] |
||||
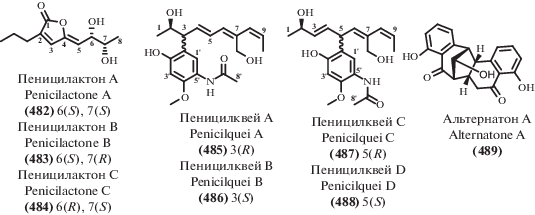
| 312 | IC50 19.4 μM (Vero) [245] MIC 5.2–13.4 μg/mL (MABA, LORA) [245] |
||||
| 314 | Cladosporium sp. HNWSW-1 |
Мангровый | CT | IC50 25.6–41.7 μM (BEL-7042, K562, SGC-7901) | [246] |
| 315 | IC50 14.9–26.7 μM (Hela, BEL-7042) | ||||
| 269 | Tolypocladium sp. | Почва шахты, Ляньюань, Китай | AB CT |
MIC 6.25, 25, 25, 6.25, 25, 6.25, 25 μg/mL
(Alternaria fragariae, Corynespora cassiicola, Alternaria alternate, Botrytis cinereal
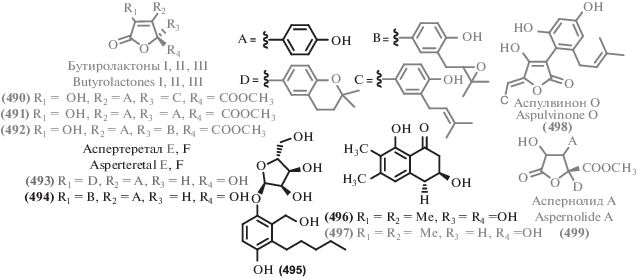
Pers, C. personata,
Verticillium dahliae Kleb, Sclerotinia sclerotiorum) MIC 25.0, 12.5 μg/mL (B. cereus, MRSA) IC50 16.32–37.8 μM (Huh7, LN229, HCT116, MGC803, A549, MDA231) |
[232] |
| 270 | MIC 25, 25, 50 μg/mL
(A. fragariae, B. cinereal Pers, C. personata) MIC 50 μg/mL (MRSA) IC50 56.35–128.5 μM (Huh7, LN229, HCT116, MGC803, A549, MDA231) |
||||
| 271 | MIC 25, 12.5, 50 μg/mL
(A. fragariae, C. cassiicola, C. personata) IC50 192.8–196.8 μM (Huh7, HCT116) |
||||
| 272 | MIC 50, 25, 50 μg/mL (A. fragariae, C. cassiicola,
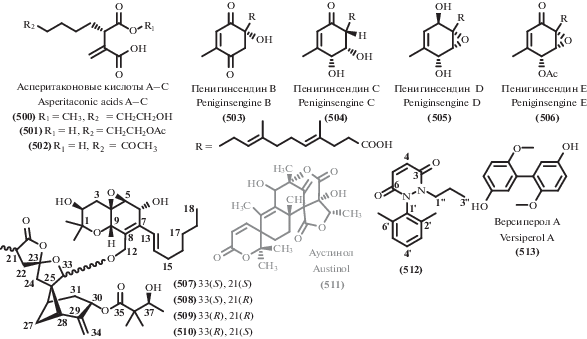
A. alternate), B. cinereal Pers, C. personata, V. dahliae Kleb, S. sclerotiorum) MIC 100.0 μg/mL (B. cereus) IC50 84.94–114.8 μM (Huh7, LN229, HCT116, MGC803, A549, MDA231) |
||||
| 273 | MIC 6.25, 12.5, 12.5 μg/mL
(A. fragariae, C. cassiicola, C. personata) IC50 198.6 μM (A549) |
||||
| 274 | MIC 25.0, 12.5 μg/mL (A. fragariae, C. cassiicola) IC50 54.29–157.2 μM (Huh7, LN229, HCT116, MGC803, A549, MDA231) |
||||
| 275 | MIC 6.25, 50, 25, 100 μg/mL (A. fragariae,
A. alternate, B. cinereal Pers, C. personata) IC50 39.94–154.1 μM (Huh7, LN229, HCT116, MGC803, A549, MDA231) |
||||
| 276 | MIC 25.0 μg/mL (C. personata),) MIC 12,5 μg/mL (B. cereus) MIC 25.0 μg/mL (MRSA, M. lysodeikticus, Bact. paratyphosum, B. subtilis, E. aerogenes, S. typhi, P. vulgaris) IC50 31.49–64.49 μM (Huh7, LN229, HCT116, MGC803, A549, MDA231) |
||||
| 277 | MIC 50 μg/mL (A. fragariae) MIC 100 μg/mL (B. cereus) IC50 50.95–129.1 μM (Huh7, LN229, HCT116, MGC803, A549, MDA231) |
||||
| 278 | MIC 25 μg/mL (A. fragariae) IC50 174.2 μM (A549) |
||||
| 332 | Aspergillus sydowii SP-1 | Антарктида | AB | MIC 4.0, 8.0, 32.0, 16.0 μg/mL (S. epidermidis, S. aureus, MRSA, MRSE) | [44] |
| 327 | Aspergillus sp. YQ-13 Aspergillus fumigatus |
Осадок гидротермальных жерл, Куэйшаньтао, Тайвань / Термофил Морской |
AB | MIC 8.75, 5.42, 19.67, 1.33, 11.91 μg/mL (P. aeruginosa, E. coli, S. aureus, B. subtilis, MRSA) | [126] [75] |
| 325 | MIC 21.13, 2.51, 3.72, 0.89, 6.25 μg/mL
(P. aeruginosa, E. coli, S. aureus, B. subtilis, MRSA) IC50 21.0–28.0 μM (SW1116, K562) [250] |
||||
| 283 | Aspergillus fumigatus SCSIO 41012 |
Глубоководный 3614 м |
AB AF |
MIC 12.5, 6.25, 25.0, 6.25, 12.5 μg/mL (A. baumanii ATCC 19606, A. baumanii ATCC 15122, Fusarium oxysporum f. sp. cucumerinu, S. aureus ATCC 16339, K. pneumonia ATCC 14578) | [237] |
| 284 | MIC 6.25 μg/mL (A. baumanii ATCC 19606) | ||||
| 286 | MIC 6.25, 12.5, 12.5, 12.5, 25.0 μg/mL (A. baumanii ATCC 15122, S. aureus ATCC 16339, Fusarium oxysporum f. sp. cucumerinu, S. aureus ATCC 29213, K. pneumonia ATCC 14578) | ||||
| 285 | MIC 12.5, 1.5, 0.78, 25.0 μg/mL (Fusarium oxysporum f. sp. cucumerinu, S. aureus ATCC 16339, S. aureus ATCC 29213, K. pneumonia ATCC 14578) | ||||
| 288 | MIC 50.0, 6.25, 12.5 μg/mL (A. baumanii ATCC 19606, A. baumanii ATCC 15122, Fusarium oxysporum f. sp. cucumerinu) | ||||
| 318 | Arthrinium sp. UJNMF0008 |
Глубоководный 3858 м |
AB CT |
IC50 11.4, 8.97 μM (M. smegmatis ATCC607, S. aureus ATCC25923) | [248] |
| 319 | IC50 42.8 μM (S. aureus ATCC25923) | ||||
| 320 | IC50 19.4, 8.37 μM (M. smegmatis ATCC607, S. aureus ATCC25923) | ||||
| 321 | IC50 35.3, 14.1 μM (M. smegmatis ATCC607, S. aureus ATCC25923) | ||||
| 324 | IC50 2.20, 1.66 μM
(M. smegmatis ATCC607, S. aureus ATCC25923) IC50 19.3, 11.7 μM (U2OS, MG63) [249] |
||||
| 330 | Penicillium pinophilum SCAU037 |
Мангровый | CT | IC50 15.1–20 μg/mL (KB, KBv200) IC50 44.3–80.8 μM (SW1116, K562, KB, HeLa) [252] |
[130] |
| 333 | Aspergillus sp. SCSIO41211 | Мангровый | CT | IC50 0.15–22.9μM (H1975, U937, K562, BGC823, MOLT-4, MCF-7, A549, HL60, Huh-7) | [254] |
| 305 | Eupenicillium sp. HJ002 | Мангровый | CT | IC50 1.5–23.3 μM (A549, HeLa, HepG-2) | [242] |
| 306 | IC50 18.6–47.2 μM (A549, HeLa, HepG-2) | ||||
| 302 | Aspergillus versicolor | Мангровый | CT | IC50 43.7 μM (HeLa) | [243] |
Таблица 6.
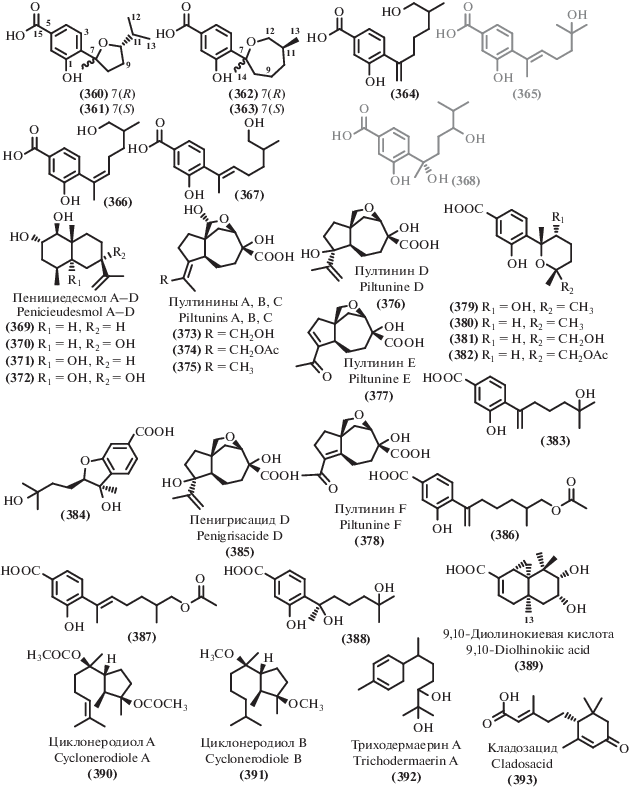
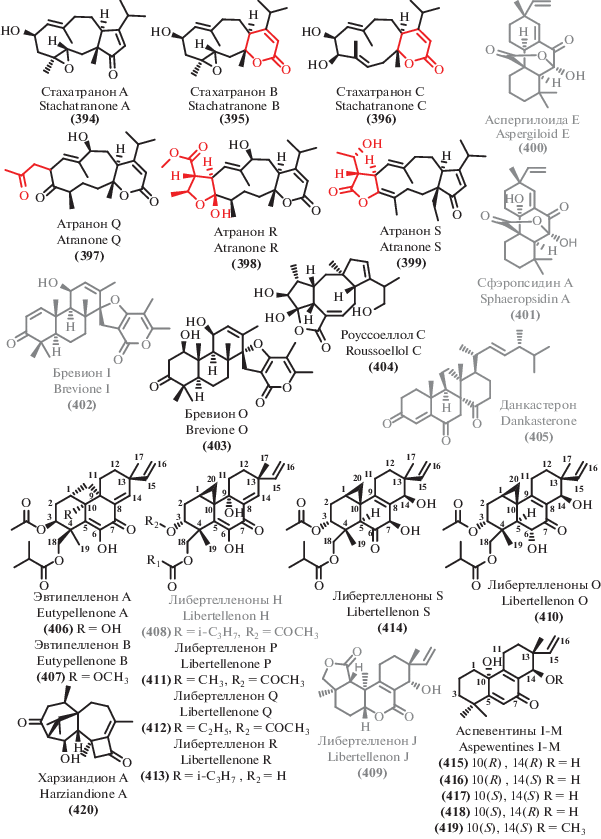
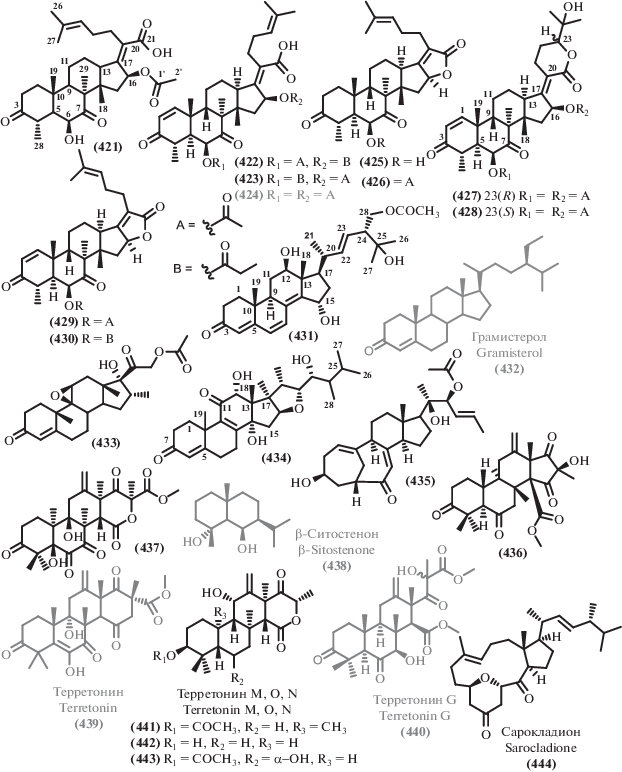
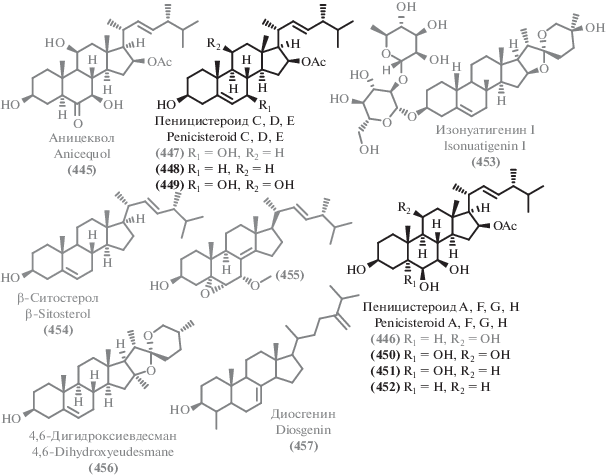
Данные о происхождении и биологической активности терпеноидов и родственных соединений
| В. | Продуцент/вид | Происхождение/тип экстремофильности | Активность/токсичность | EC50, IC50, MIC | С. |
|---|---|---|---|---|---|
| 454 | Aspergillus sydowii C1-S01-A7 |
Глубоководный 4950 м |
CT | IC50 50 μg/mL (HepG2) | [77] |
| 421 | Aspergillus
fumigatus SCSIO 41012 |
Глубоководный 3614 м |
AB AF |
MIC 50 μg/mL (A. baumanii ATCC 19606) | [237] |
| 435 | MIC 12.5, 3.125 μg/mL (A. baumanii ATCC 15122, K. pneumonia ATCC 14578) MIC 1.5 μg/mL (F.oxysporum f. sp. Momordicae) MIC 100 μg/mL (S. epidermidis) [281] MIC 100 μg/mL (Enterococcus durans) [281] |
||||
| 424 | Aspergillus
fumigatus
SCSIO 41012 Aspergillus fumigatus HNMF0047 |
Глубоководный 3614 м Морской |
AB | MIC 25, 12.5 μg/mL
(S. aureus ATCC 16339, 29213) [237] MIC 2, 4 μg/mL (MRSA ATCC 33591, B. subtilis UBC 344) [279] MIC 5.8 μg/mL (S. aureus) [280] MIC 4.6 μg/mL (P. aeruginosa) [280] MIC 16, 8 μg/mL (S. aureus, Streptococcus agalactie) |
[237] [282] |
| 422 | Aspergillus fumigatus HNMF0047 | Морской | AB | MIC 16 μg/mL (S. aureus, S. agalactie) | [282] |
| 423 | MIC 8, 2 μg/mL (S. aureus, S. agalactie) | ||||
| 395 | Stachybotrys chartarum | Морской | AB AF |
MIC 16 μg/mL (A. baumanii) | [271] |
| 397 | MIC 16 μg/mL (E. faecalis) MIC 32 μg/mL (MRSA) MIC 8 μg/mL (C. albicans) |
||||
| 401 | Aspergillus porosus | Морской | AB CT AF |
IC50 32.6, 35.3 μM
(S. aureus ATCC 25923, S. aureus ATCC BAA-41) IC50 4.9 μM (HCT-116 ATCC CCL-247) MIC 10–100 μg/mL (Botrytis cinerea, Seiridium cardinal,Seiridium cupressi,Colletotrichum acutatum,F. oxysporum, F. solani, Fusicoccum amygdule, Penicillium expansum, Pyrenochaeta lvcopersici, Sclerotinia minor, S. wlerotiorum, Verticillium dahliae) [272] IC50 6.74–10.68 μM (KB, SGC-7901, SW1116, A549) [273] |
[209] |
| 400 | IC50 71.6, 77.8 μM
(S. aureus ATCC 25923, S. aureus ATCC BAA-41) IC50 32.7 μM (HCT-116 ATCC CCL-247) |
||||
| 431 | Aspergillus
alabamensis EN-547 |
Морской | AB | MIC 32, 64 μg/mL (Ed. ictaluri, V. alginolyticus) | [234] |
| 338 | Aspergillus flocculosus | Морской | CT | IC50 0.14–0.24 μM (HCT-15, NUGC-3, NCI-H23, ACHN, PC-3, MDA-MB-231) | [255] |
| 339 | IC50 0.44–0.63 μM (HCT-15, NUGC-3, NCI-H23, ACHN, PC-3, MDA-MB-231) | ||||
| 340 | IC50 0.88–1.40 μM (HCT-15, NUGC-3, NCI-H23, ACHN, PC-3, MDA-MB-231) | ||||
| 341 | IC50 1.07–1.50 μM (HCT-15, NUGC-3, NCI-H23, ACHN, PC-3, MDA-MB-231) | ||||
| 342 | IC50 1.53–2.01 μM (HCT-15, NUGC-3, NCI-H23, ACHN, PC-3, MDA-MB-231) | ||||
| 345 | IC50 0.19–0.43 μM (HCT-15, NUGC-3, NCI-H23, ACHN, PC-3, MDA-MB-231) | ||||
| 346 | IC50 0.16–0.36 μM (HCT-15, NUGC-3, NCI-H23, ACHN, PC-3, MDA-MB-231) IC50 8 μM (CLL) [256] | ||||
| 343 | IC50 0.20–0.30 μM (HCT-15, NUGC-3, NCI-H23, ACHN, PC-3, MDA-MB-231) | ||||
| 344 | IC50 0.19–0.42 μM (HCT-15, NUGC-3, NCI-H23, ACHN, PC-3, MDA-MB-231) | ||||
| 389 | Talaromyces purpurogenus | Морской | CT | IC50 12.6–35.7 μM (HL-60, A549) | [54] |
| 404 | IC50 6.5–25.8 μM (SW480, HL-60, A549, MCF-7) | ||||
| 405 | IC50 7.9–23.8 μM (SW480, HL-60, A549, MCF-7) ED50 2.2 μg/mL (P-388) 10.1039/a903840j GI50 1.8–15.8 μM (38 Human cancer cell lines) [269] |
||||
| 402 | Penicillium sp. TJ403-1 | Морской | CT | IC50 4.92–8.6 μM (HL-60, A549, HEP3B) IC50 7.44–32.5 μM (MCF-7, A549) [275] |
[51] |
| 351 | Aspergillus ochraceus Jcma1F17 |
Морской | CT AV |
IC50 23–30 μM (ACHN, OS-RS-2, 786-O) | [257] |
| 349 | IC50 2.3–5.3 μM (ACHN, OS-RS-2, 786-O) | ||||
| 352 | IC50 11–14 μM (ACHN, OS-RS-2, 786-O) | ||||
| 350 | IC50 0.89–1.5 μM (ACHN, OS-RS-2, 786-O) IC50 2.11–6.35 μM (H1975, U937, K562, BGC823, Molt-4, MCF-7, A549, HeLa, HL60, Huh-7) [258] |
||||
| 353 | IC50 4.3–11 μM (ACHN, OS-RS-2, 786-O) IC50 1.95–17 μM (H1975, U937, K562, BGC823, Molt-4, MCF-7, A549, HeLa, HL60, Huh-7) IC50 17, 9.4 μM (H3N2, EV71) [258] |
||||
| 354 | IC50 20–30 μM (ACHN, OS-RS-2, 786-O) | ||||
| 347 | Cochliobolus lunatus SCSIO 41401 |
Морской | CT AB |
IC50 1.41–4.3 μM (ACHN, 786-O, OS-RC-2, HepG-2, SGC7901) | [76] |
| 348 | IC50 3.1–27 μM
(ACHN, 786-O, HepG-2, SGC7901) MIC 1.5–13 μg/mL (S. aureus, Erysipelothrix rhusiopathiae, Pasteurella multocida) |
||||
| 433 | Penicillium
citrinum SCSIO 41017 |
Морской | CT AF |
IC50 13.5–18 μM (SF-268, MCF-7, HepG-2, A549) | [108] |
| 439 | MIC 125–250 μg/mL (C. asianum, C. acutatum) | ||||
| 440 | Aspergillus terreus EN-539 | Морской | AB | MIC 32, 8 μg/mL (M. luteus, S. aureus) | [284] |
| 442 | Aspergillus terreus TM8 Aspergillus terreus LGO13 |
Почва Египта (оптимум роста 45–50°С)/ Термофил Морской |
AB AF |
MIC 250 μg/mL (S. aureus ATCC 6538-P, P. aeruginosa ATCC 27853) | [287] |
| 443 | MIC 250 μg/mL (S. aureus ATCC 6538-P,
B. cereus ATCC 11778, C. albicans ATCC 10231) Качественная AB активность (E. coli DSMZ 1058, B. subtilis DSMZ 704, P. agarici DSMZ 11810, M. luteus DSMZ 1605, S. warneri DSMZ 20036) [289] |
||||
| 386 | Aspergillus versicolor | Мангровый | CT | IC50 83.8 μM (HeLa) | [243] |
| 387 | IC50 53.5 μM (HeLa) | ||||
| 357 | Cytospora sp. | Мангровый | AB | MIC 233.3, 58.3, 58.3 μg/mL (MRSA, B. subtilis, P. aeruginosa) | [260] |
| 361 | Aspergillus sp. xy02 | Мангровый | AB | IC50 32.2 μM (S. aureus ATCC 25923) | [264] |
| 362 | IC50 36 μM (S. aureus ATCC 25923) | ||||
| 364 | IC50 41.9 μM (S. aureus ATCC 25923) | ||||
| 365 | IC50 33.4 μM (S. aureus ATCC 25923) MIC 256 μg/mL (B. subtilis) [265] |
||||
| 368 | IC50 36.3 μM (S. aureus ATCC 25923) MIC 8, 32 μg/mL (V. harveyi, V. parahemolyticus) [263] MIC 32 μg/mL (S. aureus, A. hydrophilia) [263] |
||||
| 370 | Penicillium sp. J-54 | Мангровый | CT | IC50 90.1 μM (K-562) | [266] |
| 410 | Eutypella sp. D-1 | Арктика | CT | IC50 2.2–6 μM (HeLa, MCF-7, HCT-116, PANC-1, SW1990) | [276] |
| 411 | IC50 1–3.6 μM (HeLa, MCF-7, HCT-116, PANC-1, SW1990) | ||||
| 412 | IC50 0.8–2.1 μM (HeLa, MCF-7, HCT-116, PANC-1, SW1990) | ||||
| 413 | IC50 26.6 μM (PANC-1) | ||||
| 414 | IC50 29.4 (HCT-116) | ||||
| 406 | IC50 10.3–13.1 μM (HeLa, MCF-7, HCT-116, PANC-1, SW1990) | ||||
| 407 | IC50 6–8.4 μM (HeLa, MCF-7, HCT-116, PANC-1, SW1990) | ||||
| 408 | IC50 0.3–1.8 μM (HeLa, MCF-7, HCT-116, PANC-1, SW1990) | ||||
| 409 | IC50 3.31–44.1 μM (U251, SW-1990, SG7901, MCF-7, Huh-7, HeLa, H460) [277] | ||||
| 358 | Aspergillus sydowii SP-1 Aspergillus sp. xy02 |
Антарктида Мангровый |
AB AF |
MIC 0.5, 1, 0.25, 0.5 μg/mL (S. aureus, MRSA, S. epidermidis, MRSE) | [44] [264] |
| 359 | MIC 0.5, 1, 0.25, 0.5 μg/mL
(S. aureus, MRSA, S. epidermidis, MRSE) [44] IC50 34 μM (S. aureus ATCC 25923) [264] MIC 0.5 μg/mL (S. aureus, V. parahemolyticus) [263] MIC 32 μg/mL (Gaeumannomyces graminis) [263] |
||||
| 446 | Penicillium
granulatum MCCC 3A00475 |
Глубоководный 2284 м |
СT AF |
IC50 8.2 μM (HepG2) [47] IC50 4.1–12.5 μM (A549, SHG-44, HepG2, BIU-87, ECA-109, Hela-S3, PANC-1, BEL-7402) [299] IC50 15–40 μg/mL (HeLa, SW1990, NCI-H460) [297] Качественная AF активность (Aspergillus niger) [297] |
[47] [299] |
| 453 | Penicillium
granulatum MCCC 3A00475 |
Глубоководный 2284 м |
CT | IC50 8.6 μM (HepG2) | [47] |
| 445 | IC50 1.2 μM
(DLD-1 cells on polyHEMA-coated) [298] IC50 40 μM (DLD-1 cells on uncoated plates) [298] |
||||
| 449 | Penicillium
granulatum MCCC 3A00475 |
Глубоководный 2284 м |
CT | IC50 5.5–8.3 μM (A549, SHG-44) | [299] |
| 451 | IC50 4.8–14.4 μM (A549, SHG-44, HepG2, BIU-87, ECA-109, Hela-S3, PANC-1, BEL-7402) | ||||
| 452 | IC50 4.4–9.2 μM (A549, HepG2, BIU-87, ECA-109, Hela-S3) | ||||
| 447 | IC50 4.4–9.9 μM
(A549, SHG-44, ECA-109, Hela-S3, PANC-1) Качественная AF активность (C. albicans ATCC 10231, S. cerevisiae ATCC 9080) [300] Качественная AB активность (S. aureus ATCC 6538-P, B. cereus ATCC 11778, B. subtilis ATCC 6633) [300] |
||||
| 385 | Penicillium griseofulvum | Глубоководный 1420 м |
CT | IC50 28.7 μM (ECA-109) | [267] |
| 415 | Aspergillus wentii SD-310 | Глубоководный 2038 м |
AB AF |
MIC 8, 32, 8, 8 μg/mL (E. tarda, P. aeruginosa, V. harveyi, V. parahaemolyticus) | [278] |
| 416 | MIC 32, 8, 8, 8 μg/mL (E. coli, E. tarda, V. harveyi, V. parahaemolyticus) | ||||
| 417 | MIC 32 μg/mL (Aeromonas hydrophilia, V. anguillarum) | ||||
| 418 | MIC 32, 32 μg/mL (E. tarda, V. harveyi) | ||||
| 419 | MIC 32, 32 μg/mL (V. anguillarum, V. harveyi) MIC 4 μg/mL (F. graminearum) |
||||
| 432 | Sarocladium kiliense | Глубоководный 5070 м |
CT | IC50 25.8 μM (HeLa-S3) | [290] |
| 438 | IC50 9.2 μM (HeLa-S3) | ||||
| 457 | IC50 44.2 μM (HeLa-S3) | ||||
| 456 | IC50 9.3 μM (HeLa-S3) | ||||
| 455 | IC50 30.1 μM (HeLa-S3) IC50 70 μM (A549) [293] |
Таблица 7.
Данные о происхождении и биологической активности соединений смешанного и неустановленного происхождения
| В. | Продуцент/вид | Происхождение/тип экстремофильности | Активность/ токсичность |
EC50, IC50, MIC | С. |
|---|---|---|---|---|---|
| 458 | Penicillium sp. ZZ1283 | Морской | AB AF |
MIC 4, 3 μg/mL (S. aureus, E. coli) MIC 8 μg/mL (C. albicans) |
[301] |
| 459 | Aspergillus ochraceus | Морской | CT | IC50 0.8–1.0 μg/mL
(BME-UV1, MDCK) [328] IC50 17–87 μM (IHKE) [329] IC50 0.3 μM (Hep G2) [330] |
[42] |
| 460 | IC50 3 μM (A2780) | ||||
| 461 | Aspergillus sp. SCSIO41211 | Мангровый | CT | IC50 0.031–23.2 μM (H1975, U937, K562, BGC823, MOLT-4, MCF-7, A549, Hela, HL60, Huh-7) | [254] |
| 463 | Trichoderma
erinaceum F1-1 |
Морской | CT | IC50 31.9 μM (MDA-MB-435) | [270] |
| 468 | IC50 12.5 μM (MDA-MB-435) | ||||
| 469 | IC50 41.4 μM (MDA-MB-435) | ||||
| 470 | IC50 22.3, 18.4 μM (MDA-MB-435, A549) | ||||
| 471 | Truncatella angustata | Морской | AV | IC50 39 μM (HIV-1) | [307] |
| 472 | IC50 16.1 μM (HIV-1) | ||||
| 473 | Penicillium sp. LS54. | Морской | AB | MIC 8 μg/mL (V. harveyi) | [308] |
| 476 | Aspergillus
versicolor DJ013 |
Морской | AF | MIC 64 μg/mL (G. graminis, C. neoformans, C. albicans) | [310] |
| 477 | MIC 64 μg/mL (G. graminis, C. neoformans, C. albicans) | ||||
| 478 | Cladosporium sp. JS1-2 | Мангровый | AB | MIC 25, 25, 12.5 μg/mL S. aureus, E. coli, B. cereus) | [121] |
| 479 | Talaromyces assiutensis JTY2 |
Мангровый | AB | MIC 20, 40 μg/mL (S. aureus, E. coli) | [311] |
| 480 | MIC 5, 2.5, 5, 2.5, 2.5, 1.25 μg/mL (M. tetragenus, S. aureus, S. albus, B. cereus, B. subtilis, E. coli) | ||||
| 482 | Penicillium sp. TGM112 | Мангровый | AB | MIC 6.25 μg/mL (S. aureus) | [312] |
| 485 | Penicillium herquei JX4 | Мангровый | AF | MIC 25, 50, 25, 100, 200, 50, 50, 50 μg/mL (Alternaria brassicicola, P. parasitica var. nicotianae, Colletotrichum capsici,B. oryzae, Diaporthe medusaea Nitschke, Ceratocystis paradoxa Mareau, P. theae, Alternaria citri) | [313] |
| 486 | MIC 25, 50, 25, 100, 100, 50, 25, 50 μg/mL (Alternaria brassicicola, P. parasitica var. nicotianae, Colletotrichum capsici,B. oryzae, Diaporthe medusaea Nitschke, Ceratocystis paradoxa Mareau, P. theae, Alternaria citri) | ||||
| 487 | MIC 50, 100, 25, 200, 200, 100, 50, 25 μg/mL (Alternaria brassicicola, P. parasitica var. nicotianae, Colletotrichum capsici,B. oryzae, Diaporthe medusaea Nitschke, Ceratocystis paradoxa Mareau, P. theae, Alternaria citri) | ||||
| 488 | MIC 50, 100, 50, 200, 200, 100, 50, 25 μg/mL (Alternaria brassicicola, P. parasitica var. nicotianae, Colletotrichum capsici,B. oryzae, Diaporthe medusaea Nitschke, Ceratocystis paradoxa Mareau, P. theae, Alternaria citri) | ||||
| 497 | Cladosporium sp. JJM22 | Мангровый | AB | IC50 20 μM (S. aureus, B. cereus,MRSA, E. coli,
V. alginolyticus, V. parahemolyticus) MIC 200 μg/mL (S. aureus, MRSA, M. gypseum SH-MU-4) [315] |
[314] |
| 490 | Aspergillus terreus LGO13 |
Морской | AB AF CT |
MIC 125, 250 μg/mL
(S. aureus ATCC 6538-P, B. cereus ATCC 11778) MIC 250 μg/mL (C. albicans ATCC 10231) 0.576–1mM (MCF-7/AGR, U251, SW620, H522, M14, SKOV3, DU145, A498) [316] |
[287] |
| 491 | Качественная AF активность
(C. albicans ATCC 10231) 0.626–1 mM (MCF-7/AGR, U251, SW620, H522, M14, SKOV3, DU145, A498) [316] |
||||
| 492 | MIC 250.0 μg/mL (B. cereus ATCC 11778) 0.16–1mM (MCF-7/AGR, U251, SW620, H522, M14, SKOV3, DU145, A498) [316] |
||||
| 498 | MIC 62.5, 250, 250 μg/mL (S. aureus ATCC 6538-P, S. cerevisiae ATCC 9080, B. cereus ATCC 11778) MIC 250 μg/mL (C. albicans ATCC 10231) |
||||
| 493 | Aspergillus terreus SCSIO FZQ028 | Глубоководный 1718 м |
AB | Качественная AB активность (S. aureus, B. thuringiensis, B. subtilis, E. coli) | [318] |
| 499 | Качественная AB активность (S. aureus, B. thuringiensis, B. subtilis, E. coli) | ||||
| 500 | Aspergillus niger | Морской | AB | MIC 16 μg/mL (S. aureus) | [322] |
| 501 | MIC 32 μg/mL (S. aureus) | ||||
| 502 | MIC 32 μg/mL (S. aureus) | ||||
| 513 | Aspergillus versicolor MCCC 3A00080 | Глубоководный 2721 м |
AB | MIC 8 μg/mL (S. aureus) | [321] |
| 474 | Phyllosticta capitalensis | Мангровый | AB | MIC 25.5 μg/mL (P. aeruginosa) [309] | [141] |
| 475 | MIC 50, 50 μg/mL (MRSA, P. aeruginosa) MIC 89.3 μg/mL (B. subtilis) [309] |
||||
| 507 | Eutypella sp. D-1 | Арктика | CT | IC50 7.3–17.1 μM (DU145, SW1990, Huh7, PANC-1) | [325] |
| 508 | IC50 4.9–11.0 μM (DU145, SW1990, Huh7, PANC-1) | ||||
| 509 | IC50 9.6–13.5 μM (DU145, SW1990, Huh7, PANC-1) | ||||
| 510 | IC50 7.5–13.4 μM (DU145, SW1990, Huh7, PANC-1) | ||||
| 511 | Penicillium sp. RO-11 | Отложения
горячего источника (45–65°C), Саудовская Аравия/Термофил |
AB CT |
MIC 1.4, 2.5, 0.13 μg/mL
(S. aureus, Escherichia fergusonii, P. aeruginosa) IC50 10 μM (HTB-176) |
[73] |
| 504 | Penicillium sp. YPGA11 | Глубоководный 4500 м |
AB | MIC 32, 8 μg/mL (S. aureus ATCC 43300, S. aureus ATCC 25913) | [327] |
| 505 | MIC 16 μg/mL (S. aureus ATCC 25913) | ||||
| 506 | MIC 64, 32 μg/mL (S. aureus ATCC 43300, S. aureus ATCC 25913) |
Ксантоны представляют собой распространенные антибиотические вторичные метаболиты микромицетов. Из различных экстремофильных источников был выделен ряд соединений этого класса (рис. 6).
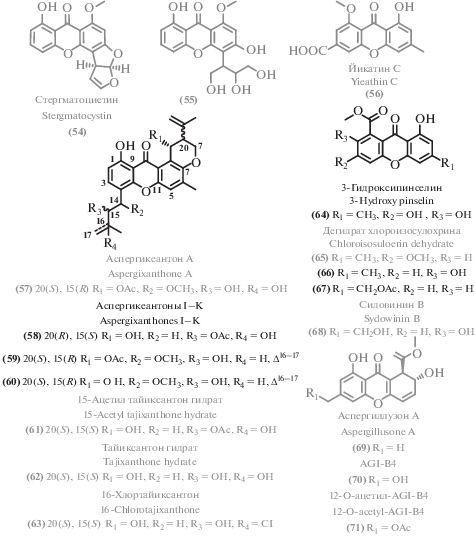
Из морского гриба рода Aspergillus [96] были выделены три новых антибактериальных пренилксантона аспергиксантоны I-K (58–60), а также четыре известных аналога: аспергиксантон А (57) [97], 15-ацетил тайиксантон гидрат (61), тайиксантон гидрат (62) [98] и 16-хлортайиксантон (63) [98, 99]. Наибольшую активность против изученных бактерий проявил новый аспергиксантон I (58). Еще одним новым вторичным метаболитом этого класса оказался 3-гидроксипинселин (64) [100], не проявивший антибиотической активности.
Некоторые экстремофильные микромицеты стали источниками известных ксантонов: 3,8-дигидрокси-4-(2,3-дигидрокси-1-гидроксиметилпропил)-1-метоксиксантон (55) [101] был выделен из донного гриба Penicillium chrysogenum MCCC 3A00292 [46]; первичное изучение метаболитов гриба рода Pseudopestalotiopsis [102] привело к выделению описанного ранее дегидрата хлороизосулохрина (65) [103]; из морского штамма Aspergillus versicolor [83] был получен известный ксантон – цитотоксический стергматоцистин (54) [84].
Глубоководный микромицет, Aspergillus sydowii C1-S01-A7 [77] является продуцентом двух новых соединений – 2-гидрокси-6-формил-вертиксантона (66) и 12-O-ацетил-сидовинина А (67), а также 22 известных соединений, в том числе имеющих антибиотическую активность: ксантонов сидовинина B (68) [104] и йикатина C (56) [105], их дигидропроизводных аспергиллузона А (69) [106] и AGI-B4 (70) [107]. Схожий спектр метаболитов был зафиксирован у морского гриба рода Aspergillus [100]: выделены 12-O-ацетил-AGI-B4 (71) [77] и аспергиллузон A (69) [106]. AGI-B4 (70) проявил заметную цитотоксичность и селективность по сравнению со структурными аналогами (например, O-ацилированными). Таким образом, ядро дигидроксиксантенона и свободная гидроксильная группа в положении С-12 являются обязательными структурными мотивами для обеспечения цитотоксической активности ксантонов этого типа (рис. 6).
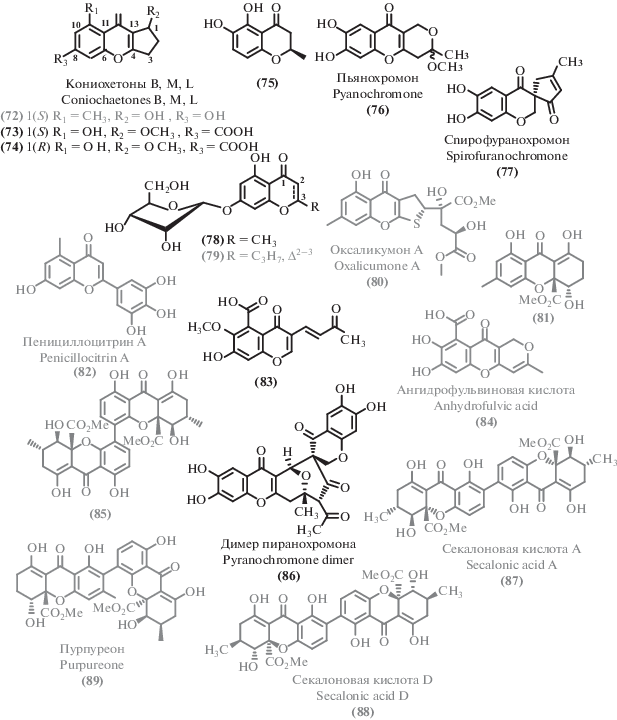
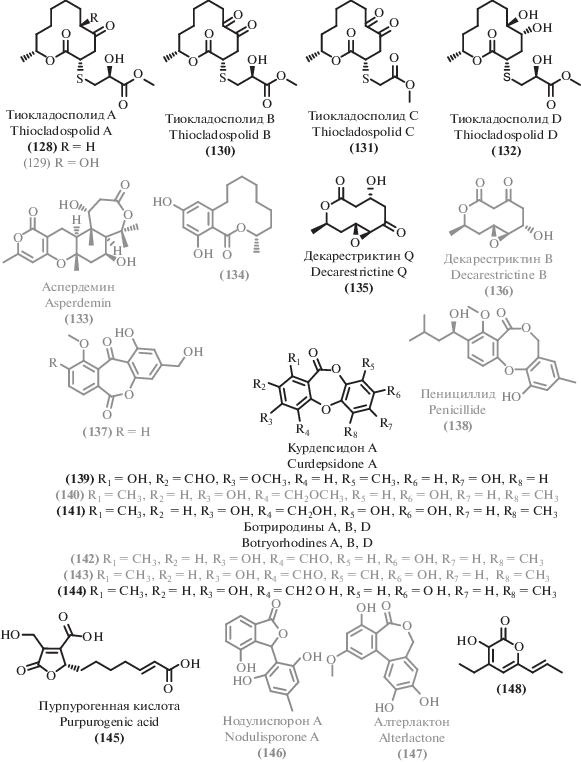
Помимо ксантонов, были выделены соединения, содержащие хромоновое ядро, в том числе и ранее неописанные. Так, из гриба морского происхождения [108] был выделен новый хромон кониохаэтон M (73), наряду с известным аналогом – кониохаэтоном В (72) [78], проявившим низкую активность [109, 110]. Из донного микромицета [59] был выделен новый хромон кониохаэтон L (74), а также ряд известных: оксаликумон А (80) [111], эфир β-диверсоноловой кислоты (81), пенициллоцитрин А (82) [112]. Среди трех новых поликетидов, выделенных из мангрового эндофита Colletotrichum gloeosporioides [113], был получен (2S)-2,3-дигидро-5,6-дигидрокси-2-метил-4H-1-бензопиран-4-он (75), проявляющий антибактериальные свойства. Еще один новый хромон псевдопесталон (98) был получен при первичном изучении упомянутого выше гриба рода Pseudopestalotiopsis [102]. Из морского гриба рода Penicillium [114] были выделены новые хромоны: пьянохромон (76), спирофуранохромон (77), 7-гидрокси-6-метокси-4-оксо-3-[(1E)-3-оксобут-1-ен-1-ил]-4H-хромен-5-карбоновая кислота (83), наряду с известной ангидрофульвиновой кислотой (84) [115].
Следует отметить также мангровый эндофит Cladosporium sp. [116], который стал источником нового гликозилированного хромона (78), наряду с известным ранее 7-O-α-D-рибозил-5-гидрокси-2-пропил-хромоном (79) [117], проявившим цитотоксические свойства.
Еще одним структурным семейством ароматических поликетидов, выделенных из экстремофильных грибов, являются димерные хромоны. Из новых соединений этого класса можно отметить выделенный из морского гриба рода Penicillium [114] неописанный ранее димер пиранохромона (86), не проявивший антибиотических свойств.
Что касается ранее описанных димерных хромонов, для некоторых из них были расширены данные о биологической активности. Так, для выделенного из морского микромицета рода Penicillium [118] 4,4'-связанного изомера секалоновой кислоты D (85), известного прежде всего своими бактерицидными свойствами [119], была обнаружена существенная цитотоксическая активность. Стереоизомер секалоновой кислоты D (88) [120], также проявивший цитотоксическую активность, был обнаружен в мангровом грибе рода Cladosporium [121]. Еще одно родственное соединение, секалоновая кислота А (87) [122], было выделено из морского гриба рода Penicillium [114]. Описанный ранее ксантон пурпуреон (89) [76, 123] проявил цитотоксическую активность [76].
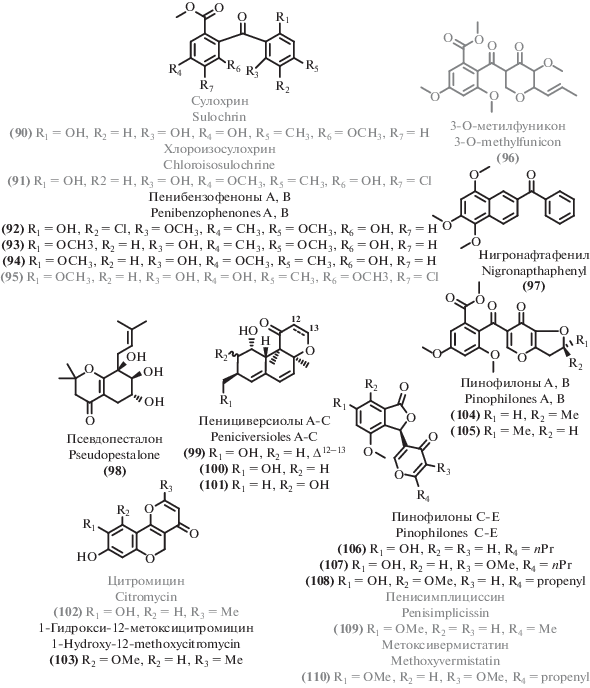
Наряду с описанными выше ксантонами и хинонами, при изучении вторичных метаболитов микромицетов обнаруживали структурно сходные соединения, прежде всего бензофеноны. Например, микромицет рода Penicillium мангрового происхождения [124] стал источником двух новых бензофенонов: антибактериального пенибензофенона А (92) и цитотоксичного пенибензофенона B (93), наряду с известным бензофеноном сулохрином (90) [70, 125].
Другим примером служит термофильный микромицет Aspergillus sp. YQ-13 [126], выделенный из гидротермальных источников. Он был изучен с точки зрения спектра вторичных метаболитов. Новое природное соединение – метиловый эфир 3-гидрокси-2-(2-гидрокси-6-метокси-4-метилбензоил)-5-метокси бензойной кислоты (94) – проявило низкую антибактериальную активность. При этом заметную активность проявил известный метаболит – 1,2-секо-трипацидин (95) [127].
Новый антибиотик, названный нигронафтафенилом (97), выделенный из магрового эндофита [128], проявил широкий спектр биологической активности, в том числе противовоспалительные свойства и способность к ингибированию альфа-глюкозидазы, что делает его перспективным для дальнейшего изучения.
Изучение некоторых экстремофильных микромицетов привело к выделению известных бензофенонов. Так, скрининг морских микромицетов на антибактериальную активность выявил штамм-продуцент шести известных метаболитов [74], в том числе и бензофенона сулохрина (90) [70, 125]. Еще один описанный бензофенон хлороизосулохрин (91) [103] был выделен при изучении вторичных метаболитов гриба рода Pseudopestalotiopsis [102].
Помимо новых бензофенонов, изучение вторичных метаболитов экстремофильных микромицетов привело к выделению ряда структурно близких соединений. Из морского гриба рода Penicillium [114] был выделен новый хромен 1-гидрокси-12-метоксицитромицин (103), наряду с известным аналогом цитромицином (102) [129].
Донный гриб Penicillium chrysogenum MCCC 3A00292 [46] продуцирует серию родственных соединений: ранее неописанные пенициверсиолы А–C (99–101), изученные в качестве цитотоксических агентов. Интересно, что цитотоксические свойства проявляет пенициверсиол А (99), но не пенициверсиолы B и С (100, 101).
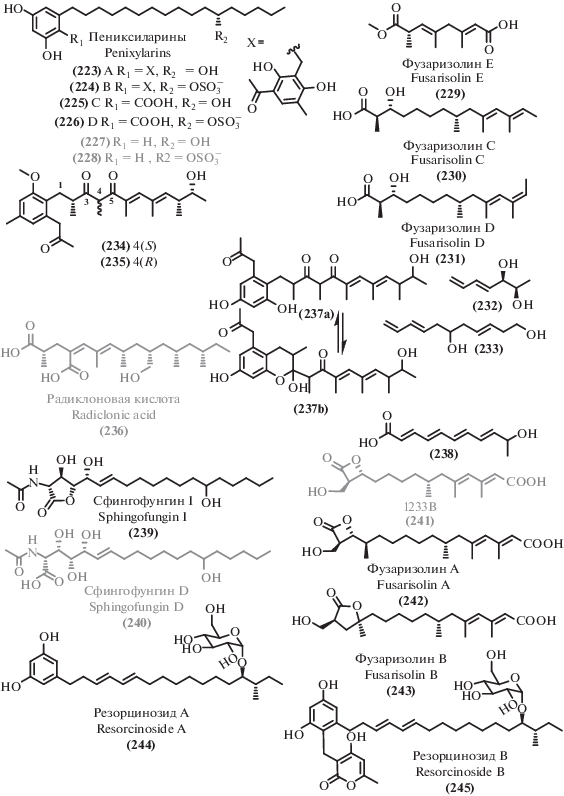
Пять новых производных фуникона, названные пинофилонами A-E (104–108) были выделены из почвенного мангрового продуцента Penicillium pinophilum SCAU037 [130] наряду с 18 биосинтетически родственными известными соединениями, некоторые из которых обладают высокой антибиотической активностью: пенисимплициссин (109) [131], метоксивермистатин (110) [132], 3-O-метилфуникон (96) [133, 134].
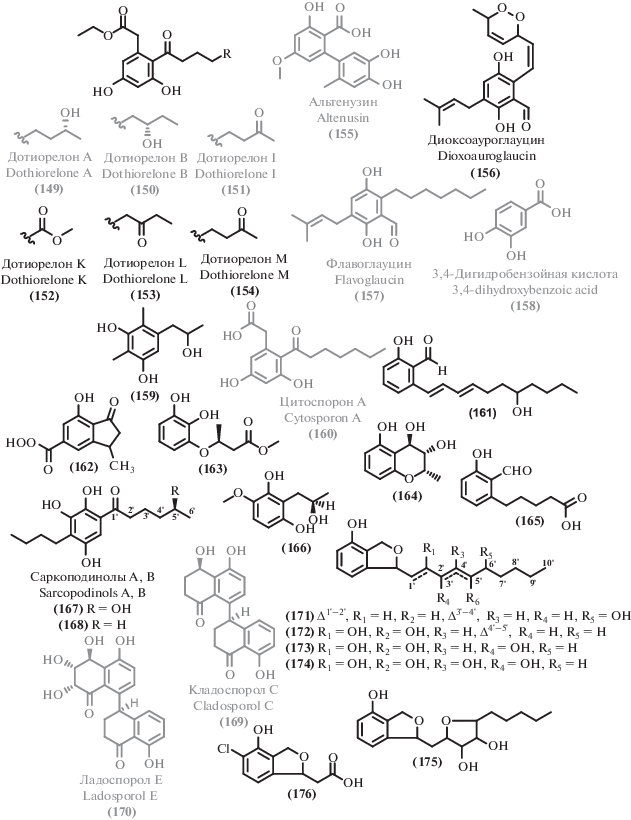
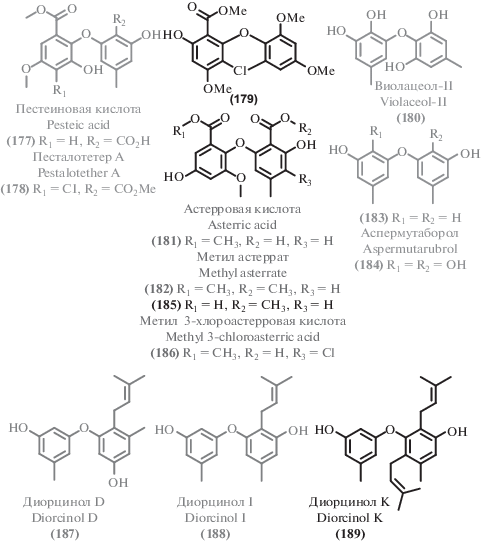
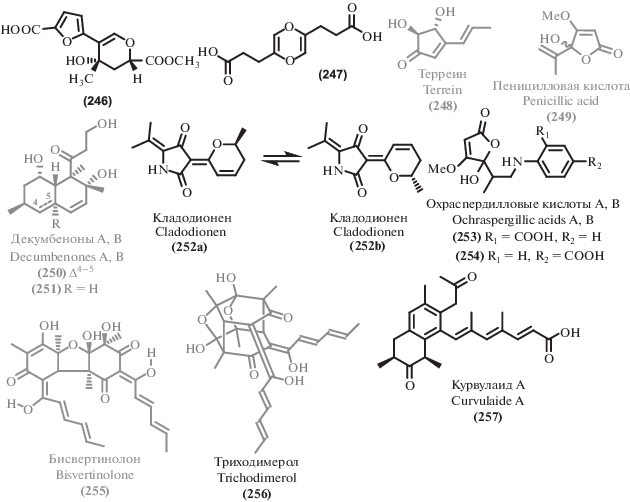
2.3. Прочие поликетиды
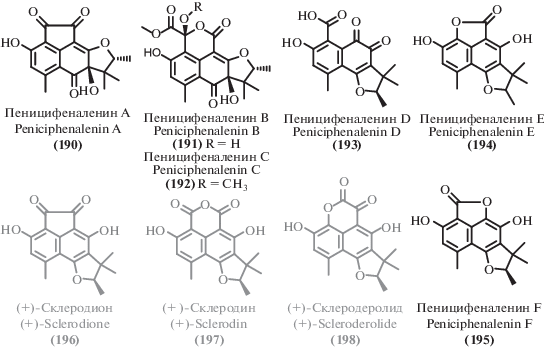
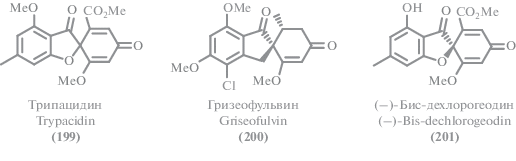
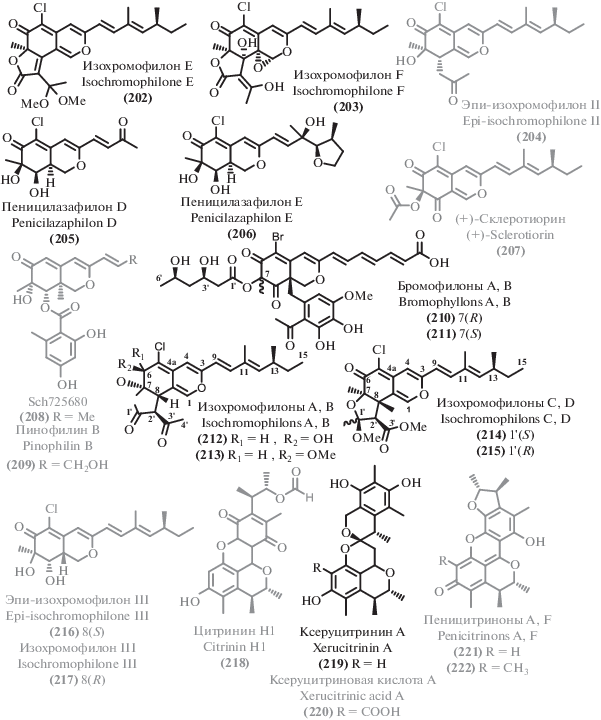
Помимо описанных выше соединений, экстремофильные микромицеты в изученный период стали источником ряда других поликетидов. Среди выделенных соединений можно выделить несколько структурных семейств. Из циклических сложных эфиров можно выделить изокумарины (111–120), дигидроизокумарины (121–127) и другие лактоны (128–148). Большая часть как новых, так и известных метаболитов можно отнести к фенолам и их производным (149–176), а также дифениловым эфирам (177–189). Из ароматических соединений существенное количество выделенных метаболитов относились к феналенонам (190–198), гризановым метаболитам (199–201) и азафилонам (202–222). Были получены также линейные поликетиды с различными боковыми цепями (223–245) и прочие поликетиды (246–257).
Изокумарины и их производные являются распространенными биоактивными метаболитами микромицетов [135]. Новые изокумарины были выделены также из мангрового миромицета Ascomycota sp. [136] – эндофита Pluchea indica. Этот штамм стал источником трех новых изокумаринов – дихлородиапортинтона (116), десметилдихлородиапортинтона (117) и десметилдихлородиапортинола (114), наряду с несколькими известными аналогами: дихлородиапортинолом (115) [137], десметилдихлородиапортином (119) [138], дихлородиапортином (120) [139, 140]. Прочие изокумарины, обладающие антибиотической активностью, оказались ранее описанными соединениями. Например, химическое изучение мангрового эндофита Phyllosticta capitalensis [141] выявило известное производное изокумарина, проявившее антибиотическую активность – 6,8-дигидрокси-5-метокси-3-метил-1H-изохромен-1-он (118) [142]. При изучении штамма Alternaria sp. SCSIO41014 [87] были получены изокумарины альтернариол (111) [143], 5-O-метиловый эфир альтернариола (112) [143], альтенуизол (113) [144].
Несколько новых соединений, выделенных из экстремофильных микромицетов, относятся к дигидроизокумаринам. Новое производное изокумарина, названное песталотиопизорин В (121), проявляющее умеренную антибактериальную активность, было выделено из штамма Pestalotiopsis мангрового происхождения [145]. Еще один новый дигидроизокумарин, нордигидроальтенуен А (123), был выделен при изучении штамма Alternaria sp. SCSIO41014 [87], наряду с известными биоактивными аналогами: (–)-3-О-ацетилальтенуеном (126) [143, 146], альтенузином (155) [147], дигидроальтенуеном А (127) [148]. Несколько известных дигидроизокумаринов были получены из других источников: из глубоководного микромицета [59] был выделен изокумарин (3R,4S)-6,8-дигидрокси-3,4,7-триметилизокумарин (122) [149]; кладоспорин (124) и 5′-гидроксиасперентин (125) [150] были выделенны из морского гриба [151].
Помимо производных изокумарина, при изучении экстремофильных микромицетов выделили серию лактонов различной природы (рис. 10). Из новых лактонов следует отметить четыре новых необычных серосодержащих соединения, которые были выделены из мангрового микромицета Cladosporium [152]. Лактоны были названы тиокладосполидами А-D (128, 130–132). Также был выделен схожий известный антибиотик панданголид 3 (129) [152, 153]. Сравнение данных ЯМР новых макролидов и известного панданголида 3 (129) позволило пересмотреть его структуру, уточнить сайт присоединения сульфидной боковой цепи. Еще один новый 10-членный лактон декарестриктин Q (135), аналог декарестриктина B (136) [154], был выделен из гриба морского происхождения рода Pseudopestalotiopsis [102]. Существенную цитотоксичность проявил еще один структурно оригинальный депсидон, выделенный из штамма морского проихождения рода Curvularia [155], названный курдепсидоном А (139). Новое приозводное депсидона, названное ботриродином I (141), наряду с 8 известными соединениями, было выделено из почвенного мангрового микромицета Lasiodiplodia theobromae M4.2-2 [156]. Были обнаружены еще несколько антибиотиков: антифунгальные и цитотоксические ботриродины A, B, D (142–144) [157], соединения (140), (134) [156, 158]. Мангровый эндофит Colletotrichum gloeosporioides [113] стал источником нового лактона (148), который проявил антимикробную активность.
Отдельно следует отметить подход к активации молчащих биосинтетических кластеров микромицетов: у мутантного штамма Penicillium purpurogenum G59, полученного действием диэтилсульфата, наблюдался биосинтез нового поликетидного цитотоксичного соединения, пурпурогеновой кислоты (145) [159].
Кроме новых соединений, был получен ряд ранее описанных лактонов, проявляющих биологическую активность. Из гриба морского происхождения [108] был выделен известный ароматический лактон 8-деметокси-10-метокси-вентихинон С (137) [77, 160]. 8-деметокси-10-метоксивентрихинон С (137) был выделен также из донного микромицета, Aspergillus sydowii C1-S01-A7 [77]. Еще несколько обнаруженных лактонов оказались ранее описанными соединениями: альтерлактон (147) [143], выделенный при изучении штамма Alternaria sp. SCSIO41014 [87]; антибиотический лактон пенициллид (138) [161], полученный из почвенного мангрового продуцента Penicillium pinophilum SCAU037 [130]; нодулиспорон А (146) [162], найденный при изучении глубоководного микромицета [59]; аспердемин (133) [163], выделенный из глубоководного гриба Penicillium chrysogenum MCCC 3A00292 [46].
Значительная доля антибиотических соединений, выделенных из экстремофильных микромицетов, представляет собой фенолы и их производные, многие из которых были описаны впервые (рис. 11). Исследование вторичных метаболитов штамма Zopfiella marina [164] морского происхождения позволило выделить ряд ранее неописанных соединений: два производных салицилового альдегида (161, 165), пять дигидроизобензофуранов (171–175) и 5-хлор-3-деоксиизоохрациновую кислоту (176). Из них только производное (161) проявило антибактериальную активность, в т.ч. и противотуберкулезную.
Спектр вторичных метаболитов мангрового гриба рода Dothiorella [165] включает ряд фенолов с антибиотической активностью, прежде всего оносящихся к структурному семейству дотиорелонов. Были выделены новые дотиорелоны K–M (152–154), а также известные производные цитоспорона: дотиорелоны A (149) [166], B (150), I (151) [167], цитоспорон А (160) [168].
Новые поликетиды саркоподинолы A, B (167, 168) были выделены из гриба Sarcopodium [169], обнаруженного в результате физико-химического скрининга 60 штаммов глубоководных микромицетов. Интересно, что соединение (168) проявило более широкий спектр цитотоксического действия, чем (167), что говорит о важности 5'-OH группы для реализации активности на некоторых клеточных линиях.
Разделение на основании биоактивности экстракта культуральной жидкости термофильного микромицета рода Penicillium [73], выделенного из горячего источника в Саудовской Аравии, привело к получению нового фенола (162). Из донного микромицета [59] был выделен 5-(2-гидроксипропил)-2,6-диметилрезорцин (159), не проявляющий биологической активности.
Мангровые эндофиты также оказались ценным источником биологически активных соединений этого типа. Так, из штамма Colletotrichum gloeosporioides [113], помимо упомянутого выше бензофенона (75) и лактона (148), был выделен новый поликетид (166). Мангровый эндофит Cladosporium sp. [116] стал источником серии новых фенолов (163, 164). Из мангрового гриба Aspergillus sp. AV-2 [170] был выделен новый пренилированный бензальдегид диоксоауроглауцин (156), а также ряд его известных аналогов, из которых флавоглауцин (157) [171], известный ранее прежде всего как антиоксидант, проявил выраженную цитотоксическую активность.
Также были выявлены описанные ранее фенолы. При изучении мангрового гриба рода Cladosporium [121] были получены известные поликетиды: кладоспорол E (170) [172], ранее не проявлявший заметной активности, и его более активный аналог кладоспорол C (169) [173]. Химическое изучение мангрового эндофита Phyllosticta capitalensis [141] выявило известный поликетид с антибиотической активностью – 3,4-дигидроксибензойную кислоту (158) [174, 175].
Помимо фенолов, были выделены родственные дифениловые эфиры (рис. 12), из которых несколько соединений было новыми. Культивирование Penicillium sp. – симбионта морской губки – позволило выделить новый хлорированный дифениловый эфир (179) [176].
Остальные дифениловые эфиры оказались известными соединениями. Изучение вторичных метаболитов гриба рода Pseudopestalotiopsis [102] выявило описанные поликетиды: пестеивую кислоту (177) и песталотетер А (178) [177]. Донный гриб Penicillium chrysogenum MCCC 3A00292 [46] продуцирует серию известных антибиотических поликетидов различной природы 3,3'-дигидрокси-5,5'-диметилдифениловый эфир (183) [178], аспермутаборол (184), также известный как виолацеол I [179, 180], виолацеол II (180) [180, 181], аспердемин (133) [163]. Скрининг морских микромицетов на антибактериальную активность выявил штамм-продуцент шести известных метаболитов [74], в том числе и поликетида метил астеррата (182) [182, 183]. Соответствующая астерровая кислота (181) [184] была выделена из культуральной жидкости микромицета рода Penicillium мангрового происхождения [124]. Близкие по структуре новый (185) и три известных поликетида (астерровая кислота (181) [184], метил астеррат (182) [182, 183], метил-3-хлороастерровая кислота (186) [185]) были выделены из мангрового гриба рода Pleosporales [186]. Из них заметную активность проявило только известное соединение (186).
Новый антибактериальный дифениловый эфир диорцинол K (189) был выделен из морского микромицета Aspergillus sp. CUGB-F046 [187], наряду с известными активными аналогами диорцинолами D, I (187, 188) [188, 189].
Феналеноны представляют собой довольно редкий класс природных соединений [190]. При изучении морского гриба рода Penicillium [94] были выделены шесть ранее неописанных производных феналенона (рис. 13) – пеницифеналенины A–F (190–195), не проявившие антибиотической активности. При этом известные структурные аналоги (+)-склеродин (197) [191], (+)-склеродеролид (198) [192], (+)-склеродион (196) [193], проявили умеренную цитотоксичность.
Описанные спироциклические метаболиты с гризановым скелетом были обнаружены в качестве вторичных метаболитов экстремофильных микромицетов (рис. 14). Упомянутый выше продуцент ряда бензофенонов и антрахинонов [74] морского происхождения, наряду с упомянутыми соединениями, синтезирует (–)-бис-дехлорогеодин (201) [194]. Этот ранее описанный метаболит проявил антибактериальную активность и умеренную цитотоксичность. Культивирование симбионта морской губки рода Penicillium [176] привело к выделению известного спироциклического антифунгального антибиотика гризеофульвина (200) [131, 195].
Из штамма рода Aspergillus [75] был выделен трипацидин (199), ранее известный высокой цитотоксической активностью [196]. Для трипацидина была выявлена противотуберкулезная активность [75].
Азафилоны предстявляют собой распространенный класс ароматических вторичных метаболитов грибов, обладающих широким спектром биологической активности [197]. Ряд представителей этого семейства, в том числе и новые галогенированные аналоги, был выделен из экстремофильных микромицетов (рис. 14). В рамках применения стратегии OSMAC, в среду для культивирования этого гриба рода Penicillium [176] добавили 5% NaBr, что позволило получить еще два бромированных азалофилона – бромофилоны А, В (210, 211). Стереоизомеры (210) и (211) содержат уникальный для азалофилонов структурный мотив – ароматическую боковую цепь. Интересно, что бромофилон B (211) оказался заметно более цитотоксичен, чем его изомер бромофилон A (210).
Одновременно ряд структурно родственных азафилонов был выделен из другого гриба рода Penicillium, также морского происхождения [198]. Новые выделенные соединения, названные пеницилазафилонами D и E (205, 206), не проявили заметной биологической активности. Ранее описанный (+)-склеротиорин (207) [199], напротив, продемонстрировал заметную противовирусную активность.
Еще одним источником галогенированных азафилонов оказался мангровый микромецет Diaporthe sp. SCSIO 41011 [200]. Из культуральной жидкости этого штамма были выделены шесть новых окисленных производных хлороазафилона, названных изохромофилонами A–F (212–215, 202, 203), наибольшую цитотоксическую активность проявил изохромофилон D (215). Наряду с новыми соединениями, был выделен ряд известных аналогов с антибиотической активностью: эпи-изохромофилон II (204) [200, 201] эпи-изохромофилон III (216) [201], изохромофилон III (217) [201]. Из почвенного мангрового продуцента Penicillium pinophilum SCAU037 [130] выделены известные азафилоны пинофилин B (209) [202] и Sch 725680 (208) [202, 203].
При изучении мангрового гриба рода Cladosporium [121] помимо новых соединений, был получен известный азафилоновый микотоксин цитринин H1 (218) [78, 204], представляющий собой спироциклический азафилон. Похожие соединения были получены из гриба морского происхождения [108]: был выделен новый поликетид ксеруцитринин А (219), ксеруцитриновая кислота A (220) [205], пеницитриноны A (221), F (222) [206].
Среди вторичных метаболитов экстремофильных микромицетов было обнаружено существенное число поликетидов линейного строения или содержащих длинные слаборазветвленные фрагменты, в том числе полиненасыщенные (рис. 16).
В результате системного скрининга морских микроорганизмов на антибактериальную активность был обнаружен штамм рода Aspergillus [75], продуцирующий сфингофунгин I (239), наряду с известными поликетидами, в том числе близким по структуре сфингофунгином D (240) [207]. Из гриба Penicillium janthinellum [208] были получены два новых гликозилированных алкилрезорцина – резорцинозиды А и B (244, 245) – первые представители структурного семейства резорцинолов, гликозилированные по алкильной, а не ароматической части молекулы. Замещенный резорцинол B (245) проявил выраженную цитотоксичность по отношению к целому ряду клеточиных линий, в том время как резорцинол А (244) практически неактивен (GI50 > 50 μM). Из культуральной жидкости штамма штамма Aspergillus porosus [209] морского происхождения были получены новые поликетидные метаболиты поросуфенолы A–D (234, 235, 237a, b). Два последних вещества при обычных условиях находятся в динамическом равновесии (линейная 237a и циклическая 237b формы). Психрофильный микромицет, выделенный из Антарктического региона, вида Penicillium crustosum HDN153086 [40] оказался продуцентом нового полиенового соединения необычной структуры (238), не проявивший биологической активности. Еще один известный линейный поликетид радиклоновая кислота (236) [210] был выделен из донного гриба Penicillium chrysogenum MCCC 3A00292 [46].
Мангровый микромицет рода Fusarium solani H918 [211], наряду с известным антибиотиком 1233B (241) [212], продуцирует серию ранее неописанных поликетидов, названных фузаризолинами A–E (242, 243, 229–231). Несмотря на отсутствие выраженной антибиотической активности, в молекулах этих соединений содержатся редкие структурные мотивы, такие как β- и γ-лактонные циклы в фузаризолинах А (242) и B (243) соответственно. Другой мангровый эндофит Cladosporium sp. [116] стал источником линейных поликетидов (232, 233).
Совместное культивирование двух микромицетов экстремофильного происхождения привело к необычному спектру биоактивных вторичных метаболитов. Из совместной культуры глубоководного гриба Penicillium crustosum PRB-2, выделенного из Антарктики, и мангрового гриба Xylaria sp. HDN13-249 [213] были выделены четыре новых алкилароматических поликетида, названные пениксиларинами А–D (223–226), а также два известных [214] биосинтетических аналога: 5-(12-гидроксигептадецил)резорцин (227) и 5-(12-сульфогептадецил)резорцин (228). Следует отметить, что соединения (223) и (224) биосинтезируются только при совместном культивировании двух продуцентов, в то время как метаболиты (225–228) могут производится монокультурой Xylaria sp., но в существенно меньших количествах.
Структуры прочих поликетидных вторичных метаболитов приведены на рис. 17, некоторые из которых были описаны впервые. Так, помимо новых галогенированных азафилонов культивирование симбионта морской губки рода Penicillium [176] привело к выделению известного микотоксина пеницилловой кислоты (249) [215–218]. Серия производных пеницилловой кислоты была выделена также из морского микромицета [42]. В соответствии со стратегией OSMAC, было проведено совместое культивирование этого микромицета с Bacillus subtilis. В результате получены два новых производных пеницилловой кислоты – охраспердилловые кислоты А и B (253, 254). Кроме того, была выделена и сама пеницилловая кислота (249).
Из морского микромицета рода Curvularia sp. был выделен новый макролид, названный курвуларидом А (257) [219], проявивший умеренную антибактериальную активность и цитотоксичность. Новый гибридный поликетид, названный кладионеном (252) [220], был выделен из другого гриба морского происхождения Cladosporium sp. OUCMDZ-1635. Кладионен (252) при нормальных условиях представляет собой равновесную смесь двух геометрических изомеров (252a, 252b). Кладионен (252) проявил выраженную цитотоксическую активность.
Разделение на основании биоактивности экстракта культуральной жидкости термофильного микромицета рода Penicillium [73], выделенного из горячих источников в Саудовской Аравии, привело к получению нового поликетида (246).
При изучении мангрового гриба рода Cladosporium [121] была получена новая активная 1,1'-диоксин-2,2'-дипропионовая кислота (247).
Был выделен также ряд известных антибиотиков различного строения. В том числе, из донного микромицета [59] был выделен триходимерол (256) [221]. Из морского психротолерантного гриба Aspergillus protuberus [222], отобранного в результате скрининга серии культивируемых полиэкстремофильных микроорганизмов Баренцева моря на антибактериальную активность, был выделен бисвертинолон (255), известный антибактериальный поликетид группы сорбициллоноидов [223].
Донный гриб Penicillium chrysogenum MCCC 3A00292 [46] продуцирует известные метаболиты декумбеноны A, B (250, 251) [224], которые были изучены в качестве цитотоксических агентов.
Изучение ряда изолятов микромицетов морского происхождения позволило выделить продуцент известного антибиотика терреина (248) [131, 225], обладающий высокой продуктивностью [226]. Отбор штаммов проводился на основе скрининга антимикробной и цитотоксической активности изолятов.
3. АЛКАЛОИДЫ
При изучении экстремофильных микромицетов было выделено более семидесяти гетероциклических соединений, которые можно отнести к алкалоидам.
Выраженную антибактериальную активность и цитотоксичность проявил новый биосинетический аддукт двух известных фунгальных метаболитов GKK1032B (258) [228] с производным фенола А, названный пениципирродиэфиром А (259) [229]. Интересно, что GKK1032B (258) был выделен и из другого морского микромицета Penicillium erubescens KUFA0220 [114, 230] и также оказался наиболее активным антибиотическим вторичным метаболитом из перечисленных. Из морского гриба Penicillium sp. ZZ380 [78] были выделены 7 новых пирроспиронов С–I (260–268), имеющих похожее строение. При этом разница в биологической активности выделенных пирроспиронов существенна. Так, выраженной цитотоксичностью в отношении 4 клеточных линий обладает только пирроспирон G (266). Антибактериальную активность, в том числе в отношении резистентных грамположительных и грамотрицательных бактерий, проявляют пирроспироны C (260), F (264), I (267).
Экстремофильные микромицеты стали источником ряда алкалоидов, содержащих индоловое ядро и его производные (рис. 19, 20).
Алкалоиды индол-дитерпенового типа (рис. 19) были выделены из микромицетов различного происхождения. Морской гриб рода Aspergillus [231] стал источником четырех новых алкалоидов индол-дитерпенового типа, названных аспериндолами A–D (279–282), только один из которых проявил цитотоксическую активность (279). При изучении штамма Tolypocladium sp. XL115 [232], выделенного из почвы угольной шахты, были получены десять новых пренилированных дитерпеновых алкалоидов, названных толипокладинами A–J (269–278), два из которых проявили существенную противомикробную активность (269, 276).
Структуры прочих индоловых алкалоидов обобщены на рис. 20. Два новых алкалоида 4-эпи-секо-шортфинововую кислоту А (300) и ее метиловый эфир (299), наряду с известным биосинтетически связанным аналогом шорфернином А (303) [233], содержащим редкий дикетоморфолиновый мотив, были выделены из эндофита морских водорослей [234].
Ранее неописанные алкалоиды, кандидусин D (296) и преуссин C (329) были выделены из морского гриба Aspergillus candidus KUFA0062 [79] вместе с родственными соединениями, из которых только петромурин С (295) [235] и преуссин (328) [236] ранее проявляли заметную активность. Прочие соединения демонстрировали слабую цитотоксичность: диметиловый эфир астериквинола D (296), кумбицины A, B, D (327, 298, 304) [235].
Глубоководный микромицет Aspergillus fumigatus SCSIO 41012 [237] оказался источником большого числа антибиотических вторичных метаболитов. Были выделены два новых алкалоида, названные фумигатозидом E (283) и F (284), наряду с их ранее описанными структурными аналогами фумикиназолинами C (285) и G (286) [238]; эпи-асзоналенином A (288) [239].
Интересным примером, помимо вышеупомянутого [213], успешного применения совместного культивирования для диверсификации спектра вторичных метаболитов микромицетов является выделение пяти новых индоловых алкалоидов: 17-гидроксинотоамида D (287), 17-O-этилонотоамида M (292), 10-O-ацетилсклеротиамида (289), 10-O-этилсклеротиамида (290) и 10-O-этилнотоамида R (293) при совместном культивировании двух морских микромицетов [240].
Изучение взаимосвязи стурктуры и цитотоксической активности нового индольного алкалоида миссзртина А (291), выделенного из морского Aspergillus sp. SCSIO XWS03F03 [241], показало существенное влияние функционализации индольного азота на реализацию биологических свойств.
Оригинальные индольные дитерпены, пеницилиндолы А–С (305–307), были выделены из мангрового гриба Eupenicillium sp. HJ002 [242]. Пенициллиндолы А (305) и B (306), не содержащие дополнительного цикла, проявили заметную цитотоксическую активность. При этом соединение (305), содержащее OH-группу в положении 19, оказалось намного активнее карбонильного аналога (306).
Два новых оксииндоловых эпимерных дитерпена, антколорины G (301) и H (302), выделенные из культуральной жидкости мангрового эндофита Aspergillus versicolor [243], проявили существенные отличия в биологической активности: умеренную цитотоксичность проявил только эпимер (302).
Ряд выделенных алкалоидов можно рассматривать как производные малеимида и пирролидона (рис. 21). Три новых макроциклических алкалоида, названных аскомилактамами А–С (308–310) были выделены из мангрового эндофита Didymella sp. CYSK-4 [244], наряду с известными аналогами фомапирролидонами А и С (311, 312) [245], чье строение было уточнено. Два новых стереоизомерных алкалоида, названные кладоспоритинами А (313) и В (314) были выделены из культуральной жидкости мангрового микромицета Cladosporium sp. HNWSW-1 [246], вместе с известным аналогом талароконволютином А (315) [247]. Интересно, что при одинаковой планарной структуре заметную цитотоксичность проявил только кладоспоритин B (314).
Некоторые выделенные алкалоиды можно отнести к производным пиридона (рис. 22). Донный микромицет Arthrinium sp. UJNMF0008 [248] продуцирует серию из восьми алкалоидов, содержащих необычные стуктурные мотивы: артпироны D–K (316–323), вместе с известным аналогом – апиоспорамидом (324) [249].
Системный скрининг морских микромицетов на широкий спектр антибактериальной активности выявил штамм рода Aspergillus [75], продуцирующий новый алкалоид хэтоминин А (326), наряду с известным хэтоминином (325) [250].
Термофильный микромицет [126], выделенный из гидротермальных источников, оказался продуцентом ряда антибиотических соединений, наиболее активными из которых оказались известные алкалоиды лепорин А (327) (ранее был описан как инсектицид [251]) и хэтоминин (325) [250].
Из почвенного мангрового продуцента Penicillium pinophilum SCAU037 [130] выделен известный алкалоид пеницидон C (330) [252]. При изучении мангрового гриба рода Cladosporium [121], наряду с поликетидами, был выделен умеренно активный новый алкалоид 2-ацетоксиметил-3,5,6-триметилпиразин (331). Новый алкалоид акремолин С (332) с умеренной антибактериальной активностью, был выделен из антарктического почвенного гриба Aspergillus sydowii SP-1 [44]. Более позднее сообщение [253] предполагает, что это соединение может быть идентично ранее описанному акремолину В, в котором изопропильная группа находится в положении 2′, а не 1′. Еще один пиразиновый алкалоид флавакол (333), был повторно выделен из мангрового Aspergillus sp. SCSIO41211 [254].
4. ТЕРПЕНОИДЫ, СТЕРОИДЫ И РОДСТВЕННЫЕ СОЕДИНЕНИЯ
Значительную часть вторичных метаболитов экстремофильных микромицетов можно отнести к терпендоидам, стероидам или родственным соединениям. Были выделены сесквитерпены и сесквитерпеноиды (334–393) (рис. 24, 25); дитерпены и дитерпеноиды (394–420) (рис. 26); стероиды, стеролы и их производные (421–457) (рис. 27, 28).
Среди сесквитерпеноидов было выделено значительное число ранее неописанных соединений, многие из которых не проявили биологической активности. Например, три новых сесквитерпена песталотиопсина I-K (334–336), не проявивших активности, были выделены из Pseudopestalotiopsis sp. PSU-AMF45 [102]. Новый сесквитерпен (337), не проявившей антибиотической активности, был выделен из мангрового гриба рода Pleosporales [186].
Из морского эндофита Aspergillus flocculosus [255] выделены шесть новых сесквитерпенов (338–342), наряду с известными (343–346) [256], принадлежащими к семейству офиоболинов. Все выделенные соединения проявили сильную цитотоксическую активность.
Нитробензойные сесквитерпеноиды редко встречаются среди природных соединений. Из морского гриба Aspergillus ochraceus Jcma1F17 [257] были выделены три новых нитробензоил-сесквитерпеноидов, инсуликолиды B, С и 14-O-ацетилинсуликолид А (351, 352, 349), а также активные известные аналоги (350, 353, 354) [258, 259].
Три новых сесквитерпена эремофиланового типа были выделены из морского гриба Cochliobolus lunatus SCSIO41401 [76]. Выделенные соединения принадлежат к структурному семейству дендрифиеллинов и были названы дендрифиеллинами H–J (355, 347, 348). Два из них (347, 348) проявили высокую цитотоксическую активность, в то время как (355) оказался неактивен, что говорит о критической важности боковой цепи дендрифиеллинов для реализации биологических свойств.
Был изучен спектр вторичных метаболитов мангрового эндофита Cytospora sp. [260]. Помимо выделения нового бициклического сесквитерпена сеирикардина D (356), не проявившего биологической активности, была установлена структура восьми известных метаболитов, антибактериальная активность была выявлена у (22E,24R)-5,8-эпидиокси-5α,8α-эргоста-6,9(11),22-триен-3β-ола (357) [261].
Два известных терпена с умеренной антибактериальной активностью – (7S)-(+)-гидроксисидоновая кислота (358) [262] и (7S, 11S)-(+)-12-гидроксисидоновая кислота (359) [263], – были выделены из антарктического почвенного гриба Aspergillus sydowii SP-1 [44].
Мангровый эндофит Aspergillus sp. xy02 [264] стал источником семи новых фенольных бисаболановых сесквитерпенов (360–364, 366, 367), проявивших слабую антибактериальную активность. Интересно, что эпимеры соединений (361) и (362) оказались полностью неактивными [264]. Также неактивным оказался терпен (367), содержащий E-двойную связь вместо Z-двойной связи в (366). Активность проявили некоторые ранее описанные аналоги: энгиодонтиумон I (365) [265], гидроксисидоновая кислота (359) [262, 263], (–)-(7S)-10-гидроксисидоновая кислота (368) [263, 264].
Четыре новых сесквитерпеноида, названные пенициедесмолами А–D (369–372) были выделены из мангрового эндофита рода Penicillium, однако только один из них продемонстрировал слабую цитотоксичность (370) [266].
Шесть сесквитерпеноидов, названных пултининами A–F (373–378) были выделены из морского гриба Penicillium piltunense KMM 4668 [151] наряду с известным структурным аналогом пенигрисацидом D (385) [267].
Помимо дитерпеновых алкалоидов, из культуральной жидкости мангрового эндофита Aspergillus versicolor [243] было выделено девять (379–384, 386–388) новых сесквитерпенов, два из которых проявили слабую цитотоксическую активность (7-деокси-7,14-дидегидро-12-ацетокси-сидоновая кислота (386) и ее изомер 7-деокси-7,8-дидегидро-12-ацетокси-сидоновая кислота (387).
Из гриба морского происхождения Cladosporium sp. OUCMDZ-1635 [220] был выделен новый аналог абсцизовой кислоты – кладозацид (393).
Не менее распространены по сравнению с сесквитерпенами и их производными среди вторичных метаболитов микромицетов оказались дитерпены и дитерпеноиды (рис. 26).
В некоторых случаях дитерпеноиды выделяли наряду с сесквитерпеновыми метаболитами. Новый сесквитерпеноид 9,10-диолхиноевая кислота (389) и дитерпеноид руссоэллол С (404), наряду с известным данкастероном (405) [268, 269], были обнаружены среди вторичных метаболитов морского гриба Talaromyces purpurogenus [54]. Культивирование морского гриба Trichoderma erinaceum F1-1 [270] привело к выделению четырех новых (близких к известным) терпеноидов различной структуры (дитерпеноида (420) и сесквитерпеноидов (390–392), не проявивших биологической активности [303].
Три новых дитерпеноида долабелланового типа стахатраноны А–С (394–396) и три новых атранона Q–S (397–399) были выделены из морского гриба Stachybotrys chartarum [271]. Новые антраноны обладают существенной структурной новизной: атранон Q (397) является первым С23 атраноном, содержащим пропан-2-оновый мотив, присоединеный к долабеллановому ядру связью С–С; антранон R (398) является первым представителем С24 атранонов, содержащим в положении С-5–С-6 конденсированный 2-метилтетрагидрофуран-3-карбоксилатный цикл (рис. 26, упомянутые фрагменты выделены красным).
Фракционирование цитоксичных фракций экстракта культуральной жидкости морского штамма Aspergillus porosus [209] привело к выделению известного фитотоксина сфэропсидина А (401) [272] [273], с недавнего времени привлекающего интерес в качестве цитотоксического агента [274]. Интересно, что у второго выделенного аналога, очень близкого по строению известного аспергилоида E (400) [273], активность существенно ниже.
Выделенный из морского коралла гриб Penicillium sp. TJ403-1 [51] оказался продуцентом ряда цитотоксических спиродитерпеноидов семейства бревионов. Новый бревион O (403) не проявил ценных фармакологических свойств, в то время как известный бревион I (402) [275] оказался активен в отношении нескольких опухолевых клеточных линий.
Семь новых дитерпенов пимаранового типа – либертелленоны O–S (410–414) и эвтипелленоны А и B (406, 407) – были выделены из культуральной жидкости почвенного Арктического гриба Eutypella sp. D-1 [276], наряду с известными либертелленонами H, J (408, 409) [277]. Все выделенные соединения проявили цитотоксичность, а высокое разнообразие структур позволило установить некоторые взаимосвязи структура-активность. Например, метоксилирование в положении С-10 благоприятно для цитотоксического действия, в то время как обращение конфигурации С-13 и гидроксилирование в положении С-14 снижает активность.
Пять новых 20-нор-изопимарановых дитерпеноидов, включая набор из четырех диастереомеров, названных аспевентинами I–L (415–418) и метилированное производное аспевентин M (419), были выделены из морского гриба Aspergillus wentii SD-310 [278].
Еще одним структурным семейством выделенных вторичных метаболитов являются соединения, представляющие собой стероиды и родственные соединения. Новые стеролы являются редкостью среди вторичных метаболитов микроорганизмов, что делает интересным обнаружение нового стерола 3,7-дикето-цефалоспорина P1 (421) в культуральной жидкости глубоководного Aspergillus fumigatus SCSIO 41012 [237]. Наряду с новым стеролом, были выделены два известных соединения этого класса: гельволовая кислота (424) [279, 280] и 22-ацетилизоциклоцитринол А (435) [281]. Интересно, что новый стерол (421) проявляет заметную специфическую активность против Acinetobacter baumannii. Гельволовая кислота (424) и 7 ее новых производных (422, 423, 425–430) были выделены из морского Aspergillus fumigatus HNMF0047 [282]. Наибольшую антибиотическую активность из них проявили соединения (422–424).
Эндофит морских водорослей Aspergillus alabamensis EN-547 [234] стал источником нового стероида эргостанового типа, 28-ацетокси-12β,15α,25-тригидроксиэргоста-4,6,8(14),22-тетраен-3-она (431), проявившего слабую антимикробную активность.
20-Ацетокси-16α-метилпрег-17α,19-дигидрокси-(9,11)-эпокси-4-ен-3,18-дион (433) и ранее описанный токсичный терпеноид терретонин (439) [283], были получены из морского штамма Penicillium citrinum SCSIO 41017 [108].
Два новых терпеноида, аспертерпены N (436) и O (437) были выделены из эндофита морских водорослей Aspergillus terreus EN-539 [284] наряду с родственными известными соединениями терретонинами А [285] и G (440) [286], стереоконфигурация которых была уточнена. Терретонин G (444), как и ранее [286], продемонстрировал слабую антибактериальную активность [284]. Позже из термофильного Aspergillus terreus TM8 и морского Aspergillus terreus LGO13 [287] был выделен новый терпеноид терретонин O (442), предположительно являющийся биосинтетическим предшественником выделенных недавно терретонинов M (441) [288] и N (443) [289]. Эти соединения окислены по положению С-11, что нетипично для этого класса соединений, но их антибактериальная активность очень низка.
Из глубоководного гриба Sarocladium kiliense [290] был получен новый эргостан, сарокладион (444), первый стероид, содержащий уникальный 5,10:8,9-дисеко мотив. Помимо нового соединения, было выделено 20 известных соединений, некторые из которых проявляют антибиотические свойства. Высокая цитотоксическая активность была обнаружена у β-ситостенона (438) [291] и 4,6-дигидроксиевдесмана (456) [292]. Умеренную активность провявили 22E-7α-метокси-5α,6α-эпоксиэргоста-8(14),22-диен-3β-ол (455) [293], диосгенин (457) [294] и грамистерол (432) [291]. Из известных стеролов следует отметить также β-ситостерол (454) [295], выделенный из донного Aspergillus sydowii C1-S01-A7 [77]. Мангровый Aspergillus sp. SCSIO41211 [254] стал источником нового стероида (434), не проявившего активности.
Активные вторичные метаболиты глубоководного микромицета Penicillium granulatum MC CC 3A00 475 [47] включают несколько соединений стероидной природы: изонуатигенин I (453) [296]; пеницистероид A (446) [297]; аницеквол (445) [298].
Пять новых эргостанов, названных пеницистероидами D–H (448–452) были получены из глубоководного штамма Penicillium granulatum MCCC 3A00475 [299] наряду с 14 известными стероидами, некоторые из которых проявляют цитотоксическую активность (прежде всего пеницистероиды А,С (446, 447) [297, 300].
5. СОЕДИНЕНИЯ СМЕШАННОГО И НЕУСТАНОВЛЕННОГО ПРОИСХОЖДЕНИЯ
Помимо обобщенных в предыдущих главах соединений, были выделены антибиотические вторичные метаболиты, которые трудно однозначно отнести к одному из вышеупомянутых классов соединений. В ряде случаев очевидно, что для биосинтеза подобных соединений необходима совместная работа ферментной машинерии различных классов (поликетидсинтазы, нерибосомные пептидсинтазы, синтазы жирных кислот, ферменты биосинтеза стеролов, шикиматного пути и др.). В некоторых случаях (особенно для структурно простых соединений) недостаточно данных для подобного биогенетического отнесения.
Изучение природы антимикробной актиности экстракта культуры морского микромицета Penicillium ZZ1283 [301] привело к выделению и установлению стуктуры 18 метаболитов, один из которых оказался ранее неописанным соединением, названным пурпурид D (458), представляющий собой конъюгат сесквитерпена дриманового типа с аминокислотой N-ацетил-L-валином.
Два известных микотоксина – охратоксины A (464) и B (465) [302, 303], содержащие пептидный и поликетидный фрагменты, – были выделены из морского гриба Aspergillus ochraceus [42]. Этиловый эфир охратоксина А (461) и его антибиотическая активность были исследованы также при выделении из мангрового гриба Aspergillus sp. SCSIO41211 [254].
Упомянутый в Разделе 4 продуцент Trichoderma erinaceum F1-1 [270] морского просхождения при культивировании на среде с добавлением L-триптофана существенно изменил спектр синтезируемых вторичных метаболитов. Вместо терпеноидов, в этом случае было выделено 18 ароматических соединений, в том числе шесть новых соединений, названных триходеролидами A–F (462–467), из который только (463) проявил слабую цитотоксичность. Также были выделены известные ароматические соединения, проявившие цитотоксические свойства: 3,3'-диметокси-5,5'-диметилдифениловый эфир (468) [304], 3-O-метил-диорцинол (469) [305] и впервые выделенный из природного источника 4'-[(2-гидрокси-1,3-пропанил)бис[окси-4,1-фенилен(1-метилэтилиден)]]бисфенол (470) [306].
Химическое изучение экстракта морского гриба Truncatella angustata [307] привело к выделению неописанных ранее пренилированных циклогексанолов, у двух из которых (471, 472) обнаружилась противовирусная активность.
Из морского гриба Penicillium sp. LS54 [308] выделен пенициллилактон А (473), являющийся первым природным соединением, содержащим 7-членный лактонный цикл, конденсированный с фурановым кольцом.
Химическое изучение мангрового эндофита Phyllosticta capitalensis [141] выявило два известных соединения смешанного биосинтетического происхождения – меротерпеноиды гуигнардоны А (474) и J (475), проявившие антибиотическую активность [309].
Два новых фурандионовых производных с умеренной антифунгальной активностью, асперфурандионы А и В (476, 477) были выделены из морского штамма Aspergillus versicolor [310].
Новое производное пентеновой кислоты 1,1'-диоксин-2,2'-дипропановая кислота (478) была получена из мангрового эндофита Cladosporium sp. JS1-2 [121] и проявила умеренную антибактериальную активность.
Talaromyces assiutensis JTY2 [311] мангрового происхождения стал источником трех новых метаболитов – производного циклопентенона талароциклопента А (479), простого эфира пирогаллола таларациклопента B (480) и нового производного итаконовой кислоты таларациклопента C (481), два из которых (479, 480) проявили антибактериальную активность.
Три новых лактона, названные пеницилактонами А–С (482–484), были получены из мангрового Penicillium sp. TGM112 [312]. Интересно, что из всех изомеров только (482) проявил антибактериальные свойства.
Две новых пары эпимерных производных ацетаминофена пеницилквеи A–D (485–488), проявившие многообещающую активность против фитопатогенных грибов, были получены из культуры Penicillium herquei JX4 [313].
Еще одни новый полициклический цитотоксичный метаболит альтернатон А (489) был выделен из морского штамма, принадлежащего к роду Alternaria [88].
Мангровый эндофит Cladosporium sp. JJM22 [314] стал источником двух новых метаболитов (495, 496) и нескольких известных, только один из которых (497) [315] проявил антибактериальную активность.
Морской штамм Aspergillus terreus LGO13 [287], помимо описанных выше терпеноидов, продуцирует ряд известных метаболитов, проявивших антибиотическую активность: бутиролактоны I–III (490–492) [316] и аспулвинон O (498) [317]. Глубоководный микромицет, принадлежащий к тому же виду, Aspergillus terreus SCSIO FZQ028 [318], стал источником ряда структурно близких бутенолидов, в том числе нового соединения (±)-аспертеретала F (494) и его недавно описанного близкого аналога аспертеретала E (493) [319], содержащего 2-бензил-3-фенил-замещенный лактон. Было выделено еще 5 известных метаболитов, в том числе упомянутый выше бутиролактон III (492). Антибактриальная активность проявилась у асперетала E (493) и аспернолида A (499) [320].
Культивирование морского гриба Aspergillus versicolor MCCC 3A00080 [321] с добавлением ингибитора гистондеацетилаз вориностата (N-гидрокси-N'-фенилоктандиамид) индуцировало биосинтез нового вторичного метаболита версиперола А (513), проявившего небольшую антибактериальную активность.
Три новых производных итаконовой кислоты, выделенные из морского Aspergillus niger, были названы асперитаконовыми кислотами А–С (500–502) [322]. Описанные осединения не проявили заметной цитотоксичности, но продемонстировали умеренную антибактериальную активность.
Новый вторичный метаболит 1-(2′,6′-диметилфенил)-2-н-пропил-1,2-дигидропиридазин-3,6-дион (512), представляющий собой производное малеинового гидразида, был выделен из мангрового гриба Aspergillus sp. AV-2 [170]. Соединения, содержащие N–N связь, довольно редко встречаются среди природных соединений [323], однако широко представлены среди синтетических биологически активных соединений, особенно производных пиридазинов [324].
Из Арктического гриба Eutypella sp. D-1 [325] были выделены новые цитотоксические меротерпеноиды, названные эвтипеллацитоспоринами A–D (507–510). Эти соединения представляют собой конъюгат поликетида (цитоспорина D) и сесквитерпеноидов (деципиенолидов А и B). Небольшая разница в активности эпимеров по С-21 – (507) и (509) – говорит о слабом влиянии конфигурации этого оптического центра.
Заметную антибактериальную активность проявил описанный меротерпеноид аустинол (511) [326] при выделении среди вторичных метаболитов теромофильного гриба рода Penicillium [73].
Химическое изучение экстракта глубоководного гриба Penicillium sp.YPGA11 [327] привело к выделению четырех новых антибактериальных меротерпеноидов фарнезилциклогексенонов, пенигинсенгинов B–E (503–506), содержащих редкие для природных соединений мотивы – 1-метилциклогексеновый цикл и (4E,8E)-4,8-диметилдека-4,8-диеновую кислоту.
ЗАКЛЮЧЕНИЕ
Поиск новых антибиотиков является все более актуальной задачей в условиях распространения резистентности. Для поиска природных биологически активных соединений в разные периоды применялись различные стратегии. Наиболее продуктивной была Ваксмановская платформа (Waksman Platform), заключающаяся в культивировании почвенных микроорганизмов c широким спектром антибиотической активности [331]. Этот подход позволил выделить большинство известных на текущий момент антибиотиков, в т.ч. применяемые в медицине и ветеринарии. Однако шансы обнаружения новых соединений таким методом после 1970-х годов стали ничтожно малы из-за проблемы переоткрытия известных антибиотиков (re-discovery problem). При этом потребность в новых антибиотических агентах только растет из-за распространения резистентности, что привело к возникновению целого ряда альтернативных подходов: омиксные методы (метаболомика, геномика, обратная геномика), мишень-ориентированный высокопроизводительный скрининг [1]. Тем не менее, ни одна из разработанных стратегий не привела к прорыву в области поиска антибиотиков.
Одим из путей преодоления кризиса в поиске природных соединений является изучение труднокультивируемых и редких микроорганизмов, в том числе и обитателей экстремальных экониш [332, 333]. Для оценки перспектив этого подхода мы провели анализ всех вторичных метаболитов экстремальных микромицетов, новых или обладающих антибиотической активностью, выделенных за период 2018–2019 годов.
С таксономической точки зрения большинство микромицетов, ставших источниками новых и/или известных активных соединений, принадлежат к распространенным родам Aspergillus и Penicillium, представители прочих таксонов имеют намного меньшие доли.
C биогенетической точки зрения, большая часть метаболитов оказались поликетидами (45%) различного строения. Пептиды и родственные соединения оказались очень редкими для экстремофильных микромицетов (5%). Распределение метаболитов по структурным семействам представлено на рис. 36.
Из всех соединений (513), для которых была установлена структура в охваченный период, около 1/3 соединений оказались ранее описанными антибиотиками (190, 37%), для некоторых из них был уточнен спектр биологической активности. Из ранее неописанных метаболитов, составивших 63% (323) от общего числа, антибиотическую активность проявили около 55% (179). При этом из числа всех активных метаболитов (369) новыми оказались около 1/2. Можно предположить, что данная статистика охватывает не все известные антибиотики, выделенные в изученный период, так как в случае выделения только известных соединений данные часто не доходят до публикации.
Несмотря на небольшой временной период охвата литературы (2018–2019), ряд упомянутых в обзоре новых природных соединений стал объектом полного синтеза. В частности, пептаиболы липовелутиболы B (24), D (26) и их липофильные аналоги были получены твердофазным методом [334]. Терпеноиды инсуликолид (354), 14-О-ацетилинсуликолид (355) и их аналоги синтезированы путем энантиоселективной металл-катализируемой сборки дриманового ядра с последующей окислительной деструкцией и функционализацией [335]. Следует также упомянуть встречный синтез индольного алкалоида миссзртина А (294) [241].
Исходя из обобщенных данных, можно сделать вывод, что несмотря на существенное количество новых вторичных метаболитов, выделенных из экстремофильных микромицетов, доля известных антибиотических соединений остается высокой. То есть, само по себе изучение экстремальных и труднодоступных местобитаний не решает проблему переоткрытия известных антибиотиков. Многие из известных соединений, выделенных в результате скрининга по биоактивности, были получены из разных продуцентов множество раз. Например, антибиотический антрахинон эмодин 35 был наработан и охарактеризован 7 раз только за рассмотренный период [61, 73–79]. Применение современных омиксных подходов, стратегий приоритизации и дерепликации [336] может существенно увеличить эффективность изучения природных соединений, в том числе и из экстремофильных экониш, так как позволит избежать перерасхода ресурсов на выделение известных соединений. В таком случае, с учетом высокого разнообразия химических структур и спектров биологической активности вторичных метаболитов экстремофильных микроорганизмов, они могут иметь высокий потенциал в качестве источников новых лекарственных средств.
Список литературы
Ribeiro da Cunha, Fonseca, Calado // Antibiotics. 2019. V. 8. P. 45. https://doi.org/10.3390/antibiotics8020045
Dougan G., Dowson C., Overington J. // Drug Discovery Today. 2019. V. 24. P. 452–461. https://doi.org/10.1016/j.drudis.2018.11.015
Политическая декларация заседания высокого уровня Генеральной Ассамблеи по проблеме устойчивости к противомикробным препаратам / Резолюция Организации Объединенных Наций A/RES/71/3 (принята 05.10.2016 г.); https://undocs.org/ru/A/RES/71/3.
Глобальный план действий по борьбе с устойчивостью к противомикробным препаратам / Всемирная Организация Здравоохранения: Женева, 2015. С. 15–29.
Стратегия предупреждения распространения антимикробной резистентности в Российской Федерации на период до 2030 года / Распоряжение Правительства Российской Федерации от 25 сентября 2017 г. № 2045-р. С. 2–14
Newman D.J., Cragg G.M. // Journal of Natural Products. 2020. V. 83. P. 770–803. https://doi.org/10.1021/acs.jnatprod.9b01285
Sayed A.M., Hassan M.H.A., Alhadrami H.A., Hassan H.M., Goodfellow M., Rateb M.E. // Journal of Applied Microbiology. 2019. P. jam.14386. https://doi.org/10.1111/jam.14386
Keller N.P. // Nature Reviews Microbiology. 2019. V. 17. P. 167–180. https://doi.org/10.1038/s41579-018-0121-1
Schueffler A., Anke T. // Nat. Prod. Rep. 2014. V. 31. P. 1425–1448. https://doi.org/10.1039/C4NP00060A
Zhang X., Li S.-J., Li J.-J., Liang Z.-Z., Zhao C.-Q. // Marine Drugs. 2018. V. 16. P. 194. https://doi.org/10.3390/md16060194
Wickneswary N., Abu Bakar M., Khalid R. // Malaysian Journal of Chemistry. 2016. V. 18. P. 100–105.
Tian Y., Li Y.-L., Zhao F.-C. // Marine Drugs. 2017. V. 15. P. 28. https://doi.org/10.3390/md15030028
Stierle A.A., Stierle D.B. // Natural Product Communications. 2014. V. 9. P. 1037–1044. https://doi.org/10.1177/1934578X1400900738
Corral P., Amoozegar M.A., Ventosa A. // Marine Drugs. 2019. V. 18. P. 33. https://doi.org/10.3390/md18010033
Tiquia-Arashiro S.M., Grube M. Fungi in Extreme Environments: Ecological Role and Biotechnological Significance / Ed. Springer International Publishing, 2019. https://doi.org/10.1007/978-3-030-19030-9
Giddings L.-A., Newman D.J. Bioactive Compounds from Extremophilic Marine Fungi. In Fungi in Extreme Environments: Ecological Role and Biotechnological Significance / Tiquia-Arashiro S.M., Grube M., Eds. Springer International Publishing, 2019. P. 349–382. https://doi.org/10.1007/978-3-030-19030-9_18
Zhang X., Li S.-J., Li J.-J., Liang Z.-Z., Zhao C.-Q. // Marine Drugs. 2018. V. 16. P. 194. https://doi.org/10.3390/md16060194
Gribble G. // Marine Drugs. 2015. V. 13. P. 4044–4136. https://doi.org/10.3390/md13074044
Xu L., Meng W., Cao C., Wang J., Shan W., Wang Q. // Marine Drugs. 2015. V. 13. P. 3479–3513. https://doi.org/10.3390/md13063479
Jin L., Quan C., Hou X., Fan S. // Marine Drugs. 2016. V. 14. P. 76. https://doi.org/10.3390/md14040076
Ma H.-G., Liu Q., Zhu G.-L., Liu H.-S., Zhu W.-M. // Journal of Asian Natural Products Research. 2016. V. 18. P. 92–115. https://doi.org/10.1080/10286020.2015.1127230
Fouillaud M., Venkatachalam M., Girard-Valenciennes E., Caro Y., Dufossé L. // Marine Drugs. 2016. V. 14. P. 64. https://doi.org/10.3390/md14040064
Imhoff J. // Marine Drugs. 2016. V. 14. P. 19. https://doi.org/10.3390/md14010019
El-Hossary E.M., Cheng C., Hamed M.M., El-Sayed Hamed A.N., Ohlsen K., Hentschel U., Abdelmohsen U.R. // European Journal of Medicinal Chemistry. 2017. V. 126. P. 631–651. https://doi.org/10.1016/j.ejmech.2016.11.022
Nicoletti R., Salvatore M., Andolfi A. // Marine Drugs. 2018. V. 16. P. 12. https://doi.org/10.3390/md16010012
Tortorella E., Tedesco P., Palma Esposito F., January G., Fani R., Jaspars M., Pascale D. de // Marine Drugs. 2018. V. 16. P. 355. https://doi.org/10.3390/md16100355
Ancheeva E., Daletos G., Proksch P. // Marine Drugs. 2018. V. 16. P. 319. https://doi.org/10.3390/md16090319
Rai M., Gade A., Zimowska B., Ingle A.P., Ingle P. // Applied Microbiology and Biotechnology. 2018. V. 102. P. 9053–9066. https://doi.org/10.1007/s00253-018-9329-2
Deshmukh S.K., Prakash V., Ranjan N. // Frontiers in Microbiology. 2018. V. 8. P. 2536. https://doi.org/10.3389/fmicb.2017.02536
Wang K.-W., Ding P. // Mini-Reviews in Medicinal Chemistry. 2018. V. 18. P. 1072–1094. https://doi.org/10.2174/1389557518666180305160856
Barone, Varrella, Tangherlini, Rastelli, Dell’Anno, Danovaro, Corinaldesi // Diversity. 2019. V. 11. P. 113. https://doi.org/10.3390/d11070113
Youssef F.S., Ashour M.L., Singab A.N.B., Wink M. // Marine Drugs. 2019. V. 17. P. 559. https://doi.org/10.3390/md17100559
Carroll A.R., Copp B.R., Davis R.A., Keyzers R.A., Prinsep M.R. // Natural Product Reports. 2019. V. 36. P. 122–173. https://doi.org/10.1039/c8np00092a
Sun W., Wu W., Liu X., Zaleta-Pinet D.A., Clark B.R. // Marine Drugs. 2019. V. 17. P. 339. https://doi.org/10.3390/md17060339
Zain ul Arifeen M., Ma Y.-N., Xue Y.-R., Liu C.-H. // Marine Drugs. 2019. V. 18. P. 9. https://doi.org/10.3390/md18010009
Luo M., Zang R., Wang X., Chen Z., Song X., Ju J., Huang H. // Journal of Natural Products. 2019. V. 82. P. 2594–2600. https://doi.org/10.1021/acs.jnatprod.9b00545
Youssef D., Alahdal A. // Molecules. 2018. V. 23. P. 394. https://doi.org/10.3390/molecules23020394
Adamczeski M., Reed A.R., Crews P. // Journal of Natural Products. 1995. V. 58. P. 201–208. https://doi.org/10.1021/np50116a007
Ван Г., Даи Ш., Чен М., Ву Х., Ши Л., Люо С., Ли С. // Химия природных соединений. 2010. Т. 46, № 4. С. 491–493.
Liu C.-C., Zhang Z.-Z., Feng Y.-Y., Gu Q.-Q., Li D.-H., Zhu T.-J. // Natural Product Research. 2019. V. 33. P. 414–419. https://doi.org/10.1080/14786419.2018.1455045
Guimarães D.O., Borges W.S., Vieira N.J., Oliveira L.F. de, Silva C.H.T.P. da, Lopes N.P., Dias L.G., Durán-Patrón R., Collado I.G., Pupo M.T. // Phytochemistry. 2010. V. 71. P. 1423–1429. https://doi.org/10.1016/j.phytochem.2010.05.012
Frank M., Özkaya F., Müller W., Hamacher A., Kassack M., Lin W., Liu Z., Proksch P. // Marine Drugs. 2019. V. 17. P. 99. https://doi.org/10.3390/md17020099
Kimura Y., Tani K., Kojima A., Sotoma G., Okada K., Shimada A. // Phytochemistry. 1996. V. 41. P. 665–669. https://doi.org/10.1016/0031-9422(95)00693-1
Li W., Luo D., Huang J., Wang L., Zhang F., Xi T., Liao J., Lu Y. // Natural Product Research. 2018. V. 32. P. 662–667. https://doi.org/10.1080/14786419.2017.1335730
Hodge R.P., Harris C.M., Harris T.M. // Journal of Natural Products. 1988. V. 51. P. 66–73. https://doi.org/10.1021/np50055a008
Niu S., Xia M., Chen M., Liu X., Li Z., Xie Y., Shao Z., Zhang G. // Marine Drugs. 2019. V. 17. P. 686. https://doi.org/10.3390/md17120686
Niu S., Wang N., Xie C.-L., Fan Z., Luo Z., Chen H.-F., Yang X.-W. // The Journal of Antibiotics. 2018. V. 71. P. 658–661. https://doi.org/10.1038/s41429-018-0046-y
Kopp B., Rehm H.J. // European Journal of Applied Microbiology and Biotechnology. 1979. V. 6. P. 397–401. https://doi.org/10.1007/BF00499170
Du L., Li D., Zhu T., Cai S., Wang F., Xiao X., Gu Q. // Tetrahedron. 2009. V. 65. P. 1033–1039. https://doi.org/10.1016/j.tet.2008.11.078
Kawai K., Nozawa K., Nakajima S., Iitaka Y. // Chemical & Pharmaceutical Bulletin. 1984. V. 32. P. 94–98. https://doi.org/10.1248/cpb.32.94
Yang B., Sun W., Wang J., Lin S., Li X.-N., Zhu H., Luo Z., Xue Y., Hu Z., Zhang Y. // Marine Drugs. 2018. V. 16. P. 110. https://doi.org/10.3390/md16040110
Du L., Yang X., Zhu T., Wang F., Xiao X., Park H., Gu Q. // Chemical & Pharmaceutical Bulletin. 2009. V. 57. P. 873–876. https://doi.org/10.1248/cpb.57.873
Zhong W., Wang J., Wei X., Chen Y., Fu T., Xiang Y., Huang X., Tian X., Xiao Z., Zhang W., Zhang S., Long L., Wang F. // Organic Letters. 2018. V. 20. P. 4593–4596. https://doi.org/10.1021/acs.orglett.8b01880
Wang W., Wan X., Liu J., Wang J., Zhu H., Chen C., Zhang Y. // Marine Drugs. 2018. V. 16. P. 150. https://doi.org/10.3390/md16050150
Zhang M., Wang W.-L., Fang Y.-C., Zhu T.-J., Gu Q.-Q., Zhu W.-M. // Journal of Natural Products. 2008. V. 71. P. 985–989. https://doi.org/10.1021/np700737g
Singh V.P., Yedukondalu N., Sharma V., Kushwaha M., Sharma R., Chaubey A., Kumar A., Singh D., Vishwakarma R.A. // Journal of Natural Products. 2018. V. 81. P. 219–226. https://doi.org/10.1021/acs.jnatprod.6b00873
Rogozhin E., Sadykova V., Baranova A., Vasilchenko A., Lushpa V., Mineev K., Georgieva M., Kul’ko A., Krasheninnikov M., Lyundup A., Vasilchenko A., Andreev Y. // Molecules. 2018. V. 23. P. 2785. https://doi.org/10.3390/molecules23112785
Fdhila F., Vázquez V., Sánchez J.L., Riguera R. // Journal of Natural Products. 2003. V. 66. P. 1299–1301. https://doi.org/10.1021/np030233e
Guo C., Lin X.-P., Liao S.-R., Yang B., Zhou X.-F., Yang X.-W., Tian X.-P., Wang J.-F., Liu Y.-H. // Natural Product Research. 2019. P. 1–9. https://doi.org/10.1080/14786419.2018.1553880
Zhao D.-L., Wang D., Tian X.-Y., Cao F., Li Y.-Q., Zhang C.-S. // Marine Drugs. 2018. V. 16. P. 36. https://doi.org/10.3390/md16010036
Wang W., Chen R., Luo Z., Wang W., Chen J. // Natural Product Research. 2018. V. 32. P. 558–563. https://doi.org/10.1080/14786419.2017.1329732
Bode H.B., Bethe B., Höfs R., Zeeck A. // ChemBioChem. 2002. V. 3. P. 619–627. https://doi.org/10.1002/1439-7633(20020703)3:7<619:: AID-CBIC619>3.0.CO;2-9
Yang S.-Q., Li X.-M., Xu G.-M., Li X., An C.-Y., Wang B.-G. // The Journal of Antibiotics. 2018. V. 71. P. 778–784. https://doi.org/10.1038/s41429-018-0063-x
Hatsuda Y., Hamasaki T., Ishida M., Yoshikawa S. // Agricultural and Biological Chemistry. 1969. V. 33. P. 131–133. https://doi.org/10.1080/00021369.1969.10859290
Endale M., Ekberg A., Alao J., Akala H., Ndakala A., Sunnerhagen P., Erdélyi M., Yenesew A. // Molecules. 2012. V. 18. P. 311–321. https://doi.org/10.3390/molecules18010311
Chung M.-I., Jou S.-J., Cheng T.-H., Lin C.-N., Ko F.-N., Teng C.-M. // Journal of Natural Products. 1994. V. 57. P. 313–316. https://doi.org/10.1021/np50104a020
Moon M.K., Han Y.-M., Lee Y.-J., Lee L.H., Yang J.H., Kwon B.-M., Kim D.K. // Archives of Pharmacal Research. 2010. V. 33. P. 1747–1751. https://doi.org/10.1007/s12272-010-1106-4
Ян Л., Сень З., Ли Ж.-Х., Пань Й.-М. // Химия природных соединений. 2016. Т. 52. № 5. С. 760–761.
Wells J.M., Cole R.J., Kirksey J.W. // Applied Microbiology. 1975. V. 30. P. 26–28.
Liu D., Yan L., Ma L., Huang Y., Pan X., Liu W., Lv Z. // Archives of Pharmacal Research. 2015. V. 38. P. 1038–1043. https://doi.org/10.1007/s12272-014-0371-z
May Zin W.W., Buttachon S., Dethoup T., Pereira J.A., Gales L., Inácio Â., Costa P.M., Lee M., Sekeroglu N., Silva A.M.S., Pinto M.M.M., Kijjoa A. // Phytochemistry. 2017. V. 141. P. 86–97. https://doi.org/10.1016/j.phytochem.2017.05.015
Hawas U.W., El-Beih A.A., El-Halawany A.M. // Archives of Pharmacal Research. 2012. V. 35. P. 1749–1756. https://doi.org/10.1007/s12272-012-1006-x
Orfali R., Perveen S. // Journal of Chemistry. 2019. V. 2019. P. 1–7. https://doi.org/10.1155/2019/7162948
Саид Г., Хоу Ш.-М., Лю Ш., Чао Ж., Дзян Я.-Я., Жен Дж.-Е., Шао Ч.-Л. // Химия природных соединений. 2019. Т. 55. № 3. С. 457–459.
Song Z., Liu Y., Gao J., Hu J., He H., Dai S., Wang L., Dai H., Zhang L., Song F. // Natural Product Research. 2019. P. 1–8. https://doi.org/10.1080/14786419.2019.1660331
Fang W., Wang J., Wang J., Shi L., Li K., Lin X., Min Y., Yang B., Tang L., Liu Y., Zhou X. // Journal of Natural Products. 2018. V. 81. P. 1405–1410. https://doi.org/10.1021/acs.jnatprod.8b00015
Wang W., Gao M., Luo Z., Liao Y., Zhang B., Ke W., Shao Z., Li F., Chen J. // Natural Product Research. 2019. V. 33. P. 3077–3082. https://doi.org/10.1080/14786419.2018.1519561
Song T., Chen M., Chai W., Zhang Z., Lian X.-Y. // Tetrahedron. 2018. V. 74. P. 884–891. https://doi.org/10.1016/j.tet.2018.01.015
Buttachon S., Ramos A., Inácio Â., Dethoup T., Gales L., Lee M., Costa P., Silva A., Sekeroglu N., Rocha E., Pinto M., Pereira J., Kijjoa A. // Marine Drugs. 2018. V. 16. P. 119. https://doi.org/10.3390/md16040119
Danielsen K., Aksnes D.W., Francis G.W. // Magnetic Resonance in Chemistry. 1992. V. 30. P. 359–360. https://doi.org/10.1002/mrc.1260300414
Lee M.S., Cha E.Y., Sul J.Y., Song I.S., Kim J.Y. // Phytotherapy Research. 2011. V. 25. P. 833–837. https://doi.org/10.1002/ptr.3323
Semple S.J., Pyke S.M., Reynolds G.D., Flower R.L.P. // Antiviral Research. 2001. V. 49. P. 169–178. https://doi.org/10.1016/S0166-3542(01)00125-5
Li J.L., Jiang X., Liu X., He C., Di Y., Lu S., Huang H., Lin B., Wang D., Fan B. // Fitoterapia. 2019. V. 133. P. 1–4. https://doi.org/10.1016/j.fitote.2018.11.015
Lee Y.M., Li H., Hong J., Cho H.Y., Bae K.S., Kim M.A., Kim D.-K., Jung J.H. // Archives of Pharmacal Research. 2010. V. 33. P. 231–235. https://doi.org/10.1007/s12272-010-0207-4
Liu K., Zheng Y., Miao C., Xiong Z., Xu L., Guan H., Yang Y., Zhao L. // Natural Product Research. 2014. V. 28. P. 2334–2337. https://doi.org/10.1080/14786419.2014.935941
Sedmera P., Volc J., Weijer J., Vokoun J., Musílek V. // Collection of Czechoslovak Chemical Communications. 1981. V. 46. P. 1210–1216. https://doi.org/10.1135/cccc19811210
Pang X., Lin X., Wang P., Zhou X., Yang B., Wang J., Liu Y. // Marine Drugs. 2018. V. 16. P. 280. https://doi.org/10.3390/md16080280
Zhao D.-L., Cao F., Wang C.-Y., Yang L.-J., Shi T., Wang K.-L., Shao C.-L., Wang C.-Y. // Journal of Natural Products. 2019. V. 82. P. 3201–3204. https://doi.org/10.1021/acs.jnatprod.9b00905
Boutin B., Peeler J., Twedt R. // Journal of Toxicology and Environmental Health, Part A. 1989. V. 26. P. 75–81. https://doi.org/10.1080/15287398909531234
Gao S.-S., Li X.-M., Wang B.-G. // Natural Product Communications. 2009. V. 4. P. 1934578X0900401. https://doi.org/10.1177/1934578X0900401107
Okuno T., Natsume I., Sawai K., Sawamura K., Furusaki A., Matsumoto T. // Tetrahedron Letters. 1983. V. 24. P. 5653–5656. https://doi.org/10.1016/S0040-4039(00)94165-0
Kornsakulkarn J., Dolsophon K., Boonyuen N., Boonruangprapa T., Rachtawee P., Prabpai S., Kongsaeree P., Thongpanchang C. // Tetrahedron. 2011. V. 67. P. 7540–7547. https://doi.org/10.1016/j.tet.2011.07.078
Supratman U., Hirai N., Sato S., Watanabe K., Malik A., Annas S., Harneti D., Maharani R., Koseki T., Shiono Y. // Natural Product Research. 2019. P. 1–7. https://doi.org/10.1080/14786419.2019.1650358
Li Q., Zhu R., Yi W., Chai W., Zhang Z., Lian X.-Y. // Phytochemistry. 2018. V. 152. P. 53–60. https://doi.org/10.1016/j.phytochem.2018.04.021
Bashyal B.P., Wellensiek B.P., Ramakrishnan R., Faeth S.H., Ahmad N., Gunatilaka A.A.L. // Bioorganic & Medicinal Chemistry. 2014. V. 22. P. 6112–6116. https://doi.org/10.1016/j.bmc.2014.08.039
Zhu A., Zhang X.-W., Zhang M., Li W., Ma Z.-Y., Zhu H.-J., Cao F. // Marine Drugs. 2018. V. 16. P. 312. https://doi.org/10.3390/md16090312
Zhu A., Yang M.-Y., Zhang Y.-H., Shao C.-L., Wang C.-Y., Hu L.-D., Cao F., Zhu H.-J. // Scientific Reports. 2018. V. 8. P. 10 621. https://doi.org/10.1038/s41598-018-28996-5
González-Andrade M., Rivera-Chávez J., Sosa-Peinado A., Figueroa M., Rodríguez-Sotres R., Mata R. // Journal of Medicinal Chemistry. 2011. V. 54. P. 3875–3884. https://doi.org/10.1021/jm200167g
Figueroa M., González M. del C., Rodríguez-Sotres R., Sosa-Peinado A., González-Andrade M., Cerda-García-Rojas C.M., Mata R. // Bioorganic & Medicinal Chemistry. 2009. V. 17. P. 2167–2174. https://doi.org/10.1016/j.bmc.2008.10.079
Song Z., Gao J., Hu J., He H., Huang P., Zhang L., Song F. // Natural Product Research. 2019. P. 1–6. https://doi.org/10.1080/14786419.2019.1597355
Maes C.M., Steyn P.S. // Journal of the Chemical Society, Perkin Transactions 1. 1984. P. 1137. https://doi.org/10.1039/p19840001137
Putra H.N., Rukachaisirikul V., Saithong S., Phongpaichit S., Preedanon S., Sakayaroj J., Hadsadee S., Jungsuttiwong S. // Tetrahedron. 2019. V. 75. P. 130 530. https://doi.org/10.1016/j.tet.2019.130530
Shimada A., Takahashi I., Kawano T., Kimura Y. // Zeitschrift für Naturforschung. 2001. V. 56b. P. 797–803. https://doi.org/10.1515/znb-2001-0813
Hamasaki T., Sato Y., Hatsuda Y. // Agricultural and Biological Chemistry. 1975. V. 39. P. 2341–2345. https://doi.org/10.1080/00021369.1975.10861955
Sun R.-R., Miao F.-P., Zhang J., Wang G., Yin X.-L., Ji N.-Y. // Magnetic Resonance in Chemistry. 2013. V. 51. P. 65–68. https://doi.org/10.1002/mrc.3903
Trisuwan K., Rukachaisirikul V., Kaewpet M., Phongpaichit S., Hutadilok-Towatana N., Preedanon S., Sakayaroj J. // Journal of Natural Products. 2011. V. 74. P. 1663–1667. https://doi.org/10.1021/np200374j
Elnaggar M.S., Ebada S.S., Ashour M.L., Ebrahim W., Müller W.E.G., Mándi A., Kurtán T., Singab A., Lin W., Liu Z., Proksch P. // Tetrahedron. 2016. V. 72. P. 2411–2419. https://doi.org/10.1016/j.tet.2016.03.073
Salendra L., Lin X., Chen W., Pang X., Luo X., Long J., Liao S., Wang J., Zhou X., Liu Y., Yang B. // Natural Product Research. 2019. P. 1–9. https://doi.org/10.1080/14786419.2019.1610757
Wang H., Gloer J.B., Scott J.A., Malloch D. // Tetrahedron Letters. 1995. V. 36. P. 5847–5850. https://doi.org/10.1016/0040-4039(95)01174-G
Khamthong N., Rukachaisirikul V., Phongpaichit S., Preedanon S., Sakayaroj J. // Tetrahedron. 2012. V. 68. P. 8245–8250. https://doi.org/10.1016/j.tet.2012.07.060
Sun Y.-L., Bao J., Liu K.-S., Zhang X.-Y., He F., Wang Y.-F., Nong X.-H., Qi S.-H. // Planta Medica. 2013. V. 79. P. 1474–1479. https://doi.org/10.1055/s-0033-1350805
Li X., Zhang L., Liu Y., Guo Z., Deng Z., Chen J., XuanTu, Zou K. // Natural Product Communications. 2013. V. 8. P. 1934578X1300800. https://doi.org/10.1177/1934578X1300800510
Luo Y.-P., Zheng C.-J., Chen G.-Y., Song X.-P., Wang Z. // The Journal of Antibiotics. 2019. V. 72. P. 513–517. https://doi.org/10.1038/s41429-019-0178-8
Kumla D., Pereira J., Dethoup T., Gales L., Freitas-Silva J., Costa P., Lee M., Silva A., Sekeroglu N., Pinto M., Kijjoa A. // Marine Drugs. 2018. V. 16. P. 289. https://doi.org/10.3390/md16080289
Fujita K.-I., Nagamine Y., Ping X., Taniguchi M. // The Journal of Antibiotics. 1999. V. 52. P. 628–634. https://doi.org/10.7164/antibiotics.52.628
Wang L., Han X., Zhu G., Wang Y., Chairoungdua A., Piyachaturawat P., Zhu W. // Frontiers in Chemistry. 2018. V. 6. P. 344. https://doi.org/10.3389/fchem.2018.00344
Zhao G.-Y., Fan J.-Y., Hua C.-P., Yan W., Chen C.-J., Lu Y.-H., Jiao R.-H., Tan R.-X. // RSC Advances. 2015. V. 5. P. 5657–5663. https://doi.org/10.1039/C4RA12851F
Chen L., Li Y.-P., Li X.-X., Lu Z.-H., Zheng Q.-H., Liu Q.-Y. // The Journal of Antibiotics. 2019. V. 72. P. 34–44. https://doi.org/10.1038/s41429-018-0104-5
Kuroba ne I, Ving L., Mcinnes A. // Secalonic Acids and Their Use. DE 3002761. 1980.
Zhang J., Tao L., Liang Y., Yan Y., Dai C., Xia X., She Z., Lin Y., Fu L. // Cell Cycle. 2009. V. 8. P. 2444–2450. https://doi.org/10.4161/cc.8.15.9170
Bai M., Zheng C.-J., Tang D.-Q., Zhang F., Wang H.-Y., Chen G.-Y. // The Journal of Antibiotics. 2019. V. 72. P. 779–782. https://doi.org/10.1038/s41429-019-0206-8
Liu F., Cai X.-L., Yang H., Xia X.-K., Guo Z.-Y., Yuan J., Li M.-F., She Z.-G., Lin Y.-C. // Planta Medica. 2010. V. 76. P. 185–189. https://doi.org/10.1055/s-0029-1186047
Lenta B.N., Ngatchou J., Frese M., Ladoh-Yemeda F., Voundi S., Nardella F., Michalek C., Wibberg D., Ngouela S., Tsamo E., Kaiser M., Kalinowski J., Sewald N. // Zeitschrift für Naturforschung B. 2016. V. 71. P. 1159–1167. https://doi.org/10.1515/znb-2016-0128
Zheng C.-J., Liao H.-X., Mei R.-Q., Huang G.-L., Yang L.-J., Zhou X.-M., Shao T.-M., Chen G.-Y., Wang C.-Y. // Natural Product Research. 2019. V. 33. P. 1127–1134. https://doi.org/10.1080/14786419.2018.1460832
Inamori Y., Kato Y., Kubo M., Kamiki T., Takemoto T., Nomoto K. // Chemical & Pharmaceutical Bulletin. 1983. V. 31. P. 4543–4548. https://doi.org/10.1248/cpb.31.4543
Tao Q., Ding C., Auckloo B.N., Wu B. // Natural Product Communications. 2018. V. 13. P. 571–573. https://doi.org/10.1177/1934578X1801300514
Lu C.-H., Huang Y.-J., Shen Y.-M. // Chinese Journal of Natural Medicines. 2005. V. 3. P. 269–271.
Ukwatta K.M., Lawrence J.L., Wijayarathna C.D. // Mycology. 2019. V. 10. P. 222–228. https://doi.org/10.1080/21501203.2019.1620892
Capon R.J., Stewart M., Ratnayake R., Lacey E., Gill J.H. // Journal of Natural Products. 2007. V. 70. P. 1746–1752. https://doi.org/10.1021/np0702483
He F., Li X., Yu J.-H., Zhang X., Nong X., Chen G., Zhu K., Wang Y.-Y., Bao J., Zhang H. // Fitoterapia. 2019. V. 136. P. 104 177. https://doi.org/10.1016/j.fitote.2019.104177
Bladt T., Frisvad J., Knudsen P., Larsen T. // Molecules. 2013. V. 18. P. 11 338–11 376. https://doi.org/10.3390/molecules180911338
Xia X.-K., Huang H.-R., She Z.-G., Cai J.-W., Lan L., Zhang J.-Y., Fu L.-W., Vrijmoed L.L.P., Lin Y.-C. // Helvetica Chimica Acta. 2007. V. 90. P. 1925–1931. https://doi.org/10.1002/hlca.200790200
De Stefano S., Nicoletti R., Milone A., Zambardino S. // Phytochemistry. 1999. V. 52. P. 1399–1401. https://doi.org/10.1016/S0031-9422(99)00320-9
Stammati A., Nicoletti R., De Stefano S., Zampaglioni F., Zucco F. // Alternatives to Laboratory Animals. 2002. V. 30. P. 69–75. https://doi.org/10.1177/026119290203000107
Noor A.O., Almasri D.M., Bagalagel A.A., Abdallah H.M., Mohamed S.G.A., Mohamed G.A., Ibrahim S.R.M. // Molecules. 2020. V. 25. P. 395. https://doi.org/10.3390/molecules25020395
Chen Y., Liu Z., Liu H., Pan Y., Li J., Liu L., She Z. // Marine Drugs. 2018. V. 16. P. 54. https://doi.org/10.3390/md16020054
Li C., Gong B., Cox D., Li C., Wang J., Ding W. // Pharmacognosy Magazine. 2014. V. 10. P. 153. https://doi.org/10.4103/0973-1296.127367
Aly A.H., Edrada-Ebel R., Wray V., Müller W.E.G., Kozytska S., Hentschel U., Proksch P., Ebel R. // Phytochemistry. 2008. V. 69. P. 1716–1725. https://doi.org/10.1016/j.phytochem.2008.02.013
Wensheng L., Jiaxin X., Fenqi L., Li X., Chunyuan L. // Pharmacognosy Magazine. 2016. V. 12. P. 259–261. https://doi.org/10.4103/0973-1296.192204
Larsen T.O., Breinholt J. // Journal of Natural Products. 1999. V. 62. P. 1182–1184. https://doi.org/10.1021/np990066b
Xu Z., Xiong B., Xu J. // Natural Product Research. 2019. P. 1–5. https://doi.org/10.1080/14786419.2019.1656624
Chen S., Liu Y., Liu Z., Cai R., Lu Y., Huang X., She Z. // RSC Advances. 2016. V. 6. P. 26 412–26 420. https://doi.org/10.1039/C6RA02566H
Aly A.H., Edrada-Ebel R., Indriani I.D., Wray V., Müller W.E.G., Totzke F., Zirrgiebel U., Schächtele C., Kubbutat M.H.G., Lin W.H., Proksch P., Ebel R. // Journal of Natural Products. 2008. V. 71. P. 972–980. https://doi.org/10.1021/np070447m
Kim N., Sohn M.-J., Koshino H., Kim E.-H., Kim W.-G. // Bioorganic & Medicinal Chemistry Letters. 2014. V. 24. P. 83–86. https://doi.org/10.1016/j.bmcl.2013.11.071
Xu Z., Wu X., Li G., Feng Z., Xu J. // Natural Product Research. 2019. P. 1–6. https://doi.org/10.1080/14786419.2018.1539980
Wang Y., Yang M.-H., Wang X.-B., Li T.-X., Kong L.-Y. // Fitoterapia. 2014. V. 99. P. 153–158. https://doi.org/10.1016/j.fitote.2014.09.015
Souza G. de, Mithöfer A., Daolio C., Schneider B., Rodrigues-Filho E. // Molecules. 2013. V. 18. P. 2528–2538. https://doi.org/10.3390/molecules18032528
Jiao P., Gloer J.B., Campbell J., Shearer C.A. // Journal of Natural Products. 2006. V. 69. P. 612–615. https://doi.org/10.1021/np0504661
Хань Ж., Мэй В., Жао Е., Дэн Ю., Дай Х. // Химия природных соединений. 2009. Т. 45. № 6. С. 676–677.
Wang X., Radwan M.M., Taráwneh A.H., Gao J., Wedge D.E., Rosa L.H., Cutler H.G., Cutler S.J. // Journal of Agricultural and Food Chemistry. 2013. V. 61. P. 4551–4555. https://doi.org/10.1021/jf400212y
Afiyatullov S.S., Zhuravleva O.I., Antonov A.S., Leshchenko E.V., Pivkin M.V., Khudyakova Y.V., Denisenko V.A., Pislyagin E.A., Kim N.Y., Berdyshev D.V., Amsberg G. von, Dyshlovoy S.A. // Marine Drugs. 2019. V. 17. P. 647. https://doi.org/10.3390/md17110647
Zhang F.-Z., Li X.-M., Yang S.-Q., Meng L.-H., Wang B.-G. // Journal of Natural Products. 2019. V. 82. P. 1535–1541. https://doi.org/10.1021/acs.jnatprod.8b01091
Jadulco R., Proksch P., Wray V., Sudarsono, Berg A., Gräfe U. // Journal of Natural Products. 2001. V. 64. P. 527–530. https://doi.org/10.1021/np000401s
Grabley S., Granzer E., Hütter K., Ludwig D., Mayer M., Thiericke R., Till G., Wink J., Philipps S., Zeeck A. // The Journal of Antibiotics. 1992. V. 45. P. 56–65. https://doi.org/10.7164/antibiotics.45.56
An F.-L., Liu W.-H., Wei X.-C., Pan Z.-H., Lu Y.-H. // Natural Product Communications. 2018. V. 13. P. 865–866. https://doi.org/10.1177/1934578X1801300720
Umeokoli B.O., Ebrahim W., El-Neketi M., Müller W.E.G., Kalscheuer R., Lin W., Liu Z., Proksch P. // Natural Product Research. 2019. V. 33. P. 2215–2222. https://doi.org/10.1080/14786419.2018.1496430
Abdou R., Scherlach K., Dahse H.-M., Sattler I., Hertweck C. // Phytochemistry. 2010. V. 71. P. 110–116. https://doi.org/10.1016/j.phytochem.2009.09.024
Aldridge D.C., Galt S., Giles D., Turner W.B. // Journal of the Chemical Society C: Organic. 1971. P. 1623. https://doi.org/10.1039/j39710001623
Xia M.-W., Yang Y., Xu R., Li C.-W., Cui C.-B. // Natural Product Research. 2019. V. 33. P. 89–94. https://doi.org/10.1080/14786419.2018.1434644
Carvalho M.R., Barbosa L.C. de A., Queiróz J.H. de, Howarth O.W. // Tetrahedron Letters. 2001. V. 42. P. 809–811. https://doi.org/10.1016/S0040-4039(00)02154-7
Zhao D.-L., Shao C.-L., Zhang Q., Wang K.-L., Guan F.-F., Shi T., Wang C.-Y. // Journal of Natural Products. 2015. V. 78. P. 2310–2314. https://doi.org/10.1021/acs.jnatprod.5b00575
Hayasaka S., Koseki T., Murayama T., Kwon E., Shiono Y. // Zeitschrift für Naturforschung B. 2011. V. 66. P. 961–964. https://doi.org/10.1515/znb-2011-0915
Юрченко А. Н., Сметанина О. Ф., Калиновский А. И., Пивкин М. В., Дмитренок П. С., Кузнецова Т. А. // Известия Академии наук. Серия химическая. 2010. Т. 59. № 4. С. 834–838.
Chokpaiboon S., Unagul P., Nithithanasilp S., Komwijit S., Somyong W., Ratiarpakul T., Isaka M., Bunyapaiboonsri T. // Natural Product Research. 2018. V. 32. P. 149–153. https://doi.org/10.1080/14786419.2017.1342083
Zheng C.-J., Huang G.-L., Liao H.-X., Mei R.-Q., Luo Y.-P., Chen G.-Y., Zhang Q.-Y. // Bioorganic Chemistry. 2019. V.85. P. 382–385. https://doi.org/10.1016/j.bioorg.2019.01.015
Хуан Ж., Гуо Ж., Ян Ж., Йин С., Ли С., Луо В., Шэ Ж., Линь Е. // Химия природных соединений. 2009. Т. 45. № 5. С. 528–530.
Kornsakulkarn J., Somyong W., Supothina S., Boonyuen N., Thongpanchang C. // Tetrahedron. 2015. V. 71. P. 9112–9116. https://doi.org/10.1016/j.tet.2015.10.015
Beekman A.M., Barrow R.A. // Australian Journal of Chemistry. 2015. V. 68. P. 1583. https://doi.org/10.1071/CH15144
Matsuo H., Nonaka K., Nagano Y., Yabuki A., Fujikura K., Takahashi Y., Ōmura S., Nakashima T. // Bioscience, Biotechnology, and Biochemistry. 2018. V. 82. P. 1323–1326. https://doi.org/10.1080/09168451.2018.1467264
Elissawy A.M., Ebada S.S., Ashour M.L., El-Neketi M., Ebrahim W., Singab A.B. // Phytochemistry Letters. 2019. V. 29. P. 1–5. https://doi.org/10.1016/j.phytol.2018.10.014
Ishikawa Y., Morimoto K., Hamasaki T. // Journal of the American Oil Chemists’ Society. 1984. V. 61. P. 1864–1868. https://doi.org/10.1007/BF02540819
Zhang Z., He X., Liu C., Che Q., Zhu T., Gu Q., Li D. // RSC Advances. 2016. V. 6. P. 76 498–76 504. https://doi.org/10.1039/C6RA14640F
Li H.-L., Li X.-M., Mándi A., Antus S., Li X., Zhang P., Liu Y., Kurtán T., Wang B.-G. // The Journal of Organic Chemistry. 2017. V. 82. P. 9946–9954. https://doi.org/10.1021/acs.joc.7b01277
Reichling J., Suschke U., Schneele J., Geiss H.K. // Natural Product Communications. 2006. V. 1. P. 1934578X0600101. https://doi.org/10.1177/1934578X0600101116
Reddy M., Gupta S., Jacob M., Khan S., Ferreira D. // Planta Medica. 2007. V. 73. P. 461–467. https://doi.org/10.1055/s-2007-967167
Frank M., Hartmann R., Plenker M., Mándi A., Kurtán T., Özkaya F.C., Müller W.E.G., Kassack M.U., Hamacher A., Lin W., Liu Z., Proksch P. // Journal of Natural Products. 2019. V. 82. P. 2159–2166. https://doi.org/10.1021/acs.jnatprod.9b00151
Klaiklay S., Rukachaisirikul V., Tadpetch K., Sukpondma Y., Phongpaichit S., Buatong J., Sakayaroj J. // Tetrahedron. 2012. V. 68. P. 2299–2305. https://doi.org/10.1016/j.tet.2012.01.041
Itabashi T., Nozawa K., Nakajima S., Kawai K. // Chemical & Pharmaceutical Bulletin. 1993. V. 41. P. 2040–2041. https://doi.org/10.1248/cpb.41.2040
Taniguchi M., Kaneda N., Shibata K., Kamikawa T. // Agricultural and Biological Chemistry. 1978. V. 42. P. 1629–1630. https://doi.org/10.1080/00021369.1978.10863223
Nuankeaw K., Chaiyosang B., Suebrasri T., Kanokmedhakul S., Lumyong S., Boonlue S. // Mycoscience. 2020. V. 61. P. 16–21. https://doi.org/10.1016/j.myc.2019.10.001
Yamazaki M., Maebayashi Y. // Chemical & Pharmaceutical Bulletin. 1982. V. 30. P. 514–518. https://doi.org/10.1248/cpb.30.514
Chomcheon P., Wiyakrutta S., Sriubolmas N., Ngamrojanavanich N., Mahidol C., Ruchirawat S., Kittakoop P. // Phytochemistry. 2009. V. 70. P. 121–127. https://doi.org/10.1016/j.phytochem.2008.10.007
Fang M.J., Fang H., Li W.J., Huang D.M., Wu Z., Zhao Y.F. // Natural Product Research. 2012. V. 26. P. 1224–1228. https://doi.org/10.1080/14786419.2011.559947
Hargreaves J., Park J., Ghisalberti E.L., Sivasithamparam K., Skelton B.W., White A.H. // Journal of Natural Products. 2002. V. 65. P. 7–10. https://doi.org/10.1021/np0102758
Fang S.-T., Wang Y.-J., Ma X.-Y., Yin X.-L., Ji N.-Y. // Natural Product Research. 2019. V. 33. P. 3127–3133. https://doi.org/10.1080/14786419.2018.1522314
Wen S., Fan W., Guo H., Huang C., Yan Z., Long Y. // Natural Product Research. 2019. P. 1–7. https://doi.org/10.1080/14786419.2019.1598993
Xu X., Yang H., Xu H., Yin L., Chen Z., Shen H. // Natural Product Research. 2018. V. 32. P. 821–825. https://doi.org/10.1080/14786419.2017.1363754
Gao H., Zhou L., Cai S., Zhang G., Zhu T., Gu Q., Li D. // The Journal of Antibiotics. 2013. V. 66. P. 539–542. https://doi.org/10.1038/ja.2013.40
Li X.-B., Zhou Y.-H., Zhu R.-X., Chang W.-Q., Yuan H.-Q., Gao W., Zhang L.-L., Zhao Z.-T., Lou H.-X. // Chemistry & Biodiversity. 2015. V. 12. P. 575–592. https://doi.org/10.1002/cbdv.201400146
Cooke R.G., Edwards J.M. Fortschritte der Chemie organischer Naturstoffe / Progress in the Chemistry of Organic Natural Products / Eds. Herz W., Grisebach H., Kirby G.W. Vienna: Springer Vienna, 1981. 153–190 p.https://doi.org/10.1007/978-3-7091-8611-4_4
Homma K., Fukuyama K., Katsube Y., Kimura Y., Hamasaki T. // Agricultural and Biological Chemistry. 1980. V. 44. P. 1333–1337. https://doi.org/10.1271/bbb1961.44.1333
Ayer W.A., Hiratsuka Y. // Revista Latinoamericana de Quimica. 1982. V. 13. P. 84–87.
Ayer W.A., Hoyano Y., Pedras M.S., Altena I. van // Canadian Journal of Chemistry. 1986. V. 64. P. 1585–1589. https://doi.org/10.1139/v86-262
Tanaka Y., Matsuzaki K., Zhong C.-L., Yoshida H., Kawakubo T., Masuma R., Tanaka H., Omura S. // The Journal of Antibiotics. 1996. V. 49. P. 1056–1059. https://doi.org/10.7164/antibiotics.49.1056
Bai Y.-B., Gao Y.-Q., Nie X.-D., Tuong T.-M.-L., Li D., Gao J.-M. // Journal of Agricultural and Food Chemistry. 2019. V. 67. P. 6125–6132. https://doi.org/10.1021/acs.jafc.9b00606
Gauthier T., Wang X., Sifuentes Dos Santos J., Fysikopoulos A., Tadrist S., Canlet C., Artigot M.P., Loiseau N., Oswald I.P., Puel O. // PLoS One. 2012. V. 7. P. e29 906. https://doi.org/10.1371/journal.pone.0029906
Gao J.-M., Yang S.-X., Qin J.-C. // Chemical Reviews. 2013. V. 113. P. 4755–4811. https://doi.org/10.1021/cr300402y
Wang C.-Y., Hao J.-D., Ning X.-Y., Wu J.-S., Zhao D.-L., Kong C.-J., Shao C.-L., Wang C.-Y. // RSC Advances. 2018. V. 8. P. 4348–4353. https://doi.org/10.1039/C7RA13327H
Pairet L., Wrigley S.K., Chetland I., Reynolds E.E., Hayes M.A., Holloway J., Ainsworth A.M., Katzer W., Cheng X.-M., Hupe D.J., Charlton P., Doherty A.M. // The Journal of Antibiotics. 1995. V. 48. P. 913–923. https://doi.org/10.7164/antibiotics.48.913
Luo X., Lin X., Tao H., Wang J., Li J., Yang B., Zhou X., Liu Y. // Journal of Natural Products. 2018. V. 81. P. 934–941. https://doi.org/10.1021/acs.jnatprod.7b01053
Hemtasin C., Kanokmedhakul S., Moosophon P., Soytong K., Kanokmedhakul K. // Phytochemistry Letters. 2016. V. 16. P. 56–60. https://doi.org/10.1016/j.phytol.2016.03.004
Myobatake Y., Takeuchi T., Kuramochi K., Kuriyama I., Ishido T., Hirano K., Sugawara F., Yoshida H., Mizushina Y. // Journal of Natural Products. 2012. V. 75. P. 135–141. https://doi.org/10.1021/np200523b
Yang S.-W., Chan T.-M., Terracciano J., Patel R., Patel M., Gullo V., Chu M. // The Journal of Antibiotics. 2006. V. 59. P. 720–723. https://doi.org/10.1038/ja.2006.96
Trivedi A.B., Hirota M., Doi E., Kitabatake N. // Journal of the Chemical Society, Perkin Transactions 1. 1993. P. 2167. https://doi.org/10.1039/p19930002167
Sadorn K., Saepua S., Boonyuen N., Laksanacharoen P., Rachtawee P., Pittayakhajonwut P. // RSC Advances. 2016. V. 6. P. 94 510–94 523. https://doi.org/10.1039/C6RA21898A
Chen S., Wang J., Wang Z., Lin X., Zhao B., Kaliaperumal K., Liao X., Tu Z., Li J., Xu S., Liu Y. // Fitoterapia. 2017. V. 117. P. 71–78. https://doi.org/10.1016/j.fitote.2017.01.005
Vanmiddlesworth F., Giacobbe R.A., Lopez M., Garrity G., Bland J.A., Bartizal K., Fromtling R.A., Polishook J., Zweerink M., Edison A.M., Rozdilsky W., Wilson K.E., Monaghan R.L. // The Journal of Antibiotics. 1992. V. 45. P. 861–867. https://doi.org/10.7164/antibiotics.45.861
Choi B.-K., Phan T.H.T., Hwang S., Oh D.-C., Kang J.S., Lee H.-S., Ngo T.D.N., Tran T.T.V., Shin H.J. // Journal of Natural Products. 2019. V. 82. P. 3186–3190. https://doi.org/10.1021/acs.jnatprod.9b00776
Neuhaus G.F., Adpressa D.A., Bruhn T., Loesgen S. // Journal of Natural Products. 2019. V. 82. P. 2780–2789. https://doi.org/10.1021/acs.jnatprod.9b00416
Sassa T., Takemura T., Ikeda M., Miura Y. // Tetrahedron Letters. 1973. V. 14. P. 2333–2334. https://doi.org/10.1016/S0040-4039(01)96211-2
Niu S., Tang X.-X., Fan Z., Xia J.-M., Xie C.-L., Yang X.-W. // Marine Drugs. 2019. V. 17. P. 125. https://doi.org/10.3390/md17020125
Höller U., Wright A.D., Matthee G.F., Konig G.M., Draeger S., Aust H.-J., Schulz B. // Mycological Research. 2000. V. 104. P. 1354–1365. https://doi.org/10.1017/S0953756200003117
Yu G., Sun Z., Peng J., Zhu M., Che Q., Zhang G., Zhu T., Gu Q., Li D. // Journal of Natural Products. 2019. V. 82. P. 2013–2017. https://doi.org/10.1021/acs.jnatprod.9b00345
Kanoh K., Adachi K., Matsuda S., Shizuri Y., Yasumoto K., Kusumi T., Okumura K., Kirikae T. // The Journal of Antibiotics. 2008. V. 61. P. 192–194. https://doi.org/10.1038/ja.2008.29
Madhyastha M.S., Marquardt R.R., Masi A., Borsa J., Frohlich A.A. // Journal of Food Protection. 1994. V. 57. P. 48–53. https://doi.org/10.4315/0362-028X-57.1.48
Al-Fakih A.A., Almaqtri W.Q.A. // Mycology. 2019. V. 10. P. 191–209. https://doi.org/10.1080/21501203.2019.1604576
Vansteelandt M., Blanchet E., Egorov M., Petit F., Toupet L., Bondon A., Monteau F., Le Bizec B., Thomas O.P., Pouchus Y.F., Le Bot R., Grovel O. // Journal of Natural Products. 2013. V. 76. P. 297–301. https://doi.org/10.1021/np3007364
Nguyen H.T., Yu N.H., Jeon S.J., Lee H.W., Bae C.-H., Yeo J.H., Lee H.B., Kim I.-S., Park H.W., Kim J.-C. // Letters in Applied Microbiology. 2016. V. 62. P. 488–493. https://doi.org/10.1111/lam.12578
Liu W.-H., Ding Y., Ji X., An F.-L., Lu Y.-H. // The Journal of Antibiotics. 2019. V. 72. P. 111–113. https://doi.org/10.1038/s41429-018-0110-7
Zhu G., Kong F., Wang Y., Fu P., Zhu W. // Marine Drugs. 2018. V. 16. P. 71. https://doi.org/10.3390/md16020071
Li M.-F., Li G.-H., Zhang K.-Q. // Metabolites. 2019. V. 9. P. 58. https://doi.org/10.3390/metabo9030058
Corral P., Esposito F.P., Tedesco P., Falco A., Tortorella E., Tartaglione L., Festa C., D’Auria M.V., Gnavi G., Varese G.C., Pascale D. de // Marine Biotechnology. 2018. V. 20. P. 502–511. https://doi.org/10.1007/s10126-018-9821-9
Trifonov L.S., Hilpert H., Floersheim P., Dreiding A.S., Rast D.M., Skrivanova R., Hoesch L. // Tetrahedron. 1986. V. 42. P. 3157–3179. https://doi.org/10.1016/S0040-4020(01)87382-8
Fujii Y., Asahara M., Ichinoe M., Nakajima H. // Phytochemistry. 2002. V. 60. P. 703–708. https://doi.org/10.1016/S0031-9422(02)00196-6
Won-Gon K., Ryoo I.-J., Park S.-H., Kim D.-S., Lee S., Park K.-C., Yoo I.-D. // Journal of Microbiology and Biotechnology. 2005. V. 15. P. 891–894.
Asfour H.Z., Awan Z.A., Bagalagel A.A., Elfaky M.A., Abdelhameed R.F.A., Elhady S.S. // Biomolecules. 2019. V. 9. P. 480. https://doi.org/10.3390/biom9090480
Tan Q.-W., Fang P.-H., Ni J.-C., Gao F., Chen Q.-J. // Molecules. 2017. V. 22. P. 2073. https://doi.org/10.3390/molecules22122073
Pastre R., Marinho A.M.R., Rodrigues-Filho E., Souza A.Q.L., Pereira J.O. // Química Nova. 2007. V. 30. P. 1867–1871. https://doi.org/10.1590/S0100-40422007000800013
Song T., Chen M., Ge Z.-W., Chai W., Li X.-C., Zhang Z., Lian X.-Y. // The Journal of Organic Chemistry. 2018. V. 83. P. 13 395–13 401. https://doi.org/10.1021/acs.joc.8b02172
Rukachaisirikul V., Satpradit S., Klaiklay S., Phongpaichit S., Borwornwiriyapan K., Sakayaroj J. // Tetrahedron. 2014. V. 70. P. 5148–5152. https://doi.org/10.1016/j.tet.2014.05.105
Ivanets E., Yurchenko A., Smetanina O., Rasin A., Zhuravleva O., Pivkin M., Popov R., Amsberg G. von, Afiyatullov S., Dyshlovoy S. // Marine Drugs. 2018. V. 16. P. 232. https://doi.org/10.3390/md16070232
Xu L.-L., Hai P., Zhang S.-B., Xiao J.-F., Gao Y., Ma B.-J., Fu H.-Y., Chen Y.-M., Yang X.-L. // Journal of Natural Products. 2019. V. 82. P. 221–231. https://doi.org/10.1021/acs.jnatprod.8b00589
Khalil Z.G., Huang X., Raju R., Piggott A.M., Capon R.J. // The Journal of Organic Chemistry. 2014. V. 79. P. 8700–8705. https://doi.org/10.1021/jo501501z
Yang S.-Q., Li X.-M., Li X., Chi L.-P., Wang B.-G. // Marine Drugs. 2018. V. 16. P. 114. https://doi.org/10.3390/md16040114
Lacey H.J., Vuong D., Pitt J.I., Lacey E., Piggott A.M. // Australian Journal of Chemistry. 2016. V. 69. P. 152. https://doi.org/10.1071/CH15488
Johnson J.H., Phillipson D.W., Kahle A.D. // The Journal of Antibiotics. 1989. V. 42. P. 1184–1185. https://doi.org/10.7164/antibiotics.42.1184
Limbadri S., Luo X., Lin X., Liao S., Wang J., Zhou X., Yang B., Liu Y. // Molecules (Basel, Switzerland). 2018. V. 23. P. 2379. https://doi.org/10.3390/molecules23092379
Takahashi C., Matsushita T., Doi M., Minoura K., Shingu T., Kumeda Y., Numata A. // J. Chem. Soc., Perkin Trans. 1. 1995. P. 2345–2353. https://doi.org/10.1039/P19950002345
Rank C., Phipps R.K., Harris P., Frisvad J.C., Gotfredsen C.H., Larsen T.O. // Tetrahedron Letters. 2006. V. 47. P. 6099–6102. https://doi.org/10.1016/j.tetlet.2006.06.086
Afiyatullov S.Sh., Zhuravleva O.I., Antonov A.S., Berdyshev D.V., Pivkin M.V., Denisenko V.A., Popov R.S., Gerasimenko A.V., Amsberg G. von, Dyshlovoy S.A., Leshchenko E.V., Yurchenko A.N. // The Journal of Antibiotics. 2018. V. 71. P. 846–853. https://doi.org/10.1038/s41429-018-0072-9
Zhou R., Liao X., Li H., Li J., Feng P., Zhao B., Xu S. // Front. Chem. 2018. V. 6. P. 212. https://doi.org/10.3389/fchem.2018.00212
Zheng C.-J., Bai M., Zhou X.-M., Huang G.-L., Shao T.-M., Luo Y.-P., Niu Z.-G., Niu Y.-Y., Chen G.-Y., Han C.-R. // Journal of Natural Products. 2018. V. 81. P. 1045–1049. https://doi.org/10.1021/acs.jnatprod.7b00673
Elsbaey M., Tanaka C., Miyamoto T. // Phytochemistry Letters. 2019. V. 32. P. 70–76. https://doi.org/10.1016/j.phytol.2019.04.023
Chen Y., Liu Z., Huang Y., Liu L., He J., Wang L., Yuan J., She Z. // Journal of Natural Products. 2019. V. 82. P. 1752–1758. https://doi.org/10.1021/acs.jnatprod.8b00918
Wijeratne E.M.K., He H., Franzblau S.G., Hoffman A.M., Gunatilaka A.A.L. // Journal of Natural Products. 2013. V. 76. P. 1860–1865. https://doi.org/10.1021/np400391p
Wang P., Cui Y., Cai C., Chen H., Dai Y., Chen P., Kong F., Yuan J., Song X., Mei W., Dai H. // Marine Drugs. 2018. V. 17. P. 4. https://doi.org/10.3390/md17010004
Suzuki S., Hosoe T., Nozawa K., Kawai K., Yaguchi T., Udagawa S. // Journal of Natural Products. 2000. V. 63. P. 768–772. https://doi.org/10.1021/np990371x
Bao J., Zhai H., Zhu K., Yu J.-H., Zhang Y., Wang Y., Jiang C.-S., Zhang X., Zhang Y., Zhang H. // Marine Drugs. 2018. V. 16. P. 174. https://doi.org/10.3390/md16050174
Alfatafta A.A., Gloer J.B., Scott J.A., Malloch D. // Journal of Natural Products. 1994. V. 57. P. 1696–1702. https://doi.org/10.1021/np50114a012
Jiao R.H., Xu S., Liu J.Y., Ge H.M., Ding H., Xu C., Zhu H.L., Tan R.X. // Organic Letters. 2006. V. 8. P. 5709–5712. https://doi.org/10.1021/ol062257t
TePaske M.R., Gloer J.B., Wicklow D.T., Dowd P.F. // Tetrahedron Letters. 1991. V. 32. P. 5687–5690. https://doi.org/10.1016/S0040-4039(00)93530-5
Ge H.M., Shen Y., Zhu C.H., Tan S.H., Ding H., Song Y.C., Tan R.X. // Phytochemistry. 2008. V. 69. P. 571–576. https://doi.org/10.1016/j.phytochem.2007.07.014
Banert K., Tantillo D.J. // Natural Product Research. 2019. V. 33. P. 3011–3015. https://doi.org/10.1080/14786419.2018.1509330
Tao H., Li Y., Lin X., Zhou X., Dong J., Liu Y., Yang B. // Natural Product Communications. 2018. V. 13. P. 1629–1631. https://doi.org/10.1177/1934578X1801301214
Choi B.-K., Trinh P.T.H., Lee H.-S., Choi B.-W., Kang J.S., Ngoc N.T.D., Van T.T.T., Shin H.J. // Marine Drugs. 2019. V. 17. P. 346. https://doi.org/10.3390/md17060346
Bladt T., Dürr C., Knudsen P., Kildgaard S., Frisvad J., Gotfredsen C., Seiffert M., Larsen T. // Molecules. 2013. V. 18. P. 14 629–14 650. https://doi.org/10.3390/molecules181214629
Tan Y., Yang B., Lin X., Luo X., Pang X., Tang L., Liu Y., Li X., Zhou X. // Journal of Natural Products. 2018. V. 81. P. 92–97. https://doi.org/10.1021/acs.jnatprod.7b00698
Fang W., Lin X., Zhou X., Wan J., Lu X., Yang B., Ai W., Lin J., Zhang T., Tu Z., Liu Y. // Med. Chem. Commun. 2014. V. 5. P. 701–705. https://doi.org/10.1039/C3MD00371J
Belofsky G., Jensen P., Renner M., Fenical W. // Tetrahedron. 1998. V. 54. P. 1715–1724. https://doi.org/10.1016/S0040-4020(97)10396-9
Deng Q., Li G., Sun M., Yang X., Xu J. // Natural Product Research. 2018. P. 1–5. https://doi.org/10.1080/14786419.2018.1512993
Zhou J., Li G., Deng Q., Zheng D., Yang X., Xu J. // Natural Product Research. 2018. V. 32. P. 2968–2972. https://doi.org/10.1080/14786419.2017.1395431
Hamasaki T., Nagayama K., Hatsuda Y. // Agricultural and Biological Chemistry. 1978. V. 42. P. 37–40. https://doi.org/10.1080/00021369.1978.10862919
Li X.-D., Li X.-M., Xu G.-M., Zhang P., Wang B.-G. // Journal of Natural Products. 2015. V. 78. P. 844–849. https://doi.org/10.1021/acs.jnatprod.5b00004
Wang P., Yu J.-H., Zhu K., Wang Y., Cheng Z.-Q., Jiang C.-S., Dai J.-G., Wu J., Zhang H. // Fitoterapia. 2018. V. 127. P. 322–327. https://doi.org/10.1016/j.fitote.2018.02.031
Yao Q., Wang J., Zhang X., Nong X., Xu X., Qi S. // Marine Drugs. 2014. V. 12. P. 5902–5915. https://doi.org/10.3390/md12125902
Qiu L., Wang P., Liao G., Zeng Y., Cai C., Kong F., Guo Z., Proksch P., Dai H., Mei W. // Marine Drugs. 2018. V. 16. P. 108. https://doi.org/10.3390/md16040108
Xing C.-P., Xie C.-L., Xia J.-M., Liu Q.-M., Lin W.-X., Ye D.-Z., Liu G.-M., Yang X.-W. // Marine Drugs. 2019. V. 17. P. 507. https://doi.org/10.3390/md17090507
Amagata T., Doi M., Tohgo M., Minoura K., Numata A. // Chemical Communications. 1999. P. 1321–1322. https://doi.org/10.1039/a903840j
Amagata T., Tanaka M., Yamada T., Doi M., Minoura K., Ohishi H., Yamori T., Numata A. // Journal of Natural Products. 2007. V. 70. P. 1731–1740. https://doi.org/10.1021/np070165m
Guo Y.-W., Gong B.-Q., Yuan J., Li H.-J., Mahmud T., Huang Y., Li J.-F., Yang D.-P., Lan W.-J. // Journal of Natural Products. 2019. V. 83. P. 79–87. https://doi.org/10.1021/acs.jnatprod.9b00710
Yang B., He Y., Lin S., Zhang J., Li H., Wang J., Hu Z., Zhang Y. // Journal of Natural Products. 2019. V. 82. P. 1923–1929. https://doi.org/10.1021/acs.jnatprod.9b00305
Evidente A., Sparapano L., Motta A., Giordano F., Fierro O., Frisullo S. // Phytochemistry. 1996. V. 42. P. 1541–1546. https://doi.org/10.1016/0031-9422(96)00206-3
Yan T., Guo Z., Jiang R., Wei W., Wang T., Guo Y., Song Y., Jiao R., Tan R., Ge H. // Planta Medica. 2013. V. 79. P. 348–352. https://doi.org/10.1055/s-0032-1328260
Lallemand B., Masi M., Maddau L., De Lorenzi M., Dam R., Cimmino A., Moreno y Banuls L., Andolfi A., Kiss R., Mathieu V., Evidente A. // Phytochemistry Letters. 2012. V. 5. P. 770–775. https://doi.org/10.1016/j.phytol.2012.08.011
Li Y., Ye D., Shao Z., Cui C., Che Y. // Marine Drugs. 2012. V. 10. P. 497–508. https://doi.org/10.3390/md10020497
Yu H.-B., Wang X.-L., Zhang Y.-X., Xu W.-H., Zhang J.-P., Zhou X.-Y., Lu X.-L., Liu X.-Y., Jiao B.-H. // Journal of Natural Products. 2018. V. 81. P. 1553–1560. https://doi.org/10.1021/acs.jnatprod.8b00039
Lu X.-L., Liu J.-T., Liu X.-Y., Gao Y., Zhang J., Jiao B.-H., Zheng H. // The Journal of Antibiotics. 2014. V. 67. P. 171–174. https://doi.org/10.1038/ja.2013.104
Li X.-D., Li X., Li X.-M., Xu G.-M., Liu Y., Wang B.-G. // Marine Drugs. 2018. V. 16. P. 440. https://doi.org/10.3390/md16110440
Ratnaweera P.B., Williams D.E., Silva E.D. de, Wijesundera R.L.C., Dalisay D.S., Andersen R.J. // Mycology. 2014. V. 5. P. 23–28. https://doi.org/10.1080/21501203.2014.892905
Yang M.-H., Li T.-X., Wang Y., Liu R.-H., Luo J., Kong L.-Y. // Fitoterapia. 2017. V. 116. P. 72–76. https://doi.org/10.1016/j.fitote.2016.11.008
Amagata T., Amagata A., Tenney K., Valeriote F.A., Lobkovsky E., Clardy J., Crews P. // Organic Letters. 2003. V. 5. P. 4393–4396. https://doi.org/10.1021/ol0356800
Kong F.-D., Huang X.-L., Ma Q.-Y., Xie Q.-Y., Wang P., Chen P.-W., Zhou L.-M., Yuan J.-Z., Dai H.-F., Luo D.-Q., Zhao Y.-X. // Journal of Natural Products. 2018. V. 81. P. 1869–1876. https://doi.org/10.1021/acs.jnatprod.8b00382
Springer J.P., Dorner J.W., Cole R.J., Cox R.H. // The Journal of Organic Chemistry. 1979. V. 44. P. 4852–4854. https://doi.org/10.1021/jo00394a023
Li H.-L., Li X.-M., Li X., Yang S.-Q., Wang B.-G. // Phytochemistry Letters. 2019. V. 32. P. 138–142. https://doi.org/10.1016/j.phytol.2019.05.017
Li G.-Y., Li B.-G., Yang T., Yin J.-H., Qi H.-Y., Liu G.-Y., Zhang G.-L. // Journal of Natural Products. 2005. V. 68. P. 1243–1246. https://doi.org/10.1021/np0501738
Fukuda T., Kurihara Y., Kanamoto A., Tomoda H. // The Journal of Antibiotics. 2014. V. 67. P. 593–595. https://doi.org/10.1038/ja.2014.46
Hamed A., Abdel-Razek A.S., Omran D.A., El-Metwally M.M., El-Hosari D.G., Frese M., Soliman H.S.M., Sewald N., Shaaban M. // Natural Product Research. 2019. P. 1–10. https://doi.org/10.1080/14786419.2018.1544977
Shaaban M., El-Metwally M.M., Abdel-Razek A.A., Laatsch H. // Natural Product Research. 2018. V. 32. P. 2437–2446. https://doi.org/10.1080/14786419.2017.1419230
Hamed A., Abdel-Razek A., Frese M., Stammler H., El-Haddad A., Ibrahim T., Sewald N., Shaaban M. // Molecules. 2018. V. 23. P. 299. https://doi.org/10.3390/molecules23020299
Fan S.-Q., Xie C.-L., Xia J.-M., Xing C.-P., Luo Z.-H., Shao Z., Yan X.-J., He S., Yang X.-W. // Organic & Biomolecular Chemistry. 2019. V. 17. P. 5925–5928. https://doi.org/10.1039/C9OB01159E
Li W.-H., Chang S.-T., Chang S.-C., Chang H.-T. // Natural Product Research. 2008. V. 22. P. 1085–1093. https://doi.org/10.1080/14786410802267510
Rosenberger M., Neukom C. // The Journal of Organic Chemistry. 1982. V. 47. P. 1782–1785. https://doi.org/10.1021/jo00348a043
Gao H., Hong K., Chen G.-D., Wang C.-X., Tang J.-S., Yu Y., Jiang M.-M., Li M.-M., Wang N.-L., Yao X.-S. // Magnetic Resonance in Chemistry. 2009. V. 48. P. 38–43. https://doi.org/10.1002/mrc.2536
Talapatra S.K., Bhaumik A., Talapatra B. // Phytochemistry. 1992. V. 31. P. 2431–2434. https://doi.org/10.1016/0031-9422(92)83293-8
Tong Z.-B., Cui X.-H., Wang J., Zhang C.-L., Zhang Y.-Y., Ren Z.-J. // Natural Product Research. 2017. V. 31. P. 2564–2567. https://doi.org/10.1080/14786419.2017.1320785
Chen S., Snyder J.K. // The Journal of Organic Chemistry. 1989. V. 54. P. 3679–3689. https://doi.org/10.1021/jo00276a033
Gao S.-S., Li X.-M., Li C.-S., Proksch P., Wang B.-G. // Bioorganic & Medicinal Chemistry Letters. 2011. V. 21. P. 2894–2897. https://doi.org/10.1016/j.bmcl.2011.03.076
Igarashi Y., Sekine A., Fukazawa H., Uehara Y., Yamaguchi K., Endo Y., Okuda T., Furumai T., Oki T. // The Journal of Antibiotics. 2002. V. 55. P. 371–376. https://doi.org/10.7164/antibiotics.55.371
Xie C.-L., Zhang D., Xia J.-M., Hu C.-C., Lin T., Lin Y.-K., Wang G.-H., Tian W.-J., Li Z.-P., Zhang X.-K., Yang X.-W., Chen H.-F. // Marine Drugs. 2019. V. 17. P. 178. https://doi.org/10.3390/md17030178
Abdel-Razek A.S., Hamed A., Frese M., Sewald N., Shaaban M. // Steroids. 2018. V. 138. P. 21–25. https://doi.org/10.1016/j.steroids.2018.06.005
Kaleem S., Ge H., Yi W., Zhang Z., Wu B. // Natural Product Research. 2019. P. 1–9. https://doi.org/10.1080/14786419.2019.1680669
Bayman P., Baker J.L., Doster M.A., Michailides T.J., Mahoney N.E. // Applied and Environmental Microbiology. 2002. V. 68. P. 2326–2329. https://doi.org/10.1128/AEM.68.5.2326-2329.2002
Wang Y., Wang L., Liu F., Wang Q., Selvaraj J., Xing F., Zhao Y., Liu Y. // Toxins. 2016. V. 8. P. 83. https://doi.org/10.3390/toxins8030083
Sargent M.V., Stransky P.O. // Journal of the Chemical Society, Perkin Transactions 1. 1982. P. 1605. https://doi.org/10.1039/p19820001605
Wang J., Lu Z., Liu P., Wang Y., Li J., Hong K., Zhu W. // Planta Medica. 2012. V. 78. P. 1861–1866. https://doi.org/10.1055/s-0032-1315395
Budde K., Quella F., Mathes A., Melchior W., Müller H., Nuyken O., Spiegel S. // Angewandte Makromolekulare Chemie. 1992. V. 194. P. 103–117. https://doi.org/10.1002/apmc.1992.051940109
Zhao Y., Liu D., Proksch P., Zhou D., Lin W. // Phytochemistry. 2018. V. 155. P. 61–68. https://doi.org/10.1016/j.phytochem.2018.07.017
Liu Y., Ding L., Fang F., He S. // Natural Product Research. 2019. V. 33. P. 2466–2470. https://doi.org/10.1080/14786419.2018.1452012
Li T.-X., Yang M.-H., Wang X.-B., Wang Y., Kong L.-Y. // Journal of Natural Products. 2015. V. 78. P. 2511–2520. https://doi.org/10.1021/acs.jnatprod.5b00008
Ding L., Xu P., Li T., Liao X., He S., Xu S. // Natural Product Research. 2019. V. 33. P. 3404–3408. https://doi.org/10.1080/14786419.2018.1480622
Cai J., Zhou X.-M., Yang X., Tang M.-M., Liao Q.-Y., Meng B.-Z., Liao S., Chen G.-Y. // Bioorganic Chemistry. 2019. P. 103 362. https://doi.org/10.1016/j.bioorg.2019.103362
Bai M., Huang G.-L., Mei R.-Q., Wang B., Luo Y.-P., Nong X.-H., Chen G.-Y., Zheng C.-J. // Marine Drugs. 2019. V. 17. P. 433. https://doi.org/10.3390/md17080433
Zhou X.-M., Zheng C.-J., Song X.-M., Tang M.-M., Yang J.-Y., Yang X., Peng S.-J., Cai J., Chen G.-Y. // Fitoterapia. 2019. V. 139. P. 104 400. https://doi.org/10.1016/j.fitote.2019.104400
Wu J.-T., Zheng C.-J., Zhang B., Zhou X.-M., Zhou Q., Chen G.-Y., Zeng Z.-E., Xie J.-L., Han C.-R., Lyu J.-X. // Natural Product Research. 2019. V. 33. P. 34–40. https://doi.org/10.1080/14786419.2018.1431634
Kongyen W., Rukachaisirikul V., Phongpaichit S., Sakayaroj J. // Natural Product Research. 2015. V. 29. P. 1995–1999. https://doi.org/10.1080/14786419.2015.1022542
Rao K.V., Sadhukhan A.K., Veerender M., Ravikumar V., Mohan E.V.S., Dhanvantri S.D., Sitaramkumar M., Moses Babu J., Vyas K., Om Reddy G. // Chemical & Pharmaceutical Bulletin. 2000. V. 48. P. 559–562. https://doi.org/10.1248/cpb.48.559
Sun W., Luan S., Qi C., Tong Q., Yan S., Li H., Zhang Y. // Cell Communication and Signaling. 2019. V. 17. P. 111. https://doi.org/10.1186/s12964-019-0425-4
Zeng Q., Zhong W.-M., Chen Y.-C., Xiang Y., Chen X.-Y., Tian X.-P., Zhang W.-M., Zhang S., Wang F.-Z. // Natural Product Research. 2019. P. 1–8. https://doi.org/10.1080/14786419.2019.1569658
Sun Y., Liu J., Li L., Gong C., Wang S., Yang F., Hua H., Lin H. // Bioorganic & Medicinal Chemistry Letters. 2018. V. 28. P. 315–318. https://doi.org/10.1016/j.bmcl.2017.12.049
Parvatkar R.R., D’Souza C., Tripathi A., Naik C.G. // Phytochemistry. 2009. V. 70. P. 128–132. https://doi.org/10.1016/j.phytochem.2008.10.017
Zhu J.X., Ding L., He S. // Natural Product Research. 2019. V. 33. P. 1191–1195. https://doi.org/10.1080/14786419.2018.1465423
Ding L., Li T., Liao X., He S., Xu S. // The Journal of Antibiotics. 2018. V. 71. P. 902–904. https://doi.org/10.1038/s41429-018-0079-2
Blair L.M., Sperry J. // Journal of Natural Products. 2013. V. 76. P. 794–812. https://doi.org/10.1021/np400124n
Wermuth C.G. // MedChemComm. 2011. V. 2. P. 935–941. https://doi.org/10.1039/C1MD00074H
Zhang Y.-X., Yu H.-B., Xu W.-H., Hu B., Guild A., Zhang J.-P., Lu X.-L., Liu X.-Y., Jiao B.-H. // Journal of Natural Products. 2019. V. 82. P. 3089–3095. https://doi.org/10.1021/acs.jnatprod.9b00700
Hayashi H., Mukaihara M., Murao S., Arai M., Lee A.Y., Clardy J. // Bioscience, Biotechnology, and Biochemistry. 1994. V. 58. P. 334–338. https://doi.org/10.1271/bbb.58.334
Cheng Z., Xu W., Liu L., Li S., Yuan W., Luo Z., Zhang J., Cheng Y., Li Q. // Marine Drugs. 2018. V. 16. P. 358. https://doi.org/10.3390/md16100358
Giromini C., Rebucci R., Fusi E., Rossi L., Saccone F., Baldi A. // Cell Biology and Toxicology. 2016. V. 32. P. 249–258. https://doi.org/10.1007/s10565-016-9332-2
Rottkord U., Röhl C., Ferse I., Schulz M.-C., Rückschloss U., Gekle M., Schwerdt G., Humpf H.-U. // Archives of Toxicology. 2017. V. 91. P. 1461–1471. https://doi.org/10.1007/s00204-016-1799-3
Cramer B., Harrer H., Nakamura K., Uemura D., Humpf H.-U. // Bioorganic & Medicinal Chemistry. 2010. V. 18. P. 343–347. https://doi.org/10.1016/j.bmc.2009.10.050
Brown E.D., Wright G.D. // Nature. 2016. V. 529. P. 336–343. https://doi.org/10.1038/nature17042
Lewis K. // Nature. 2012. V. 485. P. 439–440. https://doi.org/10.1038/485439a
Lewis K. // Nature Reviews Drug Discovery. 2013. V. 12. P. 371–387. https://doi.org/10.1038/nrd3975
Cameron A.J., Davison E.K., An C., Stubbing L.A., Dunbar P.R., Harris P.W.R., Brimble M.A. // The Journal of Organic Chemistry. 2020. V. 85. P. 1401–1406. https://doi.org/10.1021/acs.joc.9b02348
Lai Y., Zhang N., Zhang Y., Chen J.-H., Yang Z. // Organic Letters. 2018. V. 20. P. 4298–4301. https://doi.org/10.1021/acs.orglett.8b01733
Wolfender J.-L., Litaudon M., Touboul D., Queiroz E.F. // Natural Product Reports. 2019. V. 36. P. 855–868. https://doi.org/10.1039/C9NP00004F
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия