Биоорганическая химия, 2020, T. 46, № 6, стр. 666-669
Пептид HLDF-6-амид снижает цитотоксичность доксорубицина и активирует пролиферацию инфузорий Tetrahymena pyriformis
О. Ю. Соколов 1, *, А. Н. Позднякова 1, Е. Г. Черемных 1, Е. В. Васильева 3, Н. В. Кост 1, Ю. А. Золотарев 2
1 ФГБНУ Научный центр психического здоровья РАН
115552 Москва, Каширское шоссе, 34, Россия
2 Институт молекулярной генетики РАН
119334 Москва, пл. Курчатова, 4, Россия
3 ФГБНУ Институт фармакологии им. В.В. Закусова РАН
119334 Москва, ул. Балтийская, 9, Россия
* E-mail: oleg-sokolov@yandex.ru
Поступила в редакцию 09.04.2020
После доработки 16.04.2020
Принята к публикации 29.04.2020
Аннотация
Механизмы ряда биологических эффектов пептидного нейропротектора HLDF-6-амида до сих пор неизвестны и требуют дополнительного изучения. Нами впервые установлено, что HLDF-6-амид дозозависимо (1–100 мкМ) стимулирует пролиферацию инфузорий Tetrahymena pyriformis, причем антагонист глутаматных NMDA-рецепторов МК801 частично блокирует данный эффект. Показано, что введение пептида (12.5–100 мкМ) дозозависимо снижает цитотоксический и цитостатический эффект доксорубицина (25 мкМ) на инфузориях. Радио-лигандный анализ выявил наличие мест специфического связывания [3H] Ac-HLDF-6-амида на клеточных мембранах коры головного мозга крыс, что свидетельствует о рецепторном механизме действия пептида. Таким образом, впервые показано, что HLDF-6-амид стимулирует пролиферацию и обладает цитопротекторными свойствами, что может лежать в основе его ранозаживляющего, ноотропного и нейропротекторного действия. Установлено участие глутаматной системы, в частности ионотропных NMDA-рецепторов, в реализации его эффектов.
ВВЕДЕНИЕ
Гексапептид Thr-Gly-Glu-Asn-His-Arg, фрагмент 41–46 фактора дифференцировки лейкоцитов (HLDF), полностью воспроизводит действие полноразмерного фактора, обладает широким спектром ноотропной и нейропротективной активности. На основе модификаций молекулы HLDF-6 разрабатываются пептидные препараты для профилактики и лечения цереброваскулярных и нейродегенеративных заболеваний [1–3]. Недавно были выявлены другие лечебные эффекты одного из них, пептида HLDF-6-амида. Так в эксперименте на животных было показано, что HLDF-6-амид в составе геля ускоряет эпителизацию раневой поверхности ожога, причем в минимальной концентрации [4].
Целью исследования была проверка гипотезы о том, что в основе указанных биологических эффектов пептида может лежать его пролиферативная активность. В работе использовались инфузории рода Tetrahymena, широко применяющиеся в фармакологии на первом этапе оценки безопасности и/или эффективности различных соединений. Преимуществом инфузорий перед другими тест-организмами является высокая интенсивность обмена веществ, быстрый рост, возможность работы со стерильной культурой и стандартным штаммом [5]. Изучали влияние HLDF-6-амида на рост культуры в присутствии цитостатика доксорубицина и в норме. Молекулярный механизм обнаруженных эффектов пептида изучали с точки зрения его взаимодействия с глутаматными рецепторами.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Была изучена способность HLDF-6-амида влиять на рост числа инфузорий в суточной культуре. Было установлено, что введение пептида в культуру клеток дозозависимо стимулировало их размножение (рис. 1). Пептид оказывал статистически значимый (p < 0.05) пролиферативый эффект уже в концентрации 5 мкМ. Наибольший эффект (p < 0.01) логично наблюдался при его максимальной концентрации 100 мкМ. Эквимолярный аминокислотный контроль во всех использованных концентрациях (1–100 мкМ) данным эффектом не обладал и показывал значения, сходные с показателем, наблюдаемым при культивировании клеток в дистиллированной воде. Таким образом, можно сделать вывод о специфическом действии молекулы пептида, а не простом “подкормочном” эффекте. Обнаруженный нами пролиферативный эффект пептида хорошо согласуется с данными о влиянии нативного HLDF-6 на синтез белка в культуре гепатоцитов [6].
Рис. 1.
Пролиферативный эффект пептида HLDF-6-амида. Данные трех независимых экспериментов представлены в виде среднего ± стандартная ошибка среднего (m ± SEM). *, ** – Пролиферативный эффект HLDF-6-амида, отличие от дистиллированной воды и аминокислотного контроля, р < 0.05, p < 0.01. # – Ингибирующий эффект МК 801, отличие от HLDF-6-амида, р < 0.05. @ – Отличие от дистиллированной воды и аминокислотного контроля, р < 0.05.
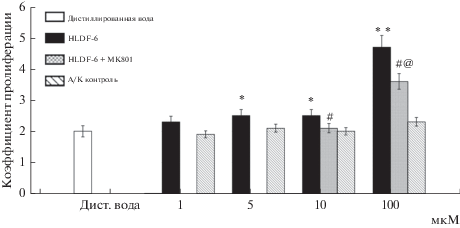
Предполагается, что функциональной мишенью специфического фармакологического эффекта пептида HLDF-6-амида являются глутаматные NMDA-рецепторы [3]. Мы исследовали возможность участия глутаматной системы в обнаруженной пролиферативной активности пептида на инфузориях. Было показано, что введение в культуру селективного антагониста NMDA-рецепторов МК801 в концентрации 10 мкМ значимо снижало (р < 0.05) пролиферативный эффект 100 мкМ пептида, а в концентрации 1 мкМ МК801 полностью блокировал (р < 0.05) эффект 10 мкМ HLDF-6-амида (рис. 1). Полученные результаты хорошо согласуются с данными об увеличении плотности именно NMDA-рецепторов в гиппокампе мозга мышей Balb/c при хроническом интраназальном введении HLDF-6-амида [3].
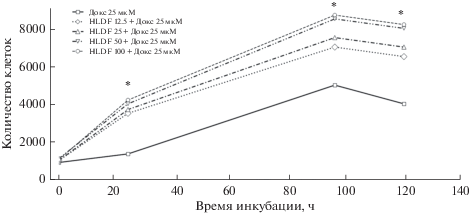
Ранее было показано, что нативный HLDF-6 снижает цитотоксическое действие фактора некроза опухоли на клетках линии HL-60 [7]. С другой стороны, он обладает выраженным цитотоксическим действием на клетки лимфолейкоза Р-388 и стимулирует цитотоксическую активность фагоцитов в отношении этих клеток [8]. Мы исследовали способность HLDF-6-амида снижать токсическое действие синтетического цитостатика доксорубицина (25 мкМ) в культуре инфузорий при 24, 96 и 120 часовой инкубации. Было установлено, что пептид во всем диапазоне использованных концентраций (12.5–100 мкМ) и во всех трех временных точках достоверно (p < 0.05) снижал эффект цитостатика при совместном введении. Показатели клеточного роста были значительно выше, чем в пробах, содержащих только доксорубицин (рис. 2). Эффект пептида был дозозависимым. Наиболее ярко он проявлялся на 96 и 120 часовой культуре. Известно, что действие доксорубицина на клетку связано как с индукцией оксидативного стресса (острый цитотоксический эффект), так и с ингибированием ДНК-топоизомеразы (хронический цитостатический эффект). Адаптация инфузорий к острому оксидативному стрессу обычно наступает в первые часы инкубации, далее все определяет их способность противостоять мутагенному действию цитостатика. Мы показали, что HLDF-6-амид значительно увеличивает адаптационные возможности инфузорий. Это свойство пептида открывает широкие перспективы его использования в комплексной, с цитостатиками, химиотерапии опухолей для снижения их побочных токсических эффектов на здоровые клетки организма.
Рис. 2.
Влияние совместного введения HLDF-6-амида и доксорубицина на пролиферацию инфузорий. * – Антитоксический эффект HLDF-6-амида, отличие от доксорубицина, p < 0.05.
Чтобы подтвердить возможность рецепторных механизмов в эффектах HLDF-6-амида, было проведено пилотное радио-рецепторное исследование с использованием меченного тритием ацетиламидного производного пептида [3H] Ac-HLDF-6-амида. Оно подтвердило наличие мест специфического связывания пептида на клеточных мембранах коры головного мозга крыс. Анализ вытеснения показал сходную аффинность ацетиламидной и амидной форм пептида (IC50 0.75 и 0.53 мкМ соответственно), в то время как сродство нативного HLDF-6 к предполагаемым рецепторам было вдвое и втрое ниже (IC50 1.83 мкМ). Следует признать, что для окончательных выводов необходима дальнейшая характеристика сайтов рецепторного связывания с помощью селективных лигандов. Однако уже сейчас можно говорить о существовании рецепторных механизмов в биологических эффектах HLDF-6-амида.
Впервые на клетках эукариот Tetrahymena pyriformis было показано, что HLDF-6-амид стимулирует пролиферацию и обладает цитопротекторными свойствами, что может лежать в основе его ранозаживляющего, ноотропного и нейропротективного действия. Установлено участие NMDA-глутаматной системы, в частности ионотропных NMDA-рецепторов, в реализации его эффектов. Показана возможность получения эффективной оценки действия различных препаратов на живую клетку с помощью инфузорий.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовали: доксорубицин, МК 801, аминокислоты (Sigma). Пептиды HLDF-6, HLDF-6-NH2, Ac-HLDF-6-NH2, [3H] Ac-HLDF-6-NH2 были получены в ИМГ РАН, как описано ранее [10 ] .
Автоматизированный биотест на инфузориях
Инфузории Tetrahymena pyriformis были получены из собственной коллекции штаммов ФГБНУ НЦПЗ. Измерения проводили на автоматическом анализаторе БиоЛаТ (ГОСТ 31674-2012). Оценивали общее количество подвижных клеток в пробах и его изменение под действием различных концентраций исследуемых веществ: HLDF-6-амид (1–100 мкМ), МК801 (1, 10 мкМ), доксорубицин (25 мкМ). В качестве контроля использовали дистиллированную воду и эквимолярную смесь аминокислот, входящих в состав HLDF-6.
Радио-рецепторный анализ
Инкубационная смесь 0.5 мл, 50 мМ Tris-HCl, pH 7.1, содержала 50 мкл 10 нМ [3H] Ac-HLDF-6‑NH2 (22 Кюри/ммоль), 200 мкл суспензии мембран коры головного мозга крыс, 50 мкл немеченых производных HLDF-6 в разных концентрациях (1 нМ–1 мМ). Неспецифическое связывание определяли в присутствии 20 μМ немеченого Ac-HLDF-6-NH2. Специфическое связывание составило 75–80%.
Список литературы
Костанян И.А., Жохов С.С., Сторожева З.И., Прошин А.Т., Сурина Е.А., Бабиченко И.И., Шерстнев В.В., Липкин В.М. // Биоорган. химия. 2006. Т. 32. С. 399–407. [Kostanian I.A., Zhokhov S.S., Storozheva Z.I., Proshin A.T., Surina E.A., Babichenko I.I., Sherstnev V.V., Lipkin V.M. // Russ. J. Bioorg. Chem. 2006. V. 32. P. 360–367.] https://doi.org/10.1134/S1068162006040066
Костанян И.А., Сторожева З.И., Семенова Н.А., Липкин В.М. // Докл. акад. наук. 2009. Т. 428, С. 565–569. [Kostanyan I.A., Storozheva Z.I., Semenova N.A., Lipkin V.M. // Dokl. Biol. Sci. 2009. V. 428. P. 418–422.] https://doi.org/10.1134/s0012496609050081
Zolotarev Y.A., Kovalev G.I., Kost N.V., Voevodina M.E., Sokolov O.Y., Dadayan A.K., Kondrakhin E.A., Vasileva E.V., Bogachuk A.P., Azev V.N., Lipkin V.M., Myasoedov N.F. // J. Psychopharmacol. 2016. V. 30 P. 922–935. https://doi.org/10.1177/0269881116660705
Зиновьев Е.В., Цыган В.Н., Арцимович И.В., Асадулаев М.С., Панеях М.Б., Зубов В.В., Лукьянов С.А., Костяков Д.В., Жилин А.А., Лопатин И.М., Уманская А.А., Османов К.Ф., Кравцов С.Н., Апчел А.В., Золотарев Ю.А., Дадаян А.К., Дадаян К.А. // Вестник российской военно-медицинской академии. 2018. Т. 63. С. 148–153.
Gromovykh T.I., Demchenko A.G., Cheremnykh E.G., Feldman N.B., Lyundup A.V., Balyasin M.V., Kiselyova O.I., Gromovykh P.S., Lutsenko S.V. // Int. J. Nanotec. 2019. V. 16. P. 87–99. https://doi.org/10.1504/IJNT.2019.102395
Бродский В.Я., Золотарев Ю.А., Мальченко Л.А., Андреева Л.А., Лазарев Д.С., Буторина Н.Н., Козик В.С., Мясоедов Н.Ф. // Онтогенез. 2019. Т. 50. С. 340–346. https://doi.org/10.1134/S0475145019050033
Гибанова Н.В., Ракитина Т.В., Липкин В.М., Костанян И.А. // Биохимия. 2007. Т. 72. С. 49–60. https://doi.org/10.1134/s0006297907010063
Даниленко Е.Д., Сысоева Г.М., Устименко С.Ю., Самуков В.В., Костанян И.А., Масычева В.И. // Вопр. онкологии. 2009. Т. 55. № 6. С. 757–760.
Золотарев Ю.А., Дадаян А.К., Кост Н.В., Воеводина М.Э., Соколов О.Ю., Козик В.С., Шрам С.И., Азев В.Н., Бочаров Э.В., Богачук А.П., Липкин В.М., Мясоедов Н.Ф. // Биоорган. химия. 2015. Т. 41. С. 644–656. [Zolotarev Yu.A., Dadayan A.K., Kost N.V., Voevodina M.E., Sokolov O.Y., Kozik V. S., Shram S.I., Bocharov E.V., Bogachuk A.P., Azev V.N., Lipkin V.M., Myasoedov N.F. // Russ. J. Bioorg. Chem., 2015. V. 41. P. 578–589.] https://doi.org/10.1134/S1068162015060205
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


