Биоорганическая химия, 2020, T. 46, № 6, стр. 797-800
Производные 6,7-диалкокси-бензотиофена в качестве основы для создания флуоресцентных сенсоров на активные формы кислорода
Я. В. Болт 1, А. С. Царькова 1, 2, Н. С. Балеева 1, *
1 ФГБУН Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
2 Российский национальный исследовательский медицинский университет имени Н.И. Пирогова
117997 Москва, ул. Островитянова, 1, Россия
* E-mail: nsbaleeva@gmail.com
Поступила в редакцию 18.04.2020
После доработки 29.04.2020
Принята к публикации 02.05.2020
Аннотация
Производное диалкокси-бензотиофена предложено в качестве основы для создания флуоресцентных сенсоров на активные формы кислорода. Синтезирован соответствующий диоксид, который потенциально будет образовываться при детектировании. Показано, что благодаря заметному смещению максимумов поглощения и испускания, происходящему при окислении, подобные производные бензотиофена могут быть успешно использованы для создания флуоресцентных сенсоров.
Редокс-процессы играют ключевую роль в биологических системах. Множество биохимических реакций зависит от регуляции такого типа превращений. Для аэробных организмов важнейшим инструментом регуляции выступает кислород и его активные формы (АФК). Синтез и перемещение АФК строго контролируется клеткой, так как такие реакционноспособные молекулы могут вызвать окислительные повреждения и привести к развитию патологий. В связи с этим АФК и их функции являются объектом детальных исследований многих научных коллективов [1–6]. Для детектирования АФК в живых системах сейчас доступны хроматографические и спектрофотометрические методы [7], люминесцентные индикаторы [8], электрохимические [8] и генетически кодируемые биосенсоры [9–12], а также флуоресцентные сенсоры [13, 14].
Среди флуоресцентных сенсоров на АФК очевидным образом стали распространены структурные модификации классических красителей, которые включают фрагменты, чувствительные к различным АФК. В подобной роли используются, например, производные цианина, флуоресцеина, кумарина, резоруфина или бензотиазола [15–18]. Как правило, взаимодействие подобных сенсоров с детектируемым объектом происходит необратимо, в результате либо образуются новые химические связи, либо разрушаются существующие. Это приводит к резкому изменению оптических свойств сенсора, например, к потере флуоресценции или наоборот приобретению интенсивной эмиссии, или же к заметному смещению положений максимумов поглощения и испускания.
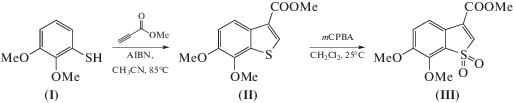
В данной работе мы предложили в качестве основы для создания подобного типа сенсоров производное бензотиофена (II). Необходимое соединение (II) было получено при взаимодействии диметоксифенилтиола (I) с метилпропиолатом в присутствии азобисизобутиронитрила (схема 1 ). Затем под действием мета-хлорнадбензойной кислоты из бензотиофена (II) был получен соответствующий диоксид (III). Последний в свою очередь предположительно будет образовываться из исходного соединения (II) под воздействием АФК. Мы установили, что превращение производного (II) в диоксид (III) легко происходит под действием водного раствора пероксида натрия, а также при выдерживании его раствора на воздухе, что говорит о высокой перспективности использовании его как сенсора на АФК в живых системах.
Схема 1 . Схема синтеза производных (II) и (III).
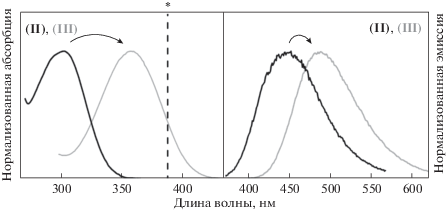
Сравнение оптических свойств полученных соединений показало, что при переходе к окисленной форме (III) в спектрах абсорбции и эмиссии наблюдается заметное батохромное смещение положений максимумов (примерно на 40–60 нм) (табл. 1, рис. 1). Стоит отметить, что столь существенная разница позволит детектировать флуоресценцию диоксида, не наблюдая при этом сигнала исходного бензотиофена (например, при использовании лазера с длиной волны 388 нм, на рис. 1 отмечено*, а также фильтров DAPI или в двуфотонном режиме). Было установлено, что превращение исходного соединения (II) в диоксид (III) не оказывает влияния на другие оптические свойства – величины квантового выхода флуоресценции и коэффициента молярного поглощения практически не изменяются (табл. 1).
Таблица 1.
Оптические свойства соединений (II) и (III) в разных растворителях
| Соединение | Растворитель | Максимум поглощения, нм | Максимум эмиссии, нм | Коэффициент молярного поглощения, М–1 см–1 | Квантовый выход флуоресценции, % |
|---|---|---|---|---|---|
| (II) | Этанол | 302 | 473 | 6500 | 17 |
| Ацетонитрил | 300 | 444 | 6500 | 32 | |
| Диоксан | 302 | 421 | 6500 | 40 | |
| (III) | Этанол | 358 | 497 | 4500 | 27 |
| Ацетонитрил | 356 | 487 | 5000 | 31 | |
| Диоксан | 355 | 471 | 4500 | 28 |
Рис. 1.
Нормализованные спектры поглощения и испускания соединений (II) (черный) и (III) (серый) в ацетонитриле. (* Отмечена длина волны лазера, используемого в микроскопии.)
Полученные результаты позволяют заключить, что использование диалкокси-бензотиофена в качестве основы для создания флуоресцентных сенсоров на АФК представляется перспективным направлением для дальнейшей работы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры ЯМР (δ, м.д.; J, Гц) зарегистрированы на приборе Bruker Fourier 300 (300 МГц, США) и Bruker Avance III (700 МГц, США) при 303 K в CDCl3 и DMSO-d6 (внутренний стандарт – Me4Si). Спектры поглощения в УФ и видимом диапазоне регистрировали на спектрофотометре Varian Cary 100 Bio (США); спектры флуоресценции – на спектрофлуориметре Varian Cary Eclipse (США). Температуры плавления определены на приборе SMP 30 (Великобритания) и не исправлены. Масс-спектры высокого разрешения записаны на приборе Bruker micrOTOF II, ионизация электрораспылением.
2,3-Диметоксифенилтиол (I). К раствору 1,2-диметоксибензола (5.77 г, 41.7 ммоль) в ТГФ (100 мл) в атмосфере аргона при –78°С прикапывали раствор n-BuLi в гексане (1 М, 39.1 мл, 62.6 ммоль), перемешивали при –78°С в течение 10 мин, затем нагревали до комнатной температуры и выдерживали 30 мин. Реакционную смесь охлаждали до –78°С, прибавляли S8 (5.01 г, 5.0 ммоль) и нагревали до 0°С в течение 1 часа. Через 30 мин к реакционной смеси добавляли водный раствор соляной кислоты (1 М, 100 мл), экстрагировали этилацетатом (3 × 50 мл), промыли водой (3 × 50 мл) и насыщенным раствором хлорида натрия (3 × × 50 мл), высушили над безводным Na2SO4 и упарили в вакууме. Продукт очищали методом колоночной хроматографии (элюент – гексан–этилацетат, 100 : 3). Желтоватая жидкость (4.34 г, 61%); 1Н-ЯМР (300 МГц, CDCl3): 6.94 (т, J2 7.9, 1H), 6.86 (дд, J2 7.9, 1.7, 1H), 6.71 (дд, J2 8.0, 1.6, 1H), 3.87 (с, 3H), 3.86 (с, 3H) [19].
3-Метоксикарбонил-6,7-диметоксибензо[b]тиофен (II). К раствору 2,3-диметоксифенилтиола (I) (2.60 г, 15.27 ммоль) в ацетонитриле (250 мл) в атмосфере аргона добавляли метилпропиолат (13.6 мл, 152.7 ммоль) и азобисизобутиронитрил (0.50 г, 3.1 ммоль). Полученный раствор перемешивали при кипении в течение 2 часов. Ацетонитрил и избыток метилпропиолата упаривали в вакууме. Полученный продукт очищали методом колоночной хроматографии (элюент – гексан–этилацетат, 50 : 1). Затем продукт дополнительно очищали с помощью кристаллизации из пентана. Белый порошок (1.35 г, 35%); т. пл. около 260°C с разложением; 1H-ЯМР (300 МГц, CDCl3): 8.24 (д, J2 8.6, 1H), 8.23 (с, 1H), 7.19 (д, J2 8.9, 1H), 4.05 (с, 3H), 3.98 (с, 3H), 3.95 (с, 3H); 13C-ЯМР (75 МГц, CDCl3): 163.2, 148.7, 142.7, 135.3, 134.7, 133.6, 132.1, 127.2, 120.0, 113.7, 60.6, 56.9, 51.6; HRMS (ESI) m/z: найдено М 253.0538, рассчитано для С12H13O4S+, [M + H]+ 253.0529.
3-Метоксикарбонил-6,7-диметоксибензо[b]тиофен-1,1-диоксид (III). Раствор 3-метоксикарбонил-6,7-диметоксибензо[b]тиофена (II) (100 мг, 0.39 ммоль) и мета-хлорнадбензойной кислоты (67 мг, 0.78 ммоль) в 2 мл сухого дихлорметана перемешивали при комнатной температуре в течение 8 ч. Затем реакционную смесь промывали насыщенным раствором гидрокарбоната натрия (3 × 1 мл), водой (3 × 1 мл) и насыщенным раствором хлорида натрия (3 × 50 мл). Полученный раствор сушили над безводным Na2SO4 и упаривали в вакууме. Полученный продукт очищали методом колоночной хроматографии (элюент – хлороформ–метанол, 10 : 1). Бесцветное масло (84 мг, 75%); т. пл. около 260°C с разложением; 1H-ЯМР (700 МГц, DMSO-d6): 7.88 (с, 1H), 7.72 (д, J2 8.4, 1H), 7.34 (д, J2 8.6, 1.9, 1H), 3.96 (с, 3H), 3.91 (с, 3H), 3.88 (с, 3H); 13C-ЯМР (176 МГц, DMSO-d6): 162.1, 154.7, 145.2, 135.1, 132.6, 128.9, 121.2, 120.6, 117.4, 61.6, 56.7, 52.9; HRMS (ESI) m/z: найдено М 285.0431, рассчитано для С12H13O6S+, [M + H]+ 285.0427.
Список литературы
Liu H., Colavitti R., Rovira I.I., Finkel T. // Circ. Res. 2005. V. 97. P. 967–974. https://doi.org/10.1161/01.RES.0000188210.72062.10
Hidalgo C., Bull R., Behrens M.I., Donoso P. // Biol. Res. 2004. V. 37. P. 539–552. https://doi.org/10.4067/S0716-97602004000400007
Tang X.D., Santarelli L.C., Heinemann S.H., Hoshi T. // Annu. Rev. Physiol. 2004. V. 66. P. 131–159. https://doi.org/10.1146/annurev.physiol.66.041002.142720
Winterbourn C.C., Hampton M.B. // Free Radic. Biol. Med. 2008. V. 45. P. 549–561. https://doi.org/10.1016/j.freeradbiomed.2008.05.004
Ray P.D., Huang B.W., Tsuji Y. // Cell Signal. 2012. V. 24. P. 981–990. https://doi.org/10.1016/j.cellsig.2012.01.008
Forrester S.J., Kikuchi D.S., Hernandes M.S., Xu Q., Griendling K.K. // Circ. Res. 2018. V. 122. P. 877–902. https://doi.org/10.1161/CIRCRESAHA.117.311401
Zhang Y., Dai M., Yuan Z. // Anal. Methods. 2018. V. 10. P. 4625–4638. https://doi.org/10.1039/C8AY01339J
Chen X., Wang F., Hyun J.Y., Wei T., Qiang J., Ren X., Shin I., Yoon J. // Chem. Soc. Rev. 2016. V. 45. P. 2976–3016. https://doi.org/10.1039/C6CS00192K
Belousov V.V., Fradkov A.F., Lukyanov K.A., Staroverov D.B., Shakhbazov K.S., Terskikh A.V., Lukyanov S. // Nat. Methods 2006. V. 3. P. 281–286. https://doi.org/10.1038/nmeth866
Gutscher M., Sobotta M.C., Wabnitz G.H., Ballikaya S., Meyer A.J., Samstag Y., Dick T.P. // J. Biol. Chem. 2009. V. 284. P. 31 532–31 540. https://doi.org/10.1074/jbc.M109.059246
Zhao Y., Jin J., Hu Q., Zhou H.M., Yi J., Yu Z., Xu L., Wang X., Yang Y., Loscalzo J. // Cell Metab. 2011. V. 14. P. 555–566. https://doi.org/10.1016/j.cmet.2011.09.004
Pak V.V., Ezeriņa D., Lyublinskaya O.G., Pedre B., Tyurin-Kuzmin P.A., Mishina N.M., Thauvin M., Young D., Wahni K., Martínez Gache S.A., Demidovich A.D., Ermakova Y.G., Maslova Y.D., Shokhina A.G., Eroglu E., Bilan D.S., Bogeski I., Michel T., Vriz S., Messens J., Belousov V.V. // Cell Metab. 2020. V. 31. P. 642–653. https://doi.org/10.1016/j.cmet.2020.02.003
Hyman L.M., Franz K.J. // Coord. Chem. Rev. 2012. V. 256. P. 2333–2356. https://doi.org/10.1016/j.ccr.2012.03.009
Gomes A., Fernandes E., Lima J.L. // J. Biochem. Biophys. Methods. 2005. V. 65. P. 45–80. https://doi.org/10.1016/j.jbbm.2005.10.003
Wu L., Sedgwick A.C., Sun X., Bull S.D., He X.-P., James T.D. // Acc. Chem. Res. 2019. V. 52. P. 2582–2597. https://doi.org/10.1021/acs.accounts.9b00302
Liu F., Wu T., Cao J., Zhang H., Hu M., Sun S., Song F., Fan J., Wang J., Peng X. // Analyst. 2013. V. 138. P. 775–778. https://doi.org/10.1039/C2AN36030F
Odyniec M.L., Gardiner J.E., Sedgwick A.C., He X.-P., Bull S.D., James T.D. // Front. Chem. Sci. Eng. 2020. V. 14. P. 117–121. https://doi.org/10.1007/s11705-018-1785-9
Odyniec M.L., Sedgwick A.C., Swan A.H., Weber M., Tang T.M.S., Gardiner J.E., Zhang M., Jiang Y.-B., Kociok-Kohn G., Elmes R.B.P., Bull S.D., He X.-P., James T.D. // Chem. Commun. 2018. V. 54. P. 8466–8469. https://doi.org/10.1039/C8CC04316G
Aebisher D., Brzostowska E.M., Mahendran A., Greer A. // J. Org. Chem. 2007. V. 72. P. 2951–2955. https://doi.org/10.1021/jo062677w
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия