Биоорганическая химия, 2020, T. 46, № 6, стр. 729-735
Влияние гипертермии на протеиназы и регуляторы роста скелетных мышц культивируемой радужной форели O. mykiss
Н. П. Канцерова 1, *, М. В. Чурова 1, Л. А. Лысенко 1, Е. Д. Тушина 1, М. А. Родин 1, М. Ю. Крупнова 1, И. В. Суховская 1
1 Институт биологии — обособленное подразделение ФГБУН ФИЦ “Карельский научный центр Российской академии наук”
185910 Петрозаводск, ул. Пушкинская, 11, Россия
* E-mail: nkantserova@yandex.ru
Поступила в редакцию 18.04.2020
После доработки 24.04.2020
Принята к публикации 28.04.2020
Аннотация
Оценен уровень экспрессии генов некоторых структурных и регуляторных мышечных белков, а также активность основных внутриклеточных протеиназ (кальпаинов, протеасом) у садковой радужной форели в благоприятные для роста периоды и в условиях гипертермии. Интенсивный рост рыб сопровождался высокой транскрипционной активностью гена тяжелой цепи миозина (MyHC) при сдерживающем влиянии миостатина, высокой скоростью обмена белков и стабильным уровнем миогенных регуляторных факторов MyoG и MyoD1b. Торможение роста форели в период летнего повышения температуры воды было сопряжено со снижением уровня экспрессии гена миозина, основного белка миофибрилл. В условиях гипертермии также снижалась протеолитическая активность кальпаинов и протеасом, определяющих уровень белковой деградации в мышцах и тем самым регулирующих интенсивность накопления в них белка и ростовых процессов в целом. Таким образом, изменения интенсивности синтеза миофибриллярных белков, миогенеза и белковой деградации у радужной форели в благоприятные для роста периоды и в условиях гипертермии происходят сопряженным образом, что подтверждает взаимосвязь этих процессов.
ВВЕДЕНИЕ
Большинство костистых рыб (кл. Teleostei) характеризуется недетерминированным ростом, скорость которого главным образом зависит от интенсивности запасания структурных белков скелетных мышц, на долю которых приходится до 40% всего синтезируемого белка [1, 2]. Продемонстрирована четкая взаимосвязь уровня экспрессии гена тяжелой цепи миозина (MyHC), основного белка миофибрилл, с темпами роста радужной форели [3], атлантического лосося [4], пятнистой зубатки [5], светлоперого судака [6] и рыб других видов, в связи с чем он используется для количественной оценки ростовых процессов [4]. Постэмбриональный мышечный рост у рыб осуществляется по двум путям – гиперплазии (образования новых волокон) и гипертрофии (увеличения размера волокон) [7] – под контролем специфических миогенных регуляторных факторов (myogenic regulatory factors, MRF) – транскрипционных факторов семейства bHLH (basic helix-loop-helix) [8]. К ним относятся MyoD, Myf5, миогенин (MyoG) и MRF4. MyoD и Myf5 вовлечены в процесс детерминации мышечных клеток, а миогенин и MRF4 – их дифференцировки. Важным отрицательным регулятором миогенеза является миостатин (MSTN), белок семейства трансформирующих ростовых факторов TGF-β, ингибирующий как пролиферацию, так и дифференцировку мышечных клеток [8].
Биосинтетические процессы в мышцах контролируются белок-деградирующей системой, включающей лизосомально-аутофагический, кальпаиновый и протеасомный пути [9, 10] и имеющей у рыб свои особенности [11, 12]. К настоящему моменту охарактеризована роль указанных ферментных систем и их относительный вклад в общую деградацию белков скелетных мышц в процессе роста рыб, на разных стадиях их жизненного и годового цикла, при различных физиологических состояниях [12–18]. В периоды интенсивного роста у рыб наблюдается максимальная скорость как биосинтеза структурных мышечных белков, так и белкового распада, обеспечивающего контроль качества синтезируемых полипептидов и элиминацию молекул с ошибками биосинтеза, нефункциональных, избыточных и стадиеспецифичных. В процессе белкового гидролиза образуются свободные аминокислоты – структурные элементы для синтеза новых белков.
Скорость роста рыб может тормозиться внешними воздействиями, в частности, для холоднолюбивой радужной форели, Oncorhynchus mykiss Walb., критичен летний подъем температур, приводящий к снижению темпов ее роста, подверженности бактериальным инвазиям, повышению процента летальности. Цель настоящего исследования – изучение отклика показателей мышечного роста, включая уровни экспрессии генов структурных (MyHC) и регуляторных мышечных белков (MyoD, MyoG, MSTN) и активность основных внутриклеточных протеиназ (кальпаинов, протеасом), у садковой радужной форели при повышении температуры воды.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Динамика роста радужной форели
Данные, представленные в табл. 1, свидетельствуют о линейном приросте живой массы и длины культивируемой форели на протяжении выростного сезона. В период повышенных температур воды с 17 июля по 22 августа (средняя температура 19.8°С, в отдельные дни достигающая 22°С) наблюдалось снижение темпа роста форели до 0.053 против 0.172, характеризующих период температурного оптимума, который составляет для форели 14–19°С [19]. Метаболизм форели и темпы ее роста так же, как у всех пойкилотермных животных, в значительной степени определяются температурой среды обитания (при достаточном количестве пищи и растворенного кислорода). Повышение температуры до 22–23°С вызывает метаболическую депрессию, проявляющуюся умеренным, а до 24–25°С – резким снижением темпа роста форели [19].
Таблица 1.
Масса, длина и темп роста (за период между текущей и предыдущей датой взятия материала) радужной форели
| Дата | Масса, г | Длина, см | Темп роста, % массы/день |
|---|---|---|---|
| 12.05.2018 | 817.1 ± 166.8 | 38.4 ± 2.62 | – |
| 27.06.2018 | 1095.4 ± 194.1 | 41.6 ± 1.87 | 0.074 |
| 17.07.2018 | 1471.6 ± 308.4 | 44.7 ± 3.35 | 0.172 |
| 24.08.2018 | 1777.1 ± 181.7 | 46.7 ± 1.92 | 0.053 |
| 18.09.2018 | 1947.3 ± 314.7 | 49.9 ± 2.38 | 0.038 |
Экспрессия генов мышечных белков радужной форели
Для оценки синтетической активности в мышцах радужной форели использовали уровень экспрессии гена тяжелой цепи миозина (MyHC) (рис. 1а). С началом периода подъема температуры воды от 13–14 до 17.5°С (июль) и выше (август) уровень экспрессии MyHC у форели достоверно снизился и лишь частично восстановился вне периода гипертермии (сентябрь). Аналогичное снижение экспрессии MyHC при повышении температуры воды было показано у пятнистой зубатки [5].
Рис. 1.
Уровень экспрессии MyHC (а), MyoG (б), MyoD1b (в), MSTN1a (г) в скелетных мышцах радужной форели. а – различия достоверны по сравнению с 12 мая, b – по сравнению с 27 июня, с – по сравнению с 17 июля.
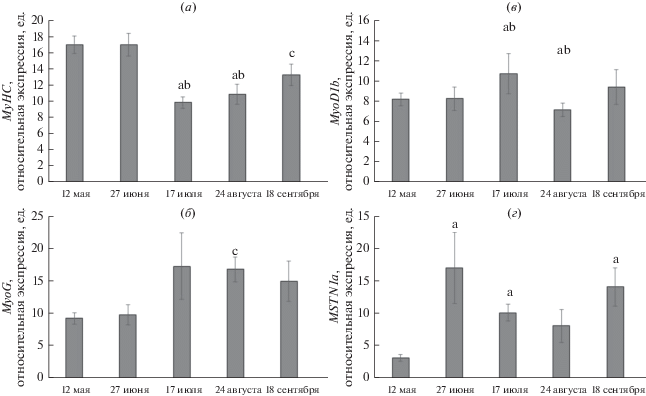
Для выяснения регуляторных механизмов температурной зависимости роста скелетных мышц была оценена экспрессия генов транскрипционных факторов регуляции миогенеза (MRF) – MyoD и миогенина. Высококонсервативный bHLH регион этих транскрипционных факторов [20] связывается с последовательностью E-box, обнаруживаемой в промоторе генов многих мышечных белков [21]. MyoD экспрессируется, как правило, в пролиферирующих миобластах, тогда как экспрессия миогенина наблюдается в постмитотических мышечных клетках. Появление транскриптов MyoD и Myf5 в пролиферирующих миобластах сопровождается повышением экспрессии миогенина, который, в свою очередь, необходим для усиления и поддержания транскрипционной активности генов структурных и сократительных мышечных белков [8]. При этом процессы гиперплазии ассоциированы главным образом с экспрессий MyoD, а гипертрофии – с экспрессией миогенина [22]. Как было ранее показано на диких и аквакультурных видах лососевых, экспрессия MRF зависит преимущественно от температуры среды [23], состава корма и режима кормления [24, 25].
Динамика экспрессии MyoG и MyoD1b (наиболее многочисленного паралога MyoD в белых скелетных мышцах рыб; [26]) представлена на рис. 1б и 1в. Коэффициент корреляции уровней экспрессии этих генов составил 0.58 (p < 0.05). Аналогичный сопряженный характер изменения уровня экспрессии MyoG и MyoD в онтогенезе ранее был описан у радужной форели [22], атлантического лосося [27], паку [28]. Известно, что MyoD активирует экспрессию миогенина, напрямую связываясь с его регуляторными элементами [28, 29].
Динамика экспрессии миостатина, антагониста мышечного роста, носила отличный от прочих регуляторов миогенеза характер (рис. 1г). Низкий уровень экспрессии миостатина у форели в благоприятный для роста период выхода из зимовального голодания (май), вероятно, является одним из факторов, способствующих интенсивному синтезу белка, включая изученный нами миозин (рис. 1а), и мышечному росту в целом. Значимая активация экспрессии MSTN1a в ответ на высокий уровень синтеза мышечного белка и поддерживающих его миогенных регуляторных факторов (июнь), вероятно, служит механизмом контроля процессов гиперплазии и гипертрофии с целью предотвращения бесконтрольного роста мышц [22].
Интенсивность протеолиза в скелетных мышцах радужной форели
Более интенсивный рост форели в период оптимальных температур (июнь) сопровождался, по нашим данным, повышенной активностью протеолитических систем, отвечающих за обмен и контроль качества белка. В период высоких температур наблюдалось снижение их активности, которое составило 30% для кальпаинов и 40% для химотрипсинподобной активности протеасом. Уровень активности внутриклеточных протеиназ нелизосомального пути белкового распада в скелетных мышцах радужной форели демонстрирует также сезонную динамику (рис. 2а, 2б), постепенно снижаясь по ходу выростного сезона. Однако, по нашим наблюдениям, в еще большей мере активность кальпаинов и протеасом зависит от возраста, будучи максимальной у рыб первого года жизни и прогрессивно снижаясь в последующие годы. Так, сходные возрастные зависимости интенсивности белкового распада в скелетных мышцах были показаны для атлантического лосося [12, 18], кумжи [30] и радужной форели [31].
Рис. 2.
Уровень активности кальпаинов и химотрипсинподобной активности протеасом в скелетных мышцах радужной форели. а – различия достоверны по сравнению с 12 мая, b – по сравнению с 27 июня.
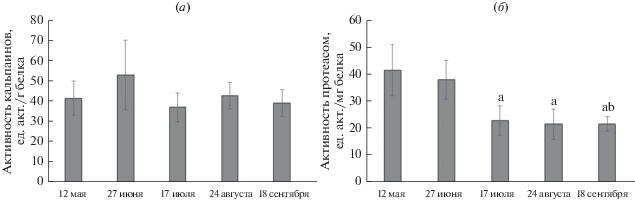
Механизмы температурной чувствительности ферментов протеолиза в данном случае неясны, поскольку изучаемый температурный спектр соответствует максимальной активности этих ферментов in vitro, а их температурная инактивация наблюдается лишь при 58–60°С [11, 12]. Однако, in vivo их активность регулируется множеством механизмов, включая скоординированную взаиморегуляцию с процессами белкового синтеза в ситуациях с преобладанием анаболических или катаболических процессов [32]. Протеолитическая активность протеасом служит ключевым звеном системы контроля качества клеточных белков, отвечающим за элиминацию меченых убиквитином дефектных полипептидов. Однако, в скелетных мышцах рыб эта активность не так высока, как в других органах [33], а компактная упаковка миофибриллярных белков делает их недоступными для гидролиза протеасомами и требует участия других протеиназ, преимущественно кальпаинов, для их дезинтеграции [10]. Кальцийзависимые протеиназы скелетных мышц рыб имеют более широкую субстратную специфичность по сравнению с кальпаинами млекопитающих и гидролизуют основные структурные белки, включая миозин, тропомиозин, α-актинин, тропонины Т и I, десмин [32]. Помимо рутинной деградации белка, кальпаины непосредственно участвуют в миогенезе, в частности, высокоселективным образом гидролизуя белки цитоскелета в ходе слияния миобластов скелетных мышц [34]. Показано, что уровень экспрессии генов кальпаинов 1 и 2 также повышается при дифференцировке мышечных клеток [35], а на более поздних стадиях миогенной дифференцировки к ним подключается кальпаин 3, специфичный для скелетных мышц [36]. Участие кальпаинов в этих высокорегулируемых процессах становится возможным при физиологическом снижении экспрессии их эндогенного ингибитора, кальпастатина, на ранних стадиях дифференцировки мышечных клеток до полной его элиминации при их слиянии [37].
Таким образом, описанные нами изменения процессов мышечного роста у рыб в благоприятные для роста периоды и при гипертермии происходят сопряженным образом и затрагивают не только белковый синтез и миогенез, но и белковую деградацию. Интенсивный рост рыб сопровождается высокой транскрипционной активностью гена миозина при сдерживающем влиянии миостатина, высокой скоростью обмена белков и стабильным уровнем миогенных регуляторных факторов MyoG и MyoD1b. Физиологические ростовые процессы, связанные с синтезом, аккумуляцией и обменом скелетномышечных белков, тормозятся в период гипертермии за счет изменений активности обслуживающих эти процессы ферментных систем и уровня регуляторов миогенеза. Одним из механизмов торможения роста форели при гипертермии служит, по-видимому, температурозависимое снижение экспрессии миозина, приводящий к активации компенсаторных механизмов – повышению экспрессии положительных регуляторов миогенеза MyoG и MyoD1b, снижению репрессирующего влияния миостатина и торможению реакций белковой деградации.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Схема эксперимента и отбор проб. Объектом исследования служили самки радужной форели возраста 2+, выращиваемые в садках (оз. Ладмозеро, Медвежьегорский р-н, Республика Карелия) на стандартном коммерческом корме для форели BioMar (Дания). Проводился ежедневный мониторинг температуры воды и содержания растворенного кислорода, как известно, связанных отрицательной зависимостью. В год наблюдений значения последнего составляли от 13.6 до 7.2 мг/л с минимумом в период высоких температур и не выходили за пределы оптимальных для форели значений (7.0 мг/л). Отбор проб осуществлялся ежемесячно, с мая по сентябрь 2018 г.; размер выборки – 8 особей. Помимо измерения длины и массы рыб, фиксировались образцы их белых скелетных мышц (–80°C) для последующего биохимического и молекулярно-генетического анализа.
Реагенты и оборудование. В работе были использованы химические реагенты, ингибиторы и субстраты протеиназ, произведенные Sigma-Aldrich (США) и ЗАО Евроген (Россия); приборы: низкотемпературная морозильная камера UF 240-86 Е (Snijders Scientific, Нидерланды), гомогенизатор TissueLyser LT (Qiagen, Германия), центрифуга Allegra 64R (Beckman Coulter, США), мультимодальный планшетный ридер CLARIOstar (BMG LABTECH, Германия), спектрофотометр Implen NanoPhotometer С (Implen, Германия), амплификатор Real-Time CFX96 Touch (BioRad, США).
Выделение тотальной РНК и проведение обратной транскрипции. Тотальную РНК выделяли из белых мышц с помощью набора RNA-extran по протоколу производителя. Затем общую РНК обрабатывали с помощью ДНКазы. Целостность и качество РНК оценивали методом электрофореза на 1% агарозном геле и спектрофотометрически с коэффициентом поглощения 260/280 нм. РНК использовали для обратной транскрипции с применением MMLV-обратной транскриптазы и случайных гексамерных праймеров.
ПЦР в реальном времени. Праймеры для MyHC, MyoG, MyoD1b, MSTN-1a и Ef-1α были подобраны с помощью программы Beacon Designer 5.0 (Premier Biosoft, США). Последовательности праймеров представлены в табл. 2. Амплификацию 2 мкл кДНК проводили с использованием 5 мкл qPCRmix-HS SYBR Green 5× (Евроген, Россия) и 500 нM праймеров в конечном объеме смеси 25 мкл. Условия ПЦР были следующими: денатурация ДНК – 5 мин при 95°C; повторяющиеся циклы (30–35): денатурация 20 с при 95°C, отжиг праймеров 30 с при 60°C, и элонгация 30 с при 72°C. Анализировали кривую плавления для подтверждения, что пары праймеров для каждого анализа qPCR генерируют один единственный продукт. Для расчета эффективности ПЦР использовались стандартные кривые, с использованием 5-кратного разбавления смеси кДНК из всех образцов. Каждый образец повторялся трижды на плашке. Относительные уровни экспрессии генов определяли методом анализа порогового цикла (КТ) и нормализовали по отношению к Ef-1α используя метод 2−ΔΔCt [38].
Таблица 2.
Последовательности праймеров для ПЦР в реальном времени
| Ген | Последовательность 5'-3' | Размер фрагмента, п.о. | Номер в GenBank |
|---|---|---|---|
| EF-1a | F: GGTGGTGTGGGTGAGTTTGAG R: AACCGCTTCTGGCTGTAGGG |
149 | NM_001124339.1 |
| MyHC | F: AGAATGTTCGCCAGGTCAATG R: TCCTCAATCGCCCTCTTCAG |
169 | Z48794 |
| MyoG | F: TGAACGAGGCATTCGAGGC R: AGTGCCTGCAGCCTCTCAA |
115 | NM_001124727.1 |
| MyoD1b | F: ATTTCGTTCCCTGTCACCTCTG R: TCGTCTTCGTTGTAATGG |
146 | NM_001124728.1 |
| MSTN-1a | F: CGGAAACCCAAGTGTTGCTTATTC R: GGCATCAGGCGGGAGATTTG |
137 | NM_001124282.1 |
Получение препаратов протеиназ. Ткани были подвергнуты гомогенизации в 20 мМ Трис-HCl-буфере (рН 7.5) с добавлением 150 мМ NaСl, 5 мМ ЭДТА-Na, 20 мМ ДТТ, 0.1%-го Triton X-100, 1 мМ АТР, 5 мМ MgCl2, смеси ингибиторов протеиназ (1 мМ PMSF, 1 мкг/мл лейпептина, 1 мкг/мл пепстатина) в соотношении 1 : 10 (вес/объем) и центрифугированию (20 000 g, 20 мин).
Анализ протеолитической активности кальпаинов. В полученном супернатанте (ферментная фракция) была протестирована активность кальпаинов – кальцийзависимая казеинолитическая активность, чувствительная к ингибиторам цистеиновых протеиназ [39]. Реакционная смесь, общим объемом 500 мкл, включала 1 мг/мл денатурированного щелочью казеина, 20 мМ ДТТ, 200 мкл ферментной фракции и 5 мМ СаСl2 (кальцийзависимая активность) или хелатора Са2+ ЭДТА-Na (Са2+-независимая активность) в 50 мМ Трис-HCl-буфере (рН 7.5). После 30-мин инкубации (28°С) в реакционной смеси было определено содержание остаточного белка по методу Брэдфорд [40]. За единицу активности (ед. акт.) кальпаинов было принято количество фермента, вызывающее увеличение оптического поглощения при 595 нм на 0.1 ОЕ за 1 ч инкубации при 28°С. Удельная активность кальпаинов была определена в расчете на 1 г белка.
Анализ протеолитической активности протеасом. Химотрипсинподобную активность (ХПА) протеасом определяли по гидролизу флуорогенного олигопептида Suc-LLVY-AMC. Реакционная смесь содержала 20 мМ Tрис-HCl (pH 7.5), 1 мМ ДТТ, 5 мМ MgCl2, 1 мМ ATР и 30 мкМ субстрата. Флуоресценцию образцов измеряли при длине волны возбуждения 380 нм и длине волны испускания 440 нм. Для оценки активности примесных протеиназ использовали ингибитор ХПА протеасом MG132. При расчете ХПА протеасом из общей активности вычитали остаточную активность в присутствии 5 мкM MG132. Активность (ед. акт.) выражали в условных единицах показаний флуориметра и нормализовали по содержанию в пробах белка.
Анализ содержания белка. Концентрацию белка определяли методом Брэдфорд [40] с использованием BSA в качестве стандарта.
Статистическая обработка результатов. Статистический анализ результатов проводили при помощи критерия Краскела–Уоллиса с последующим сравнением выборок с использованием критерия Манна–Уитни. Различия считали достоверными при р < 0.05. Взаимосвязь исследуемых показателей между собой оценивали при помощи линейной регрессии и корреляционного анализа по Пирсону.
Список литературы
Houlihan D.F., Mathers E.M., Foster A. // Fish Ecophysiology / Eds. Rankin J.C., Jensen F.B. London, UK., 1993. Ch. 2. P. 45–71.
Bureau D.P., Hua K., Cho C.Y. // Aqua. Res. 2006. V. 37. P. 1090–1098. https://doi.org/10.1007/s10499-015-9911-x
Overturf K., Hardy R. // Aquat. Res. 2001. V. 32. P. 315–322. https://doi.org/10.1046/j.1365-2109.2001.00582.x
Hevroy E.M., Jordal A.-E.O., Hordvik Espe M., Hemre G.-I., Olsvik P.A // Aquaculture. 2006. V. 252. P. 453–461. https://doi.org/10.1016/j.aquaculture.2005.07.003
Imsland A.K., Le Francois N.R., Lammare S.G., Ditlecadet D., Sigurosson S., Foss A. // Can J. Fish Aquat. Sci. 2006. V. 63. P. 1959–1967. https://doi.org/10.1139/F06-091
Dhillon R.S., Wang Y., Tufts B.L. // Comp. Biochem. Physiol. C. 2008. V. 48. P. 452.
Johnston I.A. // J. Exp. Biol. 2006. V. 209. P. 2249–2264. https://doi.org/10.1242/jeb.02153
Watabe S. // Muscle Development and Growth / Ed. Johnston I.A. London: Acad. Press, 2001. P. 19–41.
Ciechanover A. // Bioorg. Med. Chem. 2013. V. 21. P. 3400–3410. https://doi.org/10.1002/anie.200501428
Goll D.E., Neti G., Mares S.W., Thompson V.F. // J. Anim. Sci. 2008. V. 86. P. E19–E35. https://doi.org/10.2527/jas.2007-0395
Лысенко Л.А., Канцерова Н.П., Ушакова Н.В., Немова Н.Н. // Биоорган. химия. 2012. Т. 38. С. 324–332. [Lysenko L.A., Kantserova N.P., Ushakova N.V., Nemova N.N. // Russ. J. Bioorg. Chem. 2012. V. 38. P. 282–289.] https://doi.org/10.1134/S1068162012020070
Лысенко Л.А., Канцерова Н.П., Крупнова М.Ю., Веселов А.Е., Немова Н.Н. // Биоорган. химия. 2015. Т. 41. С. 717–724. [Lysenko L.A., Kantserova N.P., Krupnova M.Yu., Veselov A.E., Nemova N.N. // Russ. J. Bioorg. Chem. 2015. V. 41. P. 645–651.] https://doi.org/10.1134/S1068162015060096
Overturf K., Gaylord T.G. // Comp. Biochem. Physiol. B. 2009. V. 152. P. 150–160. https://doi.org/10.1016/j.cbpb.2008.10.012
Salem M., Silverstein J., Rexroad C.E., Yao J. // BMC Genomics. 2007. V. 8. P. 328. https://doi.org/10.1186/1471-2164-8-328
Cleveland B.M., Burr G.S. // Aquaculture. 2011. V. 319. P. 194–204. https://doi.org/10.1016/j.aquaculture.2011.06.043
Salmerón C., García de la serrana D., Jiménez-Amilburu V., Fontanillas R., Navarro I., Johnston I.A., Gutiérrez J., Capilla E. // PLoS One. 2013. V. 8. P. 75 349. https://doi.org/10.1371/journal.pone.0075349
Kantserova N.P., Lysenko L.A., Veselov A.E., Nemova N.N. // Fish Physiol. Biochem. 2017. V. 434. P. 1187–1194. https://doi.org/10.1007/s10695-017-0364-1
Lysenko L.A., Kantserova N.P., Kaivarainen E.I., Krupnova M.Yu., Nemova N.N. // Comp. Biochem. Physiol. B. 2017. V. 211. P. 22–28. https://doi.org/10.1016/j.cbpb.2017.05.001
Зданович В.В., Пушкарь В.Я., Келехсаев М.З. // Вопр. ихтиол. 2011. Т. 51. С. 494–501.
Funkenstein B, Skopal T., Rapoport B.Y., Rebhan Y., Radaelli G. // Comp. Biochem. Physiol. D. 2007. V. 2. P. 187–199. https://doi.org/10.1016/j.cbd.2007.04.001
Blackwell T., Weintraub H. // Science. 1990. V. 250. P. 1104–1110. https://doi.org/10.1126/science.2174572
Johansen K.A., Overturf K. // Mar. Biotechnol. 2005. V. 7. P. 576–587. https://doi.org/10.1007/s10126-004-5133-3
Macqueen D.J., Robb D., Johnston I.A. // J. Exp. Biol. 2007. V. 210. P. 2781–2794. https://doi.org/10.1242/jeb.006981
Johansen K.A., Overturf K. // Comp. Biochem. Physiol. B. 2006. V. 144. P. 119–127. https://doi.org/10.1016/j.cbpb.2006.02.001
Bower N.I., Taylor R.G., Johnston I.A. // Front. Zool. 2009. V. 6. P. 18. https://doi.org/10.1186/1742-9994-6-8
Macqueen D.J., Johnston I.A. // FEBS Lett. 2006. V. 580. P. 4996–5002. https://doi.org/10.1016/j.febslet.2006.08.016
Churova M.V., Meshcheryakova O.V., Veselov A.E., Efremov D.A., Nemova N.N. // Fish Physiol. Biochem. 2017. V. 43. P. 1117–1130. https://doi.org/10.1007/s10695-017-0357-0
Almeida F.L.A., Pessoti N.S, Pinhal D., Padovani C.R., Leitão N.J., Carvalho R.F., Martins C., Portella M.C., Dal Pai-Silva M. // Micron. 2010. V. 41. P. 997–1004. https://doi.org/10.1016/j.micron.2010.06.012
Berkes C.A., Tapscott S.J. // Semin. Cell. Dev. Biol. 2005. V. 16. P. 585–595. https://doi.org/10.1016/j.semcdb.2005.07.006
Kantserova N.P., Lysenko L.A., Krupnova M.Yu., Nemova N.N. // KnE Life Science. 2020. P. 283–294. https://doi.org/10.18502/kls.v5i1.6070
Lysenko L.A., Kantserova N.P., Churova M.V., Tushina E.D., Nemova N.N. // KnE Life Science. 2020. P. 581–591. https://doi.org/10.18502/kls.v5i1.6131
Nemova N.N., Lysenko L.A., Kantserova N.P. // Rus. J. Dev. Biol. 2016. V. 47. P. 161–172. https://doi.org/10.1134/S1062360416040068
Seiliez I., Dias K., Cleveland B.M. // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2014. V. 307. P. R1330–R1337. https://doi.org/10.1152/ajpregu.00370.2014
Schollmeyer J.E. // Exp. Cell Res. 1986. V. 162. P. 411–422.https://doi.org/10.1016/0014-4827(86)90346-0
Poussard S., Cottin P., Brustis G.G., Talmat S., Elamrani N., Ducastaing A. // Biochimie. 1993. V. 75. P. 885–890.
Kramerova I., Kudryashova E., Wu B., Spencer M.J. // Mol. Cell Biol. 2006. V. 26. P. 8437–8447. https://doi.org/10.1128/MCB.01296-06
Barnoy S., Maki M., Kosower N.S. // Biochem. Biophys. Res. Commun. 2005. V. 332. P. 697–701. https://doi.org/10.1016/j.bbrc.2005.05.010
Livak K.J., Schmittgen T.D. // Methods. 2001. V. 25. P. 402–408. https://doi.org/10.1006/meth.2001.1262
Enns D.L., Belcastro A.N. // Can. J. Physiol. Pharmacol. 2006. V. 84. P. 601–609. https://doi.org/10.1139/y06-013
Bradford M.M. // Anal. Biochem. 1976. V. 72. P. 248–254.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


