Биоорганическая химия, 2020, T. 46, № 6, стр. 746-752
Отрицательная корреляция между естественными антителами человека, направленными к гликотопам Galβ1-3GlcNAc и Galβ1-4GlcNAc
Н. В. Шилова 1, 3, 2, И. М. Рыжов 1, М. М. Зиганшина 2, А. С. Ракитько 4, М. Е. Хуфлейт 5, Н. В. Бовин 1, *
1 ФГБУН Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
2 Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова Минздрава РФ
117997 Москва, ул. Академика Опарина, 4, Россия
3 OOO Семиотик
117437 Москва, ул. Миклухо-Маклая, 16/10, Россия
4 МГУ им. М.В. Ломоносова, механико-математический факультет
119991 Москва, Ленинские горы, 1A, Россия
5 Университет Вармы и Мазури, факультет медицинских наук
10-082 Ольштын, ул. Варшавская, 30, Польша
* E-mail: professorbovin@yandex.ru
Поступила в редакцию 26.03.2020
После доработки 06.04.2020
Принята к публикации 14.04.2020
Аннотация
На когорте из 106 доноров мы проанализировали корреляции в связывании естественными антителами человека гликанов в составе гликанового эррея. Наряду с тривиальными взаимосвязями (между структурно схожими гликанами) мы обнаружили высокую положительную корреляцию между совершенно неродственными гликанами. Наиболее интригующей среди отрицательных является корреляция средней силы (близкая к –0.5) между антителами к Galβ1-3GlcNAc и антителами к лактозаминам (Galβ1-4GlcNAc)n. Причина функционального антагонизма между этими антителами пока не ясна.
ВВЕДЕНИЕ
Репертуар естественных антигликановых антител человека (АГАТ) складывается из константных (которые есть почти у всех людей) и вариабельных (таких как к антигенам групп крови) иммуноглобулинов [1]. Стабильность “анти-гликома”, по-видимому, связана с эволюционным отбором наиболее важных для врожденного иммунитета антител, закрепленных в геноме [2]. Например, уровень11 антител к гликанам Ga-lα1‑4GlcNAc, GalNAcα1-3GalNAc, Fucα1-4GlcNAc, Galβ1‑3GlcNAc за редкими исключениями высок [3], в то время как специфические антитела к сиало-эпитопам практически отсутствуют [4]. Репертуар АГАТ сложился в результате стимуляции иммунной системы экзогенными патогенами (в первую очередь бактериями), а также необходимости элиминировать постоянно появляющиеся эндогенные аберрантные клетки. Бактерии антигенно изменчивы – штаммы одного и того же вида могут иметь совершенно разные полисахариды; эволюции нужно было генетически закрепить иммуноглобулины против нескольких разновидностей особо опасных бактерий, несмотря на противоположную тенденцию – стремление избежать их избыточности. Это значит, что между некоторыми из естественных антител можно ожидать положительную корреляцию, когда увеличенный (уменьшенный) титр одного антитела сопровождается увеличением (уменьшением) титра второго при исследовании статистически достаточной когорты индивидов. По-видимому, такой же параллелизм можно ожидать и в элиминировании опухолевых клеток. Не столь очевидно наличие отрицательной корреляции, то есть, когда высокий титр одного антитела с высокой достоверностью сопровождается низким титром другого.
С практической точки зрения, выявление корреляций между АГАТ важно при поиске диагностических сигнатур (комбинации антител, специфической для каждой определенной патологии), что особенно перспективно для сложных системных заболеваний, таких как рак и большие акушерские синдромы, когда один маркер принципиально не дает высокой диагностической чувствительности и специфичности [5–8]. Разнообразие АГАТ в крови высоко [1, 3], а с помощью гликанового эррея в крови больных можно определять сотни специфичностей одновременно, что делает сигнатурный подход реализуемым [9]. Чтобы понять, почему те или иные антитела попадают в диагностическую сигнатуру, и связано ли их появление (или исчезновение) в крови больного с патологией непосредственным образом, нужно как минимум идентифицировать их молекулярные мишени. А чтобы приблизиться к их нахождению, необходимы данные по взаимосвязям АГАТ разной специфичности, полученным на достаточно представительной когорте доноров. В данной работе мы провели корреляционный и кластерный анализ большого массива данных гликоэррея (когорта >100 здоровых женщин [3]) и описали найденные взаимосвязи между парами АГАТ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Кластеризация
В данной работе мы заново проанализировали опубликованные ранее данные [3, 10], полученные с использованием гликанового эррея, включающего 211 синтетических гликанов. Поскольку количество кластеров нам заранее было неизвестно, был использован метод иерархической кластеризации. В качестве матрицы расстояний брали матрицу Q = 1 – cor(X)[i,j], где cor(X)[i,j] – коэффициент корреляции между гликанами i и j. Для выделения достоверных кластеров мы использовали метод бутстрепинга [11]. Вычисления производились с помощью R-пакета pvclust; число случайно сгенерированных выборок на основе имеющихся данных (бутстреп ресамплинг) составляло 20 000. В качестве кластеров рассматривали группы гликанов, для которых величина p ≥ 0.99. Всего было выявлено 23 кластера, внутри которых АГАТ достоверно коррелировали (табл. 1).
Таблица 1.
Выявленные кластеры корреляции
| Кластер # | Структура | Средний коэффициент корреляции внутри кластера |
|---|---|---|
| 1 | GalNAcα1-4(Fucα1-2)Galβ1-4GlcNAcβ-sp3* | 0.99 |
| 1 | (GlcNAcβ1)3-3,4,6-GalNAcα-sp3 | |
| 2 | GlcNAcβ1-3Galβ1-4GlcNAcβ-sp3 | 0.97 |
| 2 | 3-O-SuGalβ1-4GlcNAcβ1-3Galβ1-4GlcNAcβ-sp3 | |
| 2 | (Galβ1-4GlcNAcβ1-3)2-Galβ1-4GlcNAcβ-sp3 | |
| 3 | Neu5Acα2-6GalNAcα-sp3 | 0.95 |
| 3 | Neu5Gcα2-6GalNAcα-sp3 | |
| 4 | GlcNAcα1-3Galβ1-4GlcNAcβ-sp3 | 0.95 |
| 4 | GlcNAcα1-3Galβ1-4GlcNAcβ-sp2 | |
| 5 | (Glcα1-6)3β-sp4 | 0.94 |
| 5 | (Glcα1-6)4β-sp4 | |
| 6 | 3-O-Su-Galβ1-3GlcNAcβ-sp3 | 0.91 |
| 6 | Neu5Acα2-3Galβ1-3GlcNAcβ-sp3 | |
| 7 | Galβ1-3GlcNAcβ1-3Galβ1-4Glcβ-sp4 | 0.91 |
| 7 | Galβ1-4GlcNAcβ1-3Galβ1-4Glcβ-sp4 | |
| 8 | Fucα1-2Galβ1-3GlcNAcβ1-3Galβ1-4Glcβ-sp4 | 0.89 |
| 8 | Fucα1-2Galβ1-3(Fucα1-4)GlcNAcβ1-3Galβ1-4Glcβ-sp4 | |
| 9 | GlcNAcβ1-3GalNAcα-sp3 | 0.87 |
| 9 | GlcNAcβ1-6(GlcNAcβ1-3)GalNAcα-sp3 | |
| 10 | GalNAcα1-3(Fucα1-2)Galβ-sp3 | 0.86 |
| 10 | GalNAcα1-3(Fucα1-2)Galβ-sp5 | |
| 11 | Galα1-3(Fucα1-2)Galβ-sp3 | 0.90 |
| 11 | Galα1-3(Fucα1-2)Galβ-sp5 | |
| 11 | Galα1-3(Fucα1-2)Galβ1-4GlcNAcβ-sp3 | |
| 12 | Galα1-4GlcNAcβ-sp3 | 0.84 |
| 12 | Galα1-4GlcNAcβ1-3Galβ1-4GlcNAcβ-sp3 | |
| 13 | GlcNAcβ1-4GlcNAcβ-sp4 | 0.81 |
| 13 | GlcNAcβ1-4GlcNAcβ-Asn | |
| 14 | GlcNAcβ1-4GlcNAcβ1-4GlcNAcβ-sp4 | 0.84 |
| 14 | (GlcNAcβ1-4)5β-sp4 | |
| 14 | (GlcNAcβ1-4)6-sp4 | |
| 15 | 6-O-Su-Galβ1-4GlcNAcβ-sp3 | 0.76 |
| 15 | 6-O-Su-Galβ1-4GlcNAcβ-sp2 | |
| 16 | Galβ1-4GlcNAcβ1-3GalNAcα-sp3 | 0.76 |
| 16 | Galβ1-4GlcNAcβ1-6(Galβ1-4GlcNAcβ1-3)GalNAcα-sp3 | |
| 17 | 4-O-Su-Galβ1-4GlcNAcβ-sp3 | 0.86 |
| 17 | 4-O-Su-Galβ1-4GlcNAcβ-sp2 | |
| 17 | 4,6-O-Su2-Galβ1-4GlcNAcβ-sp3 | |
| 17 | 4,6-O-Su2-Galβ1-4GlcNAcβ-sp2 | |
| 18 | Neu5Acβ-sp9 | 0.73 |
| 18 | Neu5Acα2-8Neu5Acβ-sp9 | |
| 19 | Neu5Acα2-3Galβ1-4Glcβ-sp4 | 0.69 |
| 19 | Neu5Acα2-8Neu5Acα2-3Galβl-4Glcβ-sp4 | |
| 20 | Neu5Gcβ2-6Galβ1-4GlcNAcβ-sp3 | 0.63 |
| 20 | Neu5Acβ2-6Galβ1-4GlcNAcβ-sp3 | |
| 21 | Neu5Acβ2-6GalNAcα-sp3 | 0.57 |
| 21 | Galβ1-3(Neu5Acβ2-6)GalNAcα-sp3 | |
| 22 | Galβ-sp3 | 0.49 |
| 22 | Neu5Acα2-6Galβ-sp3 | |
| 22 | GlcAβ1-6Galβ-sp3 | |
| 23 | GalNAcβ1-3Galβ-sp3 | 0.65 |
| 23 | Fucα1-2(GalNAcβ1-3)Galβ-sp3 |
Порог объединения в кластер определяется значением р, при этом внутри кластера гликаны не обязательно очень хорошо коррелируют между собой, как это видно из табл. 1; здесь рассматривались корреляции вплоть до ~0.5. Более важно было отличие на уровне целых кластеров, то есть одного кластера от другого.
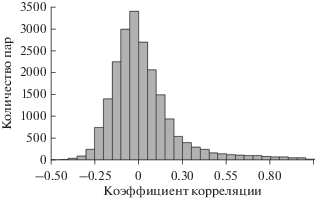
Приведенные выше корреляции, как между кластерами, так и между индивидуальными АГАТ внутри них, были положительны. Общую картину как положительных, так и отрицательных корреляций можно увидеть на гистограмме (рис. 1), которая говорит о редкой встречаемости высоких корреляций.
Большая часть этих 23 кластеров тривиальна, к этой категории мы относим следующие случаи.
1) Антитела к гликанам, отличающихся только спейсером, как, например, кластеры # 15 и 17;
2) Антитела к гомополимерам, таким как хитоолигосахариды (# 13 и 14);
3) Антитела к производному N-гликолилнейраминовой кислоты в паре с производным N-ацетилнейраминовой кислоты (кластер #3);
Корреляции внутри кластеров этих трех типов высоки.
4) Антитела к гликанам, имеющих общий моносахаридный остаток, например, кластер #22, в который вошли два гликана с коровым остатком Galβ и, собственно, Galβ, а также кластер #2, объединяющий молекулы с коровым мотивом 3Galβ1-4GlcNAcβ; коэффициенты корреляции в таких случаях могут быть как низкими (очень небольшой эпитоп, кластер #22), так и высокими (#2).
Наибольший интерес представляют такие кластеры АГАТ, в которых структуры гликанов совсем непохожи. Можно предположить два механизма корреляции антител к непохожим антигенам. Первый – одни и те же антитела связываются со взаимно мимикрирующими антигенами. Второй – не структурная, а функциональная сцепленность, например, антитела к разным молекулам одного и того же патогена. Высокая нетривиальная корреляция обнаружилась лишь одна, между гликанами кластера #1, в который вошли GalNAcα1-4(Fucα1-2)Galβ1-4GlcNAcβ-sp3 и (GlcNAcβ1)3-3,4,6-GalNAcα-sp3. Оба гликана являются неприродными, поэтому предполагать их функциональную сцепленность бессмысленно. Что касается взаимного мимикрирования, то можно предположить, что антитела узнают определенное пространственное расположение метильных групп, которых в первом гликане три, а во втором четыре, и они размещены довольно компактно. Ранее мы нашли похожий эффект при узнавании естественными антителами человека структурно совершенно разных сильно метилированных полисахаридов [12].
Существует ли корреляция между антителами групп крови A и B?
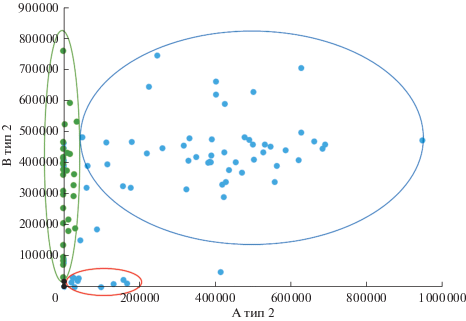
По имеющейся выборке доноров коэффициент корреляции Пирсона между двумя гликанами GalNAcα1-3(Fucα1-2)Galβ1-4GlcNAcβ (A тип 2) и Galα1-3(Fucα1-2)Galβ1-4GlcNAcβ (B тип 2) оказался равен 0.43, что говорит о наличии слабой положительной корреляции. Наличие или отсутствие антител к этим гликанам определяет группу крови человека по системе АВО. Насколько она достоверна с биологической точки зрения?
Рис. 2 показывает, что когорта из 106 изученных доноров разбивается на четыре группы по интенсивности сигналов к гликанам A тип 2 и B тип 2. Эти группы (доноров четвертой группы было только двое, что согласуется с известной низкой частотой встречаемости22 индивидуумов группы крови АВ) соответствуют четырем группам системы АВО. С математической точки зрения, корреляция предполагает наличие обоих параметров, которые однонаправленно изменяются. В случае с антителами к антигенам групп крови, один из параметров равен нулю (так, у доноров группы крови В уровень анти-А антител широко варьируется, а анти-В антител нет вовсе), поэтому отрицательной корреляции быть не может, а положительная корреляция возникла вследствие того, что в рассматриваемой когорте преобладающее большинство индивидуумов имеет, по-видимому, группу I(0), для которой характерно наличие ненулевых уровней антител к обоим рассматриваемым антигенам, флуктуация в сигналах к которым и позволила выявить математическую (но не биологическую) взаимосвязь. То же самое следует ожидать и для других связанных с углеводными антигенами систем групп крови, таких как Lewis и Pp (есть и другие системы, но там представленность одного из параметров, то есть фенотипа, составляет около 0.99).
Рис. 2.
Встречаемость антител, направленных к тетрасахаридам групп крови GalNAcα1-3(Fucα1-2)Galβ1-4GlcNAcβ (A тип 2) и Galα1-3(Fucα1-2)Galβ1-4GlcNAcβ (B тип 2). По осям абсцисс и ординат – относительные единицы флуоресценции, уменьшенные в тысячу раз. Зеленые точки соответствуют группе крови III(B), красные – II(А), голубые – I(O), черные – IV(AB).
Взаимодействия между кластерами
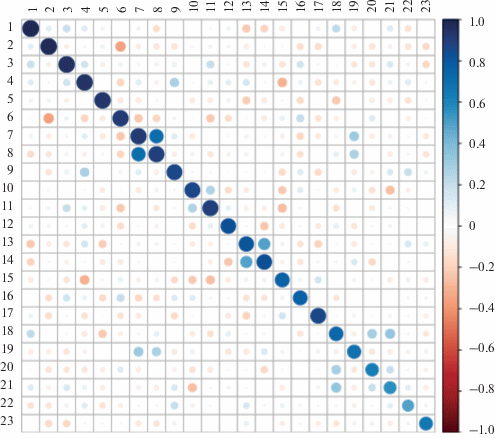
Было оценено также и межкластерное взаимодействие (рис. 3). Поскольку мы задали высокое пороговое значение р, алгоритм не объединил кластеры похожих гликанов в общий кластер большего размера. Тем не менее, есть кластеры, которые можно было бы объединить в более крупный, например, кластеры #7 и #8, коэффициент корреляции между ними составил 0.71, в то время как внутри этих малых кластеров корреляция была 0.91 и 0.89 соответственно. Подобная ситуация наблюдается для пары #13 и #14, коэффициент корреляции между ними 0.50. Структурная схожесть гликанов в обоих случаях очевидна (табл. 1).
Рис. 3.
Межкластерное взаимодействие обнаруженных 23 кластеров. Точки на диагонали обозначают величину коэффициента корреляции внутри кластера i (i – номер строки/столбца). Точки вне диагонали обозначают среднюю величину коэффициента корреляции между кластерами. Синий цвет соответствует положительной, а коричневый – отрицательной корреляции, градация цвета приведена справа.
Существуют ли отрицательные корреляции?
Оказалось, что на уровне кластеров наблюдается отрицательная корреляция между #6 и #2 (коэффициент корреляции составил –0.36, это лучшая из обнаруженных величин). На уровне отдельных пар гликанов также найдено несколько примеров (табл. 2), и корреляция в них находилась в интервале –0.44…–0.47, т.е. приближалась к корреляциям средней силы.
Таблица 2.
Лучшие отрицательные корреляции между индивидуальными гликанами
| Кор 2 | Кор 1 | Корреляция |
|---|---|---|
| Galβ1-4GlcNAcβ1-3Galβ1-4GlcNAcβ-sp3 , LN2 | Galβ1-3GlcNAcβ-sp2, LeC | –0.44 |
| (Galβ1-4GlcNAcβ1-3)2-Galβ1-4GlcNAcβ-sp3, LN3 | Galβ1-3GlcNAcβ-sp2, LeC | –0.42 |
| Galβ1-4GlcNAcβ1-3Galβ1-4GlcNAcβ-sp3, LN2 | 3-O-Su-Galβ1-3GlcNAcβ-sp3, Su-LeC | –0.42 |
| Galβ1-4GlcNAcβ1-3Galβ1-4GlcNAcβ-sp3, LN2 | Neu5Acα2-3Galβ1-3GlcNAcβ-sp3, SiaLeC | –0.47 |
Все четыре пары имеют очевидный общий структурный мотив, отличающий “левые” гликаны от “правых”, а именно, гликаны из левого столбца основаны на так называемом коре 2, то есть, N-ацетиллактозамине (LN) [13], а гликаны из правого столбца относятся к кору 1, то есть к Galβ1-3GlcNAc (LeC) [14]. Отметим, что эта закономерность проявляется только для незамещенных олиголактозаминовых цепей, и что единичного LN для связывания антител недостаточно. Важно также, что антитела, связывающиеся на чипе с гликанами 3-O-Su-Galβ1-3GlcNAcβ и Neu5Acα2-3Galβ1-3GlcNAcβ, на самом деле почти идентичны антителам к “родительскому” дисахариду LeC, что было показано с помощью их аффинного выделения [15]. Имея в виду все вышесказанное, мы выбрали для дальнейшего рассмотрения первую пару из табл. 2.
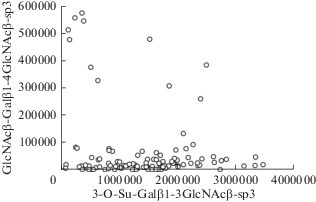
Чтобы наглядно продемонстрировать наличие реципрокных взаимоотношений, мы приводим диаграмму (рис. 4), на которой видно, что уровни антител к двум гликанам (пример из табл. 2) редко оказываются вблизи диагонали.
Рис. 4.
Реципрокные взаимоотношения между анти-3-O-Su-Galβ1-3GlcNAc и анти-GlcNAcβ1-3Galβ1-4GlcNAc антителами. По осям абсцисс и ординат – относительные единицы флуоресценции, уменьшенные в тысячу раз.
Биологический смысл антагонизма между анти-Galβ1-3GlcNAc (LeC) and анти-Galβ1-4GlcNAcβ1-3Galβ1-4GlcNAc (LN2) антителами пока неясен. Вряд ли это “физическая” конкуренция за связывание антител с двумя соседними эпитопами одной и той же молекулы, это больше похоже на функциональный антагонизм. Антитела к LeC выполняют функцию надзора за возникновением опухолевых клеток, у больных раком молочной железы наблюдается их дефицит [16, 17]. Возможно, анти-LN2 восполняют этот дефицит, в пользу чего говорят данные о повышенной экспрессии линейных полилактозаминовых цепей при карциномах (а в нормальных тканях они представлены слабо) [18, 19]. Наличие антител к полилактозаминам является фактором риска, они относятся к так называемым холодовым агглютининам (ауто-антителам), а у беременных могут вызвать ответ к плоду, так как полилактозаминовые цепи широко представлены у эмбриона (после рождения они трансформируются в разветвленные), иными словами, являются онко-эмбриональными антигенами [17]. То есть, при дефиците антител к LeC, антитела к полилактозаминам появляются (точнее, не исчезают при взрослении) как их суррогат. Более убедительной гипотезы у нас нет.
Таким образом, при изучении антигликановых естественных антител в большой когорте доноров выявляются как положительные, так и отрицательные корреляции между антителами, которые бывают нетривиальными, когда коррелирующие антитела направлены к гликанам неродственной структуры. Причины возникновения таких корреляций предстоит выяснить.
Список литературы
Bovin N.V. // Biochemistry (Moscow). 2013. V. 78. P. 786–797. https://doi.org/10.1134/S0006297913070109
Khasbiullina N.R., Bovin N.V. // Biochemistry (Moscow). 2015. V. 80. P. 820–835. https://doi.org/10.1134/S0006297915070032
Huflejt M.E., Vuskovic M., Vasiliu D., Xu H., Obukhova P., Shilova N., Tuzikov A., Galanina O., Arun B., Lu K., Bovin N. // Molecular Immunology. 2009. V. 46. P. 3037–3049. https://doi.org/10.1016/j.molimm.2009.06.010
Shilova N., Huflejt M.E., Vuskovic M., Obukhova P., Navakouski M., Khasbiullina N., Pazynina G., Galanina O., Bazhenov A., Bovin N. // Top. Curr. Chem. 2015. V. 366. P. 169–181. https://doi.org/10.1007/128_2013_469
Vuskovic M., Xu H., Bovin N., Pass H., Huflejt M. // Int. J. Bioinform. Res. Appl. 2011. V. 7. P. 402–426. https://doi.org/10.1504/IJBRA.2011.043771
Jacob F., Goldstein D.R., Bovin N.V., Pochechueva T., Spengler M., Caduff R., Fink D., Vuskovic M.I., Huflejt M.E., Heinzelmann-Schwarz V. // Int. J. Cancer. 2012. V. 130. P. 138–146. https://doi.org/10.1002/ijc.26002
Butvilovskaya V.I., Popletaeva S.B., Chechetkin V.R., Zubtsova Z.I., Tsybulskaya M.V., Samokhina L.O., Vinnitskii L.I., Ragimov A.A., Pozharitskaya E.I., Grigoryeva G.A., Meshalkina N.Yu., Golysheva S.V., Shilova N.V., Bovin N.V., Zasedatelev A.S., Rubina A.Y. // Cancer Medicine. 2016. V. 5. P. 1361–1372. https://doi.org/10.1002/cam4.692
Зиганшина М.М., Шилова Н.В., Хасбиуллина Н.Р., Ракитько А.С., Тютюнник Н.В., Мантрова Д.А., Тютюнник В.Л., Бовин Н.В., Сухих Г.Т. // Росс. аллергол. журн. 2018. V. 15. P. 37–39.
Шилова Н.В., Хасбиуллина Н.Р., Полякова С.М., Ракитько А.С., Нокель А.Ю., Бовин Н.В. // Росс. аллергол. журн. 2017. V. 14. P. 202–204.
Vuskovic M., Barbuti A.-M., Goldsmith-Rooney E., Glassman L., Bovin N., Pass H., Tchou-Wong K.-M., Chen M., Yan B., Niu J., Qu Q., Costa M., Huflejt M. // J. Proteom. Bioinform. 2013. V. 6. P. 302–312. https://doi.org/10.4172/jpb.1000295
Efron B. // Ann. Statist. 1969. V. 7. P. 1–26.
Dobrochaeva K.L., Khasbiullina N.R., Shilova N.V., Knirel Yu.A., Bovin N.V. // Mol. Imm. 2019. V. 106. P. 63–68. https://doi.org/10.1016/j.molimm.2018.12.011
Северов В.В., Пазынина Г.В., Овчинникова Т.В., Бовин Н.В. // Биоорган. химия. 2015. Т. 41. С. 170–184. [Severov V.V., Pazynina G.V., Ovchinnikova T.V., Bovin N.V. // Russ. J. Bioorg. Chem. 2015. V. 41. P. 147–160.] https://doi.org/10.1134/S1068162015020120
Северов В.В., Белянчиков И.М., Пазынина Г.В., Бовин Н.В. // Биоорган. химия. 2007. Т. 33. С. 131–147. [Severov V.V., Belyanchikov I.M., Pazynina G.V., Bovin N.V. // Russ. J. Bioorg. Chem. 2007. V. 33. P. 122–138.] https://doi.org/10.1134/S1068162007010141
Obukhova P., Korchagina E., Henry S., Bovin N. // Transfusion. 2011. V. 52. P. 860–869. https://doi.org/10.1111/j.1537-2995.2011.03381.x
Maerle A.V., Voronina D.V., Dobrochaeva K.L., Galanina O.E., Alekseev L.P., Bovin N.V., Zavriev S.K., Ryazantsev D.Yu. // Glycoconj. J. 2017. V. 34. P. 199–205. https://doi.org/10.1007/s10719-016-9751-6
Tupitsyn N.N., Udalova Y.A., Galanina O.E., Kadagidze Z.G., Borovkova N.B., Podolsky V.V., Shinkarev S.A., Gadetskaya N.A., Letyagin V.P., Obukhova P.S., Shilova N.V., Subbotina A.A., Bovin N.V. // Hem. Imm. 2009. V. 2. P. 45–54.
Miyake M., Kohno N., Nudelman E.D., Hakomori S. // Cancer Res. 1989. V. 49. P. 5689–5695.
Watanabe K., Hakomori S. // J. Exp. Med. 1976. V. 744. P. 644–653.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия