Биоорганическая химия, 2021, T. 47, № 2, стр. 179-183
Модифицированные олигонуклеотиды: новые структуры, новые свойства, новые области применения
В. Г. Метелев 1, Т. С. Орецкая 1, *
1 Московский государственный университет имени М.В. Ломоносова, химический факультет
и НИИ физико-химической биологии имени А.Н. Белозерского
119991 Москва, Ленинские горы, 1, Россия
* E-mail: oretskaya@belozersky.msu.ru
Поступила в редакцию 28.09.2020
После доработки 10.10.2020
Принята к публикации 12.10.2020
Аннотация
Нуклеиновые кислоты прошли длинный и тернистый путь “от лабораторного стола до больничной палаты” (“from bench to bedside”). В настоящее время можно предположить, что лекарственные препараты на основе модифицированных олигонуклеотидов найдут достойное применение в персонализированной медицине будущего.
Модифицированные олиго- и полинуклеотиды стали важнейшими инструментами в молекулярной биологии, биохимии, медицинской химии, диагностических процедурах и завоевывают свою нишу среди терапевтических средств нового поколения. Решающее значение для качественного скачка в изучении свойств и использовании такого рода соединений сыграло появление универсального автоматизированного метода синтеза фрагментов нуклеиновых кислот (НК). Конструирование, синтез и применение олигонуклеотидов как лекарственных препаратов были бы невозможны, если бы в апреле 1953 г. в журнале “Nature” не появились три легендарные статьи, описывающие структуру ДНК. Первая – Джеймса Уотсона (J.D. Watson) и Фрэнсиса Крика (F.H. Crick) [1], в которой впервые приведена трехмерная модель структуры ДНК. Две другие статьи были написаны учеными Королевского колледжа в Кембридже. Розалинд Франклин (R.E. Franklin) и Раймонд Гослинг (R.G. Gosling) представили исследование дифракции рентгеновских лучей на кристаллах ДНК [2], а Морис Уилкинс (M.H. Wilkins), Александр Стокс (A.R. Stokes) и Герберт Уилсон (H.R. Wilson) [3] сделали расчеты параметров двойной спирали на основе кристаллографических данных. История открытия двойной спирали хорошо описана не только в знаменитой книге Уотсона “Двойная спираль: воспоминания об открытии структуры ДНК” [4], но и в ряде других книг, например, в книге “Розалинд Франклин: темная леди ДНК”, опубликованной Брендой Мэддокс (B. Maddox) в 2002 г. [5].
Появление этих книг, современных обзоров по истории развития химии нуклеиновых кислот и их применения [6–8], а также желание многих ученых представить свои работы в данном тематическом номере журнала свидетельствуют о том, что до сих пор значимость этого фантастического и феерического события, поистине величайшего в ХХ веке, и его последствий не перестает привлекать внимание ученых и историков науки.
История химического синтеза ДНК началась через два года после открытия структуры двойной спирали ДНК Уотсоном и Криком. Решение проблемы быстрого и эффективного синтеза фрагментов НК являлось основанием для развития молекулярной биологии, биотехнологии, генетики, инженерии белков, расшифровки генома человека. История синтеза НК включает тысячи работ ученых из многих стран мира. Исследования одних строились на достижениях других. Невозможно перечислить всех, кто внес свой вклад в развитие этой области. В первой классической работе, опубликованной А.М. Микельсоном (A.M. Michelson) и А.Р. Тоддом (A.R. Todd), описывался синтез динуклеотида с использованием соединений трехвалентного фосфора [9]. Это был “мастер-класс” постановки защитных групп и методов фосфитилирования. Впервые был использован прогрессивный для того времени способ выделения полученного динуклеозидфосфата с помощью бумажной ионообменной хроматографии. Знаменательными событиями в истории химии олигонуклеотидов явились синтез гена тРНК и появление универсального автоматизированного метода синтеза олигонуклеотидов, поэтому, признавая заслуги многих химиков, в первую очередь следует отметить огромный вклад Х.Г. Кораны (H.G. Khorana) и М.Х. Карузерса (M.H. Caruthers) [6–8, 10–12]. Параллельно с совершенствованием методов создания межнуклеотидной связи и введения/удаления защитных групп начался бум по встраиванию модифицированных звеньев во фрагменты ДНК, изучению влияния модификаций на химические и физико-химические свойства одно- и двутяжевых фрагментов и их широкому использованию в фундаментальных исследованиях, медицинской и диагностической практике.
Немодифицированные НК могут выступать как объект и инструмент исследования или воздействия на биологические процессы. Однако введение модифицированных фрагментов в олигонуклеотидную цепь позволяет значительно расширить комплекс задач, в том числе существенно улучшить проникновение фрагментов ДНК через клеточные мембраны, повысить устойчивость к действию клеточных нуклеаз, увеличить термодинамическую стабильность НК-дуплексов. Встраивание в олигонуклеотид химически активных групп дает возможность получить разнообразные конъюгаты с молекулами пептидов, красителей и др. В принципе, возможно постсинтетическое введение статистических модификаций или модификаций по 3'- и/или 5'-концу олигонуклеотидов, однако наиболее универсальным методом является направленное встраивание модифицированного звена в заранее заданное положение олигомерной цепи в процессе химического синтеза. Модификации можно подразделить на терминальные и внутрицепочечные. Замена или введение дополнительных группировок может происходить по межнуклеотидной фосфатной группе, углеводному фрагменту или гетероциклическому основанию.
Модификация олигонуклеотидов направлена на улучшение фармакокинетических и фармакодинамических свойств. Можно выделить некоторую направленность в изменении свойств при введении модификаций, в частности изменение углеводофосфатного остова приводит к повышению нуклеазной стабильности и аффинности к НК, тогда как присоединение заместителей по 3'- и 5'-концам значительно улучшает доставку олигонуклеотидов к органам и проникновение в клетки.
Важно всегда помнить, что одним из фундаментальных свойств олигонуклеотидов является их способность к комплементационным взаимодействиям, поэтому при введении различных модификаций одной из главных задач является сохранение структур и функций, необходимых для взаимодействия с комплементарными участками целевых нуклеиновых кислот. Не случайно, что модификация в большинстве случаев направлена на углеводофосфатный остов [13–18]. Важными аспектами являются повышение специфичности связывания модифицированных олигонуклеотидов с целевыми нуклеиновыми кислотами или НК-связывающими белками, увеличение стабильности этих соединений по отношению к гидролизу клеточными нуклеазами. Тем не менее следует отметить, что в любом случае модификации не должны приводить к появлению токсичных метаболитов [13].
Если ранее речь шла о какой-то конкретной модификации (основными вехами принято считать описанные в обзорах [6–8, 13], в том числе 2′-F (1964), PS (1966), 2′-O-метил (1969), 2′-O-MOE (1978), PMO (1989), PNA (1991), NP (1994), LNA (1998), tc-DNA (2002)), то к настоящему моменту накоплена такая “солидная библиотека” олигонуклеотидных производных, что следует говорить о семействах модификаций. Это можно продемонстрировать на примере 2',4'-мостиковых олигонуклеотидов, описанных в обзоре Wan et al. [13], где приведены сведения о 30-мостиковых аналогах. До сих пор остаются востребованными такие изменения структуры, которые приводят к снижению суммарного заряда модифицированного олигонуклеотида и повышению его гидрофобности [19–23].
К настоящему моменту 11 препаратов [24] на основе олигонуклеотидов были одобрены к использованию в медицинской практике (табл. 1).
Таблица 1.
Олигонуклеотиды, используемые в качестве лекарственных препаратов
| Препарат | Организация (год одобрения) | Межнуклеозидный фосфат | Углеводный фрагмент или остаток морфолина | Особенности строения соединения | Cсылка |
|---|---|---|---|---|---|
| Фомивирсен (Fomivirsen) | FDA (1998), EMA (1999) |
PS, PO | 2'-Дезоксирибоза | ss | [25] |
| Пегаптаниб (Pegaptanib) | FDA (2004) | PO | 2'-F-2'-дезоксипиримидиновые и 2'-O-метилпуриновые нуклеозиды | ss | [26] |
| 5'-концевой ПЭГ-линкер, 3',3'-межнуклеотидная связь, аптамер | |||||
| Мипомерсен (Mipomеrsen) | FDA (2013) | PS, PO | 2'-Дезоксирибоза и 2'-O-(2-метоксиэтил)рибоза | ss | [27] |
| центральная часть – дезоксинуклеотиды, остальные рибонуклеотиды (гэпмер) | |||||
| Этеплирсен (Eteplirsen) | FDA (2016) | Диамидофосфат |  |
ss
на 5'-конце |
[28] |
| Нусинерсен (Nusinersen) | FDA (2016) EMA (2017) |
PS, PO | 2'-O-(2-метоксиэтил)рибоза | ss | [29] |
| Инотерсен (Inotersen) | FDA (2018) EMA (2018) |
PS, PO | 2'-O-(2-метоксиэтил)рибоза | ss гэпмер |
[30] |
| Патисиран (Patisiran) | FDA (2018) EMA (2018) |
PO | 2'-O-метилрибоза и 2'-дезоксирибоза | ds siРНК | [31] |
| основная часть – рибонуклеотиды, на 3'-конце по два T | |||||
| Воланесорсен (Volanesorsen) | EMA (2019) | PS, PO | 2'-Дезоксирибоза и 2'-O-(2-метоксиэтил)рибоза | ss гэпмер |
[32] |
| Гивосиран (Givosiran) | FDA (2019) | PS на концах, другие PO | 2'-F(A/C/G) 2'-O-метил(A/C/G/U) |
ds siРНК | [33] |
| на 3'-конце L96 (“трехантенный” GalNAc) | |||||
| Голодирсен (Golodirsen) | FDA (2019) | Диамидофосфат | 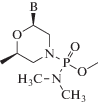 |
ss
на 5'-конце |
[34] |
| Вилтоларсен (Viltolarsen) | MHLW (2020) | Диамидофосфат |  |
ss | [35] |
Клинические испытания ряда других модифицированных олигонуклеотидов (антисмысловых олигонуклеотидов (AСO), малых интерферирующих РНК (siРНК), “ловушек”, аптамеров) продолжаются. Это указывает на то, что потенциал АСО и других основанных на НК лекарственных препаратов реализуется вполне успешно. Использование синтетических олигонуклеотидов для терапевтических целей требует нового подхода для их рационального дизайна и крупномасштабного синтеза [36]. В то время как более чем 70 кандидатов в лекарственные препараты прошли разные стадии клинических испытаний [6], для значительного количества АСО испытания были прекращены. Список олигонуклеотидов, отклоненных для дальнейшего использования в качестве биомедицинских препаратов, продолжает расти. Причиной может быть неподтвержденная мишень в гене, неправильно подобранная нуклеотидная последовательность AСO, достигнутый уровень нокдауна, недостаточный для терапии, активность AСO вне цели и, что наиболее важно, терапевтический индекс, ограничивающий лечение.
Анализируя данные табл. 1, можно легко заметить, что несмотря на колоссальное число предложенных модификаций, сейчас на практике реально используются лишь несколько (весьма небольшая часть из потенциально возможных) относительно простых. Остальные, не нашедшие пока применения в качестве лекарств, широко применяются в научных исследованиях или находятся на различных стадиях клинических испытаний [37–41].
Поиск лекарственных препаратов на основе самым разным образом модифицированных олигонуклеотидов напоминает теорему Курта Геделя (K.F. Godel) о неполноте: всякая система математических аксиом, начиная с определенного уровня сложности, либо внутренне противоречива, либо неполна [42]. Клетка, а тем более организм в целом, слишком сложны, а информация о функционировании системы недостаточна, чтобы сконструировать некое универсальное средство для лечения даже уникальной (отдельной) болезни. Данный факт является причиной того, что широкий ряд ДНК-фрагментов, содержащих иногда набор различный модификаций, не доходят даже до самой ранней стадии клинических испытаний, оставаясь в химической лаборатории в качестве новых соединений, но не биомедицинских препаратов.
Химический синтез терапевтических олигонуклеотидов нетривиален, и комбинированные эффекты нескольких модификаций часто непредсказуемы. При выборе модификаций и их положений в НК-фрагменте необходимо руководствоваться эмпирическим тестированием.
Отсутствие противовирусного препарата для борьбы с SARS-CoV-2 привело к использованию различных лекарств, ингибирующих отдельные стадии репликации вирусов [43]. Было бы удивительно, если бы не появились публикации, в которых пока чисто теоретически не были бы предложены направления воздействия на вирус с помощью олигонуклеотидов. Rossi et al. [44] предполагают, что терапевтические средства на основе олигонуклеотидов могут быть нацелены либо на сам вирус, ингибируя его трансмембранный S-белок (spike protein) или воздействуя на его репликационные белки через нарушение НК-белковых взаимодействий (аптамеры), либо направлены на вирусный геном через подавление экспрессии генов (gene silencing), опосредованное siРНК или АСО. Подходы, заставляющие гены “молчать”, могут уменьшить воспалительные эффекты в легких и других органах, приводящие к смертности в тяжелых случаях COVID-19.
В настоящее время можно предположить, что олигонуклеотидные препараты найдут достойное применение при лечении различных заболеваний, в том числе наследственных и орфанных (редких), а также в диагностике и в персонализированной медицине будущего.
Список литературы
Watson J.D., Crick F.H. // Nature. 1953. V. 171. P. 737–738. https://doi.org/10.1038/171737a0
Franklin R.E., Gosling R.G. // Nature. 1953. V. 171. P. 740–741. https://doi.org/10.1038/171740a0
Wilkins M.H., Stokes A.R., Wilson H.R. // Nature. 1953. V. 171. P. 738–740. https://doi.org/10.1038/171738a0
Watson J.D. // The Double Helix: a Personal Account of the Discovery of the Structure of DNA. New York: Atheneum, 1968.
Maddox B. Rosalind Franklin: The Dark Lady of DNA. New York: HarperCollins, 2002.
Agrawal S., Gait M.J. Chapter 1: History and Development of Nucleotide Analogues in Nucleic Acids Drugs // In Advances in Nucleic Acid Therapeutics. 2019. P. 1–21. https://doi.org/10.1039/9781788015714-00001
Lundin K.E., Gissberg O., Smith C.I.E., Zain R. // Methods Mol. Biol. 2019. V. 2036. P. 3–16. https://doi.org/10.1007/978-1-4939-9670-4_1
Glazier D.A., Liao J., Roberts B.L., Li X., Yang K., Stevens C.M., Tang W. // Bioconjugate Chem. 2020. V. 31. P. 1213−1233. https://doi.org/10.1021/acs.bioconjchem.0c00060
Michelson A.M., Todd A.R. // J. Chem. Soc. 1955. P. 2632–2638. https://doi.org/10.1039/JR9550002632
Caruthers M.H., Khorana H.G. // J. Mol. Biol. 1972. V. 72. P. 407–426. https://doi.org/10.1016/0022-2836(72)90154-4
Caruthers M.H. // Science. 1985. V. 230. P. 281–285. https://doi.org/10.1126/science.3863253
Lundin K.E., Gissberg O., Smith C.I.E. // Hum. Gene Ther. 2015. V. 26. P. 475–485. https://doi.org/10.1089/hum.2015.070
Wan W.B., Seth P.P. // J. Med. Chem. 2016. V. 59. P. 9645−9667. https://doi.org/10.1021/acs.jmedchem.6b00551
Прохорова Д.В., Челобанов Б.П., Буракова Е.А., Фокина А.А., Стеценко Д.А. // Биоорг. химия. 2017. Т. 43. С. 45–50. [Prokhorova D.V., Chelobanov B.P., Burakova E.A., Fokina A.A., Stetsenko D.A. // Russ. J. Bioorg. Chem. 2017. V. 43. P. 38–42.] https://doi.org/10.1134/S1068162017010071
Miroshnichenko S.K., Patutina O.A., Burakova E.A., Chelobanov B.P., Fokina A.A., Vlassov V.V., Altman S., Zenkova M.A., Stetsenko D.A. // PNAS. 2019. V. 116. P. 1229–1234. https://doi.org/10.1073/pnas.1813376116
Zatsepin T.S., Oretskaya T.S., Stetsenko D.A., Gait M.J. // Bioconjugate Chemistry. 2005. V. 16. P. 471–489. https://doi.org/10.1021/bc049712v
Dolinnaya N.G., Zubin E.M., Kubareva E.A., Zatsepin T.S., Oretskaya T.S. // Current Organic Chemistry. 2009. V. 13. P. 1029–1049. https://doi.org/10.2174/138527209788680745
Хомякова Е.А., Казанова Е.В., Зубин Е.М., Кубарева Е.А., Молочков Н.В., Рязанова Е.М., Орецкая Т.С. // Биоорг. химия. 2010. Т. 36. С. 343–353. [Khomyakova E.A., Kazanova E.V., Zubin E.M., Kubareva E.A., Molochkov N.V., Ryazanova E.M., Oretskaya T.S. // Russ. J. Bioorg. Chem. 2010. V. 36. P. 315–324.] https://doi.org/10.1134/S1068162010030064
Yanachkov I., Zavizion B., Metelev V., Stevens L.J., Tabatadze Y., Yanachkova M., Wright G., Krichevsky A.M., Tabatadze D.R. // Org. Biomol. Chem. 2017. V. 15. P. 1363–1380. https://doi.org/10.1039/c6ob02576e
Metelev V.G., Bogdanov A.A., Jr. // Theranostics. 2020. V. 10. P. 1391–1414. https://doi.org/10.7150/thno.37936
Markov O.V., Filatov A.V., Kupryushkin M.S., Chernikov I.V., Patutina O.F., Strunov A.A., Chernolovskaya E.L., Vlas-sov V.V., Pyshnyi D.V., Zenkova M.A. // Molecules. 2020. V. 25. P. 3663. https://doi.org/10.3390/molecules25163663
Chernikov I.V., Meschaninova M.I., Chernolovskaya E.L. // Methods in Molecular Biology. 2020. V. 2115. P. 57–77. https://doi.org/10.1007/978-1-0716-0290-4_3
Osborn M.F., Coles A.H., Biscans A., Haraszti R.A., Roux L., Davis S., Ly S., Echeverria D., Hassler M.R., Godinho B.M.D.C., Nikan M., Khvorova A. // Nucleic Acids Research. 2019. V. 47. P. 1070–1081. https://doi.org/10.1093/nar/gky1232
Kuijper E.C., Bergsma A.J., Pijnappel W.W.M.P., Aartsma-Rus A. // J. Inherit. Metab. Dis. 2020. https://doi.org/10.1002/jimd.12251
Stix G. // Sci. Am. 1998. V. 279. P. 50. https://doi.org/10.1038/scientificamerican1198-46b
Doggrell S.A. // Expert Opin. Pharmacother. 2005. V. 6. P. 1421–1423. https://doi.org/10.1517/14656566.6.8.1421
Hair P., Cameron F., McKeage K. // Drugs. 2013. V. 73. P. 487–493. https://doi.org/10.1007/s40265-013-0042-2
Aartsma-Rus A., Krieg A.M. // Nucl. Acid. Ther. 2017. V. 27. P. 1–3. https://doi.org/10.1089/nat.2016.0657
Aartsma-Rus A. // Nucl. Acid. Ther. 2017. V. 27. P. 67–69. https://doi.org/10.1089/nat.2017.0665
Benson M.D., Waddington-Cruz M., Berk J.L., Polydefkis M., Dyck P.J., Wang A.K., Planté-Bordeneuve V., Barroso F.A., Merlini G., Obici L., Scheinberg M., Brannagan T.H., Litchy W.J., Whelan C., Drachman B.M., Adams D., Heitner S.B., Conceição I., Schmidt H.H., Vita G., Campistol J.M., Gamez J., Gorevic P.D., Gane E., Shah A.M., Solomon S.D., Monia B.P., Hughes S.G., Kwoh T.J., McEvoy B.W., Jung S.W., Baker B.F., Ackermann E.J., Gertz M.A., Coelho T. // N. Engl. J. Med. 2018. V. 379. P. 22–31. https://doi.org/10.1056/NEJMoa1716793
Hoy S.M. // Drugs. 2018. V. 78. P. 1625–1631.https://doi.org/10.1007/s40265-018-0983-6
Yang X., Lee S.R., Choi Y.S., Alexander V.J., Digenio A., Yang Q., Miller Y.I., Witztum J.L., Tsimikas S. // J. Lipid Res. 2016. V. 57. P. 706–713. https://doi.org/10.1194/jlr.M066399
Sardh E., Harper P., Balwani M., Stein P., Rees D., Bissell D.M., Desnick R., Parker C., Phillips J., Bonkovsky H.L., Daphne Vassiliou D., Penz C., Chan-Daniels A., He Q., Querbes W., Fitzgerald K., Kim J.B., Garg P., Akshay Vaishnaw A., Amy R. Simon A.R., Anderson K.E. // N. Engl. J. Med. 2019. V. 380. P. 549–558. https://doi.org/10.1056/NEJMoa1807838
Heo Y.A. // Drugs. 2020. V. 80. P. 329–333. https://doi.org/10.1007/s40265-020-01267-2
Roshmi R.R., Yokota T. // Drugs Today (Barc). 2019. V. 55. P. 627–639. https://doi.org/10.1358/dot.2019.55.10.3045038
Obika S., Sekine M. // Synthesis of Therapeutic Oligonucleotides. Springer, Singapore. 2018. V. VIII. P. 284. https://doi.org/10.1007/978-981-13-1912-9
Зубин Е.М., Анцыпович С.И., Орецкая Т.С., Романова Е.А., Волков Е.М., Ташлицкий В.Н., Шабарова З.А. // Биоорг. химия. 1997. Т. 23. С. 809–816. [Zubin E.M., Antsypovich S.I., Oretskaya T.S., Romanova E.A., Volkov E.M., Tashlitskii V.N., Shabarova Z.A. // Russ. J. Bioorg. Chem. 1997. V. 23. P. 730–736.]
Naryshkin N.A., Farrow M.A., Ivanovskaya M.G., Oretskaya T.S., Shabarova Z.A., Gait M.J. // Bioche-mistry. 1997. V. 36. P. 3496–3505. https://doi.org/10.1021/bi962789p
Monakhova M., Ryazanova A., Hentschel A., Viryasov M., Oretskaya T., Friedhoff P., Kubareva E. // Journal of Chromatography A. 2015. V. 1389. P. 19–27. https://doi.org/10.1016/j.chroma.2015.02.045
Rechkunova N.I., Lavrik O.I. // Photochemistry and Photobiology. 2020. V. 96. P. 440–449. https://doi.org/10.1111/php.13222
Khodyreva S.N., Lavrik O.I. // DNA Repair. 2020. V. 90. P. 102 847. https://doi.org/10.1016/j.dnarep.2020.102847
Курт Гедель // О формально неразрешимых предложениях Principia Mathematica и родственных систем. 1992 / перевод Б. Мельцер, всестороннее введение Р. Брейтуэйт. Дуврское переиздание издания Basic Books 1962 года. ISBN 0-486-66980-7
Kupferschmidt K., Cohen J. // Science. 2020. V. 367. P. 1412–1413. https://doi.org/10.1126/science.367.6485.1412
Rossi J.J., Rossi D. // Nucleic Acid Ther. 2020. V. 30. P. 129–132. https://doi.org/10.1089/nat.2020.0868
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


