Биоорганическая химия, 2021, T. 47, № 4, стр. 419-430
IgA1-протеаза как основа вакцины для профилактики бактериальных менингитов
Л. С. Жигис 1, *, О. В. Котельникова 1, А. А. Зинченко 1, Д. М. Карлинский 1, Ю. А. Прокопенко 1, Л. Д. Румш 1
1 ФГБУН “Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова” РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
* E-mail: zhigis@ibch.ru
Поступила в редакцию 17.08.2020
После доработки 15.11.2020
Принята к публикации 20.11.2020
Аннотация
Обзор посвящен изучению протективных свойств IgA1-протеазы и возможности создания вакцинного препарата для профилактики бактериальных менингитов различного происхождения на ее основе. Бактериальный менингит относится к группе социально опасных заболеваний и характеризуется тяжелым течением, многочисленными осложнениями и высокой смертностью. Используемые в настоящее время в мировой практике подходы к созданию антимикробных вакцин основаны на узкой направленности против конкретного возбудителя. Разработка однокомпонентной вакцины против широкого спектра бактериальных возбудителей с общим фактором вирулентности по-прежнему остается актуальной. Таким антигеном может служить IgA1-протеаза – белок, выступающий одним из основных факторов вирулентности ряда грамотрицательных и грамположительных бактерий. Бактериальная IgA1-протеаза характеризуется уникальной специфичностью в отношении иммуноглобулинов А1 (IgA1), расщепляя пептидные связи в шарнирных участках IgA1 человека и высших приматов. Бактерии, попадая на слизистую оболочку, разрушают IgA1, выступающий первым барьером защиты организма от инфекций. Нейтрализация IgA1-протеазы на этой стадии может стать препятствием к развитию инфекции, затрудняя адгезию целого ряда патогенов, продуцирующих этот белок. Имеющиеся в литературе данные о механизме противобактериальной защиты носят разрозненный и неоднозначный характер. В обзоре рассматриваются литературные данные и результаты собственных экспериментов по протективной активности IgA1-протеазы. Нами было показано, что рекомбинантная IgA1-протеаза менингококка и некоторые ее фрагменты защищают мышей от заражения живой вирулентной культурой не только менингококков основных эпидемических серогрупп (А, В, С и W135), но и некоторых наиболее распространенных вирулентных серотипов пневмококка. Полученные данные говорят о возможности создания однокомпонентной вакцины против этих и, возможно, других бактериальных инфекций. В настоящее время достигнут значительный прогресс в изучении структуры и функций секретируемых белков у бактерий Neisseria meningitidis и Haemophilus influenzae. Описаны системы транслокации белков N. meningitidis, имеющие отношение к секреции белков у этих бактерий, и представлены современные данные о функциях этих белков. Анализ экспериментальных данных о структуре IgA1-протеазы N. meningitidis и формировании иммунитета при вакцинации имеет ключевое значение при создании профилактических препаратов.
ВВЕДЕНИЕ
В настоящее время эффективность вакцинации для защиты от инфекционных заболеваний общепризнана во всем мире. За последние 30 лет резко возросло число вновь создаваемых вакцин, благодаря которым были ликвидированы или сведены до минимума более десятка тяжелых инфекций (дифтерия, столбняк, краснуха, полиомиелит и др.).
Используемые в настоящее время в мировой практике подходы к созданию антимикробных вакцин основаны на узкой направленности против конкретного возбудителя. Для защиты от всего многообразия циркулирующих и непрерывно мутирующих штаммов этих микробов требуется комплексная вакцинация, включающая в себя многократное введение каждого компонента. Разработка, испытания и производство таких препаратов требуют огромных расходов, что существенно сказывается на себестоимости вакцинных препаратов. Высокая стоимость производимых вакцин делает их труднодоступными для многих развивающихся стран и осложняет процесс вакцинопрофилактики широких слоев населения.
Разработка однокомпонентной вакцины против широкого спектра бактериальных возбудителей с общим фактором вирулентности по-прежнему остается актуальной, а поиск соответствующих иммунологически безвредных протективных антигенов – важная научно-исследовательская задача.
Одним из перспективных протективных антигенов с точки зрения создания такой вакцины может служить бактериальная IgА1-протеаза, которая секретируется рядом грамотрицательных (Neisseria meningitidis, N. gonorrhoeae, Haemophilus influenzae) и грамположительных (Streptococcus pneumoniae, S. sanguis, S. oralis) бактерий [1–6]. IgA1-протеазы представляют собой семейство сериновых (E.C. 3.4.21.72) и металло- (E.C. 3.4.24.13) эндопептидаз. Эти ферменты характеризуются уникальной специфичностью в отношении иммуноглобулинов А1, обладая способностью расщеплять пептидные связи в шарнирных участках сывороточного (IgA1) и секреторного (sIgA1) иммуноглобулинов А1 человека и высших приматов [4, 7]. Бактерии, заселяя слизистую оболочку, разрушают sIgA1, который присутствует на слизистой оболочке в значительном количестве и служит первым барьером защиты организма от инфекций. Нейтрализация IgA1-протеазы на этой стадии инвазии может стать препятствием для развития инфекции, затрудняя адгезию бактерий на поверхности слизистой оболочки.
В данном обзоре обсуждаются проблемы создания монокомпонентной поливакцины для профилактики бактериальных менингитов, возбудителями которых выступает широкий спектр грамотрицательных и грамположительных микроорганизмов, патогенность которых обусловлена IgА1-протеазой.
БАКТЕРИАЛЬНЫЕ МЕНИНГИТЫ
Бактериальный менингит – заболевание с высоким эпидемическим потенциалом, которое характеризуется тяжелым течением и часто носит молниеносный характер. Между появлением первых симптомов, сходных с таковыми при ОРВИ и других инфекционных заболеваниях, и развитием токсического шока с высоким летальным исходом может пройти менее 24 ч, что затрудняет возможность оказания своевременной специализированной помощи. До 19% переболевших имеют серьезные отдаленные последствия, включая неврологические нарушения, судороги, потерю слуха или зрения, психологические нарушения, потерю конечностей и др. [8–10].
К возбудителям бактериального менингита относится широкий круг патогенов различной этиологии. Основные возбудители – N. meningitidis, H. influenzae и S. pneumoniae, вызывающие более 90% от всех случаев заболевания менингитом после младенческого возраста [11].
Neisseria meningitidis. Хотя клиническое описание менингита как заболевания появилось в начале 1880-х гг. [12], первые данные о его возбудителе, выделенном из спинномозговой жидкости больного, были опубликованы в статье Marchiafava et al. в 1884 г. [13]. Три года спустя были описаны идентификация и культивирование этой бактерии [14]. Патогенный микроорганизм N. meningitidis, проникая через эпителиальный барьер носоглотки и достигая кровотока, вызывает сепсис, а преодолевая гематоэнцефалический барьер, вызывает токсический отек головного мозга – менингит [15, 16].
Показатель заболеваемости, вызванной менингококком, может варьировать от <1 до 1000 случаев на 100 тыс. населения в зависимости от региона, времени года, демографических данных и других факторов [17].
N. meningitidis остается одной из наиболее распространенных причин менингита во многих географических районах, включая США, и выступает единственной бактерией, способной вызывать крупные вспышки этого заболевания [18–20]. В развитых странах уровень смертности составляет 10–15%, а в развивающихся странах – до 20% [12].
На основе структуры капсульного полисахарида N. meningitidis разделяют на 13 серогрупп, пять из которых (A, B, C, W и Y) ответственны за большинство менингококковых заболеваний.
Учитывая способность менингококка быстро вызывать смертельные и эпидемические заболевания во всем мире, понимание превентивных стратегий против этого патогена – глобальный приоритет для здравоохранения.
Первые менингококковые вакцины были созданы на основе капсульных полисахаридов N. meningitidis соответствующих серогрупп, однако эти вакцины оказались эффективными только для взрослого населения. У детей до одного года иммунитет на эти вакцины не формировался. Кроме того, полисахаридные вакцины – тимус-независимые и не затрагивают механизмы клеточного иммунитета. Их действие основано на формировании специфических антител только к капсульному полисахариду данной серогруппы менингококка.
Толерантность детей раннего возраста к полисахаридным вакцинам удалось преодолеть только с конца 1990 г. после создания вакцин на основе капсульных полисахаридов, конъюгированных с различными белковыми носителями.
Преимуществом конъюгированных вакцин выступает их способность под влиянием антигена-носителя генерировать тимус-зависимый ответ и вызывать формирование иммунологической памяти, а также снижать бактерионосительство и, следовательно, предотвращать распространение инфекции. Наибольший интерес представляют 4-валентные вакцины против N. meningitidis серогрупп А, С, W и Y на основе их капсульных полисахаридов, конъюгированных с дифтерийным анатоксином, предназначенные для вакцинации людей всех возрастов, включая детей от двух месяцев [18].
Проблематичной оказалась разработка эффективной вакцины против менингококка серогруппы В на основе его капсульного полисахарида в связи с высоким сродством этого антигена с ганглиозидами эмбриональных тканей человека, что чревато возникновением аутоиммунного процесса [21]. В то же время заболеваемость менингитом, вызванным менингококком серогруппы В, в некоторых европейских странах достигает 64% [22]. В конце 2012 г. появилось сообщение о клинических испытаниях многокомпонентной вакцины 4CMenB против менингококка серогруппы В на основе белков, характерных для недавно возникшего эпидемического штамма, а также трех поверхностных белков, обнаруженных при секвенировании бактериального генома [23–25].
Вакцины против менингококка серогруппы B на основе белков наружной мембраны (OMV) применяли во многих странах (Куба, Южная Америка, Норвегия и Новая Зеландия). Вакцина MeNZB, использованная в Новой Зеландии, была эффективна в снижении показателей заболеваемости и в борьбе с эпидемией, вызванной менингококком серогруппы В [26]. Создание полноценной вакцины на основе белков наружной мембраны менингококка было затруднено из-за высокой вариабельности этих белков.
Вакцины MenB-4C (Bexsero; Novartis Vaccines, Италия) и MenB-FHbp (Trumenba; Wyeth Pharmaceuticals, США) с более широким спектром действия, чем вакцины на основе OMV, были одобрены для использования в США, причем первая также одобрена к применению в странах Европы, Канаде и Австралии [18, 23].
К настоящему моменту в практике здравоохранения имеется широкий набор вакцин против различных серогрупп менингококка. Однако эти вакцины – многокомпонентные и требуют проведения нескольких повторных инъекций, что значительно увеличивает антигенную нагрузку на организм человека, в особенности детей младших возрастов.
Haemophilus influenzae. Данный патоген – грамотрицательная факультативная аэробная палочка. На основе структуры полисахаридной капсулы выделяют 6 серотипов H. influenzae (a, b, c, d, e, f), вызывающих инвазивные формы, в 95% случаев обусловленные серотипом b.
H. influenzae типа b (Hib) – возбудитель тяжелых инфекций у детей до 5 лет – в разных странах Европы в период до вакцинации вызывал 5–46 случаев на 100 тыс. детей и до 200 случаев в странах Африки с летальностью до 40% [27]. В мире в 2000 г. эта инфекция охватила 8.1 млн детей в возрасте 0–5 лет, при этом менингит был диагностирован в 60% случаев, из которых было зарегистрировано 363 тыс. летальных исходов. В России в 2005–2007 гг., в зависимости от региона, было выявлено 5–57% случаев гнойных менингитов, обусловленных Hib, с летальностью 5–15%. До 35% переболевших детей страдают стойкими дефектами ЦНС, до 5–10% – плевропневмонией, до 80% – эпиглоттитом [28].
Первая вакцина против Hib на основе капсульного полисахарида была лицензирована в США в 1985 г., но оказалась неэффективной для детей до 18 месяцев.
Капсульные полисахариды Hib, конъюгированные со столбнячным анатоксином, нетоксичным вариантом дифтерийного токсина, белком внешней мембраны N. meningitidis серогруппы В, – основа комбинированных препаратов Пентаксим (Санофи Пастер, Франция) и Инфанрикс-Гекса (Глаксо Смит Кляйн, Бельгия) [29]. Вакцинация этими препаратами приводит к снижению заболеваемости тяжелой пневмонией на 20–25%. Однако у 18% вакцинированных наблюдались различные осложнения, а у 33% отмечались низкие уровни защитных антител.
С 2013 г. конъюгированные вакцины стали применять в 184 странах мира. Несмотря на это, в мире ежегодно регистрировалось до 199 тыс. летальных исходов, что поставило Hib на третье место по летальности после пневмококковой и ротавирусной инфекций [29, 30].
В настоящее время в реестре ВОЗ зарегистрированы три вакцины на основе капсульного полисахарида Hib, конъюгированного со столбнячным анатоксином: вакцина гемофильная тип В (ФБУН “Ростовский научно-исследовательский институт микробиологии и паразитологии”, Россия), Акт-Хиб (Санофи Пастер, Франция) и Хиберикс (Глаксо Смит Кляйн, Бельгия) [29]. Эффективность этих вакцин составляет 95–100%, а защитный титр антител сохраняется не менее 4 лет.
Streptococcus pneumoniae. Заболевания, вызываемые у человека этим возбудителем – самые частые во всем мире: ежегодно умирает более 1 млн человек, из которых больше половины – дети до 5 лет. В отсутствие вакцинации в России фиксируют 300–700 случаев заболевания на 100 тыс. населения, что согласуется с результатами зарубежных исследований [31–33]. Особой тяжестью отличается пневмококковый менингит [28].
В настоящее время для профилактики пневмококковой инфекции применяют как полисахаридные вакцины Пневмо 23 (Санофи Пастер, Франция) и Пневмовакс 23 (Мерк, Шарп и Доум, США), представляющие собой смесь очищенных капсульных полисахаридов 23 наиболее часто встречающихся серотипов пневмококка, так и вакцины на основе капсульных полисахаридов, конъюгированных с белком-носителем: Превенар 13 (Пфайзер, США) и Синфлорикс-10 (Глаксо Смит-Кляйн, Бельгия).
Применение этих вакцин в значительной степени ограничено из-за изменчивости серотипа и геномной пластичности, выступающими характерными чертами этой бактерии, а все возрастающая частота лекарственной устойчивости штаммов подчеркивает важность разработки противопневмококковых вакцин нового поколения, охватывающих многие серотипы [7, 18].
Несмотря на появление новых антибиотиков и вакцин, пневмококки продолжают вызывать по всему миру заболевания детей раннего возраста, пожилых людей и людей с ослабленным иммунитетом. Высокая заболеваемость и смертность от этой инфекции в последние десятилетия привели к необходимости разработки новых вакцин. Таким образом, замена всего огромного арсенала противобактериальных вакцин на одну монокомпонентную представляется целесообразным.
СТРУКТУРА И ФУНКЦИИ СЕРИНОВЫХ IgA1-ПРОТЕАЗ
В настоящее время достигнут значительный прогресс в изучении структуры и функций белков бактерий N. meningitidis. В обзоре Tommassen et al. [34] описаны системы транслокации, механизмы секреции и функции ряда белков N. meningitidis, в том числе IgA1-протеазы, классического аутотранспортера грамотрицательных бактерий.
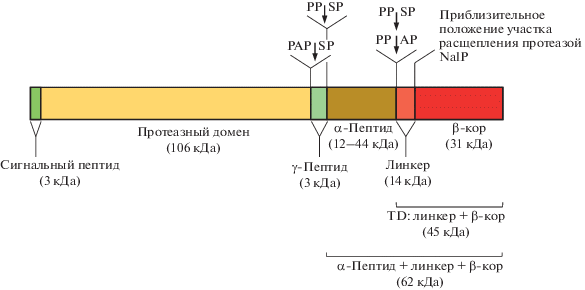
Аутотранспортеры содержат три основных участка: сигнальный пептид, транспортируемый домен и транслокаторный домен (TD) [6, 35, 36] (рис. 1). Транспортируемый домен IgA1-протеазы расположен между сигнальным пептидом и транслокаторным доменом и состоит из двух субдоменов: N-концевого протеазного домена и α-пептида, связанных между собой небольшим γ‑пептидом. Транслокаторный домен расположен в C-концевом участке IgA1-протеазы и содержит линкерный пептид и β-кор. N‑Концевой сигнальный пептид принимает участие в транспорте белка через цитоплазматическую мембрану. TD формирует во внешней мембране канал, через который транспортируемый домен переносится во внеклеточное пространство. На внешней мембране бактерии IgA1-протеаза подвергается аутокаталитическому расщеплению в сайтах (PAPSP, PPSP или PPAP), расположенных между протеазным доменом и γ-пептидом, между γ-пептидом и α-пептидом и между α-пептидом и линкерным пептидом. Наличие последнего участка процессинга зависит от штамма [6]. В некоторых случаях весь транспортируемый домен, включая линкерный пептид, может высвобождаться после расщепления аутотранспортерной протеазой NalP (рис. 1) [6, 37].
Рис. 1.
Доменная структура IgA1-протеазы H. influenzae [6]. Представлено схематическое строение полноразмерной IgA1-протеазы с положениями участков аутокаталитического процессинга и их последовательностями, а также с положением участка расщепления протеазой NalP.
IgA1-протеаза расщепляет иммуноглобулин A1 человека в сайте TPPTPSPS, который гомологичен сайтам аутокаталитического процессинга и находится в шарнирной области между доменами Fab и Fc [38]. IgA1-протеаза не расщепляет иммуноглобулин IgA2, в котором отсутствует такой сайт расщепления (рис. 2) [39, 40]. Расщепление IgA1 может ингибировать IgA-опосредованную агглютинацию и последующий механический клиренс бактерий в носоглотке. Также было показано, что IgA1-протеаза расщепляет ассоциированный с лизосомами мембранный белок LAMP1 [41], который, как сообщалось ранее, способствует выживанию бактерий в эпителиальных клетках [42], и трансцитозу через поляризованный эпителий [43]. Кроме того, IgA1-протеаза расщепляет везикулярный мембранный белок синаптобревин II в хром-аффинных клетках [44] и хорионический гонадотропный гормон человека [45], но физиологические последствия такого расщепления не ясны. Все эти альтернативные субстраты содержат мишень, гомологичную сайтам аутокаталитического расщепления.
Идентификация бактериальных IgA1-протеаз, их протеазная активность, специфичность и структура подробно описаны в обзоре Nicole et al. [36]. IgA1-протеазы H. influenzae, N. meningitidis и N. gonorrhoeae обладают значительной гомологией, имеют структуры, характерные для аутотранспортеров, и подвергаются аутопротеолитическому расщеплению, что приводит к высвобождению транспортируемого домена из встроенного в мембрану β-цилиндрического домена [35, 46–48]. IgA1-протеазы большинства штаммов H. influenzae, N. meningitidis и N. gonorrhoeae способны расщеплять сывороточный IgA1 и в меньшей степени – димерную секреторную форму IgA1. В работе Kilian et al. [49] была исследована эффективность расщепления иммуноглобулинов внеклеточными штаммами Haemophilus и S. pneumoniae и показано, что H. influenzae и S. pneumoniae вырабатывают фермент, селективно расщепляющий белки миеломы IgA1 человека, но не активный в отношении ряда других белков, включая IgA2, IgG и IgM человека, секреторный белок свиней и крупного рогатого скота. Ни один из непатогенных штаммов Haemophilus не продуцировал протеазу IgA1. Следовательно, продукция IgA1-протеазы – важный фактор в патогенезе этого заболевания.
Как отражение структуры клональной популяции инкапсулированных изолятов H. influenzae, типируемые штаммы характеризуются IgA1-протеазами с аналогичной расщепляющей способностью. Напротив, нетипируемые IgA1-протеазы H. influenzae (NTHi) характеризуются высокой вариабельностью в отношении антигенности, предположительно из-за горизонтального переноса гена и рекомбинации между несколькими колонизирующими штаммами, чтобы уклоняться от защиты иммунной системой [50, 51]. Эта вариабельность приводит к изменению протеолитической активности от штамма к штамму для изолятов NTHi от больных пациентов с более высоким уровнем активности по сравнению с колонизирующими изолятами NTHi [52].
В работе Nicole et al. [36] показано, что IgA1-протеазы, аутотранспортеры Hap, Hia и Hsf H. influenzae – факторы вирулентности, способствующие колонизации и выживаемости бактерий в организме человека. Адгезия к респираторному эпителию, формирование микроколоний, приводящее к образованию биопленки, и протеазная активность, способствующая распространению бактерий и уклонению от иммунитета – важные патогенные механизмы, которые опосредуются этими белками. Описаны механизмы, с помощью которых эти факторы вирулентности могут действовать совместно для ускорения инфицирования бактериями H. influenzae.
Hia-опосредуемая адгезия к эпителиальным клеткам и Hap-опосредованная адгезия как к эпителиальным клеткам, так и к внеклеточному матриксу (ECM) могут быть ответственны за первоначальный контакт с организмом хозяина, в то время как IgA1-протеаза расщепляет IgA1, защищая бактерии от врожденного иммунного ответа. По мере прогрессирования инфекции взаимодействия белков Hap–Hap приводят к формированию микроколоний и могут в конечном итоге привести к формированию биопленки, что представляет собой еще один механизм уклонения от иммунитета. За счет аутопротеолитической активности Hap некоторые бактерии могут высвобождаться из биопленки для колонизации на другом участке. Наконец, бактериальная инвазия, опосредованная Hap, может привести к формированию внутриклеточного бактериального резервуара, который может быть ответственным за рецидивирующие инфекции, наблюдаемые при хронической обструктивной болезни легких и отите. Дальнейшее изучение этих белков может способствовать более подробной оценке развития заболевания, вызванного бактериями H. influenzae, и ускорить разработку новых противомикробных препаратов [36].
Были исследованы трехмерные структуры указанных выше белков H. influenzae [53, 54]. В кристаллической структуре транспортируемого домена в качестве основных структурных компонентов были выявлены N-концевой трипсино/химотрипсиноподобный протеазный домен и β-спиральный остов. На рис. 3 представлена трехмерная структура IgA1-протеазы по сравнению со структурой транспортируемого домена белка Hap.
Рис. 3.
Пространственные структуры транспортируемых доменов IgA1-протеазы и Hap [40]: (а) – кристаллическая структура транспортируемого домена IgA1-протеазы с N-концевым глобулярным протеазным доменом (обозначен домен 2 – D2); (б) – кристаллическая структура транспортируемого домена Hap с N-концевым глобулярным протеазным доменом (обозначен С-концевой β-спиральный самоассоциирующийся домен SAAT).
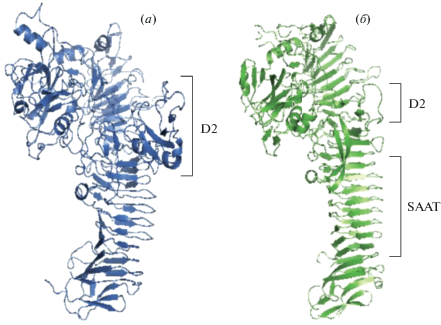
β-Спиральный остов содержит ядро из гидрофобных остатков и остатков серина, треонина и аспарагина, расположенных на поверхности цепи и сложенных в складчатую структуру. Он служит для удаления N-концевого домена из бактериальной мембраны. N-Концевой домен характеризуется глобулярной структурой с уникальными петлями в области укладки химотрипсинового домена, имеющими значение для выбора субстрата [54], и содержит каталитическую триаду, отвечающую за активность протеазы [53]. Активный центр протеазного домена – идеален для остатков пролина, которые, как правило, обнаруживаются в специфических сайтах расщепления белков IgA1-протеазой. Следует отметить, что небольшой домен 2 формирует уникальную петлю, выступающую из стержня β-спирали, придавая белку Y-образную структуру. Расчетные исследования кристаллических структур IgA1 человека и IgA1-протеазы показали, что Fc-домен IgA1 связывается в углублении, образованном доменом 2 и протеазным доменом, что свидетельствует об участии этого небольшого фрагмента в распознавании субстрата [36, 54]. Уникальная петля расположена над активным центром фермента и выполняет роль крышки, закрытой в отсутствие иммуноглобулина. После связывания Fc-домена IgA1 в углублении, образованном между N-концевым доменом протеазы и доменом 2, присоединенным к β-спиральной цепи, крышка стабилизируется в открытой конформации. Это взаимодействие обеспечивает доступ шарнирного пептида к активному центру, что приводит к распознаванию и расщеплению субстрата. Таким образом обеспечивается протеолитическая специфичность фермента.
IgA1-ПРОТЕАЗА И ЕЕ ФРАГМЕНТЫ КАК ОСНОВА ДЛЯ СОЗДАНИЯ ТЕРАПЕВТИЧЕСКИХ И ПРОФИЛАКТИЧЕСКИХ СРЕДСТВ
В работе Wang et al. [55] была сконструирована и получена высокоактивная рекомбинантная IgA1-протеаза из H. influenzae 49247, способная расщеплять in vitro гликозилированный IgA1-cодержащий иммунный комплекс, с целью возможного использования фермента в качестве терапевтического средства для лечения IgA-нефропатии. Тяжесть нарушений почечной функции, таких как протеинурия и гематурия, также может быть снижена с помощью инъекций IgA1-протеазы [56].
В 2007 г. Vitovski et al. [57] получили ряд белков-предшественников IgA1-протеазы менингококка. Были подробно изучены механизмы аутокаталитической активации этого фермента, но иммуногенные и протективные свойства полученных белков не были исследованы, и возможность их использования в качестве вакцины также не рассматривалась.
В работе Wani et al. [58] была впервые показана активность рекомбинантных форм IgA1-протеазы пневмококка и выявлены специфические ингибиторы, препятствующие колонизации слизистой оболочки пневмококком, а неактивный мутант рассматривался как компонент кандидатной вакцины.
В работе Romanello et al. [59] было показано, что IgA1-протеаза пневмококков связана с поверхностью бактериальной клетки с помощью N-концевого мембранного якоря. Описаны клонирование, экспрессия, ферментативная активность и иммуногенность трех фрагментов IgA1-протеазы, из которых один включает только аминокислоты N-концевого участка. Все полученные мутанты были полностью лишены ферментативной активности. Антигенные свойства рекомбинантных полипептидов авторы тестировали с сыворотками пациентов с диагнозом пневмония различной этиологии. В сыворотках пяти пациентов из девяти были обнаружены антитела к фрагменту IgA1-протеазы (1032–1964 а.о.), у семи пациентов – к фрагменту IgA1-протеазы (708–1964 а.о.). Полноразмерная IgA1-протеаза выявляла антитела во всех сыворотках, указывая на то, что IgA1-протеаза – основной антиген S. pneumoniae в патогенезе у человека. Эти фрагменты, так же как и IgA1-протеаза – поверхностные белки, присутствующие практически во всех серотипах пневмококка. Авторы заключили, что эти рекомбинантные белки могут быть кандидатами для создания противопневмококковой вакцины.
Описан синтез N-концевых фрагментов IgA1-протеазы из N. meningitidis серогруппы А, содержащих 40–104 а.о. [60], которые были использованы в качестве пептидов-носителей углеводных компонентов клеточных стенок различных микроорганизмов: Neisseria, Streptococcus, Klebsiella, Salmonella, Shigella и Haemophilus. Но конъюгация этих фрагментов с полисахаридом менингококка серогруппы С не позволила получить поливалентные композиции. Они обеспечивали защиту только от менингококка серогруппы С.
Для лечения аутоиммунных и других заболеваний, связанных с накоплением IgA1 в тканях и органах человека, методом рекомбинантных ДНК были получены растворимые формы IgA1-протеазы [61, 62]. Авторы использовали их в качестве терапевтических препаратов, но в качестве вакцины не рассматривали.
В статье Gupta et al. [63] описаны результаты компьютерного анализа потенциальных Т-клеточных эпитопов трех белков менингококка серогруппы В: белка А, стимулирующего Т-клетки (TspA), аутотранспортного белка А (AutA) и IgA1-протеазы. В результате исследования были выявлены шесть девятичленных Т-клеточных эпитопов. Авторы предположили, что эти пептиды могут быть использованы в качестве перспективных агентов для защиты от менингококков серогруппы В, но экспериментальные данные, подтверждающие эту гипотезу, в работе не приведены, и возможность получения поливалентной вакцины на их основе также не обсуждалась.
В дальнейшем многими авторами высказывалось предположение, что IgA1-протеаза – важнейший фактор вирулентности бактерий, может быть использована как средство защиты от этих патогенов [17, 63].
Экспериментальное подтверждение протективной активности IgA1-протеазы представлено небольшим количеством работ. В серии работ [64–74] в опытах на животных было показано, что нативная IgA1-протеаза, выделенная из живой вирулентной культуры N. meningitidis серогруппы А, а также рекомбинантные IgA1-протеазы N. meningitidis серогруппы В в активной или мутантной формах и некоторые укороченные аналоги этих белков обладают высокой иммуногенной и протективной активностью.
На примере отдельных низкомолекулярных фрагментов IgA1-протеазы показана важная роль В- и Т-эпитопов, расположенных в N-концевом участке IgA1-протеазы N. meningitidis серогруппы В (штамм Н44/76), для сохранения иммуногенных и протективных свойств [64, 65]. Эти белки защищали мышей от заражения живой вирулентной культурой менингококков основных эпидемических серогрупп (А, В и С) и обладали характерной для белков способностью к формированию иммунологической памяти [68, 69, 73].
В опытах острого заражения животных показана роль клеточного и гуморального факторов в формировании иммунитета к менингококку серогруппы В. Защиту иммунизированных животных обеспечивали как иммунные лимфоциты, так и специфические антитела, способные in vitro связываться с IgA1-протеазой N. meningitidis [69].
Было также показано, что специфические антитела, образующиеся при иммунизации животных аналогами IgA1-протеазы или при инфицировании менингококком, способны связываться не только с секретируемым ферментом, но и с поверхностью микробных клеток [66].
Анализ популяционного состава лимфоцитов (CD4+, CD8+ и CD19+) в крови и селезенке иммунизированных животных на момент заражения менингококками показал, что механизм защиты обусловлен различными популяциями лимфоцитов в зависимости от структуры иммуногенов [69].
Аналогичные результаты были получены при изучении стрептококковых IgA1-металлопротеаз для защиты животных от заболеваний, вызываемых пневмококками и S. suis серотипа 2. Авторы рассматривают этот белок и его фрагменты в качестве протективного поверхностного антигена IgA1-протеазы [5, 75].
Группа авторов [75–78] исследовала антигенный состав и сходство IgA1-протеаз различных представителей микробов серинового типа и металлопротеаз, патогенность которых обусловлена IgА1-протеазой. Обнаружено высокое сходство эпитопов IgA1-протеаз N. meningitidis и N. gonorrhoeae, что делает их привлекательными компонентами потенциальной вакцины широкого профиля. Незначительным оказалось сходство указанных эпитопов с IgA1-металлопротеазами S. pneumoniae [77].
Позднее Kotelnikova et al. [68] установили, что иммунизация животных IgA1-протеазой N. meningitidis и ее аналогами способна обеспечивать формирование иммунологической памяти и защиту от смертельного заражения не только менингококковой, но и пневмококковой инфекциями. Напротив, сыворотки кроликов, иммунизированных убитой культурой S. pneumoniae, содержали высокие титры протективных антител к IgA1-протеазе N. meningitidis и ее фрагментам.
Эти результаты представляют особый интерес, поскольку IgA1-протеаза S. pneumoniae относится к классу металлопротеаз и существенно отличается по аминокислотной последовательности от сериновых IgA1-протеаз, секретируемых N. meningitidis, N. gonorrhoeae и H. influenzae. Протективная активность менингококковой IgA1-протеазы и ее аналогов при инфицировании животных S. pneumoniae может зависеть от наличия у этих белков конформационных эпитопов, близких по структуре к эпитопам поверхностных белков пневмококков. Кроме того, секретируемые протеазы могут иметь несколько мишеней и, таким образом, разными способами вмешиваться в метаболизм и иммунный ответ хозяина [34, 79, 80].
ЗАКЛЮЧЕНИЕ
Анализ литературных данных показал, что разработка вакцин против бактериальных менингитов на основе поверхностных антигенов микроорганизмов, вызывающих эти заболевания, привела к созданию целого ряда эффективных препаратов строго направленного действия против конкретного возбудителя. Поиски новых вакцинных антигенов стимулировали исследования не только поверхностных, но и секретируемых белков. Интересным направлением стало изучение IgA1-протеазы как одного из основных факторов вирулентности, способствующих колонизации и выживаемости микрооганизмов в организме человека. Нейтрализация IgA1-протеазы на этой стадии инвазии может стать препятствием для развития инфекций, патогенность которых обусловлена этим ферментом. IgA1-протеаза способствует взаимодействию патогена с хозяином (адгезия к клеткам организма-хозяина, уклонение от формирования приобретенного иммунитета, предотвращение активации комплемента, нейтрализация антимикробных пептидов, деградация иммуноглобулинов и т.д.).
Представленные данные о свойствах IgA1-протеаз ряда патогенных микроорганизмов показали, что высокая иммуногенная и протективная активность рекомбинантных вариантов фермента и некоторых его фрагментов в отношении грамотрицательных (N. meningitidis, N. gonorrheoeae, H. influenzae) и некоторых грамположительных (S. pneumoniae, S. suis) бактерий, в совокупности с высокой гомологией консервативных участков первичной структуры полноразмерных IgA1-протеаз, позволяют говорить о возможности формирования перекрестного иммунитета к различным возбудителям, патогенность которых обусловлена IgA1-протеазой. Приведенные исследования свидетельствуют о возможности и целесообразности создания монокомпонентной вакцины широкого спектра действия против ряда бактериальных инфекций.
Список литературы
Henderson I.R., Nataro J.P. // Infect. Immun. 2001. V. 69. P. 1231–1243. https://doi.org/10.1128/IAI.69.3.1231-1243.2001
Казеева Т.Н., Шевелев А.Б. // Биохимия. 2007. Т. 72. С. 485–494. https://doi.org/10.1134/s0006297907050045
Mistry D., Stockley R.A. // Int. J. Biochem. Cell Biol. 2006. V. 38. P. 1244–1248. https://doi.org/10.1016/j.biocel.2005.10.005
Plaut A.G., Bachovchin W.W. // Methods Enzymol. 1994. V. 244. P. 137–151. https://doi.org/10.1016/0076-6879(94)44012-3
Lei F., Zhao J., Lin L., Zhang Q., Xu Z., Han L., Xie C., Zhou R., Jin M., Zhang A. // Microbes Infect. 2016. V. 18. P. 285–289. https://doi.org/10.1016/j.micinf.2015.12.005
Roussel-Jazédé V., Arenas J., Langereis J.D., Tommassen J., van Ulsen P. // Microbiology. 2014. V. 160. P. 2421–2431. https://doi.org/10.1099/mic.0.082511-0
Kilian M., Thomsen B., Petersen T.E., Bleeg H. // Mol. Immunol. 1983. V. 20. P. 1051–1058. https://doi.org/10.1016/0161-5890(83)90046-9
Meningococcal vaccines: WHO position paper, November 2011 // Wkly Epidemiol. Rec. 2011. V. 86. P. 521–539.
Erickson L.J., De Wals P., McMahon J., Heim S. // Clin. Infect. Dis. 2001. V. 33. P. 737–739. https://doi.org/10.1086/322587
Edwards M.S., Baker C.J. // J. Pediatr. 1981. V. 99. P. 540–545. https://doi.org/10.1016/s0022-3476(81)80250-8
Agrawal S., Nadel S. // Pediatr. Drugs. 2011. V. 13. P. 385–400. https://doi.org/10.2165/11593340-000000000-00000
Stephens D.S., Apicella M.A. // In: Mandell, Douglas, and Bennett’s principles and practice of infectious diseases / Eds. Bennett J.E., Dolin R., Blaser M.J. Philadelphia: Elsevier Saunders, 2015. P. 2425–2445.
Marchiafava E., Celli A. // Gazz. degli Ospedali. 1884. V. 5. P. 59.
Weichselbaum A. // Fortschr. Med. 1887. V. 5. P. 573–583.
Pace D., Pollard A.J. // Vaccine. 2012. V. 30. P. B3–B9. https://doi.org/10.1016/j.vaccine.2011.12.062
Takada S., Fujiwara S., Inoue T., Kataoka Yu., Hadano Y., Matsumoto K., Morino K., Shimizu T. // Intern. Med. 2016. V. 55. P. 567–572. https://doi.org/10.2169/internalmedicine.55.3272
Rouphael N.G., Stephens D.S. // Methods Mol. Biol. 2012. V. 799. P. 1–20. https://doi.org/10.1007/978-1-61779-346-2_1
Crum-Cianflone N., Sullivan E. // Infect. Dis. Ther. 2016. V. 5. P. 89–112. https://doi.org/10.1007/s40121-016-0107-0
Girard M.P., Preziosi M.P., Aguado M.T., Kieny M.P. // Vaccine. 2006. V. 24. P. 4692–4700. https://doi.org/10.1016/j.vaccine.2006.03.034
Thigpen M.C., Whitney C.G., Messonnier N.E., Zell E.R., Lynfield R., Hadler J.L., Harrison L.H., Farley M.M., Reingold A., Bennett N.M., Craig A.S., Schaffner W., Thomas A., Lewis M.M., Scallan E., Schuchat A., Emerging Infections Programs Network // N. Engl. J. Med. 2011. V. 364. P. 2016–2025. https://doi.org/10.1056/nejmoa1005384
Caron F., du Châtelet I.P., Leroy J.P., Ruckly C., Blanchard M., Bohic N., Massy N., Morer I., Floret D., Delbos V., Hong E., Révillion M., Berthelot G., Lemée L., Deghmane A.E., Bénichou J., Lévy-Bruhl D., Taha M.K. // Lancet Infect. Dis. 2011. V. 11. P. 455–463. https://doi.org/10.1016/s1473-3099(11)70027-5
Королева И.С., Белошицкий Г.В., Закроева И.М., Королева М.А. // Инфекция и иммунитет. 2012. Т. 2. С. 546–547.
Gossger N., Snape M.D., Yu L.M., Finn A., Bona G., Esposito S., Principi N., Diez-Domingo J., Sokal E., Becker B., Kieninger D., Prymula R., Dull P., Ypma E., Toneatto D., Kimura A., Pollard A.J., European MenB Vaccine Study Group // JAMA. 2012. V. 307. P. 573–582. https://doi.org/10.1001/jama.2012.85
Granoff D.M. // Clin. Infect. Dis. 2010. V. 50. P. S54–S65. https://doi.org/10.1086/648966
Holst J., Oster P., Arnold R., Tatley M.V., Næss L.M., Aaberge I.S., Galloway Y., McNicholas A., O’Hallahan J., Rosenqvist E., Black S. // Hum. Vaccin. Immunother. 2013. V. 9. P. 1241–1253. https://doi.org/10.4161/hv.24129
Folaranmi T., Rubin L., Martin S.W., Patel M., MacNeil J.R., Centers for Disease Control (CDC) // MMWR Morb. Mortal. Wkly Rep. 2015. V. 64. P. 608–612.
Haemophilus influenzae type b immunization // Bulletins du Centre International de L’enfance. 1992. P. 33–34.
Платонов А.Е., Харит С.М., Платонова О.В. // Эпидемиология и вакцинопрофилактика. 2009. № 5. С. 32–46.
Озерецковский Н.А., Немировская Т.И. // Эпидемиология и вакцинопрофилактика. 2016. V. 15. P. 61–66. https://doi.org/10.31631/2073-3046-2016-15-1-61-66
Haemophilus influenzae type b (Hib). Green Book. Immunizaition against infections disease // 2013. Part 2. Ch. 16. P. 127–143. https://www.gov.uk/government/publications/haemophilus-influenzae-type-hib-the-green-book-chapter-16
Козлов Р.С. // Пневмококки: прошлое, настоящее и будущее. Смоленск: Смоленская государственная медицинская академия, 2005. 128 с.
Таточенко В.А. // Вопр. совр. педиатрии. 2007. T. 6. С. 85–91.
Clark J.E., Hammal D., Hampton F., Spencer D., Parker L. // Epidemiol. Infect. 2007. V. 135. P. 262–269. https://doi.org/10.1017/s0950268806006741
Tommassen J., Arenas J. // Front. Cell. Infect. Microbiol. 2017. V. 7. P. 256. https://doi.org/10.3389/fcimb.2017.00256
Pohlner J., Halter R., Beyreuther K., Meyer T.F. // Nature. 1987. V. 325. P. 458–462. https://doi.org/10.1038/325458a0
Spahich N.A., Geme J.W.St., 3rd // Front. Cell. Infect. Microbiol. 2011. V. 1. P. 1–9. https://dx.doi.org/10.3389%2Ffcimb.2011.00005
van Ulsen P., van Alphen L., ten Hove J., Fransen F., van der Ley P., Tommassen J. // Mol. Microbiol. 2003. V. 50. P. 1017–1030. https://doi.org/10.1046/j.1365-2958.2003.03773.x
Plaut A.G., Gilbert J.V., Artenstein M.S., Capra J.D. // Science. 1975. V. 190. P. 1103–1105. https://doi.org/10.1126/science.810892
Boehm M.K., Woof J.M., Kerr M.A., Perkins S.J. // J. Mol. Biol. 1999. V. 286. P. 1421–1447. https://doi.org/10.1006/jmbi.1998.2556
Torano A., Putnam F.W. // Proc. Natl. Acad. Sci. USA. 1978. V. 75. P. 966–969. https://doi.org/10.1073/pnas.75.2.966
Hauck C.R., Meyer T.F. // FEBS Lett. 1997. V. 405. P. 86–90. https://doi.org/10.1016/s0014-5793(97)00163-4
Lin L., Ayala P., Larson J., Mulks M., Fukuda M., Carlsson S.R., Enns C., So M. // Mol. Microbiol. 1997. V. 24. P. 1083–1094. https://doi.org/10.1046/j.1365-2958.1997.4191776.x
Hopper S., Vasquez B., Merz A., Clary S., Wilbur J.S., So M. // Infect. Immun. 2000. V. 68. P. 906–911. https://doi.org/10.1128/iai.68.2.906-911.2000
Binscheck T., Bartels F., Bergel H., Bigalke H., Yamasaki S., Hayashi T., Niemann H., Pohlner J. // J. Biol. Chem. 1995. V. 270. P. 1770–1774. https://doi.org/10.1074/jbc.270.4.1770
Senior B.W., Stewart W.W., Galloway C., Kerr M.A. // J. Infect. Dis. 2001. V. 184. P. 922–925. https://doi.org/10.1086/323397
Grundy F.J., Plaut A.G., Wright A. // Adv. Exp. Med. Biol. 1987. V. 216B. P. 1251–1260.
Poulsen K., Brandt J., Hjorth J.P., Thogersen H.C., Kilian M. // Infect. Immun. 1989. V. 57. P. 3097–3105. https://doi.org/10.1128/iai.57.10.3097-3105.1989
Plaut A.G., Qiu J., Geme J.W.St., 3rd // Vaccine. 2000. V. 19 (Suppl. 1). P. S148–S152. https://doi.org/10.1016/s0264-410x(00)00296-6
Kilian M., Mestecky J., Schrohenloher R.E. // Infect. Immun. 1979. V. 26. P. 143–149. https://doi.org/10.1128/iai.26.1.143-149.1979
Musser J.M., Barenkamp S.J., Granoff D.M., Selan-der R.K. // Infect. Immun. 1986. V. 52. P. 183–191. https://doi.org/10.1128/iai.52.1.183-191.1986
Lomholt H., van Alphen L., Kilian M. // Infect. Immun. 1993. V. 61. P. 4575–4581. https://doi.org/10.1128/iai.61.11.4575-4581.1993
Vitovski S., Dunkin K.T., Howard A.J., Sayers J.R. // JAMA. 2002. V. 287. P. 1699–1705. https://doi.org/10.1001/jama.287.13.1699
Perona J.J., Craik C.S. // Protein Sci. 1995. V. 4. P. 337–360. https://doi.org/10.1002/pro.5560040301
Johnson T.A., Qiu J., Plaut A.G., Holyoak T. // J. Mol. Biol. 2009. V. 389. P. 559–574. https://doi.org/10.1016/j.jmb.2009.04.041
Wang H., Zhong X., Li J., Zhu M., Wang L., Ji X., Fan J., Wang L. // Mol. Biotechnol. 2018. V. 60. P. 134–140. https://doi.org/10.1007/s12033-017-0054-3
Lechner S.M., Abbad L., Boedec E., Papista C., Le Stang M.B., Moal C., Maillard J., Jamin A., Bex-Coudrat J., Wang Y., Li A., Martini P.G., Monteiro R.C., Berthelot L. // J. Am. Soc. Nephrol. 2016. V. 27. P. 2622–2629. https://doi.org/10.1681/asn.2015080856
Vitovski S., Sayers J.R. // Infect. Immun. 2007. V. 75. P. 2875–2885. https://doi.org/10.1128/iai.01671-06
Wani J.H., Gilbert J.V., Plaut A.G., Weiser J.N. // Infect. Immun. 1996. V. 64. P. 3967–3974. https://doi.org/10.1128/iai.64.10.3967-3974.1996
Romanello V., Marcacci M., Moschioni M., Censini S., Covacci A., Baritussio A.G., Montecucco C., Tonello F. // Protein Expr. Purif. 2006. V. 45. P. 142–149. https://doi.org/10.1016/j.pep.2005.07.015
Achtman M., Moreau M. // Patent US 7235242 B2, 26.06.2007.
Long S., Phan E., Vellard M.C. // J. Biomed. Biotechnol. 2010. V. 2010. P. 1–9. https://doi.org/10.1155/2010/253983
Plaut A.G, Qiu J. // Patent US 7407653 B2, 05.08.2008.
Gupta S.K., Smita S., Sarangi A.N., Srivastava M., Akhoond B.A., Rahman Q., Gupta S.K. // Vaccine. 2010. V. 28. P. 7092–7097. https://doi.org/10.1016/j.vaccine.2010.08.005
Zinchenko A.A., Alliluev A.P., Serova O.P., Gordeeva E.A., Zhigis L.S., Zueva V.S., Razgulyaeva O.A., Melikhova T.D., Nokel E.A., Drozhzhina E.Yu., Kotelnikova O.V., Rumsh L.D. // J. Meningitis. 2015. V. 1. P. 1–5. https://doi.org/10.4172/2572-2050.1000102
Зинченко А.А., Котельникова О.В., Гордеева Е.А., Прокопенко Ю.А., Разгуляева О.А., Серова О.В., Мелихова Т.Д., Нокель Е.А., Жигис Л.С., Зуева В.С., Аллилуев А.П., Румш Л.Д. // Биоорг. химия. 2018. Т. 44. С. 61–70. [Zinchenko A.A., Kotelnikova O.V., Gordeeva E.A., Prokopenko Yu.A., Razgulyaeva O.A., Serova O.V., Melikhova T.D., Nokel E.A., Zhigis L.S., Zueva V.S., Alliluev A.P., Rumsh L.D. // Russ. J. Bioorg. Chem. 2018. V. 44. P. 64–72. https://doi.org/10.1134/S1068162018010193]
Kotelnikova O.V., Zinchenko A.A., Vikhrov A.A., Alliluev A.P., Serova O.V., Gordeeva E.A., Zhigis L.S., Zueva V.S., Razgulyaeva O.A., Melikhova T.D., Nokel E.A., Drozhzhina E.Y., Rumsh L.D. // Bull. Exp. Biol. Med. 2016. V. 161. P. 391–394. https://doi.org/10.1007/s10517-016-3422-2
Серова О.В., Мельников Э.Э., Зинченко А.А., Котельникова О.В., Аллилуев А.П., Бичучер А.М., Гордее-ва Е.А., Жигис Л.С., Зуева В.С., Козлов Л.В., Мелихова Т.Д., Нокель Е.А., Ягудаева Е.Ю., Румш Л.Д. // Биофарм. журнал. 2011. Т. 3. С. 42–47.
Kotelnikova O.V., Alliluev A.P., Zinchenko A.A., Zhigisa L., Prokopenko Y., Nokel E.A., Razgulyaeva O.A., Zueva V.S., Tokarskaya M., Yastrebova N., Gordeeva E.A., Melikhova T.D., Kaliberda E.N., Rumsh L.D. // Microbes Infect. 2019. V. 21. P. 336–340. https://doi.org/10.1016/j.micinf.2019.02.003
Kotel’nikova O.V., Alliluev A.P., Zinchenko A.A, Prokopen-ko Yu.A., Zhigis L.S., Zueva V.S., Razgulyaeva O.A., Gordeeva E.A., Melikhova T.D., Nokel’ E.A., Rumsh L.D. // Bull. Exp. Biol. Med. 2018. V. 165. P. 763–766. https://doi.org/10.1007/s10517-018-4260-1
Котельникова О.В., Аллилуев А.П., Дрожжина Е.Ю., Королева И.С., Ситникова Е.А., Зинченко А.А., Гордеева Е.А., Мелихова Т.Д., Нокель Е.А., Жигис Л.С., Зуева В.С., Разгуляева О.А., Серова О.В., Ягудае-ва Е.Ю., Румш Л.Д. // Биомед. хим. 2014. Т. 60. С. 479–486. https://doi.org/10.18097/pbmc20146004479
Румш Л.Д., Мельников Э. Э., Аллилуев А.П., Козлов Л.В., Котельникова О.В., Жигис Л.С., Серова О.В., Ягудае-ва Е.Ю., Бичучер А.М., Зубов В. П., Анохина И. В., Зуева В.С., Аваков А.Э. // Патент RU 2453599 C1, 20.06.2012.
Румш Л.Д., Серова О.В., Зинченко А.А., Аллилуев А.П., Козлов Л.В., Котельникова О.В., Жигис Л.С., Ягудаева Е.Ю., Андинина С.С., Анохина И.В., Зуева В.С., Гордеева Е.А., Мелихова Т.Д., Нокель Е.А. // Патент RU 2486243 C1, 27.06.2013.
Зинченко А.А., Серова О.В., Прокопенко Ю.А., Гордеева Е.А., Мелихова Т.Д., Нокель Е.А., Калиберда Е.Н., Котельникова О.В., Жигис Л.С., Разгуляева О.А., Аллилуев А.П., Румш Л.Д. // Патент RU 2701964 C2, 02.10.2019.
Zhigis L.S., Kotel’nikova O.V., Vikhrov A.A., Zinchenko A.A., Serova O.V., Zueva V.S., Razgulyaeva O.A., Gordeeva E.A., Melikhova T.D., Nokel E.A., Alliluev A.P., Drozhzhina E.Yu., Rumsh L.D. // Biotechnol. Lett. 2015. V. 37. P. 2289–2293. https://doi.org/10.1007/s10529-015-1916-z
Janoff E.N., Rubins J.B., Fasching C., Charboneau D., Rahkola J.T., Plaut A.G., Weiser J.N. // Mucosal Immunol. 2014. V. 7. P. 249–256. https://doi.org/10.1038/mi.2013.41
Lomholt H., Kilian M. // Infect. Immun. 1994. V. 62. P. 3178–3183. https://doi.org/10.1128/iai.62.8.3178-3183.1994
Lomholt H., Poulsen K., Kilian M. // Mol. Microbiol. 1995. V. 15. P. 495–506. https://doi.org/10.1111/j.1365-2958.1995.tb02263.x
Lomholt J.A., Kilian M. // J. Clin. Microbiol. 2000. V. 38. P. 2760–2762. https://doi.org/10.1128/jcm.38.7.2760-2762.2000
Казеева Т.Н., Шевелев А.Б., Леонович О.А., Фаизов Т.Х., Белякова А.В., Лебедева А.А., Кузнецова Т.В., Маракасова Е.С., Ермохина О.В., Эпова Е.Ю., Дудорова М.Г., Соцкова Д.В., Волкова Е.А., Терехина А.С., Воронова Т.Ю, Васильев И.А. // Электронный научный журнал Современные проблемы науки и образования. 2012. № 1. https://www.science-education.ru/ru/article/view?id=5096
Pérez-Ortega J., Rodríguez A., Ribes E., Tommassen J., Arenas J. // Front. Microbiol. 2017. V. 8. P. 434. https://doi.org/10.3389/fmicb.2017.00434
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия



