Биоорганическая химия, 2021, T. 47, № 4, стр. 431-463
Современные подходы к поиску анксиолитических средств
Д. В. Мальцев 1, 2, *, А. А. Спасов 1, 2, М. В. Мирошников 1, М. О. Скрипка 1
1 ФГБОУ ВО “Волгоградский государственный медицинский университет” Минздрава России
400131 Волгоград, площадь Павших Борцов, 1, Россия
2 ГБУ “Волгоградский медицинский научный центр”
400131 Волгоград, площадь Павших Борцов, 1, Россия
* E-mail: maltsevdmitriy@rambler.ru
Поступила в редакцию 04.07.2020
После доработки 26.07.2020
Принята к публикации 28.07.2020
Аннотация
Представлен обзор исследований новых фармакологических субстанций в аспекте их анксиолитической активности. Описанные вещества выступают производными различных химических классов и характеризуются выраженным противотревожным действием. Разнообразие описанных в данной статье синтезированных веществ представляет собой совокупность наиболее интересных и перспективных проектов на данный момент. Согласно современным тенденциям, дальнейшее подробное доклиническое изучение химерных соединений с политаргетным механизмом действия – весьма актуальное направление в химической и фармакологической, а также медицинской сферах деятельности исследователей.
ВВЕДЕНИЕ
По данным ВОЗ, во всем мире зарегистрировано более 260 млн человек, подверженных различным тревожным расстройствам. По причине тревожных и депрессивных расстройств населения мировая экономика ежегодно терпит убытки, оцениваемые в 1 трлн долларов США [1]. На долю лиц с ментальными расстройствами, нуждающихся в систематической помощи, в России приходится 8–10% населения, а число наиболее тяжелых пациентов составляет ~3–6% [2]. Так, наиболее часто в клинической практике встречаются генерализованное тревожное расстройство (ГТР), посттравматическое стрессовое расстройство, паническое расстройство, обсессивно-компульсивное расстройство, социальные фобии и тревожно-депрессивное расстройство [3]. Терапевтическая коррекция данных патологий на сегодняшний день – проблема весьма актуальная и требующая решения. Классические анксиолитические (транквилизирующие) препараты, к числу которых относятся феназепам, диазепам, алпразолам и др., характеризуются высоким анксиолитическим потенциалом и адекватной скоростью реализации противотревожного эффекта при широком терапевтическом индексе [4], именно поэтому многие из них используются в терапии тревожных патологий уже более 40 лет. Тем не менее данные препараты имеют значительный перечень побочных эффектов, среди которых психическая и физическая зависимость, миорелаксация и седация. Применение указанной группы лекарственных средств ограничено для пациентов, чья профессиональная деятельность связана с повышенным вниманием и координацией движений (водители, диспетчеры и т.п.). “Новые анксиолитики” [5], по классификации Т.А. Ворониной и С.Б. Середенина (2002 г.), к которым относятся частичные агонисты бензодиазепинового рецептора (абекарнил), эндогенные модуляторы ГАМКА-бензодиазепинового рецепторного комплекса (эндозепины), агонисты ГАМКБ-рецепторного комплекса (фенибут), мембранные модуляторы ГАМКА-бензодиазепинового рецепторного комплекса (афобазол), глутаматергические (кетамин) и серотонинергические анксиолитики (буспирон), в большинстве случаев характеризуются менее выраженными побочными эффектами, но и менее активны при терапии фобических расстройств в сравнении с производными бензодиазепина. Для лечения патологического стресса назначаются также антидепрессанты, преимущественно группы селективных ингибиторов обратного захвата серотонина [6] (флуоксетин), однако и они не лишены ряда нежелательных действий – атипичные реакции, длительное развитие основного эффекта либо его нивелирование. Широкое многообразие препаратов и механизмов их основного действия при лечении тревожных расстройств обусловлено биохимической сложностью и этиологической индивидуальностью патологического процесса. В настоящее время одной из стратегий лечения невротических расстройств выступает одновременное сбалансированное назначение транквилизаторов и антидепрессантов, что значительно повышает эффективность терапии [7]. Другой путь – создание новых полимодальных соединений, сочетающих указанные виды активности [8].
Ввиду частой неклассической картины фобических расстройств, тревожные заболевания следует отличать от непсихических нарушений [3]: соматических, эндокринных расстройств, а также адекватной ситуационной тревоги, носящей мобилизационный характер. Причины симптоматического калейдоскопа, к тому же, могут заключаться в каскадных нарушениях нескольких нейромедиаторных систем [9] (ГАМКергическая, серотонинергическая, глутаматная, эндоканнабиноидная) либо нарушениях взаимодействия между ними.
ОСНОВНЫЕ МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ РЕГУЛЯЦИИ ПСИХИЧЕСКОГО СОСТОЯНИЯ ЧЕЛОВЕКА
На современном этапе патобиохимические проблемы тревожных расстройств, а также терапевтические пути их решения занимают важное место как в клинической медицинской практике, так и в фундаментальных научных исследованиях [10, 11]. Поскольку тревожно-фобические расстройства – этиологически сложноидентифицируемые патологические состояния [12], на сегодняшний день в фокусе внимания исследователей находится не менее десятка гипотез о механизмах действия и роли медиаторных систем, нарушения которых могут приводить к развитию тревожных заболеваний. Наиболее изученная среди этих систем – ГАМКергический механизм, поскольку дефекты формирования или функционирования рецептора, а также некорректная работа транспортера ГАМК могут приводить к развитию ряда тревожных состояний [13]. Другими наиболее изученными механизмами выступают серотонинергическая [14] и катехоламинергическая системы [15], поскольку их патобиохимическая неполноценность способна негативно сказываться на психическом статусе пациента в сторону тревожно-фобического состояния, а также приводить к развитию депрессии и хронических стрессовых расстройств.
Помимо вышеназванных систем в настоящее время активно ведутся исследования альтернативных путей, дисрегуляция которых требует коррекции по причине значительного влияния на генез патологий психики. Одни из самых перспективных среди них – ингибиторы TSPO, лиганды которого рассматриваются как чувствительные биомаркеры визуализации нейроочага поражения головного мозга [16, 17]. В то же время они характеризуются анксиолитическим и антидепрессивным эффектом без очевидных побочных действий обычных бензодиазепинов. Также активно разрабатываются новые соединения, аффинные к сигма- [18, 19] и опиоидным рецепторам [20], проводятся эксперименты по снижению побочных эффектов, главными из которых выступают зависимость и аддикция. Еще одно новое направление изучения механизмов действия новых соединений с анксиолитической активностью – ингибиторы ионных каналов транзиторного рецепторного потенциала TRPC4 и TRPC5, эффекты которых связаны с поведенческими изменениями и чувством страха под действием стимуляции GPCRs [21]. Кроме того, ведутся разработки в отношении ингибирования потенциал-зависимых натриевых каналов, т.к. ряд источников подтверждает [22, 23], что взаимодействие данного канала с определенными лигандами может приводить к развитию противотревожного эффекта. Помимо этого, существует большой объем информации о разработке новых соединений с H3-гистаминергической активностью [24, 25].
В результате открытия новых мишеней для реализации антифобического действия в организме в большом количестве разрабатываются вещества различных химических классов с транквилизирующей активностью, они находятся на доклиническом этапе исследования. Анализируя химическую структуру представленных в данном обзоре субстанций, можно заметить, что с ГАМК-рецептором взаимодействует широкий спектр соединений с выраженной анксиолитической активностью: производные пиперазина, хинолина, диазепинобензимидазола, пиримидина, фторфенилацетамида, бензотриазина, гувацина и синтетических флаваноидов [26]. С серотониновыми рецепторами также взаимодействуют многие из описанных веществ, что подтверждает вовлеченность серотониновой и ГАМКергической систем в корректировку тревожно-фобических состояний и вызывает серьезный исследовательский интерес к природе связи этих систем со стрессово-депрессивными расстройствами. К веществам, влияющим на серотониновые рецепторы [27], относятся производные индола, пиперидина, триазина, бензосульфонамида, пиримидина, пиперазина, бензимидазола и диазепинобензимидазола. К ингибиторам моноаминоксидазы (МАО) относятся производные пиразола [28], TSPO – производные пурина и пиримидина [16, 17], TRPC4 и TRPC5 – производные бензимидазола [21]. Сродство к опиоидным рецепторам [20] проявляли производные тиазола, диазенафтацена, триазола, а к гистаминовым – производные пиридина [24, 25]. Стоит отметить влияние глициновых рецепторов в цикле патогенеза тревоги в миндалине мозга человека [29]. Изменения в обменном факторе гуанина – коллибистине (Cb) – приводят к возникновению тревоги, развитию эпилепсии и интеллектуальных нарушений [30]. Некоторые исследования показывают роль рецепторов холецистокинина типа В (CCK-B) в анксиогенезе: введение холецистокинина здоровым добровольцам приводило к развитию тревожного состояния, а пациентам с паническим расстройством – к панической атаке [31]. Однако клиническое исследование этого механизма не привело к положительным результатам [32]. Известно свойство кофеина, неселективного A1/2A-аденозинового антагониста, в малых дозах улучшать состояние при стрессе и депрессии, но усугублять его в больших дозах [33]. Вовлеченность BNDF в генез тревожных состояний подтверждается также значительным снижением содержания этого фактора в плазме пациентов с ГТР по сравнению с группой здоровых добровольцев [34].
При более детальном анализе химической основы веществ (кора), числа и стереорасположения радикальных заместителей становится очевидно, что многие из представленных соединений проявляют определенное сходство между собой. Поэтому теоретически при химической трансформации структуры вещества возможно взаимодействие и с иными субъединицами рецепторов, терапевтически положительно влияющих на психическое здоровье пациентов. Основываясь на этом предположении, а также приведенной в данном обзоре информации о соединениях, одним из наиболее выгодных направлений в разработке и исследовании веществ с нейропсихотропной активностью представляется синтез новых комбинированных субстанций [35], содержащих привилегированные скаффолды. Примером данного класса соединений служат производные диазепинобензимидазола [36], содержащие в своей структуре диазепиновый и бензимидазольный фрагменты. Эти вещества с комбинированной структурной основой, в теории, могут проявлять несколько типов активностей, одной из которых может быть противотревожная [37], а дополнительными – антидепрессивная, анальгетическая, снотворная, ноотропная. Эти вещества в перспективе могут оказывать влияние на множество рецепторных систем, что может приводить к более быстрому проявлению терапевтического эффекта, сниженным побочным эффектам или их отсутствию [38], а также наличию терапевтического потенциала и для иных патологических состояний.
Исходя из этого, новые комбинированные препараты способны взаимодействовать с несколькими типами мишеней, а при наличии широкой линейки препаратов с комбинированными структурами можно добиться более выраженного анксиолитического эффекта в отдельных клинических ситуациях. Представленная проблематика специфичности терапии тревожных состояний анксиолитическими и антидепрессивными средствами приводит к поиску химически и фармакологически наиболее оптимальных и выгодных субстанций с перспективными анксиолитическими характеристиками (скорость достижения эффекта, его сила и продолжительность) и минимумом побочных эффектов. В данной статье представлен обзор современных литературных данных за последние годы, актуализирована информация о новых соединениях с потенциальной антифобической активностью. Описанные вещества находятся на доклиническом этапе исследований, характеризуются различными механизмами действия и нейропсихотропными свойствами.
Химические структуры описанных в данной статье новых соединений, виды активностей, а также мишени, посредством которых обусловлено действие этих субстанций, приведены в табл. 1.
Таблица 1.
Сведения о представленных в статье фармакологических соединениях с анксиолитической активностью
| Название | Формула | Химическая группа | Активность | Мишень | Тесты | Ссылка |
|---|---|---|---|---|---|---|
| LQFM032 |  2-(4-((1-Фенил-1Н-пиразол-4- ил)метил)пиперазин-1-ил)этан-1-ол
2-(4-((1-Фенил-1Н-пиразол-4- ил)метил)пиперазин-1-ил)этан-1-ол
|
Производное пиперазина | Анксиолитическая, когнитивная | Бензодиазепиновый фрагмент ГАМКА-рецепторов | “Приподнятый крестообразный лабиринт”, тест пассивного избегания со скополамином | [42] |
| PQ | 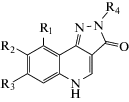 Общая формула производных веществ пиразоло[4,3-c]хинолин-3-онов (PQ)
Общая формула производных веществ пиразоло[4,3-c]хинолин-3-онов (PQ)
|
Производные пиразолохинолина | Анксиолитическая | Бензодиазепиновый фрагмент ГАМКА-рецепторов | Радиолигандный метод исследования | [44] |
| РГПУ-135 | 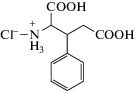 Гидрохлорид β-фенилглутаминовой
кислоты
Гидрохлорид β-фенилглутаминовой
кислоты
|
Производное β-фе-нилглутаминовой кислоты | Анксиолитическая, антидепрессивная, нейропротекторная | Бензодиазепиновый фрагмент ГАМКА- и ГАМКБ-рецепторов |
“Открытое поле”, “темная/светлая камера”, “подвешивание за хвост” | [45, 46] |
| DAB |  11-H-2,3,4,5-Тетрагидродиазепино[1,2-a]бенз-имидазола гидрохлориды
11-H-2,3,4,5-Тетрагидродиазепино[1,2-a]бенз-имидазола гидрохлориды
|
Производные диазепинобензимидазола | Анксиолитическая, антидепрессивная, когнитивная, антикомпульсивная | Бензодиазепиновый фрагмент ГАМКА-рецепторов |
“Приподнятый крестообразный лабиринт”, “темная/ светлая камера”, “принудительное взятие воды” по Vogel, “принудительное плавание” по Porsolt, тест “закапывания шариков” | [36, 38, 47] |
| DCUK-OEt |  5,7-Дихлор-4-([дифенилкарбамо-
ил]амино)хинолин-2-этилкарбоксилат)
5,7-Дихлор-4-([дифенилкарбамо-
ил]амино)хинолин-2-этилкарбоксилат)
|
Производное аминохинолина | Анксиолитическая | Аллостерический модулятор ГАМКА-рецептора | Радиолигандный метод | [51] |
| 6-MeOF |  6-Метоксифлаванон
6-Метоксифлаванон
|
Синтетические флаваноиды | Анксиолитическая | Аллостерический модулятор ГАМКА-рецептора | “Приподнятый крестообразный лабиринт”, “открытое поле” | [52] |
| Соединения (5b–12b) | 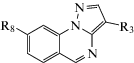 (5a–5b), (12a–12c)
(5a–5b), (12a–12c)
 (8), (10)
Пиразоло[1,5-a]хиназолины
(8), (10)
Пиразоло[1,5-a]хиназолины
|
Производные бензотриазина | Анксиолитическая | Аллостерический модулятор ГАМКА-рецептора | “Темная/светлая камера” | [53] |
| AZD7325 |  (4-Амино-8-(2-фтор-6-метоксифенил)-N-пропилциннолин-3-карбоксиамид
(4-Амино-8-(2-фтор-6-метоксифенил)-N-пропилциннолин-3-карбоксиамид
|
Производное N-пропилциннолина | Анксиолитическая | Аллостерический модулятор ГАМКА-рецептора | “Приподнятый крестообразный лабиринт” | [54, 55] |
| PF-06372865 | 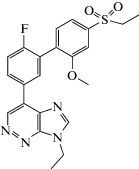 7-Этил-4-(4′-(этилсульфонил)-6-флуоро-2′-метоксибифенил-3-ил)-7H-имидазо[4,5-c]пиридазин
7-Этил-4-(4′-(этилсульфонил)-6-флуоро-2′-метоксибифенил-3-ил)-7H-имидазо[4,5-c]пиридазин
|
Производное имидазопиридазина | Анксиолитическая, анальгетическая, когнитивная | Аллостерический модулятор ГАМКА-рецептора | Радиолигандный метод | [56] |
| ADX71441 |  N-(5-(4-(4-[Хлор-3-фторбензил)-6-метокси-3,5-диоксо-4,5-дигидро-1,2,4-триазин-2(3H)-ил)-2-фторфенил)ацетамид N-(5-(4-(4-[Хлор-3-фторбензил)-6-метокси-3,5-диоксо-4,5-дигидро-1,2,4-триазин-2(3H)-ил)-2-фторфенил)ацетамид
|
Производное три-азина | Анксиолитическая | Положительный аллостерический модулятор (ПАМ) ГАМКБ-рецепторов | “Приподнятый крестообразный лабиринт”, тест “закапывания шариков” | [62] |
| SSD114 | 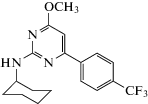 N-Циклогексил-4-метокси-6-(4-(трифторметил)фенил)пиримидин-2-амин N-Циклогексил-4-метокси-6-(4-(трифторметил)фенил)пиримидин-2-амин
|
Производное пиримидина | Анксиолитическая | Положительный аллостерический модулятор (ПАМ) ГАМКБ-рецепторов | Потенцирующий эффект препарата в тесте in vivo с баклофеном | [63] |
| DDPM-2571 |  1-(2-((((2',4'-Дихлор-[1,1'-бифенил]-2-ил)метилен)амино)окси)этил)-1,2,5,6-тетрагидропиридин-3-карбоновой
кислоты гидрохлорид
1-(2-((((2',4'-Дихлор-[1,1'-бифенил]-2-ил)метилен)амино)окси)этил)-1,2,5,6-тетрагидропиридин-3-карбоновой
кислоты гидрохлорид
|
Производное 1,2,5,6-тетрагидропиридин-3-карбоновой кислоты | Анксиолитическая | Cелективный ингибитор транспортера ГАМК GAT1 | “Приподнятый крестообразный лабиринт”, “четыре пластины” | [68, 69] |
| YQA-14 | 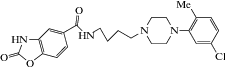 N-[4-[4-(5-Хлор-2-метилфенил)-1-пиперазинил]бутил]-2,3-дигидро-2-оксо-5-бензоксазолкарбоксиамид N-[4-[4-(5-Хлор-2-метилфенил)-1-пиперазинил]бутил]-2,3-дигидро-2-оксо-5-бензоксазолкарбоксиамид
|
Производное бензоксазола | Анксиолитическая, антидепрессивная | Антагонист дофаминовых D3-рецепторов | “Приподнятый крестообразный лабиринт”, “открытое поле”, “принудительное плавание” по Porsolt | [72] |
| SB242084 |  6-Хлор-5-метил-N-{6-[(2-метилпиридин-3-ил)окси]пиридин-3-ил}индолин-1-карбоксамид
6-Хлор-5-метил-N-{6-[(2-метилпиридин-3-ил)окси]пиридин-3-ил}индолин-1-карбоксамид
|
Производное пиридина | Анксиолитическая | Антагонист 5-НТ2С | “Приподнятый крестообразный лабиринт”, стресс по Geller–Seifter | [75] |
| S32212 | 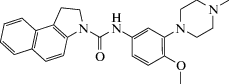 N-[4-Метокси-3-(4-метилпиперазин-1-ил)фенил]-1,2-дигидро-3H-бензо[e]индол-3-карбоксамид N-[4-Метокси-3-(4-метилпиперазин-1-ил)фенил]-1,2-дигидро-3H-бензо[e]индол-3-карбоксамид
|
Производное пиридина | Анксиолитическая, антидепрессивная | Обратный агонист 5-НТ2С | “Принудительное взятие воды” по Vogel, “принудительное плавание” по Porsolt | [76] |
| LQFM180 |  Этил-4-(3,5-ди-три-бутил-4-гидроксибензил)пиперазин-1-карбоксилат
Этил-4-(3,5-ди-три-бутил-4-гидроксибензил)пиперазин-1-карбоксилат
|
Производное пиперазина | Анксиолитическая | Агонисты серотониновых 5-HT1А-рецепторов | “Приподнятый крестообразный лабиринт”, “открытое поле”, тест пассивного избегания со скополамином | [81] |
| HBK-17 |  1-[(2,5-Диметилфенокси)пропил]-4-(2-метоксифенил)пиперазин
1-[(2,5-Диметилфенокси)пропил]-4-(2-метоксифенил)пиперазингидрохлорид |
Производное пиперазина | Анксиолитическая | Агонисты 5-НТ1А-, антагонисты 5-НТ7- и D2-рецепторов | “Приподнятый крестообразный лабиринт”, “четыре пластины” | [82] |
| D2AAK1 | 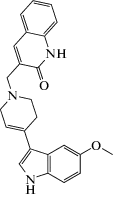 3-(1-Бензил-1,2,3,6-тетрагидропиридин-4-ил)-5-этокси-1H-индол
3-(1-Бензил-1,2,3,6-тетрагидропиридин-4-ил)-5-этокси-1H-индол
|
Производное хинолина | Анксиолитическая | Агонисты серотониновых 5-HT1А- и 5-HT2А-рецепторов, агонисты дофаминовых D1- и D3-рецепторов |
“Приподнятый крестообразный лабиринт” | [83] |
| ADN-1184 |  N-[3-[4-(6-фтор-1,2-бензоксазол-3-ил)пиперидин-1-ил]пропил]-3-метилбензенсуль-фонамид N-[3-[4-(6-фтор-1,2-бензоксазол-3-ил)пиперидин-1-ил]пропил]-3-метилбензенсуль-фонамид
|
Производное арилсульфаниламида | Анксиолитическая, антикомпульсивная, анальгетическая | Агонисты 5-HT6/5-HT7/5-HT2A/D2-рецепторов | “Приподнятый крестообразный лабиринт”, “принудительное взятие воды” по Vogel, тест “закапывания шариков”, “четыре пластины” | [84] |
| AVN-492 | 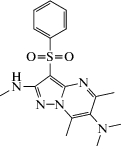 3-Бензенсульфонил-5,7,N2,N6,N6-пентаметилпиразоло[1,5-a]пиримидин-2,6-диамин
3-Бензенсульфонил-5,7,N2,N6,N6-пентаметилпиразоло[1,5-a]пиримидин-2,6-диамин
|
Производное пиримидина | Анксиолитическая | Агонист серотониновых 5-НТ6-рецепторов | “Приподнятый крестообразный лабиринт” | [85] |
| PZ-1150 |  4-Фтор-N-(1-{2-[(пропан-2-ил)фенокси]этил}-8-азабицикло[3.2.1]октан-3-ил)-бензенсульфонамид
4-Фтор-N-(1-{2-[(пропан-2-ил)фенокси]этил}-8-азабицикло[3.2.1]октан-3-ил)-бензенсульфонамид
|
Производное бензолсульфонамида | Анксиолитическая, анальгетическая | Агонисты серотониновых 5-НТ7-рецепторов | “Четыре пластины” | [86] |
| F15599 и F13714 |  F15599: ((3-Хлор-4-фторфенил)-[4-фтор-4-[[(5-метилпиримидин-2-ил)метиламино]метил]пиперидин-1-ил]метанон) F15599: ((3-Хлор-4-фторфенил)-[4-фтор-4-[[(5-метилпиримидин-2-ил)метиламино]метил]пиперидин-1-ил]метанон)
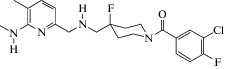 F13714: (3-Хлор-4-фторфенил-(4-фтор-4-{[(5-метил-6-метиламино-пиридин-2-илметил)-амино]-метил}пиперидин-1-ил-метанон) F13714: (3-Хлор-4-фторфенил-(4-фтор-4-{[(5-метил-6-метиламино-пиридин-2-илметил)-амино]-метил}пиперидин-1-ил-метанон)
|
Производные пиперидина | Анксиолитическая | Агонисты серотониновых 5-HT1А-рецепторов | “Приподнятый крестообразный лабиринт”, “принудительное взятие воды” по Vogel | [87, 88] |
| ACH-000029 | 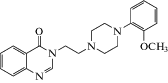 3-(2-(4-(2-Метоксифенил)пиперазин-1-ил)этил)хиназолин-4(3H)-он
3-(2-(4-(2-Метоксифенил)пиперазин-1-ил)этил)хиназолин-4(3H)-он
|
Производное хиназолина | Анксиолитическая | Агонист серотониновых 5-НТ1А- и 5-НТ1D-рецепторов, антагонист 5-НТ2А-рецептора, антагонист α1А, α1B- и α1D-адренергических рецепторов | Тест “закапывания шариков”, “темная/светлая камера” | [89] |
| PAAPMNBA |  N-{4'[(2E)-3-(3-Нитрофенил)-1-(фенил)проп-2-ен-1-он]}ацетамид N-{4'[(2E)-3-(3-Нитрофенил)-1-(фенил)проп-2-ен-1-он]}ацетамид
|
Производное фенилпропенона | Анксиолитическая | Антагонист серотониновых 5-НТ1-, 5-НТ2А/2С- и 5-НТ3А/3В-рецепторов | “Открытое поле”, “темная/светлая камера” | [90] |
| RS67333 |  (1-[4-Амино-5-хлор-2-метоксифенил]-3-[1-бутил-4-пиперидинил]-1-пропанон)
(1-[4-Амино-5-хлор-2-метоксифенил]-3-[1-бутил-4-пиперидинил]-1-пропанон)
|
Производное пиперидина | Анксиолитическая | Агонист серотониновых 5-НТ4-рецепторов | “Приподнятый крестообразный лабиринт” | [91] |
| Соединения (18), (26) |  R = 2-нафтил
(18): 3-((4-амино-6-(4-метидпиперазин-1-ил)-1,3,5-триазин-2-ил)метил)-5,5-диметил-1-(нафтален-1-илметил)имидазолидин-2,4-дион
R = 2-нафтил
(18): 3-((4-амино-6-(4-метидпиперазин-1-ил)-1,3,5-триазин-2-ил)метил)-5,5-диметил-1-(нафтален-1-илметил)имидазолидин-2,4-дион
 R = 2-нафтил
(26): 3-((4-Амино-6-(4-метидпиперазин-1-ил)-1,3,5-триазин-2-ил)метил)-5-метил-5-(нафтален-2-ил)имидазолидин-2,4-дион
R = 2-нафтил
(26): 3-((4-Амино-6-(4-метидпиперазин-1-ил)-1,3,5-триазин-2-ил)метил)-5-метил-5-(нафтален-2-ил)имидазолидин-2,4-дион
|
Производные арилгидантоин-1,3,5-три-азина | Анксиолитическая, антидепрессивная, метаболическая | Агонисты серотониновых 5-НТ6-рецепторов | “Принудительное взятие воды” по Vogel | [92] |
| MF-8 |  (5-(4-Фторфенил)-3-(2-гидрокси-3-(4-(2-метоксифенил)пиперазин-1-ил)пропил)-5-метилгидантоин)
(5-(4-Фторфенил)-3-(2-гидрокси-3-(4-(2-метоксифенил)пиперазин-1-ил)пропил)-5-метилгидантоин)
|
Производное метилгидантоина | Анксиолитическая, анальгетическая | Агонист серотониновых 5-HT1A-, 5-HT7B- и D2L-рецепторов | “Принудительное плавание” по Porsolt, “четыре пластины” | [93, 94] |
| YL-0919 |  1-(1-Бензил-4-гидроксипиперидин-4-ил-метил)-2(1H)-пиридин гидрохлорид
1-(1-Бензил-4-гидроксипиперидин-4-ил-метил)-2(1H)-пиридин гидрохлорид
|
Производное пиперидина | Анксиолитическая, антидепрессивная | Агонисты серотониновых 5-НТ1А-рецепторов | “Приподнятый крестообразный лабиринт”, “открытое поле”, тест потребления глюкозы, водный тест Морриса | [95] |
| Соединение (6n) |  N-n-Пропил-3-этоксихиноксалин-
2-карбоксамид N-n-Пропил-3-этоксихиноксалин-
2-карбоксамид
|
Производное хиноксалина | Анксиолитическая | Антагонисты серотониновых 5-НТ3-рецепторов | “Приподнятый крестообразный лабиринт” | [96] |
| RU-476 |  R1 = C2H4N(C2H5)2
R2 = C6H4OCH3
R3 = H
9-(2-Диэтиламиноэтил)-2-(4-метоксифенил)имидазо[1,2-α]бензимидазол
R1 = C2H4N(C2H5)2
R2 = C6H4OCH3
R3 = H
9-(2-Диэтиламиноэтил)-2-(4-метоксифенил)имидазо[1,2-α]бензимидазол
|
Производное имидазобензимидазола | Анксиолитическая | Агонист серотониновых 5-НТ2А-рецепторов | “Приподнятый крестообразный лабиринт”, “принудительное взятие воды” по Vogel | [97–99] |
| Соединения (9), (10), (17) |  (9): 3-(4-Фторфенил)-5-(4-хлорфенил)-N-метил-4,5-дигидро-1H-пиразол-1-карботиоамид
(10): 3-(4-Фторфенил)-5-(4-бромфенил)-N-метил-4,5-дигидро-1H-пиразол-1-карботиоамид
(17): 3-(4-Фторфенил)-5-(4-бромфенил)-N-этил-4,5-дигидро-1H-пиразол-1-карботиоамид
(9): 3-(4-Фторфенил)-5-(4-хлорфенил)-N-метил-4,5-дигидро-1H-пиразол-1-карботиоамид
(10): 3-(4-Фторфенил)-5-(4-бромфенил)-N-метил-4,5-дигидро-1H-пиразол-1-карботиоамид
(17): 3-(4-Фторфенил)-5-(4-бромфенил)-N-этил-4,5-дигидро-1H-пиразол-1-карботиоамид
|
Производные пиразола | Анксиолитическая | Ингибиторы моноаминоксидазы (ИМАО) | “Приподнятый крестообразный лабиринт” | [105] |
| PFC-3 и 12 |  PFC-3: 2-[5-(4-Бензилокси-фенил)-1-(4-хлор-бензенсульфонил)-4,5-дигидро-1H-пиразол-3-ил]-фенол PFC-3: 2-[5-(4-Бензилокси-фенил)-1-(4-хлор-бензенсульфонил)-4,5-дигидро-1H-пиразол-3-ил]-фенол
 PFC-12: 3-антрацен-9-ил-1-(4-хлор-бензенсульфонил)-5-p-толил-4,5-дигидро-1H-пиразол PFC-12: 3-антрацен-9-ил-1-(4-хлор-бензенсульфонил)-5-p-толил-4,5-дигидро-1H-пиразол
|
Производные 1,3,5-тризамещенного 2-пиразолина | Анксиолитическая, антидепрессивная | Ингибиторы моноаминоксидазы (ИМАО) | “Приподнятый крестообразный лабиринт”, “принудительное плавание” по Porsolt, “подвешивание за хвост” | [106] |
| ZBD-2 |  N-Бензил-N-этил-2-(7,8-дигидро-7-бензил-8-оксо-2-фенил-9H-пурин-9-ил)ацетамид N-Бензил-N-этил-2-(7,8-дигидро-7-бензил-8-оксо-2-фенил-9H-пурин-9-ил)ацетамид
|
Производное пурина | Анксиолитическая, антидепрессивная, анальгетическая, нейропротективная | Ингибитор транслокаторного протеина TSPO | “Приподнятый крестообразный лабиринт”, “принудительное плавание” по Porsolt | [107] |
| YL-IPA08 |  N-Этил-N-(2-пиридинилметил)-2-(3,4-дихлорфенил)-7-метилимидазо[1,2-a]пиридин-3-ацетамид гидрохлорид N-Этил-N-(2-пиридинилметил)-2-(3,4-дихлорфенил)-7-метилимидазо[1,2-a]пиридин-3-ацетамид гидрохлорид
|
Производное пиримидина | Анксиолитическая | Ингибитор транслокаторного протеина TSPO | “Приподнятый крестообразный лабиринт”, “принуди-тельное взятие воды” по Vogel | [108] |
| GML-1 | 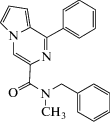 N-Бензил-N-метил-1-фенилпирроло[1,2-a]пиразин-3-карбоксиамид N-Бензил-N-метил-1-фенилпирроло[1,2-a]пиразин-3-карбоксиамид
|
Производное пирроло[1,2-a]пиразина | Анксиолитическая | Ингибитор транслокаторного протеина TSPO | ”Приподнятый крестообразный лабиринт” | [110, 111] |
| Соединение (25) |  4-Фенил-3-арил-сульфохинолин
4-Фенил-3-арил-сульфохинолин
|
Производное сульфохинолина | Анксиолитическая | Селективный негативный аллостерический модулятор метаботропного mGlu5-рецептора | Тест ультразвуковой вокализации, контекстуальный тест страха | [117] |
| 4-PSQ |  4-Фенилселенил-7-хлорохинолин
4-Фенилселенил-7-хлорохинолин
|
Производное хинолина | Анксиолитическая | Ингибитор захвата глутамата | “Приподнятый крестообразный лабиринт”, “открытое поле”, “темная/светлая камера” | [118] |
| ATPM-ET | 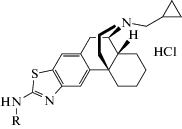 [(–)-3-N-Этиламинотиазоло[5,4-b]-N-циклопропилметилморфинана гидрохлорид]
[(–)-3-N-Этиламинотиазоло[5,4-b]-N-циклопропилметилморфинана гидрохлорид]
|
Производное циклопропилметилморфинана | Анксиолитическая | Антагонист κ- и частичный агонист μ-опиоидных рецепторов | “Приподнятый крестообразный лабиринт”, “открытое поле” | [124] |
| KNT-127 | 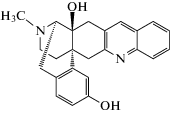 (6R,6aS,14aR)-17-метил-5,6,7,14-тетрагидро-6aH-6,14a-(эпиминоэтано)нафто[2,1-b]акридин-2,6a-диол
(6R,6aS,14aR)-17-метил-5,6,7,14-тетрагидро-6aH-6,14a-(эпиминоэтано)нафто[2,1-b]акридин-2,6a-диол
|
Производное нафтоакридина | Анксиолитическая | Агонист d-опиоидного рецептора | “Приподнятый крестообразный лабиринт” | [125] |
| PILAB 8 |  5'-4-Пентил-1H-1,2,3-триазол
5'-4-Пентил-1H-1,2,3-триазол
|
Производные 5'-4-алкил/арил-1H-1,2,3-триазола | Анксиолитическая | Агонист µ-опиоидного рецептора | “Приподнятый крестообразный лабиринт” | [126] |
| HC-070 | 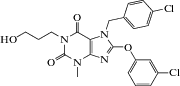 7-(4-Хлоробензил)-8-(3-хлорфенокси)-1-(3-гидроксипропил)-3-метил-3,7-дигидро-1H-пурин-2,6-дион
7-(4-Хлоробензил)-8-(3-хлорфенокси)-1-(3-гидроксипропил)-3-метил-3,7-дигидро-1H-пурин-2,6-дион
|
Производное пурина | Анксиолитическая | Ингибиторы TRPC4 и TRPC5 | “Приподнятый крестообразный лабиринт” | [21] |
| M084 |  N-Бутил-1H-бензимидазол-2-амин N-Бутил-1H-бензимидазол-2-амин
|
Производное бенз-имидазола | Анксиолитическая, антидепрессивная | Ингибитор TRPC4 и TRPC5 | “Приподнятый крестообразный лабиринт”, “принудительное плавание” по Porsolt | [128] |
| ST-1283 | 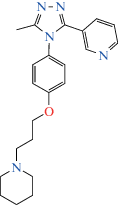 [3-(5-Метил-4-(4-(3-(пиперидин-1-ил)проп-окси)фенил)-4H-1,2,4-триазол-3-ил)пиридин]
[3-(5-Метил-4-(4-(3-(пиперидин-1-ил)проп-окси)фенил)-4H-1,2,4-триазол-3-ил)пиридин]
|
Производное пиридина | Анксиолитическая | Антагонист Н3-гистаминового рецептора | “Приподнятый крестообразный лабиринт” | [131] |
| Соединение (5) | 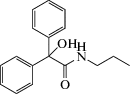 N-Пропил-2,2-дифенил-2-гидроксиацетамид N-Пропил-2,2-дифенил-2-гидроксиацетамид
|
Производное дифенила | Анксиолитическая | Ингибитор потенциал-зависимых натриевых каналов | “Приподнятый крестообразный лабиринт”, “подвешивание за хвост” | [132] |
| WYQ-C36D |  (R)-2-(1-Циклопентил-4-оксо-4,5-дигидро-1H-пиразоло[3,4-d]пиримидин-6-иламино)-N-(4-метоксифенил)-пропанамид
(R)-2-(1-Циклопентил-4-оксо-4,5-дигидро-1H-пиразоло[3,4-d]пиримидин-6-иламино)-N-(4-метоксифенил)-пропанамид
|
Производное пиримидина | Анксиолитическая, антидепрессивная, когнитивная | Ингибитор фосфодиэстеразы 9-го типа | “Приподнятый крестообразный лабиринт”, “принудительное плавание” по Porsolt | [133] |
| Zlc-002 |  Метиловый эфир N-(2-карбометоксиацетил)-D-валина
Метиловый эфир N-(2-карбометоксиацетил)-D-валина
|
Малая молекула, производное валина | Анксиолитическая | Ингибитор связывания nNOS-CAPON | “Открытое поле”, “приподнятый крестообразный лабиринт”, “питание в новой обстановке”, “темная/светлая камера” | [134] |
| BIF-66 |  Гидробромид 4'-(2,3,4,5-тетрагидро-11Н- [1,3]диазепино[1,2-a]бензимидазол-11-илметил)бифенил-2-карбоновая кислота
Гидробромид 4'-(2,3,4,5-тетрагидро-11Н- [1,3]диазепино[1,2-a]бензимидазол-11-илметил)бифенил-2-карбоновая кислота
|
Производное 11Н- [1, 3]диазепино[1,2-a]-бензимидазолов | Анксиолитическая | Не изучен | “Открытое поле”, “приподнятый крестообразный лабиринт” | [135] |
| AZH-57 |  Дигидрохлорид 5-метил-2-[(2-морфолино)-этилтио]бензимидазола
Дигидрохлорид 5-метил-2-[(2-морфолино)-этилтио]бензимидазола
|
Производное 2-меркаптобензимидазола | Анксиолитическая | Предположительно σ-рецепторы | “Открытое поле”, “приподнятый крестообразный лабиринт” | [135] |
НЕЙРОМЕДИАТОРНАЯ СИСТЕМА ГАМК
Агонисты ГАМК-рецепторов. γ-Аминомасляная кислота – основной тормозной медиатор ЦНС. Агонистами данного класса выступают производные бензодиазепина – диазепам, феназепам, мидазолам и др. С момента открытия подтипов бензодиазепиновых рецепторов в 1979 г. поиск действенных анксиолитиков со сниженным перечнем побочных действий продолжается и сегодня [39, 40]. Клонирование и экспрессия ГАМКА-рецепторов выявило несколько подтипов рецепторов, основанных на вариации субъединичного состава. Особое внимание было уделено α-субъединицам, образующим ионный канал, поскольку было доказано, что данные субъединицы оказывают значительное влияние на фармакологическую активность анксиолитиков. α1-Субъединица ассоциируется с седативным действием; это открытие привело к успешной разработке и внедрению в клиническую практику множества α1-селективных препаратов со снотворным эффектом, таких как нитразепам, лоразепам, оксазепам. Поскольку было доказано, что α2,3-субъединицы ГАМКА-рецептора связаны с проявлением анксиолитического эффекта, этот механизм до сих пор остается классическим для поиска новых субстанций с противотревожным действием [41].
Так, в работе Brito et al. (2017) на различных поведенческих моделях изучалась анксиолитическая активность соединения LQFM032 – производного пиперазина. Исследуемое вещество вводили перорально в дозах 18–162 мкМ/кг. По результатам проведенных исследований, авторами статьи было сделано заключение о вовлечении ГАМКергической системы в генез анксиолитического эффекта соединения LQFM032, поскольку это подтверждалось нивелированием действия вещества при совместном использовании с флумазенилом в тесте “приподнятый крестообразный лабиринт” [42]. Помимо исследования антифобического действия соединения авторы проводили эксперименты по изучению влияния вещества на когнитивные функции в тесте пассивного избегания со скополамином (поскольку анксиолитические эффекты классических агонистов бензодиазепинового сайта связаны с нежелательной антероградной амнезией). По данным нейротоксикологического исследования по Irwin, исследуемое вещество отличается низкой токсичностью (токсические эффекты развивались в дозе 875 мкМ/кг), что также служит положительным фактором. Среди производных пиперазина на сегодняшний момент на рынке уже существует транквилизирующий препарат под названием атаракс (гидроксизин), характеризующийся умеренной анксиолитической активностью и применяемый для купирования различных тревожных состояний [43].
Другой класс потенциальных анксиолитиков – конденсированные производные пиразолохинолина PQ, описанные Rivilli et al. в 2018 г. Данные вещества были получены и испытаны как высокоаффинные агонисты бензодиазепинового сайта ионотропного ГАМКА-рецептора. Преимущество данных соединений по сравнению с бензодиазепинами заключается в отсутствии нежелательного эффекта седации. Предполагаемый ГАМКергический механизм действия веществ был доказан с помощью радиолигандного метода исследования. Проведен детальный химический разбор, в котором авторы дали заключение о высокой селективности связывания с бензодиазепиновым участком ГАМКА-рецептора с величиной IC50 = = 0.326 нМ для соединений, содержащих в структуре заместитель брома в положении 8, а также р-метоксифенильную группу в положении N2. Анксиолитическая активность была подтверждена экспериментально в ряде антифобических моделей. Соединения с метоксифенильной группой при N2 и высокой аффинностью к ГАМКА-рецепторам показали значительный антифобический эффект, превосходящий препараты сравнения. Авторами сделан вывод о наличии достоверного эффекта в дозах 0.5 и 1.0 мг/кг. Кроме того, авторы указывают на хорошую степень проницаемости гематоэнцефалического барьера для соединения PQ [44].
В работах Tyurenkov et al. изучено влияние нового средства с антидепрессантным, анксиолитическим и нейропротекторным действием – РГПУ-135 (гидрохлорид β-фенилглутаминовой кислоты, нейроглутам) – на общее состояние и поведение аутбредных мышей при хроническом стрессе, вызванном повторными истощающими физическими нагрузками. Нейроглутам вводили животным внутрижелудочно (через зонд) в дистиллированной воде в дозах 13, 26 и 52 мг/кг на протяжении 6 дней ежедневно однократно за 1 ч до плавания. Установлено, что нейроглутам проявляет стресс-протекторные свойства в дозе 26 мг/кг и в меньшей степени – в дозе 52 мг/кг: уменьшает выраженность нарушений общего состояния и поведения животных в домашней клетке, препятствует снижению массы тела, в постстрессорном периоде способствует повышению локомоторной и исследовательской активности, уменьшению проявлений тревоги в тесте “открытое поле” и выраженности депрессивноподобного поведения мышей в тесте “подвешивание за хвост” [45]. ГАМКергический механизм действия нейроглутама был выявлен путем анализа влияния антагониста ГАМКА-рецепторов бикукуллина (1 мг/кг) и антагониста ГАМКБ-рецепторов факлофена (2 мг/кг) на характер и выраженность эффектов нейроглутама (26 мг/кг) в тестах “открытое поле” и “темная/светлая камера”. При сочетанном применении нейроглутама и бикукуллина анксиолитический и антидепрессивный эффекты нейроглутама не проявлялись, т.е. для их реализации необходима активация ГАМКА-рецепторов [46].
Еще один перспективный класс веществ – производные диазепинобензимидазола – DAB [38]. Spasov et al. позиционируют структуру соединения как комбинацию привилегированных подструктур – диазепина и бензимидазола. Каждая из них самостоятельно зарекомендовала себя как характеризующаяся психотропной активностью, обе широко применяются в терапии тревожных расстройств. Авторами выдвигается теория об улучшенных нейропсихотропных свойствах со сниженным перечнем побочных эффектов для вновь полученных диазепинобензимидазолов, обусловленных синтетическим преобразованием соединений.
При рассмотрении химической структуры наиболее перспективного соединения – DAB-21, показавшего в тестах in vivo наиболее сильный антифобический потенциал, авторы выдвигают гипотезу о негативном влиянии на анксиолитический эффект исследуемого соединения присутствия в положении 11 2-пирролидиноэтильного радикала и наличия в этом радикале у атома азота насыщенного гетероцикла, но только в том случае, когда для цикла характерна выраженная трехмерная (3D) геометрия. Это характерно именно для шестичленных циклов, но не для пятичленного пирролидина, имеющего более плоскую структуру. Новые соединения позиционируются как вещества с полимодальным механизмом действия, что может быть перспективным критерием в дальнейших исследованиях нейропсихотропного профиля. Так, в работах описывается множество методик анксиолитического, антидепрессивного, поведенческого, анальгетического профиля, а также оценивается влияние веществ на снижение проявлений обсессивно-компульсивного расстройства. По результатам исследований, представленных в статьях, соединения-лидеры изучаемого ряда веществ DAB (DAB-19, DAB-21) превосходят препарат сравнения диазепам и выступают перспективными для углубленного изучения нейропсихотропного профиля [36, 38, 47].
Аллостерические модуляторы ГАМКА-рецептора. В ГАМКА-рецепторе существует целый ряд модуляторных сайтов, отличных от сайта связывания агониста. Различные соединения, действующие на сайты, повышают или, наоборот, снижают эффективность активации ГАМКА-рецепторов агонистом. Бензодиазепиновый сайт – мишень для ряда препаратов, используемых в клинической практике: антиконвульсантов, седативных и гипнотических средств [48]. Активация бензодиазепинового сайта приводит к увеличению аффинности к агонисту у определенной группы ГАМКА-рецепторов. Было показано, что токи хлорных ионов, опосредованные низкоаффинными ГАМКергическими рецепторами, в гиппокампе усиливаются бензодиазепинами в гораздо большей степени, нежели опосредованные высокоаффинными рецепторами. Такие различия ГАМКергических рецепторов могут быть объяснены различным составом входящих в них субъединиц [49]. Данная теория подтверждается тем, что диазепам приводит к увеличению ГАМКергического ионного тока лишь при наличии γ2-субъединицы в ГАМКА-рецепторах. Другим сайтом аллостерической модуляции ГАМКА-рецепторов выступает сайт барбитуратов. ГАМКА-рецепторы, чувствительные к барбитуратам, более широко распространены в мозге, чем бензодиазепиновые. В отличие от бензодиазепинов, увеличивающих аффинность ГАМКергического рецептора к агонисту, барбитураты увеличивают время открытого состояния и проводимость каналов ГАМКергического рецептора. Кроме бензодиазепинов и барбитуратов специфичное модулирующее действие на ГАМКА-рецепторы оказывают нейростероиды и соли цинка [50].
Borghese et al. (2017) изучали новый селективный ПАМ ГАМКА-рецепторов DCUK-OEt – производное аминохинолина. Механизм действия данного соединения был подтвержден радиолигандным методом, также производился поиск сайта связывания с помощью молекулярного моделирования. Авторами было отмечено, что наибольший антифобический эффект DCUK-OEt может быть вызван при взаимодействии соединения с рецепторами ГАМК, содержащими либо γ2-, либо δ-субъединицы вместе с α1- и β3-субъединицами; это комбинации субъединиц – α1β3γ2 и α1β3δ. Для соединения DCUK-OEt не было выявлено взаимодействий с другими рецепторами, транспортерами и ионными каналами [51].
Akbar et al. (2017) были открыты свойства флавоноидов как позитивных модуляторов (ПАМ) ГАМКА-рецепторов, к тому же лишенных побочных эффектов бензодиазепинов. По результатам радиолигандного исследования, молекулярный связующий сайт соединения 6-MeOF (6-метоксифлаванон) отличается от других известных флавоноидных модуляторов ГАМК-рецепторов: он действует на γ-субъединицы, нечувствительные к антагонизму флумазенила, следовательно, 6-MeOF – перспективное анксиолитическое соединение. Авторы провели анализ химической формулы изучаемого соединения и пришли к заключению, что положение 6 ядра флавонов активно даже без какой-либо замены и придает этой группе анксиолитические свойства, тогда как само ядро считается неактивным в отношении анксиолизиса. Однако в недавних исследованиях установлено, что замена в положении 6 на флаваноновом ядре приводит к увеличению анксиолитических свойств этой группы. Активность вещества 6-MeOF изучали in vivo на моделях антифобического действия при внутрибрюшинном введении, исследуемое вещество вводили в дозах 10–100 мг/кг. Анксиолитический эффект был сопоставим с препаратом сравнения диазепамом (2 мг/кг) [52]. Биораспределение 6-MeOF оценивали в плазме, коре головного мозга и миндалевидном теле. Анализ фармакокинетического профиля показал, что 6-MeOF способно проникать через гематоэнцефалический барьер.
Guerrini et al. описаны новые производные бензотриазина (5b–12b), для которых была показана способность вытеснять [Н3]-флумазенил из бензодиазепинового сайта связывания. Вещества были синтезированы из исходного соединения этилпиразоло[1,5-a]хиназолин-3-карбоксилата, показавшего значительное сродство с ГАМКА. Было выяснено, что соединения аффинны к α2- и α3-субъединицам и действуют как α2/α3-GABAА-R-положительные аллостерические модуляторы. Химическую модификацию осуществляли либо введением метоксигруппы в положение 8, либо трансформацией этоксикарбонильной функциональной группы в арильную (гетеро) алкильную сложноэфирную группу. При изучении нейропсихотропных эффектов in vivo была показана наибольшая активность соединения (12b) среди изучаемых соединений. Данное вещество не вызывало нейротоксических эффектов и не изменяло моторику и координацию движений у исследуемых животных [53].
Описанное в работе Artelsmair et al. (2018) соединение AZD7325, производное N-пропилциннолина, – высокоаффинный селективный модулятор системы рецепторов GABAA с дифференцированными связывающими и модулирующими свойствами, зависящими от конкретного подтипа GABAA. Аффинность высока для GABAA α1-, α2- и α3-субъединиц, но не для GABAA α5-субъединицы, что ограничивает негативное влияние AZD7325 на когнитивные функции. AZD7325 потенцировало действие диазепама на α2- и α3-, но не на α1- и α5‑субъединицы, ограничивая его седативный эффект. Соединение действует как полный антагонист золпидема на уровне α1-субъединицы, что согласуется с отсутствием седативного эффекта. AZD7325 также усиливал нативные ответы ГАМК в нейронах, полученных из префронтальной коры крыс, и продемонстрировал эффективность в ряде моделей тревожности in vivo [54, 55].
Изучаемое Nickolls et al. производное имидазопиридазина PF-06372865 выступает ПАМ для GABAA, проявляя селективность к α2- и α3-субъединицам, ассоциированным с анальгетическим и противотревожным действием, и к α5-субъединице, ответственной за функционирование памяти, однако не воздействует на α1-субъединицу, влияние на которую обусловливает седативный эффект [56].
Положительные аллостерические модуляторы (ПАМ) GABAB-рецепторов. γ-Аминомасляная кислота (ГАМК), главный ингибирующий нейротрансмиттер, опосредует свое действие через различные рецепторные системы – ионотропные и метаботропные рецепторы GABAA/C и GABAB соответственно [57]. В то время как GABAA/C-рецепторы образуют хлоридные каналы и быстро опосредуют синаптическое ингибирование, рецептор GABAB ассоциирован с GPCR, впоследствии взаимодействующим с нуклеотидом гуанином, и, в зависимости от локализации, опосредует пресинаптическое или медленное постсинаптическое ингибирование посредством модуляции Ca2+- и K+-каналов [58]. Значительный прогресс в понимании физиологической роли GABAB-рецептора и его места в патофизиологическом каскаде некоторых расстройств связан с открытием его агониста – баклофена (β-хлорфенил-ГАМК) [59]. Введенный в клиническую практику как миорелаксант центрального действия более четырех десятилетий назад, баклофен стал одним из основных лекарственных средств в терапии спастичности, хронического и изнурительного состояния, а также состояний, характеризующихся значительным увеличением тонуса и ригидности мышц, обычно наблюдаемых у пациентов с рассеянным склерозом или травмами спинного мозга. Однако баклофен характеризуется слабым проникновением через гематоэнцефалический барьер, коротким периодом действия и может вызывать различные побочные эффекты, включая седацию, головокружение, тошноту, мышечную слабость и умственную путаницу [60]. Эти ограничения исключают более широкое использование баклофена в коррекции множества других заболеваний, несмотря на его многообещающие эффекты в серии клинических исследований: препарат снижает симптомы тревоги у пациентов с ПТСР (посттравматическое стрессовое расстройство), паническими атаками и синдромом отмены алкоголя. ПАМ GABAB – альтернатива прямым агонистам рецептора [61] и поэтому представляют собой перспективный терапевтический подход для лечения расстройств, к которым баклофен неприменим. В отличие от аллостерических агонистов, активирующих рецептор постоянно, действие ПАМ включает повышение активности рецепторов только в синапсах, где высвобождается ГАМК. ПАМ GABAB-рецептора – многообещающая альтернатива прямых агонистов рецептора в качестве терапевтического подхода для лечения аддикции, хронической боли, тревоги и эпилепсии.
В статье Kalinichev et al. (2016) приведены данные по изучению транквилизирующей активности соединения ADX71441, производного триазина. Механизм действия вещества изучали с использованием клеток линии НЕК293, авторы сделали заключение о связи ADX71441 с позитивным аллостерическим модулированием GABAB-рецепторов [62]. По результатам исследований, проведенных на противотревожных моделях (0.3–3.0 мг/кг, per os), соединение ADX71441 – перспективно для лечения тревожных состояний и обсессивно-компульсивного расстройства. К тому же, в исследованиях миорелаксирующей активности было установлено, что вещество не вызывает расслабления мышц даже в дозе 10 мг/кг.
Porcu et al. (2016) исследовали аффинность связывания соединения SSD114 с ГАМКБ-рецепторами на препаратах мозга крыс [63]. SSD114 – производное пиримидина. Молекула содержит центральное плоское шестичленное кольцо с заместителями различной полярности. Как предполагают авторы, вторичные амины могут быть ответственны за связывание водорода с рецептором, тогда как плоская ароматическая система может взаимодействовать с гидрофобным фрагментом рецептора. По данным литературы, соединение SSD114 проявляло фармакологическую активность в отношении GABAB ПАМ. Показано, что ГАМКергическое влияние изучаемого соединения полностью отменяется при использовании антагониста GABAB-рецепторов CGP54626. Также авторами было отмечено, что SSD114 ведет себя как специфический и селективный рецептор GABAB ПАМ in vitro. Увеличение концентрации SSD114 вызывало зависящее от концентрации потенцирование стимулирующих эффектов, индуцированных ГАМК (1–20 мкМ), со значениями EC50 в низком диапазоне концентраций. Более того, SSD114 усиливал ответные реакции GABAB-рецепторов в моделях in vivo с баклофеном. На основании результатов данного эксперимента установлено, что предварительная обработка самыми неэффективными дозами SSD114 синергически увеличивает седативный/гипнотический эффект субпороговой дозы баклофена. Все индуцированные баклофеном параметры – седация и гипнотическое состояние – были заметно усилены предварительной обработкой SSD114. На основании приведенных данных можно считать, что SSD114 ведет себя как GABAB ПАМ в анализе in vivo.
СЕЛЕКТИВНЫЙ ИНГИБИТОР ТРАНСПОРТЕРА ГАМК GAT1
В настоящее время существует ряд стратегий, позволяющих увеличить ГАМКергическую активность, включающих прямой агонизм для ГАМКергических рецепторов, ингибирование ГАМК, катаболизм или его обратный захват из синаптической щели. На сегодняшний день обнаружено пять транспортных средств ГАМК (GAT), один из них – везикулярный транспортер ГАМК [64]. Другие четыре (GAT1–4) – мембранные белки, принадлежащие семейству генов-носителей (SLC6A) Na+-независимых транспортеров [65]. В связи с их ключевой ролью в регуляции концентрации ГАМК в головном мозге, GAT (в частности, GAT1) стали перспективной мишенью для создания новых лекарственных средств для лечения заболеваний ЦНС [66]. Тиагабин представляет производное изоникотиновой кислоты, выступающей высокоселективным ингибитором GAT1 [67]. Этот препарат блокирует обратный нейрональный захват ГАМК, что приводит к увеличению концентрации этого нейромедиатора в синаптической щели, увеличивающего ток ионов хлора через клеточные мембраны. В настоящее время тиагабин реализуется как вспомогательное средство при лечении тревожных расстройств.
Salat et al. (2016) показали анксиолитический и антидепрессивный эффекты соединения DDPM-2571 – производного 1,2,5,6-тетрагидропиридин-3-карбоновой кислоты. Показатели, полученные при исследовании вещества на животных моделях тревоги и депрессии в дозе 5 мг/кг, статистически достоверно превышали показатели препарата сравнения диазепама [68, 69].
КАТЕХОЛАМИНЕРГИЧЕСКАЯ И СЕРОТОНИНЕРГИЧЕСКАЯ СИСТЕМЫ
Дофаминовые рецепторы. В стрессовых ситуациях происходит активация дофаминергической иннервации и снижение уровня дофамина в миндалине. Дофаминовые рецепторы относятся к родопсиноподобным аминергическим G-белковым рецепторам (GPCRs) и играют главенствующую роль в центральной нервной системе. Существует пять подтипов дофаминовых рецепторов, которые можно разделить на две группы: D1-подобные (D1 и D5) и D2-подобные (D2, D3 и D4) – в зависимости от активации или ингибирования вторичного мессенджера, циклического аденозинмонофосфата (цАМФ) [70]. Найдено множество литературных данных об анксиогенном эффекте лигандов дофаминовых рецепторов, в частности 2-го подтипа, либо об ослаблении ими проявлений тревоги [71].
Rice et al. (2018) изучали соединение YQA-14 [72], производное бензоксазола, новый селективный антагонист дофаминовых D3-рецепторов. Вещество представляется перспективным в отношении терапии ПТСР. В методиках in vivo соединение изучали в дозах 3.12–12.5 мг/кг при внутрижелудочном введении. Исследователями была выбрана концепция выработки у животных длительного стресса (modified single prolonged stress) путем продолжительного совокупного применения нескольких поведенческих тестов (“приподнятый крестообразный лабиринт”, “открытое поле”, “принудительное плавание” по Porsolt). В результате полученных данных было выяснено, что соединение YQA-14 значительно снижает проявления тревожно-депрессивного характера у исследуемых животных.
Серотониновые рецепторы. Серотонинергическая система остается перспективной мишенью для создания новых анксиолитиков, поскольку 5-гидрокситриптамин играет важную роль в регуляции многих физиологических процессов, включая эмоции, циркадные ритмы и аппетит [73]. Существует семь семейств серотониновых рецепторов (5-НТ1–7), реализующих различные фармакологические эффекты. Было выявлено, что анксиолитический эффект развивается при стимулировании 5-HT2B- или блокировании 5-HT2А-, 5-HT3- и 5-HT5А-рецепторов. Среди 5-HT-рецепторов подтип 5-HT1А оказывает более глубокое воздействие на контроль тревоги и депрессии, влияя на серотонинергическую нейротрансмиссию в нескольких областях мозга. В соответствии с широким терапевтическим потенциалом рецепторов 5-HT1А были разработаны различные препараты, наиболее известные из которых – азапироны – буспирон и тандоспирон, используемые для коррекции тревоги, обеспечивающие неселективную и неаддитивную терапевтическую альтернативу использованию бензодиазепинов.
Была показана роль 5-НТ2С в формировании тревожного поведения у грызунов [74]. Применение антагониста 5-НТ2С под шифром SB242084 приводило к развитию анксиолитического эффекта в ряде поведенческих тестов [75]. Под действием соединения S32212, обратного агониста 5-НТ2С, зарегистрировано противотревожное действие в тесте конфликтной ситуации по Vogel [76].
5-НТ3-рецепторы – пентамерные лиганд-ионные каналы, принадлежащие к суперсемейству CYS-петлевых рецепторов. Ряд доклинических исследований показал, что антагонисты 5-HT3-рецептора играют значительную роль в лечении психических расстройств, таких как депрессия и тревога [77, 78].
По литературным источникам [79, 80], активация рецепторов 5-НТ6 и/или 5-НТ7 может оказывать положительное влияние на эффективность и широту терапевтического спектра применяемых в настоящее время антидепрессантов. Рецепторы 5-НТ6 и 5-НТ7 положительно связаны с цАМФ (система вторичных мессенджеров аденилатциклазы) и широко распространены в кортиколимбических областях (полосатом теле, коре, обонятельном бугорке, прилежащем ядре, в частности рецептор 5-НТ6, гиппокампе, гипоталамусе и миндалине), участвующих в контроле настроения и эмоций.
В статье Brito et al. (2017) приводятся данные по изучению транквилизирующей активности соединения LQFM180, производного пиперазина. В настоящее время для этого соединения показан полимодальный тип действия с анксиолитической и антидепрессивной активностями. Химическая структура LQFM180 содержит базовую часть производных пиперазина с центральной фармакологической активностью и бутилированный гидрокситолуол – соединение с выраженными антиоксидантными свойствами. Рациональность введения данного радикала обусловлена когнитивными нарушениями, связанными с окислительным стрессом. Авторами статьи была доказана вовлеченность серотонинергической системы в реализацию анксиолитического эффекта субстанции при использовании фармакологических антагонистов – NAN-190 и PCPA. Таким образом, анксиолитическая активность LQFM180 развивается в том числе по серотонинергическому пути. Эксперименты in vivo проводили на антифобических моделях, животным каждой группы вводили изучаемое вещество перорально в дозах 9.4–75.2 мг/кг. Показатели группы соединения LQFM180 превышали данные группы препарата сравнения диазепама (5 мг/кг) в проведенных методиках (тест “приподнятый крестообразный лабиринт”, тест пассивного избегания со скополамином). Исследование антидепрессивной активности продолжили с использованием адреноблокаторов празозина и пропранолола, дофаминоблокаторов галоперидола и сульпирида, а также PCPA и AMPT для изучения моноаминов. Таким образом, антидепрессивная активность соединения LQFM180 включает серотонинергический, дофаминергический и норадренергический пути [81].
В статье Pytka et al. (2018) изложены результаты исследования производного 2-метоксифенилпиперазина под шифром HBK-17, для которого показана высокая аффинность к 5-НТ1А- и 5-НТ7-рецепторам. Противотревожная активность изучена на моделях “четыре пластины” и “приподнятый крестообразный лабиринт”. Отмечено преимущественное влияние соединения на β-аррестиновый путь после связывания с 5-НТ1А [82].
В статье Kondej et al. (2016) приводятся данные о новом производном хинолинона – соединении D2AAK1. Арилпиперазины и, в меньшей степени, арилпиперидины и арилтетрагидропиридины были зарегистрированы как привилегированные структуры для аминергических рецепторов, сопряженных с G-белком, в частности серотонинового и дофаминового. Кроме того, арилтетрагидропиридины известны как лиганды других мишеней, например, σ-рецепторов, а также рецепторов, активированных пролифераторами пероксисом (PPAR, принадлежащие к семейству ядерных рецепторов), агонистов с антидиабетической активностью и MAO-B. Для соединения D2AAK1 показан политаргетный механизм действия: D1-, D3-, 5-HT1А- и 5-HT2А-рецепторный, обусловливающий антипсихотический и анксиолитический эффекты. Изучение антифобической активности in vivo проводили в дозе 100 мг/кг внутрибрюшинно, соединение достоверно повышало уровень противотревожной активности [83]. Результаты исследований D2AAK1 на животных показывают также, что для этого соединения характерны антипсихотические свойства, поскольку оно снижает гиперактивность, вызванную амфетамином в модели на мышах, представляющей классический тест для потенциальных нейролептиков. Более того, соединение D2AAK1 проявляло анксиолитические свойства, характерные для антипсихотиков второго поколения, таких как рисперидон и зипразидон.
Partyka et al. (2019) описано соединение ADN-1184 – производное арилсульфаниламида с 5‑HT6/5-HT7/5-HT2А/D2-рецепторной активностями [84]. В исследованиях in vivo авторами было доказано, что соединение в дозе 0.3 мг/кг проявляет статистически значимую анксиолитическую и антидепрессивную активности. Через 1 ч после введения вещества производили измерение уровня серотонина и его метаболитов во фронтальной коре методом высокоэффективной жидкостной хроматографии. Изучаемое вещество не оказывало влияния на метаболизм серотонина во фронтальной коре.
Łażewska et al. (2018) изучали производное пиримидина AVN-492. В результате исследования 69 мишеней, включающих рецепторы, ионные каналы, транспортеры нейромедиатиров и ферменты, был сделан вывод о вовлечении 5-НТ6-рецепторов в реализацию противотревожного эффекта. Исследование зависимости структуры и активности совместно с молекулярным анализом подтвердило преимущественное взаимодействие с 5-HT7 для стерически обремененных заместителей в положении 2 арилоксильного фрагмента (изопропил, трет-бутил, циклопентил и фенил). Кроме того, замена пиперидинового фрагмента на 8-азабициклооктан (тропан) приводила к активации 5-НТ7-лигандов и повышению селективности к рецепторам 5-HT1А. Наконец, авторами была подтверждена большая предпочтительность для взаимодействия с сульфонамидной группировкой 5-НТ7-рецептора, нежели для амидных и мочевинных остатков. Нейропсихотропную активность соединения изучали in vivo после внутрижелудочного введения AVN-492 в дозах 0.05 и 0.2 мг/кг на анксиолитических и антидепрессивных моделях [85]. В результате исследования были установлены статистически значимые нейропсихотропные эффекты в дозах, меньших или сопоставимых с циталопрамом и диазепамом, использованных в качестве препаратов сравнения.
Группой исследователей Słoczyńska et al. (2018) открыто производное бензенсульфонамида PZ-1150 с 5-НТ7-антагонистическими свойствами, проявляющее антидепрессивный и анксиолитический эффекты [86].
Соединение F15599 впервые было описано Assié et al. (2010) в качестве агониста серотониновых рецепторов с наибольшей аффинностью к 5‑НТ1А-подтипу [87]. Данному производному пиперидина свойственна антидепрессивная активность. Еще одно производное пиперидина, описанное Jastrzbska-Wiesek et al., – соединение F13714. Эксперименты in vivo проводили на анксиолитических и антидепрессивных моделях [88], и был отмечен анксиолитический потенциал изучаемого соединения.
В исследовании Azevedo et al. (2019) установлена анксиолитическая активность соединения ACH-000029, производного хиназолина, селективного агониста 5-НТ1А-, 5-НТ1D-рецепторов и антагониста 5-НТ2А-серотониновых, а также α1А-, α1B- и α1D-адренергических рецепторов, с хорошей селективностью к другим GPCR. Продемонстрирована высокая степень проникновения соединения через ГЭБ. Анксиолитический эффект наблюдали в моделях “закапывание шариков” и “темная/светлая камера” в диапазонах доз 8–32 и 16–30 мг/кг. Антифобическая активность была сопоставима с наблюдаемой для ингибиторов обратного захвата серотонина (пароксетин и флуоксетин) и бензодиазепинов (алпразолам, диазепам и клобазам). На основании анализа экспрессии c‑Fos в головном мозге после перорального введения ACH-000029 установлено, что эффект соединения тесно связан с областями обработки сигналов окружающей среды и тревожного поведения: миндалиной, паравентрикулярным ядром таламуса, паллидумом, ядром ложа терминальной полоски и голубым пятном. При исследовании безопасности ACH-000029 in vivo в функциональной наблюдательной батарее (functional observational battery) до 50 мг/кг и в абстинентном тесте до 30 мг/кг дважды в день в течение 20 дней отклонений обнаружено не было [89].
В исследовании Ferreira et al. (2020) показан антагонизм соединения PAAPMNBA (производного фенилпропенона) с серотониновыми рецепторами 5-НТ1, 5-НТ2А/2С и 5-НТ3А/3В. Соединение вводили взрослым особям Danio rerio в дозах 4, 12 и 40 мг/кг внутрибрюшинно, и его анксиолитическая активность была выявлена в тестах “открытое поле” и “темная/светлая камера”. Соединение малотоксично, а также уменьшает локомоцию D. rerio in vivo [90].
Группой ученых под руководством Faye (2020) исследован агонист 5-НТ4-подтипа серотониновых рецепторов под шифром RS67333, производное пиперидина. Его противотревожная активность выявлена в ряде тестов in vivo в сравнении с диазепамом. Соединение вводили внутрибрюшинно в дозе 1.5 мг/кг либо под медиальную префронтальную кору мышей в дозе 0.5 мг. Установлено, что активация 5-НТ4 на терминалях аксонов медиальной префронтальной коры, связанных с дорсальными ядрами шва, обусловливает развитие быстрого анксиолитического действия [91].
Kurczab et al. (2018) установлены плейотропные эффекты агонистов 5-НТ6-серотониновых рецепторов, соединений (18) и (26), производных арилгидантоин-1,3,5-триазина – анксиолитический, антидепрессивный, метаболический. Также авторами были отмечены и другие активности для изучаемых субстанций помимо серотонинергической. Соединения, содержащие галогеновые заместители (9, 10, 16, 17, 23, 24, 30), были определены как наиболее активные против фермента MAO-A (IC50 = 6.25–37.24 мкМ). В результате изучения веществ на моделях in vivo было установлен пик нейротропного действия соединения (26) в дозе 3 мг/кг [92]. Интерес исследователей вызвали соединения (9), (10) и (17), проявляющие умеренную анксиолитическую активность.
Аффинность соединения MF-8, производного метилгидантоина, изучалась Kucwaj-Brysz еt al. (2018) [93] in vitro на клеточной линии HEK293, экспрессирующей 5-HT1A-, 5-HT7B- и D2L-рецепторы. Наибольшее связывание наблюдалось с 5-НТ7-рецепторами. Результаты исследований молекулярного моделирования совместно с кристаллографическим анализом обеспечили более глубокое понимание лиганд-рецепторного взаимодействия. Молекулярно-динамическое моделирование подтвердило стабильность комплекса белок–лиганд. Авторы пришли к выводу о влиянии гидантоиновой части молекулы на проявление ее нейропсихотропных эффектов [94].
Ran et al. (2018) изучали производное пиперидина – YL-0919, частичного агониста 5-НТ1А-серотониновых рецепторов и селективного ингибитора обратного захвата серотонина [95]. Экспериментальную часть исследований проводили на животных моделях тревоги и депрессии. Получены перспективные данные для дальнейшего изучения нейропсихотропного профиля вещества. Кроме того, на крысах был проведен дендритный анализ, и было установлено увеличение под действием соединения YL-0919 образования дендритов по длине и числу в области гиппокампа. Таким образом, соединение YL-0919 характеризуется терапевтическим потенциалом в отношении поведенческих расстройств, связанных с морфологической деструкцией дендритного волокна.
Bhatt et al. (2016) было описано производное хиноксалина (6n) в качестве потенциального антагониста 5-НТ3-рецепторов [96]. Исследования проводили in vivo на большом количестве нейропсихотропных тестов per os в объеме 5 мл/кг в течение 14 дней. Соединение проявляло умеренную активность, сопоставимую с препаратом сравнения пароксетином.
Spasov et al. (2016) описали влияние производных имидазобензимидазола на 2А-подтип серотониновых рецепторов. Для наиболее активного соединения RU-476 с помощью радиолигандного метода определяли способность связываться с 5-НТ2А-рецепторами [97, 98]. Авторами было показано наличие нейропсихотропной активности у производного бензимидазола RU-476 in vivo при однократном и хроническом введении на животных поведенческих моделях. Изучаемое соединение в дозе 0.5 мг/кг статистически значимо проявляло анксиолитическую активность [99].
ИНГИБИТОРЫ МОНОАМИНОКСИДАЗЫ (ИМАО)
Моноаминоксидаза (МАО) представляет собой FAD-зависимую аминоксидазу, расположенную на наружной мембране митохондрий головного мозга, печени, слизистой оболочки кишечника и некоторых других органов и тканей, катализирующую окислительное дезаминирование биогенных аминов в альдегиды с радикальными и полярными нуклеофильными механизмами и выполняющую существенную физиологическую роль в центральной нервной системе и периферических органах. Существуют два изомера, MAO-A и MAO-B, которые кодируются различными генами и отличаются чувствительностью к избирательным ингибиторам [100]. MAO-A предпочтительно катализирует окисление серотонина, норэпинефрина, тирамина и дофамина. Она играет важную роль в психических расстройствах, таких как биполярная депрессия и атипичное поведение с повышенным стрессом [101], в то время как MAO-B селективно катализирует окисление фенилэтиламина и бензиламина, участвует в нейродегенеративных процессах [102]. Надлежащее функционирование синаптических нейропередач обусловлено быстрым разрушением биогенных аминов, имеющих критически важное значение для регулирования эмоционального поведения и других функций мозга. Нежелательное повышение в плазме концентрации МАО-субстратов и продуктов реакций может вызывать серьезные проблемы психического здоровья [103]. В настоящее время существует большое количество препаратов-ингибиторов моноаминоксидазы, среди которых выделяют неселективные (прониазид, ниаламид, фенелзин, применяемые при различных панических и депрессивных состояниях, но гепатотоксичные) и селективные (обратимые ингибиторы МАО-А – моклобемид, пирлиндол, метралиндол, применяемые при терапии депрессивных и фобических расстройств, и необратимые ингибиторы МАО-В – селегилин и разагилин, в основном применяемые в качестве противопаркинсонических средств, но, согласно ряду литературных источников, снижающие и различные тревожно-фобические состояния [104]).
Koc et al. (2014) изучили 28 новых производных пиразола, среди которых наиболее активными оказались соединения (9), (10) и (17). Активность в отношении моноаминоксидаз показана с помощью молекулярного докинга. Были проведены биохимические исследования по определению ингибирующей активности МАО-А и МАО-В для синтезированных соединений с использованием изоформ МАО печени крыс. Установлено, что соединения в основном селективно ингибируют фермент МАО-А, среди них соединение (9) – наиболее активно (IC50 = 6.25 мкМ). Отмечено, что наличие атома галогена (Cl и Br) на фенильном кольце обусловливает лучшую ингибирующую активность МАО-А. Тем не менее, ингибирующее свойство бромидзамещенных соединений было заметно ниже, чем у хлорзамещенных, к тому же для соединений с тиокарбамоильными заместителями также происходило снижение ингибирования активности МАО-А. Авторами была показана умеренная анксиолитическая и антидепрессивная активность соединений (9), (10) и (17) в тестах in vivo при интраперитонеальном введении в дозе 100 мг/кг [105].
Соединения PFC-1–PFC-16 – производные пиразолина, изучаемые Upadhyay et al. [106]. Соединения PFC-3 и PFC-12 были выбраны как наиболее активные среди всех синтезированных производных. Анализ химической структуры веществ показал, что замещение хлорбензолсульфонилом в положении N1 благоприятно влияет на выраженность анксиолитического и антидепрессивного действия, замещение 2-гидроксифенилом в 3-й позиции и 4-бензилоксифенилом в 5-м положении пиразолинового ядра играет важную роль в развитии антидепрессивного эффекта соединения PFC-3, а присоединение гидрофобного радикала антрацен-9-ил в третьей позиции и замещение метилфенилом в 5-м положении увеличило анксиолитическую активность соединения PFC-12. Вещества демонстрировали значительную противотревожную и антидепрессивную активность на различных поведенческих моделях in vivo. Результаты дозозависимых фармакологических исследований продемонстрировали, что синтезированные производные 1,3,5-тризамещенные-2-пиразолины имеют широкий диапазон анксиолитической и антидепрессивной активности.
ИНГИБИТОРЫ ТРАНСЛОКАТОРНОГО ПРОТЕИНА TSPO
Транслокаторный белок (18 кДа) (TSPO), ранее называемый периферическим бензодиазепиновым рецептором (PBR), в последние годы активно изучается в патофизиологии ПТСР, поскольку отличается нейростероидным эффектом, утверждая гипотезу о том, что для селективных лигандов TSPO свойственен потенциал в лечении ПТСР-расстройств. Транслокаторный белок располагается между наружной и внутренней митохондриальными мембранами. Функция данного белка связана с переносом холестерола и участием в стероидогенезе, в частности в нейростероидогенезе. Есть данные, подтверждающие связь экспрессии TSPO и психических расстройств [16]. Стероидные гормоны модулируют экспрессию TSPO и активность их в нейронах. При невропатологических состояниях (инсульт, болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, множественный склероз, боковой амиотрофический склероз), травмах и воспалении экспрессия TSPO усилена в реактивной микроглие и астроцитах, поэтому лиганды TSPO обычно рассматривают как чувствительные биомаркеры визуализации головного мозга для какого-либо нейроочага поражения. Лиганды TSPO характеризуются анксиолитическим и антидепрессивным эффектом без очевидных побочных действий обычных бензодиазепинов. К представителям данного класса относятся бензодиазепиновые соединения, например, Ro5-4864 (4-хлородиазепам), применяемый для лечения психоподобных нарушений, эффективный также в отношении патологий, связанных с миелиновой дегенерацией. Другой лекарственный препарат из группы ингибиторов транслокаторного протеина TSPO – эмапунил, производное оксопурина. Благодаря эффективному стимулированию производства нейростероидов, таких как прегненолон, эмапунил выступает быстродействующим анксиолитическим препаратом с менее серьезными побочными эффектами, чем бензодиазепины [17].
Li et al. изучали соединение ZBD-2 – производное пурина, лиганд для транслокаторного протеина, с присущими анксиолитической, антидепрессивной и анальгизирующей активностями. Также для субстанции было показано нейропротективное действие. Эксперименты in vivo проводили на доклинических нейропсихотропных моделях в дозах 0.75–3.0 мг/кг при пероральном введении. Соединение позиционируется как препарат для лечения послеродовой депрессии женщин [107].
В ранее проведенных Zhang et al. исследованиях с антагонистом PK11195 была отмечена высокая аффинность к транслокаторному белку соединения YL-IPA08, производного пиридина [108]. Для соединения показано относительно высокое сродство к TSPO (IC50 = 0.23 нМ). Было обнаружено, что для YL-IPA08 характерны заметные антидепрессивные и анксиолитические эффекты на нескольких животных моделях при хроническом введении в дозах 3–6 мг/кг, но не вызывает побочных эффектов, обычно связанных с классическими бензодиазепинами, таких как миорелаксация и когнитивные расстройства. Авторы позиционируют соединение как перспективное средство в терапии ПТСР [109].
В НИИ фармакологии им. В.В. Закусова в 2018 г. изучено производное пирроло[1,2-а]пиразина под шифром GML-1, лиганда TSPO с анксиолитическим действием, показанным в тесте “приподнятый крестообразный лабиринт” на крысах в дозе 1 мг/кг. Установлено, что величина анксиолитического эффекта GML-1 не коррелирует с его концентрацией в плазме крови [110, 111].
ГЛУТАМАТНЫЕ РЕЦЕПТОРЫ
Глутаминовая кислота – нейромедиаторная аминокислота, одна из важных представителей класса “возбуждающих аминокислот” [112]. Связывание глутамата со специфическими рецепторами нейронов приводит к возбуждению последних. Для нормального функционирования необходимо правильное соотношение активностей тормозящей ГАМКергической и возбуждающей глутаматергической систем. Гиперактивация глутаматергической системы может приводить к тревожным расстройствам, поэтому остается актуальным поиск новых веществ, влияющих на ионотропные и метаботропные глутаматные рецепторы. Отрицательные аллостерические модуляторы (ОАМ) метаботропного глутаматного рецептора 5 (mGluR5) выступают кандидатами в лекарственные средства для лечения ряда психических заболеваний, включая тревогу и депрессию [113]. Метаботропные глутаматные рецепторы (mGluRs) составляют класс C рецепторов, связанных с G-белком (GPCR), и выполняют ключевую роль в глутаматергической сигнализации. Этот класс (GPCRs) состоит из трех подклассов, включая группы I (mGluR1 и mGluR5), II (mGluR2 и mGluR3) и III (mGluR4, mGluR6, mGluR7 и mGluR8) [114]. Группа I mGluRs соединена с Gq и расположена главным образом постсинаптически, их активация увеличивает NMDA-рецепторную активность и возбудимость нейронов. Ингибирование mGluR5, в основном экспрессирующегося в полосатом теле, гиппокампе, амигдале и лобной коре головного мозга, – перспективный метод лечения ряда психических заболеваний, в том числе тревожных и депрессивных расстройств [115]. В связи с косвенным усилением активности NMDA, активаторы mGluR5 могут быть эффективными при психических расстройствах, фобиях, наркомании, шизофрении и когнитивных нарушениях. Поскольку сайт ортостерического глутамата – высококонсервативный для всех mGluRs, большинство программ обнаружения направлено на аллостерические модуляторы, которые селективны не только между подклассами, но и внутри подклассов [116]. Для mGluR выделяют хемотипы отрицательных и положительных аллостерических модуляторов (ОАМ и ПАМ). Ранее изученные ОАМ mGluR5 представляют собой с химической точки зрения стержнеобразные соединения, в которых концевые кольца обычно соединялись ацетиленовой группой.
В работе Galambos et al. описан пошаговый синтез группы производных 4-фенил-3-арилсульфохинолинов, основными этапами которого стали стабилизация и оптимизация хинолиновых ядер путем введения фторированных и хлорпроизводных заместителей в положение 1 и метоксигрупп в положениях 3 и 4. Авторы приводят расчеты докинга, показавшие, что вещество-лидер – соединение (25) – отличается высоким сродством к аллостерическому сайту связывания нативных рецепторов (крысы и человека), а также рекомбинантных рецепторов человека mGluR5 и проявляет более чем 50-кратную селективность по сравнению с нативными рецепторами mGluR1. В анксиолитических моделях in vivo соединение (25) было исследовано в диапазоне доз 0.5−10.0 мг/кг при пероральном способе введения. Показано, что соединение (25) обладает антифобическим действием даже в высоких концентрациях и не оказывает побочных эффектов. Также противотревожная активность соединения (25) была продемонстрирована в тесте ультразвуковой вокализации и контекстуальном тесте страха (fear conditioning). В тесте ультразвуковой вокализации соединение (25) значительно и дозозависимо снижало ультразвуковую вокализацию, а в контекстуальном тесте страха – значительно и дозозависимо уменьшало число замираний исследуемых животных [117].
Reis et al. (2017) описано производное хинолина 4-PSQ. Авторами делается предположение о вовлеченности глутаматергической системы в реализацию транквилизирующего эффекта, поскольку соединение 4-PSQ ингибирует захват [Н3]-глутамата [118]. Кроме того, были проведены дополнительные исследования, подтверждающие вовлеченность глутамата в анксиолитический эффект вещества на каинатовой модели, оценена эффективность ингибирования соединением 4-PSQ каинат-индуцированного тревожного поведения. Авторы сообщают о снижении проявления страха у исследуемых животных. Анксиолитическая активность in vivo была доказана на нескольких моделях в дозировках 5–50 мг/кг при пероральном введении.
ОПИОИДНЫЕ РЕЦЕПТОРЫ
Κ-, μ- и δ-опиоидные рецепторы, принадлежащие к подсемейству родопсинов семейства G‑связанных рецепторов (GPCR), широко распространены во всей центральной и периферической нервной системе [20]. Помимо модуляции боли и зависимости, эти опиоидные рецепторы и их эндогенные опиоидные пептиды также вовлечены в регулирование эмоциональных состояний [119]. По результатам проведенных исследований с использованием агонистов δ-рецепторов показано, что активация δ-рецептора приводит к возникновению анксиолитического и антидепрессивного эффектов [120]. Роль μ-рецептора в генерации настроения, по ряду литературных источников неоднозначна, поскольку при фармакологической блокаде μ-рецептора наблюдается депрессивное поведение у грызунов, тогда как у мышей с μ-рецепторным нокаутом проявляются антидепрессивные и анксиолитические эффекты. Также κ-рецептор и эндогенный лиганд динорфин участвуют в регуляции эмоций [121]. Было показано, что κ-рецептор индуцирует анксиогенные, анксиолитические, депрессивные и антидепрессивные эффекты у разных животных в поведенческих моделях, тогда как антагонисты κ-рецепторов оказывают последовательные анксиолитические и антидепрессивные эффекты [122]. К тому же, по некоторым данным, была продемонстрирована перспективность комбинации κ/μ-опиоидов для регулирования эмоций и лечения наркотической зависимости [123].
Wang et al. была изучена анксиолитическая и антидепрессивная активность соединения ATPM-ET – производного тиазола (3-N-этиламинотиазоло[5,4-b]-N-циклопропилметилморфинана гидрохлорид). Авторами была доказана анксиолитическая и антидепрессивная активность соединения ATPM-ET на моделях in vivo после подкожного введения субстанции в дозах 1 и 2 мг/кг. При совместном введении с κ-антагонистом nor-BNI наблюдалось снижение анксиолитического эффекта вещества, что может свидетельствовать о κ-рецепторном механизме действия [124]. Проведено исследование в тесте отвращения с бупренорфином, антагонистом κ- и частичным агонистом μ-рецепторов, чтобы определить влияние ATPM-ET в эмоциональных реакциях. Показано, что ATPM-ET (2 мг/кг) не индуцирует негативных эмоций у мышей, соединение рассматривается как антагонист κ-рецепторов и частичный агонист μ-опиоидных рецепторов.
В работе Yamada et al. было изучено соединение KNT-127 – производное нафтоакридина. В результате исследования взаимодействия вещества с антагонистом d-опиоидного рецептора (DOP) налтриндола авторы сделали предположение об агонистическом действии KNT-127 на DOP. В тестах in vivo вещество вводили мышам подкожно в диапазоне доз 1, 3 и 10 мг/кг. Авторами подчеркнуты выраженные анксиолитические свойства KNT-127 в дозе 10 мг/кг, при этом эффекты изучаемого вещества были сходны с диазепамом, а побочных эффектов бензодиазепиновых анксиолитиков (седация, миорелаксация) не наблюдалось [125].
Серия производных 5'-4-алкил/арил-1Н-1,2,3-триазола с агонистическим µ-рецепторным профилем представлена в статье Montes et al. (2017). Эти соединения – продукты синтеза двух привилегированных структур – триазола, оказывающего общеседативное действие на ЦНС (снижение тревоги, депрессии и т.д.), и изатинового скаффолда, применяемого при нарушениях сна. По результатам тестов in vivo при введении мышам наиболее активного соединения PILAB 8 (25 мкМ/кг, интраперитонеально) наблюдался достоверный анксиолитический эффект, превышающий эффект препарата сравнения мидазолама. Также был изучен механизм действия PILAB 8 посредством совместного введения с неспецифическим антагонистом опиоидных рецепторов налоксоном в одном из тестов, а также с µ-антагонистом CTOP – в другом. Показано, что налоксон блокировал анксиолитический эффект изучаемого вещества, а СТОР снижал продолжительность сна (hypnosis following) [126].
ИНГИБИТОРЫ TRPC4 И TRPC5
Ионные каналы транзиторного рецепторного потенциала (transient receptor potential channels) в большом количестве присутствуют в головном мозге, особенно в коре и миндалине, где они регулируют передачу сенсорных сигналов. По ряду литературных источников, роль TRPC4 и TRPC5 связана с поведенческими изменениями и чувством страха [21, 127]. Стимуляция Gαq-G-белковых рецепторов (GPCRs) индуцирует TRPC4 и TRPC5 в гетерологичных экспрессионных системах, что считается физиологически значимым фактором для активации каналов, т.к. стимуляция Gαq-связанных GPCRs-рецепторов коррелирует с атипичным и тревожным поведением [128]. Комбинированным GPCR Gαi/o также свойственна способность к активации TRPC4, возможно, даже более выраженная, чем у Gαq [129]. Таким образом, эти каналы выступают преобразователями еще более широкого спектра сигналов. К тому же, согласно данным литературы, делеция TRPC4 или TRPC5 снижает тревожное поведение у лабораторных животных.
Just et al. изучали производное пурина – HC-070 – ингибитор рекомбинантных гомомультимеров TRPC4 и TRPC5 в гетерологичных экспрессионных системах с наномолярной активностью, механизм действия которого был доказан электрофизиологическими и флуориметрическими методами. HC-070 ингибирует гетеромультимеры TRPC1/5 и TRPC1/4 с аналогичной эффективностью и уменьшает ответы, вызываемые тетрапептидом холецистокинина (CCK-4) в миндалине. По результатам исследований HC-070 (1–3 мг/кг, per os) in vivo авторы делают заключение о снижении тревожного поведения без влияния на локомоторную активность в сравнении с диазепамом (1.5 мг/кг), а также о наличии антидепрессивной активности [21].
Yang et al. (2015) исследовали соединение M084 – производное бензимидазола, потенциальный ингибитор TRPC4 и TRPC5. В тестах in vivo (2–40 мг/кг, интраперитонеально) оно оказывало анксиолитический и антидепрессивный эффект, считается перспективным для дальнейшего изучения психотропной активности [128].
ГИСТАМИНОВЫЕ РЕЦЕПТОРЫ, ИНГИБИТОРЫ ФОСФОДИЭСТЕРАЗЫ IX, ИОННЫЕ КАНАЛЫ И НЕКОТОРЫЕ ДРУГИЕ МИШЕНИ
На сегодняшний день известно множество нейропсихотропных мишеней, воздействуя на которые агонистически или антагонистически, можно влиять на тревожно-фобическое состояние человека [9], однако с каждым годом исследуются и новые механизмы – потенциальные посредники коррекции эмоционального состояния человека. Например, с момента открытия центральных гистаминовых Н3-рецепторов накапливается все больше доказательств, подтверждающих их роль в функционировании ЦНС, а именно в познании, эмоциональном статусе, при стрессе [24, 25, 129]. Гистаминовые рецепторы ЦНС вовлечены в патогенез тревожности и депрессии, в литературных источниках встречаются данные многочисленных исследований, указывающие на функциональную связь между тревожностью и гистаминергической нейромедиацией на классических анксиолитических моделях in vivo (Н1-антагонист хлорфенамин снижал тревожность у крыс) [130]. В литературных данных содержится информация об анксиолитической активности соединений, опосредованной, например, ингибированием потенциал-зависимых натриевых каналов. Приведенные системы – далеко не полный перечень целевых мишеней в терапии тревожных расстройств.
Соединение ST-1283, изученное Sadek et al. – производное пиридина – рассматривается в качестве антагониста Н3-гистаминового рецептора. В экспериментах in vivo авторами была доказана его анксиолитическая и антидепрессивная активность (7.5 мг/кг, интраперитонеально). Показано, что вещество не влияет на локомоторную активность исследуемых животных [131].
Pastore et al. (2017) изучали фармакологическую активность соединений N-пропил-2,2-дифенил-2-гидроксиацетамидов, среди которых было выбрано соединение (5), изученное на предмет нейропсихотропной активности. Посредством электрофизиологических и радиолигандных исследований было выяснено, что механизм анксиолитического действия соединения (5) не связан с ГАМК- или 5-НТ-рецепторами. Авторами была выдвинута гипотеза об ингибировании веществом потенциал-зависимых натриевых каналов. Для подтверждения своей теории авторы использовали культуру клеток НЕК293 с применением методики “patch-clamp”. При изучении фармакологической активности in vivo при введении соединения (5) (10 мг/кг, интраперитонеально) было выявлено выраженное антифобическое и антидепрессивное действие без изменения локомоторной активности экспериментальных мышей [132].
В работе Huang et al. (2018) описан новый ингибитор фосфодиэстеразы 9-го типа, производное пиримидина WYQ-C36D, проявивший in vivo антидепрессивный, анксиолитический, позитивный мнестический эффекты в дозах 0.1, 0.5 и 1.0 мг/кг. На клеточной линии HT-22 соединение оказывало протективный эффект в условиях цитотоксичности, индуцированной кортикостероном [133].
Zhu et al. (2020) изучали влияние малой молекулы Zlc-002 на связывание nNOS-CAPON. Ранее было показано, что при взаимодействии nNOS-CAPON в гиппокампе наблюдается анксиогенный эффект, в то время как ингибирование этого взаимодействия приводит к анксиолизису [134]. При внутрибрюшинном введении Zlc-002 в дозах 40 и 80 мг/кг на протяжении 14 дней наблюдалось противотревожное действие соединения в условиях тестов “открытое поле”, “приподнятый крестообразный лабиринт”, “питание в новой обстановке” и “темная/светлая камера”. Внутривенное введение вещества в течение 7 дней также приводило к развитию противотревожного эффекта, однако соединение оказалось неактивным при введении per os [134].
В работе Spasov et al. (2020) исследованы две группы бензимидазол-содержащих структур, а именно 11-бифенилметилзамещенные 11Н- [1,3]диазепино[1,2-a]бензимидазолы под шифрами BIF, а также функционально-замещенные по алкильной группе 2-алкилтиобензимидазолы (AZH). Среди изученных соединений наиболее активными в анксиолитическом аспекте стали соединение BIF-66, содержащее карбоксильную группу в бифенильном фрагменте, и соединение AZH-57 с морфоэтильным радикалом в качестве S-заместителя. По результатам тестов in vivo “приподнятый крестообразный лабиринт” и “открытое поле” с препаратами сравнения – диазепамом (1 мг/кг) и афобазолом (5 мг/кг) – для соединений ряда BIF и AZH показана выраженная противотревожная активность. Хотя механизмы действия описанных веществ находятся в процессе исследования, можно предположить тропность соединений AZH к σ-рецепторам на основании единства меркаптобензимидазольной структуры AZH и фабомотизола [135].
ЗАКЛЮЧЕНИЕ
На сегодняшний день существует широкий ряд мишеней, воздействие на которые способствует коррекции поведенческих нарушений тревожно-депрессивного генеза. Сохраняется интерес к изучению модуляторов основного тормозного механизма ЦНС, опосредованного ГАМК-рецепторным комплексом: для 12 из более чем 50 описанных соединений характерен ГАМКергический механизм действия. В то же время активно разрабатываются препараты серотонинового пути с полимодальным влиянием на широкий спектр подтипов 5-НТ-рецепторов – от 1А до 7, сочетающие серотониновый эффект с дофамин-, гистамин- и адренергическими эффектами. Стоит отметить тенденцию к расширению роли опиоидных рецепторов, ингибиторов TSPO, TRPC и МАО, а также антиглутаматергических соединений в фармакологической коррекции психоневрологических нарушений. Большое внимание уделяется синтезу полициклических структур и их последующей оптимизации, созданию новых препаратов на основе известных привилегированных структур, а также комбинированию химических скаффолдов. Отдельные направления современного поиска транквилизирующих средств посвящены малым молекулам.
Таким образом, пул новых анксиолитиков, находящихся на доклиническом этапе исследования, в настоящее время достаточно широк. Среди них можно выделить перспективные молекулы, представляющие научный интерес для дальнейшего изучения и разработки на их основе новых препаратов для лечения тревожных расстройств.
Список литературы
Bandelow B., Michaelis S., Wedekind D. // Dialogues Clin. Neurosci. 2017. V. 19. P. 93–107. https://doi.org/10.31887/DCNS.2017.19.2/bbandelow
Незнанов Н.Г., Мартынихин И.А., Мосолов С.Н. // Современная терапия психических расстройств. 2017. С. 2–13. https://doi.org/10.21265/PSYPH2017.41.6437
Вознесенская Т.Г. // Неврология, нейропсихиатрия, психосоматика. 2013. № 2. С. 18–22.
Ладыженский М.Я., Городничев А.В., Костюкова Е.Г. // Современная терапия психических расстройств. 2014. № 2. С. 20–25.
Воронина Т.А., Середенин С.Б. // Экспериментальная и клиническая фармакология. 2002. Т. 65. № 5. С. 4–17.
Дробижев М.Ю., Федотова А.В., Кикта С.В. // Профилактическая медицина. 2013. Т. 16. № 4. С. 34–39.
Murrough J.W., Yaqubi S., Sayed S., Charney D.S. // Expert Opin. Emerg. Drugs. 2015. V. 20. P. 393–406. https://doi.org/10.1517/14728214.2015.1049996
Howland R.H. // J. Psychosoc. Nurs. Ment. Health. Serv. 2015. V. 53. P. 21–24. https://doi.org/10.3928/02793695-20151022-01
Gribel G., Holmes A. // Nat. Rev. Drug. Discov. 2013. V. 12. P. 667–687. https://doi.org/10.1038/nrd4075
Kim Y, Baik S.Y., Jin M.J., Choi K.H., Lee S.H. // Psychother. Psychosom. 2020. V. 24. P. 1–3. https://doi.org/10.1159/000506647
Suarez G.L., Morales S., Metcalf K., Pérez-Edgar K.E. // Infant. Child. Dev. 2019. V. 28. P. e2130. https://doi.org/10.1002/icd.2130
Eysenck M.W., Fajkowska M. // Cogn. Emot. 2018. V. 32. P. 1391–1400. https://doi.org/10.1080/02699931.2017.1330255
He Y., Ouyang J., Hu Z., Yang J., Chu Y., Huang S., Yang Y., Lui C. // Psychiatry Res. 2019. V. 271. P. 649–657. https://doi.org/10.1016/j.psychres.2018.12.025
Zhuang X., Xu H., Fang Z., Xu C., Xue C., Hong X. // Eur. J. Pharmacol. 2018. V. 834. P. 213–220. https://doi.org/10.1016/j.ejphar.2018.07.033
Zarrindast M.R., Khakpai F. // Arch. Iran Med. 2015. V. 18. P. 591–603.
Arbo B.D., Benetti F., Garcia-Segura L.M., Ribeiro M.F. // J. Steroid Biochem. Mol. Biol. 2015. V. 154. P. 68–74. https://doi.org/10.1016/j.jsbmb.2015.07.007
Kim T., Pae A.N. // Expert Opin. Ther. Pat. 2016. V. 26. P. 1325–1351. https://doi.org/10.1080/13543776.2016.1230606
Vakhitova Y.V., Kuzmina U.S., Voronin M.V., Zainullina L.F., Seredenin S.B. // Dokl. Biochem. Biophys. 2019. V. 488. P. 313–315. https://doi.org/10.1134/S1607672919050090
Капица И.Г., Иванова Е.А, Воронина Т.А. // Эксп. и клин. фарм. 2019. Т. 82. С. 3–7.
Nazeri M., Nezhadi A., Shabani M. // Addict Health. 2019. V. 11. P. 216–222. https://doi.org/10.22122/ahj.v11i4.243
Just S., Chenard B.L., Ceci A., Strassmaier T., Chong J.A., Blair N.T., Gallaschun R.J., Camino D. del, Cantin S., D’Amours M., Eickmeier C., Fanger C.M., Hecker C., Hessler D.P., Hengerer B., Kroker K.S., Malekiani S., Mihalek R., McLaughlin J., Rast G., Witek J.A., Sauer A., Pryce C.R., Moran M.M. // PLoS One. 2018. V. 13. P. e0191225. https://doi.org/10.1371/journal.pone.0191225
Wang Z.J., Heinbockel T. // Molecules. 2018. V. 23. P. E1061. https://doi.org/10.3390/molecules23051061
Hill A.S., Ben-Shahar Y. // Channels (Austin). 2018. V. 12. P. 262–275. https://doi.org/10.1080/19336950.2018.1495006
Кудряшов Н.В., Набиева Г.В., Калинина Т.С., Миронов С.Е., Горбунов А.А., Воронина Т.А. // Эксп. и клин. фарм. 2019. Т. 82. С. 36–43. https://doi.org/10.30906/0869-2092-2019-82-10-36-43
Alachkar A., Khan N., Łażewska D., Kieć-Kononowicz K., Sadek B. // Neuropsychiatr. Dis. Treat. 2019. V. 15. P. 531–542. https://doi.org/10.2147/NDT.S193125
Jembrek M.J., Vlainic J. // Curr. Pharm. Des. 2015. V. 21. P. 4943–4959. https://doi.org/10.2174/1381612821666150914121624
Olivier B. // Eur. J. Pharmacol. 2015. V. 753. P. 2–18. https://doi.org/10.1016/j.ejphar.2014.10.031
Koç G.Ş., Tan O.U., Uçar G., Yildirim E., Erol K., Palaska E. // Drug Res. (Stuttg). 2014. V. 64. P. 591–598. https://doi.org/10.1055/s-0033-1363997
McCracken L.M., Lowes D.C. Salling M.C., Carreau-Vollmer C., Odean N.N., Blednov Y.A., Betz H., Harris R.A., Harrison N.L. // Proc. Natl. Acad. Sci. USA. 2017. V. 114. P. E7179–E7186. https://doi.org/10.1073/pnas.1703839114
Kalscheuer V.M., Musante L., Fang C., Hoffmann K., Fuchs C., Carta E., Deas E., Venkateswarlu K., Menzel C., Ullmann R., Tommerup N., Dalprà L., Tzschach A., Selicorni A., Lüscher B., Ropers H.-H., Harvey K., Harvey R.J. // Hum. Mutat. 2009. V. 30. P. 61–68. https://doi.org/10.1002/humu.20814
de Montigny C. // Arch. Gen. Psychiatry. 1989. V. 46. P. 511–517. https://doi.org/10.1001/archpsyc.1989.01810060031006
Griebel G., Holsboer F. // Nat. Rev. Drug. Discov. 2012. V. 11. P. 462–478. https://doi.org/10.1038/nrd3702
Yamada K., Kobayashi M., Kanda T. // Int. Rev. Neurobiol. 2014. V. 119. P. 373–393. https://doi.org/10.1016/B978-0-12-801022-8.00015-5
Wang Y., Zhang H., Li Y., Wang Z., Fan Q., Yu S., Lin Z., Xiao Z. // J. Affect. Disord. 2015. V. 186. P. 7–12. https://doi.org/10.1016/j.jad.2015.07.023
Davison E.K., Brimble M.A. // Curr. Opin. Chem. Biol. 2019. V. 52. P. 1–8. https://doi.org/10.1016/j.cbpa.2018.12.007
Таран А.С., Мальцев Д.В., Яковлев Д.С., Караваева Т.А., Ткаченко Ю.О., Диваева Л.Н., Морковник А.С., Кузьменко Т.А. // Волг. науч.-мед. журн. 2017. Т. 53. С. 24–26.
Диваева Л.Н., Спасов А.А., Мальцев Д.В., Кузьменко Т.А., Морковник А.С., Яковлев Д.С., Таран А.С., Петров В.И., Анисимова В.А. // Патент RU2629022С1, 2017.
Спасов А.А., Диваева Л.Н., Мальцев Д.В., Кузьменко Т.А., Морковник А.С., Мирошников М.В., Таран А.С., Золотова Е.А. // Вест. волг. гос. мед. ун-та. 2018. Т. 67. С. 19–23.
Петров В.И., Озеров А.А., Новиков М.С., Тюренков И.Н., Бугаева Л.И., Багметова В.В. // Совр. пробл. науки и обр. 2015. № 3. С. 13.
Сажин В.А., Ковалев Г.В. // Эксп. и клин. фарм. 1993. Т. 56. № 2. С. 72–74.
Trincavelli M.L., Da Pozzo E., Daniele S., Martini C. // Curr. Top. Med. Chem. 2012. V. 12. P. 254–269. https://doi.org/10.2174/1568026799078787
Brito A.F., Fajemiroye J.O., Neri H.F.S., Silva D.M., Silva D.P. B., Sanz G., Vaz B.G., de Carvalho F.S., Ghedini P.C., Lião L.M., Menegatti R., Costa E.A. // Chem. Biol. Drug Des. 2017. V. 90. P. 432–442. https://doi.org/10.1111/cbdd.12961
Milenin V.V. // Anesteziol. Reanimatol. 2010. V. 1. P. 23–25.
Rivilli M.J.L., Turina A.V., Bignante E.A., Molina V.H., Perillo M.A., Briñon M.C., Moyano E.L. // Bioorg. Med. Chem. 2018. V. 26. P. 3967–3974. https://doi.org/10.1016/j.bmc.2018.06.021
Тюренков И.Н., Багметова В.В., Маркина Ю.В. // Эксп. и клин. фарм. 2017. Т. 80. № 2. С. 8–13. https://doi.org/10.30906/0869-2092-2017-80-2-8-13
Тюренков И.Н., Багметова В.В., Робертус А.И., Васильева Е.В., Ковалёв Г.И. // Нейрохимия. 2015. Т. 32. С. 140–152. https://doi.org/10.7868/S1027813315010136
Maltsev D.V., Spasov A.A., Miroshnikov M.V., Skripka M.O., Divaeva L.N. // Res. Pharmacol. 2020. V. 6 (3). P. 9–14. https://doi.org/10.3897/rrpharmacology.6.55142
Olsen R.W. // Neuropharmacology. 2018. V. 136. P. 10–22. https://doi.org/10.1016/j.neuropharm.2018.01.036
Sigel E., Ernst M. // Pharmacol. Sci. 2018. V. 39. P. 659–671. https://doi.org/10.1016/j.tips.2018.03.006
Семьянов А.В., Казанцев В.Б. // Нейрон-глиальное взаимодействие в мозге. Нижний Новгород: Изд-во Нижегород. гос. ун-та им. Н.И. Лобачевского, 2007. 107 с.
Borghese C.M., Herman M., Snell L.D., Lawrence K.J., Lee H.-Y., Backos D.S., Vanderlinden L.A., Harris R.A., Roberto M., Hoffman P.L., Tabakoff B. // Sci. Rep. 2017. V. 7. P. 6230. https://doi.org/10.1038/s41598-017-05966-x
Akbar S., Subhan F., Karim N., Aman U., Ullah S., Shahid M., Ahmad N., Fawad K., Sewell R.D.E. // Eur. J. Pharm. 2017. V. 801. P. 19–27. https://doi.org/10.1016/j.ejphar.2017.02.047
Guerrini G., Ciciani G., Crocetti L., Daniele S., Ghelardini C., Giovannoni M.P., Iacovone A., Mannelli L.D.C., Martini C., Vergelli C. // J. Med. Chem. 2017. V. 60. P. 9691–9702. https://doi.org/10.1021/acs.jmedchem.7b01151
Artelsmair M., Gu C., Lewis R.J., Elmore C.S. // J. Labelled Comp. Radiopharm. 2018. V. 61. P. 415–426. https://doi.org/10.1002/jlcr.3602
Gu C., Artelsmair M., Elmore C.S., Lewis R.J., Davis P., Hall J.E., Dembofsky B.T., Christoph G., Smith M.A., Chapdelaine M., Sunzel M. // Drug Metab. Dispos. 2018. V. 46. P. 303–315. https://doi.org/10.1124/dmd.117.078873
Nickolls S.A., Gurrell R., van Amerongen G., Kammonen J., Cao L., Brown A.R., Stead C., Mead A., Watson C., Hsu C., Owen R.M., Pike A., Fish R.L., Chen L., Qiu R., Morris E.D., Feng G., Whitlock M., Gorman D., van Gerven J., Reynolds D.S., Dua P., Butt R.P. // Br. J. Pharmacol. 2018. V. 175. P. 708–725. https://doi.org/10.1111/bph.14119
Fritzius T., Bettler B. // Basic Clin. Pharmacol. Toxicol. 2019. V. 126. P. 25–34. https://doi.org/10.1111/bcpt.13241
Frangaj A., Fan Q.R. // Neuropharmacology. 2018. V. 136. P. 68–79. https://doi.org/10.1016/j.neuropharm.2017.10.011
Ghanavatian S., Derian A. // StatPearls. https://www.ncbi.nlm.nih.gov/books/NBK519505/. Treasure Island (FL): StatPearls Publishing, 2020.
George K., Sadiq N.M. // StatPearls [https://www.ncbi.nlm.nih.gov/books/NBK545230/]. Treasure Island (FL): StatPearls Publishing, 2020.
Brown K.M., Roy K.K., Hockerman G.H., Doerksen R.J., Colby D.A. // J. Med. Chem. 2015. V. 58. P. 6336–6347. https://doi.org/10.1021/jm5018913
Kalinichev M., Girard F., Haddouk H., Rouillier M., Riguet E., Royer-Urios I., Mutel V., Lütjens R., Poli S. // Neuropharmacology. 2016. V. 114. P. 34–47. https://doi.org/10.1016/j.neuropharm.2016.11.016
Porcu A., Lobina C., Giunta D., Solinas M., Mugnaini C., Castelli M.P. // Eur. J. Pharm. 2016. V. 791. P. 115–123. https://doi.org/10.1016/j.ejphar.2016.08.032
Soudijn W., van Wijngaarden I. // Curr. Med. Chem. 2000. V. 7. P. 1063–1079. https://doi.org/10.2174/0929867003374363
Schousboe A., Madsen K.K. // Neurochem. Res. 2017. V. 42. P. 2019–2023. https://doi.org/10.1007/s11064-017-2188-x
Fattorini G., Melone M., Conti F. // Neurosci. 2020. V. 14. P. 9. https://doi.org/10.3389/fncel.2020.00009
Bresnahan R., Martin-McGill K.J. // Cochrane Database Syst. Rev. 2019. V. 10. P. CD001908. https://doi.org/10.1002/14651858.CD001908.pub4
Sałat K., Podkowa A., Malikowska N., Kern F., Pabel J., Wojcieszak E., Kulig K., Wanner K.T., Strach B., Wyska E. // Neuropharm. 2017. V. 113. P. 331–342. https://doi.org/10.1016/j.neuropharm.2016.10.019
Hauke T.J., Höfner G., Wanner K.T. // ChemMedChem. 2019. V. 14. P. 583–593. https://doi.org/10.1002/cmdc.201800729
Незнанов Н.Г., Мартынихин И.А., Мосолов С.Н. // Совр. терапия психич. расстройств. 2017. № 2. С. 2–15.
Сюняков Т.С., Сюняков С.А., Дорофеева О.А. // Психиатрия и психофармакотерапия. 2011. Т. 13. № 6. С. 9–16.
Rice O.V., Ashby C.R. Jr., Dixon C., Laurenzo W., Hayden J., Song R., Li J., Tiwari A.K., Gardner E.L. // Synapse. 2018. V. 72. P. e22035. https://doi.org/10.1002/syn.22035
Żmudzka E., Sałaciak K., Sapa J., Pytka K. // Life Sci. 2018. V. 210. P. 106–124. https://doi.org/10.1016/j.lfs.2018.08.050
Heisler L.K., Zhou L., Bajwa P., Hsu J., Tecott L.H. // Genes Brain Behav. 2007. V. 6. P. 491–496. https://doi.org/10.1111/j.1601-183X.2007.00316.x
Martin J.R., Ballard T.M., Higgins G.A. // Pharmacol. Biochem. Behav. 2002. V. 71. P. 615–625. https://doi.org/10.1016/s0091-3057(01)00713-4
Dekeyne A., Brocco M., Loiseau F., Gobert A., Rivet J.-M., Di Cara B., Cremers T.I., Flik G., Fone K.C.F., Watson D.J.G., Papp M., Sharp T., Serres F., Cespuglio R., Olivier B., Chan J.S.W., Lavielle G., Millan M.J. // J. Pharmacol. Exp. Ther. 2012. V. 340. P. 765–780. https://doi.org/10.1124/jpet.111.187534
Kurhe Y., Radhakrishnan M., Thangaraj D., Gupta D. // Indian J. Pharmacol. 2014. V. 46. P. 100–104. https://doi.org/10.4103/0253-7613.125186
Mahesh R., Dhar A.K., Jindal A., Bhatt S. // Can. J. Physiol. Pharmacol. 2013. V. 91. P. 848– 854. https://doi.org/10.1139/cjpp-2013-0134
Adriani W., Travaglini D., Lacivita E., Saso L., Leopoldo M., Laviola G. // Neuropharmacology. 2012. V. 62. P. 833–842. https://doi.org/10.1016/j.neuropharm.2011.09.012
Jastrzębska-Więsek M., Siwek A., Partyka A., Kubacka M., Mogilski S., Wasik A., Kołaczkowski M., Wesołowska A. // Neuropharmacology. 2014. V. 85. P. 253–262. https://doi.org/10.1016/j.neuropharm.2014.05.036
Brito A.F., Braga P.C.C.S., Moreira L. K.S., Silva D.M., Silva D.P.B., Sanz G., Vaz B.G., de Carvalho F.S., Lião L.M., Silva R.R., Noël F., Neri H.F. S., Ghedini P.C., de Carvalho M.F., Gil E.D.S., Costa E.A., Menegatti R. // Naunyn Schmiedebergs Arch. Pharmacol. 2018. V. 391. P. 255–269. https://doi.org/10.1007/s00210-017-1451-7
Pytka K., Głuch-Lutwin M., Żmudzka E., Sałaciak K., Siwek A., Niemczyk K., Walczak M., Smolik M., Olczyk A., Gałuszka A., Śmieja J., Filipek B., Sapa J., Kołaczkowski M., Pańczyk K., Waszkielewicz A., Marona H. // Front. Pharmacol. 2018. V. 9. P. 1146. https://doi.org/10.3389/fphar.2018.01146
Kondej M., Wróbel T.M., Silva A.G., Stępnicki P., Koszła O., Kędzierska E., Bartyzel A., Biała G., Matosiuk D., Loza M.I., Castro M., Kaczor A.A. // Eur. J. Med. Chem. 2019. V. 180. P. 673–689. https://doi.org/10.1016/j.ejmech.2019.07.050
Partyka A., Jastrzębska-Więsek M., Antkiewicz-Michaluk L., Michaluk J., Wąsik A., Canale V., Zajdel P., Kołaczkowski M., Wesołowska A. // Behav. Brain Res. 2019. V. 359. P. 9–16. https://doi.org/10.1016/j.bbr.2018.10.004
Łażewska D., Kurczab R., Więcek M., Satała G., Kieć-Kononowicz K., Handzlik J. // Bioorg. Chem. 2019. V. 84. P. 319–325. https://doi.org/10.1016/j.bioorg.2018.11.046
Słoczyńska K., Wójcik-Pszczoła K., Canale V., Żmudzki P., Zajdel P., Pękala E. // J. Biochem. Mol. Toxicol. 2018. V. 32. P. e22048. https://doi.org/10.1002/jbt.22048
Assié M.-B., Bardin L., Auclair A.L., Carilla-Durand E., Depoortère R., Koek W., Kleven M.S., Colpaert F., Vacher B., Newman-Tancredi A. // Int. J. Neuropsychopharmacol. 2010. V. 13. P. 1285–1298. https://doi.org/10.1017/S1461145709991222
Jastrzębska-Więsek M., Partyka A., Rychtyk J., Śniecikowska J., Kołaczkowski M., Wesołowska A., Varney M.A., Newman-Tancredi A. //ACS Chem. Neurosci. 2017. V. 9. P. 1040–1050. https://doi.org/10.1021/acschemneuro.7b00443
Azevedo H., Ferreira M., Costa R.W., Russo V., Russo E., Mascarello A., Guimarães C.R.W. // Prog. Neuropsyc. Biol. Psyc. 2019. V. 95. P. 109707. https://doi.org/10.1016/j.pnpbp.2019.109707
Ferreira M.K.A., da Silva A.W., Silva F.C.O. // Biochem. Biophys. Res. Commun. 2020. V. 526. P. 505–511. https://doi.org/10.1016/j.bbrc.2020.03.129
Faye C., Hen R., Guiard B.P. // Biol. Psychiatry. 2020. V. 87. P. 514–525. https://doi.org/10.1016/j.biopsych.2019.08.009
Kurczab R., Ali W., Łażewska D., Kotańska M., Jastrzębska-Więsek M., Satała ., Więcek M., Lubelska A., Latacz G., Partyka A., Starek M., Dąbrowska M., Wesołowska A., Jacob C., Kieć-Kononowicz K., Handzlik J. // Molecules. 2018. V. 23. P. 2529. https://doi.org/10.3390/molecules23102529
Kucwaj-Brysz K., Kurczab R., Jastrzębska-Więsek M., Żesławska E., Satała G., Nitek W., Partyka A., Siwek A., Jankowska A., Wesołowska A., Kieć-Kononowicz K., Handzlik J. // Eur. J. Med. Chem. 2018. V. 147. P. 102–114. https://doi.org/10.1016/j.ejmech.2018.01.093
Latacz G., Lubelska A., Jastrzębska-Więsek M., Partyka A., Kucwaj-Brysz K., Ann Wesołowska K., Kieć-Kononowicz K., Handzlik J. // Bioorg. Med. Chem. Lett. 2018. V. 28. P. 878–883. https://doi.org/10.1016/j.bmcl.2018.02.003
Ran Y., Hu X.-X., Wang Y.-L., Zhao N., Zhang L.-M., Liu H.-X., Li Y.-F. // Acta Pharm. Sinica. 2018. V. 39. P. 12–23. https://doi.org/10.1038/aps.2017.83
Bhatt S., Mahesh R., Jindal A., Devadoss T. // J. Basic Clin. Physiol. Pharmacol. 2017. V. 28. P. 93–100. https://doi.org/10.1515/jbcpp-2016-0057
Спасов А.А., Яковлев Д.С., Мальцев Д.В., Жуковская О.Н., Анисимова В.А., Ковалев Г.И., Зимин И.А., Морковина Я.В. // Биоорг. химия. 2016. Т. 42. С. 440–447. [Spasov A.A., Yakovlev D.S., Maltsev D.V., Zhukovskaya O.N., Anisimova V.A., Kovalev G.I., Zimin I.A., Morkovina Y.V. // Russ. J. Bioorg. Chem. 2016. V. 42. P. 397–403.] https://doi.org/10.1134/S1068162016040178
Яковлев Д.С., Спасов А.А., Мальцев Д.В., Васильев П.М., Анисимова В.А., Морковина Я.В. // Сб. трудов науч.-практич. конференции профессорско-преподавательского коллектива, посвященной 80-летию Волгоград. гос. мед. ун-та, 2015. С. 54–56.
Maltsev D.V., Yakovlev D.S., Matokhin D.G., Samsonik Y.V., Spasov A.A., Anisimova V.A.// Eur. Neuropsychopharmacol. 2013. V. 23. P. 519–520. https://doi.org/10.1016/S0924-977X(13)70824-1
Tipton K.F. // J. Neural. Transm. (Vienna). 2018. V. 125. P. 1519–1551. https://doi.org/10.1007/s00702-018-1881-5
Schiele M.A., Thiel C., Deckert J., Zaudig M., Berberich G., Domschke K. // Int. J. Neuropsychopharmacol. 2020. V. 23. P. 319–323. https://doi.org/10.1093/ijnp/pyaa016
Ramsay R.R. // Prog. Neuropsychopharmacol. Biol. Psychiatry. 2016. V. 69. P. 81–89. https://doi.org/10.1016/j.pnpbp.2016.02.005
Fowler J.S., Logan J., Shumay E., Alia-Klein N., Wang G.J., Volkow N.D. // J. Labelled Comp. Radiopharm. 2015. V. 58. P. 51–64. https://doi.org/10.1002/jlcr.3247
Kasai S., Yoshihara T., Lopatina O., Ishihara K., Higashida H. // Front. Beh. Neurosci. 2017. V. 11. P. 75. https://doi.org/10.3389/fnbeh.2017.00075
Koç G.Ş., Tan O.U., Uçar G., Yıldırım E., Erol K., Palaska E. // Drug Res. 2014. V. 64. P. 591–598. https://doi.org/10.1055/s-0033-1363997
Upadhyay S., Tripathi A.C., Paliwal S., Saraf S.K. // EXCLI J. 2017. V. 16. P. 628. https://doi.org/10.17179/excli2017-250
Li X., Liu A., Yang L., Zhang K., Wu Y.-M., Zhao M.-G., Liu S.-B. // Mol. Brain. 2018. V. 11. P. 12. https://doi.org/10.1186/s13041-018-0355-x
Zhang X.Y., Zhang L.-M., Mi W.-D., Li Y.-F. // Neural Regen. Res. 2018. V. 13. P. 1937–1944. https://doi.org/10.4103/1673-5374.239442
Perkins E.C., Newport D.J. // Curr. Treat. Options Psych. 2018. V. 5. P. 377–400. https://doi.org/10.1007/s40501-018-0159-8
Novitskii A.A., Bochkov P.O., Shevchenko R.V. // Bull. Exp. Biol. Med. 2018. V. 165. P. 751–753. https://doi.org/10.1007/s10517-018-4257-9
Яркова М.А., Литвин А.А., Колыванов Г.Б., Жердев В.П., Середенин С.Б., Гегечкори В.И. // Фармакокин. и фармакодин. 2018. № 2. С. 52–58.
Miller C.K., Krentzel A.A., Patisaul H.B., Meitzen J. // Physiol. Behav. 2020. V. 214. P. 112770. https://doi.org/10.1016/j.physbeh.2019.112770
Sartori S.B., Singewald N. // Pharmacol. Ther. 2019. V. 204. P. 107402. https://doi.org/10.1016/j.pharmthera.2019.107402
Zoicas I., Kornhuber J. // Int. J. Mol. Sci. 2019. V. 20. P. 1412. https://doi.org/10.3390/ijms20061412
Tu C.H., MacDonald I., Chen Y.H. // Front. Psychiatry. 2019. V. 10. P. 14. https://doi.org/10.3389/fpsyt.2019.00014
Harvey B.H., Shahid M. // Pharmacol. Biochem. Behav. 2012. V. 100. P. 775–800. https://doi.org/10.1016/j.pbb.2011.06.014
Galambos J., Bielik A., Krasavin M., Orgován Z., Domány G., Nógrádi K., Wágner G., Balogh G.T, Béni Z., Kóti J., Szakács Z., Bobok A., Kolok S., Mikó-Bakk M.L., Vastag M., Sághy K., Laszy J., Halász A.S., Balázs O., Gál K., Greiner I., Szombathelyi Z., Keserü G.M. // J. Med. Chem. 2017. V. 60. P. 2470−2484. https://doi.org/10.1021/acs.jmedchem.6b01858
Reis A.S., Pinz M., Duarte L.F.B., Roehrs J.A., Alves D., Luchese C., Wilhelm E.A. // J. Psyc. Res. 2017. V. 84. P. 191–199. https://doi.org/10.1016/j.jpsychires.2016.10.007
Anderson G. // Prog. Neuropsychopharmacol. Biol. Psychiatry. 2020. V. 98. P. 109782. https://doi.org/10.1016/j.pnpbp.2019.109782
Nagase H., Saitoh A. // Pharmacol. Ther. 2020. V. 205. P. 107427. https://doi.org/10.1016/j.pharmthera.2019.107427
Hang A., Wang Y.J. // Acta Pharmacol. Sin. 2015. V. 36. P. 783–790. https://doi.org/10.1038/aps.2015.32
Anand J.P., Montgomery D. // Handb. Exp. Pharm. 2018. V. 247. P. 21–51. https://doi.org/10.1007/164_2018_104
Hassan A.N., Howe A.S., Samokhvalov A.V., Foll B.L., George T.P. // Am. J. Addict. 2017. V. 26. P. 551–563. https://doi.org/10.1111/ajad.12581
Wang Q., Long Y., Hang A., Zan G.-Y., Shu X.-H., Wang Y.-J., Liu J.-G. // Psychopharmacology (Berl.). 2016. V. 233. P. 2411–2418. https://doi.org/10.1007/s00213-016-4292-z
Yamada D., Yanagisawa S., Yoshizawa K., Yanagita S., Oka J.-I., Nagase H., Saitoh A. // Neuropharmacology. 2019. V. 160. P. 107792. https://doi.org/10.1016/j.neuropharm.2019.107792
Montes G., Da Silva B.N.M., Rezende B., Sudo R.T., Ferreira V.F., da Silva F.D., Pinto A.D.C., Da Silva B.V., Zapata-Sudo G. // Molecules. 2017. V. 22. P. 800. https://doi.org/10.3390/molecules22050800
Minard A., Bauer C.C., Wright D.J., Rubaiy H.N., Muraki K., Beech D.J., Bon R.S. // Cells. 2018. V. 7. P. 52. https://doi.org/10.3390/cells7060052
Yang L.P., Jiang F.-J., Wu G.-S., Deng K., Wen M., Zhou X., Hong X., Zhu M.X., Luo H.-R. // PLoS One. 2015. V. 10. P. e0136255. https://doi.org/10.1371/journal.pone.0136255
Zhu Y., Lu Y., Qu C., Miller M., Tian J., Thakur D.P., Zhu J., Deng Z., Hu X., Wu M., McManus O.B., Li M., Hong X., Zhu M.X., Luo H.-R. // Br. J. Pharmacol. 2015. V. 172. P. 3495–3509. https://doi.org/10.1111/bph.13140
Kárpáti A., Yoshikawa T., Naganuma F., Matsuzawa T., Kitano H., Yamada Y., Yokoyama M., Futatsugi A., Mikoshiba K., Yanai K. // Sci. Rep. 2019. V. 9. P. 16451. https://doi.org/10.1038/s41598-019-52623-6
Sadek B., Bahi A., Schwed J.S., Walter M., Stark H. // Drug Des. Dev. Ther. 2014. V. 8. P. 627–637. https://doi.org/10.2147/DDDT.S63088
Pastore V., Wasowski C., Martin P., Enrique A., Higgs J., Bruno-Blanch L.E., Milesi V., Marder M. // Eur. J. Pharm. 2018. V. 819. P. 270–280. https://doi.org/10.1016/j.ejphar.2017.11.048
Huang X.F., Jiang W.T., Liu L., Song F.-C., Zhu X., Shi G.-L., Ding S.-M., Ke H.-M., Wang W., O’Donnell J.M., Zhang H.-T., Luo H.-B., Wan Y.-Q., Song G.-Q., Xu Y. // CNS Neurosci. Ther. 2018. V. 24. P. 889–896. https://doi.org/10.1111/cns.12864
Zhu L.J., Chang L., Shi H.J., Li N. // Biochem. Biophys. Res. Commun. 2020. V. 523. P. 299–306. https://doi.org/10.1016/j.bbrc.2019.12.037
Спасов А.А., Жуковская О.Н., Мальцев Д.В., Мирошников М.В., Скрипка М.О., Султанова К.Т., Морковник А.С. // Биоорг. химия. 2020. Т. 46. С. 92–100. [Spasov A.A., Zhukovskaya O.N., Maltsev D.V., Miroshnikov M.V., Skripka M.O., Sultanova K.T., Morkovnik A.S. // Russ. J. Bioorg. Chem. 2020. V. 46. P. 107–114.] https://doi.org/10.1134/S1068162020010124
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


