Биоорганическая химия, 2021, T. 47, № 5, стр. 652-656
Мультиплексная ПЦР на чипе с прямой детекцией удлинения иммобилизованного праймера
С. А. Лапа 1, *, Е. С. Клочихина 1, Р. А. Мифтахов 1, А. С. Заседателев 1, А. В. Чудинов 1
1 ФГБУН “Институт молекулярной биологии им. В.А. Энгельгардта” РАН
119991 Москва, ул. Вавилова, 32, Россия
* E-mail: lapa@biochip.ru
Поступила в редакцию 09.12.2020
После доработки 26.12.2020
Принята к публикации 27.12.2020
Аннотация
Разработан вариант мультиплексной ПЦР на чипе с прямой детекцией удлинения иммобилизованного праймера. Детекция осуществляется определением флуоресцентного сигнала встраиваемых в растущую цепь флуоресцентно-меченных dUTP. Благодаря такому подходу образуется удлиненный праймер, иммобилизованный на твердой фазе, несущий в своей цепи несколько ковалентно связанных флуоресцентных меток (их количество зависит от АТ-состава и длины ПЦР-продукта), что позволяет полностью удалять все компоненты смеси после проведения ПЦР и тем самым резко снижать фоновый сигнал и увеличивать чувствительность анализа на гидрогелевых биочипах. Метод успешно применен для дифференциального обнаружения важных бактериальных возбудителей пневмонии человека – Staphylococcus aureus и Streptococcus pneumoniae, в том числе в одном анализируемом образце.
ВВЕДЕНИЕ
Ускоренное дифференциальное определение возбудителя – важная задача клинической молекулярной биологии. Методы, основанные на ПЦР в едином общем объеме, ограничены степенью мультиплексности системы, требуют строгих расчетов при конструировании праймеров и визуальной детекции с помощью гель-электрофореза, причем из-за сходной длины ПЦР-продуктов интерпретация может быть в высокой мере субъективной. Методы, основанные на ПЦР в общем объеме с последующей гибридизацией продуктов в иммобилизованной фазе – трудоемки и требуют значительного времени для осуществления анализа, а в ряде случаев – методических усложнений [1]. Методы, основанные на ПЦР с применением биологических микрочипов, используют в качестве стадии детекции гибридизацию удлиненного в растворе флуоресцентно-меченного праймера (ПЦР-продукта) либо избытка того же непрореагировавшего праймера с удлиненным иммобилизованным праймером [2–4]. Квазиравновесная процедура отмывки прогибридизованного продукта может вносить искажения в результирующую картину сигналов чипа. Использование флуоресцентных праймеров, находящихся в растворе, увеличивает неспецифический флуоресцентный фон при детекции сигнала.
Предлагаемый подход – мультиплексная ПЦР с прямой детекцией флуоресцентного сигнала удлиненного иммобилизованного праймера – позволяет избежать этих недостатков, увеличивает скорость проведения анализа и чувствительность диагностической системы за счет полного удаления всех компонентов жидкой фазы (реакционной смеси “над поверхностью чипа”).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ранее нами была разработана мультиплексная ПЦР для видового определения пяти основных возбудителей бактериальной пневмонии человека [5]. В настоящей работе использованы праймеры, специфичные к двум основным возбудителям инфекционной пневмонии, Staphylococcus aureus и Streptococcus pneumoniae, фланкирующие регионы генов ebpS и cpsB соответственно. Ген эластин-связывающего белка ebpS (elastin-binding protein S) относится к группе генов S. aureus, которые кодируют белки, участвующие в связывании молекул на поверхности клеток [6]. Стрептококковый ген cpsB (tyrosine-protein phosphatase B) участвует в регуляции биосинтеза капсульных полисахаридов [7]. Обе генетические мишени используются в качестве видоспецифичных маркеров для определения вышеуказанных возбудителей.
На рис. 1 показана схема анализа образцов: с применением стандартной технологии гидрогелевых биочипов (рис. 1а) и с применением предлагаемого способа прямой детекции удлинения иммобилизованного праймера после проведения реакции (рис. 1б). Стандартный подход подразумевает использование дополнительной стадии после проведения ПЦР – гибридизации находящегося в растворе меченого праймера (а также продуктов амплификации) с удлиненным иммобилизованным праймером. Это требует тонкой оптимизации условий гибридизации и на практике приводит к высокому фоновому сигналу из-за неспецифического связывания флуоресцентно-меченного праймера с гелевыми ячейками и с неспецифическими иммобилизованными праймерами.
Рис. 1.
Схема вариантов ПЦР на гидрогелевых биочипах: (а) – стандартный вариант ПЦР с использованием свободного (не иммобилизованного) флуоресцентно-меченного праймера в смеси; (б) – предлагаемый вариант ПЦР с использованием иммобилизованного праймера, содержащего флуоресцентно-меченный dUTP.
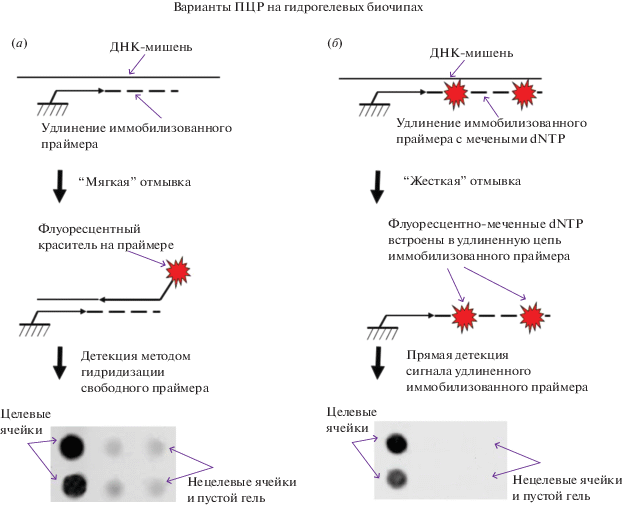
В предлагаемом нами подходе применяется “жесткая” отмывка, возможная благодаря включению флуоресцентно-меченных нуклеотидов (Cy5-dUTP) в иммобилизованную растущую цепь в процессе ПЦР, что резко снижает уровень неспецифических сигналов: достигнуто среднее отношение сигнал/фон, равное (30–35)/1 (в зависимости от нуклеотидной последовательности праймера), в то время как для стандартной технологии ПЦР на биочипе характерны значения (5–15)/1 для тех же праймеров.
На рис. 2 продемонстрированы результаты мультиплексной ПЦР на гидрогелевом биочипе для дифференциального обнаружения в образце двух наиболее значимых бактериальных возбудителей пневмонии человека: Staphylococcus aureus и Streptococcus pneumoniae. Проводили тестирование образцов, содержащих как один возбудитель, так и два возбудителя в одном анализируемом образце. Наблюдали только сигналы специфичных к мишеням ячеек чипа.
Рис. 2.
Результаты ПЦР на гидрогелевом биочипе. (а) – Схема биочипа для проведения ПЦР в иммобилизованной фазе: маркеры для пространственного позиционирования чипа в чип-детекторе обозначены черным, ячейки пустого геля – белым, ячейки с иммобилизованными праймерами – серым; R1 и R2 – праймеры, специфичные к Staphylococcus aureus (ген ebpS); R3–R5 – праймеры, специфичные к Streptococcus pneumoniae (ген cpsB); концентрации праймеров: без литеры – 8000 пмоль/мкл, литера а – 4000 пмоль/мкл, литера b – 2000 пмоль/мкл, литера с – 1000 пмоль/мкл; (б) – детекция Staphylococcus aureus; (в) – детекция Streptococcus pneumoniae; (г) – детекция смеси Staphylococcus aureus и Streptococcus pneumoniae в одном исследуемом образце.

ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Штаммы. В работе использовали деконтаминированную полногеномную ДНК бактериальных штаммов из коллекции Государственного научного центра прикладной микробиологии и биотехнологии (п. Оболенск, Россия): Staphylococcus aureus ATCC 25923, Staphylococcus aureus ATCC 43300 и Streptococcus pneumoniae ATCC 49619. Выделение ДНК из клеточных культур осуществляли CTAB-методом [8].
Праймеры. Множественное выравнивание последовательностей геномных мишеней (не менее 20 последовательностей для каждой мишени) проводили с помощью алгоритма ClustalW (www.clustal.org). Конструирование праймеров осуществляли с помощью сетевого ресурса www.idtdna.com, анализ специфичности проводили с использованием алгоритма BLAST (NIH, США).
Праймеры, специфичные к Staphylococcus aureus, ген ebpS: прямой ebpS-f (5'-ACTCGACTGAGGATAAAGCGTCT-3'), обратный ebpS-r (5'-CCTCCAAATATCGCTAATGCACC-3'), иммобилизованные R1 (5'-NH2-CCTCCAAATATCGCTAATGCACC-3'), R2 (5'-NH2-GGTAACAATACTTTGGCCATGCCACC-3'); длина ПЦР-продукта – 283 п.н.
Праймеры, специфичные к Streptococcus pneumoniae, ген cpsB: cpsB-f (5'-TTGATGTAGATGACGGTCCCAAG-3'), обратный cpsB-r (5'-TATATCTCTGCGCCATAAGCAAT-3'), иммобилизованные R3 (5'-NH2-TATATCTCTGCGCCATAAGCAAT-3'), R4 (5'-NH2-CGAACCTGAAGAAAGTTTTCTG-3'), R5 (5'-NH2-GCAAT-GACTAAATCATCTGCCAC-3'); длина ПЦР-продукта – 217 п.н.
Мультиплексная ПЦР в иммобилизованной фазе. Реакционная смесь (30 мкл) содержала 1.5 ед. Taq-полимеразы (Thermo Scientific, США) в буфере той же фирмы, dNTP в концентрации 400 мкМ каждого, праймеры и полногеномную бактериальную матрицу (либо смесь бактериальных ДНК) в количестве 103–105 копий. В качестве флуоресцентного субстрата для полимеразы использовали Cy5-dUTP [9] в концентрации 8 мкМ. Смесь помещали на биочип и герметизировали реакционный объем с помощью Frame-Seal (25 мкл; Bio-Rad, США). Биочип представлял собой обработанное силикатное стекло либо полимерную подложку с матрицей гидрогелевых ячеек, в которых были иммобилизованы праймеры с первичной аминогруппой на 5'-конце, изготовленные по методу Rubina et al. [10]. Реакцию проводили на ДНК-амплификаторе TGradient (Biometra, США) для in situ ПЦР при следующих условиях: 95°C – 3 мин (начальная денатурация); 36 циклов: 95°C – 20 с, 64°C – 30 с, 72°C – 40 с; далее 72°C – 5 мин (завершающая инкубация).
После проведения ПЦР проводили “жесткую” отмывку биочипа в 1%-ном водном растворе Tween-20 в течение 2 мин при 100°C. Флуоресцентные сигналы регистрировали на специализированном анализаторе биочипов [11] разработки ИМБ РАН (Россия) при длине волны возбуждения, соответствующей Cy5 (~650 нм).
ЗАКЛЮЧЕНИЕ
Разработан и применен метод детекции возбудителей пневмонии Staphylococcus aureus и Streptococcus pneumoniae, основанный на мультиплексной ПЦР в иммобилизованной фазе. Ковалентное встраивание меток в удлиняющийся иммобизованный праймер позволяет полностью удалять реакционный раствор после проведения ПЦР и тем самым резко снижать фоновый сигнал и увеличивать чувствительность анализа на гидрогелевых биочипах.
На основе продемонстрированного подхода предполагается создание тест-системы с расширенным спектром диагностируемых возбудителей инфекционной пневмонии для применения в ускоренной клинической диагностике.
Список литературы
Tang X., Morris S.L., Langone J.J., Bockstahler L.E. // J. Microbiol. Methods. 2005. V. 63. P. 318–330. https://doi.org/10.1016/j.mimet.2005.04.026
Mikhailovich V., Lapa S., Gryadunov D., Sobolev A., Strizhkov B., Chernyh N., Skotnikova O., Irtuganova O., Moroz A., Litvinov V., Vladimirskii M., Perelman M., Chernousova L., Erokhin V., Zasedatelev A., Mirzabekov A. // J. Clin. Microbiol. 2001. V. 39. P. 2531–2540. https://doi.org/10.1128/JCM.39.7.2531-2540.2001
Pemov A., Modi H., Chandler D.P., Bavykin S. // Nucleic Acids Res. 2005. V. 33. P. e11.
Cooney C., Sipes D., Thakore N., Holmberg R., Belgrader P. // Biomed. Microdevices. 2012. V. 14. P. 45–53. https://doi.org/10.1093/nar/gnh184
Лапа С.А., Клочихина Е.С., Мифтахов Р.А., Золотов А.М., Заседателев А.С., Чудинов А.В. // Биоорг. химия. 2020. Т. 46. С. 550–552. [Lapa S.A., Klochikhina E.S., Miftakhov R.A., Zolotov A.M., Zasedatelev A.S., Chudinov A.V. // Russ. J. Bioorg. Chem. 2020. V. 46. Р. 859–861.] https://doi.org/10.1134/S1068162020050131
Downer R., Roche F., Park P.W., Mecham R.P., Foster T.J. // J. Biol. Chem. 2002. V. 4. P. 243–250. https://doi.org/10.1074/jbc.M107621200
Morona J.K., Morona R., Miller D.C., Paton J.C. // J. Bacteriol. 2002. V. 184. P. 577–583. https://doi.org/10.1128/jb.184.2.577-583.2002
Doyle J.J., Doyle J.L. // Phytochem. Bulletin. 1987. V. 19. P. 11–15.
Shershov V.E., Lapa S.A., Kuznetsova V.E., Spitsyn M.A., Guseinov T.O., Polyakov S.A., Stomahin A.A., Zasedatelev A.S., Chudinov A.V. // J. Fluoresc. 2017. V. 27. P. 2001–2016.https://doi.org/10.1007/s10895-017-2139-6
Rubina A.Yu., Pan’kov S.V., Dementieva E.I., Pen’kov D.N., Butygin A.V., Vasiliskov V.A., Chudinov A.V., Mikheikin A.L., Mikhailovich V.M., Mipzabekov A.D. // Anal. Biochem. 2004. V. 325. P. 92–106. https://doi.org/10.1016/j.ab.2003.10.010
Lysov Yu., Barsky V., Urasov D., Urasov R., Cherepanov A., Mamaev D., Yegorov Ye., Chudinov A., Surzhikov S., Rubina A., Smoldovskaya O., Zasedatelev A. // Biomed. Opt. Express. 2017. V. 8. P. 114798. https://doi.org/10.1364/BOE.8.004798
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


