Биоорганическая химия, 2021, T. 47, № 5, стр. 647-651
Тиофеновый аналог хромофора GFP как флуороген для белка FAST
Н. С. Балеева 1, 2, *, А. Ю. Смирнов 1, 2, И. Н. Мяснянко 1, 2, А. С. Гавриков 1, М. С. Баранов 1, 2
1 ФГБУН “Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова” РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
2 Российский национальный исследовательский медицинский университет имени Н.И. Пирогова
117997 Москва, ул. Островитянова, 1, Россия
* E-mail: nsbaleeva@gmail.com
Поступила в редакцию 12.03.2021
После доработки 25.03.2021
Принята к публикации 28.03.2021
Аннотация
Синтезировано тиофеновое производное хромофора белка GFP. Установлено, что введение тиофенового заместителя приводит к значительному возрастанию коэффициента экстинкции. Показано, что полученное соединение может быть использовано для флуоресцентной микроскопии в качестве пары для флуороген-активирующего белка FAST.
ВВЕДЕНИЕ
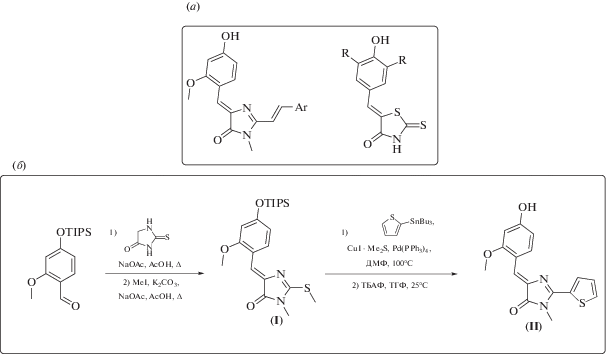
В последние годы популярным типом генетически кодируемых флуоресцентных меток стали так называемые флуороген-активирующие белки [1–3]. Такие белки способны формировать комплексы с флуорогенами – низкомолекулярными люминесцирующими молекулами, имеющими в растворах лишь слабовыраженную флуоресценцию. В результате формирования комплекса и фиксации флуорогена белком происходит многократное усиление флуоресценции [4]. Представитель такой группы белков – белок FAST (Fluorescence-Activating and absorption-Shifting Tag) [5]. Этот белок способен образовывать флуоресцентные комплексы с бензилиденовыми производными роданинов [6] или производными хромофоров флуоресцентных белков [7] (схема 1 ).
На данный момент для белка FAST создано более десятка флуорогенов, имеющих самую разную окраску [8, 9]. Однако все эти вещества образуют флуоресцентные комплексы с умеренной яркостью: их квантовый выход флуоресценции лежит в районе 20–30%, коэффициент экстинкции составляет 20 000–40 000 M–1 см–1. Поскольку яркость флуоресцентных меток – одна из важнейших характеристик, актуальное направление дальнейшего исследования в области создания новых пар “белок FAST – флуороген” – поиск веществ, отличающихся более интенсивными поглощением и/или флуоресценцией. Поэтому целью данной работы стало создание соединения с такими свойствами на основе хромофора GFP.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В настоящей работе мы исследовали, как влияет на оптические свойства флуоресцентного комплекса введение тиофенового заместителя в структуру флуорогена. Хорошо известно, что введение в молекулы красителей такого фрагмента может приводить к заметному росту коэффициента экстинкции [10, 11]. Для синтеза тиофенового аналога хромофора белка GFP (II) нами была выбрана палладий-катализируемая реакция кросс-сочетания (схема 1 ). Этот метод уже был использован для синтеза ряда бензилиденимидазолонов, содержащих различные ароматические заместители во втором положении имидазолона [12, 13]. Целевое соединение было получено с общим выходом 38% из силилированного пара-гидрокси-мета-метоксибензальдегида (схема 1 ).
Схема 1 . (а) – Примеры флуорогенов белка FAST; (б) – схема синтеза соединения (II).
Наличие гидроксигруппы в бензилиденовом фрагменте соединения (II) обеспечивает возможность перехода молекулы в анионную форму. Было установлено, что максимум абсорбции нейтральной формы составляет 432 нм, а анионной – 492 нм. Обе формы характеризуются очень слабой флуоресценцией в области 510–545 нм с квантовым выходом менее 0.05% (табл. 1).
Таблица 1.
Оптические свойства соединения (II) в фосфатном буфере в свободном виде и в виде комплекса с белком FAST
| Соединение/комплекс | Положение максимума абсорбции, нм | Коэффициент экстинкции, M–1 см–1 | Положение максимума эмиссии, нм | Квантовый выход флуоресцен-ции, % | Kd, мкM | |
|---|---|---|---|---|---|---|
| Соединение (II) | Нейтральная форма | 432 | 75 000 | ~510 | <0.05 | – |
| Анионная форма | 492 | 152 500 | 545 | <0.05 | – | |
| Комплекс белка FAST с соединением (II) | 512 | 101 500 | 543 | 2 | 0.21 | |
Дальнейшее исследование показало, что соединение (II) проявляет ярко выраженные флуорогенные свойства. Добавление белка FAST в раствор соединения (II) приводит к увеличению интенсивности флуоресценции в 150 раз и батохромному смещению максимума абсорбции на 80 нм (рис. 1а). Последнее, очевидно, вызвано депротонированием гидроксигруппы, как и для других флуорогенов белка FAST [5]. Мы установили, что комплекс белка FAST с соединением (II) характеризуется квантовым выходом флуоресценции 2% и коэффициентом экстинкции 101 500 M–1 см–1 (табл. 1). Таким образом, нам не удалось заметно повысить яркость, однако мы показали, что введение тиофенового фрагмента в структуру флуорогена позволяет значительно увеличить коэффициент экстинкции.
Рис. 1.
(а) – Спектры абсорбции (черный) и эмиссии (оранжевый) соединения (II) в свободном виде (пунктирные кривые 1 и 2) и в виде комплекса с белком FAST (сплошные кривые 3 и 4) в фосфатном буфере; (б) – флуоресцентная микроскопия живых клеток HeLa Kyoto, временно трансфицированных конструкцией, кодирующей H2B-FAST. Конечная концентрация соединения (II) в растворе – 20 мкМ. Масштабный отрезок – 10 мкм.

Мы исследовали возможность использования соединения (II) для окрашивания живых клеток линии HeLa Kyoto, трансфицированных конструкцией H2B-FAST. При добавлении соединения (II) в клеточную среду наблюдалось появление яркого флуоресцентного сигнала в отсутствие заметного нецелевого окрашивания (рис. 1б).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование. Спектры ЯМР (δ, м.д.; J, Гц) регистрировали на спектрометре Avance III (700 МГц; Bruker, США) при 303 K в DMSO-d6 (внутренний стандарт – Me4Si), спектры поглощения – на спектрофотометре Cary 100 Bio (Varian, США), спектры флуоресценции – на спектрофлуориметре Cary Eclipse (Varian, США). Температуры плавления определяли на приборе SMP 30 (Stuart Scientific, Великобритания) и не исправляли. Масс-спектры высокого разрешения записывали на масс-спектрометре micrOTOF II (Bruker, Германия), ионизация электрораспылением.
(Z)-5-(2-Метокси-4-((триизопропилсилил)окси)бензилиден)-3-метил-2-(метилтио)-3,5-дигидро-4H-имидазол-4-он (I). Смесь 2-метокси-4-((триизопропилсилил)окси)бензальдегида (2 г, 6.5 ммоль), 2-тиоксоимидазолидин-4-она (0.58 г, 5 ммоль) и ацетата натрия (1.76 г, 21.5 ммоль) в уксусной кислоте (15 мл) кипятили в течение 3 ч. Затем при интенсивном перемешивании реакционную смесь разбавляли водой (50 мл). Выпавший осадок отфильтровывали, промывали водой (20 мл) и диэтиловым эфиром (10 мл), сушили под вакуумом. Полученный осадок растворяли в ацетонитриле (65 мл), добавляли иодметан (1.6 мл, 3.7 г, 26 ммоль) и карбонат калия (3.6 г, 26 ммоль). Реакционную смесь кипятили 8 ч, затем охлаждали до комнатной температуры и упаривали на роторном испарителе до четверти исходного объема. Затем остаток разбавляли этилацетатом (350 мл), промывали насыщенным раствором NaCl (150 мл), высушивали над безводным Na2SO4 и упаривали на роторном испарителе. Полученный продукт дополнительно очищали с помощью колоночной хроматографии (элюент хлороформ–этанол, 99 : 1). Желтый порошок (1.7 г, 61%); т. пл. 152–154°C.
1H-ЯМР: 8.74 (д, J2 8.8, 1 H), 7.15 (с, 1 H), 6.58 (дд, J2 8.5, 2.2, 1 H), 6.50 (д, J2 2.3, 1 H), 3.85 (с, 3 H), 3.07 (с, 3 H), 2.70 (с, 3 H), 1.31 (кв, J2 7.5, 3 H), 1.09 (д, J2 7.5, 18 H).
13C-ЯМР: 168.9, 164.0, 159.8, 158.8, 136.0, 133.1, 116.2, 115.3, 112.1, 102.9, 55.7, 26.2, 17.6, 12.4, 12.0.
HRMS (ESI) m/z: найдено М 435.2129; рассчитано для C22H35N2O3SSi+, [M]+ 435.2132.
5-((Z)-4-Гидрокси-2-метоксибензилиден)-3-метил-2-(тиофен-2-ил)-3,5-дигидро-4H-имидазол-4-он (II). (Z)-5-(2-Метокси-4-((триизопропилсилил)окси)бензилиден)-3-метил-2-(метилтио)-3,5-дигидро-4H-имидазол-4-он (0.43 г, 1 ммоль) растворяли в диметилфорамиде (20 мл), добавляли 2-(трибутилстаннил)тиофен (0.35 мл, 1.1 ммоль), раствор CuI ⋅ Me2S в диэтиловом эфире (0.84 M, 1.9 мл, 2.2 ммоль) и тетракис(трифенилфосфин)палладий (0.06 г, 0.05 ммоль) и перемешивали при температуре 100°C в течение 15 ч в инертной атмосфере. Затем реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом (100 мл), промывали водой (3 × × 25 мл), насыщенным раствором хлорида натрия (3 × 25 мл), высушивали над безводным Na2SO4 и упаривали на роторном испарителе. Полученный остаток растворяли в тетрагидрофуране (50 мл), добавляли фторид тетрабутиламмония (0.48 г, 1.5 ммоль) и перемешивали 1 ч при комнатной температуре. Затем реакционную смесь разбавляли этилацетатом (100 мл), промывали фосфатным буфером (pH 7; 5 × 25 мл), насыщенным раствором NaCl (3 × 25 мл), высушивали над безводным Na2SO4 и упаривали на роторном испарителе. Полученный продукт дополнительно очищали с помощью колоночной хроматографии (элюент гексан–этилацетат, 1 : 1). Оранжевый порошок (0.2 г, 62%); т. пл. ~245°С с разложением.
1H-ЯМР: 10.33 (с, 1 H), 8.71 (д, J2 8.6, 1 H), 7.96–7.96 (м, 2 H), 7.39 (с, 1 H), 7.32–7.29 (м, 1 H), 6.53 (дд, J2 8.6, 2.1, 1 H), 6.47 (д, J2 2.1, 1 H), 3.85 (с, 3 H), 3.44 (с, 3 H).
13C-ЯМР: 170.0, 162.1, 160.7, 154.4, 135.1, 133.9, 132.3, 131.8, 130.5, 128.9, 119.9, 114.3, 108.8, 98.7, 55.6, 28.3.
HRMS (ESI) m/z: найдено М 315.0794; рассчитано для C16H15N2O3S+, [M]+ 315.0798.
Экспрессия и выделение белка FAST. Препарат белка FAST получали согласно методике, опубликованной ранее [7].
Флуоресцентная микроскопия. Клеточную линию HeLa Kyoto (получена из EMBL) выращивали в среде DMEM (ПанЭко, Россия) с 50 ед./мл пенициллина, 50 мг/мл стрептомицина (ПанЭко, Россия), 2 мМ L-глутамина (ПанЭко, Россия) и 10% бычьего сывороточного альбумина (HyClone, Thermo Scientific, США) при 37°C и 5% CO2. Для временной трансфекции использовали трансфекционный агент FuGENE 6 (Promega, США). Конструкция H2B-FAST, кодирующая белок слияния гистона H2B с белком FAST, была собрана по стандарту GoldenGate [14]. Непосредственно перед съемкой среду DMEM заменяли на раствор Хэнкса (ПанЭко, Россия) с 20 мM HEPES (Sigma, США).
Широкопольную флуоресцентную микроскопию проводили с помощью микроскопа Leica 6000 (Leica, Германия) с объективом HCX PL APO 100X/1.40-0.70NA. Микроскоп оснащен камерой Zyla sCMOS (Andor) и источником света CoolLED pE-300. При съемке использовали GFP-фильтр. Концентрация флуорогена в среде для имиджинга составляла 20 мкМ, мощность облучения – 2.5 Вт/см2.
ЗАКЛЮЧЕНИЕ
Синтезировано новое производное хромофора GFP, содержащее тиофеновый заместитель во втором положении имидазолонового фрагмента. Установлено, что это соединение способно формировать флуоресцентный комплекс с белком FAST, характеризующийся интенсивным поглощением с коэффициентом экстинкции 101 500 M–1 см–1. Таким образом, можно заключить, что тиофеновые производные хромофоров флуоресцентных белков – перспективная основа для создания новой группы флуорогенов белка FAST, а также прочих флуороген-активирующих белков или иных мишеней.
Список литературы
Xu S., Hu H.Y. // Acta Pharm. Sin. B. 2018. V. 8. P. 339–348. https://doi.org/10.1016/j.apsb.2018.02.001
Péresse T., Gautier A. // Int. J. Mol. Sci. 2019. V. 20. P. 6142. https://doi.org/10.3390/ijms20246142
Gallo E. // Bioconjugate Chem. 2020. V. 31. P. 16–27. https://doi.org/10.1021/acs.bioconjchem.9b00710
Baldridge A., Feng S., Chang Y.T., Tolbert L.M. // ACS Comb. Sci. 2011. V. 13. P. 214–217. https://doi.org/10.1021/co200025e
Plamont M.A., Billon-Denis R., Maurin S., Gauron C., Pimenta F.M., Specht C.G., Shi J., Quérard J., Pan B., Rossignol J., Moncoq K., Morellet N., Volovitch M., Lescop E., Chen Y., Triller A., Vriz S., Saux T., Jullien L., Gautier A. // Proc. Natl. Acad. Sci. USA. 2016. V. 113. P. 497–502. https://doi.org/10.1073/pnas.1513094113
Li C., Plamont M.A., Sladitschek H.L., Rodrigues V., Aujard I., Neveu P., Saux T., Jullien L., Gautier A. // Chem. Sci. 2017. V. 8. P. 5598–5605. https://doi.org/10.1039/C7SC01364G
Povarova N.V., Zaitseva S.O., Baleeva N.S., Smirnov A.Y., Myasnyanko I.N., Zagudaylova M.B., Bozhanova N.G., Gorbachev D.A., Malyshevskaya K.K., Gavrikov A.S., Mishin A.S., Baranov M.S. // Chem. Eur. J. 2019. V. 25. P. 9592–9596. https://doi.org/10.1002/chem.201901151
Myasnyanko I.N., Gavrikov A.S., Zaitseva S.O., Smirnov A.Yu., Zaitseva E.R., Sokolov A.I., Malyshevskaya K.K., Baleeva N.S., Mishin A.S., Baranov M.S. // Chem. Eur. J. 2020. V. 27. P. 3986–3990. https://doi.org/10.1002/chem.202004760
Li C., Tebo A.G., Thauvin M., Plamont M., Volovitch M., Morin X., Vriz S., Gautier A. // Angew. Chemie. 2020. V. 132. P. 18073–18079. https://doi.org/10.1002/ange.202006576
Sun Y., Qu Z., Zhou Z., Gai L., Lu H. // Org. Biomol. Chem. 2019. V. 17. P. 3617–3622. https://doi.org/10.1039/c9ob00030e
Kubota Ya., Kimura K., Jin J., Manseki K., Funabiki K., Matsui K. // New J. Chem. 2019. V. 43. P. 1156–1165. https://doi.org/10.1039/C8NJ04672G
Oumouch S., Bourotte M., Schmitt M., Bourguignon J.-J. // Synthesis. 2005. V. 1. P. 25–27. https://doi.org/10.1055/s-2004-834935
Gosling S., Rollin P., Tatibouët A. // Synthesis. 2011. V. 22. P. 3649–3660. https://doi.org/10.1055/s-0030-1260259
Engler C., Kandzia R., Marillonnet S. // PLoS One. 2008. V. 3. P. e3647. https://doi.org/10.1371/journal.pone.0003647
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия