Биоорганическая химия, 2021, T. 47, № 5, стр. 573-582
Влияние состава липосом на доставку плазмидной ДНК в эукариотические клетки
А. А. Михеев 1, Е. В. Шмендель 2, Г. В. Назаров 1, М. А. Маслов 2, *
1 ФГУП “Научный центр “Сигнал”
107014 Москва, ул. Большая Оленья, 8, Россия
2 Институт тонких химических технологий имени М.В. Ломоносова,
МИРЭА – Российский технологический университет
119571 Москва, просп. Вернадского, 86, Россия
* E-mail: mamaslov@mail.ru
Поступила в редакцию 31.03.2021
После доработки 04.04.2021
Принята к публикации 06.04.2021
Аннотация
Генная терапия – перспективный метод лечения различных заболеваний путем введения терапевтических нуклеиновых кислот, для доставки которых широкое распространение получили катионные липосомы. Показана способность катионных липосом, состоящих из поликатионного липида 2Х3 (1,26-бис(холест-5-ен-3β-илоксикарбониламино)-7,11,16,20-тетраазагексакозан тетрагидрохлорид) и липида-хелпера DOPE (1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин) при различных соотношениях (2.5 : 1 (L1), 2 : 1 (L2), 1.5 : 1 (L3), 1 : 1 (L4), 1 : 1.5 (L5), 1 : 2 (L6) и 1 : 2.5 (L7)), обеспечивать доставку плазмидной ДНК (пДНК) в клетки HEK293 с эффективностью выше, чем у коммерческого препарата Липофектамин 2000. Мы обнаружили, что трансфицирующая активность катионных липосом зависит как от их состава, так и от состава комплексов, формируемых катионными липосомами и пДНК (соотношение N/P). Катионные липосомы не проявляют токсичных свойств по отношению к эукариотическим клеткам HEK293 и при соотношении N/P ≥ 6/1 оказались эффективнее Липофектамина 2000, при этом наибольшая эффективность достигается для образца L2. При более низких значениях N/P = 1/1, 2/1 и 4/1 липосомы L1 обеспечивают активный транспорт нуклеиновых кислот в клетки. Таким образом, для дальнейших экспериментов in vivo выбраны нетоксичные и небольшие по размеру липосомы L1 и L2, в которых содержание амфифила 2Х3 в 2 и более раз превосходит количество липида-хелпера DOPE. Разработанные катионные липосомы могут успешно использоваться в качестве эффективных трансфицирующих агентов.
ВВЕДЕНИЕ
Несмотря на большое количество исследований по поиску и оптимизации систем доставки нуклеиновых кислот (НК), их низкая эффективность по-прежнему остается одним из главных факторов, ограничивающих развитие генной терапии. Разработка транспортной системы, способной эффективно переносить НК в клетки-мишени с минимальным риском возникновения побочных эффектов у пациента, – конечная цель исследований по трансфекции – процесса трансформации клеток эукариот экзогенными НК.
Невирусные системы доставки НК обладают такими преимуществами, как простота синтеза, отсутствие ограничений в размере доставляемых НК, возможность модификации состава, низкая цитотоксичность [1, 2]. К невирусным системам доставки относятся полимеры [3, 4], дендримеры [5, 6] и липосомы [7, 8]. Наиболее эффективные среди них – катионные липосомы [9, 10], состоящие из катионных амфифилов (КА) [11–14]. С целью создания безопасных и эффективных липосом структура КА подвергается различным химическим модификациям, таким как изменение катионной группы [15–19], спейсера [20–23], гидрофобного заместителя [24, 25], а также линкера [26–30], что, в свою очередь, приводит к изменению эффективности трансфекции (ЭТ) клеток. Несмотря на определенные успехи в области разработки липосомальных систем доставки НК, уровень трансфекции эукариотических клеток, необходимый для практического использования, пока не достигнут. Это связано с недостаточным пониманием закономерностей по влиянию состава катионных липосом на их физико-химические параметры и биологическую активность.
Наиболее перспективные для транспорта НК – КА на основе холестерина и природных полиаминов [15, 31–37]. Так, липосомы на основе амфифила 2X3 (1,26-бис(холест-5-ен-3β-илоксикарбониламино)-7,11,16,20-тетраазагексакозан тетрагидрохлорид, рис. 1), содержащего спермин, два холестериновых остатка, карбамоильный линкер и гексаметиленовый спейсер, трансфицировали эукариотические клетки in vitro эффективнее своих аналогов [32], не теряя своей активности в присутствии эмбриональной бычьей сыворотки (FBS).
В состав липосом помимо КА также могут входить липиды-хелперы, которые увеличивают ЭТ. Среди цвиттер-ионных липидов-хелперов часто используются 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин (DOPE) [38, 39] и 1,2-диолеоил-sn-глицеро-3-фосфoхолин (DOPC) [40, 41] (рис. 1). Использование DOPE в составе липосом приводит к эффективной доставке НК по сравнению с DOPC благодаря способности DOPE формировать инвертированную гексагональную фазу в условиях эндосомального закисления [38]. Также было обнаружено, что использование DOPE в качестве липида-хелпера способствует более компактной упаковке НК [29, 41–44]. В составе катионных липосом DOPE может преобладать по содержанию над КА (КА : DOPE, 1 : 4) [34] или находиться в недостатке (КА : DOPE, 7 : 1) [45]. Наиболее часто используемое соотношение между КА : DOPE – соотношение 1 : 1 [32, 33, 35, 41–43, 45].
Другой важный параметр, влияющий на ЭТ, – это состав комплексов, формируемых липосомами и НК, который определяется соотношением количества положительно заряженных атомов азота КА к количеству отрицательно заряженных фосфатных групп НК (N/P). Так, при соотношении N/P = 1/1 катионные липосомы не полностью компактизируют НК, что приводит к низкой ЭТ [46, 47]. Увеличение соотношения N/P увеличивает ЭТ за счет формирования компактных комплексов с избыточным положительным зарядом, обеспечивающим электростатическое взаимодействие с отрицательно заряженной поверхностью мембраны эукариотических клеток [48, 49]. Однако с увеличением соотношения N/P также увеличивается цитотоксичность комплексов [50], что диктует необходимость выбора оптимального соотношения N/P, обеспечивающего разумный баланс между ЭТ и безопасностью липосом.
С целью создания эффективных систем доставки нуклеиновых кислот нами изучено влияние состава катионных липосом, сформированных на основе амфифила 2X3 и цвиттер-ионного липида DOPE, а также соотношения N/P, на физико-химические характеристики липосом, их цитотоксичность и ЭТ с целью выявления оптимальных условий для транспорта пДНК в эукариотические клетки in vitro.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Получение катионных липосом и изучение их физико-химических характеристик. Катионные липосомы L1–L7, состоящие из КА 2X3 и липида-хелпера DOPE (рис. 1) при различном соотношении компонентов (табл. 1), были сформированы с использованием метода гидратации липидной пленки и последующей обработки ультразвуком [46, 47]. Количество DOPE в составе липосом может варьироваться в широком диапазоне значений [44, 45]. Ранее была продемонстрирована высокая эффективность доставки пДНК и siРНК липосомами 2X3-DOPE при мольном соотношении 1 : 1 (L4) [33, 46, 47] и 1 : 2 (L6) [51, 52], однако в одном эксперименте данные липосомы никогда не сравнивались. Кроме того, с целью поиска оптимального состава катионных липосом было важно исследовать соотношения компонентов.
Таблица 1.
Состав катионных липосом, их физико-химические параметры и цитотоксичность для клеток HEK293
| Липосомы | Соотношение, мольн. | Средний размер липосом, нм |
ξ-Потенциал липосом, мВ | Индекс полидис-персности | IC50, мкМ | |
|---|---|---|---|---|---|---|
| 2X3 | DOPE | |||||
| L1 | 2.5 | 1.0 | 75.2 ± 0.6 | 89 ± 1.57 | 0.264 ± 0.030 | >80 |
| L2 | 2.0 | 1.0 | 77.2 ± 1.4 | 88 ± 2.86 | 0.266 ± 0.010 | >80 |
| L3 | 1.5 | 1.0 | 86.2 ± 0.6 | 97 ± 2.46 | 0.259 ± 0.049 | >80 |
| L4 | 1.0 | 1.0 | 73.0 ± 1.2 | 99 ± 2.19 | 0.231 ± 0.076 | >80 |
| L5 | 1.0 | 1.5 | 67.4 ± 0.6 | 100 ± 2.99 | 0.290 ± 0.006 | >80 |
| L6 | 1.0 | 2.0 | 101.6 ± 1.2 | 100 ± 2.57 | 0.260 ± 0.008 | >80 |
| L7 | 1.0 | 2.5 | 130.6 ± 0.8 | 102 ± 2.08 | 0.335 ± 0.015 | >80 |
Первый этап при создании систем доставки НК на основе липосом – изучение их физико-химических параметров. Стабильность таких систем может быть оценена по значениям размера и поверхностного потенциала частиц методом динамического светорассеяния (табл. 1).
Гидродинамический диаметр катионных липосом L1–L7 варьирует от 75.2 до 130.6 нм. Небольшое увеличение размера может быть связано c увеличением количества DOPE в их составе (табл. 1). Ранее было показано, что увеличение количества DOPE в составе катионных липосом с амфифилом SPYRIT-7 приводит, наоборот, к уменьшению их размера [20]. Таким образом, размер липосом зависит не только от количества DOPE, но также от природы КА. Поверхностный заряд всех липосом был положительным (88–102 мВ). Значение индекса полидисперсности катионных липосом L1–L7 указывало на формирование однородных по размеру частиц, за исключением липосом L7 (индекс полидисперсности 0.335).
Цитотоксичность катионных липосом. Цитотоксичность катионных липосом L1–L7 (табл. 1) оценивали с помощью МТТ-теста, используя клетки почки эмбриона человека (НЕК293) [46]. Процент гибели клеток зависит от концентрации липосом. Показатель их токсичности – концентрация, при которой выживает 50% клеток (IC50). Значения IC50, полученные с помощью МТТ-теста на клетках HEK293, не были достигнуты при концентрациях липосом L1–L7 от 5 до 80 мкМ.
Физико-химические характеристики комплексов катионных липосом и пДНК. Комплексы катионных липосом L1–L7 и пДНК pGLuc (0.5 мкг/мл) формировали при различных соотношениях N/P (1/1, 2/1, 4/1, 6/1, 8/1, 10/1) путем смешивания эквивалентных объемов растворов катионных липосом и пДНК в среде DMEM. Ранее было показано, что небольшие по размеру (40–80 нм) комплексы обеспечивают более высокую ЭТ в условиях in vivo, в то время как частицы с размером 200–400 нм оптимальны для трансфекции клеток in vitro [53, 54].
По сравнению с индивидуальными липосомами (табл. 1), при соотношениях N/P = 1/1 и 2/1 гидродинамический диаметр комплексов пДНК с липосомами, содержащими избыток КА (2X3 > 1), увеличивался до значений 200–300 нм (рис. 2а). В случае липосом с соотношением компонентов 2X3/DOPE ≤ 1 диаметр комплексов достигал значений 400–600 нм. Дальнейшее увеличение количества липосом в комплексах (N/P = 4/1) приводило к компактизации пДНК и образованию частиц размером 100–280 нм. Начиная с N/P = = 6/1, размер комплексов практически не изменялся и не превышал 200 нм.
Рис. 2.
Гидродинамический диаметр (а) и ζ-потенциал (б) комплексов катионных липосом L1–L7 и пДНК pGLuc, сформированных при различных соотношениях N/P.

Все исследуемые комплексы катионных липосом с пДНК при соотношении N/P = 1/1 имели отрицательный заряд, который изменялся на положительный, начиная с N/P = 2/1 для липосом L1, L2, L4, L6, L7 и с N/P = 4/1 для липосом L3 и L5 (рис. 2б). Аналогичные закономерности нами наблюдались ранее как для катионных липосом L6, так и для адресных липосом на их основе [35].
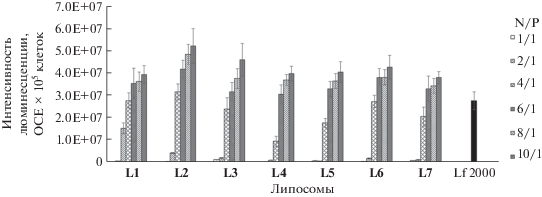
Доставка пДНК катионными липосомами различного состава. С целью оценки эффективности доставки пДНК pGLuc в эукариотические клетки HEK293 с помощью катионных липосом L1–L7 определяли уровень экспрессии люциферазы с помощью люминесцентного анализа, оценивая среднюю интенсивность люминесценции в клеточной популяции. ЭТ сравнивали с коммерческим препаратом Липофектамин 2000, который состоит из смеси поликатионного липида 2,3-диолеилокси-N-[2-(сперминкарбоксамидо)этил]-N,N-диметил-1-пропиламмоний трифторацетата и DOPE и считается “золотым стандартом” среди трансфицирующих реагентов in vitro [55].
Для определения состава катионных липосом и комплексов, оптимальных для доставки пДНК, проводили оценку трансфицирующей активности при разных соотношениях N/P (рис. 3). При соотношении N/P = 1/1 или 2/1 низкая ЭТ наблюдалась для всех исследуемых липосом. Следует отметить, что при соотношении N/P = 2/1 катионные липосомы L1 и L2 с соотношением компонентов 2X3/DOPE ≥ 2 формировали небольшие по размеру комплексы (рис. 2) и более эффективно доставляли пДНК (рис. 3) относительно других липосом. При соотношении N/P = 4/1 все комплексы катионных липосом приобретали положительный заряд (ζ-потенциал > 40 мВ) и компактизовали пДНК до 80–160 нм (рис. 2), что способствовало более эффективной доставке НК (рис. 3). Однако только липосомы L2 превосходили по эффективности коммерческий препарат Липофектамин 2000. При соотношениях N/P ≥ 6/1 все исследуемые липосомы были эффективнее Липофектамина 2000: так, при N/P = 8/1 или 10/1 интенсивность значений люминесценции были от 1.3 до 2 раз выше, чем для Липофектамина 2000. Наибольшие значения наблюдались при соотношении N/P = 10/1 для липосом L2 и L3, содержащих избыток амфифила 2X3. При этом следует отметить, что для липосом L1, L6 и L7 увеличение соотношения N/P, начиная с 6/1, незначительно влияло на ЭТ.
Рис. 3.
Доставка пДНК с помощью катионных липосом в клетки НЕК293. Клетки инкубировали с комплексами, сформированными pGLuc (0.5 мкг на лунку) и катионными липосомами L1–L7 при различных соотношениях N/P. Уровень средней интенсивности люминесценции клеток измеряли методом люминесцентного анализа через 72 ч после инкубации клеток с комплексами. Результаты 12 экспериментов представлены как среднее трех повторов. Доставку pGLuc с помощью Липофектамина 2000 (Lf2000) осуществляли в соответствии с протоколом фирмы-производителя.
Сравнительную оценку ЭТ катионных липосом проводили по отношению к ранее изученным липосомам L4 [33, 46, 47] (рис. 4а) и L6 [51, 52] (рис. 4б). Было обнаружено, что наибольшие различия в ЭТ отмечаются при соотношениях N/P = = 1/1, 2/1 и 4/1 (рис. 4). При более высоких соотношениях N/P ЭТ исследуемых липосом L1–L7 была статистически неразличимой.
Рис. 4.
Сравнительная оценка эффективности трансфекции катионных липосом L1–L3 и L5–L7 по отношению к липосомам L4 (а) и катионных липосом L1–L5 и L7 по отношению к липосомам L6 (б).

Наибольшее различие наблюдалось при соотношении N/P = 2/1 для катионных липосом L1 (2Х3/DOPE = 2.5) с максимальным содержанием амфифила 2Х3, они оказались в 104 раз эффективнее липосом L4 (2Х3/DOPE = 1) и L6 (2Х3/DOPE = = 0.5). Ранее нами было показано, что соотношение N/P = 2/1 – одно из главных условий для адресной доставки НК фолат-содержащими катионными липосомами на основе L6 [51], поэтому увеличение количества поликатионного амфифила 2X3 в составе адресных липосом до 2.5 мольных эквивалентов может привести к значительному усилению экспрессии белка и повысить эффективность направленной доставки в опухолевые клетки. Также следует отметить, что именно липосомы L1 формируют при соотношении N/P = 2/1 самые маленькие комплексы (~200 нм, рис. 2а) с зарядом ~40 мВ (рис. 2б). Дальнейшее увеличение количества липосом в комплексах (N/P = 4/1) приводит как к уменьшению их размера, так и к увеличению их поверхностного заряда, что нивелирует различие в ЭТ между исследуемыми липосомами (рис. 4а, 4б).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение липосом. Катионный амфифил 2Х3 (чистота >95%) синтезировали по описанной ранее методике [31]. В работе использовали цвиттер-ионный фосфолипид DOPE (Avanti Polar Lipids, США) и коммерчески доступный препарат Липофектамин 2000 (Invitrogen, США).
Чистоту синтезированного КА определяли на высокоэффективном жидкостном хроматографе Ultimate 3000, соединенном с масс-спектрометром LCQ Fleet (Thermo Scientific, США). Хроматографирование осуществляли на колонке Thermo Scientific Hypersil Gold C-8 (50 × 2.1 мм, 1.9 мкм) в режиме градиентного элюирования: фаза А – 0.1%-ный раствор муравьиной кислоты в деионизированной воде; фаза В – 0.1%-ный раствор муравьиной кислоты в смеси ацетонитрил/изопропиловый спирт в соотношении 80/20 (V/V).
Для получения липосом к раствору 2Х3 в системе хлороформ–метанол (5/1, V/V) добавляли раствор DOPE в хлороформе при различных соотношениях (табл. 1) и затем осторожно удаляли растворитель под вакуумом на роторном испарителе. Полученную липидную пленку сушили в вакууме масляного насоса (0.01 торр) в течение 4 ч, гидратировали в воде для инъекций (Solopharm, Россия) при 50–60°С в течение 10 мин. Липидные дисперсии обрабатывали ультразвуком в течение 15 мин при 60–65°C в ультразвуковой бане (Bandelin Sonorex Digitec DT 52H, Германия) с последующим фильтрованием через стерильный фильтр (Chromafil CA-45/25 (S), Macherey-Nagel, Германия) с размером пор 450 нм. Полученные катионные липосомы L1–L7 с концентрацией 1 мМ по амфифилу 2Х3 хранили при 4°С в атмосфере аргона.
Нуклеиновые кислоты. В экспериментах для оценки эффективности доставки гена GLuc использовали плазмиду psGLuc-N1 (4544 п.н.) полученную на основе pEGFP-N1 (4733 п.н.; Clontech Laboratories, США, GenBank U55762) путем клонирования в нее гена GLuc из плазмиды pNEBR-X1GLuc (4821 п.н.; New England BioLabs, США).
Получение комплексов катионных липосом с пДНК. Для экспериментов по трансфекции были сформированы комплексы катионных липосом с пДНК в среде DMEM (Invitrogen, США) без сыворотки путем смешивания 50 мкл раствора пДНК (0.5 мкг) в DMEM и 50 мкл раствора липосом L1–L7 в DMEM при соотношениях N/P = = 1/1, 2/1, 4/1, 6/1, 8/1, 10/1 с последующей инкубацией в течение 20 мин при комнатной температуре.
Для измерения физико-химических характеристик 50 мкл липосом смешивали с 950 мкл дистиллированной воды (Milli-Q). Для измерения физико-химических характеристик комплексов 50 мкл пДНК pGLuc в дистиллированной воде (Milli-Q) смешивали с 50 мкл катионных липосом L1–L7 в дистиллированной воде (Milli-Q), при соответствующих соотношениях N/P = 1/1, 2/1, 4/1, 6/1, 8/1 и 10/1, инкубировали в течение 20 мин при 25°С и добавляли 950 мкл дистиллированной воды (Milli-Q).
Физико-химические характеристики липосом и их комплексов с пДНК. Размер и ξ-потенциал липосом и их комплексов с пДНК измеряли на приборе динамического лазерного светорассеивания Malvern Zetasizer Nano (Malvern Instruments Ltd., Великобритания; угол 173°, вязкость 0.890 сП, температура 25°C, время равновесия 2 мин, показатели преломления для воды и липосом 1.33 и 1.46 соответственно). Средний гидродинамический диаметр (нм) по количеству частиц регистрировали как среднее значение трех измерений.
Клеточная линия. Клеточную линию HEK293 (ATCC, США) культивировали в среде DMEM в присутствии 10% FBS с антибиотиком (5000 ед./мл пенициллина и 5000 мкг/мл стрептомицина) в атмосфере 5%-ного СО2 при 37°С.
Тест на жизнеспособность клеток. Клетки HEK293 культивировали в 96-луночных планшетах (плотность посадки 2 × 105 клеток на лунку, инкубация в атмосфере 5%-ного СО2 при 37°С в течение 24 ч). В день проведения эксперимента клеточную среду DMEM + 10% FBS с антибиотиком заменяли растворами липосом L1–L7 с концентрациями 5, 10, 20, 40 и 80 мкМ в DMEM (суммарный объем 150 мл на лунку) в отсутствие FBS и инкубировали в атмосфере 5%-ного СО2 в течение 4 ч при 37°С, после чего добавляли 16 мкл FBS и дополнительно инкубировали 20 ч при 37°С.
По окончании инкубации к клеткам без смены среды добавляли 10 мкл раствора 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолийбромида (МТТ) (Sigma, США) с концентрацией 5 мг/мл. Через 4 ч культуральную среду удаляли, кристаллы формазана растворяли в диметилсульфоксиде (ДМСО, 200 мкл на лунку) и определяли разницу между оптической плотностью при 620 и 570 нм (Multiscan RC, Labsystems, Финляндия) [53]. Из экспериментальных данных вычисляли значение IC50. Результаты были выражены как средние значения для трех параллельных измерений и были статистически обработаны с использованием t-критерия Стьюдента.
Трансфекция клеток. Клетки HEK293 культивировали в 24-луночных планшетах (плотность посадки 2 × 105 клеток на лунку, инкубация в атмосфере 5%-ного СО2 при 37°С в течение 24 ч). Перед проведением трансфекции в планшетах заменяли культуральную среду DMEM + 10% FBS с антибиотиком на среду DMEM + 10% FBS без антибиотика. Комплексы катионных липосом с пДНК объемом 100 мкл добавляли к клеткам. Для равномерного распределения раствора комплексов по всему объему лунки планшет помещали для перемешивания на ротационный миксер, а затем выдерживали в течение 4 ч при 37°C в атмосфере с 5% CO2. Далее заменяли среду на свежую DMEM + 10% FBS с антибиотиком и оставляли в CO2-инкубаторе на 68 ч.
Для определения ЭТ использовали люминесцентный анализ на планшетном люминометре GloMax Multi plus (Promega, США) с автоматическим вводом 50 мкл субстрата BioLux Gaussia Luciferase (New England Biolabs, США), устанавливая параметры по протоколу производителя (5 с интегрирования, 37 с задержки). Все экспериментальные точки были измерены в трех повторах и статистически обработаны с использованием t-критерия Стьюдента.
ЗАКЛЮЧЕНИЕ
В результате проведенных исследований были получены катионные липосомы L1–L7 разного состава на основе амфифила 2X3 и цвиттер-ионного липида DOPE, которые оказались не токсичными в отношении эукариотических клеток HEK293, обладали оптимальными физико-химическими характеристиками и могут быть использованы в качестве систем доставки НК. Для обеспечения более эффективной доставки пДНК содержание поликатионного амфифила 2X3 должно быть больше, чем липида-хелпера DOPE для всех исследуемых соотношений N/P. При соотношении N/P > 4/1 формируются небольшие по размеру положительно заряженные комплексы пДНК с катионными липосомами, которые эффективнее коммерческого препарата Липофектамин 2000. При этом при соотношениях N/P = 8/1 и 10/1 липосомы L2, содержащие 2.0 мольных эквивалента поликатионного амфифила 2X3, обеспечивают максимальный уровень трансфекции клеток. При соотношении N/P = 2/1 липосомы L1, содержащие 2.5 мольных эквивалента амфифила 2X3, оказались эффективнее липосом L2–L7, что может быть использовано для направленного транспорта пДНК.
Разработанные катионные липосомы могут успешно использоваться в качестве эффективных трансфицирующих агентов. Для дальнейших экспериментов in vivo могут быть выбраны нетоксичные, небольшие по размеру липосомы L1 и L2, в которых содержание амфифила 2Х3 в 2 и более раз превосходит количество липида-хелпера DOPE.
Список литературы
Yin H., Kanasty R.L., Eltoukhy A.A., Vegas A.J., Dorkin J.R., Anderson D.G. // Nat. Rev. Genet. 2014. V. 15. P. 541–555. https://doi.org/10.1038/nrg3763
Li S.D., Huang L. // J. Control. Rel. 2007. V. 123. P. 181–183. https://doi.org/10.1016/j.jconrel.2007.09.004
Eliyahu H., Barenholz Y., Domb A.J. // Molecules. 2005. V. 10. P. 34–64. https://doi.org/10.3390/10010034
Saad M., Garbuzenko O.B., Ber E., Chandna P., Khandare J.J., Pozharov V.P., Minko T. // J. Control. Rel. 2008. V. 130. P. 107–114. https://doi.org/10.1016/j.jconrel.2008.05.024
Chaplot S.P., Rupenthal I.D. // J. Pharm. Pharmacol. 2014. V. 66. P. 542–556. https://doi.org/10.1111/jphp.12104
Wu J., Huang W., He Z. // Sci. World J. 2013. V. 29. P. 1–16. https://doi.org/10.1155/2013/630654
Petrilli R., Eloy J.O., Souza M.C., Barcellos J.P.A., Marchetti J.M., Yung B., Lee R.J. // Nanobiomat. Drug Del. 2016. V. 9. P. 78–109. https://doi.org/10.1016/B978-0-323-42866-8.00003-4
Allen T.M., Cullis P.R. // Adv. Drug Del. Rev. 2013. V. 65. P. 36–48. https://doi.org/10.1016/j.addr.2012.09.037
Shim G., Kim M.G., Park J.Y., Oh Y.K. // Asian J. Pharm. Sci. 2013. V. 8. P. 72–80. https://doi.org/10.1016/j.ajps.2013.07.009
Elhissi A., Hassan I.U., Papapanou A., Zeb N., Taylor K.M.G. // Adv. Plan. Lip. Bil. Liposom. 2014. V. 19. P. 53–66. https://doi.org/10.1016/B978-0-12-418699-6.00002-3
Felgner P.L., Gadek. T.R., Holm M., Roman R., Chan H.W., Wenz M., Northrop J.P., Ringold G.M., Danielsen M. // Proc. Natl. Acad. Sci. USA. 1987. V. 84. P. 7413–7417. https://doi.org/10.1073/pnas.84.21.7413
Martin B., Sainlos M., Aissaoui A., Oudrhiri N., Hauchecorne M., Vigneron J.P., Lehn J.M., Lehn P. // Curr. Pharm. Design. 2005. V. 11. P. 375–394. https://doi.org/10.2174/1381612053382133
Maslov M.A., Sycheva E.V., Morozova N.G., Serebrennikova G.A. // Russ. Chem. Bull. 2000. V. 3. P. 385–400. https://doi.org/10.1007/bf02494765
Mintzer M.A., Simanek E.E. // Chem. Rev. 2009. V. 109. P. 259–302. https://doi.org/10.1021/cr800409e
Zhi D., Zhang S., Cui S., Zhao Y., Wang Y., Zhao D. // Bioconjugate Chem. 2013. V. 24. P. 487–519. https://doi.org/10.1021/bc300381s
Biswas J., Mishra S.K., Kondaiah P., Bhattacharya S. // Org. Biomol. Chem. 2011. V. 9. P. 4600–4613. https://doi.org/10.1039/c0ob00940g
Niyomtham N., Apiratikul N., Chanchang K., Opanasopit P., Yingyongnarongkul B.E. // Biol. Pharm. Bull. 2014. V. 37. P. 1534–1542. https://doi.org/10.1248/bpb.b14-00349
Ojeda E., Puras G., Agirre M., Zarate J., Grijalvo S., Eritja R., Martinez-Navarrete G., Soto-Sanchez C., Diaz-Tahoces A., Aviles-Trigueros M., Fernandez E., Pedraz J.L. // Biomaterials. 2016. V. 77. P. 267–279. https://doi.org/10.1016/j.biomaterials.2015.11.017
Puchkov P.A., Shmendel E.V., Luneva A.S., Morozova N.G., Zenkova M.A., Maslov M.A. // Bioorg. Med. Chem. Lett. 2016. V. 26. P. 5911–5915. https://doi.org/10.1016/j.bmcl.2016.11.005
Sharma V.D., Lees J., Hoffman N.E., Brailoiu E., Madesh M., Wunder S.L., Ilies M.A. // Mol. Pharmaceutics. 2014. V. 11. P. 545–559. https://doi.org/10.1021/mp4005035
Cho S.M., Lee H.Y., Kim J.C. // Korean J. Chem. Eng. 2008. V. 25. P. 390–393. https://doi.org/10.1007/s11814-008-0066-6
Rao N.M. // Chem. Physic. Lip. 2010. V. 163. P. 245–252. https://doi.org/10.1016/j.chemphyslip.2010.01.001
Puchkov P.A., Kartashova I.A., Shmendel E.V., Luneva A.S., Morozova N.G., Zenkova M.A., Maslov M.A. // Bioorg. Med. Chem. Lett. 2017. V. 27. P. 3284–3288. https://doi.org/10.1016/j.bmcl.2017.06.026
Ui-Tei K., Naito Y., Takahashi F., Haraguchi T., Ohki-Hamazaki H., Juni A., Ueda R., Saigo K. // Nucl. Acids Res. 2004. V. 32. P. 936–948. https://doi.org/10.1093/nar/gkh247
Chen H.M., Li Y.H., Wu S.H. // PNAS. 2007. V. 104. P. 3318–3323. https://doi.org/10.1073/pnas.0611119104
Choi J.S., Lee E.J., Jang H.S., Park J.S. // Bioconjugate Chem. 2001. V. 12. P. 108–113. https://doi.org/10.1021/bc000081o
Liu D., Hu J., Qiao W., Li Z., Zhang S. Cheng L. // Bioorg. Med. Chem. Lett. 2005. V. 15. P. 3147–3150. https://doi.org/10.1016/j.bmcl.2005.04.010
Liu D., Qiao W., Li Z., Chen Y., Cui X., Li K., Yu L., Yan K., Zhu L., Guo Y. Cheng L. // Chem. Biol. Drug Des. 2008. V. 71. P. 336–344. https://doi.org/10.1111/j.1747-0285.2008.00644.x
Fujiwara T., Hasegawa S., Hirashima N., Nakanishi M., Ohwada T. // Biochim. Biophys. Acta. 2000. V. 1468. P. 396–402. https://doi.org/10.1016/s0005-2736(00)00278-9
Puchkov P.A., Shmendel E.V., Luneva A.S., Zenkova M.A., Maslov M.A. // Chem. Select. 2020. V. 5. P. 4509–4514. https://doi.org/10.1002/slct.201904879
Petukhov I.A., Maslov M.A., Morozova N.G., Serebrennikova G.A. // Russ. Chem. Bull. 2010. V. 59. P. 260–268. https://doi.org/10.1007/s11172-010-0071-x
Maslov M.A., Kabilova T.O., Petukhov I.A., Morozova N.G., Serebrennikova G.A., Vlassov V.V., Zenkova M.A. // J. Control. Release. 2012. V. 160. P. 182–193. https://doi.org/10.1016/j.jconrel.2011.11.023
Markov O.V., Mironova N.L., Maslov M.A., Petukhov I.A., Morozova N.G., Vlassov V.V., Zenkova M.A. // J. Control. Release. 2012. V. 160. P. 200–210. https://doi.org/10.1016/j.jconrel.2011.11.034
Ju J., Huan M.L., Wan N., Hou Y.L., Ma X.X., Jia Y.Y., Li C., Zhou S.Y., Zhang B.L. // Bioorg. Med. Chem. Lett. 2016. V. 26. P. 2401–2407. https://doi.org/10.1016/j.bmcl.2016.04.007
Markov O.V., Mironova N.L., Shmendel E.V., Serikov R.N., Morozova N.G., Maslov M.A., Vlassov V.V., Zenkova M.A. // J. Control. Release. 2015. V. 213. P. 45–56. https://doi.org/10.1016/j.jconrel.2015.06.028
Niyomtham N., Apiratikul N., Suksen K., Opanasopit P., Yingyongnarongkul B.E. // Bioorg. Med. Chem. Lett. 2015. V. 25. P. 496–503. https://doi.org/10.1016/j.bmcl.2014.12.043
Mikheev A.A., Shmendel E.V., Zhestovskaya E.S., Nazarov G.V., Maslov M.A. // Fine Chem. Technol. 2020. V. 15. P. 7–27. https://doi.org/10.32362/2410-6593-2020-15-1-7-27
Zuidam N. J., Barenholz Y. // Biochim. Biophys. Acta. 1998. V. 1368. P. 115–128. https://doi.org/10.1016/s0005-2736(97)00187-9
Zuidam N.J., Hirsch-Lerner D., Margulies S., Barenholz Y. // Biochim. Biophys. Acta. 1999. V. 1411. P. 207–220. https://doi.org/10.1016/s0005-2736(99)00069-3
Balazs D.A., Godbey W.T. // J. Drug Del. 2011. V. 2011. P. 1–12. https://doi.org/10.1155/2011/326497
Pisani M., Mobbili G., Bruni P. // Non-Viral Gene Therapy. 2011. P. 319–348. https://doi.org/10.5772/21283
Gao X., Huang L. // Biochem. Biophys. Res. Commun. 1991. V. 179. P. 280–285. https://doi.org/10.1016/0006-291x(91)91366-k
Leventis R., Silvius J.R. // Biochim. Biophys. Acta. 1990. V. 1023. P. 124–132. https://doi.org/10.1016/0005-2736(90)90017-i
Hassan Farhood H., Natalya Serbina N., Leaf Huang L. // Biochim. Biophys. Acta. 1995. V. 1235. P. 289–295. https://doi.org/10.1016/0005-2736(95)80016-9
Mochizuki S., Kanegae N., Nishina K., Kamikawa Y., Koiwai K., Masunaga H., Sakurai K. // Biochim. Biophys. Acta. 2013. V. 1828. P. 412–418. https://doi.org/10.1016/j.bbamem.2012.10.017
Luneva A.S., Puchkov P.A, Shmendel E.V., Zenkova M.A., Kuzevanova A.Yu., Alimov A.A., Karpukhin A.V., Maslov M.A. // Russ. J. Bioorg. Chem. 2018. V. 44. P. 724–731. https://doi.org/10.1134/S1068162019010084
Shmendel E.V., Bakhareva S.A., Makarova D.M., Chernikov I.V., Morozova N.G., Chernolovskaya E.L., Zenkova M.A., Maslov M.A. // Russ. J. Bioorg. Chem. 2020. V. 46. P. 1250–1260. https://doi.org/10.1134/S106816202006031X
Perrie Y., Gregoriadis G. // Biochim. Biophys. Acta. 2000. V. 1475. P. 125–132. https://doi.org/10.1016/s0304-4165(00)00055-6
Ma B., Zhang S., Jiang H., Zhao B., Lv H. // J. Controll. Rel. 2007. V. 123 P. 184–194. https://doi.org/10.1016/j.jconrel.2007.08.022
Nguyen L.T., Atobe K., Barichello J.M., Ishida T., Kiwada H. // Biol. Pharm. Bull. 2007. V. 30. P. 751–757. https://doi.org/10.1248/bpb.30.751
Kabilova T.O., Shmendel E.V., Gladkikh D.V., Chernolovskaya E.L., Markov O.V., Morozova N.G., Maslov M.A., Zenkova M.A. // Eur. J. Pharm. Biopharm. 2018. V. 123. P. 59–70. https://doi.org/10.1016/j.ejpb.2017.11.010
Shmendel E.V., Kabilova T.O., Morozova N.G., Zenkova M.A., Maslov M.A. // J. Drug Del. Sci. Technol. 2020. V. 57. P. 101609. https://doi.org/10.1016/j.jddst.2020.101609
Carmichael J., De Graff W.G., Gazdar A.F., Minna J.D., Mitchell J.B. // Cancer Res. 1987. V. 47. P. 936–942.
Zhdanov R.I., Podobed O.V., Vlasov V.V. // Bioelectrochem. 2002. V. 58. P. 53–64. https://doi.org/10.1016/s1567-5394(02)00132-9
Dalby B., Cates S., Harris A., Ohki E.C., Tilkins M.L., Price P.J., Ciccarone V.C. // Methods. 2004. V. 33. P. 95–103. https://doi.org/10.1016/j.ymeth.2003.11.023
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия



