Биоорганическая химия, 2022, T. 48, № 1, стр. 87-97
Синтез, нейротропная активность и молекулярный докинг новых конденсированных производных тиено[2,3-b]пиридина
В. В. Дабаева 1, М. Р. Багдасарян 1, Р. Г. Пароникян 1, И. М. Назарян 1, А. Г. Акопян 1, Л. С. Унанян 1, 2, Е. Г. Пароникян 1, Ш. Ш. Дашян 1, *
1 Научно-технологический центр органической и фармацевтической химии НАН Республики Армении
0014 Ереван, просп. Азатутян, 26, Армения
2 Российско-Армянский университет, Институт биомедицины и фармации
0051 Ереван, ул. О. Эмина, 123, Армения
* E-mail: shdashyan@gmail.com
Поступила в редакцию 02.05.2021
После доработки 25.05.2021
Принята к публикации 10.06.2021
- EDN: ZXRMCW
- DOI: 10.31857/S0132342322010031
Аннотация
Разработаны методы получения новых конденсированных производных пиридо[3',2':4,5]ти-ено[3,2-d]пиримидинов на основе 5,6-диметил-2-оксо-1,2-дигидропиридин-3-карбонитрила. Осу-ществлены реакции замещения в 3-м и 4-м положениях 7,8-диметилпиридо[3',2':4,5]тиено[3,2-d]пиримидин-4(3H)-она. Исследована нейротропная активность 12 полученных соединений in vivo на крысах и мышах. У восьми соединений обнаружено противосудорожное действие по антагонизму с коразолом. Четыре отобранные соединения обладали анксиолитическим и активирующим поведение действием. Проведен молекулярный докинг синтезированных соединений для предсказания их взаимодействия с GABAA-рецептором. Выявлено пять соединений, комплексообразование которых с GABAA-рецептором осуществляется в двух местах: бензамидиновом сайте субсайта 1 и субсайте 3 интерфейса ECD, что свидетельствует об ингибирующем действии соединений на мишень.
ВВЕДЕНИЕ
В настоящее время для лечения различных заболеваний широкое применение находят лекарственные препараты, основными биологическими ингредиентами которых выступают конденсированные гетероциклические системы, содержащие пиридиновое кольцо. Это такие известные лекарственные средства, как, например, никотиновая кислота и никотинамид (специфические противопелларгические препараты), пиридоксин (витамин В6), изониазид и фтивазид (известные противотуберкулезные средства) и многие другие. В то же время структура пиримидинсодержащих соединений также одна из интересных в биологическом отношении, т.к. диапазон физиологического действия производных пиримидина разнообразен. Так, например, в медицинской практике широкое применение нашли лекарственные средства, созданные на основе конденсированных гетероциклических систем, содержащих пиримидиновое кольцо, обладающие противоопухолевой [1, 2], антимикробной [3–5], противовоспалительной [6], противосудорожной [7, 8] активностью.
Повышенный интерес к химии и фармакологии тиено[2,3-b]пиридинов и пиридо[3',2':4,5]тиено[3,2-d]пиримидинов как к объектов исследования обусловлен тем, что изучение биологических свойств ранее полученных производных данного ряда выявило множество соединений с высокой нейротропной активностью [9–11].
В настоящее время все применяемые эффективные противосудорожные (противоэпилептические) средства не лишены существенных побочных эффектов. В связи с этим поиск новых, более эффективных и малотоксичных противосудорожных соединений, в том числе с расширенными психотропными свойствами, продолжает оставаться весьма актуальным.
Цель данного исследования – синтез новых конденсированных пиридо[3',2':4,5]тиено[3,2-d]-пиримидинов на основе тиено[2,3-b]пиридинов, изучение их нейротропных свойств in vivo и проведение молекулярного докинга.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтез новых производных тиено[2,3-b]пиридинов и пиридо[3',2':4,5]тиено[3,2-d]пиримидинов. В продолжение исследований по синтезу и изучению биологической активности производных тиенопиримидинов синтезированы 3- и 4-замещенные пиридо[3',2':4,5]тиено[3,2-d]пиримидины (VIa–f) и (VIIIa–f) (схема 1).
Схема 1 . Схема синтеза новых функционально замещенных и конденсированных пиридинов (VIa–f) и (VIIIa–f).
В качестве исходного соединения для получения замещенных в пиримидиновом цикле конденсированных производных (VI) и (VIII) использовали 5,6-диметил-2-оксо-1,2-дигидропиридин-3-карбонитрил (II), полученный взаимодействием метилэтилкетона (I) с этилформиатом и цианоацетамидом в среде этилата натрия и диэтиламина. При кипячении последнего в хлорокиси фосфора в течение 6 ч получен 2-хлоро-5,6-диметилникотинонитрил (III), который в реакции с этиловым эфиром тиогликолевой кислоты превращается в этил-3-амино-5,6-диметилтиено[2,3-b]пиридин-2-карбоксилат (IV). Наличие в тиофеновом кольце последнего удобных функциональных групп позволило осуществить реакцию Ниментовского с получением конденсированного тиено[3,2-d]пиримидин-4-она (V). В последнем обращает на себя внимание легкость алкилирования галогенидами, причем установлено, что замещение осуществляется в положении 3 пиримидинового кольца, о чем свидетельствуют данные ИК-спектров (сохраняется полоса, присущая группе C=O при 1670 см–1, и отсутствует полоса поглощения, соответствующая сигналу группы NH).
Для установления влияния характера заместителей в положении 4 в пиримидиновом кольце на биологическую активность полученных соединений пиримидинон (V) превращен под действием хлорокиси фосфора в хлорпроизводное (VII), причем установлено, что присутствие пиридина значительно повышает выход соответствующего хлорпроизводного (VII). Дальнейшее замещение атома хлора различными аминами позволяет получать целевые продукты (VIIIa–f) с высокими выходами.
Биологическая активность полученных соединений. Было проведено экспериментальное исследование нейротропных свойств 12 новых синтезированных производных пиридотиенопиримидинов (VIa–f) и (VIIIa–f) in vivo на двух видах животных, включая изучение противосудорожной активности на мышах и психотропного действия (исследовательская активность в тесте “открытое поле” на крысах, антитревожное действие в тесте “приподнятый крестообразный лабиринт” на мышах и миорелаксантный эффект в тесте “вращающийся стержень” на мышах).
Исследование противосудорожной активности 12 соединений (VIa–f) и (VIIIa–f) проводили на белых беспородных мышах (n = 250). Соединения вводили внутрибрюшинно в обьеме 0.2 мл в следующих дозах: 12.5, 25, 50, 75 и 100 мг/кг. Каждую дозу соединений по каждому тесту изучали на шести животных. Препаратами сравнения служили известные препараты этосуксимид (200 мг/кг) и диазепам (2 мг/кг). Противосудорожную и прогностическую транквилизирующую активность изучали по влиянию соединений на клонические подергивания и коразоловые (пентилентетразол, ПТЗ) судороги в тесте “антагонизм с коразолом”.
При анализе данных по антикоразоловому эффекту на мышах было обнаружено, что изучаемые соединения в выявленной оптимальной дозе 50 мг/кг в той или степени проявляют антикоразоловое действие. В табл. 1 представлены ЕD50 (эффективные дозы, вызывающих противосудорожный эффект у 50% животных) активных соединений: (VIa), (VIc), (VIe), (VIf), (VIIIa), (VIIIc), (VIIId) и (VIIIe). Остальные соединения проявляли слабое противосудорожное действие – 20–40%-ную эффективность. Активные соединения, так же как препараты сравнения этосуксимид и диазепам, предотвращают клонические коразоловые судороги. Соединения по антикоразоловой активности превосходят этосуксимид в несколько раз. Однако, в отличие от диазепама, эта активность проявлялась в более высоких дозах – 34–62 мг/кг (табл. 1). Сравниваемый транквилизатор диазепам обладал антикоразоловой активностью у 50% мышей в дозе 0.5 мг/кг. В изучаемых дозах все соединения и этосуксимид не вызывали миорелаксацию у мышей, тогда как диазепам уже в дозе 2–3 мг/кг вызывает миорелаксацию.
Из всех исследованных соединений были отобраны четыре самые эффективные соединения (имеющие самые низкие значения ЕD50): соединения (VIc), (VIe), (VIf) и (VIIIe).
Были исследованы некоторые психотропные свойства этих соединений − исследовательская активность в тесте “открытое поле” на крысах и антитревожное действие в тесте “приподнятый крестообразный лабиринт” (ПКЛ) на мышах. Сравнение проводили только с диазепамом, т.к. в этих тестах этосуксимид неактивен.
В поведенческом тесте “открытое поле” у крыс контрольной группы к диазепаму и к данным соединениям количество горизонтальных перемещений составляло 55.0, вертикальных – 6.4, а количество обследованных ячеек – 8.6 (табл. 2). И-сследуемые соединения вызывали некоторое изменение показателей поведения по сравнению с контролем. При введении соединений (VIc), (VIe), (VIf), (VIIIe) и диазепама наблюдалось активирующее действие – статистически достоверное увеличение всех показателей (горизонтальные, вертикальные перемещения) по сравнению с контролем. Статистически достоверно увеличивалось также и количество обследованных ячеек после введения отобранных соединений и диазепама, т.е. имеет место выраженное антитревожное действие исследованных соединений, особенно у соединений (VIc) (25.5) и (VIf) (28.2).
Таблица 1.
Антикоразоловая активность и миорелаксация соединений (VIa), (VIc), (VIe), (VIf), (VIIIa), (VIIIc), (VIIId), (VIIIe) и препаратов сравнения этосуксимида и диазепама на мышах (n = 250)
| Соединение | Доза, мг/кг | Антагонизм с коразолом* (ED50, мг/кг) |
Миорелаксация (TD50, мг/кг) |
|---|---|---|---|
| (VIa) | 50 | 44 (32.6–59.4) | >500 |
| (VIc) | 50 | 40 (32.0–50.0) | >500 |
| (VIe) | 50 | 34.0 (29.6–39.1) | >500 |
| (VIf) | 50 | 34.5 (28.8–41.4) | >500 |
| (VIIIa) | 50 | 62 (53.9–71.3) | >500 |
| (VIIIc) | 50 | 48 (39.7–58.1) | >500 |
| (VIIId) | 50 | 56 (46.6–67.2) | >500 |
| (VIIIe) | 50 | 36 (23.8–48.2) | >500 |
| Этосуксимид | 200 | 155 (117.5–204.5) | 520.0 (426–634) |
| Диазепам | 2 | 0.5 (0.4–0.7) | 2.7 (1.4–5.5) |
Таблица 2.
Исследовательская активность соединений (VIc), (VIe), (VIf), (VIIIe) и препарата сравнения диазепа-ма в тесте “открытое поле” на крысах (n = 30)
| Соединение | Доза, мг/кг | Количество (в абсолютных значениях за 5 мин) | ||
|---|---|---|---|---|
| горизонтальных перемещений | вертикальных перемещений | обследованных ячеек | ||
| Контроль (эмульгатор) | – | 55.0 ± 12.5 | 6.4 ± 2.1 | 8.6 ± 2.3 |
| (VIc) | 50 | 124.3 ± 8.5* | 12.0 ± 2.4* | 25.5 ± 4.2* |
| (VIe) | 50 | 77.0 ± 5.3* | 10.8 ± 2.2* | 14.2 ± 3.4* |
| (VIf) | 50 | 126.4 ± 9.6* | 11.8 ± 2.7* | 28.2 ± 5.5* |
| (VIIIe) | 50 | 102.8 ± 5.6* | 9.6 ± 1.8* | 22.2 ± 7.6* |
| Диазепам | 2 | 135.6 ± 4.2* | 13.5 ± 3.7* | 14.5 ± 3.3* |
В тесте ПКЛ (экспериментальная модель страха) мыши контрольной группы преимущественно находились в закрытых рукавах (табл. 3). Введение соединений, а также препарата сравнения диазепама привело к статистически значимому снижению времени нахождения животных в закрытых рукавах, а также уменьшению числа заходов в закрытые рукава. Экспериментальные мыши долгое время находились в центре лабиринта, в отличие от животных контрольной группы и животных, которым вводили диазепам, что может свидетельствовать о некой защитной реакции исследованных соединений. В отличие от контрольной группы, животные под воздействием всех отобранных соединений (VIc), (VIe), (VIf) и (VIIIe) в дозе 50 мг/кг, а также диазепама (2 мг/кг) статистически достоверно долгое время находились в открытых рукавах, особенно после введения соединений (VIc) (82 с) и (VIf) (99 с). Таким образом, у соединений (VIc) и (VIf) выявлено выраженное анксиолитическое действие.
Таблица 3.
Влияние соединений (VIc), (VIe), (VIf), (VIIIe) и препарата сравнения диазепама в тесте “приподнятый крестообразный лабиринт” (5 мин исследований) на мышах (n = 30)
| Соединение | Доза, мг/кг | Время нахождения в закрытых рукавах, с | Число заходов в закрытые рукава, с | Время нахождения в центре, с | Время нахождения в открытых рукавах, с |
|---|---|---|---|---|---|
| Контроль | – | 293.2 (261.8–328.4) | 5.8 (5.1–6.67) | 3.0 (2.6–3.45) | 3.8 (3.17–4.56) |
| (VIc) | 50 | 164.0 (136.7–196.8)* | 4.0 (3.3–4.8)* | 54 (45–64.8)* | 82.0 (72.6–92.7)* |
| (VIe) | 50 | 199.0 (160.1–237.9)* | 8.8 (5.0–12.6) | 95.0 (79.8–110.2)* | 6.0 (2.8–9.2)* |
| (VIf) | 50 | 142.0 (123.5–163.3)* | 3.6 (3.1–4.1)* | 59 (51.3–67.8)* | 99.0 (82.5–110.4)* |
| (VIIIe) | 50 | 248.8 (216.3–286)* | 4.8 (4.25–5.4) | 34 (29.6–39.1)* | 17.2 (14.3–20.6)* |
| Диазепам | 2 | 213.2 (177.7–255.8)* | 5.5 (4.58–6.6) | 50.8 (42.3–61)* | 36.0 (31.3–41.4)* |
Молекулярный докинг. В связи с тем, что большинство изученных соединений проявляют антагонизм к коразолу, а механизм судорожного действия коразола обусловлен угнетающим влиянием на GABAА-рецепторы, для прогноза возможных типов и механизмов действия на мишень в данной работе дополнительно был проведен молекулярный докинг с GABAА-рецепторами.
Эксперименты in silico проводили для всех 16 полученных соединений с использованием методов молекулярного моделирования и компьютерного анализа (детали приведены в “Эксперим. части”). Полученные нами результаты свидетельствуют о том, что соединения (VIb), (VId), (VIe), (VIf) и (VIIIe) (топ-5) показывают высокие значения биофизических показателей комплексообразования по сравнению с остальными соединениями. Необходимо отметить, что взаимодействие соединения (VIIId) с GABAA-рецептором не наблюдается (рис. 1).
Взаимодействия в системе лиганд–мишень для всех исследуемых соединений с GABAA-рецептором осуществляются в основном за счет гидрофобных связей и электростатических сил, при этом у некоторых соединений наблюдается присутствие водородных связей. Рассчитанные биофизические показатели комплексообразования для соединений топ-5 приведены в табл. 4.
Таблица 4.
Биофизические параметры комплексообразования соединений, показавших наилучший результат при взаимодействии с GABAA-рецептором (PDBID: 4COF)
| Соединение | Энергия связывания, ккал/моль |
Константа связывания Кb |
|---|---|---|
| (VIb) | –9.01 ± 0.45 | 3.70 × 106 |
| (VId) | –8.80 ± 0.44 | 2.59 × 106 |
| (VIe) | –9.10 ± 0.45 | 4.29 × 106 |
| (VIf) | –9.20 ± 0.46 | 5.08 × 106 |
| (VIIIe) | –8.37 ± 0.41 | 1.25 × 106 |
Кластерный анализ мест связывания для соединений, показывающих наилучший результат при комплексообразовании с GABAA-рецептором, свидетельствует о том, что связывание осуществляется в двух местах (рис. 2), оба места находятся во внеклеточном домене интерфейса ECD (extracellular domen) и затрагивают два известных для малых молекул субсайта с вовлечением цепей A, B, C и D [12]. Первый сайт связывания – бензамидиновый сайт субсайта 1 интерфейса ECD, образованный аминокислотными остатками, включенными в цепи B и C, а также C и D [13]. Второй сайт связывания – субсайт 3 интерфейса ECD, характеризующийся связыванием соединений, которое оказывает ингибирующее действие на мишень. Второй сайт связывания – специфический сайт связывания для катионов, он обычно формируется между α+/β– субъединицами цепей с вовлечением аминокислотных остатков в позициях 127, 137 и 184 [14]. Соединения (VIb), (VId), (VIe) и (VIIIe) связываются с субсайтом 1. Соединения (VId) и (VIe) связываются в субсайте 1, образованном цепями B и C. У соединения (VIe) наблюдается присутствие возможных водородных связей с расстоянием 2.9 и 3.3 Å. Первый образуется между фтором ароматического кольца (VIe) и Gln64 цепи B с углом 51.2°, а второй – между Thr202 цепи C с углом 60.0°. У двух соединений наблюдаются также гидрофобные и электростатические силы при комплексообразовании с аминокислотными остатками Asp43, Tyr62, Thr176, Phe200, Ala201 и Tyr205 (рис. 3).
Рис. 3.
Суперпозиционирование положений соединений (VId) (фиолетовый) и (VIe) (красный) в субсайте 1 цепей B и C ECD GABAA-рецептора.
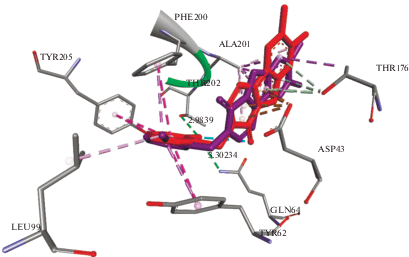
Что касается соединений (VIb) и (VIIIe), то они связываются в субсайте 1 цепей C и D ECD (рис. 4). У соединения (VIIIe) наблюдается как гидрофобный, так и электростатический тип связей, при этом взаимодействия с соединением (VIb) имеют исключительно гидрофобный характер. У данных соединений водородных связей при комплексообразовании не наблюдается. Построенные конформационные карты комплексообразования свидетельствуют о том, что аминокислотные остатки, вовлеченные в процесс комплексообразования, отличаются. Соединение (VIb) связывается с Thr176 и Tyr205, у соединения (VIIIe) такие связи отсутствуют.
Рис. 4.
Суперпозиционирование положений соединений (VIb) (желтый) и (VIIIe) (синий) в субсайте 1 цепей C и D ECD GABAA-рецептора.

Для идентификации механизмов действия соединений, связывающихся с субсайтом 1 интерфейса ECD, были выявлены аминокислотные остатки, входящие в процесс комплексообразования. Результаты свидетельствуют о том, что аминокислотные остатки Asp43, Phе200 и Ala201 у всех четырех лигандов идентичны. С остатками Thr176 и Tyr205 взаимодействие не наблюдается только у соединения (VIIIe) (табл. 5). Эти остатки играют ключевую роль при связывании малых молекул с субсайтом 1 ECD [15].
Таблица 5.
Ключевые аминокислотные остатки, входящие в процесс комплексообразования, для соединений (VIb), (VId), (VIe) и (VIIIe) при взаимодействии с субсайтом 1 интерфейса ECD
| Соеди-нение | Аминокислотный остаток | |||||
|---|---|---|---|---|---|---|
| Asp43 | Tyr62 | Thr176 | Phе200 | Ala201 | Tyr205 | |
| (VIb) | + | – | + | + | + | + |
| (VId) | + | + | + | + | + | + |
| (VIe) | + | + | + | + | + | + |
| (VIIIe) | + | + | – | + | + | – |
Взаимодействие соединения (VIf) в субсайте 3 осуществляется в основном за счет гидрофобных сил с вовлечением аминокислотных остатков Val50, Met55, Ala135, Met137 и Pro184 (рис. 5). Наблюдается также электростатическое взаимодействие с Pro273 и Lys274.
Рис. 5.
Пространственное расположение и конформационная карта комплексообразования соединения (VIf) в субсайте 3 ECD GABAA-рецептора.

Необходимо отметить, что из топ-5 соединение (VIf) имеет самое высокое значение констант связывания (Кb = 5.08 × 106). На основе полученных пространственно-энергетических параметров данное соединение можно классифицировать как ингибитор GABAA-рецепторов [16].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали коммерческие реактивы фирм Fluka (Германия) и Sigma-Aldrich (США). Растворители очищали по стандартным методикам. Температуры плавления определяли на микронагревательном столике марки Boetius (Германия). Элементный анализ проводили на приборе Elemental Analyzer Euro EA 3000 (E-uroVector, Германия). ИК-спектры регистрировали на спектрометре Nicolet Avatar 330 FT-IR (Thermo Scientific, США) в вазелиновом масле, спектры ЯМР 1Н и 13С (δ, м.д.; КССВ J, Гц) – на спектрометре Mercury 300 Vx (Varian, США) с частотой 300 и 75.462 МГц соответственно в DM-SO-d6/CCl4, 1/3, стандарт – тетраметилсилан.
Данные элементного анализа и спектральные данные для всех синтезированных соединений приведены в дополнительных материалах.
5,6-Диметил-2-оксо-1,2-дигидропиридин-3-карбонитрил (II). К этилату натрия (2.3 г (0.1 моль) натрия в 50 мл абсолютного этанола, охлажденного до 0°С), при перемешивании добавляли по каплям 7.2 г (0.1 моль) метилэтилкетона (I), затем 22.4 г (0.3 моль) этилформиата. Смесь оставляли при комнатной температуре на сутки. На следующий день к смеси при охлаждении (0−5°С) добавляли 50 мл воды и раствор, полученный растворением 8.4 г (0.08 моль) цианоацетамида в 30 мл воды. К полученной реакционной смеси добавляли 2 мл диэтиламина и нагревали в течение 6 ч, поддерживая температуру не выше 35°С. После охлаждения полученные кристаллы отфильтровывали, промывали водой, эфиром, перекристаллизовывали из спирта. Выход 31%, т. пл. 292°С.
5,6-Диметил-2-хлоро-3-цианопиридин (III). Смесь 1.5 г (0.01 моль) соединения (II) и 35 мл хлорокиси фосфора нагревали на кипящей водяной бане в течение 8 ч. Затем избыток хлорокиси фосфора отгоняли в вакууме, остаток подщелачивали водным раствором NaOH при охлаждении ледяной водой, выпавшие кристаллы отфильтровывали, промывали водой, перекристаллизовывали из смеси CHCl3−EtOH (3 : 1). Выход 71%, т. пл. 100–101°С.
Этил-3-амино-5,6-диметилтиено[2,3-b]пиридин-2-карбоксилат (IV). К этилату натрия, приготовленному из 0.23 г (0.01 моль) металлического натрия и 25 мл абсолютного этанола, при перемешивании добавляли по каплям 1.2 г (0.01 моль) этилового эфира тиогликолевой кислоты и 1.7 г (0.01 моль) соединения (III). Реакционную смесь кипятили при перемешивании в течение 6 ч. Затем растворитель отгоняли, добавляли 10 мл воды, выпавшие кристаллы отфильтровывали, промывали водой, эфиром, перекристаллизовывали из смеси CHCl3−EtOH (4 : 1). Выход 75%, т. пл. 249–250°С.
7,8-Диметилпиридо[3',2':4,5]тиено[3,2-d]пиримидин-4(3H)-он (V). Смесь 2.5 г (0.01 моль) соединения (IV) и 20 мл формамида нагревали в течение 2 ч при 190–200°С. После охлаждения к смеси добавляли 20 мл воды, выпавшие кристаллы отфильтровывали, промывали водой, эфиром, перекристаллизовывали из смеси CHCl3−EtOH (5 : 1). Выход 92%, т. пл. >350°С.
Общая методика получения соединений (VIa–f). Смесь 2.3 г (0.01 моль) соединения (V), 1.7 г (0.012 моль) поташа и 10 мл абсолютного ДМФA кипятили в течение 1 ч. После охлаждения к смеси добавляли 0.012 моль соответствующего галогенпроизводного и кипятили в течение 2 ч. Затем смесь охлаждали, добавляли ледяную воду, полученные кристаллы отфильтровывали, промывали водой, эфиром, перекристаллизовывали из этанола.
7,8-Диметил-3-(3-метилбутил)пиридо[3',2':4,5]-тиено[3,2-d]пиримидин-4(3H)-он (VIa). Выход 72%, т. пл. 160–161°С.
7,8-Диметил-3-(2-фенилэтил)пиридо[3',2':4,5]-тиено[3,2-d]пиримидин-4(3H)-он (VIb). Выход 73%, т. пл. 184–185°С.
2-(7,8-Диметил-4-оксопиридо[3',2':4,5]тиено-[3,2-d]пиримидин-3(4H)-ил)ацетамид (VIc). Выход 85%, т. пл. >310°С.
3-(2-Хлорбензил)-7,8-диметилпиридо[3',2':4,5]-тиено[3,2-d]пиримидин-4(3H)-он (VId). Выход 69%, т. пл. 206–207°С.
3-(2-Фторбензил)-7,8-диметилпиридо[3',2':4,5]-тиено[3,2-d]пиримидин-4(3H)-он (VIe). Выход 64%, т. пл. 203–204°С.
N-(3-Хлорфенил)-2-(7,8-диметил-4-оксопиридо[3',2':4,5]тиено[3,2-d]пиримидин-3(4H)-ил)-ацетамид (VIf). Выход 70%, т. пл. 302–303°С.
4-Хлоро-7,8-диметилпиридо[3',2':4,5]тиено-[3,2-d]пиримидин (VII). Смесь 2.3 г (0.01 моль) соединения (V), 2 мл абсолютного пиридина и 30 мл хлорокиси фосфора нагревали в течение 4 ч при 105°С. Избыток хлорокиси фосфора отгоняли в вакууме, к остатку при охлаждении льдом и солью добавляли 20 мл ледяной воды. Затем смесь нейтрализовывали 25%-ным водным раствором аммиака, выпавшие кристаллы отфильтровывали, промывали водой, перекристаллизовывали из этанола. Выход 68%, т. пл. 185–186°С.
Общая методика получения соединений (VIIIa–f). Смесь 2.5 г (0.01 моль) соединения (VII) и 0.012 моль соответствующего амина в 10 мл абсолютного этанола кипятили в течение 6 ч. После отгонки растворителя остаток обрабатывали холодной водой, выпавшие кристаллы отфильтровывали, промывали водой, эфиром, перекристаллизовывали из смеси CHCl3−EtOH (3 : 1).
N-Изопропил-7,8-диметилпиридо[3',2':4,5]тиено[3,2-d]пиримидин-4-амин (VIIIa). Выход 64%, т. пл. 269–270°С.
N-(2-Метоксиэтил)-7,8-диметилпиридо[3',2':4,5]-тиено[3,2-d]пиримидин-4-амин (VIIIb). Выход 62%, т. пл. 159–160°С.
4-(4-Этилпиперазин-1-ил)-7,8-диметилпиридо[3',2':4,5]тиено[3,2-d]пиримидин (VIIIc). Выход 58%, т. пл. 109–110°С.
7,8-Диметил-4-морфолин-4-илпиридо[3',2':4,5]-тиено[3,2-d]пиримидин (VIIId). Выход 73%, т. пл. 174–175°С.
7,8-Диметил-4-пиперидин-1-илпиридо[3',2':4,5]-тиено[3,2-d]пиримидин (VIIIe). Выход 76%, т. пл. 132–133°С.
7,8-Диметил-4-пиперазин-1-илпиридо[3',2':4,5]-тиено[3,2-d]пиримидин (VIIIf). Выход 62%, т. пл. 95–96°С.
Экспериментальные животные. Биологические свойства полученных соединений изучали in vivo на животных двух видов: белых беспородных мышах (n = 280, масса 18–24 г) и белых беспородных крысах (n = 30, масса 130–140 г) обоего пола, полученных из вивария Института тонкой органической химии им. А.Л. Мнджояна (Армения).
Нейротропные свойства исследуемых соединений. Противосудорожную и прогностическую транквилизирующую активность 12 соединений изучали по влиянию соединений на клонические подергивания и судороги, вызываемые подкожным введением коразола (в дозе 90 мг/кг, 0.2 мл) мышам (пентилентетразол, Acros Organics, США) [17–19]. Соединения вводили внутрибрюшинно в обьеме 0.2 мл в следующих дозах: 12.5, 25, 50, 75 и 100 мг/кг. Каждую дозу соединений по каждому тесту изучали на шести животных. Животным контрольной группы внутрибрюшинно вводили эмульгатор (суспензия Tween-80 с карбоксиметилцеллюлезой, 0.2 мл). Препаратами сравнения служили противосудорожный препарат из группы сукцинимидов этосуксимид (Neuraxpharm Arzneimittel GmbH, Германия) и известный транквилизатор диазепам (Polfa, Польша). Последний препарат был взят для сравнения в связи с тем, что у некоторых производных пиридотиенопиримидинов обнаруженo антитревожное действие [20, 21]. Препараты сравнения применялись внутрибрюшинно в том же обьеме и в тех же условиях, как и исследованные соединения. Диазепам вводили в дозах 0.1, 0.2, 0.5 и 1.0 мг/кг, а этосуксимид – в дозах 100, 150, 200 и 300 мг/кг.
Для отобранных соединений изучали также исследовательскую активность при регистрации спонтанного двигательно-исследовательского поведения в модифицированном тесте “открытое поле” на крысах (в каждой группе по шесть животных). Использовали установку, имеющую отверстия (ячейки), дно которой разделено на квадраты. Опыты проводили в дневное время при естественном освещении. Исследуемые соединения вводили крысам внутрибрюшинно в наиболее эффективной противосудорожной дозе – 50 мг/кг, в объеме 0.2 мл. Животным контрольной группы вводили эмульгатор (суспензия Tween-80 с карбоксиметилцеллюлозой) в объеме 0.2 мл. В течение 5 мин эксперимента у животных опытной и контрольной групп определяли количество горизонтальных перемещений (пересечений квадратов), обнюхиваний ячеек и вставания на задние лапки (вертикальные перемещения) [22, 23].
Антитревожное, седативное и антидепрессивное действие изучали в тесте “приподнятый крестообразный лабиринт” (ПКЛ) на мышах, разработанном Pellow et al. (1986) [24, 25]. ПКЛ – это приподнятая над полом крестообразная установка, имеющая по паре расположенных друг напротив друга открытых и закрытых рукавов. В норме животные предпочитают большую часть времени проводить в закрытых (темных) рукавах лабиринта. При этом фиксируется время, проведенное в закрытом рукаве, количество попыток зайти в закрытые рукава и время нахождения в центре установки. В вышеуказанной модели исследуемые соединения и сравниваемые препараты вводили внутрибрюшинно до проведения экспериментов. Животным контрольной группы вводили эмульгатор в объеме 0.2 мл. Результаты эксперимента обрабатывали статистически (р ≤ 0.05).
Изучено также побочное нейротоксическое (миорелаксантное) действие соединений на мышах в дозах 50–100 мг/кг при внутрибрюшинном введении, а также препаратов сравнения (этосуксимид и диазепам) в эффективных противосудорожных дозах. Миорелаксацию мышей исследовали в тесте “вращающийся стержень” [17, 26]. Мышей сажали на металлический стержень с гофрированным резиновым покрытием, который вращался со скоростью 5 об/мин. Определяли число животных, не способных удерживаться на нем в течение 2 мин. Для определения ED50 (эффективных доз, вызывающих противосудорожный эффект у 50% животных) использовали статистический метод пробит-анализа по Литчфильду и Уилкоксону [27].
Установки для тестов “открытое поле”, “приподнятый крестообразный лабиринт” и “вращающийся стержень” были изготовлены в инженерном отделе Института тонкой органической химии им. А.Л. Мнджояна (Армения).
Молекулярный докинг. Молекулярные модели исследуемых соединений были сконструированы с помощью программного пакета ChemOffice (Cambridgesoft). Энергетическую минимизацию моделей осуществляли с использованием силового поля ММ2 [28]. В качестве мишени использовали молекулярную модель GABAА-рецептора из базы данных RCSB с идентификационным номером PDBID: 4COF [29]. Для молекулярного докинга была выбрана программа AutodockVina [30]. В качестве методологии применяли парный докинг с использованием “слепого способа”. In silico эксперимент проводили десятикратно с 20 начальными конформерами при континууме исчислений (exhaustiveness) 500, объем пространственного бокса не превышал 27 000 Å3. Отбор наилучших конформеров осуществляли на основе среднеквадратичного отклонения атомов со значением RMSD ≤ 2 Å [31]. Кластеризацию данных проводили на основе алгоритма FOREL в среде Python [32]. Статистический анализ результатов in silico экспериментов осуществляли с учетом стандартных отклонений, средних значений, стандартных средних ошибок. Конформационный анализ комплексообразования проводили с использованием BIOVIA Discovery Studio Visuali-zer [33]. Расчет константы связывания осуществляли с использованием уравнения:
где ΔGcalc – энергия взаимодействия, R – газовая постоянная, T – абсолютная температура, K – константа связывания.ЗАКЛЮЧЕНИЕ
Разработаны методы синтеза новых конденсированных производных пиридо[3',2':4,5]тиено[3,2-d]пиримидинов. Осуществлена реакция Ниментовского взаимодействием этил-3-амино-5,6-диметилтиено[2,3-b]пиридин-2-карбоксилата с формамидом.
Исследование нейротропных свойств 12 синтезированных производных позволило обнаружить у многих представителей этого ряда (восемь соединений) противосудорожное действие по антагонизму с коразолом. Соединения по противосудорожному действию превосходили этосуксимид, но уступали диазепаму. В противосудорожных дозах соединения не проявляли центральную миорелаксирующую активность, как и этосуксимид, в отличие от транквилизатора диазепама. Все отобранные соединения, как и диазепам, обладали активирующим и анксиолитическим действием в поведенческом тесте “открытое поле”. Полученные данные в тесте ПКЛ говорят об антитревожной активности всех отобранных соединений в дозе 50 мг/кг, как и диазепама в дозе 2 мг/кг.
В результате молекулярного докинга был выделен топ-5 соединений с высокими значениями биофизических показателей комплексообразования по сравнению с остальными соединениями. Показано, что взаимодействиe соединений с GABAA-рецептором осуществляется в основном за счет гидрофобных связей и электростатических сил. С использованием кластерного анализа также установлено, что связывание соединений при комплексообразовании с GABAA-рецепторами осуществляется в двух местах: бензамидиновом сайте субсайта 1 и субсайте 3 интерфейса ECD. На основе полученных пространственно-энергетических параметров можно сделать вывод об ингибиторном действии исследуемых соединений на GABAA-рецепторы.
При изучении связи между химическим строением и биологической активностью синтезированных соединений было установлено, что наиболее выраженными противосудорожными свойствами обладают пиридо[3',2':4,5]тиено[3,2-d]пиримидиноны, в отличие от пиридо[3',2':4,5]тиено[3,2-d]пиримидинов, что немаловажно в плане целенаправленного поиска новых биологически активных соединений с нейротропным действием.
Полученные производные пиридо[3',2':4,5]тиено[3,2-d]пиримидинов представляются перспективными для разработки новых эффективных нейротропных препаратов.
Список литературы
Guetzoyan L.J., Spooner R.A., Michael Lord J., Ro-berts L.M., Clarkson G.J. // Eur. J. Med. Chem. 2010. V. 45. P. 275–283. https://doi.org/10.1016/j.ejmech.2009.10.007
Zhao X.-L., Zhao Y.-F., Guo S.-C., Song H.-S., Wang D., Gong P. // Molecules. 2007. V. 12. P. 1136–1146. https://doi.org/10.3390/12051136
Holla B.Sh., Mahalinga M., Karthikeyan M.S., Poojary B., Akberali P.M., Kumari N.S. // Eur. J. Med. Chem. 2005. V. 40. P. 1173–1178. https://doi.org/10.1016/j.ejmech.2005.02.013
Eid F.A., Abd El-Wahab A.H.F., El-Hag Ali G.A.M., K-hafagy M.M. // Acta Pharm. 2004. V. 54. P. 13–26. https://acta.pharmaceutica.farmaceut.org/materials/ pdf/1304.pdf
Gami S.P., Vilapara K.V., Khunt H.R., Babariya J.S., Naliapara Y.T. // Int. Lett. Chem. Phys. Astron. 2014. V. 30. P. 127–134. https://doi.org/10.18052/www.scipress.com/ILCPA. 30.127
Rashad A.E., Heikal O.A., El-Nezhawy A.O., Abdel-Megeid F.M.E. // Heteroatom. Chem. 2005. V. 16. P. 226–234. https://doi.org/10.1002/hc.20114
Пароникян Е.Г., Акопян Ш.Ф., Норавян А.С., Джагацпанян И.А., Пароникян Р.Г., Назарян И.М., Акопян А.Г. // Хим.-фарм. журнал. 2012. Т. 46. С. 25–27. [Paronikyan E.G., Akopyan Sh.F., Noravyan A.S., D-zhagatspanyan I.A., Paronikyan R.G., Nazaryan I.M., Akobyan A.G. // Pharm. Chem. J. 2012. V. 46. P. 154–156.] https://doi.org/10.1007/s11094-012-0750-z
Wang S.B., Piao G.C., Zhang H.J., Quan Z.S. // Molecules. 2015. V. 20. P. 6827–6843. https://doi.org/10.3390/molecules20046827
Дабаева В.В., Багдасарян М.Р., Норавян А.С., Джагацпанян И.А., Назарян И.М., Акопян А.Г. // Хим.-фарм. журнал. 2015. Т. 49. С. 17–21. [Dabaeva V.V., Bagdasaryan M.R., Noravyan A.S., Dzhagatspanyan I.A., Nazaryan I.M., Akopyan A.G. // Pharm. Chem. J. 2015. V. 49. P. 587–591.] https://doi.org/10.1007/s11094-015-1334-5
Дабаева В.В., Багдасарян М. Р., Норавян А.С., Казарян Ж.В., Джагацпанян И.А., Назарян И.М., Акопян А.Г. // Хим.-фарм. журнал. 2015. Т. 49. С. 34–37. [Dabaeva V.V., Bagdasaryan M.R., Noravyan A.S., Kazaryan Zh.V., Dzhagatspanyan I.A., Nazaryan I.M., Akopyan A.G. // Pharm. Chem. J. 2016. V. 49. P. 830–833.] https://doi.org/10.1007/s11094-016-1381-6
Дабаева В.В., Багдасарян М.Р., Дашян Ш.Ш., Джагацпанян И.А., Назарян И.М., Акопян А.Г., Пароникян Р.Г. // Хим.-фарм. журнал. 2018. Т. 52. С. 28–33. [Dabaeva V.V., Bagdasaryan M.R., Dashyan Sh.Sh., D-zhagatspanyan I.A., Nazaryan I.M., Akopyan A.G., Paronikyan R.G. // Pharm. Chem. J.. 2019. V. 49. P. 844–849.] https://doi.org/10.1007/s11094-019-1912-z
Kothayer H., Ibrahim S.M., Soltan M.K., Rezq S., Mahmoud S.S. // Drug Dev. Res. 2018. V. 80. P. 343–352. https://doi.org/10.1002/ddr.21506
Puthenkalam R., Hieckel M., Simeone X., Suwattanasophon C., Feldbauer R.V., Ecker G.F., Ernst M. // Front. Mol. Neurosci. 2016. V. 9. P. 1–20. https://doi.org/10.3389/fnmol.2016.00044
Sieghart W. // Adv. Pharmacol. 2015. V. 72. P. 53–96. https://doi.org/10.1016/bs.apha.2014.10.002
Brohan J., Goudra B.G. // CNS Drugs. 2017. V. 31. P. 845–856. https://doi.org/10.1007/s40263-017-0463-7
Tomita S. // Curr. Opin. Neurobiol. 2019. V. 57. P. 81–86. https://doi.org/10.1016/j.conb.2019.01.017
Vogel H.G., Vogel W.H. // In: Drug Discovery and Eva-luation: Pharmacological Assays / Ed. Vogel H.E. Springer-Verlag Berlin Heidelberg, 2008. P. 569−874.
Loscher W., Schmidt D. // Epilepsy Res. 1988. V. 2. P. 145–181. https://doi.org/10.1016/0920-1211(88)90054-X
Swinyard E.A. // Experimental Models of Epilepsy. Raven Press, New-York, 1992. P. 433–458.
Katzung B. // Drugs Used in Generalized Seizures. Basic and Clinical Pharmacology. Large Medical Books, McGraw-Hill, 9th edn, 2003.
Машковский М.Д. // Лекарственные средства. М.: Новая волна, 2006.
File S.E. // Behav. Brain. Res. 2001. V. 125. P. 151–157. https://doi.org/10.1016/S0166-4328(01)00292-3
Stanford S.C. // J. Psycopharmac. 2007. V. 21. P. 134–135. https://doi.org/10.1177/0269881107073199
Prut C.B. // Eur. J. Pharmacol. 2003. V. 463. P. 3–33. https://doi.org/10.1016/S0014-2999(03)01272-X
Pelow S., File S.E. // Pharmacol. Biochem. Behav. 1985. V. 24. P. 525−529. https://doi.org/10.1016/0091-3057(86)90552-6
Dunham N.W., Miya T.S. // J. Am. Pharm. Ass. Sci. Ed. 1957. V. 46. P. 208−209. https://doi.org/10.1002/jps.3030460322
Беленький М.Л. // Элементы количественной оценки фармакологического эффекта. Л.: Медицина, 1961.
Kerwin S.M. // J. Am. Chem. Soc. 2010. V. 132. P. 2466–2467. https://doi.org/10.1021/ja1005306
Rose P.W., Prlić A., Altunkaya A., Bi C., Bradley A.R., Christie C.H., Di L., Duarte J.M., Dutta Sh., Feng Z., Green R.K., Goodsell D.S., Hudson B., Kalro T., Lowe R., Peisach E., Randle Ch., Rose A.S., Shao Ch., Tao Yi-Ping Y., Voigt M., Westbrook J.D., Woo J., Yang H., Young J.Y., Zardecki Ch., H.M., Burley S.K. // Nucleic Acids Res. 2017. V. 45(D1). P. D271–D281. https://doi.org/10.1093/nar/gkw1000
Trott O., Olson A.J. // J. Comput. Chem. 2009. V. 31. P. 455–461. https://doi.org/10.1002/jcc.21334
Hunanyan L., Makichyan A., Ghamaryan V., Hrutyunyan A., Danagulyan G. // Chemical Journal of Armenia. 2019. V. 72. P. 530–533.
Muthanna M.S.A., Wang P., Wei M., Rafiq A., Josbert N.N. // Information. 2021. V. 12. 76. P. 1–20. https://doi.org/10.3390/info12020076
Biovia D.S. // Discovery Studio Visualizer. San Diego, CA, USA, 2017.
Дополнительные материалы
- скачать ESM.docx
- Дополнительные материалы
Инструменты
Биоорганическая химия





