Биоорганическая химия, 2022, T. 48, № 1, стр. 63-74
Прямое конъюгирование пенициллинов и цефалоспоринов с белками для рецепторного анализа бета-лактамных антибиотиков
Т. С. Серченя 1, *, И. В. Горбачева 1, О. В. Свиридов 1
1 Институт биоорганической химии НАН Беларуси
220141 Минск, ул. Акад. Купревича, 5/2, Беларусь
* E-mail: serchenya@iboch.by
Поступила в редакцию 26.04.2021
После доработки 04.05.2021
Принята к публикации 21.05.2021
- EDN: ACHAUO
- DOI: 10.31857/S0132342322010122
Аннотация
Пятнадцать белковых конъюгатов пенициллинов и цефалоспоринов, содержащих амино- и/или карбоксильные группы в исходных структурах, синтезированы в реакциях с сывороточным альбумином человека или овальбумином с использованием 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорида (EDC) или комбинации EDC/N-гидроксисульфосукцинимид (sNHS) при различных соотношениях базовых реагентов. Проведено сравнительное исследование состава и свойств конъюгатов методами УФ-спектроскопии, масс-спектрометрии и лиганд-рецепторного анализа. Показано, что содержание остатков антибиотика в полученных макромолекулах варьируется от 1 до 22, бета-лактамный цикл остается интактным, и это обеспечивает специфическое взаимодействие конъюгатов с пенициллин-связывающим белком. В двух разработанных моделях рецепторных биоаналитических систем конъюгат ампициллина на твердой фазе взаимодействует с пенициллин-связывающим белком в составе его комплекса с моноклональным антителом, которое детектировали с использованием иммуноферментной метки в микропланшетах или наночастиц золота на тест-полосках. Связывание конъюгированного ампициллина с рецептором конкурентно ингибировалось антибиотиками, добавленными в жидкую фазу, и показатели аналитической чувствительности в отношении пенициллина G для микропланшетной и рецепторно-хроматографической тест-систем составили 0.05 и 1 нг/мл соответственно.
ВВЕДЕНИЕ
Бета-лактамные антибиотики составляют один из наиболее широко используемых в медицине и ветеринарной химиотерапии классов противомикробных препаратов [1, 2]. Поэтому точные, простые и быстрые методы их определения востребованы и актуальны для контроля биобезопасности продуктов питания животного происхождения [3–6], оценки уровня бета-лактамов в крови в целях назначения адекватной дозы пациентам при неотложных состояниях [6–9], а также для мониторинга содержания в объектах окружающей среды [10, 11]. Эффективным методом скринингового контроля различных антибиотиков признан иммуноанализ, основанный на реакции антиген–антитело [3, 12–15]. Однако в случае бета-лактамных антибиотиков уникальную возможность для разработки методов биоанализа представляет лиганд-рецепторное взаимодействие с участием специфического пенициллин-связывающего белка (ПСБ), узнающего обязательный структурный элемент этих лекарственных субстанций – бета-лактамное кольцо. ПСБ в мембране бактерий играет ключевую роль в механизме антибактериального действия бета-лактамов, образуя с ними комплекс с последующей химической модификацией остатка серина в активном центре и обусловленной этим утратой ПСБ функции транспептидазы в биосинтезе пептидогликанов клеточной стенки бактерии, что приводит к гибели микроорганизма [16–18]. Преимущество использования рецептора в биоанализе, в отличие от большинства антител, заключается в способности узнавать и связывать целую группу бета-лактамов, при этом взаимодействие происходит только с активными формами этих антибиотиков, имеющими цельное бета-лактамное кольцо. Тест-системы рецепторного анализа – новый и перспективный инструмент, в сравнении с иммуноанализом они характеризуется повышенной аналитической чувствительность и гораздо более широкой групповой специфичностью.
Химически модифицированные белки и производные низкомолекулярных органических биомолекул (гаптенов) представляют собой главные реагенты для создания иммуно- и рецепторно-аналитических систем. При этом высокоэффективная стратегия модификации соединений должна обеспечивать получение биологически активных и стабильных гаптен-белковых конъюгатов, отличаться простотой и воспроизводимостью. В нашей работе для получения белковых конъюгатов бета-лактамных антибиотиков были выбраны подходы к биоконъюгированию, учитывающие наличие реакционноспособных групп в исходных соединениях и необходимость сохранения структуры бета-лактамного кольца – основного сайта узнавания антибиотика рецепторным белком. При этом задействовались как аминогруппы, так и карбоксильные группы пенициллинов и цефалоспоринов – наиболее важных в практическом плане подклассов бета-лактамов.
В основе молекул аминопенициллинов лежит структура 6-аминопенициллановой кислоты, включающая конденсированные тиазолидиновый и бета-лактамный циклы (рис. 1). Аминированные цефалоспорины – производные 7-аминоцефалоспорановой и 7-аминодезацетоксицефалоспорановой кислот, содержащие конденсированные бета-лактамное и дигидротиазиновое кольца (рис. 1). Для проявления биологической активности большое значение имеют целостность и, соответственно, реакционная способность бета-лактамного цикла, который очень неустойчив в кислой и щелочной средах, а также может разрушаться в ходе химической модификации.
Из литературы неясно, как химическая природа сайта конъюгирования в молекуле бета-лактама и способ его ковалентного присоединения к белку могут влиять на поведение конъюгата антибиотика на твердой фазе и на взаимодействие с рецепторным белком в биоаналитической системе. Описаны белковые конъюгаты бета-лактамных антибиотиков, применяемые в качестве иммуногенов для получения антител, и конъюгаты с пероксидазой из корней хрена для иммуноаналитических тест-систем [13–15, 19, 20]. Эти конъюгаты синтезировали с использованием различных линкеров или безлинкерным карбодиимидным методом. Однако в литературе отсутствуют количественные характеристики присоединения антибиотиков к белку в терминах содержания гаптена в описанных конъюгатах и сведения о зависимости этого показателя от мольного соотношения реагентов, а также данные о влиянии сайта модификации молекулы антибиотика на стехиометрию конъюгирования. Не изучена в полной мере связь между аналитическими параметрами тест-систем рецепторного анализа и свойствами твердофазных белковых конъюгатов бета-лактамов.
Цель данной работы – провести комплексное сравнительное исследование способов прямого (“безлинкерного”) конъюгирования пенициллинов и цефалоспоринов с инертными белками и изучить зависимость характеристик связывания конъюгатов с пенициллин-связывающим белком от их общей структуры. Такие знания и полученные реагенты полезны в разработках высокочувствительных систем микропланшетного и хроматографического рецепторного анализа с широкой групповой специфичностью в отношении бета-лактамных антибиотиков в пищевых продуктах.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтез белковых конъюгатов бета-лактамных антибиотиков. Для получения белковых конъюгатов бета-лактамов были выбраны методы биоконъюгирования с учетом реакционноспособных групп, присутствующих в исходных антибиотиках. При этом также учитывали, что в процессе синтеза конъюгатов не должно разрушаться бета-лактамное кольцо, выступающее основным сайтом узнавания антибиотика рецепторным белком. Целостность бета-лактамного кольца подтверждали спектрофотометрически по отсутствию пиков поглощения при 320–330 нм [21]. Наличие в исходных молекулах доступных карбокси- и аминогрупп определило выбор методик с использованием водорастворимого карбодиимида и получения активированных сложных эфиров. Эти синтетические подходы позволяют проводить реакцию образования прочной амидной связи между компонентами конъюгата в водных средах (иногда с добавлением органического растворителя), в которых многие малые биомолекулы достаточно хорошо растворимы, а белки могут сохранять свою нативную структуру. Карбодиимид (EDC), хорошо себя зарекомендовавший в безлинкерном синтезе биоконъюгатов, образует с карбоксильной группой неустойчивый в водных растворах промежуточный продукт, поэтому этот реагент часто используют в комбинации с N-гидроксисукцинимидом или его сульфопроизводным (sNHS) и получают эффективный в реакции N‑ацилирования сложный эфир.
Поскольку практически все белки содержат аминогруппы, их модификация особенно часто проводится посредством активированных эфиров малых органических молекул. Все бета-лактамы характеризуются наличием карбоксильной группы, которая, однако, расположена вблизи бета-лактамного кольца. Поэтому мы выбрали такие пенициллины и цефалоспорины (ампициллин, амоксициллин и цефалексин), которые содержат также и аминогруппу в боковой цепи, что позволяет в конъюгате пространственно разделить функционально важный бета-лактамный цикл и амидную связь антибиотика с белком. Кроме того, в отличие от природного пенициллина G, синтетические аминопенициллины достаточно стабильны в водных растворах при нейтральных рН, что позволяет избежать расщепления бета-лактамного кольца в реакции конъюгирования. Из цефалоспоринов был взят цефалексин, по структуре очень близкий к аминопенициллинам, но отличающийся строением цикла, конденсированного с бета-лактамным кольцом (рис. 1).
В нашей работе белковые конъюгаты аминопенициллинов и цефалоспоринов синтезированы путем ковалентного присоединения к молекулам сывороточного альбумина человека (ЧСА) и овальбумина исследуемых бета-лактамов путем карбодиимидной конденсации с EDC и в реакции активированных эфиров с использованием комбинации EDC/sNHS. В первом случае происходит конъюгирование преимущественно по аминогруппам антибиотика, хотя возможны и реакции с участием его карбоксильных групп, а поперечная сшивка молекул белка, скорее всего, тормозится из-за конкуренции со стороны аминопроизводных бета-лактамов, имеющих более высокую подвижность в растворе. В вариантах синтеза с EDC/sNHS за счет изменения порядка добавления реагентов проводили активацию карбоксильной группы антибиотика или белка и далее ацилировали полученными активированными эфирами NH2-группы другого компонента реакции конъюгирования. При этом мольные соотношения белок/антибиотик варьировались в диапазоне от 1 : 10 до 1 : 150.
По данным MALDI-TOF-масс-спектрометрии, количество остатков присоединенного к белкам (ЧСА и овальбумин) антибиотика изменялось от 1 до 22. Показано, что при одинаковом мольном соотношении реагентов количество присоединенных остатков бета-лактамов к ЧСА зависит от выбранной методики конъюгирования (табл. 1). При одностадийном конъюгировании с ЕDC наблюдалось присоединение 7, 20 и 22 остатков ампициллина к одной белковой молекуле при, соответственно, 10-, 50- и 150-кратном мольном избытке этого антибиотика. В то же время в реакции активированных эфиров при тех же соотношениях реагентов были получены другие количества присоединенного гаптена: при ацилировании аминогрупп белковой молекулы – 1, 5 и 6, а при конъюгировании по аминогруппам ампициллина – 5, 12 и 19. Видно, что при карбодиимидной конденсации в сравнении с использованием двух реагентов EDC/sNHS максимальное присоединение происходит уже при 50-кратном избытке антибиотика. При активации карбоксильных групп бета-лактама наблюдается присоединение не более 5–6 остатков гаптена даже при его большом мольном избытке, а в случае 10‑кратного избытка ампициллина мы получаем конъюгат лишь с эквимольным соотношением белок–гаптен. В табл. 1 не включены конъюгаты ЧСА с цефтиофуром (К13, синтезирован по методике с EDC/sNHS), цефапирином и цефоперазоном (К14 и К15, получены с использованием EDC), которые содержали, соответственно, 5, 12 и 2 остатка антибиотика на молекулу белка.
Таблица 1.
Синтезированные белковые конъюгаты бета-лактамов, использованные методы конъюгирования и содержание остатков антибиотиков в конъюгатах
| Шифр конъюгата | Бета-лактам | Метод и сайт(ы) конъюгирования в антибиотике | Избыток антибиотика в реакции, моль/моль белка |
Содержание остатков антибиотика
в конъюгате, моль/моль белка |
|---|---|---|---|---|
| К1 | Ампициллин | EDC (Н2N-Aмп-COOH) | 10 | 7 |
| К2 | Ампициллин | EDC (Н2N-Aмп-COOH) | 150 | 22 |
| К3 | Ампициллин | EDC/sNHS (Aмп-COOH) | 10 | 1 |
| К4 | Ампициллин | EDC/sNHS (Aмп-COOH) | 150 | 6 |
| К5 | Ампициллин | EDC/sNHS (Aмп-NH2) | 10 | 5 |
| К6 | Ампициллин | EDC/sNHS (Aмп-NH2) | 50 | 12 |
| К7 | Ампициллин | EDC/sNHS (Aмп-NH2) | 150 | 19 |
| К8 | Цефалексин | EDC/sNHS (Цеф-COOH) | 10 | 1 |
| К9 | Цефалексин | EDC/sNHS (Цеф-COOH) | 10 | 2 |
| К10 | Цефалексин | EDC (H2N-Цеф-СООН) | 50 | 7 |
| К11 | Цефалексин | EDC/sNHS (Цеф-NH2) | 150 | 18 |
| К12 | Амоксициллин | EDC/sNHS (Aмокс-NH2) | 150 | 12 |
Отметим, что при конъюгировании по аминогруппам гаптена в случае реакции активированных эфиров наблюдается последовательное и наиболее контролируемое увеличение количества присоединенных остатков ампициллина согласно возрастанию его мольной нагрузки в реакционной смеси.
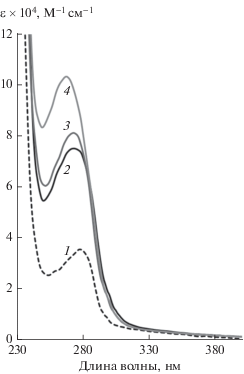
Спектральные характеристики конъюгатов. Спектральные характеристики некоторых синтезированных конъюгатов (К6, К11 и К12) представлены на рис. 2. Интактный ЧСА характеризовался максимумом спектра поглощения при 278 нм, а овальбумин – при 279 нм. Значение коэффициента молярной экстинкции в максимуме поглощения для ЧСА составило 3.5 × 104 М–1 см–1, а для овальбумина – 3.2 × 104 М–1 см–1. Форма спектров поглощения конъюгатов, синтезированных с использованием различных методик (данные не представлены), была та же, что и у спектра исходного белка, но наблюдался сдвиг максимума абсорбции и гиперхромный эффект, зависящие от количества присоединенного гаптена. Так, спектры поглощения эквимольных конъюгатов имели характеристики, практически идентичные абсорбционным спектрам немодифицированных белков. В случаях присоединения более 1–2 остатков ампициллина, цефалексина или амоксицилина к белковым молекулам происходит сдвиг максимума спектра поглощения в коротковолновую область на 4–6 нм для конъюгатов с ампициллином и амоксициллином и на 6–8 нм для конъюгатов с цефалексином. В то же время дополнительные пики и плечи в полосах спектров конъюгатов отсутствуют, что указывает на сохранение интактного бета-лактамного кольца антибиотиков в составе конъюгатов. Таким образом, абсорбционная спектроскопия оказалась эффективным инструментом количественного и качественного контроля структуры белковых конъюгатов бета-лактамов, предназначенных для систем биоанализа.
Рис. 2.
Спектры поглощения синтезированных конъюгатов бета-лактамов с ЧСА: 1 – ЧСА, 2 – конъюгат ампициллина К6, 3 – конъюгат амоксициллина К12, 4 – конъюгат цефалексина К11.
Рецепторный анализ, связывание с рецепторным белком бета-лактамов и биоаналитические свойства конъюгатов. Исследовано влияние белкового конъюгирования на связывающую активность бета-лактамов по отношению к ПСБ, установлены биоаналитические свойства полученных конъюгатов и разработаны конструкции модельных систем рецепторного анализа в микропланшетном варианте и на хроматографических тест-полосках.
За модель мы принимаем исследовательскую биоаналитическую систему в качестве промежуточного объекта на общепринятом этапе создания валидированной практической системы для тестирования не только стандартных, но и неизвестных проб, приготовленных из образцов пищевой продукции [22]. По сравнению с иммуноанализом, рецепторный анализ в скрининговых лабораторных исследованиях содержания бета-лактамов в различных пищевых матрицах обладает следующими преимуществами: более высокой чувствительностью, широкой групповой специфичностью, способностью выявлять реакционноспособные формы антибиотиков.
В микропланшетном варианте рецепторного анализа на твердой фазе иммобилизовали синтезированные конъюгаты бета-лактамных антибиотиков, а главным компонентом жидкой фазы был ПСБ в составе специфического комплекса с моноклональным антителом (МАт) к нему, которое выполняло только функцию биологической метки и не влияло на активность лиганд-связывающего центра рецепторного белка. В гетерофазной системе происходило распределение ПСБ между антибиотиком на твердой фазе и его конкурентом в растворе в составе “стандартов” с возрастающими концентрациями бета-лактама. Выявление связавшегося ПСБ осуществляли с помощью антивидовых антител (иммуноглобулины козы против иммуноглобулинов мыши), конъюгированных с пероксидазой из корней хрена.
Сравнение конъюгированных бета-лактамов проводили по параметрам рецепторного связывания, показателям калибровочного графика и аналитическим характеристикам тест-системы (табл. 2). При этом оценивали связывающую активность конъюгатов в отсутствие конкурирующего бета-лактама в растворе (В0, о.е.) и параметры конкурентного ингибирования взаимодействия ПСБ с твердофазным антибиотиком возрастающими концентрациями (0.03–900 нг/мл) пенициллина G, ампициллина и цефалексина. Кроме того, определяли разницу сигнал–фон (ΔВ), соотношения значений оптической плотности Bi/B0 для стандартов, содержащих пенициллин G (0.05 нг/мл), ампициллин (0.05 нг/мл) и цефалексин (3 нг/мл), чувствительность анализа (IC50, нг/мл) и повторяемость (К.В., %). Результаты исследования представлены в табл. 2.
Таблица 2.
Биоаналитические характеристики синтезированных конъюгатов бета-лактамов
| № | В0, о.е. |
Стандарт | К.В., % | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| пенициллин G | ампициллин | цефалексин | |||||||||
| ΔВ | IC50, нг/мл | В0.05/B0, % | ΔВ | IC50, нг/мл | В0.05/B0, % | ΔВ | IC50, нг/мл | В3/B0, % | |||
| К1 | 1.28 | 1.12 | 0.38 | 81 | 1.12 | 0.40 | 90 | 1.10 | 53.0 | 90 | 3.2 |
| К2 | 1.97 | 1.81 | 0.38 | 91 | 1.82 | 0.45 | 94 | 1.78 | 55.0 | 93 | 3.3 |
| К3 | 0.52 | 0.40 | 0.34 | 79 | 0.41 | 0.39 | 86 | 0.38 | 52.0 | 85 | 4.1 |
| К4 | 1.21 | 1.06 | 0.35 | 80 | 1.07 | 0.39 | 87 | 1.02 | 52.0 | 86 | 4.3 |
| К5 | 1.17 | 1.01 | 0.35 | 80 | 1.02 | 0.39 | 87 | 0.98 | 52.0 | 86 | 2.5 |
| К6 | 1.51 | 1.38 | 0.35 | 88 | 1.37 | 0.38 | 92 | 1.34 | 53.0 | 92 | 3.4 |
| К7 | 2.12 | 1.97 | 0.35 | 89 | 1.98 | 0.42 | 92 | 1.94 | 55.0 | 94 | 4.3 |
| К8 | 0.32 | 0.23 | – | 80 | 0.23 | – | 84 | 0.22 | – | 84 | 2.8 |
| К9 | 0.33 | 0.23 | – | 80 | 0.23 | – | 87 | 0.22 | – | 84 | 3.2 |
| К10 | 0.47 | 0.35 | 0.34 | 84 | 0.35 | 0.39 | 88 | 0.32 | 50.0 | 85 | 3.1 |
| К11 | 1.15 | 1.01 | 0.35 | 85 | 1.01 | 0.41 | 90 | 0.98 | 51.0 | 93 | 3.1 |
| К12 | 1.50 | 1.38 | 0.36 | 89 | 1.40 | 0.41 | 92 | 1.34 | 52.0 | 93 | 3.2 |
Согласно полученным данным, эквимольные конъюгаты слабее других конъюгатов связывались с рецепторным белком, и для конъюгата с ампициллином В0 составило лишь 0.52 о.е. В конъюгатах с ампициллином и амоксициллином при мольных соотношениях белок/гаптен, равных 1 : (5–7) (К1, К4, К5), значение В0 составило 1.17–1.28 о.е., а при содержании 1 : 12 (К6, К12) соответствующий колориметрический сигнал был уже 1.50 о.е. При максимальных количествах конъюгированных ампициллина (К2, К7) и цефалексина (К11) с белком параметр связывания В0 составил, соответственно, 1.97–2.12 и 1.15 о.е. Как видно из результатов, цефалексин, конъюгированный с ЧСА или овальбумином, характеризуется намного более низкими показателями связывания с рецептором по сравнению с ампициллином при одинаковых мольных долях этих бета-лактамов в конъюгатах (К2 и К11; К1, К4, К5 и К10). Это свидетельствует о меньшем сродстве данного цефалоспорина к ПСБ, что также подтверждается значениями ингибиторной активности IC50 при использовании цефалексина в качестве стандарта (табл. 2).
Итак, в лиганд-рецепторной системе, включающей белковый конъюгат бета-лактама и ПСБ, с ферментно-колориметрической детекцией взаимодействия оптический ответ в существенной мере зависит от природы и количества присоединенных остатков антибиотика в конъюгате. При выборе твердофазного лиганда для разработки рецепторной тест-системы для определения бета-лактамов следует учитывать тот установленный нами факт, что наибольшее связывание с ПСБ имеют конъюгаты, содержащие 12–22 остатков ампициллина или амоксициллина.
При сравнении характеристик конъюгатов с идентичным содержанием бета-лактамов (К1, К4, К5, К10; К6, К12; К2, К7, К11), но синтезированных различными способами прямого конъюгирования, мы показали, что в терминах параметров В0, ΔВ и IC50 они имеют схожие характеристики взаимодействия с рецептором и близкие биоаналитические свойства. Это говорит о том, что сайт в молекуле бета-лактама, через который он напрямую присоединяется к белку-носителю, не критичен для последующего взаимодействия конъюгированного антибиотика с рецепторным белком. Таким образом, бета-лактамное кольцо остается доступным для лиганд-связывающего центра ПСБ при модификации как аминогруппы на периферии молекулы, так и карбоксильной группы вблизи бета-лактамной группировки.
При сравнении биоаналитических свойств конъюгатов видно, что для всех твердофазных конъюгированных антибиотиков в рецепторной тест-системе графически рассчитанная чувствительность анализа (IC50) находится в пределах 0.34–0.38 нг/мл для растворов пенициллина G в стандартах, 0.39–0.45 нг/мл для ампициллина и 50–55 нг/мл для цефалексина (табл. 2). Эти данные свидетельствуют о том, что увеличение содержания остатков антибиотика в составе конъюгата с белком незначительно влияет на положение калибровочного графика относительно оси концентраций. Это свойство отличает рецепторный анализ от работы большинства иммунохимических тест-систем с использованием моно- или поликлональных антител. Так что выбрать оптимальный конъюгат для рецепторного анализа, обеспечивающий наибольший колориметрический сигнал В0, можно не в ущерб чувствительности анализа IC50. Конъюгаты К13–К15 на основе цефтиофура, цефапирина и цефоперазона проявляли активность в отношении ПСБ, и характеристики их связывания укладывались в структурно-функциональные зависимости, описанные выше.
Из синтезированных продуктов подходящими для иммуноанализа (данные не приведены) оказались белковые конъюгаты ампициллина (К3) и цефалексина (К8, К9), что будет предметом последующих публикаций.
Для оценки групповой специфичности анализа бета-лактамов в модельных рецепторно-ферментных тест-системах микропланшетной конструкции использовали конъюгаты ампициллина (К7), цефалексина (К11) и калибраторы – растворы с точными концентрациями индивидуальных антибиотиков группы бета-лактамов, наиболее часто применяемых в клинической практике и ветеринарии. Результаты исследования представлены в табл. 3. Установлено, что связывающая активность бета-лактамных лигандов по отношению к рецепторному белку уменьшается в следующем ряду: пенициллин G > ампициллин > амоксициллин > цефоперазон > цефапирин > цефтиофур > > цефалексин. Показано также, что специфичность анализа не зависит от природы (пенициллин или цефалоспорин) твердофазного лиганда. Калибровочные графики, полученные для исследуемых бета-лактамов, характеризовались IC50 в диапазоне 0.35–0.46 нг/мл для пенициллинов и 0.72–55 нг/мл для цефалоспоринов, а перекрестная реактивность относительно пенициллина G составила 82.6–86.4% для пенициллинов и 0.7–48.6% для цефалоспоринов. Индивидуальные рабочие диапазоны достоверно определяемых концентраций различных бета-лактамов находились в широких пределах: 0.05–8.0 нг/мл для пенициллинов и 0.05–600 нг/мл для цефалоспоринов.
Таблица 3.
Характеристики специфичности и диапазоны определяемых концентраций бета-лактамов в рецепторно-ферментном анализе с использованием твердофазных конъюгатов ампициллина и цефалексина
| Твердофазный конъюгат | Стандарт | IC50, нг/мл | Перекрестная реактивность, % | К.В., % | Диапазон концентраций, нг/мл |
|---|---|---|---|---|---|
| Ампициллин–
альбумин (К7) |
Пенициллин G | 0.38 | 100.0 | 3.6 | 0.05–4.0 |
| Ампициллин | 0.44 | 86.4 | 3.7 | 0.05–8.0 | |
| Амоксициллин | 0.46 | 82.6 | 3.8 | 0.05–8.0 | |
| Цефалексин | 55.0 | 0.7 | 5.1 | 3.0–600.0 | |
| Цефоперазон | 0.80 | 47.5 | 4.2 | 0.05–8.0 | |
| Цефтиофур | 4.0 | 9.5 | 4.0 | 0.3–100.0 | |
| Цефапирин | 1.1 | 34.5 | 4.0 | 0.05–30.0 | |
| Цефалексин–
альбумин (К11) |
Пенициллин G | 0.35 | 100 | 3.8 | 0.05–4.0 |
| Ампициллин | 0.41 | 85.4 | 3.7 | 0.05–8.0 | |
| Амоксициллин | 0.42 | 83.3 | 3.7 | 0.05–8.0 | |
| Цефалексин | 51.0 | 0.7 | 5.2 | 3.0–600.0 | |
| Цефоперазон | 0.72 | 48.6 | 4.3 | 0.05–8.0 | |
| Цефтиофур | 3.5 | 10.0 | 4.1 | 0.3–100.0 | |
| Цефапирин | 0.80 | 43.7 | 3.8 | 0.05–30.0 |
Сравнивая работу в рецепторно-ферментных системах конъюгатов К2 и К7 с практически одинаковым высоким содержанием ампициллина, присоединенного через его аминогруппу, мы обнаружили, что в случае двухэтапной методики синтеза (К7) конъюгат имеет несколько лучшие биоаналитические характеристики (В0 и IC50). Поэтому конъюгат К7 признан оптимальным лигандом для микропланшетной твердой фазы, и в последующей работе его использовали для иммобилизации на нитроцеллюлозной мембране хроматографических тест-полосок.
Расширяя сделанную нами ранее формулировку, отметим, что аналитические характеристики системы гетерофазного рецепторно-ферментного анализа, включающей белковый конъюгат бета-лактама на твердой фазе, в значительной степени определяются содержанием и природой антибиотика в конъюгате и в меньшей мере зависят от сайта присоединения в гаптене, а также способа прямого конъюгирования.
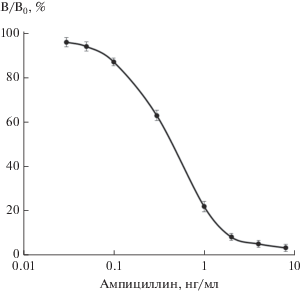
В результате экспериментов по оптимизации условий лиганд-рецепторного взаимодействия в микропланшетной системе (концентрации конъюгата К7 на твердой фазе, ПСБ и ампициллина в растворе, рН и ионная сила среды, температура) получены аналитические характеристики, которые выражаются калибровочной кривой, представленной на рис. 3. Рабочий диапазон анализа составляет 0.05–8.0 нг/мл при IC50 = 0.42 ± ± 0.05 нг/мл (n = 5) и аналитической чувствительности 0.05 нг/мл в отношении ампициллина, что превышает показатели, представленные в литературе [13, 14, 19]. Так, иммуносенсор для флу-оресцентного анализа бета-лактамных антибиотиков в работе Benito-Peña et al. [13] характеризовался следующими параметрами: IC50 = = 30 нг/мл и предел детекции 2.4 нг/мл при динамическом диапазоне анализа 6–191 нг/мл. Предел детекции ампициллина в буферном растворе в биосенсоре с использованием МАт, представленном в работе Cliquet et al. [14], не превышал 46 нг/мл. Разработанная Zeng et al. [19] тест-система для определения бета-лактамов с использованием ПСБ (рекомбинантного аналога природного рецептора PBP 2x из Streptococcus pneumoniae R6) позволяет определять ампициллин и пени-циллин G в диапазоне 1–16 нг/мл и характеризуется пределом детекции для этих бета-лактамов 0.75 и 1.22 нг/мл соответственно.
Рис. 3.
Зависимость связывания ПСБ с твердофазным конъюгатом ампициллина К7 от концентрации свободного ампициллина в жидкой фазе модельной системы рецепторно-ферментного анализа.
Разработанная в данной работе конструкция тест-системы с высокими показателями чувствительности может стать прототипом набора реагентов для рецепторно-ферментного анализа бета-лактамов в пищевой продукции животного происхождения.
Рецепторно-хроматографический анализ. В настоящее время широкое применение получили экспресс-методы детекции малых биомолекул и белковых маркеров на хроматографических тест-полосках благодаря быстроте и простоте выполнения, высокой производительности и возможности проведения анализа вне лаборатории без сложного оборудования. Такой анализ – эффективный инструмент качественного и количественного определения антибиотиков в продуктах [4, 23].
Нами исследовано взаимодействие синтезированного белкового конъюгата ампициллина, свободных бета-лактамов и ПСБ в разработанной рецепторно-хроматографической системе на тест-полоске, которая представляет собой мультимембранный композит. На рабочей нитроцеллюлозной мембране в аналитической зоне иммобилизовали конъюгат ампициллина К7, показавший наилучшие результаты в микропланшетной системе, а контрольную зону формировали адсорбцией антивидовых антител (иммуноглобулины козы против иммуноглобулинов мыши). В подвижной фазе детектирующим реагентом был ПСБ, иммунохимически иммобилизованный через МАт мыши к ПСБ, адсорбированное на золотых наночастицах, которые, в свою очередь, служили колориметрической меткой. В ходе анализа тест-полоску мембраной для образца погружали в раствор, содержащий детектирующий комплекс и исследуемые стандартные пробы с возрастающими концентрациями бета-лактамов (пенициллин G, ампициллин, амоксициллин или цефалексин). При движении раствора вдоль полоски к впитывающей верхней мембране происходило взаимодействие твердофазного конъюгата К7 с меченым ПСБ в аналитической зоне, а затем протекало связывание в контрольной зоне адсорбированных антивидовых антител с МАт в составе детектирующего комплекса. Аналитический процесс состоит из одной стадии и занимает 10 мин. Оценка результатов заключается в визуальном контроле наличия или отсутствия окрашивания в аналитической и контрольной зонах тест-полоски (рис. 4).
Рис. 4.
Взаимодействия меченного золотыми наночастицами комплекса МАт–ПСБ с конъюгатом ампициллина К7 в аналитической зоне и антивидовыми антителами в контрольной зоне тест-полоски при возрастающих концентрациях бета-лактамов в подвижной фазе модельной системы рецепторно-хроматографического анализа: (а) – ампициллин в концентрации 0 (1), 0.25 (2), 0.5 (3), 1.0 (4), 2.0 (5), 3.0 (6) и 5.0 нг/мл (7); (б) – пенициллин G в концентрации 0 (1), 0.25 (2), 0.5 (3), 1.0 (4), 2.0 (5), 3.0 (6) и 5.0 нг/мл (7); (в) – амоксициллин в концентрации 0 (1), 0.5 (2), 1.0 (3), 2.0 (4) и 5.0 нг/мл (5); (г) – цефоперазон в концентрации 0 (1), 1.0 (2), 2.0 (3), 4.0 (4) и 8.0 нг/мл (5); (д) – цефалексин в концентрации 0 (1), 100 (2), 200 (3) и 400 нг/мл (4).

Различные бета-лактамные антибиотики в качестве конкурентных ингибиторов связывания К7 с меченым ПСБ в стандартных растворах с концентрациями 0.25–5.0 нг/мл для пенициллинов и 1–400 нг/мл для цефалоспоринов снижали интенсивность окраски аналитической полосы, что позволило оценить пределы их обнаружения (табл. 4). Показано, что порог визуальной детекции ампициллина, пенициллина G и амоксициллина составляет 1–2 нг/мл, если не рассматривать на данном этапе влияние пищевого матрикса на результаты определений. Так, разработанная рецепторно-хроматографическая система позволяет выявлять перечисленные бета-лактамы в концентрациях даже ниже значений максимально допустимого уровня (МДУ) этих ветеринарных субстанций в продуктах питания [24, 25 ] .
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и материалы. В экспериментальной работе использовали 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (EDC), N-гидроксисульфосукцинимид (sNHS), 2-(N-морфолино)этансульфоновую кислоту (MES), бычий сывороточный альбумин (BSA), 30%-ный водный раствор H2O2, 3,3',5,5'-тетраметилбензидин (ТМБ), тимеросаль (Sigma-Aldrich, США); колонки Zeba для хроматографии под действием гравитационных сил для обессоливания (Thermo Fisher Scientific, США); диметилсульфоксид (Applichem, Германия); хлорид натрия, Tween-20, кислоту лимонную моногидрат (Merck, Германия); сахарозу (Riedel-de-Haën, Германия); колонки с Sephadex G-25 (GE Healthcare, США). Реактивы отечественных и российских производителей: натрий фосфорнокислый двузамещенный 12-водный, натрий фосфорнокислый однозамещенный 2‑водный, гидроокись натрия, соляная кислота, серная кислота, глицерин – имели классификацию не ниже ч.д.а. ЧСА (5%-ный раствор) предоставлен РНПЦ трансфузиологии и медицинских биотехнологий (Беларусь), антитела козы против иммуноглобулинов мыши получены от УП “ХОП ИБОХ” НАН Беларуси (Беларусь). Конъюгат этих антител с высокоочищенной (Rz ≥ 3.0) пероксидазой из корней хрена (Диаэм, Россия) синтезировали путем окисления углеводных цепей фермента периодатом натрия, присоединения иммуноглобулина с образованием основания Шиффа и стабилизацией конъюгата восстановлением двойной связи борогидридом натрия. Сухие порошки высокоочищенных антибиотиков: пенициллин G, ампициллин, амоксициллин, це-фалексин, цефоперазон, цефтиофур, цефапирин – куплены у Sigma-Aldrich, США. ПСБ (рекомбинантный аналог природного рецептора PBP 2x из Streptococcus pneumoniae R6) и моноклональные антитела к нему приобретены у Glory Sciences Co., Ltd, КНР (www.glorybios.com).
Для приготовления всех растворов использовали деионизированную воду с удельным электрическим сопротивлением 17–18 МОм см, полученную в модульной системе очистки воды Ar-ium® pro VF (Sartorius, Германия).
При проведении рецепторно-ферментного анализа в качестве твердофазных носителей использовали разборные полистирольные 96-луночные микропланшеты (ООО “Хема-медика”, Россия). Системы хроматографического анализа на тест-полосках конструировали с применением комплекта мембран из набора MDI Easypack (Advanced Microdevices, Индия).
Получение белковых конъюгатов бета-лактамов. В трех описанных ниже методиках конъюгаты бета-лактамов с белками синтезировали в присутствии EDC в одну стадию или с использованием EDC/sNHS в две стадии в вариантах первоначальной активации карбоксилов антибиотика или белка и, соответственно, присоединения бета-лактама через карбоксильную или аминогруппу. В качестве белка-носителя применяли ЧСА в случаях ампициллина и амоксициллина или же ЧСА и овальбумин в случае цефалексина.
Реакция карбодиимидной конденсации в присутствии EDC. Препарат ЧСА растворяли в 0.01 М MES (рН 6.0) с 0.15 М NaCl. К растворам, содержащим 15 мг (225 нмоль), 3 мг (45 нмоль) или 1 мг (15 нмоль) ЧСА, добавляли 0.7 мг (3.7 мкмоль) EDC и 0.8 мг (2.3 мкмоль) ампициллина в 0.01 М MES (рН 6.0), что соответствовало 10-, 50- или 150-кратному мольному избытку антибиотика по отношению к белку. Реакцию конъюгирования проводили в течение 18 ч при 4оС.
Биоконъюгация путем активирования карбоксильных групп антибиотика с использованием EDC/sNHS. Препарат ЧСА растворяли в 0.1 М натрий-фосфатном буфере (PBS), рН 7.4, с 0.15 М NaCl. Препараты антибиотиков растворяли в 0.01 М MES (рН 6.0) с 0.15 М NaCl. К трем растворам антибиотика, содержащим по 0.8 мг (2.3 мкмоль) ампициллина, добавляли 0.8 мг (3.7 мкмоль) sNHS и 0.7 мг (3.7 мкмоль) EDC, инкубировали 15–20 мин при 25°С. Далее вносили растворы белка, содержащие 15 мг (225 нмоль), 3 мг (45 нмоль) или 1 мг (15 нмоль) ЧСА, что соответствовало 10-, 50- или 150-кратному мольному избытку антибиотика в реакционной смеси. Реакцию конъюгирования проводили в течение 18 ч при 4°С.
Конъюгирование за счет карбоксильных групп белка, активированных EDC/sNHS. Препарат ЧСА растворяли в 0.01 М MES (рН 6.0) с 0.15 М N-aCl. К растворам, содержащим 15 мг (225 нмоль), 3 мг (45 нмоль) или 1 мг (15 нмоль) ЧСА, добавляли 0.8 мг (3.7 мкмоль) sNHS и 0.7 мг (3.7 мкмоль) EDC, инкубировали 15–20 мин при 25°С. Далее к растворам белка добавляли 0.8 мг (2.3 мкмоль) ампициллина в 0.1 М PBS (рН 7.0) с 0.15 М NaCl, что соответствовало 10-, 50- или 150-кратному мольному избытку антибиотика по отношению к белку. Реакцию конъюгирования проводили в течение 18 ч при 4°С.
С применением аналогичных подходов были приготовлены конъюгаты цефалексина с ЧСА и овальбумином (10-, 50-, 150-кратный мольный избыток антибиотика в реакциях). Конъюгат амоксициллина с ЧСА синтезировали через NH2‑группу антибиотика с использованием его 150-кратного мольного избытка.
Очистку всех полученных конъюгатов проводили хроматографией под действием гравитационных сил с использованием колонок Zeba, уравновешенных 0.02 М PBS (рH 7.2), содержащим 0.15 М NaCl. Очищенные конъюгаты разбавляли в 2 раза глицерином и хранили при –20°С.
Спектральные измерения. Спектры поглощения растворов антибиотиков и синтезированных конъюгатов измеряли в кювете с длиной оптического пути 1 см с использованием спектрофотометра Tecan Infiniti М200 (Австрия).
Масс-спектры. Масс-спектры MALDI-TOF регистрировали на приборе Microflex LRF (Bruker, Германия). Изменение молекулярной массы (М) белков при конъюгировании ΔМ, выраженное в Да, определяли как разницу в молекулярных массах конъюгата и немодифицированного белка. Степень конъюгирования (1 моль антибиотика на 1 моль белка) рассчитывали как ΔМ/М (антибиотика).
Биоспецифическое связывание и конкурентное ингибирование взаимодействий в рецепторно-ферментных системах. В лунках микропланшета иммобилизовали белковые конъюгаты антибиотиков из 100 мкл раствора с концентрацией 0.1 мкг/мл путем инкубации при 4–8°С в течение 18 ч. Стабилизацию проводили путем внесения во все лунки по 150 мкл 0.05 М PBS (рН 7.4), содержащего 0.15 М NaCl, 0.05% Tween-20, 1 мг/мл BSA, 2% сахарозы, 0.01% эуксил К-100, и выдерживания планшета при 4–8°С в течение 18 ч. Исходные растворы исследуемых антибиотиков в концентрации 4 мг/мл готовили в 0.01 M PBS (рН 7.2), 0.15 M NaCl. Стандарты (калибровочные растворы) готовили в том же буфере в концентрации 0, 0.03–8.0 нг/мл для пенициллина G, амоксициллина, ампициллина, цефоперазона; 0, 0.05–100.0 нг/мл для цефтиофура и цефапирина; 1–900 нг/мл для цефалексина.
При проведении анализа в лунки вносили по 50 мкл калибровочных растворов с антибиотиком в возрастающих концентрациях и по 50 мкл предварительно приготовленной смеси, содержащей ПСБ и МАт к нему в концентрациях 0.05 и 0.1 мкг/мл соответственно. Инкубацию системы в планшете проводили при 25°С в течение 30 мин. Далее удаляли непрореагировавшие компоненты и промывали планшет с использованием промывочного раствора (0.01 M PBS, рН 7.2, 0.15 M NaCl, 0.05% Tween-20). На второй стадии вносили в лунки по 100 мкл раствора конъюгата антивидовых антител (иммуноглобулины козы против иммуноглобулинов мыши) с пероксидазой хрена в титре 1 : 25 000. После инкубации при 25°С в течение 15 мин содержимое лунок удаляли и промывали планшет, как описано выше. В лунки вносили по 100 мкл хромоген-субстратного раствора, содержащего ТМБ и перекись водорода (0.1 М натрий-цитратный буфер, pH 4.2, 3 мМ H2O2 и 1 мМ TMБ), и инкубировали 15 мин при 20–25°С. Ферментативную реакцию останавливали добавлением в лунки по 100 мкл 5%-ной H2SO4.
Измеряли оптическую плотность при 450 нм (ОП450) в планшетном спектрофотометре Tecan Infinity M200 (Австрия) и рассчитывали соотношение Bi/B0 (%), где B0 – оптическая плотность в отсутствие бета-лактама в растворе, Bi – оптическая плотность в присутствии возрастающих концентраций антибиотика в растворе. Калибровочные графики зависимости конкурентного связывания от концентраций бета-лактама в калибровочных пробах строили в координатах: Bi/B0 (%, ось ординат – линейная) и концентрация (нг/мл, ось абсцисс – логарифмическая).
Общую чувствительность метода оценивали по графически определенной величине IC50, что соответствует концентрации антибиотика в растворе, вызывающей 50%-ное ингибирование связывания рецептора с твердофазным лигандом (уменьшение B0 вдвое). Аналитическую чувствительность (предел обнаружения, минимальную достоверно измеряемую концентрацию) получали из калибровочного графика как абциссу точки В0 – 2 SD, где SD – среднеквадратичное отклонение. Перекрестную реактивность (ПР) рассчитывали по формуле: ПР (%) = IC50 (пенициллин G)/IC50 (другой антибиотик) × 100.
Рецепторно-хроматографический анализ на тест-полосках. Нанесение реагентов на нитроцеллюлозную мембрану проводили с помощью автоматического диспенсера IsoFlow (Imagene Technology, США). Аналитическую зону тест-полоски формировали путем нанесения конъюгата ампициллина К7 из раствора с концентрацией 0.5 мг/мл, а в контрольной зоне иммобилизовали антивидовые антитела (иммуноглобулины козы против иммуноглобулинов мыши) из раствора с концентрацией 0.25 мг/мл. Функционализированные мембраны высушивали на воздухе при 20–22°C не менее 20 ч и вместе с подложкой для исследуемой пробы и впитывающей мембраной собирали в мультимембранный композит. Тест-полоски нарезали шириной 3.5 мм с помощью автоматического гильотинного нарезчика IndexCutter 1 (A-PointTechnologies, США).
Наночастицы золота получали восстановлением золотохлористоводородной кислоты цитратом натрия по методу Френса, как описано в работе Byzova et al. [26]. Полученные наночастицы в выбранной на основании фотометрических данных концентрации 10 мкг/мл адсорбционно конъюгировали с МАт к ПСБ. Для проведения модельного рецепторно-хроматографического анализа бета-лактамов в лунки инертного пластмассового микропланшета вносили меченный наночастицами золота комплекс МАт–ПСБ и добавляли бета-лактам (ампициллин, пенициллин G, амоксициллин, цефоперазон или цефалексин) в возрастающих концентрациях в диапазоне 0.25–400 нг/мл. Далее реагенты выдерживали в течение 3–5 мин и в лунку помещали подготовленные тест-полоски. Хроматографию проводили в течение 10 мин и визуально регистрировали окрашивание в аналитической и контрольной зонах.
Все эксперименты по лиганд-рецепторному связыванию проводили не менее чем в трех повторах. Обработку данных проводили с помощью программы Microsoft Excel. На калибровочном графике (рис. 3) планки погрешностей обозначают среднеквадратичное отклонение SD.
ЗАКЛЮЧЕНИЕ
В результате выполненного исследования охарактеризованы методики прямого конъюгирования пенициллинов и цефалоспоринов с белковыми макромолекулами (ЧСА и овальбумина) для технологий рецепторного анализа. Установлено влияние модификаций пенициллинов и цефалоспоринов в области бета-лактамного кольца и в боковой цепи на связывание с белком-рецептором, определены спектральные характеристики синтезированных белковых конъюгатов бета-лактамов. Предложены оптимальные условия биоконъюгирования белков с этими субстанциями без предварительного введения линкерных (спейсерных) групп в структуры антибиотиков. Установлено оптимальное мольное соотношение антибиотика и белка-носителя в синтезированном конъюгате для его эффективного взаимодействия с ПСБ. В модельных системах лиганд-рецепторного связывания исследованы биоаналитические свойства полученных конъюгатов. Разработаны конструкции тест-систем для рецепторного анализа бета-лактамных антибиотиков в микропланшетном варианте и в виде хроматографических тест-полосок, характеризующиеся широкой групповой специфичностью и высокой аналитической чувствительностью в отношении пенициллинов и цефалоспоринов.
В ближайшей перспективе описанная в данной работе модельная рецепторно-хроматографическая тест-система для выявления бета-лактамов может стать практическим аналитическим средством экспресс-контроля биобезопасности продуктов питания.
Список литературы
Sachi S., Ferdous J., Sikder M.H., Azizul Karim Hussani S.M. // J. Adv. Vet. Anim. Res. 2019. V. 6. P. 315–332. https://doi.org/10.5455/javar.2019.f350
Landers T.F., Cohen B., Wittum T.E., Larson E.L. // Public Health Rep. 2012. V. 127. P. 4–22. https://doi.org/10.1177/003335491212700103
Kantiani L., Farre M., Barcelo D. // Trends Anal. Chem. 2009. V. 28. P. 729–744. https://doi.org/10.1016/j.trac.2009.04.005
Dzantiev B.B., Byzova N.A., Urusov A.E., Zherdev A.V. // Trends Anal. Chem. 2014. V. 55. P. 81–93. https://doi.org/10.1016/j.trac.2013.11.007
Zhang J., Wang Z., Wen K., Liang X., Shen J. // Anal. Biochem. 2013. V. 442. P. 158–165. https://doi.org/10.1016/j.ab.2013.07.042
Merola G., Martini E., Tomassetti M., Campanella L. // J. Pharm. Biomed. Anal. 2014. V. 106. P. 186–196. https://doi.org/10.1016/j.jpba.2014.08.005
Abdulla A., Bahmany S., Wijma R.A., van der Nagel B.C.H., Koch B.C.P. // J. Chromatogr. B Anal. Technol. Biomed. Life Sci. 2017. V. 1060. P. 138–143. https://doi.org/10.1016/j.jchromb.2017.06.014
Briscoe S.E., McWhinney B.C., Lipman J., Roberts J.A., Ungerer J.P.J. // J. Chromatogr. B Anal. Technol. Biomed. Life Sci. 2012. V. 907. P. 178–184. https://doi.org/10.1016/j.jchromb.2012.09.016
Rawson T.M., Sharma S., Georgiou P., Holmes A., Cass A., O’Hare D. // Electrochem. Commun. 2016. V. 82. P. 1–5. https://doi.org/10.1016/j.elecom.2017.07.011
Merola G., Martini E., Tomassetti M., Campanella L. // Sens. Actuators B Chem. 2014. V. 199. P. 301–313. https://doi.org/10.1016/j.snb.2014.03.083
Hrioua A., Loudiki A., Farahi A., Bakasse M., Lahrich S., Saqrane S., Mhammedi M.A.El. // Bioelectrochemistry. 2021. V. 137. P. 107687. https://doi.org/10.1016/j.bioelechem.2020.107687
Бызова Н.А., Зверева Е.А., Жердев А.В., Дзантиев Б.Б. // Прикл. биохимия и микробиология. 2011. Т. 47. С. 685–693. [Byzova N.A., Zvereva E.A., Zherdev A.V., Dzantiev B.B. // Appl. Biochem. Microbiol. 2011. V. 47. P. 627–634.] https://doi.org/10.1134/S0003683811060032
Benito-Peña E., Moreno-Bondi M.C., Orellana G., Maquieira Á., van Amerongen A. // J. Agric. Food Chem. 2005. V. 53. P. 6635−6642. https://doi.org/10.1021/jf0511502
Cliquet P., Goddeeris B.M., Bonroy K., Cox E. // Food Agric. Immunol. 2005. V. 16. P. 101–115. https://doi.org/10.1080/09540100500139239
Cliquet P., Cox E., Van Dorpe C., Schacht E., Goddeeris B.M. // J. Agric. Food Chem. 2001. V. 49. P. 3349−3355. https://doi.org/10.1021/jf001428k
Macheboeuf P., Contreras-Martel C., Job V., Dideberg O., Dessen A. // FEMS Microbiol. Rev. 2006. V. 30. P. 673–691. https://doi.org/10.1111/j.1574-6976.2006.00024.x
Sauvage E., Kerff F., Terrak M., Ayala J.A., Charlier P. // FEMS Microbiol. Rev. 2008. V. 32. P. 234–258. https://doi.org/10.1111/j.1574-6976.2008.00105.x
Mbah A.N., Isokpehi R.D. // Chemother. Res. Pract. 2013. V. 2013. Article ID 614670. https://doi.org/10.1155/2013/614670
Zeng K., Zhang J., Wang Y., Wang Z.H., Zhang S.X., Chong Ming W.U. // Biomed. Environ. Sci. 2013. V. 26. P. 100–109. https://doi.org/10.3967/0895-3988.2013.02.004
Peng J., Cheng G., Huang L., Wang Y., Hao H., Peng D. // Anal. Bioanal. Chem. 2013. V. 405. P. 8925–8933. https://doi.org/10.1007/s00216-013-7311-5
Komova N.S., Berlina A.N., Zherdev A.V., Dzantiev B.B. // Orient. J. Chem. 2020. V. 36. P. 21–25. https://doi.org/10.13005/ojc/360103
Вашкевич И.И., Ястребова А.А., Куприенко О.С., Серченя Т.С., Иванько М.В., Шкиндерова В.О., Пыжик И.П., Смоляк Т.М., Мелещеня А.В., Свиридов О.В. // Вес. Нац. акад. навук Беларусi. Сер. хiм. навук. 2020. Т. 56. № 3. С. 318–332. https://doi.org/10.29235/1561-8331-2020-56-3-318-332
Chen W., Huang Z., Hu S., Peng J., Liu D., Xiong Y., Xu H., Wei H., Weihua L. // J. Dairy Sci. 2019. V. 102. P. 1887–1900. https://doi.org/10.3168/jds.2018-15462
Перечень ветеринарных лекарственных средств (фармакологически активных веществ), максимально допустимые уровни остатков которых могут содержаться в непереработанной пищевой продукции животного происхождения, в том числе в сырье, и методик их определения // Решение Коллегии Евразийской экономической комиссии от 13.02.2018 г. № 28. http://pravo.by/document/?guid=3871&p0=F91800044
European Commission. Commission Regulation (EU) No. 37/2010 of 22 December 2009 on pharmacologically active substances and their classification regarding maximum residue limits in foodstuffs of animal origin // Official Journal of the European Union. 2010. L 15/1. https://ec.europa.eu/health/sites/health/files/files/ eudralex/vol-5/reg_2010_37/reg_2010_37_en.pdf
Byzova N.A., Smirnova N.I., Zherdev A.V., Eremin S.A., Shanin I.A., Lei H.T., Sun Y., Dzantiev B.B. // Talanta. 2013. V. 119. P. 125–132. https://doi.org/10.1016/j.talanta.2013.10.054
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия



