Биоорганическая химия, 2022, T. 48, № 3, стр. 357-370
Синтез и исследование антидепрессивных свойств новых аналогов аргинин-вазопрессина
К. В. Бородина 1, *, О. Н. Саванец 1, Е. С. Пустюльга 1, В. П. Мартинович 1, Е. В. Кравченко 1, Л. М. Ольгомец 1, В. П. Голубович 1
1 Институт биоорганической химии НАН Беларуси
220141 Минск, ул. акад. В.Ф. Купревича, 5/2, Беларусь
* E-mail: borodina@iboch.by
Поступила в редакцию 14.07.2021
После доработки 03.11.2021
Принята к публикации 10.11.2021
- EDN: DIKUZY
- DOI: 10.31857/S0132342322030058
Аннотация
С целью поиска новых аналогов аргинин-вазопрессина (АВП), обладающих антидепрессивными свойствами, было осуществлено компьютерное моделирование, которое позволило выявить ряд пептидных аналогов С-концевого фрагмента АВП: N-Ac-D-Ser-Pro-D-Arg-Gly-NH2, N-Ac-Phe-Pro-Arg-Gly-NH2, N-Ac-Trp-Pro-Arg-Gly-NH2. В работе представлены методики синтеза смоделированных соединений. C использованием теста принудительного плавания для выявления соединений, потенциально обладающих антидепрессивной активностью, было показано, что при интраназальном введении крысам-самцам линии Wistar исследуемых пептидов в дозах 0.1–10.0 мкг/кг наибольшим сходством по ряду изученных показателей с референтным антидепрессантом флуоксетином обладают N-Ac-Trp-Pro-Arg-Gly-NH2 (0.1, 1.0 и 10.0 мкг/кг) и N-Ac-D-Ser-Pro-D-Arg-Gly-NH2 (1.0 мкг/кг).
ВВЕДЕНИЕ
Аргинин-вазопрессин (АВП) участвует в регуляции как периферических, так и центральных процессов: эмоций, поведения, памяти, социального взаимодействия и стресса [1]. Исследования показали, что в головном мозге под действием ферментов молекула АВП быстро (период полураспада <1 мин [2]) распадается на ряд более коротких биологически активных метаболитов [3]. Фрагмент АВП4–9 (pGln4-Asn5-Cyt6-Pro7-Arg8-Gly9-NH2) обнаруживается в мозге крыс как один из основных продуктов ферментативной деградации гормона. Данный олигопептид более селективен и активен, а также ферментативно устойчив (период полураспада ~40 мин [4]) по сравнению с исходным гормоном, но при этом не проявляет периферических свойств, связанных с регуляцией кровяного давления, водного баланса и терморегуляцией [3]. Согласно ряду исследований [5, 6], АВП4–9 связывается рецепторами V1a вазопрессина. Данный подтип рецепторов в большом количестве экспрессируется в боковой перегородке, входящей в структуру лимбической системы – важнейшего центра регуляции поведения, эмоций, памяти, социального взаимодействия [7]. В то же время V1a-рецепторы расположены в супраоптическом ядре в области нейронов, синтезирующих АВП, что может указывать на то, что АВП4–9 принимает участие в контроле АВП in vivo и способен, по всей видимости, пролонгировать физиологическое действие данного гормона [8, 9]. Известен ряд аналогов АВП4–9, более устойчивых к действию протеиназ, легче преодолевающих гематоэнцефалический барьер и проявляющих ноотропные и поведенческие эффекты [10–12]. Однако широкое применение АВП4–9 и его аналоги не нашли из-за сложности и многостадийности процесса синтеза, а также трудностей доставки этих соединений в нужные области головного мозга. Решением данной проблемы могут стать более короткие фрагменты и аналоги АВП, доставку которых в нужные области головного мозга можно осуществить путем всасывания через слизистую носа (интраназально). Основные преимущества интраназального введения: 1) более простое попадание действующих веществ в нервную систему через лишенные гематоэнцефалического барьера оболочки обонятельных нервов; 2) высокая биодоступность; 3) отсутствие эффекта первого прохождения через печень и связанных с этим неблагоприятных реакций; 4) удобство и легкость применения; 5) быстрота развития системного эффекта [13]. Известно, что С-концевой фрагмент АВП6–9 – Сys6-Pro7-Arg8-Gly9-NH2 – сохраняет влияние на поведение, память, стимулирует исследовательскую активность, но обладает низкой устойчивостью к действию протеиназ [4, 14, 15]. С целью увеличения энзиматической стабильности и активности пептида ранее было предложено заменить остаток Cys на N-Ac-D-Met и N-Ac-D-Ser. Исследования показали, что модифицированные тетрапептиды при интраназальном введении оказывают положительное влияние на обучение и память крыс, а также проявляют антидепрессивную активность в дозах 0.01–10.0 мкг/кг [16, 17].
Цель данной работы – моделирование и синтез новых аналогов АВП, а также исследование их антидепрессивной активности при интраназальном введении крысам линии Wistar.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
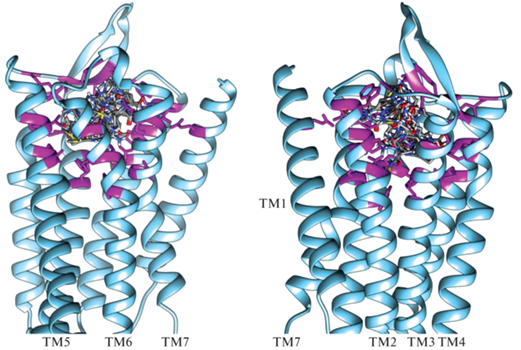
Для поиска новых аналогов АВП использовали метод молекулярного моделирования. На первом этапе было осуществлено моделирование взаимодействия рецептора V1a с метаболитом АВП4–9. Исследуемый белок-рецептор имеет семь трансмембранных доменов (ТМ), расположенных параллельно друг другу: ТМ1 – Lys53-Leu76, TM2 – Phe89-Cys110, TM3 – Val126-Ala147, TM4 – Arg166-Phe189, TM5 – Trp219-Ile239, TM6 – Phe294-Trp313, TM7 – Ile332-Phe351. Домены образуют полость, которая может служить участком, удобным для связывания пептидных лигандов (рис. 1) [18]. Основываясь на результатах ранее проведенных экспериментов по моделированию взаимодействия V1a-рецептора с АВП и его аналогами, для моделирования были выбраны трансмембранная и внеклеточная части белка [19, 20].
Рис. 1.
Изображение нижней экстрацеллюлярной и трансмембранной частей рецептора V1a человека со встроенным метаболитом АВП4–9.
В результате докинга была выделена область рецептора, с которой взаимодействует АВП4–9 (рис. 1), расположенная в первой трети трансмембранной области V1a-рецептора, локализация которой совпадает с “карманом”, выявленным для АВП и его аналогов в ранее проведенных экспериментах [20]. Показано, что исследуемый пептид образует водородные связи с V1a-рецептором за счет взаимодействия атомов водородов амидных групп остатков Asn и Gly-NH2 с остатками Сys203 и Val217 соответственно, при этом полученные данные хорошо согласуются с ранее выдвинутым предположением [15], что данные аминокислотные остатки могут играть важную роль в связывании пептида. С другой стороны, известно, что дальнейшая ферментативная деградация приводит к отщеплению остатка Gly-NH2 в АВП4–9, при этом образуется АВП4–8, который не теряет свойств предшественника [4].
Моделирование взаимодействия фрагментов АВП4–9 с исследуемой областью V1a-рецептора показало, что короткие фрагменты АВП4–5 (pGln-Asn-OH) и АВП7–9 (H-Pro-Arg-Gly-NH2) не связываются с исследуемой областью рецептора и имеют более высокие значения энергии взаимодействия (средние значения –4.30 и –4.60 ккал/моль соответственно), чем АВП4–9 (среднее значение ‒7.50 ккал/моль) (табл. 1).
Таблица 1.
Энергии взаимодействия основного метаболита АВП и его фрагментов с V1a-рецептором человека
| Пептид | |||||
|---|---|---|---|---|---|
| АВП4–9 | АВП6–9 | АВП7–9 | АВП7–8 | АВП4–5 | |
| Е, ккал/моль | –7.50 ± 0.20 | –5.95 ± 0.22 | –4.60 ± 0.14 | –4.41 ± 0.23 | –4.30 ± 0.22 |
Для дальнейшего конструирования аналога АВП был выбран фрагмент АВП6–9, который по результатам докинга связывается с исследуемой областью рецептора и имеет наименьшую энергию взаимодействия среди исследованных фрагментов.
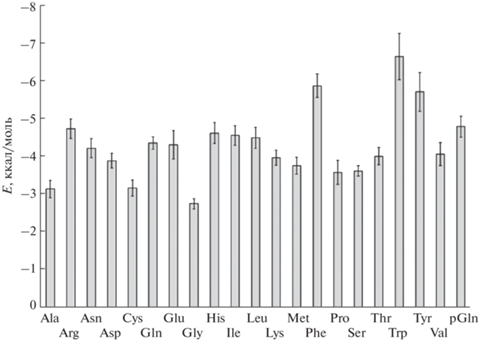
На следующем этапе было осуществлено моделирование взаимодействия найденной области в белке-рецепторе с рядом природных аминокислот и фрагментов АВП4–9. Средние значения энергии связывания десяти наиболее устойчивых конформаций каждой из выбранных аминокислот приведены на рис. 2.
Из рис. 2 видно, что наименьшие значения энергии взаимодействия с V1a получены для Tyr, Phe, Trp, средние энергии взаимодействия с рецептором которых равны –5.7, –5.9 и –6.6 ккал/моль соответственно. Последующая замена Cys в АВП6–9 на указанные аминокислотные остатки позволила получить тетрапептиды с меньшими энергиями связывания, чем у АВП6–9, основного метаболита АВП, а также у ранее исследованных тетрапептидов (рис. 3).
Более низкие энергии связывания пептидов, содержащих ароматические аминокислотные остатки, вероятно, обусловлены множеством факторов, в том числе могут объясняться π–π-взаимодействием (стекингом), а также тем, что ароматические аминокислоты, в частности Tyr и Phe, играют важнейшую роль для ориентирования и передачи сигнала при взаимодействии нейрогипофизарных гормонов и их рецепторов [15, 18–20]. Для ряда смоделированных пептидов (N-Ac-D-Ser-Pro-Arg-Gly-NH2, N-Ac-D-Ser-Pro-D-Arg-Gly-NH2, N-Ac-Trp-Pro-Arg-Gly-NH2) обна-ружено взаимодействие с остатком Tyr115, входящим в состав внеклеточной части белка-рецептора и играющим важнейшую в роль в связывании агонистов и селективности [20].
Для синтеза и дальнейшего исследования антидепрессивной активности было выбрано пять тетрапептидов: N-Ac-Ser-Pro-Arg-Gly-NH2 (VI), N-Ac-D-Ser-Pro-Arg-Gly-NH2 (VIII), N-Ac-D-Ser-Pro-D-Arg-Gly-NH2 (X), N-Ac-Phe-Pro-Arg-Gly-NH2 (XII) и N-Ac-Trp-Pro-Arg-Gly-NH2 (XIII).
Основной проблемой при синтезе тетрапептидов (схема 1 ) оказались побочные реакции боковых функциональных групп в аминокислотных остатках Arg, Ser и Trp. Получение трипептидов Boc-Pro-Arg-Gly-NH2·HCl (III) и Boc-Pro-D-Arg-Gly-NH2·HCl (IV) осуществляли по схемам, описанным ранее [21], используя протонирование в качестве защиты гуанидиновой группы остатка аргинина. При синтезе была отмечена различная растворимость диастереомеров Boc-Pro-Arg-OH (I) и Boc-Pro-D-Arg-ОН (II) в смеси диоксан/вода: соединение (II) не выпадало в осадок в процессе синтеза, в связи с чем осложнялся процесс выделения и очистки дипептида.
Схема 1 . Синтез тетрапептидов N-Ac-D-Ser-Pro-Arg-Gly-NH2 (VIII), N-Ac-D-Ser-Pro-D-Arg-Gly-NH2 (X), N-Ac-Phe-Pro-Arg-Gly-NH2 (XII) и N-Ac-Trp-Pro-Arg-Gly-NH2 (XIII), где Хаа = Ser(Bzl), D-Ser, Phe. HOSu – N-гидроксисукцинимид; DCC – N,N'-дициклогексилкарбодиимид; DIPC – N,N'-диизопропилкарбодиимид; HOBt – 1-гидроксибензотриазол; TEA – триэтиламин; Pfp-OH – пентафторфенол.
Отщепление Boc-защитных групп трипептидов проводили 5.0 н. раствором HCl в этилацетате. Гидрохлориды пептидов после снятия Boc-защитных групп, которое протекало с выходами, близкими к количественным (92–99%), использовали в синтезе после определения однородности методом ТСХ.
Бензильную защиту с OH-группы серина в тетрапептиде N-Ac-Ser(Bzl)-Pro-Arg-Gly-NH2 удаляли гидрированием над катализатором – платиновой чернью – в растворе уксусная кислота/метанол (схема 2 ).
Схема 2. Получение N-Ac-Ser-Pro-Arg-Gly-NH2 (VI).
Присоединение аминокислотных остатков Boc-D-Ser и Boc-D-Phe при синтезе Boc-D-Ser-Pro-Arg-Gly-NH2 (VII), Boc-D-Ser-Pro-D-Arg-Gly-NH2 (IX) и Boc-Phe-Pro-Arg-Gly-NH2 (XI) осуществляли согласно схеме 1 методом активированных эфиров [22], которые брали в 30–40%-ном избытке. Метод Кишфалуди удобен тем, что позволяет снизить вероятность рацемизации присоединяемых аминокислотных остатков, а также легко удалить избыток активированного эфира на последующей стадии снятия Boc-защитных групп за счет хорошей растворимости эфиров в этилацетате в присутствии галогенводородов.
В случае присоединения триптофана важно избежать побочных реакций индольного кольца, связанных с алкилированием при снятии N-защитных групп в кислой среде [23]. С целью избежать бутилирования триптофана при удалении Boc-защиты для синтеза N-Ac-Trp-Pro-Arg-Gly-NH2 (XIII) использовали N-Ac-Trp-ОН, который присоединяли к трипептиду карбодиимидным методом в присутствии 1-гидроксибензотриазола (HOBt) в качестве противорацемической добавки.
Влияние синтезированных пептидов на показатели поведения крыс линии Wistar в тесте принудительного плавания. Тест принудительного плавания (Forced swimming test, FST) – одна из самых распространенных и широко используемых моделей для выявления соединений, обладающих антидепрессивными свойствами. После первоначальных интенсивных попыток избегания стрессовой ситуации (плавание ‒ swimming и вскарабкивание ‒ climbing) животные прекращают борьбу, наступает иммобилизация. Полагают, что иммобилизация отражает либо неспособность упорно продолжать поведение, направленное на избегание стрессовой ситуации (т.е. поведение отчаяния), либо развитие пассивного поведения, обеспечивающего экономию сил, однако препятствующего активной борьбе за выход из стрессовой ситуации [24].
В FST эффективно “острое” применение антидепрессантов, тогда как в клинической практике требуется хроническое введение наряду с отсроченным началом действия [24]. Ольфакторная бульбэктомия, парадигмы хронического стресса и выученной беспомощности могут с большей степенью надежности считаться животными моделями депрессии, чем FST, однако у этих тестов низкая пропускная способность и слабая межлабораторная воспроизводимость [24]. Тот факт, что FST позволяет получить двусторонне направленные результаты, придает модели высокую прогностическую достоверность. По мнению исследователей, FST – подходящая модель для доклинических исследований расстройств настроения [24, 25].
Применение фармакологических и патологоанатомических методов позволило установить, что антидепрессанты с катехоламинергическими механизмами действия избирательно повышают поведение climbing, а с серотонинергическими – swimming [24]. Так, эффекты антагонистов ГАМКВ-рецепторов преимущественно опосредуются через серотонинергическую систему; эти соединения увеличивают долю поведения swimming, которое ослабляется при последующем снижении концентрации серотонина в мозге [24].
Влияние N-Ac-Ser-Pro-Arg-Gly-NH2 (VI), N-Ac-D-Ser-Pro-Arg-Gly-NH2 (VIII), N-Ac-D-Ser-Pro-D-Arg-Gly-NH2 (X), N-Ac-Phe-Pro-Arg-Gly-NH2 (XII) и N-Ac-Trp-Pro-Arg-Gly-NH2 (XIII) на поведение изучали на половозрелых белых крысах-самцах линии Wistar. Тетрапептиды вводили грызунам однократно интраназально в дозах 0.1, 1.0 и 10.0 мкг/кг веса животного с использованием эквивалентного объема растворителя. Особям контрольной группы вместо пептидов вводили дистиллированную воду (1 мкл на 10 г тела). В качестве референтного лекарственного средства использовали флуоксетин (Флуксен, Украина), который вводили крысам внутрибрюшинно в дозе 20.0 мг/кг.
Результаты экспериментов показали, что соединение N-Ac-Trp-Pro-Arg-Gly-NH2 (XIII) статистически значимо снижало длительность иммобилизации (на 40.0, 40.9 и 42.8% относительно контроля при введении в дозах 0.1, 1.0 и 10.0 мкг/кг соответственно, р < 0.05). Соединение N-Ac-D‑Ser-Pro-D-Arg-Gly-NH2 (Х) в дозе 1.0 мкг/кг (но не 0.1 и 10.0 мкг/кг) существенно снижало длительность иммобилизации – на 48.1%, р < 0.05 (рис. 4а). Действие пептидов (X) и (XIII) было сопоставимым с таковым флуоксетина (20.0 мг/кг здесь и далее), который статистически достоверно уменьшал длительность иммобилизации – на 57.8% относительно значений в контроле, р < 0.05 (рис. 4а).
Рис. 4.
Диаграммы изменения показателя “суммарная длительность иммобилизации” (%) в тесте принудительного плавания: (a) – “тест”, после введения соединений относительно значений показателя в контроле; (б) – “тест” относительно значений показателя в “пре-тесте” (К-1 – контроль к соединению (VI); К-2 – контроль к соединениям (VIII) и (XII); К-3 – контроль к соединениям (X) и (XIII); К-4 – контроль к флуоксетину). * p < 0.05, критерий Манна–Уитни; #p < 0.05, критерий Уилкоксона.

По данным литературы, эффективная доза флуоксетина составляет 20 мг/кг при однократном введении [24], а в случае 21-кратного введения минимальная эффективная доза составляет 1.0 мг/кг [26]. Таким образом, соединения (Х) и (XIII) превосходили стандартный антидепрессант по уровню действующих доз на 3–4 порядка соответственно. Соединения N-Ac-Ser-Pro-Arg-Gly-NH2 (VI), N-Ac-D-Ser-Pro-Arg-Gly-NH2 (VIII) и N-Ac-Phe-Pro-Arg-Gly-NH2 (XII) достоверно не изменяли длительность иммобилизации в сравнении с контролем (рис. 4а).
Суммарная длительность иммобилизации на этапе “тест” была существенно больше, чем в “пре-тесте” у животных в контроле (серия 3, р < 0.05), а также после применения соединений (VIII) (1.0, 10.0 мкг/кг) и (XII) (10.0 мкг/кг) (р < 0.05). Отсутствие динамики указанного показателя отмечено после введения соединения (Х), а его существенное снижение в сравнении с “пре-тестом” (p < 0.05) – как после применения соединений (XII) (0.1 мкг/кг) и (XIII) (0.1 мкг/кг), так и на фоне флуоксетина (рис. 4б). Стабилизация или снижение суммарной длительности иммобилизации на этапе “тест” могут быть расценены как положительные изменения, противоположные выученной иммобилизации, отмеченной в контроле.
Введение всех исследованных соединений и флуоксетина не вызывало статистически значимого изменения параметра “суммарная длительность активного плавания” (swimming) относительно контроля, однако отмечена четко выраженная тенденция к возрастанию swimming: на 174.6% – после введения референтного антидепрессанта; на 92.0–162.0% – пептида (XIII) в дозах 0.1–10.0 мкг/кг; на 149.0 и 134.0% – соединения (VI) в дозах 1.0 и 10.0 мкг/кг соответственно; на 65.7–127.7% – соединения (Х) в дозах 0.1–10.0 мкг/кг; в остальных случаях отклонения от контроля были незначительными (рис. 5a).
Рис. 5.
Диаграммы изменения показателя “суммарная длительность активного плавания” (swimming) (%) в тесте принудительного плавания: (a) – “тест”, после введения соединений относительно значений показателя в контроле; (б) – “тест” относительно значений показателя в “пре-тесте” (К-1 – контроль к соединению (VI); К-2 – контроль к соединениям (VIII) и (XII); К-3 – контроль к соединениям (X) и (XIII); К-4 – контроль к флуоксетину). # p < 0.05, критерий Уилкоксона.

В контроле (серии 2–4) этап “тест” в сравнении с “пре-тестом” характеризовался статистически достоверным снижением продолжительности активного плавания (swimming) ‒ на 42.8, 38.3 и 42.7% соответственно (p < 0.05). Соединения (VI) (0.1–10.0 мкг/кг), (VIII) (0.1 мкг/кг), (X) (0.1–10.0 мкг/кг), (XII) (0.1–10.0 мкг/кг), (XIII) (0.1–10.0 мкг/кг) и флуоксетин препятствовали значимому уменьшению swimming, отмеченному в контроле; наиболее выраженным эффектом характеризовались пептид (XIII) (0.1 мкг/кг) и флуоксетин, действие которых было сопоставимым (рис. 5б).
Статистически значимых изменений показателя “суммарная длительность активного плавания” (climbing) относительно контроля при введении исследованных соединений и флуоксетина не было обнаружено, однако отмечалась отчетливая тенденция к увеличению продолжительности climbing при введении соединения (VI) (0.1–10.0 мкг/кг) ‒ на 79.2–125.0%; соединения (VIII) (10.0 мкг/кг) – на 106.0% и соединения (XII) (0.1 и 1.0 мкг/кг) – на 108.2 и 91.0% соответственно. Пептиды (X), (XIII) и флуоксетин слабо влияли на указанный показатель (рис. 6а). Введение соединения (VI) способствовало существенному снижению числа крыс с низкой (<25 с) продолжительностью активного плавания в варианте climbing – в 5.3 раза по сравнению с контролем (p = 0.04, точный критерий Фишера).
Рис. 6.
Диаграммы изменения показателя “суммарная длительность активного плавания” (climbing) (%) в FST: (a) – “тест”, после введения соединений относительно значений показателя в контроле; (б) – “тест” относительно значений показателя в “пре-тесте” (К-1 – контроль к соединению (VI); К-2 – контроль к соединениям (VIII) и (XII); К-3 – контроль к соединениям (X) и (XIII); К-4 – контроль к флуоксетину). #p < 0.05, критерий Уилкоксона.

В контроле (серии 1–4, статистически значимо для серии 2 – на 42.8%) отмечалось уменьшение длительности активного плавания (climbing) на этапе “тест” в сравнении с “пре-тестом”. Применение пептидов (VIII) (10.0 мкг/кг) и (XII) (1.0 и 10.0 мкг/кг) предотвращало статистически значимое снижение названного показателя. Введение соединений (Х) (0.1 мкг/кг), (XIII) (1.0 и 10.0 мкг/кг) и флуоксетина сопровождалось значимым снижением длительности climbing на этапе “тест” в сравнении с “пре-тестом” ‒ на 52.9, 41.7, 34.8 и 42.4% соответственно (р < 0.05) при отсутствии достоверных изменений в контроле (серии 3, 4) (рис. 6б).
Усиление swimming (при слабом влиянии на climbing) соединениями (X), (XIII) и флуоксетином могло указывать на наличие у них серотонин-, но не катехоламинергического механизма действия [24]. Пептид (VI), по-видимому, характеризовался более сложным механизмом действия, поскольку усиливал как swimming, так и climbing, а соединения (VIII) и (XII), напротив, несколько усиливали активное поведение climbing, не меняя swimming (рис. 5а, 6а).
Отмечена тенденция к возрастанию латентного периода первого акта иммобилизации (ЛП1иммоб) на фоне введения всех изученных пептидов; по выраженности указанного действия соединения (VI), (Х), (ХII) и (ХIII) (0.1 и 1.0 мкг/кг) превосходили флуоксетин (рис. 7а).
Рис. 7.
Влияние пептидов на изменение показателя ЛП1иммоб (%) в тесте принудительного плавания: (a) – “тест”, после введения соединений относительно значений показателя в контроле; (б) – “тест” относительно значений показателя в “пре-тесте” (К-1 – контроль к соединению (VI); К-2 – контроль к соединениям (VIII) и (XII); К-3 – контроль к соединениям (X) и (XIII); К-4 – контроль к флуоксетину). # p < 0.05, критерий Уилкоксона.

В контроле (1–4, для серий 2 и 4 р < 0.05) имело место снижение ЛП1иммоб на этапе “тест” по сравнению со значениями в “пре-тесте”, устраняемое соединением (XII) (0.1–10.0 мкг/кг), ослабляемое пептидом (VIII) (0.1 мкг/кг) и флуоксетином. Введение пептида (VI) (1.0 и 10.0 мкг/кг, но не 0.1 мкг/кг) индуцировало снижение указанного показателя (p < 0.05), тогда как в соответствующей контрольной группе 1 снижение было незначимым (рис. 7б). Применение соединения (ХIII) в дозе 1.0 мкг/кг вызывало существенное возрастание значений показателя ЛП1иммоб (в 2.84 раза выше, чем значения того же критерия на этапе “пре-тест”, p < 0.05), что могло отражать отсрочивание выученной иммобилизации и резко отличало соединение (ХIII) от остальных испытанных образцов и флуоксетина (рис. 7б).
Исследованные соединения и референтный антидепрессант флуоксетин существенно не влияли на суммарную длительность пассивного плавания и латентный период первого акта активного плавания в варианте swimming (ЛП1акт) как в сравнении с контролем, так и при сопоставлении “тест”/“пре-тест”. Исключением явился пептид (XII), применение которого сопровождалось снижением длительности пассивного плавания на этапе “тест” относительно “пре-теста” при введении в дозах 1.0 и 10.0 мкг/кг (на 32.1 и 29.5%, p < < 0.05) и значимым возрастанием того же показателя в дозе 0.1 мкг/кг (на 41.9%, p < 0.05).
В качестве соединений с наиболее выраженным эффектом в FST были отобраны пептиды (X) (1.0 мкг/кг) и (XIII) (0.1–10.0 мкг/кг), которые, как и флуоксетин, снижали суммарную длительность иммобилизации (p < 0.05) (рис. 4а). Соединение (XIII) (0.1 мкг/кг) и флуоксетин нивелировали отмеченное в контроле значимое возрастание суммарной длительности иммобилизации в “тесте” в сравнении с “пре-тестом” (рис. 4б). Соединения (X) (0.1–10.0 мкг/кг), (XIII) (0.1–10.0 мкг/кг) и флуоксетин проявляли тенденцию к повышению показателя swimming в сравнении с контролем и “пре-тестом” (рис. 5). Указанные соединения не влияли на продолжительность climbing в сравнении с контролем; вместе с тем соединения (X) (0.1 мкг/кг), (XIII) (1.0 и 10.0 мкг/кг) и флуоксетин снижали двигательную активность в вертикальной плоскости в сопоставлении с “пре-тестом” (p < 0.05) (рис. 6). Таким образом, соединения (Х) и (ХIII) имели сходный с флуоксетином “профиль” фармакологического действия, проявлявшийся преобладанием climbimg над swimming. Пептиды (X) и (XIII) по уровню активных доз существенно превосходили стандартный антидепрессант. Отличие соединения (ХIII) (1.0 мкг/кг) от других пептидов и флуоксетина – способность индуцировать существенное возрастание значений показателя ЛП1иммоб, что могло отражать отсрочивание выученной иммобилизации и предпочтение активной стратегии поведения при повторной экспозиции в условиях неизбегаемого стресса (рис. 7б).
Аспекты сезонности влияют на трактовку результатов в FST. Иммобилизация у грызунов летом менее продолжительна, и поведение отчаяния менее выражено летом по сравнению с зимой и весной [27]; у трех из четырех исследованных антидепрессантов были выявлены сезонные колебания эффективности [28]. Выраженному эффекту соединений N-Ac-D-Ser-Pro-D-Arg-Gly-NH2 (X) и N-Ac-Trp-Pro-Arg-Gly-NH2 (XIII) могло благоприятствовать проведение исследования в зимний период (наиболее приемлемый период для выявления антидепрессивного действия [27, 28]).
Перспективно дальнейшее изучение активности пептида N-Ac-Trp-Pro-Arg-Gly-NH2 (XIII) как потенциально эффективного фармакологического вещества с использованием иных животных моделей депрессивноподобного расстройства (хронический стресс, выученная беспомощность [24]).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ.
Компьютерное моделирование. Молекулярный докинг рецептора V1a (Р37288 (V1AR_HUMAN), база данных SwissModel) и пептидов (или аминокислот), созданных с помощью программы PyMol, выполняли в программе UCSF Chimera (RBVI, США) через инструмент AutoDock Vina. Моделирование проводили локально в трансмембранной области белка-рецептора V1a согласно данным SwissModel. Минимизацию структуры пептидов проводили с помощью силового поля MMFF94 в программе ChemOffice 2019 (PerkinElmer Inc., США). Минимизацию структуры модели-рецептора осуществляли в программе UCSF Chimera. В данной работе использовали гибкий докинг: поиск оптимального положения осуществляли при подвижном лиганде (аминокислоте или пептиде) относительно неподвижной структуры белка. Для синтеза и дальнейших исследований отбирали соединения, показавшие наилучшие значения энергии связывания.
Синтез пептидов. В процессе синтеза использовали реагенты, аминокислоты и их производные фирм Sigma, США; AcrosOrganics, Бельгия; Fluka, Швейцария. Процессы синтеза и удаления защитных групп контролировали методом тонкослойной хроматографии (ТСХ) на пластинках Merck (Германия) в различных системах растворителей: хлороформ–метанол–25%-ный аммиак 6 : 4 : 1 (А); этилацетат–пиридин–уксусная кислота–вода 5 : 3 : 1 : 2 (Б); хлороформ–метанол–25%-ный аммиак–уксусная кислота 20 : 15 : 5 : 1 (В); н-бутанол–уксусная кислота–вода 4 : 1 : 1 (Г); метанол–этилацетат–уксусная кислота 4 : 2 : 1 (Д). Соединения обнаруживали с помощью хлор-бензидиновой пробы.
Аналитическую ВЖЭХ и масс-спектрометрию (ионизация распылением в электрическом поле (ESI MS) в режиме сканирования положительных ионов) проводили на хроматографе Agilent 1200 с масс-селективным детектором типа тройной квадруполь Agilent 6140 (США). Колонка Agilent ZorbaxSBC18 RR (2.1 × 30 мм), размер частиц 3.5 мкм. Использовали градиент концентраций ацетонитрила 10–95% в 0.05%-ном растворе муравьиной кислоты в деионизированной воде.
Температуры плавления (некорректируемые) определяли на приборе Кофлера (Wagner & Munz,GmbH, Германия).
Удельное вращение соединений измеряли на спектрополяриметре J-20 (Jasco, Япония).
Boc-Pro-Arg-OH (I). В 8 мл свежеперегнанного 1,4-диоксана растворяли 1.03 г (4.8 ммоль) N‑трет-бутилоксикарбонилпролина и 0.61 г (5.3 ммоль) N-оксисукцинимида (SuOH) и при постоянном перемешивании охлаждали на ледяной бане до 7°С, затем в охлажденный раствор вносили 1.09 г (5.3 ммоль) DCC, перемешивали образовавшуюся суспензию в течение 1 ч при охлаждении и 3 ч при комнатной температуре. Выпавшую в осадок N,N'-дициклогексилмочевину отфильтровывали и промывали на фильтре 1.0–1.5 мл 1,4-диоксана. Фильтрат, представляющий собой раствор N-сукцинимидного эфира пролина в 1,4-диоксане, прибавляли к раствору 0.59 г (3.4 ммоль) аргинина в 4 мл воды. Реакционную смесь перемешивали при 20°С в течение 4 ч, по окончании реакции охлаждали до 5°С, отфильтровывали осадок Boc-Pro-Arg-OH, промывали на фильтре водой, охлажденной до 3–5°С, затем этилацетатом. Сушили в вакуум-эксикаторе с P2O5 до постоянной массы. Получили 1.12 г (89%) пептида (І) с чистотой ~99% по данным ВЭЖХ; т. пл. 154–155°С; $\left[ \alpha \right]_{D}^{{20}}$–49° (с 1, метанол); Rf 0.72 (А), 0.25 (Б), 0.66 (В); ESI MS, m/z: 372.2 [M + H]+, 373.2 [M + 2H]+.
Boc-Pro-D-Arg-OH (II). Синтез Boc-Pro-D-Arg-OH проводили аналогично методике, описанной для соединения (I), за исключением стадии выделения: по окончании реакции из раствора упаривали на роторном испарителе 1,4-диоксан, к остатку приливали ацетон и после уплотнения осадка декантировали водно-ацетоновый слой, а осадок дважды переосаждали из метанола эфиром. Сушили в вакуум-эксикаторе с P2O5 до постоянной массы. Получили 1.02 г (80%) пептида (II) с чистотой ~99% по данным ВЭЖХ; т. пл. 130–132°С; Rf 0.72 (А), 0.25 (Б), 0.66 (В); MS ESI, m/z: 372.2 [М + Н]+, 373.2 [M + 2H]+.
HCl·Boc-Pro-Arg-Gly-NH2 (III). Смесь 1.11 г (3.0 ммоль) Boc-Pro-Arg-OH и 0.33 г (3.0 ммоль) HCl·Gly-NH2 в 7 мл DMF (реагенты предварительно растирали в ступке до мелкого порошка) перемешивали 1 ч при 20°С, охлаждали до 0–5°С и добавляли 0.45 г (3.3 ммоль) 1-оксибензатриазола (HOBt), затем 0.42 г (3.3 ммоль) N,N'-диизопропилкарбодиимид (DIPC). Реакционную смесь перемешивали 1 ч при (0–5°С) и 16 ч при 20°С. Осадок N,N'-диизопропилмочевины отделяли фильтрованием, промывали DMF. К диметилформамидному раствору добавляли 25 мл диэтилового эфира, после уплотнения осадка декантировали слой растворителей, осадок дважды переосаждали из метанола эфиром. Сушили в вакуум-эксикаторе с P2O5 и NaOH до постоянной массы. Получили 1.28 г (92%) пептида (III) с чистотой ~95% по данным ВЭЖХ; т. пл. 85–87°С; $\left[ \alpha \right]_{D}^{{20}}$–51° (с 1, метанол); Rf 0.39 (Б), 0.56 (В), 0.56 (Г); ESI MS, m/z: 428.3 [М + Н]+, 450.3 [M + Na]+, 855.5 [2M – H]+.
HCl·Boc-Pro-D-Arg-Gly-NH2 (IV). Пептид получали по методике синтеза соединения (III). В результате взаимодействия 0.35 г (0.94 ммоль) Boc-Pro-D-Arg-OH (II) и 0.10 г (0.94 ммоль) HCl⋅H-Gly-NH2 получили 0.37 г (90%) пептида (IV) с чистотой ~98% по данным ВЭЖХ; т. пл. 85–87°С; Rf 0.27 (А), 0.46 (Б), 0.76 (В); ESI MS, m/z: 428.3 [М + Н]+.
Boc-Ser(Bzl)-Pro-Arg-Gly-NH2 (V). К охлажденному до 5°С на ледяной бане раствору 0.30 г (0.65 ммоль) Boc-Ser(Bzl)-OPfp (полученному методом Кишфалуди [22]) в 7 мл DMF добавляли 0.24 г (0.49 ммоль) 2HCl·CH3COOC2H5·H-Pro-Arg-Gly-NH2 (получали обработкой соединения (III) HCl в этилацетате) и 0.07 мл (0.50 ммоль) TEA (pH ~ 9). Перемешивали на ледяной бане в течение 1.5 ч, после чего выпавшие в осадок соли отфильтровывали, промывали на фильтре небольшим количеством DMF. К диметилформамидному раствору добавляли 20 мл диэтилового эфира, после уплотнения осадка декантировали слой растворителей, осадок дважды переосаждали из метанола диэтиловым эфиром и этилацетатом. Сушили в вакуум-эксикаторе с P2O5 и NaOH до постоянной массы. Получили 0.26 г (86%) с чистотой 85% по данным ВЭЖХ; т. пл. 115–117°С; Rf 0.15 (Б); ESI MS, m/z: 605.4 [М + Н]+, 606.4 [M + 2H]+, 607.4 [M + 3H]+.
N-Ac-Ser-Pro-Arg-Gly-NH2 (VI). К раствору 0.17 г (0.29 ммоль) 2HCl·H-Ser(Bzl)-Pro-Arg-Gly-NH2 (получали обработкой соединения (IV) HCl в этилацетате) в 1.1 мл DMF добавляли 0.04 мл (0.29 ммоль) TEA (pH ~ 8). Реакционную смесь охлаждали на ледяной бане и вносили 0.06 г (0.38 ммоль) сукцинимидного эфира уксусной кислоты (AcOSu). Перемешивали 3 ч, после чего осадок отфильтровывали, промывали на фильтре небольшим количеством DMF. К диметилформамидному раствору добавляли 10 мл диэтилового эфира, после уплотнения осадка декантировали слой растворителей, осадок дважды переосаждали из метанола диэтиловым эфиром и этилацетатом, защиту c ОН-группы остатка серина в N-Ac-Ser(Bzl)-Pro-Arg-Gly-NH2 удаляли гидрированием в 1.1 мл раствора уксусной кислоты/метанола (2 : 1) в присутствии палладиевой черни при постоянном перемешивании в течение 1.5 ч, контролируя отщепление защитной группы методом ТСХ. Осадок катализатора отфильтровывали, тетрапептид переводили в осадок добавлением 15 мл диэтилового эфира. N-Ac-Ser-Pro-Arg-Gly-NH2 дважды переосаждали из метанола диэтиловым эфиром и этилацетатом. Очистку соединения проводили методом колоночной хроматографии на силикагеле-60, в качестве элюента использовали смесь хлороформ–метанол–вода в соотношении 10 : 10 : 1. Фракции, содержащий чистый пептид, объединяли и упаривали. После высушивания в эксикаторе получили 0.08 г (60%) соединения (VI) с чистотой 90% по данным ВЭЖХ; т. пл. 120–122°С; Rf 0.19 (Б); ESI MS, m/z: 457.2 [М + Н]+.
Boc-D-Ser-Pro-Arg-Gly-NH2 (VII). Тетрапептид получали аналогично методике синтеза соединения (V). В результате взаимодействия 0.14 г (0.29 ммоль) пептида 2HCl·CH3COOC2H5·H-Pro-Arg-Gly-NH2 (синтезировали обработкой соединения (IV) HCl в этилацетате) с 0.13 г (0.35 ммоль) Boc-D-Ser-OPfp получили 0.11 г (73%) Boc-D-Ser-Pro-Arg-Gly-NH2 с чистотой 87% по данным ВЭЖХ; т. пл. 113–115°С; $\left[ \alpha \right]_{D}^{{20}}$–18° (с 0.5, метанол); Rf 0.38 (А), 0.36 (Б), 0.68 (Г); ESI MS, m/z: 515.3 [М + Н]+, 516.3 [M + 2H]+, 537.3 [M + Na]+.
N-Ac-D-Ser-Pro-Arg-Gly-NH2 (VIII). Ацетилирование и очистку тетрапептида (VII) проводили аналогично методике синтеза соединения (VI). Из 0.10 г (0.22 ммоль) Н-D-Ser-Pro-Arg-Gly-NH2 и 0.04 г (0.26 ммоль) AcOSu получили 0.08 г (80%) тетрапептида (VIII) с чистотой 98% по данным ВЭЖХ; т. пл. 124–125°C; Rf 0.19 (Б), 0.83 (В); ESI MS, m/z: 457.2 [М + Н]+, 458.2 [M + 2H]+.
Boc-D-Ser-Pro-D-Arg-Gly-NH2 (IX). Синтез осуществляли аналогично способу получения соединения (V). В результате взаимодействия 0.32 г (0.29 ммоль) 2HCl·CH3COOC2H5·H-Pro-D-Arg-Gly-NH2 (получали обработкой соединения (IV) HCl в этилацетате) с 0.13 г (0.35 ммоль) Boc-D-Ser-OPfp получили 0.37 г (90%) с чистотой 90% по данным ВЭЖХ; т. пл. 114–116°С; Rf 0.38 (А), 0.36 (Б), 0.68 (Г); ESI MS, m/z: 515.3 [М + Н]+.
N-Ac-D-Ser-Pro-D-Arg-Gly-NH2 (X). Ацетилирование и очистку тетрапептида (IX) проводили аналогично методике получения соединения (VI). В результате взаимодействия 0.10 г (0.22 ммоль) Н‑D-Ser-Pro-D-Arg-Gly-NH2 (получали обработкой соединения (IX) HCl в этилацетате) с 0.04 г (0.26 ммоль) AcOSu получили 0.09 г тетрапептида (X) (90%) с чистотой 90% по данным ВЭЖХ; т. пл. 138–140°С; Rf 0.03 (А), 0.09 (Б), 0.83 (В); ESI MS, m/z: 457.3 [М + Н]+, 458.3 [M + 2H]+, 479.2 [M + Na]+.
Boc-Phe-Pro-Arg-Gly-NH2 (XI). Синтез тетрапептида осуществляли по методике, описанной для соединения (V). В результате взаимодействия 0.20 г (0.41 ммоль) 2HCl·CH3COOC2H5·H-Pro-Arg-Gly-NH2 с 0.26 г (0.53 ммоль) Boc-Phe-OPfp (синтезировали методом Кишфалуди [22]) получили тетрапептид (XI) массой 0.21 г (73%) с чистотой по ВЭЖХ 95%; т. пл. 119–121°С; Rf 0.28 (А), 0.66 (Б), 0.65 (Д); ESI MS, m/z: 575.3 [М + Н]+, 576.3 [M + 2H]+, 577.3 [M + 3H]+, 597.3 [M + Na]+.
N-Ac-Phe-Pro-Arg-Gly-NH2 (XII). Ацетилирование и очистку тетрапептида (XII) проводили аналогично методике, описанной для соединения (VI). В результате взаимодействия 0.08 г (0.15 ммоль) Н-Phe-Pro-Arg-Gly-NH2 (получали обработкой соединения (XI) HCl в этилацетате) с 0.03 г (0.21 ммоль) AcOSu получили 0.06 г (77%) с чистотой по ВЭЖХ 90%; т. пл. 115–117°С; Rf 0.16 (А), 0.43 (Д); ESI MS, m/z: 517.3 [М + Н]+, 518.3 [M + 2H]+.
N-Ac-Trp-Pro-Arg-Gly-NH2 (XIII). К раствору 0.98 г (2.0 ммоль) 2HCl·CH3COOC2H5·H-Pro-Arg-Gly-NH2 (получен обработкой соединения (III) HCl в этилацетате) в 7.0 мл DMF добавляли 0.03 мл (2.0 ммоль) TEA (pH ~ 8). Реакционную смесь перемешивали в течение 20 мин, а затем добавляли 0.53 г (2.0 ммоль) N-Ac-Trp-OH. После охлаждения до 0°С в раствор добавляли 0.28 (2.1 ммоль) HOBt и 0.32 мл (2.1 ммоль) DIPC. Реакционную смесь перемешивали 1 ч при (0–5°С) и 18 ч при 20°С. Осадок N,N'-диизопропилмочевины отделяли фильтрованием, промывали DMF. Обработку синтеза проводили аналогично методике, описанной для соединения (VI). Сушили в вакуум-эксикаторе с P2O5 и NaOH до постоянной массы. Получили 1.0 г (90%) пептида (XIII) с чистотой 95% по данным ВЭЖХ; т. пл. 125–127°С; Rf 0.49 (Б), 0.44 (Д); ESI MS, m/z: 556.3 [М + Н]+, 557.4 [М + 2Н]+, 578.4 [M + Na]+.
Влияние синтезированных пептидов на показатели поведения крыс линии Wistar в тесте принудительного плавания. Фармакологическую активность полученных соединений изучали в опытах на половозрелых крысах-самцах линии Wistar с массой тела 250–350 г (питомник вивария Института биоорганической химии НАН Беларуси), содержавшихся в стандартных условиях вивария со свободным доступом к пище и воде в соответствии с требованиями Санитарных правил и норм 2.1.2.12-18-2006 [29]. Всего было задействовано 194 крысы. Эксперименты проводили в период с сентября по январь (с 12:30 до 17:30).
Для создания депрессивноподобного состояния (поведение отчаяния) у грызунов использовали парадигму принудительного плавания. Установка и условия эксперимента соответствовали модифицированному методу Possolt [24, 30]; разграничивали поведение, направленное на выход из стрессовой ситуации в FST, на две категории: 1) плавание (swimming) по всей камере для проведения теста с движениями лапок животного в горизонтальной плоскости, 2) вскарабкивание (climbing) с движением передних конечностей в вертикальной плоскости. Прозрачный пластиковый цилиндр диаметром 30 см и высотой 66 см на высоту 38 см наполняли водой, температуру которой поддерживали на уровне 25°С. Температуру регистрировали каждые 16 мин с помощью автоматического термометра (Jiedong Hualing Plastic Co., LTD, Китай), при необходимости извлечения животного, добавляли горячую воду до достижения необходимой температуры. При проведении эксперимента продолжительностью 16 мин животное помещали в цилиндр с водой таким образом, чтобы оно не могло ни выбраться из сосуда, ни найти в нем опору, т.е. касаться дна лапками или хвостом. В ходе эксперимента визуально регистрировали следующие показатели: 1) суммарную длительность иммобилизации; 2) суммарную длительность активного плавания в варианте swimming; 3) суммарную длительность активного плавания в варианте climbing; 4) суммарную длительность пассивного плавания; 5) латентный период первой иммобилизации (ЛП1иммоб); 6) латентный период первого акта активного плавания в варианте swimming (ЛП1акт). Критерием антидепрессивной активности исследуемых соединений в FST считали статистически достоверное уменьшение длительности иммобилизации в сравнении с контролем. За сутки до тестирования каждое животное помещали в сосуд с водой на тот же промежуток времени для адаптации (“пре-тест”, по аналогии с работами [24, 30]), затем регистрировали вышеперечисленные показатели. При повторных тестированиях в FST у крыс наблюдается выученная иммобилизация, которая объясняется тем, что стрессовая ситуация становится более знакомой животному [31].
Экспериментальных крыс разделили на контрольные и опытные группы. Особям контрольных групп 1–4 (по 5–15 крыс в группе) назначали однократно интраназально дистиллированную воду (за 10–30 мин до эксперимента) в объеме 1 мкл на 10 г массы тела; контрольные группы 1–4 служили для сопоставления с основными группами при введении пептидов (VI); (VIII) и (XII); (X) и (XIII); флуоксетина соответственно (за 10–30 мин до эксперимента). Исследуемые соединения в виде водных растворов применяли у животных основных групп однократно интраназально в дозах 0.1, 1.0 и 10.0 мкг/кг с использованием эквивалентного объема растворителя. Число особей в каждой из основных групп составляло 10, кроме группы животных, которым вводили соединение (XIII) (доза 10.0 мкг/кг) – 19 крыс. В качестве препарата сравнения использовали флуоксетин (Флуксен, Украина), который вводили внутрибрюшинно в дозе 20 мг/кг (n = 10).
Изменения значений изученных показателей на этапе “тест” относительно таковых в контроле определяли по формуле:
где А1 – активность соединения, %; Хоп и Хк – среднее значение измеряемого показателя у животных основной и контрольной группы соответственно, с.Изменения значений исследуемых параметров на этапе “тест” относительно таковых в “пре-тесте” определяли по формуле:
При определении статистической значимости различий в вариационных рядах использовали метод непараметрической статистики; для сравнения двух зависимых выборок применяли критерий Уилкоксона, для сравнения двух независимых выборок – критерий Манна–Уитни; при наличии трех и более групп использовали критерий Крускала–Уоллиса для независимых выборок. Для анализа качественных признаков применяли точный критерий Фишера. Критический уровень статистической значимости при проверке статистических гипотез принимали равным 0.05.
ЗАКЛЮЧЕНИЕ
В результате проведенного исследования, используя компьютерное моделирование, были предложены структуры тетрапептидных аналогов АВП6-9, потенциально обладающих поведенческой активностью. Разработаны методики синтеза смоделированных соединений (N-Ac-Ser-Pro-Arg-Gly-NH2, N-Ac-D-Ser-Pro-Arg-Gly-NH2, N‑Ac- D-Ser-Pro-D-Arg-Gly-NH2, N-Ac-Phe-Pro-Arg-Gly-NH2 и N-Ac-Trp-Pro-Arg-Gly-NH2) классическими методами пептидной химии в растворе и получены их опытные образцы. В результате изучения влияния однократного интраназального введения синтезированных тетрапептидов в дозах 0.1, 1.0, 10.0 мкг/кг на показатели поведения крыс-самцов линии Wistar в FST установлено, что действие N-Ac-D-Ser-Pro-D-Arg-Gly-NH2 (в дозе 1.0 мкг/кг) и N-Ac-Trp-Pro-Arg-Gly-NH2 (в дозах 0.1, 1.0, 10.0 мкг/кг) наиболее сходны с референтным препаратом флуоксетин. Полученные данные позволяют предположить наличие антидепрессивной активности у данных пептидов. При подтверждении эффектов N-Ac-D-Ser-Pro-D‑Arg- Gly-NH2 и N-Ac-D-Ser-Pro-D-Arg-Gly-NH2 в других моделях данные вещества могут быть перспективными в качестве фармакологических субстанций для создания новых антидепрессантов и ноотропов с интаназальным способом введения.
Список литературы
Белакоскова С.Г., Цикунов С.Г. // Обзоры по клинич. фармакол. и лек. терапии. 2018. Т. 16. С. 5–12. https://doi.org/10.17816/RCF1635-12
Stark H., Burbach J.P.H., Van Der Kleij A.A.M., De Wied D. // Peptides. 1989. V. 10. P. 717–720. https://doi.org/10.1016/0196-9781(89)90102-2
Burbach J.P.H., Schoots O., Hernando F. // Progress in Brain Res. 1999. V. 119. P. 127–139. https://doi.org/10.1016/S0079-6123(08)61566-6
Hirate K., Hirano M., Nakajima Y., Hiayma A., Maeda O., Asakura W. // Behav. Brain Res. 1997. V. 83. P. 205–208. https://doi.org/10.1016/S0166-4328(97)86070-6
Sermasi E., Howl J., Wheatley M., Coote J.H. // Exp. Brain Res. 1998. V. 119. P. 85–91. https://doi.org/10.1007/s002210050322
Tanabe S., Shishido Y., Nakayama Y., Furushido M., Hashimoto S., Terasaki T., Tsujimoto G., Yokokura E. // Pharmacol. Biochem. Behav. 1999. V. 63. P. 549–553. https://doi.org/10.1016/s0091-3057(99)00034-9
Ostrowski N.L., Lolait S.T., Young W.S. // Endocrynology. 1994. V. 135. P. 1511–1528. https://doi.org/10.1210/endo.135.4.7925112
Jurzak M., Fahrenholz F., Gerstberger R. // J. Neuroendocrinol. 1993. V. 5. P. 523–531. https://doi.org/10.1111/j.1365-2826.1993.tb00517.x
Gouzenes L., Dayanithi G., Moos F.C. // J. Neuroendocrinol. 1999. V. 10. P. 1735–1739. https://doi.org/10.1523/JNEUROSCI.18-05-01879.1998
Maegawa H., Katsube N., Okegawa T., Aishita H., Kawasaki A. // Life Sci. 1992. V. 51. P. 285–293. https://doi.org/10.1016/0024-3205(92)90087-6
Nakayama Y., Takano Y., Shimohigashi Y., Tanabe S., Fujita T., Kamiya H., Tsujimoto G. // Brain Res. 2000. V. 858. P. 416–423. https://doi.org/10.1016/S0006-8993(00)01955-7
Tanabe S., Shishido Y., Furushido M., Kado K., Hashimoto S., Yokokura E., Terasaki T. // Patent EP0919567A1, 02.06.1999.
Гуревич К.Г. // Качественная клиническая практика. 2008. №. 1. С. 2–5.
Мартинович В.П., Слободчикова Л.К., Голубович В.П., Ахрем А.А., Титов С.А., Воскресенская О.Г. // Хим.-фарм. журнал. 1989. Т. 23. С. 713–716. https://doi.org/10.1007/BF00764432
Hurby V.J., Chow M.S., Smith D.D. // Annu. Rev. Pharmacol. Toxicol. 1990. V. 30. P. 501–534. https://doi.org/10.1146/annurev.pa.30.040190.002441
Воскресенская О.Г., Ким А.П., Голубович В.П., Каменский А.А. // Нейрохимия. 2008. Т. 25. С. 64–69.
Белякова А.С., Воскресенская О.Г., Каменский А.А., Голубович В.П. // Вестн. Моск. ун-та. Биология. 2012. Т. 16. С. 3–7. [Belyakova A.S., Voskresenskaya O.G., Kamensky A.A., Golubovich V.P. // Moscow Univ. Biol. Sci. Bull. 2012. V. 67. P. 1–5.] https://doi.org/10.3103/S0096392512010026
Slusarz M.J., Sikorska E., Slusarz R., Ciarkowski J. // J. Med. Chem. 2006. V. 49. P. 2463–2469. https://doi.org/10.1021/jm051075m
Slusarz R., Slusarz M.J. // QSAR & Combinatorial Science. 2009. V. 28. P. 1166–1175. https://doi.org/10.1002/qsar.200810164
Mouillac B., Chini B., Balestre M.N., Elands J., Trumpp-Kallmeyer S., Hoflack J., Hibert M., Jard S., Barberis K. // J. Biol. Chem. 1995. V. 270. P. 25771–25777. https://doi.org/10.1074/jbc.270.43.25771
Бородина К.В., Стаханова А.А., Мартинович В.П., Воскресенская О.Г., Голубович В.П., Каменский А.А. // Известия НАН Беларуси. Сер. хим. наук. 2021. Т. 57. С. 61–69. https://doi.org/10.29235/1561-8331-2021-57-1-61-69
Kisfaludi L., Schon I., Szirtes T., Nyeki O., Low M. // Tetrahedron Lett. 1974. V. 15. P. 1785–1786.
Benoiton N.L. // Chemistry of Peptide Synthesis. USA: CRC Press Taylor & Francis Group, 2006. 290 p.
Slattary D.A., Cryan J.F. // Nature Prot. 2012. V. 7. P. 1009–1014. https://doi.org/10.1038/nprot.2012.044
Гарибова Т.Л., Крайнева В.А., Воронина Т.А. // Фармакокинетика и фармакодинамика. 2017. № 3. С. 14–19.
Contreras C.M., Rodriguez-Landa J.F., Gutiérrez-García A.G., Bernal-Morales B. // J. Psychopharmacol. 2001. V. 15. P. 231–236. https://doi.org/10.1177/026988110101500401
Aksoy A., Schulz D., Yilmaz A., Canbeyli R. // Int. J. Neurosci. 2004. V. 114. P. 1513–1520. https://doi.org/10.1080/00207450490509131
Borsini F., Lecci A., Stasi M.A., Pessia M., Meli A. // Behav. Pharmacol. 1990. V. 1. P. 395–401.
СТБ 2.1.2.12-18-2006. Устройство, оборудование и содержание экспериментально-биологических клиник (вивариев). Минск: Министерство здравоохранения, 2006. 22 с.
Mezadri T.J., Batista G.M., Portes A.C., Marino-Neto J., Lino-de-Oliveira C. // J. Neurosci. Methods. 2011. V. 195. P. 200–205. https://doi.org/10.1016/j.jneumeth.2010.12.015
Parra A., Vinader-Caerols C., Monleón S., Simón V.M. // Psicothema. 1999. V. 11. P. 239–246.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия