Биоорганическая химия, 2022, T. 48, № 3, стр. 352-356
Синтез тетрагемисукцинатов брассиностероидов и их влияние на начальный рост растений ярового ячменя
Р. П. Литвиновская 1, *, Н. Е. Манжелесова 1, О. П. Савочка 1, В. А. Хрипач 1
1 Институт биоорганической химии НАН Беларуси
220141 Минск, ул. Акад. В.Ф. Купревича, 5/2, Беларусь
* E-mail: litvin@iboch.by
Поступила в редакцию 17.03.2021
После доработки 05.04.2021
Принята к публикации 15.04.2021
- EDN: RWIWNF
- DOI: 10.31857/S0132342322030125
Аннотация
Реакцией брассиностероидов с ангидридом янтарной кислоты в присутствии диметиламинопиридина впервые получены производные 24-эпибрассинолида и 24-эпикастастерона с янтарной кислотой в виде тетрагемисукцинатов. В лабораторных опытах установлено, что полученные соединения оказывают заметное влияние на посевные качества семян и рост проростков ярового ячменя. Действие тетрагемисукцинатов в ряде тестов превосходило росторегулирующие эффекты соответствующих брассиностероидов, янтарной кислоты и смеси этих фитогормонов.
ВВЕДЕНИЕ
Стероидные гормоны растений – брассиностероиды – известны как регуляторы роста и адаптогены. Накоплено значительное число экспериментальных данных по синтезу и росторегулирующей активности этих соединений, противострессовому действию, а также практическому применению [1, 2]. Выявлено одно из важнейших свойств фитогормональных стероидов – взаимодействие с другими фитогормонами. При стимуляции ростовых процессов показано синергическое взаимодействие брассиностероидов и гиббереллинов, ауксинов и фенольных соединений [3, 4]. Эти сведения побуждают интерес исследователей к синтезу сложных эфиров фитогормональных стероидов с такого рода соединениями. Так, ранее мы осуществили синтез ряда производных брассиностероидов с биологически значимыми кислотами. Конъюгаты с индолилуксусной кислотой [5], например, оказывали стимулирующее действие на рост стеблей проростков пшеницы, при этом ростостимулирующий эффект каждого из гормонов, взятых в отдельности или в виде смеси, уступал по величине действию сложноэфирного конъюгата, в котором оба фитогормональных компонента связаны ковалентными связями. Аналогичные свойства проявляли производные брассиностероидов с 5-аминолевулиновой кислотой [6]. Синтез и изучение салицилатов брассиностероидов позволили сделать заключение, что они улучшают посевные качества семян ярового ячменя и действуют как индукторы иммунной системы растений проса и ячменя в условиях абиотического и биотического стресса [7, 8]. При этом механическая смесь компонентов не обладала таким эффектом.
В продолжение наших исследований сложноэфирных конъюгатов брассиностероидов мы обратились к изучению гемисукцинатов стероидных фитогормонов. Янтарная кислота занимает особое место среди биостимуляторов – она оказывает активирующее действие на многие обменные процессы растений, повышает всхожесть семян и продуктивность некоторых растений, может изменять энергетический уровень некоторых ферментов, стимулируя накопление аскорбиновой кислоты и восстановленных форм аминокислот [9]. Янтарная кислота широко используется для стимуляции всхожести и роста, улучшения приживаемости, ускорения развития растений и повышения урожайности сельскохозяйственных культур [10]. Она нормализует естественную микрофлору почвы и оказывает общеукрепляющее действие – помогает лучше усваивать питательные вещества и удобрения. Имеются данные, что в связанной форме янтарная кислота проявляет более высокий ростостимулирующий эффект [11].
Цель настоящей работы – синтез конъюгатов брассиностероидов ряда 24-эпибрассинолида с янтарной кислотой и оценка их влияния на начальный рост растений ярового ячменя.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
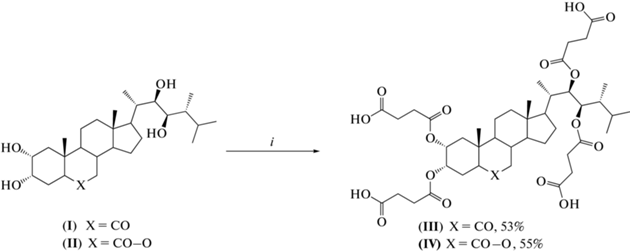
Синтез гемисукцинатов осуществляли взаимодействием 24-эпибрасинолида (ЭБ) (I) и 24‑эпикастастерона (ЭК) (II) с ангидридом янтарной кислоты (ЯК) в пиридине в присутствии диметиламинопиридина. Использование эквивалентных количеств ангидрида или его небольшого избытка приводит к получению смеси эфиров с участием гидроксильных групп по различным положениям молекулы, при этом преобладают тризамещенные производные, что четко видно из хромато-масс-спектров (см. дополнительные материалы). При проведении реакции с большим избытком янтарного ангидрида (10 экв. на каждую гидроксильную группу исходного брассиностероида (I) или (II)) при 90°С в течение 96 ч в качестве основных продуктов выделены соответствующие тетрагемисукцинаты (III) и (IV) (схема 1 ).
Схема 1 . Синтез тетрагемисукцинатов брассиностероидов ряда 24-эпибрассинолида. i – янтарный ангидрид, 4-диметиламинопиридин, 90°С, 90–96 ч.
Доказательство структуры полученных соединений – значительное смещение в слабое поле в спектре 1Н-ЯМР сигналов протонов при атоме С2, С3, С22 и С23 – 4.83, 4.99 и 5.10–5.15 м.д. для тетрагемисукцината 24-эпикастастерона (III) и 4.93, 5.20, 5.35 и 5.44 м.д. для тетрагемисукцината 24-эпибрассинолида (IV) по сравнению с исходными брассиностероидами [1] и появление 16‑протонного мультиплета (2.41–2.55 и 2.64–2.71 м.д. соответственно), принадлежащего метиленовым протонам остатков янтарной кислоты. В спектре 13С-ЯМР дополнительно присутствуют восемь сигналов углеродных атомов групп С=О. Достоверность приведенных структур также доказывает присутствие в масс-спектрах высокого разрешения полученных тетрагемисукцинатов пика молекулярного иона и появление дополнительного сильного сигнала валентных колебаний карбонильной группы в ИК-спектрах.
Исследование активности полученных соединений проводили в лабораторных опытах, применяя характерные для биорегуляторов фитотесты по влиянию на посевные качества семян и рост проростков [12]. Использование семян с пониженной всхожестью позволило выявить определенные особенности регуляторного действия синтезированных соединений. Отмечено, что применение фитогормональных стероидов ряда 24-эпибрассинолида и их модифицированных производных (III) и (IV) приводило к значительному повышению энергии прорастания семян и в меньшей степени – всхожести. Наибольшую активность показали ЭБ и его тетрагемисукцинат (IV). Они значительно стимулировали прорастание семян – на 30 и 40% соответственно (рис. 1а). ЭК и его тетрагемисукцинат (III) оказались менее активными (стимуляция прорастания семян – на 14 и 10% соответственно). При этом тетрагемисукцинат (IV) был более активен, чем исходный ЭБ, тогда как тетрагемисукцинат (III) – чуть менее активен, чем ЭК. Механическая смесь ЭБ и янтарной кислоты показала меньшую активность по сравнению с конъюгированной формой, а смесь ЭК с янтарной кислотой, наоборот, была более активна, чем соответствующий тетрагемисукцинат.
Рис. 1.
Влияние фитогормональных стероидов и их тетрагемисукцинатов на прорастание семян (а) и рост проростков (б) ярового ячменя. 1 – Контроль; 2 – ЭБ (II), 10–8 М; 3 – ЯК, 10–8 М; 4 – ЭБ + ЯК, 10–8 М (1 : 1); 5 – ЭБ + ЯК, 10–8 М (1 : 4), 6 – тетрагемисукцинат (IV), 10–8 М; 7 – ЭК (I), 10–8 М; 8 – ЭК + ЯК, 10–8 М (1 : 1); 9 – ЭК + ЯК, 10–8 М (1 : 4), 10 – тетрагемисукцинат (III), 10–8 М. * Различия достоверны по сравнению с контролем (p ≤ 0.05).

Все изученные соединения и композиции, кроме тетрагемисукцината (IV), в той или иной степени ингибировали рост корешков, тогда как на растяжение колеоптилей они либо не оказывали влияния, либо его стимулировали (рис. 1б).
Наибольший ингибирующий эффект (~30%) отмечался на корешках под влиянием природных брассиностероидов. Стимулирующий эффект отмечен только под действием тетрагемисукцината (IV) (10%). Максимальное стимулирующее действие на рост колеоптилей оказывали тетрагемисукцинаты. Соединения, взятые по отдельности, на этот показатель не влияли, смеси занимали промежуточное положение, стимулируя рост проростков, но в меньшей степени, чем тетрагемисукцинаты. Следует отметить, что янтарная кислота в виде тетрагемисукцинатов с брассиностероидами полностью снимала ингибирующее действие последних на рост первичных корешков, тогда как в составе смесей данный эффект проявлялся частично. При этом в вариантах с применением смесей 24-эпибрассинолида с янтарной кислотой на результат не оказывало влияния используемое количество последней (1 и 4 экв.), тогда как смесь 24-эпикастастерона с 1 экв. янтарной кислоты была более активной, чем его смесь с 4 экв. кислоты.
Проведенные лабораторные опыты свидетельствуют о том, что тетрагемисукцинаты брассиностероидов с янтарной кислотой обладают росторегулирующим действием. Более детальное изучение этих соединений может показать, связано ли это со структурой брассиностероида (возможно, конъюгат выступает в роли “депо”, постепенно высвобождая действующее вещество) или имеет место синергический эффект.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование и материалы. ИК-спектры (υ, см–1) получены на спектрометре Spectrum 100 (Perkin Elmer, Великобритания) в пленке. Спектры 1Н‑ЯМР (δ, м.д., КССВ, Гц) и 13С-ЯМР (δ, м.д.) получены в дейтерированных растворителях с использованием остаточного пика растворителя в качестве внутреннего стандарта (δH 3.31 м.д. и δС 49.2 м.д. для СD3OD; δH 7.58 м.д. и δС 135.9 м.д. для С5D5N) на спектрометре Avance 500 (Bruker, Германия; 500 МГц для 1Н и 125 МГц для 13С). Масс-спектры получены на масс-спектрометре 6410 Triple Quad LC/MS 1200 HPLC (Agilent Technologies, США) при регистрации положительных и отрицательных ионов в режиме электроспрей-ионизации (ESI, 70 эВ). Масс-спектры высокого разрешения получены на приборе 6550 iFunnel Q‑TOF LC/MS (Agilent Technologies, США) электроспрей-ионизацией в режиме положительных ионов. Протекание реакций контролировали методом ТСХ на пластинках Kieselgel 60 F254 с визуализацией путем обработки анисовым проявителем с последующим нагреванием. Хроматографическое разделение реакционных смесей осуществляли на силикагеле 40/60 (Kieselgel 60, Merck, Германия). В работе использовали реактивы фирмы Sigma-Aldrich (США) и брассиностероиды ЭК (I) и ЭБ (II), синтезированные в лаборатории химии стероидов Института биоорганической химии НАН Беларуси.
(22R,23R)-5α-Эргостан-6-она 2α,3α,22,23-тетрагемисукцинат (III). К раствору 57 мг (0.123 ммоль) ЭК (I) в 3 мл абсолютного пиридина добавляли 492 мг (4.92 ммоль) янтарного ангидрида и 2 мг (0.016 ммоль) диметиламинопиридина. Полученную смесь перемешивали при 90°С в течение 96 ч. Затем упаривали пиридин, остаток растворяли в хлороформе и хорошо промывали водой от избытка янтарной кислоты, сушили над Na2SO4, растворитель удаляли в вакууме. Остаток хроматографировали на силикагеле (элюент CHCl3 : MeOH, 3 : 1). Получили 56 мг (53%) тетрагемисукцината (III) в виде маслообразного вещества.
(22R,23R)-B-Гомо-7-окса-5α-эргостан-6-она 2α,3α,22,23-тетрагемисукцинат (IV). По методике, описанной для соединения (III), из 48 мг (0.10 ммоль) ЭБ (II), 400 мг (4.00 ммоль) янтарного ангидрида и 2 мг (0.016 ммоль) 4-диметиламинопиридина получили 48 мг (55%) тетрагемисукцината (IV) в виде маслообразного вещества.
Данные спектров соединений (III) и (IV) приведены в дополнительных материалах.
Действие брассиностероидов и их конъюгатов с янтарной кислотой на ранний рост растений ярового ячменя. Тестирование брассиностероидов ряда 24-эпибрассинолида и их тетрагемисукцинатов с янтарной кислотой изучали в лабораторных условиях на семенах ярового ячменя сорта Магутны. Семена проращивали на растворах веществ в чашках Петри в термостате при 20°С, затем выставляли на свет в люминостатную установку Philips 59451 (Германия) с освещенностью 6 тыс. люкс и световым режимом 16/8 ч. Через 3 сут согласно ГОСТ 12038-84 [13] проводили учет энергии прорастания, через 7 сут – учет всхожести, через 10 сут измеряли высоту колеоптилей и длину корешков контрольных и опытных вариантов. В контрольном варианте семена проращивали на дистиллированной воде. Оптимальная концентрация исследуемых веществ была взята как наиболее активная, исходя из результатов предыдущих исследований [5–8].
Эксперименты повторяли независимо трижды при 4-кратной повторности, число растений в повторности – не менее 20. На рис. 1 представлены средние арифметические и их среднеквадратические ошибки (M ± m). Достоверность различий рассчитывали по t-критерию Стьюдента. Достоверными считали отличия при р ≤ 0.05.
ЗАКЛЮЧЕНИЕ
Впервые получены производные 24-эпибрассинолида и 24-эпикастастерона с янтарной кислотой. Синтез тетрагемисукцинатов осуществляли взаимодействием соответствующих брассиностероидов с ангидридом янтарной кислоты в присутствии диметиламинопиридина. В тестах на проростках ярового ячменя установлено, что полученные соединения оказывают заметное влияние на посевные качества семян и рост проростков. Действие тетрагемисукцинатов в ряде тестов превосходило росторегулирующие эффекты соответствующих брассиностероидов, янтарной кислоты и смеси этих фитогормонов.
Полученные результаты могут стать основой для создания препаратов росторегулирующего и адаптогенного действия.
Список литературы
Khripach V.A., Zhabinskii V.N., de Groot A.E. // Brassinosteroids: A New Class of Plant Hormones. San Diego: Academic Press, 1999. 456 p. https://doi.org/10.1046/j.1365-3059.2000.0423d.x
Nolan T.M., Vukašinović N., Liu D., Russinova E., Yin Y. // Plant Cell. 2020. V. 32. P. 295–318. https://doi.org/10.1105/tpc.19.00335
Bajqus A., Hayat S. // Plant Physiol. Biochem. 2009. V. 47. P. 1–8. https://doi.org/10.1016/j.plaphy.2008.10.002
Манжелесова Н.Е., Волынец А.П. // Физиология патогенеза и болезнеустойчивости растений / Под ред. Решетникова В.Н. Минск: Беларуская навука, 2016. С. 169–188.
Литвиновская Р.П., Минин П.С., Райман М.Э., Жилицкая Г.А., Куртикова А.Л., Кожарнович К.Г., Деревянчук М.В., Кравец В.С., Хрипач В.А. // Химия природ. соед. 2013. Т. 49. С. 408–414. [Litvinovskaya R.P., Minin P.S., Raiman M.E., Zhilitskaya G.A., Kurtikova A.L., Kozharnovich K.G., Derevyanchuk M. V., Kravets V.S., Khripach V.A. // Chem. Nat. Comp. 2013. V. 49. P. 478–485.] https://doi.org/10.1007/s10600-013-0643-8
Хрипач В.А., Литвиновская Р.П., Райман М.Э., Минин П.С., Кисель М.А., Тростянко И.В., Долгопалец В.И. // Патент BY 18530 С1, опубл. 30.08.2014.
Литвиновская Р.П., Вайнер А.А., Жилицкая Г.А., Колупаев Ю.Е., Савочка О.П., Хрипач В.А. // Химия природ. соед. 2016. Т. 52. С. 394–398. [Litvinovskaya R.P., Vayner A.A., Zhylitskaya H.A., Kolupaev Yu.E., Savachka A.P., Khripach V.A. // Chem. Nat. Comp. 2016. V. 52. P. 452–457.] https://doi.org/10.1007/s10600-016-1671-y
Манжелесова Н.Е., Литвиновская Р.П., Полянская С.Н., Корытько Л.А., Савочка О.П. // Доклады НАН Беларуси. 2019. Т. 63. С. 304–311. https://doi.org/10.29235/1561-8323-2019-63-3-304-311
Грабовская Н.И., Бабенко О.К., Сафронова Н.М., Хусаинова Р.К. // Современная наука: актуальные проблемы теории и практики. Сер. Естественные и технические науки. 2020. № 1. С. 28–32.
Верещагин А.Л., Акимова С.С., Нуйкина Н.В., Щурова И.А., Прищенко Ю.Е., Антонова О.И., Кузьменко И.А., Кузьменко С.И., Брегвадзе Н.Г. // Патент RU 2267924 C1, опубл. 20.01.2006.
Латашко В.М., Бадовская Л.А., Пономаренко Р.И., Сокирко В.П. // Материалы 6-й Международной конференции “Регуляторы роста и развития растений в биотехнологиях”. Москва, 2001. С. 255.
Knight B.E.A., Taylor H.F., Wain R.L. // Ann. Appl. Biol. 1969. V. 63. P. 211–223.
ГОСТ 12038-84 Семена сельскохозяйственных культур. Методы определения всхожести. Москва: ИПК Издательство стандартов, 2004.
Дополнительные материалы
- скачать ESM.docx
- Приложение 1
Инструменты
Биоорганическая химия