Биоорганическая химия, 2022, T. 48, № 4, стр. 500-504
Циркулярные пермутанты белка BrUSLEE как флуоресцентные индикаторы pН
А. В. Мамонтова 1, Т. Р. Симонян 1, К. А. Лукьянов 2, А. М. Богданов 2, *
1 Центр наук о жизни, Сколковский институт науки и технологий
121205 Москва, Большой бульвар, 30, стр. 1, Россия
2 ФГБУН “Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова” РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
* E-mail: noobissat@yandex.ru
Поступила в редакцию 08.11.2021
После доработки 15.11.2021
Принята к публикации 16.11.2021
- EDN: CAHMRI
- DOI: 10.31857/S0132342322040157
Аннотация
Получены два варианта циркулярных пермутантов BrUSLEE – зеленого флуоресцентного белка с коротким временем жизни флуоресценции. Охарактеризована зависимость кинетик затухания флуоресценции этих флуорофоров от рН. Показано, что оба пермутанта (cpBrUS и cpBrUS-145) демонстрируют трехкомпонентную кинетику затухания флуоресценции, причем время жизни одной из компонент изменяется в диапазоне ~3000–300 пс в ответ на сдвиг рН от 5.5 до 9.0, при этом исходный белок BrUSLEE не показывает существенного изменения кинетики затухания флуоресценции в области pH 6.0–8.5, интересной с физиологической точки зрения. Характер измеренной рН-зависимости позволяет рассматривать полученные пермутанты как индикаторы рН с детекцией сигнала во временном домене.
ВВЕДЕНИЕ
Один из факторов поддержания гомеостаза и контроля нормальных физиологических функций клеток – специфическая кислотность, характерная для разных субклеточныx компартментов [1, 2]. Мониторинг изменений внутриклеточного pH in situ может предоставить ценную информацию о клеточном метаболизме и обеспечить более глубокое понимание физиологических и патологических процессов [3, 4]. Большинство традиционных флуоресцентных индикаторов, выступая мощным инструментом для биоимиджинга в реальном времени, способно лишь к относительной оценке изменения исследуемого параметра в клетке [5–7].
Цель настоящей работы – создание генетически кодируемых индикаторов для количественного измерения рН на основе флуоресцентного белка BrUSLEE [8], который ранее продемонстрировал свой потенциал в качестве метки для FLIM (fluorescence lifetime imaging microscopy), обладающей коротким временем жизни флуоресценции.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
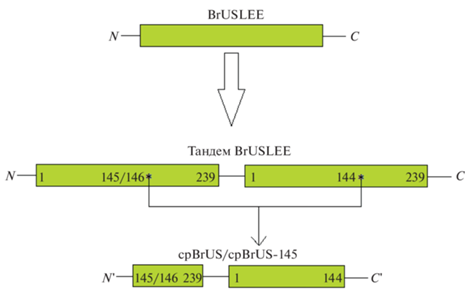
Для повышения чувствительности хромофора флуоресцентного белка к химическому окружению мы провели циркулярную пермутацию BrUSLEE (рис. 1). Принцип метода пермутации состоит в перестановке элементов первичной структуры белка с общим сохранением его трехмерной укладки и перемещением концов в область хромофорного окружения. Точкой пермутации был выбран сайт, включающий 144–149 а.о. (по номенклатуре avGFP – Aequorea victoria Green Fluorescent Protein [9]), по аналогии с существующими пермутантами на основе GFP (Green Fluorescent Protein), хорошо зарекомендовавшими себя в составе флуоресцентных индикаторов (в частности, GCaMP6s [10]). При этом предложены два альтернативных варианта первичной структуры пермутантов: с удалением (cpBrUS-145) и с сохранением (cpBrUS) остатка в положении 145 (остаток Met145 – важная детерминанта флуоресцентных свойств BrUSLEE [11]).
Рис. 1.
Схема создания пермутированных вариантов флуоресцентного белка BrUSLEE. Области, кодирующие флуоресцентный белок, показаны зелеными прямоугольниками. Звездочками отмечены точки пермутации. Цифрами обозначены соответствующие аминокислотные остатки по номенклатуре avGFP [9].
Далее мы исследовали рН-зависимость времени жизни флуоресценции исходного белка BrUSLEE и полученных циркулярных пермутантов cpBrUS-145 и cpBrUS in vitro на очищенных препаратах выделенных белков с помощью времяразрешенной спектроскопии при однофотонном возбуждении пикосекундным лазером с центральной длиной волны испускания ~450 нм (табл. 1, рис. 2).
Таблица 1.
Кинетические характеристики затухания флуоресценции белка BrUSLEE и пермутантов cpBrUS и cpBrUS-145 при возбуждении пикосекундным лазером 450 нм при различных значениях рН
| cpBrUS/cpBrUS-145/BrUSLEE | |||||||
|---|---|---|---|---|---|---|---|
| рН | τ1, пс | A1, % | τ2, пс | A2, % | τ3, пс | A3, % | χ2 |
| 3.0 | 80/40/105 | 31/15/37 | 1860/1810/1802 | 27/25/24 | 6470/5010/6410 | 42/60/39 | 1.16/1.207/1.16 |
| 3.5 | 90/38/84 | 31/15/34 | 1970/1511/1653 | 29/20/26 | 6780/4969/6280 | 40/65/40 | 1.186/1.252/1.14 |
| 4.0 | 90/45/40 | 29/16/39 | 1890/1694/2077 | 29/24/27 | 6580/5515/6855 | 42/60/34 | 1.142/1.133/1.164 |
| 4.5 | 80/36/66 | 28/17/38 | 1790/1417/1614 | 29/20/24 | 6460/5345/6241 | 43/63/38 | 1.25/1.198/1.118 |
| 5.0 | 80/57/304 | 27/16/39 | 1740/1656/1194 | 30/24/38 | 6530/5538/5650 | 43/60/23 | 1.17/1.269/1.149 |
| 5.5 | 100/55/374 | 28/18/39 | 2030/1653/1367 | 32/25/38 | 6760/5697/5997 | 39/57/23 | 1.2/1.15/1.239 |
| 6.0 | 90/45/764 | 25/22/79 | 1880/1201/3090 | 33/17/16 | 6590/5092/6544 | 42/61/5 | 1.218/1.235/1.546 |
| 6.5 | 100/71/801 | 26/26/74 | 1710/1226/2899 | 31/20/21 | 6310/5107/7559 | 43/54/5 | 1.18/1.154/0.964 |
| 7.0 | 130/76/802 | 26/28/83 | 1730/749/2565 | 35/18/17 | 6350/4752/нет | 39/54/нет | 1.154/1.137/0.98 |
| 7.5 | 170/110/809 | 27/43/83 | 1590/817/2598 | 36/21/17 | 6130/4582/нет | 37/36/нет | 1.266/1.078/1.046 |
| 8.0 | 360/117/808 | 35/47/83 | 1840/725/2620 | 40/21/17 | 5950/4312/нет | 25/32/нет | 1.188/1.055/1.122 |
| 8.5 | 330/111/770 | 37/52/79 | 1770/602/2340 | 38/27/21 | 5360/3520/нет | 25/21/нет | 1.139/0.917/1.031 |
| 9.0 | 610/111/785 | 50/54/81 | 2590/474/2388 | 38/31/19 | 6960/2192/нет | 12/15/нет | 1.262/0.819/1.017 |
| 9.5 | 870/111/784 | 67/48/82 | 3280/516/2497 | 30/35/18 | 8380/2110/нет | 3/17/нет | 1.214/0.769/1.003 |
| 10.0 | 600/95/780 | 47/40/79 | 2270/474/2370 | 45/35/21 | 5170/1787/нет | 8/25/нет | 0.966/0.797/0.989 |
| 10.5 | 610/129/765 | 45/37/74 | 1990/586/2346 | 42/25/16 | 4430/1685/нет | 13/38/нет | 0.963/0.876/0.972 |
| 11.0 | 640/113/779 | 46/26/69 | 2020/590/2426 | 43/25/31 | 3990/1655/нет | 11/49/нет | 0.941/0.893/1.003 |
Рис. 2.
(а) – Зависимость среднего времени жизни флуоресценции (Тm) от pH для белка BrUSLEE и пермутантов cpBrUS и cpBrUS-145 in vitro; (б) – калибровочная кривая, характеризующая зависимость нормированного на амплитуду времени жизни флуоресценции τ3 пермутантов cpBrUS и cpBrUS-145 от pH in vitro (n = 3).
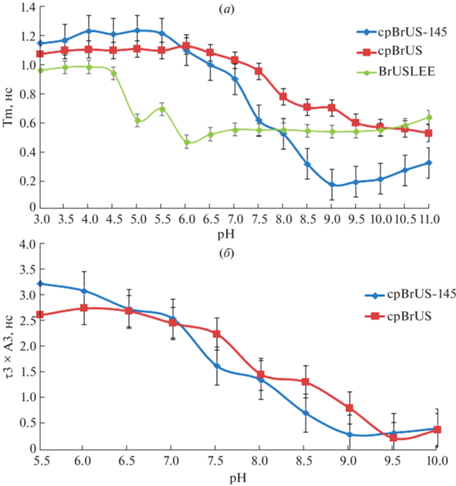
Кинетики затухания флуоресценции флуорофоров обоих пермутантов демонстрируют выраженную зависимость от pH раствора (рис. 2а); они адекватно аппроксимируются трехэкспоненциальной моделью, причем время жизни третьей компоненты с учетом амплитуды (τ3 × A3) показывает десятикратное изменение (~3000–300 пс) в диапазоне рН 5.5–9.0 (рис. 2б, табл. 1). Форма зависимости τ3 × A3 от рН близка к линейной, что потенциально облегчает калибровку флуоресцентного сигнала для экспериментального определения величины рН. Следует отметить, что пермутант cpBrUS-145 демонстрирует более значительный динамический диапазон ответа, чем cpBrUS (шестикратное изменение среднего времени жизни флуоресценции против двухкратного соответственно), что указывает на способность остатка Met145 ограничивать конформационную подвижность хромофора. При этом наблюдается незначительная чувствительность исходного белка BrUSLEE в узкой области значений рН 4.5–5.5 (рис. 2а), а при многокомпонентной экспоненциальной аппроксимации ни одна из компонент затухания флуоресценции белка BrUSLEE не показывает существенного изменения в области 6.0–8.5, интересной с физиологической точки зрения (табл. 1).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение циркулярных пермутантов BrUSLEE. Мы сконструировали ДНК-векторы, несущие кодирующие последовательности cpBrUSLEE. Для этого методом ПЦР-амплификации получили тандемные повторы последовательностей генов BrUSLEE [8, 12], соединенные олигонуклеотидным линкером, кодирующим аминокислотную последовательность состава (Ser-Gly-Thr)2; использовали следующие праймеры: 5'-ATGCGGATCCATGGTGAGCAAGGGCGAG-3', 5'-ATGCGTCGACCTTGTACAGCTCGTCCATGC-3', 5'-ATGCGTCGACAGCGGGACTAGCGGGACTATGGTGAGCAAGGGCGAG-3', 5'-ATGCAAGCTTTTAC-TTGTACAGCTCGTCCATGC-3'; программа ПЦР: 95°С – 5 мин, (95°С – 30 с, 58°С – 30 с, 72°С – 30 с) × 18, 72°С – 7 мин. Эта промежуточная конструкция служила матрицей для ПЦР-амплификации последовательностей ДНК, кодирующих варианты cpBrUSLEE, с использованием прямого (5'-концевого) праймера, соответствующего последовательности, кодирующей начало С‑концевой части первой копии cpBrUSLEE (начиная с 145 или 146 а.о.) (5'-ATGCGGATCCATGAACAGCCACAACGTC-3' или 5'-ATGCGGATCCAACAGCCACAACGTCTAT-3'), и обратного (3'-концевого) праймера, комплементарного последова-тельности ДНК, кодирующей конец N-концевой части второй копии cpBrUSLEE (1–144 а.о.) (5'‑AAGCTTTTAATGCGTTGTACTCCAGCTTGTGCC-3'), при следующей программе ПЦР: 95°С – 5 мин, (95°С – 30 с, 55°С – 30 с, 72°С – 30 с) × 18, 72°С – 7 мин.
Экспрессия и очистка белка. Последовательности, кодирующие пермутанты cpBrUS и cpBrUS-145, были клонированы в вектор pQE30 (Qiagen, США) с меткой 6His на N-конце, экспрессированы в штамме E. coli XL1 Blue (Invitrogen, США) и очищены с использованием металл-аффинной смолы TALON (Clontech, США) [13].
Спектроскопия времени жизни флуоресценции очищенных белков. Измерения производили с помощью времяразрешенного флуоресцентного спектрометра miniTau (Edinburgh Instruments, Великобритания) в окне 50 нс, разделенном на 2048 временных каналов. Возбуждение флуоресценции производили пикосекундным лазером EPL-450 (Edinburgh Instruments) с центральной длиной волны излучения 445.6 нм, частотой повторений 20 МГц; счет фотонов проводили в спектральном диапазоне 475–525 нм. Обработку и визуализацию данных, определение χ2 (критерий Пирсона) проводили в программе Fluoracle 2.5.1 (Edinburgh Instruments).
ЗАКЛЮЧЕНИЕ
Получены два циркулярных пермутанта BrUSLEE с удалением (cpBrUS-145) и с сохранением (cpBrUS) аминокислотного остатка Met в положении 145. В отличие от исходного BrUSLEE, оба пермутанта продемонстрировали выраженную зависимость кинетики затухания флуоресценции от рН в физиологическом диапазоне 6.0–8.5. Таким образом, циркулярная пермутация существенно повышает чувствительность хромофора BrUSLEE к изменениям рН, и оба циркулярных пермутанта BrUSLEE можно рассматривать как перспективные зонды для количественных измерений рН.
Список литературы
Casey J.R., Grinstein S., Orlowski J. // Nat. Rev. Mol. Cell Biol. 2010. V. 11. P. 50–61. https://doi.org/10.1038/nrm2820
Demaurex N. // Physiology. 2002. V. 17. P. 1–5. https://doi.org/10.1152/physiologyonline.2002.17.1.1
Boron W.F. // Adv. Physiol. Educ. 2004. V. 28. P. 160–179. https://doi.org/10.1152/advan.00045.2004
Lagadic-Gossmann D., Huc L., Lecureur V. // Cell Death Differ. 2004. V. 11. P. 953–961. https://doi.org/10.1038/sj.cdd.4401466
Zhu H., Fan J., Xu Q., Li H., Wang J., Gao P., Peng X. // Chem. Commun. 2012. V. 48. P. 11766. https://doi.org/10.1039/c2cc36785h
Ermakova Y.G., Pak V.V., Bogdanova Y.A., Kotlobay A.A., Yampolsky I.V., Shokhina A.G., Panova A.S., Marygin R.A., Staroverov D.B., Bilan D.S., Sies H., Belousov V.V. // Chem. Commun. 2018. V. 54. P. 2898–2901. https://doi.org/10.1039/C7CC08740C
Martynov V.I., Pakhomov A.A., Deyev I.E., Petrenko A.G. // Biochim. Biophys. Acta (BBA) – Gen. Subj. 2018. V. 1862. P. 2924–2939. https://doi.org/10.1016/j.bbagen.2018.09.013
Mamontova A.V., Solovyev I.D., Savitsky A.P., Shakhov A.M., Lukyanov K.A., Bogdanov A.M. // Sci. Rep. 2018. V. 8. P. 13224. https://doi.org/10.1038/s41598-018-31687-w
FPbase: avGFP. https://www.fpbase.org/protein/avgfp/
Chen T.-W., Wardill T.J., Sun Y., Pulver S.R., Renninger S.L., Baohan A., Schreiter E.R., Kerr R.A., Orger M.B., Jayaraman V., Looger L.L., Svoboda K., Kim D.S. // Nature. 2013. V. 499. P. 295–300. https://doi.org/10.1038/nature12354
Mamontova A.V., Shakhov A.M., Lukyanov K.A., Bogdanov A.M. // Biomolecules. 2020. V. 10. P. 1547. https://doi.org/10.3390/biom10111547
FPbase: BrUSLEE. https://www.fpbase.org/protein/bruslee/
TALON® Metal Affinity Resins User Manual. http://wolfson.huji.ac.il/purification/PDF/Tag_Protein_Purification/Ni-NTA/TALON_UserManual.pdf
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


