Биоорганическая химия, 2022, T. 48, № 4, стр. 495-499
Цианиновые красители в качестве флуорогенов для белков FAST и nanoFAST
А. А. Хрулев 1, Н. С. Балеева 1, 2, П. Н. Камзеева 1, М. С. Баранов 1, 2, А. В. Аралов 1, *
1 ФГБУН “Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова” РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
2 Российский национальный исследовательский медицинский университет имени Н.И. Пирогова
117997 Москва, ул. Островитянова, 1, Россия
* E-mail: baruh238@mail.ru
Поступила в редакцию 08.11.2021
После доработки 11.11.2021
Принята к публикации 13.11.2021
- EDN: ZNSVJC
- DOI: 10.31857/S013234232204011X
Аннотация
Синтезировано семь новых цианиновых красителей. Данные соединения, вместе с одиннадцатью описанными производными этого же класса, опробованы в качестве флуорогенов для белков FAST и nanoFAST. Исследование увеличения интенсивности флуоресценции при взаимодействии с данными белками позволило выявить структурные элементы, пригодные в дизайне систем белкового мечения на основе пар цианиновый краситель–флуороген-активирующий белок.
ВВЕДЕНИЕ
В настоящее время флуороген-активирующие белки, один из типов генетически кодируемых флуоресцентных меток, рассматриваются в качестве перспективных инструментов для изучения функционирования живых систем [1–3]. Подобные белки обладают способностью образовывать комплексы с низкомолекулярными флуорогенными соединениями (флуорогенами), имеющими слабовыраженную флуоресценцию в несвязанном состоянии в растворе, которая, однако, многократно увеличивается при взаимодействии с белком за счет фиксации молекулы красителя, ограничивающей безызлучательный сброс энергии после ее возбуждения [4]. В качестве подобных белков зарекомендовал себя белок FAST и недавно разработанный укороченный вариант nanoFAST, на данный момент представляющий собой самый короткий флуороген-активирующий белок [5, 6]. В качестве низкомолекулярного партнера подобных белков активно изучались производные хромофоров флуоресцентных белков [7], а также бензилиденовые производные роданинов [8], и получено множество пар белок–флуороген, покрывающих практически весь диапазон видимого излучения [9–11]. Тем не менее среди недостатков подобных систем флуоресцентного мечения можно упомянуть умеренную яркость, в основном за счет низкого коэффициента молярного поглощения флуорогенов, составляющего для большинства представителей 20 000–40 000 М–1 см–1. Таким образом, повышение яркости подобных флуоресцирующих комплексов, в том числе за счет увеличения коэффициента молярного поглощения красителей, представляется актуальной задачей.
Цель данного исследования заключалась в оценке потенциала нового класса красителей в качестве низкомолекулярных флуорогенов для систем флуоресцентного мечения на основе белков FAST и nanoFAST.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
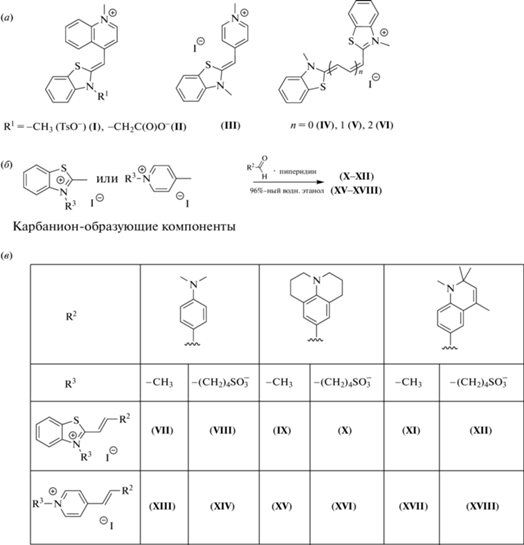
Цианиновые красители обладают рядом полезных свойств, среди которых следует отметить большие коэффициенты молярного поглощения, узкие полосы поглощения/излучения, высокую биосовместимость и низкую токсичность для биологических образцов [12]. В случае высокого квантового выхода флуоресценции флуорогена в комплексе с белком подобные красители могут обеспечить разработку новых эффективных систем мечения с большей яркостью. В настоящей работе мы решили опробовать набор из 18 цианиновых производных в качестве флуорогенов для белков FAST и nanoFAST (схема 1 ). Производные (I–IX), (XIII) и (XIV) получены по литературным методикам [13–23], а новые производные (X–XII) и (XV–XVIII) синтезированы реакцией конденсации Кневенагеля кипячением карбанион-образующей и карбонил-содержащей электрофильной компонент в водном этаноле в присутствии каталитического количества пиперидина (схема 1 ) [24].
Схема 1 . (а) – Структуры цианиновых красителей (I–VI); (б) – схема синтеза производных (X–XII) и (XV–XVIII); (в) – структуры цианиновых красителей (VII–XVIII).
Изучение изменения интенсивности флуоресценции при взаимодействии с белками FAST и nanoFAST позволило выявить фрагменты, пригодные для последующего дизайна пар цианиновых красителей с данными белками. Так, сравнение симметричных красителей (IV–VI) показало перспективность триметинового звена соединения (V) (11.3-кратное увеличение интенсивности флуоресценции, см. табл. 1) для последующего дизайна цианиновых красителей с гетероциклическими фрагментами, отличными от бензотиазольного. Из гетероциклических фрагментов цианинов можно выделить бензотиазольный и 1,2,3,5,6,7-гексагидропиридо[3,2,1-ij]хинолиновый (джулолидиновый)/1,2,2,4,6-пентаметил-1,2-дигидрохинолиновый фрагменты, наличие которых обеспечило “разгорание” красителей в 5–7 раз (см. табл. 1 для соединений (IX–XII)).
Таблица 1.
Увеличение интенсивности флуоресценции соединений (IV–VI) и (IX–XII) при взаимодействии с белками FAST и nanoFAST
| Соединение | Увеличение интенсивности флуоресценции при заданной длине волны возбуждения при взаимодействии с белком FAST (nanoFAST) | ||||
|---|---|---|---|---|---|
| 380 нм | 430 нм | 480 нм | 530 нм | 580 нм | |
| (IV) | 1.54 (1.71) | 2.10 (2.50) | 1.03 (1.11) | 1.08 (1.10) | 1.19 (1.37) |
| (V) | 1.07 (1.43) | 1.07 (1.22) | 1.43 (1.75) | 2.31 (3.16) | 7.40 (11.30) |
| (VI) | 1.49 (1.39) | 1.10 (1.21) | 1.10 (1.19) | 1.39 (1.66) | 1.09 (1.58) |
| (IX) | 1.08 (1.41) | 1.12 (1.26) | 1.99 (2.09) | 5.08 (4.84) | 6.27 (5.53) |
| (X) | 1.32 (1.42) | 1.11 (1.27) | 1.47 (1.84) | 3.23 (4.61) | 4.99 (7.00) |
| (XI) | 1.34 (1.68) | 1.21 (1.32) | 2.34 (2.24) | 4.87 (4.36) | 7.15 (6.24) |
| (XII) | 1.26 (1.62) | 1.13 (1.26) | 1.75 (1.85) | 3.30 (3.60) | 5.54 (6.62) |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Препараты белков FAST и nanoFAST получали согласно описанным ранее методикам [6, 8]. Увеличение интенсивности флуоресценции определяли как отношение интенсивности флуоресценции раствора хромофор + белок к интенсивности флуоресценции раствора свободного хромофора, зарегистрированным на планшет-ридере Tecan Infinite 200 Pro M Nano (Tecan Trading AG, Швейцария), работающем в двух режимах (1 и 10 мкМ раствор хромофора и белка соответственно). Регистрацию интенсивности флуоресценции обоих растворов осуществляли при одинаковой длине волны, приведенной для каждого соединения (табл. 1). Из-за используемых концентраций могли возникнуть ненасыщенные условия. Корректировку интенсивности поглощения не проводили.
Общая методика получения производных (X–XII) и (XV–XVIII). К раствору соответствующих карбанион-образующей компоненты (1 ммоль) и карбонил-содержащей компоненты (1.5 ммоль) в 96%-ном водном этаноле (15 мл) добавляли каталитическое количество пиперидина (10 мкл), полученный раствор кипятили с обратным холодильником в течение 20 ч. Реакционную смесь упаривали на роторном испарителе. Остаток растирали с ацетоном (5 мл), выпавший осадок отфильтровывали и промывали ацетоном (3 × 5 мл). Очистку целевого соединения проводили с помощью колоночной хроматографии на силикагеле в градиенте концентраций метанола в дихлорметане (10 → 30%, v/v), получая соответствующее целевое соединение.
4-(2-(2-(2,3,6,7-Тетрагидро-1H,5H-пиридо-[3,2,1-ij]хинолин-9-ил)винил)бензо[d]тиазол-3-ий-3-ил)бутан-1-сульфонат (X). Темно-фиолетовый аморфный порошок (180 мг, 77%).
Иодид 3-метил-2-(2-(1,2,2,4-тетраметил-1,2-дигидрохинолин-6-ил)винил)бензо[d]тиазол-3-ия (XI). Темно-красный аморфный порошок (85 мг, 73%).
4-(2-[2-(1,2,2,4-Тетраметил-1,2-дигидрохинолин-6-ил)винил)бензо[d]тиазол-3-ий-3-ил)бутан-1-сульфонат (XII). Темно-фиолетовый аморфный порошок (160 мг, 86%).
Иодид 1-метил-4-[2-(2,3,6,7-тетрагидро-1Н,5Н-пиридо[3,2,1-ij]хинолин-9-ил)винил)пиридин-1-ия (XV). Фиолетовый аморфный порошок (45 мг, 45%).
4-(4-[2-(2,3,6,7-Тетрагидро-1Н,5Н-бензо[ij]хинолизидин-9-ил)винил)пиридин-1-ий-1-ил)бутан-1-сульфонат (XVI). Темно-красный аморфный порошок (21 мг, 33%).
Иодид 1-метил-4-[2-(1,2,2,4-тетраметил-1,2-дигидрохинолин-6-ил)винил]пиридин-1-ия (XVII). Темно-красный аморфный порошок (60 мг, 50%).
4-(4-[2-(1,2,2,4-Тетраметил-1,2-дигидрохинолин-6-ил)винил]пиридин-1-ий-1-ил)бутан-1-сульфонат (XVIII). Красный аморфный порошок (90 мг, 70%).
Данные спектров полученных соединений (X–XII) и (XV–XVIII) приведены в дополнительных материалах.
ЗАКЛЮЧЕНИЕ
В настоящей работе синтезировано семь новых цианиновых красителей. Данные соединения, вместе с одиннадцатью описанными ранее производными, были оценены в качестве флуорогенов для белков FAST и nanoFAST. Выявлены структурные элементы цианиновых красителей, перспективные для последующего дизайна новых белковых флуоресцентных меток на основе пар цианиновый флуороген–FAST/nanoFAST, а именно бензотиазольный и 1,2,3,5,6,7-гексагидропиридо[3,2,1-ij]хинолиновый (джулолидиновый)/ 1,2,2,4,6-пентаметил-1,2-дигидрохинолиновый фрагменты, наличие которых обеспечило при взаимодействии с белками FAST и nanoFAST “разгорание” красителей в 5–7 раз.
Список литературы
Xu S., Hu H.Y. // Acta Pharm. Sin. B. 2018. V. 8. P. 339–348. https://doi.org/10.1016/j.apsb.2018.02.001
Péresse T., Gautier A. // Int. J. Mol. Sci. 2019. V. 20. P. 6142. https://doi.org/10.3390/ijms20246142
Gallo E. // Bioconj. Chem. 2020. V. 31. P. 16–27. https://doi.org/10.1021/acs.bioconjchem.9b00710
Baldridge A., Feng S., Chang Y.T., Tolbert L.M. // ACS Comb. Sci. 2011. V. 13. P. 214–217. https://doi.org/10.1021/co200025e
Plamont M.A., Billon-Denis R., Maurin S., Gauron C., Pimenta F.M., Specht C.G., Shi J., Quérard J., Pan B., Rossignol J., Moncoq K., Morellet N., Volovitch M., Lescop E., Chen Y., Triller A., Vriz S., Saux T., Jullien L., Gautier A. // Proc. Natl. Acad. Sci. USA. 2016. V. 113. P. 497–502. https://doi.org/10.1073/pnas.1513094113
Mineev K.S., Goncharuk S.A., Goncharuk M.V., Povarova N.V., Sokolov A.I., Baleeva N.S., Smirnov A.Y., Myasnyanko I.N., Ruchkin D.A., Bukhdruker S., Remeeva A., Mishin A., Borshchevskiy V., Gordeliy V., Arseniev A.S., Gorbachev D.A., Gavrikov A.S., Mishin A.S., Baranov M.S. // Chem. Sci. 2021. V. 12. P. 6719–6725. https://doi.org/10.1039/d1sc01454d
Li C., Plamont M.A., Sladitschek H.L., Rodrigues V., Aujard I., Neveu P., Saux T., Jullien L., Gautier A. // Chem. Sci. 2017. V. 8. P. 5598–5605. https://doi.org/10.1039/C7SC01364G
Povarova N.V., Zaitseva S.O., Baleeva N.S., Smirnov A.Y., Myasnyanko I.N., Zagudaylova M.B., Bozhanova N.G., Gorbachev D.A., Malyshevskaya K.K., Gavrikov A.S., Mishin A.S., Baranov M.S. // Chem. Eur. J. 2019. V. 25. P. 9592–9596. https://doi.org/10.1002/chem.201901151
Myasnyanko I.N., Gavrikov A.S., Zaitseva S.O., Smirnov A.Yu., Zaitseva E.R., Sokolov A.I., Malyshevskaya K.K., Baleeva N.S., Mishin A.S., Baranov M.S. // Chem. Eur. J. 2020. V. 27. P. 3986–3990. https://doi.org/10.1002/chem.202004760
Li C., Tebo A.G., Thauvin M., Plamont M., Volovitch M., Morin X., Vriz S., Gautier A. // Angew. Chemie. 2020. V. 132. P. 18073–18079. https://doi.org/10.1002/ange.202006576
Балеева Н.С., Смирнов А.Ю., Мяснянко И.Н., Гавриков А.С., Баранов М.С. // Биоорг. химия. 2021. Т. 47. С. 647–651. [Baleeva N.S., Smirnov A.Yu., Myasnyanko I.N., Gavrikov A.S., Baranov M.S. // Russ. J. Bioorg. Chem. 2021. V. 47. P. 1118–1121.] https://doi.org/10.1134/S1068162021050198
Li Y., Zhou Y., Yue X., Dai Z. // Adv. Healthc. Mater. 2020. V. 9. P. 2001327. https://doi.org/10.1002/adhm.202001327
Wang L., Lin W., Sun W., Yan M., Zhao J., Guan L., Deng W., Zhang Y. // J. Org. Chem. 2019. V. 84. P. 3960–3967. https://doi.org/10.1021/acs.joc.8b03122
Dolgosheina E.V., Jeng S.C., Panchapakesan S.S., Cojocaru R., Chen P.S., Wilson P.D., Hawkins N., Wiggins P.A., Unrau P.J. // ACS Chem. Biol. 2014. V. 9. P. 2412–2420. https://doi.org/10.1021/cb500499x
Turaev A.V., Tsvetkov V.B., Tankevich M.V., Smirnov I.P., Aralov A.V., Pozmogova G.E., Varizhuk A.M. // Biochimie. 2019. V. 162. P. 216–228. https://doi.org/10.1016/j.biochi.2019.04.018
Kurutos A., Nikodinovic-Runic J., Veselinovic A., Veselinovic J.B., Kamounah F.S., Ilic-Tomic T. // New J. Chem. 2021. V. 45. P. 12818–12829. https://doi.org/10.1039/D1NJ01659H
Quan-Quan S., Ru S., Jian-Feng G., Qing-Feng X., Na-Jun L., Jian-Mei L. // Dyes Pigm. 2012. V. 93. P. 1506–1511. https://doi.org/10.1016/j.dyepig.2011.11.001
Rao T.V.S., Huff J.B., Bieniarz C. // Tetrahedron. 1998. V. 54. P. 10627–10634. https://doi.org/10.1016/S0040-4020(98)00597-3
Vasilev A., Deligeorgiev T., Gadjev N., Kaloyanova S., Vaquero J., Alvarez-Builla J., Baeza A. // Dyes Pigm. 2008. V. 77. P. 550–555. https://doi.org/10.1016/j.dyepig.2007.08.004
Al-horaibi S.A., Alrabie A.A., Alghamdi M.T., Al-Ostoot F.H., Garoon E.M., Rajbhoj A.S. // J. Mol. Struct. 2021. V. 1224. P. 128836. https://doi.org/10.1016/j.molstruc.2020.128836
Coe B.J., Foxon S.P., Harper E.C., Harris J.A., Helliwell M., Raftery J., Asselberghs I., Clays K., Franz E., Brunschwig B.S., Fitch A.G. // Dyes Pigm. 2009. V. 82. P. 171–186. https://doi.org/10.1016/j.dyepig.2008.12.010
Fang-Fang S., Ying-Ming Z., Xian-Yin D., Hao-Yang Z., Yu L. // J. Org. Chem. 2020. V. 85. P. 6131–6136. https://doi.org/10.1021/acs.joc.9b03513
Zhong-Sheng W., Fu-You L., Chun-Hui H., Lu W., Min W., Lin-Pei J., Nan-Qiang L. // J. Phys. Chem. B. 2000. V. 104. P. 9676–9682. https://doi.org/10.1021/jp001580p
Shindy H.A. // Dyes Pigm. 2017. V. 145. P. 505–513. https://doi.org/10.1016/j.dyepig.2017.06.029
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Инструменты
Биоорганическая химия