Биоорганическая химия, 2022, T. 48, № 5, стр. 589-598
Детекция вируса блютанга с помощью микросфер, конъюгированных с моноклональными антителами к групп-специфичному белку (VP7), методом проточной вирометрии
Н. В. Руденко 1, *, А. П. Каратовская 1, А. В. Замятина 1, А. С. Малоголовкин 2, 4, В. А. Олейников 3, Ф. А. Бровко 1, А. Ю. Кольцов 2, О. Г. Лаптева 2, Д. В. Колбасов 2, А. О. Шепеляковская 1
1 Филиал Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова, РАН
142290 Пущино, просп. Науки, 6, Россия
2 ФГБНУ “Федеральный исследовательский центр вирусологии и микробиологии”
601125 Владимирская обл., пос. Вольгинский, ул. Академика Бакулова, стр. 1, Россия
3 ФГБУН “Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова” РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
4 Научно-технологический университет “Сириус”
354340 Краснодарский край,
федеральная территория “Сириус”, пгт. Сириус, Олимпийский просп., 1, Россия
* E-mail: nrudkova@mail.ru
Поступила в редакцию 30.11.2021
После доработки 15.12.2021
Принята к публикации 18.12.2021
- EDN: TCYFXN
- DOI: 10.31857/S0132342322040170
Аннотация
Блютанг – инфекционное трансмиссивное вирусное заболевание экономически значимых сельскохозяйственных жвачных животных, для которого характерны как летальный исход, так и продолжительная виремия без клинических симптомов, что делает актуальной разработку высокочувствительных методов обнаружения вируса блютанга (BTV). На основе высокоаффинных моноклональных антител к VP7 (вирусному белку 7) были разработаны методы обнаружения вирусных частиц с помощью иммунофлуоресценции клеток Vero, инфицированных BTV, иммуноферментного сэндвич-анализа и проточной вирометрии. Высокая аналитическая чувствительность (10–0.25 ТЦД50/мл (тканевая цитопатогенная доза)) была продемонстрирована с помощью проточного флуориметрического анализа. Возможность быстрого и эффективного выявления вирусных частиц в биологических жидкостях животного методом проточной вирометрии была продемонстрирована в модельной системе при определении BTV в сыворотке крови крупного рогатого скота, аналитическая чувствительность определения при этом составляла 100.75 ТЦД50/мл.
ВВЕДЕНИЕ
Блютанг, или катаральная лихорадка овец, – это инфекция домашних и диких жвачных животных, переносимая насекомыми. Блютанг поражает преимущественно овец, при этом широко распространено скрытое заражение крупного рогатого скота. Вирус блютанга (BTV) принадлежит к роду Orbivirus, семейству Reoviridae. BTV имеет сегментированный геном из двухцепочечной РНК, упакованный в покрытую оболочкой частицу размером 80 нм. Поверхностный гликопротеин VP2 демонстрирует высокую гетерогенность у различных штаммов BTV и определяет серотипную специфичность. Существует 29 различных типов (серотипов) BTV, которые могут инфицировать домашних овец, коз и крупный рогатый скот, а также диких животных, таких как буйволы, олени, антилопы и верблюды [1, 2].
Бессимптомное течение инфекции у крупного рогатого скота приводит к неконтролируемой передаче вируса и чрезвычайно затрудняет эпидемиологическую оценку заболеваемости. Несмотря на прогресс в исследованиях вакцины против BTV, болезнь по-прежнему представляет серьезную угрозу для животноводства во всем мире [3, 4].
Простые, надежные, быстрые и чувствительные диагностические тесты имеют решающее значение для контроля перемещений животных, карантинов и расследования вспышек заболевания. Существующие методы диагностики условно можно разделить на две группы. К первой группе относятся методы прямого обнаружения вирусов (инфицирование куриного эмбриона или клеточной линии) с последующей иммунологической и генетической характеристикой (ПЦР и/или секвенирование). Эти методы предоставляют исчерпывающую информацию о вирусе, но чрезвычайно трудоемки и требуют много времени [2, 5–10].
Выявление специфических антител к BTV у инфицированных, выздоровевших и вакцинированных животных – еще одно важное направление диагностики (иммуноферментный анализ, иммунофлуоресцентный тест). Например, описан иммуноанализ с использованием микросфер, конъюгированных с двумя поверхностными вирусными белками, для одновременного определения групп- и серотип-специфических антител в сыворотке крови инфицированных животных [11]. Показано, что антитела к белкам BTV могут быть обнаружены в сыворотках крови овец через 7–14 лет после инфицирования и сохраняются в течение длительного времени [12]. Серологические анализы подтверждают предыдущий контакт животных с вирусом, а не наличие инфекционного вируса.
Формат сэндвич-ИФА широко используется из-за его высокой чувствительности и специфичности для обнаружения аналитов в многокомпонентных смесях, таких как биологические жидкости [13]. Проточный цитометр – широко используемый прибор в клинической лабораторной практике. Быстрое многомерное исследование отдельных живых микрообъектов сделало проточную цитометрию бесценным инструментом как для качественного, так и для количественного анализа [14, 15]. Проточная вирометрия обеспечивает быстрое, чувствительное и количественное обнаружение вирусных аналитов, что побудило нас разработать анализы на основе проточной вирометрии для обнаружения BTV.
Успешному обнаружению вирусов способствует использование микрочастиц, конъюгированных с антителами для улавливания вирусных частиц. В нескольких исследованиях микрочастицы, конъюгированные с вирус-специфическими антителами, использовались для идентификации и дифференциации вирусов гриппа A и B, вируса иммунодефицита человека (ВИЧ-1) и вируса Денге [16–19].
В работе Руденко с соавт. [20] описаны получение и характеристика высокоаффинных моноклональных антител (mAb) к поверхностным эпитопам VP7 BTV. VP7 – относительно консервативный белок, ответственный за групповую специфичность [1] и иммуногенные свойства вируса и количественно преобладающий в структуре вириона [21–23]. При получении mAb для детекции BVT был использован рекомбинантный белок VP7_а, соответствующий фрагменту белка VP7, экспонированному на поверхности вирусной частицы и включающему 114–257 а.о. [24]. mAb к VP7 способны связываться с поверхностными эпитопами 24 серотипов BTV.
Цель данного исследования – разработка быстрого и чувствительного метода детекции вируса блютанга в биологических жидкостях животных методом проточной вирометрии с использованием моноклональных антител [20] к поверхностным эпитопам вирусной частицы.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Обнаружение вируса блютанга в инфицированных клетках с помощью реакции непрямой иммунофлуоресценции. Для идентификации BTV в инфицированных клетках использовали панель специфических mAb [20]. Способность mAb взаимодействовать с поверхностными эпитопами вирусных частиц была подтверждена иммуноферментным анализом по взаимодействию с рекомбинантным белком, состоящим из участка аминокислотной последовательности VP7, экспонированного на поверхности вирусной частицы (114–257 а.о. в последовательности исходного белка), и фрагмента тиоредоксина. Этот анализ и получение рекомбинантного VP7 описаны нами ранее [20]. Все полученные mAb были протестированы на их способность обнаруживать BTV в инфицированных клеточных линиях в реакции непрямой иммунофлуоресценции (РНИФ). mAb эффективно окрашивали инфицированные клетки. На рис. 1 показано сравнение данных между взаимодействием антител с вирусными частицами в инфицированных клетках и данными ИФА о взаимодействии mAb с рекомбинантным белком, содержащим фрагменты VP7 и тиоредоксина.
Рис. 1.
Сравнение антиген-связывающей активности mAb к VP7 вируса блютанга [20]. Гистограмма показывает зависимость степени связывания mAb от концентрации: ИФА – связывание с рекомбинантным белком, состоящим из фрагментов VP7 и тиоредоксина; РНИФ – идентификация BTV-1 в инфицированных клетках Vero.
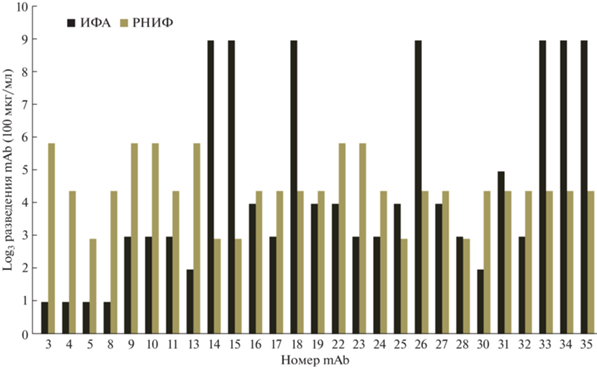
Антитела к VP7 реагировали с инфицированными клеточными линиями до концентрации 0.1 мкг/мл в РНИФ. Визуализацию проводили с использованием вторичных антител, меченных FITC. На рис. 2 в качестве примера представлена микрофотография иммунофлуоресцентного окрашивания антителом Bt-33 (как одним из наиболее эффективных в этой реакции) клеток Vero, инфицированных BTV серотипа 1, демонстрирующая эффективное выявление вирусных частиц, в сравнении с интактными клетками. Амплификацию вируса проводили в течение четырех суток. Даже незначительного количества вирусных частиц, выделенных из зараженного материала, достаточно для эффективного выявления антителами в РНИФ.
Рис. 2.
РНИФ культуры клеток Vero, инфицированных BTV-1 MOI 0.02, культивируемой в течение 96 ч после инфекции: (а) – неинфицированная культура клеток Vero; (б) – детекция с mAb AlpA-2 [25]; (в) – детекция с Bt-33. Увеличение 40×.

Сэндвич-ИФА. Тест-системы для выявления BTV были разработаны в формате сэндвич-ИФА, как описано ранее [26]. Для подбора детектирующих пар антител к BTV проводили биотинилирование всех mAb имеющейся панели с помощью N-гидроксисукцинимидного эфира биотина. Биотинилированные антитела использовали в качестве детектирующих антител, а иммобилизованные на планшетах для ИФА немеченые антитела – для захвата вирусных частиц.
Были проверены все возможные сочетания mAb против вирусных частиц для обнаружения детектирующих пар антител с максимальным соотношением сигнал/фон, т.е. отношением оптической плотности в лунках микропланшета с антигеном и без него. В качестве аналита использовали инактивированный препарат BTV серотипа 1, экстрагированный фреоном. Полученный таким образом BTV представляет собой цельные вирусные частицы [27], это дало основание предполагать, что разработанный метод будет направлен на выявление интактных вирусов. В результате были выбраны следующие пары mAb, эффективно выявляющие инактивированный BTV: Bt-3 (захват) + + Bt-9 (детекция), Bt-3 (з) + Bt-28 (д), Bt-8 (з) + + Bt-9 (д), Bt-8 (з) + Bt-28 (д), Bt-(3 + 8) (з) + Bt-9 (д), Bt-(3 + 8) (з) + Bt-28 (д). Соотношение сигнал/фон для этих детектирующих “пар” равнялось шести при концентрации аналита 100 нг/мл, ошибка измерения ±5%. Максимальную чувствительность демонстрировали пары антител Bt-3 (з) + + Bt-9bio (д) и Bt-3 (з) + Bt-28bio (д), которая составила 103.94 ТЦД50/мл и 3 нг/мл при использовании инактивированного препарата.
Конъюгирование флуоресцентных микросфер с mAb. Антитела захвата из детектирующих пар, разработанных для сэндвич-ИФА, конъюгировали с флуоресцентными микросферами с использованием Sulfo-SMCC. Контроль иммобилизации антител на флуоресцентных микросферах проводили по взаимодействию с антителами против иммуноглобулинов мыши, меченных PE. Конъюгаты флуоресцентных микросфер с mAb демонстрировали 500-кратное увеличение медианы интенсивности флуоресценции (MIF) при 585/40 нм по сравнению с контрольными микрочастицами без антител.
Для обнаружения вирусных частиц использовали микросферы, конъюгированные с mAb захвата, и детектирующие антитела, меченные либо AlexaFluor 488, либо биотином. В случае использования биотинилированных антител иммунные комплексы детектировали стрептавидином, меченным PE (SA-PE).
Были протестированы все детектирующие пары mAb, отобранные в сэндвич-ИФА. Сравнили два способа мечения детектирующих антител с целью определения оптимального способа детекции вирусных частиц: прямое введение флуоресцентной метки (AlexaFluor 488) и опосредованное через высокоаффинную биотин-стрептавидиновую систему, позволяющую не только идентифицировать сигнал, но и амплифицировать его.
Иммунофлуориметрическое определение концентрации вируса блютанга с использованием микросфер. Определение вируса проводили, добавляя препарат BTV (в соответствующем разведении) к смеси функциональных микросфер с иммобилизованными mAb захвата и с мечеными детектирующими mAb. Процедура определения BTV была максимально оптимизирована, подобраны концентрации реагентов с учетом оптимальных диапазонов и линейности детекции аналитов. Концентрация AlexaFluor 488-меченных и биотинилированных антител составляла 5 мкг/мл. С целью оптимизации процедуры анализа были объединены этапы инкубирования сенсибилизированных микросфер в экспериментальной точке с аналитом и детектирующими мечеными антителами. В случае AlexaFluor 488-меченных антител анализ проводили в одну стадию, в случае биотинилированных антител – в две. В результате общее время анализа удалось сократить на 60 мин без потери в чувствительности и специфичности.
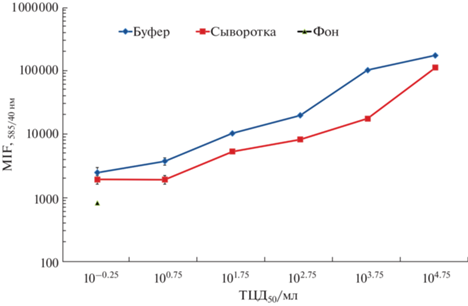
Результаты определения BTV представлены в табл. 1. При использовании AlexaFluor 488 в качестве флуоресцентной метки минимальный предел определения (аналитическая чувствительность определения BTV) для всех исследуемых детектирующих пар составил 101.75 ТЦД50/мл. По-видимому, существенный вклад в чувствительность определения вносила неспецифическая флуоресценция, т.е. значение MIF в отсутствие вирусных частиц (отрицательный контроль). При использовании биотинилированных детектирующих антител и в качестве флуоресцентной метки SA-PE неспецифическая флуоресценция имела значения в среднем на 76% меньше, чем в случае с AlexaFluor 488. Минимальным пределом определения считали значение MIF, превышающее отрицательный контроль (фон) как минимум в 2 раза (табл. 1). Для большинства исследуемых детектирующих пар минимальный предел определения составил 100.75 ТЦД50/мл. Детектирующая пара Bt-3 (з) + Bt-28 (д) демонстрировала предел детекции вирусных частиц, равный 10–0.25 ТЦД50/мл. На рис. 3 представлен калибровочный график определения вирусных частиц, а также показано определение BTV в сыворотке бычьей крови, в этом случае чувствительность составила 100.75 ТЦД50/мл.
Таблица 1.
Измерение концентрации вируса блютанга серотипа 1 (ТЦД50/мл) методом проточной вирометрии с использованием детектирующих пар mAb, отобранных в сэндвич-ИФА, и двух типов флуоресцентных меток
| mAb на микросферах захвата | Детектирую-щие mAb | Детектирующий реагент: mAb-AlexaFluor 488 | Детектирующий реагент: mAb-биотин + SA-PE | ||||
|---|---|---|---|---|---|---|---|
| фон*, MIF | аналитическая чувствительность, BTV | фон*, MIF | аналитическая чувствительность, BTV | ||||
| ТЦД50/мл | MIF | ТЦД50/мл | MIF | ||||
| Bt-3 | Bt-9 | 4331 | 101.75 | 5607 | 1386 | 100.75 | 3295 |
| Bt-3 | Bt-28 | 2871 | 101.75 | 6604 | 939 | 10–0.25 | 2284 |
| Bt-8 | Bt-9 | 2410 | 101.75 | 5603 | 1620 | 100.75 | 3207 |
| Bt-8 | Bt-28 | 2629 | 101.75 | 4699 | 1625 | 100.75 | 3188 |
| Bt-3 + Bt-8 | Bt-9 | 4178 | 101.75 | 5760 | 1902 | 100.75 | 3704 |
| Bt-3 + Bt-8 | Bt-28 | 2926 | 101.75 | 5859 | 1637 | 100.75 | 3848 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Несмотря на эффективность существующих методов диагностики BTV, большинство современных методов медленные или дорогостоящие, что не позволяет быстро реагировать при вспышках заболевания. Молекулярно-биологические методы, такие как ПЦР в реальном времени, несмотря на высокую скорость определения, требуют выделения генетического материала и сложного оборудования. ПЦР выявляет инфекцию, но не свидетельствует о фактической связи между инфекцией и клиническими признаками. Секвенирование геномов, в особенности для РНК-вирусов, несмотря на очевидные успехи и снижение стоимости, все еще остается дорогой и длительной процедурой, не позволяющей использовать его в качестве рутинного диагностического теста [28]. Развитие аналитических методов быстрого обнаружения и идентификации BTV с высокой чувствительностью и избирательностью по-прежнему актуально.
Для разработки иммунохимических методов идентификации BTV была использована панель моноклональных антител [20] к VP7 – относительно консервативному белку, ответственному за групповую специфичность [10]. Этот фрагмент экспонирован на поверхности интактных вирионов и коровых частиц вируса BTV [24]. Антитела к VP7 узнают вирусные частицы всех серотипов, следовательно, разработанный тест пригоден для скрининга виремии, вызванной любым серотипом вируса блютанга. Использование антител с такой специфичностью позволило разработать высокочувствительный тест для идентификации вирусных частиц непосредственно в биологических жидкостях зараженного животного. В данной работе продемонстрирована возможность определения BTV в сыворотке крови с использованием цитофлуориметра BD Accuri C6 (Becton Dickinson, США), позволившего значительно сократить время детекции. Проточные цитофлуориметры широко распространены в современных лабораториях.
Чувствительность определения вирусных частиц разработанным методом сопоставима с данными Martinelle et al. [29], которые методом ПЦР в реальном времени определяли содержание вирусов в тканях на пике виремии после некропсии вакцинированных и невакцинированных животных, искусственно зараженных патогенными штаммами вируса. При этом наименьшее число копий вирусных геномов было отмечено для серотипа BTV4 – после пересчета соответствует 100.58 ТЦД50/мл. Такое количество вирусов уже достаточно для детекции разработанным методом. Для других серотипов на пике виремии количество копий вирусных геномов существенно выше, а следовательно, разработанным методом они могут детектироваться и на более ранней стадии инфицирования. При этом важно отметить, что для передачи вирусов комарами необходимо, чтобы вирус преодолел порог 103155 ТЦД50/мл. Следовательно, иммунофлуориметрическое определение концентрации вирусов с использованием микросфер, описанное в данной работе, имеет достаточную чувствительность и может применяться для выявления интактных вирусных частиц непосредственно в биологических жидкостях инфицированных животных.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Вирус блютанга и клетки. BTV-1 (Испанский пул 1,2 овечья кровь) с инфекционной активностью 106.75 ТЦД50/мл получен из Государственной коллекции микроорганизмов, вызывающих опасные, особо опасные, зооантропонозные и пограничные болезни (регистрационный номер CCU – 441429, http://ckp-rf.ru/ckp/441429/). Лизаты клеток Vero, зараженных BTV-1, очищали и концентрировали в соответствии с методикой Verwoerd et al. [27]. Для размножения вируса использовали клетки почек африканской зеленой мартышки (Vero) из коллекции ФГБНУ “Федеральный исследовательский центр вирусологии и микробиологии”.
Размножение и титрование BTV-1. Культуру клеток Vero инфицировали BTV-1 MOI 0.02. Адсорбцию вируса проводили в течение 1 ч при 37 ± ± 0.5°С. Затем инфицированный монослой клеток отмывали от несвязавшегося вируса трехкратно средой Игла-МЕМ без сыворотки. Далее клетки инкубировали со средой Игла-МЕМ, содержащей 2% FBS (SH30070.03; Defined Fetal Bovine Serum, HyClone, США) при 37 ± 0.5°С в течение 4 суток. Цитопатический эффект контролировали ежедневно. Инфекционную активность BTV-1 определяли путем лимитирующего разведения вируса в клетках Vero. Инфекционную дозу для культуры ткани ТЦД50/мл рассчитывали с использованием метода Рида и Мюнха в модификации Ашмарина [30].
Реакция непрямой иммунофлуоресценции (РНИФ). Для определения способности ранее полученных антител [20] идентифицировать антигены BTV-1 в инфицированных клетках были подготовлены аналитические тест-планшеты для тестирования в РНИФ. Клетки Vero культивировали в лунках 96-луночных планшетов в течение 1–2 суток в ростовой среде Игла, содержащей 10% фетальной бычьей сыворотки, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина, 2.5 ед./мл амфотерицина В. Клетки в планшетах заражали BTV‑1 MOI 0.02 в объеме 100 мкл среды Игла с указанными антибиотиками. Интактные и инфицированные клетки инкубировали при 37°С в атмосфере 95%-ной влажности и 5% СО2 в течение 4 суток. Кондиционную среду из лунок удаляли, клеточный монослой дважды промывали PBS (3 мМ KCl, 1 мМ KH2PO4, 140 мМ NaCl, 9 мМ Na2HPO4), фиксировали 80%-ным (v/v) ацетоном, охлажденным до –20°С.
К клеткам добавляли серийные двукратные разведения антител и сывороток (нормальной, в качестве отрицательного контроля, и специфической, содержащей антитела к вирусу, – в качестве положительного контроля) в PBS, содержащем 1% FBS, и инкубировали в течение 1 ч при 37°С. После двух последующих промывок PBS антитела кролика против иммуноглобулинов мыши, конъюгированные с FITC, добавляли в рабочем разведении 1 : 1000 в соответствии с рекомендациями производителя (31555; Thermo Fisher Scientific, США). Иммунные комплексы в инфицированных клетках визуализировали с помощью флуоресцентного микроскопа Eclipse 90i (Nicon, Япония).
Конъюгация антител с биотином. Биотинилирование антител проводили по стандартной методике [31].
Сэндвич-ИФА. Сэндвич-ИФА проводили, как описано ранее [26]. Немеченые mAb захвата иммобилизовали на полистирольных планшетах для ИФА (655001; Greinerbio-one, США), далее добавляли биотинилированные mAb детекции и инактивированный BTV-1 (100 нг/мл) [27], в контрольные лунки вносили только антитела детекции. Образовавшиеся иммунные комплексы выявляли конъюгатом пероксидазы хрена со стрептавидином (21126; Thermo Fisher Scientific, США), взаимодействующим с биотинилированными детектирующими антителами. Детекцию проводили после обработки о-фенилендиамином (P23938; Sigma-Aldrich, США) – растворимым хромогенным субстратом пероксидазы, измеряли оптическую плотность при 490 нм на микропланшетном фотометре iMark (Bio-Rad, США).
Конъюгация функциональных микросфер с mAb. Для ковалентного присоединения mAb использовали микросферы размером 7.5 мкм (558582, 558583, 558581; BD Biosciences, США), содержащие функциональные группы, взаимодействующие с Sulfo-SMCC (22322; Pierce, США). Функциональные микросферы конъюгировали с mAb Bt-3 и Bt-8 [20] в качестве антител захвата согласно инструкции производителя (558556; BD Biosciences, США).
Конъюгирование антител с AlexaFluor 488. mAb Bt-9 и Bt-28 конъюгировали с N-гидроксисукцинимидным эфиром AlexaFluor 488 (A20000; Thermo Fisher Scientific, США) в бикарбонатном буфере (0.1 М, рН 9.0) согласно методике Velázquez-López et al. [32].
Детекция вируса блютанга методом проточной цитофлуориметрии. В качестве самостоятельных систем для обнаружения BTV-1 были использованы функциональные микросферы: с иммобилизованными mAb Bt-3 (558582, BD Biosciences), с mAb Bt-8 (558583, BD Biosciences) и Bt-3 + Bt-8 (558581, BD Biosciences). Для детекции использовали mAb Bt-8, Bt-9, Bt-28, меченные биотином или AlexaFluor 488. Серийные десятикратные разведения BTV-1 (от концентрации вирусных частиц, равной 106.75, до 10–2.25 ТЦД50/мл) готовили в буфере для разведения (PBS с 0.1% Tween 20 и 1% FBS).
В случае использования флуоресцентно меченых детектирующих антител реакционную смесь готовили путем одновременного смешивания всех компонентов в буфере для разведения. В ходе эксперимента в отдельные промаркированные пробирки добавляли по 1 мл заранее приготовленных растворов, содержащих вирусные частицы в десятикратно различающихся концентрациях. В качестве отрицательного контроля использовали 1 мл буфера для разведения без добавления вирусов. К каждой экспериментальной точке добавляли по 1 мкл суспензии микросфер, конъюгированных с антителами захвата, что соответствовало ~6 × 103 частиц, и флуоресцентно меченых антител до конечной концентрации 10 мкг/мл. Полученные смеси инкубировали 4 ч при комнатной температуре в темноте, тщательно перемешивая содержимое пробирок. Определение BTV в бычьей сыворотке выполняли аналогичным образом с использованием FBS вместо буфера для разведения.
После связывания микросфер с вирусными частицами и детектирующими антителами реакционные смеси порциями переносили в лунки планшета MultiScreen HTS BV FilterPlate (MSBVN1210; Millipore, США), мембрана которого имела диаметр пор 1.2 мкм. Планшет помещали в устройство вакуумного фильтрования Bio-Dot® Microfiltration Apparatus (1706545; Bio-Rad, США) и присоединяли к водоструйному насосу для удаления жидкости с несвязавшимися компонентами смеси. Микросферы, собранные в лунках планшета, промывали буфером для разведения, трижды наполняя этим буфером лунки и удаляя его путем фильтрования. При использовании детектирующих антител, модифицированных биотином, антитела добавляли до конечной концентрации 5 мкг/мл. Пробы инкубировали и отмывали так же, как описано выше, после чего микросферы суспендировали в 100 мкл буфера для разведения с добавлением конъюгата SA-PE в концентрации 1 мкг/мл (SA-5207; Vector Laboratories, США) и инкубировали 30 мин при комнатной температуре в темноте. Далее микросферы промывали, как описано выше, после чего планшет отсоединяли от фильтровальной системы, содержимое экспериментальных лунок суспендировали в 100 мкл буфера для разведения и переносили в пробирки для дальнейшего анализа методом проточной цитофлуориметрии. Анализ проводили на приборе BD Accuri C6 (BD Biosciences, США), имеющем лазеры с длинами волн для возбуждения флуорофоров 488 и 640 нм. Детекцию флуоресцентного сигнала AlexaFluor 488 осуществляли при использовании стандартного оптического фильтра FL-1: 533/30 нм, фикоэритрина (PE) – FL-2: 585/40 нм. Образцы подавали в анализатор при скорости потока 14 мкл/мин. Пул микросфер визуализировали на двумерной гистограмме, созданной на основе измерения прямого и бокового рассеяния. После этого строили графики зависимости содержания вирусных частиц в растворе от среднего значения интенсивности флуоресценции (MFI) при 533/30 нм в случае AlexaFluor 488 и 585/40 нм в случае фикоэритрина. Буфер для разведения без добавления аналита использовали в качестве отрицательного контроля. Согласно вышеописанной методике с использованием детектирующей пары Bt-3, в качестве антитела захвата, конъюгированного с функциональными микросферами (558582, BD), и Bt-28, в качестве детектирующего антитела, были получены данные для калибровочного графика (рис. 3). Проанализировано 10 экспериментальных точек с разведениями с шагом “десять” как в буфере для разведения, так и в сыворотке.
ЗАКЛЮЧЕНИЕ
Разработан эффективный тест непрямой иммунофлуоресценции на основе моноклональных антител к VP7 вируса блютанга. РНИФ может быть успешно использована для скрининга BTV-инфицированных клеток в вирусной диагностике и фундаментальных исследованиях. Разработан тест на основе флуоресцентных микросфер для количественного определения BTV методом проточной цитометрии с использованием охарактеризованных mAb к VP7 BTV. Детектирующая пара mAb – конъюгированные с флуоресцентными микросферами Bt-3 (антитела захвата) + биотинилированные Bt-28 (антитела детекции) – выявляла вирусные частицы BTV вплоть до концентрации 10–0.25 ТЦД50/мл, в сыворотке бычьей крови чувствительность определения составила 100.75 ТЦД50/мл.
В работе продемонстрировано, что mAb к VP7 BTV могут быть использованы в диагностических методах: сэндвич-ИФА, РНИФ и проточной вирометрии. Показано, что проточный вирометрический анализ BTV на основе флуоресцентных микросфер чувствителен, не требует выделения вируса и позволяет обнаруживать его непосредственно в биологических жидкостях, что дает преимущество для диагностики BTV и быстрого скрининга поголовья сельскохозяйственных животных.
Список литературы
Mertens P.P.C., Maan S., Samuel A., Attoui H. // In: Virus Taxonomy. Classification and Nomenclature of Viruses / Eds. Fauquet C.M., Mayo M.A., Maniloff J., Desselberger U., Ball L.A. Amsterdam: Elsevier Academic Press, 2005. P. 466–483.
Maan S., Maan N.S., Belaganahalli M.N., Potgieter A.C., Kumar V., Batra K., Wright I.M., Kirkland P.D., Mertens P.P.C. // PLoS One. 2016. V. 11. P. e0163014. https://doi.org/10.1371/journal.pone.0163014
Mertens P.P.C., Diprose J., Maan S., Singh K.P., Attoui H., Samuel A.R. // Vet. Ital. 2004. V. 40. P. 426–437.
Mellor P.S., Carpenter S., Harrup L., Baylis M., Mertens P.P. // Prev. Vet. Med. 2008. V. 87. P. 4–20. https://doi.org/10.1016/j.prevetmed.2008.06.002
Blacksell S.D., Lunt R.A. // J. Virol. Methods. 1993. V. 44. P. 241–250. https://doi.org/10.1016/0166-0934(93)90059-z
Hamblin C. // Vet. Ital. 2004. V. 40. P. 538–545.
Clavijo A., Heckert R.A., Dulac G.C., Afshar A. // J. Virol. Methods. 2000. V. 87. P. 13–23. https://doi.org/10.1016/s0166-0934(00)00150-6
Nunamaker R.A., Ellis J.A., Wigington J.G., Maclachlan N.J. // Comp. Biochem. Physiol. Comp. Physiol. 1992. V. 101. P. 471–476. https://doi.org/10.1016/0300-9629(92)90496-d
Zientara S., Sailleau C., Bréard E., Viarouge C., Doceul V., Vitour D. // Vet. Ital. 2015. V. 51. P. 393–399. https://doi.org/10.12834/VetIt.512.3148.2
Wilson W.C., Ma H.C., Venter E.H., van Djik A.A., Seal B.S., Mecham J.O. // Virus Res. 2000. V. 67. P. 141–151. https://doi.org/10.1016/s0168-1702(00)00138-6
Breard E., Garnier A., Despres P., Boisseau S.B., Comtet L., Viarouge C., Bakkali-Kassimi L., Pourquier P., Hudelet P., Vitour D., Rossi S., Belbis G., Sailleau C., Zientara S. // Transboundary and Emerging Diseases. 2017. V. 64. P. 1837–1847. https://doi.org/10.1111/tbed.12578
Stott J.L., Barber T.L., Osburn B.I. // Am. J. Vet. Res. 1985. V. 46. P. 1043–1049.
Руденко Н.В., Каратовская А.П., Цфасман И.М., Бровко Ф.А., Васильева Н.В. // Биоорг. химия. 2017. Т. 43. С. 501–506. [Rudenko N.V., Karatovskaya A.P., Tsfasman I.M., Brovko F.A., Vasilyeva N.V. // Russ. J. Bioorg. Chem. 2017. V. 43. P. 526–530.] https://doi.org/10.1134/S1068162017050119
Reyes J.L.Z., Aguilar H.C. // Methods. 2018. V. 134–135. P. 87–97. https://doi.org/10.1016/j.ymeth.2017.12.011
Lippé R. // J. Virol. 2018. V. 92. P. e01765-17. https://doi.org/10.1128/JVI.01765-17
Yan X., Zhong W., Tang A., Schielke E.G., Hang W., Nolan J.P. // Anal. Chem. 2005. V. 77. P. 7673–7678. https://doi.org/10.1021/ac0508797
Arakelyan A., Fitzgerald W., Margolis L., Grivel J.-C. // J. Clin. Invest. 2013. V. 123. P. 3716–3727. https://doi.org/10.1172/JCI67042
Arakelyan A., Fitzgerald W., King D.F., Rogers P., Cheeseman H.M., Grivel J.-C., Shattock R.J., Margolis L. // Sci. Rep. 2017. V. 7. P. 948. https://doi.org/10.1038/s41598-017-00935-w
Zicari S., Arakelya A., Fitzgerald W., Zaitseva E., Chernomordik L.V., Margolis L., Grivel J.-C. // Virol. J. 2016. V. 488. P. 20–27. https://doi.org/10.1016/j.virol.2015.10.021
Руденко Н.В., Каратовская A.П., Шепеляковская А.О., Замятина А.В., Бровко Ф.А., Стрижакова О.M., Лыска В.М., Мима К.А., Иматдинов А.Р., Иматдинов И.Р., Кольцов А.Ю., Малоголовкин Н.И., Колбасов Д.В. // Биоорг. химия. 2019. Т. 45. С. 1–10. [Rudenko N.V., Karatovskaya A.P., Shepelyakovskaya A.O., Zamyatina A.V., Brovko F.A., Koltsov A.Yu., Imatdinov I.R., Imatdinov A.R., Strijakova O.M., Mima K.A., Lyska V.M., Kolbasov D.V. // Russ. J. Bioorg. Chem. 2019. V. 45. P. 505–513.] https://doi.org/10.1134/S1068162019060347
Grimes J.M., Burroughs J.N., Gouet P., Diprose J.M., Malby R., Zientara S., Mertens P.P., Stuart D.I. // Nature. 1998. V. 395. P. 470–478. https://doi.org/10.1038/26694
Hewat E.A., Booth T.F., Roy P.J. // Struct. Biol. 1992. V. 109. P. 61–69. https://doi.org/10.1016/1047-8477(92)90068-l
Lewis S.A., Grubman M.J. // Virus Res. 1990. V. 16. P. 17–26. https://doi.org/10.1016/0168-1702(90)90040-i
Wang L.F., Hyatt A.D., Whiteley P.L., Andrew M., Li J.K.-K., Eaton B.T. // Arch. Virol. 1996. V. 141. P. 111–123. https://doi.org/10.1007/BF01718592
Karatovskaya A.P., Rudenko N.V., Tsfasman I.M., Guseva K.A., Laman A.G., Boziev K.M., Brovko F.A., Vasilyeva N.V. // Proc. Biochem. 2016. V. 51. P. 1521–1526. https://doi.org/10.1016/j.procbio.2016.06.009
Руденко Н.В., Аббасова С.Г., Гришин Е.В. // Биоорг. химия. 2011. Т. 37. С. 354–360. [Rudenko N.V., Abbasova S.G., Grishin E.V. // Russ. J. Bioorg. Chem. 2011. V. 37. P. 316–321.] https://doi.org/10.1134/S1068162011030162
Verwoerd D.W., Els H.J., De Villiers E.M., Huismans H. // J. Virol. 1972. V. 10. P. 783–794. https://doi.org/10.1128/JVI.10.4.783-794.1972
Rojas J.M., Rodríguez-Martín D., Martín V., Sevilla N. // Veterinary Medicine: Research and Reports. 2019. V. 10. P. 17–27. https://doi.org/10.2147/VMRR.S163804
Martinelle L., Dal Pozzo F., Thys C., De Leeuw I., Van Campe W., De Clercq K., Thiry E., Saegerman C. // Vet. Res. 2018. V. 49. P. 63. https://doi.org/10.1186/s13567-018-0556-4
Троценко Н.И. // Практикум по ветеринарной вирусологии / Под ред. Белоусовой Р.В., Троценко Н.И., Преображенской Е.А. Москва: Колос, 2013. С. 248.
Hay F.C., Westwood O.M.R. // In: Practical Immunology, 4th ed. / Eds. Hay F.C., Westwood O.M.R., Nelson P.N. Oxford: Blackwell Science, 2002. P. 1–39, 133–134.
Velázquez-López I., León-Cruz E., Pardo J.P., Sosa-Peinado A., González-Andrade M. // Anal. Biochem. 2016. V. 516. P. 13–22. https://doi.org/10.1016/j.ab.2016.10.011
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия