Биоорганическая химия, 2022, T. 48, № 5, стр. 599-605
Биочип с агарозными микроячейками, содержащими термоотщепляемые праймеры
А. М. Золотов 1, Р. А. Мифтахов 1, А. Ю. Иконникова 1, С. А. Лапа 1, В. Е. Кузнецова 1, В. А. Василисков 1, В. Е. Шершов 1, А. С. Заседателев 1, Т. В. Наседкина 1, А. В. Чудинов 1, *
1 Институт молекулярной биологии им. В.А. Энгельгардта РАН
119991 Москва, ул. Вавилова, 32, Россия
* E-mail: chud@eimb.ru
Поступила в редакцию 17.12.2021
После доработки 28.12.2021
Принята к публикации 30.12.2021
- EDN: NPENCV
- DOI: 10.31857/S0132342322040200
Аннотация
Разработан способ иммобилизации коротких последовательностей ДНК в агарозных ячейках, закрепленных на поверхности полимерной подложки, с последующим частичным отщеплением ДНК от агарозы при нагревании с сохранением функциональных свойств. Эффективность метода была продемонстрирована на олигонуклеотидах, сохранивших после отщепления от агарозы способность участвовать в качестве праймеров в ПЦР-амплификации участка последовательности 7-го экзона гена ABO человека.
ВВЕДЕНИЕ
Амплификация нуклеиновых кислот позволяет исследовать ультрамалые количества исходного генетического материала и широко используется в молекулярно-генетических исследованиях, а также в клинической диагностике. Сочетание ПЦР и параллельного множественного анализа продуктов ПЦР стало основным трендом современных высокопроизводительных молекулярно-биологических исследований, в том числе технологии биологических микрочипов (microarray) [1] и секвенирования нового поколения (NGS) [2]. В последнее время интенсивно развивается технология микроанализа ДНК, в которой ПЦР и регистрация результатов ПЦР совмещены в одном микроустройстве [3, 4]. Направление получило название “лаборатория на чипе” (Lab on Chip) [5]. Технология “лаборатории на чипе” рассматривается как одно из основных направлений в развитии мирового тренда – диагностики на месте оказания помощи (Point-of-care Diagnostics) [6]. При реализации данного направления используют разные методические и инструментальные подходы с применением различных полимерных материалов, с последующим направленным изменением свойств поверхности и свойств материалов в результате физического, химического или биологического воздействия. Такие материалы c программируемыми свойствами стали называть “умными” (smart) материалами [7]. Метод получения прочно связанных с полимерной подложкой агарозных ячеек с иммобилизованными олигонуклеотидами, которые способны отщепляться при нагревании и участвовать в амплификации в качестве праймеров, открывает новые возможности для разработки технологий микроанализа нуклеиновых кислот “лаборатория на чипе”.
Цель данной работы – разработка метода получения кросс-сшитых агарозных ячеек, связанных ковалентными связями с полимерной подложкой и содержащих иммобилизованные термоотщепляемые от агарозы олигонуклеотиды, которые после термоотщепления могут участвовать в ПЦР в качестве праймеров.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
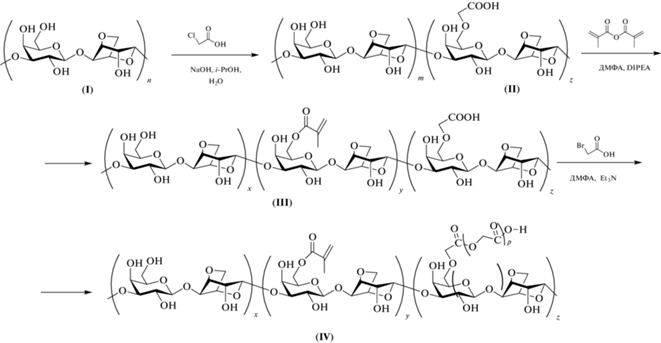
В данной работе получали карбоксиметилированную агарозу в результате реакции агарозы с хлоруксусной кислотой в щелочных условиях, затем вводили фрагменты метакриловой кислоты с помощью реакции с ангидридом метакриловой кислоты по сохранившимся гидроксильным группам. Последующая обработка бромуксусной кислотой и триэтиламином приводила к образованию связанного с агарозой полигликолевого линкера с концевой карбоксильной группой по методу, описанному в работе Pinkus [8] (схема 1 ). Условия модификации агарозы оптимизировали с контролем степени модификации агарозных звеньев углеводного полимера. Агароза после модификации сохраняет способность к термозависимому фазовому переходу плавления–гелеобразования, а добавление хаотропных реагентов позволяет регулировать температурные границы этих переходов, солюбилизировать агарозу и получать раствор при комнатной температуре.
Схема 1 . Получение карбоксиметилагарозы (II), метакрилкарбоксиметилагарозы (III) и метакрилкарбоксиполигликольагарозы (IV).
Полимерную подложку изготавливали нанесением тонкого слоя раствора циклоолефинового сополимера (ЦОС) на пленочный полиэтилентерефталат (ПЭТ) центрифугированием (spin coating) с последующим высушиванием и “свариванием” при температуре >150°С. Слой ЦОС прочно держится на поверхности ПЭТ, не отслаивается в условиях термоциклической ПЦР.
Раствор солюбилизированной модифицированной агарозы с метиленбисакриламидом и фотоинициатором бензофеноном в виде матрицы микрокапель наносили иглой робота-манипулятора на поверхность полимерной подложки при комнатной температуре (диаметр иглы 100 мкм, шаг 300 мкм). При фотооблучении происходит кросс-сшивание агарозы с образованием плотных ячеек, связанных ковалентными связями с фотоактивной поверхностью подложки. Карбоксильные группы на полигликолевых линкерах при этом сохраняются. Связывание агарозных ячеек с поверхностью ПЭТ, не покрытого ЦОС, не происходит.
После активации карбоксильные группы связывали пептидной связью с красителем NH2-Cy5, несущим первичную аминогруппу на гексаметиленовом линкере (схема 2 ), или парой олигонуклеотидов, несущих на 5'-конце первичную аминогруппу.
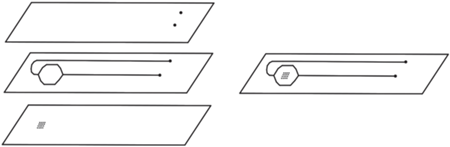
Подложку с агарозными ячейками использовали для изготовления неразборного пленочного чипа. Чип изготавливали сборкой, путем склеивания между собой слоев ПЭТ-пленки. Чип содержит внутреннюю герметичную камеру (высота 200 мкм, объем 25 мкл), в которой находятся агарозные ячейки (рис. 1). Ячейки наносили на подложку перед сборкой чипа. Подачу и удаление рабочих растворов производили через отверстия в крышке, и далее растворы по внутренним каналам поступали в камеру. Нагрев растворов в камере чипа осуществляли через подложку и крышку. Регистрацию флуоресцентных сигналов ячеек выполняли через крышку. ПЭТ не поглощает и не флуоресцирует в оптическом диапазоне флуоресценции красителя Cy5 [9, 10]. При нагревании при 95°С в ТЕ-буфере (рН 8.0) молекулы красителя, связанные с агарозными ячейками на терморасщепляемых линкерах, частично отщепляются (схема 2 ). За первые 5 мин степень отщепления составляет 42% (рис. 2 и 3). В контроле молекулы красителя, связанные с карбоксиметилированными агарозными ячейками, без специально получаемого полигликолевого линкера, в тех же условиях отщепляются меньше, степень отщепления составляет 11% (рис. 2 и 3). Олигонуклеотиды, связанные с агарозными ячейками, при нагревании также отщепляются и сохраняют специфические функции.
Схема 2 . Кросс-сшивание и контроль метакрилкарбоксиполигликольагарозы (IV) по термоотщеплению красителя NH2-Cy5.
Рис. 2.
Изображение чипа с агарозными ячейками с иммобилизованным красителем NH2-Cy5 в свете флуоресценции красителя (возбуждение 650 нм, регистрация 716 нм), полученное на флуоресцентном анализаторе биочипов. (Т–) – ячейки без термоотщепляемого линкера, (Т+) – ячейки с термоотщепляемыми линкерами до прогрева и после прогрева в течение 5 мин при 95°С в ТЕ-буфере (рН 8.0), по два ряда в четырех повторах.

Рис 3.
Средние значения флуоресцентных сигналов агарозных ячеек с иммобилизованным красителем NH2-Cy5 в свете флуоресценции красителя. (Т–) – ячейки без терморасщепляемого линкера, (Т+) – ячейки с терморасщепляемыми линкерами до и после прогрева в течение 5 мин при 95°С в ТЕ-буфере (рН 8.0).

Олигонуклеотиды, отщепившиеся от агарозных ячеек, использовали в качестве праймеров в реакции амплификации участка последовательности 7-го экзона гена ABO человека, который детерминирует серологический фенотип группы крови ABO. Все агарозные ячейки при этом сохранились на своих местах. Результаты ПЦР контролировали методом электрофореза в 2%-ном агарозном геле с окрашиванием SYBR Green. На электрофореграмме фиксировался продукт ПЦР соответствующей длины – 124 п.н. (рис. 4), что свидетельствует о сохранении специфических функций олигонуклеотидов после процедуры их иммобилизации в агарозных ячейках чипа с последующим термическим отщеплением от агарозного геля. В данном случае агарозный гель ячеек чипа выступает в роли материала с программируемыми свойствами, “умного” (smart) геля – при нагревании от агарозного геля отщепляются иммобилизованные ранее фрагменты ДНК и участвуют в ПЦР в качестве праймеров.
Рис. 4.
Электрофореграмма продуктов амплификации 7-го экзона гена ABO человека в 2%-ном агарозном геле, окрашенном SYBR Green. Длина целевого продукта – 124 п.н; 1 – Маркер длин фрагментов ДНК (pUC19/Msp I; Sileks, Россия); 2 – продукт ПЦР, полученный в камере чипа с ячейками, содержащими праймеры на терморасщепляемых линкерах; 3 – продукты ПЦР, полученные в камере чипа с ячейками, которые не активировали; 4 – продукты ПЦР, полученные в камере чипа в присутствии праймеров в растворе (положительный контроль); 5 – продукты ПЦР, полученные в камере чипа с праймерами, которые термически не отщепляются; 6 – продукты ПЦР, полученные в камере чипа без добавления матрицы (отрицательный контроль); 7 – продукты ПЦР, полученные в камере чипа без добавления ДНК-полимеразы (отрицательный контроль).

ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и оборудование. Использовали образцы бесцветной пленки кристаллического полиэтилентерефталата ПЭТ Э (ГОСТ 24234-80, плотность 1.39 г/см3, молекулярная масса 20 000–40 000, размер 25 × 75 мм, толщина 200 мкм); циклоолефиновый сополимер COC Topas 5013L-10 (Ticona GmbH, Германия); агарозу 162-0102 (Bio-Rad, США), а также геномную ДНК человека (здорового донора) из коллекции Института вакцин и сывороток им. И.И. Мечникова (Москва). В реакции амплификации использовали праймеры: прямой AB_F1 NH2-GTC CGT GGA CGT GGA CAT G и обратный AB_R NH2-CCG GCC CTC GTA GGT GAA, сконструированные с помощью сетевого ресурса Primer-Blast (www.ncbi. nlm.nih.gov/tools/primer-blast). Была использована последовательность 7-го экзона гена ABO человека (GenBank: NM_020469.3).
Флуоресцентные сигналы регистрировали на специализированном флуоресцентном анализаторе биочипов [11] разработки ИМБ РАН (Россия) при длине волны возбуждения, соответствующей Cy5 (650 нм), и запирающем фильтре 716 нм.
Карбоксиметилагароза. Агарозу (20 мг, 65.8 мкм мономерных звеньев) в смеси с i-PrOH (300 мкл) и 4 M NaOH (100 мкл) суспендировали на встряхивателе Vortex Genie 2T (Scientific Industries, США) в течение 1 ч при комнатной температуре, добавляли раствор хлоруксусной кислоты (6.2 мг, 65.8 мкм) в i-PrOH (100 мкл), прогревали при 60°С 15 мин при перемешивании на термошейкере TS-100C (Biosan, Латвия). Охлаждали до комнатной температуры, нейтрализовали ледяной уксусной кислотой, промывали 0.1 М HCl, далее последовательно промывали 50, 75 и 87.5%-ным раствором i-PrOH в воде и 100%-ным i‑PrOH, сушили в вакууме.
Метакрилаткарбоксиметилагароза. К раствору полученной карбоксиметилагарозы в DMF (500 мкл) при 4°С и перемешивании добавляли DIPEA (1.39 мкл, 8 мкм) и метакриловый ангидрид (1.23 мкл, 8.2 мкм). Смесь перемешивали 3 ч при 4°С и дополнительно 3 ч при 25°С. Продукт осаждали ацетоном, промывали 96%-ным EtOH, сушили в вакууме.
Метакрилатполигликолькарбоксиметилагароза. К раствору полученной метакрилаткарбоксиметилагарозы в DMF (500 мкл) при перемешивании добавляли Et3N (10 мкл), через 30 мин добавляли бромуксусную кислоту (15 мг, 108.6 мкм), Et3N (5 мкл) и дополнительно перемешивали 1 ч при 25°С. Продукт осаждали и многократно промывали 50%-ным EtOH, промывали последовательно 50, 75 и 87.5%-ным раствором EtOH в воде и 96%-ным EtOH, высушивали в вакууме.
Матрица ячеек кросс-сшитой модифицированной агарозы. К полученной метакрилатполигликолькарбоксиметилагарозе добавляли раствор бензофенона (2.5 мг, 0.35 мкм) и N,N'-метиленбисакриламида (5 мг, 32.4 мкм) в ДМФА (250 мкл), перемешивали 20 мин, добавляли воду (250 мкл), перемешивали. Полученный раствор модифицированной агарозы использовали для капельного нанесения иглой робота-манипулятора (QArray, Genetix, Англия) на подготовленную полимерную подложку. Подложку с матрицей агарозных капель охлаждали при –18°С в течение 30 мин, раствор при этом переходит в состояние геля. Подложку с ячейками облучали УФ-светом с помощью осветителя люминесцентного ОИ-18А с кварцевой ртутной лампой сверхвысокого давления ДРК-120 в течение 12 мин, затем многократно промывали смесью диоксан/ДМФА (1 : 1).
Активация карбоксильных групп в агарозных ячейках. Над ячейками на подложке формировали разборную камеру объемом 25 мкл. В камеру вносили 0.1 М раствор активатора TSTU и 0.1 М раствор диизопропилэтиламина (DIPEA) в 25 мкл смеси диоксан/ДМФА (1 : 1), инкубировали 1 ч при комнатной температуре, раствор удаляли, промывали смесью диоксан/ДМФА (1 : 1).
Иммобилизация красителя и олигонуклеотидов. В камеру вносили 25 мкл раствора красителя NH2-Cy5 или пары олигонуклеотидов AB_F1 и AB_R, каждый в концентрации 1 мкМ в 0.1 М карбонатном буфере (рН 9.2), инкубировали при 4°С в течение ночи, удаляли раствор, многократно промывали 30%-ным ацетонитрилом в 0.1 М триэтиламмонийацетатном (ТЕАА) буфере (рН 7.0).
Отщепление красителя от агарозных ячеек. Подложку с агарозными ячейками, в которых иммобилизован краситель Cy5, использовали для изготовления неразборного пленочного чипа. Через отверстие в крышке в камеру подавали ТЕ-буфер (рН 8.0), прогревали при 95°С. Флуоресцентные сигналы ячеек до и после прогрева регистрировали через крышку и слой жидкости при комнатной температуре на специализированном анализаторе биочипов [9] разработки ИМБ РАН (Россия) при длине волны возбуждения, соответствующей Cy5 (650 нм), и запирающем фильтре 716 нм (рис. 2).
ПЦР с олигонуклеотидами, отщепившимися от агарозных ячеек. Для изготовления пленочного чипа использовали подложку с иммобилизованными в агарозных ячейках олигонуклеотидами. Камеру чипа через отверстия в крышке заполняли реакционной смесью (30 мкл), которая содержала 1.5 ед. Taq-полимеразы (Thermo Scientific, США) в буфере той же фирмы, dNTP в концентрации 400 мкМ каждого и геномную ДНК человека в количестве 10 нг в качестве матрицы.
Реакцию проводили на ДНК-амплификаторе TGradient (Biometra, США) для in situ ПЦР при следующих условиях: 95°C – 3 мин (начальная денатурация); 36 циклов: 95°C – 20 с, 60°C – 30 с, 72°C – 40 с; далее 72°C – 5 мин (завершающая инкубация). Реакционную смесь через отверстия в крышке извлекали из чипа, упаривали в вакууме досуха, растворяли в минимальном объеме деионизированной H2O и анализировали методом электрофореза в 2%-ном агарозном геле с окрашиванием SYBR Green.
ЗАКЛЮЧЕНИЕ
Разработаны методы изготовления полимерной подложки с фотоактивной поверхностью и введения в природный полимер, агарозу, химических групп, придающих агарозе новые дополнительные свойства, с сохранением способности к термозависимому фазовому переходу плавления–гелеобразования. Добавление хаотропных реагентов позволяет солюбилизировать агарозу и получать раствор при комнатной температуре. Модифицированная агароза прибрела способность при УФ-облучении образовывать термически стойкие ячейки, прочно связываться с подложкой, ковалентно связывать олигонуклеотиды, которые могут быть отщеплены от агарозы по команде, подаваемой путем нагрева. Модификация агарозы позволяет получить “умный” гель, который выполняет подаваемую с помощью нагрева команду и отщепляет присоединенные к гелю целевые фрагменты ДНК с сохранением их функциональных свойств – они могут использоваться в ПЦР в качестве праймеров.
Разработанные методы решают часть задач, необходимых для реализации технологии изготовления матрицы закрепленных на подложке агарозных ячеек – микрореакторов, предназначенных для проведения в каждой ячейке термоциклической ПЦР с общей анализируемой смесью ДНК по единому термоциклу, но с различными парами праймеров в каждой ячейке, с изоляцией ячеек от внешней среды, исключением массообмена между ячейками при термоциклировании и одновременным микроскопическим контролем результатов.
Найденные решения могут быть использованы при разработке технологии параллельного множественного микроанализа образцов ДНК для выявления соматических и инфекционных заболеваний человека.
Список литературы
Gryadunov D., Dementieva E., Mikhailovich V., Nasedkina T., Rubina A., Savvateeva E., Fesenko E., Chudinov A., Zimenkov D., Kolchinsky A., Zasedatelev A. // Expert Rev. Mol. Diagn. 2011. V. 11. P. 839–853. https://doi.org/10.1586/erm.11.73
Mardis E.R. // Annu. Rev. Anal. Chem. 2013. V. 6. P. 287–303. https://doi.org/10.1146/annurev-anchem-062012-092628
Andreadis J.D., Chrisey L.A. // Nucleic Acids Res. 2000. V. 28. P. e5. https://doi.org/10.1093/nar/28.2.e5
Wu Z., Bai Y., Cheng Z., Liu F., Wang P., Yang D., Li G., Jin Q., Mao H., Zhao J. // Biosens. Bioelectron. 2017. https://doi.org/10.1016/j.bios.2017.05.021
Ahrberg C.D., Manz A., Chung B.G. // Lab on Chip. 2016. V. 16. P. 3866–3884. https://doi.org/10.1039/c6lc00984k
Primiceri E., Chiriacò M.C., Notarangelo F.M., Crocamo A., Ardissino D., Cereda M., Bramanti A.P., Bianchessi M.A., Giannelli G., Maruccio G. // Sensors. 2018. V. 18. P. 3607. https://doi.org/10.3390/s18113607
English M.A., Soenksen L.R., Gayet R.V., de Puig H., Angenent-Mari N.M., Mao A.S., Nguyen P.Q., Collins J.J. // Science. 2019. V. 365. P. 780–785. https://doi.org/10.1126/science.aaw5122
Pinkus A.G. // J. Polymer Sci.: Polymer Chem. Ed. 1984. V. 22. P. 1131–1140. https://doi.org/10.1002/pol.1984.170220513
Мифтаxов Р.А., Лапа C.А., Шеpшов В.Е., Заcедателева О.А., Гуcейнов Т.О., Cпицын М.А., Кузнецова В.Е., Мамаев Д.Д., Лыcов Ю.П., Баpcкий В.Е., Тимофеев Э.Н., Заcедателев А.C., Чудинов А.В. // Биофизика. 2018. Т. 63. С. 661–668. https://doi.org/10.1134/S000630291804004X
Мифтахов Р.А., Лапа С.А., Кузнецова В.Е., Золотов А.М., Василисков В.А., Шершов В.Е., Суржиков С.А., Заседателев А.С., Чудинов А.В. // Биоорг. химия. 2021. Т. 47. С. 841–844. [Miftakhov R.A., Lapa S.A., Kuznetsova V.E., Zolotov A.M., Vasiliskov V.A., Shershov V.E., Surzhikov S.A., Zasedatelev A.S., Chudinov A.V. // Russ. J. Bioorg. Chem. 2021. V. 47. P. 1345–1347.] https://doi.org/10.1134/S1068162021060182
Lysov Yu., Barsky V., Urasov D., Urasov R., Cherepanov A., Mamaev D., Yegorov Ye., Chudinov A., Surzhikov S., Rubina A., Smoldovskaya O., Zasedatelev A. // Biomed. Opt. Express. 2017. V. 8. P. 114798. https://doi.org/10.1364/BOE.8.004798
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия