Биоорганическая химия, 2022, T. 48, № 6, стр. 633-647
Перспективы использования сульфатированных полисахаридов с высоким содержанием фукозы из морских организмов в лечении и профилактике COVID-19 и постковидного синдрома
М. В. Киселевский 1, *, Н. Ю Анисимова 1, М. И. Билан 2, А. И. Усов 2, Н. Е. Устюжанина 2, А. А. Петкевич 1, И. Ж. Шубина 1, Г. Е. Морозевич 3, Н. Э. Нифантьев 2, **
1 ФГБУ “Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина” Минздрава России
115522 Москва, Каширское ш., 23, Россия
2 Институт органической химии им. Н.Д. Зелинского РАН
119991 Москва, Ленинский просп., 47, Россия
3 Научно-исследовательский институт биомедицинской химии им. В.Н. Ореховича
119121 Москва, Погодинская ул., 10, Россия
* E-mail: kisele@inbox.ru
** E-mail: nen@ioc.ac.ru
Поступила в редакцию 20.06.2022
После доработки 24.06.2022
Принята к публикации 26.06.2022
- EDN: SSYNFU
- DOI: 10.31857/S013234232206015X
Аннотация
Симптомы появившейся в 2019 г. новой коронавирусной инфекции (COVID-19) варьируют от незначительного повышения температуры тела и слабости до острой пневмонии и полиорганной недостаточности. Клиническая картина COVID-19 гетерогенна и полисистемна, поэтому для лечения необходимы лекарственные средства с широким спектром действия. До сих пор не решена проблема выбора стратегии лечения постковидного синдрома. Полисахариды с высоким содержанием фукозы, выделенные из морских водорослей и животных, могут составить основу для последующего создания перспективных агентов для лечения COVID-19 и постковидного синдрома. Этот класс биополимеров проявляет разнообразную биологическую активность, включая противовирусную, антитромботическую, антикоагулянтную, гемостимулирующую, противовоспалительную и иммунорегуляторную. Низкомолекулярные производные указанных полисахаридов, а также синтетические олигосахариды с оптимизированными параметрами (размер и структура углеводной цепи, степень сульфатирования, положение сульфатных групп) можно рассматривать как наиболее перспективные соединения из-за высокой биодоступности, что, несомненно, увеличивает их терапевтический потенциал.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ.......................................................633
ПРОТИВОКОРОНАВИРУСНАЯ АКТИВНОСТЬ СУЛЬФАТИ- РОВАННЫХ ПОЛИСАХАРИДОВ..................637
ЛЕЧЕНИЕ И ПРОФИЛАКТИКА ИММУНОСУПРЕССИИ.................................637
АНТИКОАГУЛЯНТНЫЕ СВОЙСТВА СУЛЬФАТИРОВАННЫХ ПОЛИСАХАРИДОВ.........................................638
ПРОТИВОФИБРОЗНАЯ АКТИВНОСТЬ СУЛЬФАТИ- РОВАННЫХ ПОЛИСАХАРИДОВ..................639
ПРОТИВОВОСПАЛИТЕЛЬНЫЙ ЭФФЕКТ СУЛЬФАТИ- РОВАННЫХ ПОЛИСАХАРИДОВ..................640
ЗАКЛЮЧЕНИЕ................................................641
СПИСОК ЛИТЕРАТУРЫ................................642
ВВЕДЕНИЕ
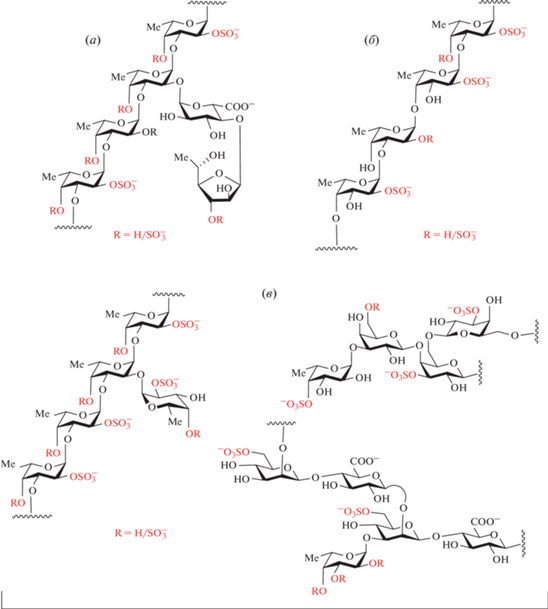
Морские водоросли и некоторые виды животных содержат сульфатированные полисахариды различной структуры. Наиболее изучены полисахариды с высоким содержанием фукозы, выделенные из иглокожих (морских ежей и морских огурцов) и бурых водорослей. Так, в стенке тела голотурий (морских огурцов) содержатся два типа указанных полисахаридов: фукозилированные хондроитинсульфаты (ФХС) и сульфатированные фуканы (СФ). ФХС – уникальные полисахариды голотурий. В основе их молекул лежит линейная цепь, построенная из чередующихся остатков N-ацетилгалактозамина и глюкуроновой кислоты, соединенных в дисахаридный блок →3)-β-D-GalNAc-(1→4)-β-D-GlcA-(1→. Строение этой цепи не отличается от строения углеводной цепи ФХС позвоночных [1], однако молекулы ФХС несут разветвления, чаще всего в виде остатков α-L-фукозы при О-3 остатков глюкуроновой кислоты. Встречаются и более сложные боковые цепи, такие как дисахаридные блоки, состоящие из остатков Fuc, Gal и GalNAc, присоединенные не только к О-3 глюкуроновой кислоты, но и также к О-4 или О-6 N-ацетил-галактозамина. Сульфатные группы обычно расположены при О-4 или О-6 (или одновременно при О-4 и О-6) остатков N-ацетил-галактозамина, занимают различные положения в остатках фукозы и иногда могут встречаться при О-2 или О-3 остатков глюкуроновой кислоты (рис. 1) [2–4]. Структуры ФХС, выделенных из различных видов голотурий, специфичны для данных видов животных [5].
Рис. 1.
Примеры фукозилированных хондроитинсульфатов (ФХС) из голотурий: (а) – полисахарид из Cucumaria japonica [2], имеющий трисахаридное повторяющееся звено, типичное для большинства известных ФХС; (б) – фрагмент углеводной цепи ФХС из Cucumaria frondosa [3], содержащий разветвления как при О-3 остатка глюкуроновой кислоты, так и при О-6 остатка N-ацетил-галактозамина; (в) – фрагмент углеводной цепи ФХС из Eupentacta fraudatrix, содержащий в качестве боковой цепи (1→2)-связанный дифукозильный остаток [4]; (г) – фрагмент другого ФХС из Eupentacta fraudatrix, содержащего 2,3-дисульфатированный остаток глюкуроновой кислоты [4]. Красным цветом выделены сульфаты в фиксированных положениях и варьируемые заместители R.
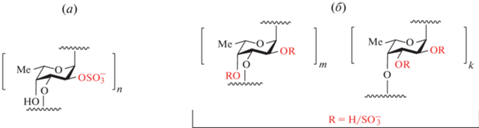
Образцы СФ были впервые получены из морских ежей. СФ – компоненты гидрофильной оболочки яйцеклеток, играющие ключевую роль в процессе оплодотворения. Цепи этих полисахаридов, как правило, линейны и построены из соединенных через (1→3)-связь остатков α-L-фукозы с различным профилем сульфатирования. Специфичное расположение сульфатных групп в цепи обычно приводит к образованию тетрасахаридного повторяющегося звена [6]. Эти полисахариды могут быть получены из морских ежей в очень ограниченных количествах, но похожие СФ вместе с ФХС присутствуют в более значимых количествах в стенке тела голотурий. СФ из голотурий более разнообразны по структуре, они представляют собой линейные цепи, построенные из (1→3)- или (1→4)-связанных остатков фукозы, которые могут содержать разветвления. Сульфатные группы в СФ могут располагаться как в основной цепи, так и в боковых звеньях (рис. 2). В одном виде морских огурцов часто обнаруживают только один тип СФ [7], но известны примеры выделения из одного вида (например, из Pattalus mollis) нескольких различных по структуре СФ [8].
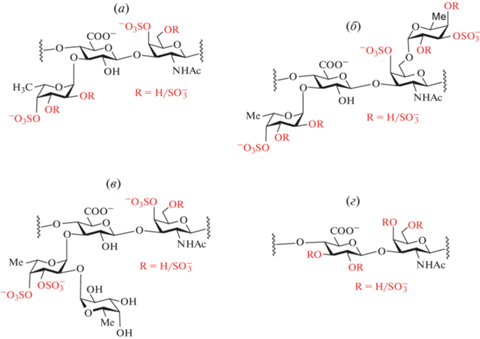
Бурые водоросли – практически неисчерпаемый источник сульфатированных полисахаридов с высоким содержанием фукозы, но эти биополимеры обычно обладают более сложным строением, чем ФХС и СФ. Наряду с остатками фукозы, они могут содержать другие моносахариды, такие как галактоза, ксилоза, манноза, глюкуроновая кислота [9]. Эти гетерогенные полисахариды были названы специфическим термином “фукоиданы”. Полисахаридная фракция, полученная из водорослей, часто представляет собой смесь различных по структуре биополимеров, у которых СФ может быть главным компонентом. Состав такой смеси зависит от вида и возраста водоросли, а также от условий произрастания. Цепи водорослевых СФ могут быть построены из повторяющихся (1→3)-связанных остатков фукозы [10] или из чередующихся (1→3)- и (1→4)-связанных фукозных звеньев [11], часто с ответвлениями в виде единичных остатков фукозы или разнообразных коротких олигосахаридов. Структурная регулярность, как правило, замаскирована произвольным расположением сульфатов или разветвлений. Полисахаридный экстракт из водорослей обычно содержит другие сульфатированные полисахариды, такие как галактофуканы, фукоглюкурономаннаны и фукоглюкуронаны [12] (рис. 3).
Сульфатированные полисахариды демонстрируют различную биологическую активность благодаря взаимодействию с белками, определяющими протекание многих физиологических процессов. Наиболее хорошо изученным примером выступает антикоагулянтное действие, подобное эффекту гепарина [13]. Поскольку фукоиданы – это нетоксичные, биосовместимые и относительно легко доступные соединения, их рассматривают как перспективную основу для разработки новых медицинских препаратов с противовирусной, противовоспалительной, противоопухолевой, иммуномодулирующей и антикоагулянтной активностью. Уже опубликованы сотни статей, посвященных потенциальному терапевтическому эффекту фукоиданов и других полисахаридов с высоким содержанием фукозы [14–20].
Биологическое действие фукоиданов связывают, в первую очередь, с их высокой степенью сульфатирования, хотя другие тонкие детали структуры и молекулярный вес также играют существенную роль. Детальный структурный анализ фукоиданов чрезвычайно сложен из-за нерегулярности и гетерогенности их структуры [9]. Важно отметить, что большинство опубликованных биологических исследований фукоиданов было выполнено с использованием коммерческих образцов, которые получают без специальной очистки и подтверждения химического строения. В результате точная корреляция между структурой и биологической активностью таких продуктов не может считаться корректно установленной.
Большинство работ, предметом которых выступает биологическая активность сульфатированных фукозосодержащих полисахаридов, посвящены характеристике их антикоагулянтного и антитромботического действия [21–23]. Однако недавно противовирусная активность этих полисахаридов, сходная с действием гепарина [24], привлекла повышенное внимание из-за пандемии, вызванной вирусом SARS-CoV-2 (коронавирус тяжелого острого респираторного синдрома 2) [25–31]. Детальное рассмотрение этой проблемы представлено в данном обзоре.
Клиническая картина COVID-19 варьирует от бессимптомного течения заболевания до потенциально опасной для жизни пневмонии, которая в конечном итоге может привести к острому респираторному дистресс-синдрому (ОРДС) [32, 33]. Хотя большинство случаев COVID-19 можно отнести к легкой или средней степени, тем не менее ~15% составляют тяжелые заболевания, требующие кислородной поддержки, и ~5% – критические заболевания, требующие искусственной вентиляции легких. SARS-CoV-2 инфицирует различные клетки, включая альвеолярные макрофаги, что активирует их и вызывает развитие цитокинового шторма [34, 35].
Исследования показали, что COVID-19 может значительно влиять на гемопоэз и иммунную систему, приводя к лимфопении, тромбоцитопении, дисфункции нейтрофилов и анемии [36–39]. В настоящее время для лечения COVID-19 используются лекарственные препараты с различным механизмом действия, которые наряду с клинической эффективностью могут вызывать нежелательные явления. Особая проблема заключается в разработке тактики лечения постковидного синдрома у больных, требующих длительной сопроводительной терапии. Поэтому природные препараты привлекают значительное внимание, поскольку они содержат биологически активные соединения, которые можно использовать для разработки лекарств с широким спектром биологической активности с минимальными побочными эффектами [40]. Один из перспективных классов природных соединений – фукоиданы, обладающие целым спектром свойств: антиоксидантной, противовоспалительной, иммунорегулирующей, антифиброзной, противовирусной и антикоагулянтной активностью, которые уже отмечались выше, а также способностью стимулировать гемопоэз [41]. Проведенные в последнее время исследования свидетельствуют о возможном терапевтическом потенциале фукоиданов при лечении COVID-19 и профилактике постковидного синдрома [17, 42, 43]. Этому вопросу отчасти посвящен и недавний обзор Pradhan et al. [44], однако в нем не рассматриваются гемостимулирующая, антифиброзная, антикоагулянтная и противовоспалительная активность фукоиданов, которые проанализированы в нашем обзоре.
ПРОТИВОКОРОНАВИРУСНАЯ АКТИВНОСТЬ СУЛЬФАТИРОВАННЫХ ПОЛИСАХАРИДОВ
Коронавирусы SARS, несмотря на разнообразие, обладают общими функциональными элементами, в том числе гликопротеинами Spike (SGP, Spike glycoprotein, S-белок, S-гликопротеин), образующими характерные “шипы” на поверхности вируса, которые придают ей вид короны, определившей название этой группы вирусов. Ранее считалось, что взаимодействие S-белка с ангиотензин-превращающим ферментом 2 (angiotensin-converting enzyme 2, ACE2) – начальный этап инфицирования [40, 45–47], но в последнее время выяснено, что инфицирование начинается со взаимодействия S-белка с гепарансульфатом [24, 48], экспонированном на поверхности моноцитов и макрофагов. Вирус SARS-CoV-2 может проникать в клетку организма-хозяина также за счет взаимодействия S-гликопротеина с еще одним рецептором – нейропилином-1 (NRP1) [41, 42, 49, 50].
Ингибирование взаимодействия S-гликопротеинов SARS-CoV-2 с гепарансульфатом и ACE2 с помощью сульфатированных полисахаридов, фукоиданов, хондроитинсульфатов, фукозилированных хондроитинсульфатов и других полисахаридов, в настоящее время активно изучается в специализированных лабораториях для создания средств профилактики и лечения COVID-19. Например, в опытах in vitro было показано, что фракции фукоиданов RPI-27 (100 кДа) и RPI-28 (~12 кДа) из морской водоросли Saccharina japonica специфически и эффективно связываются с S‑белком SARS-CoV-2 и, вероятно, тем самым могут препятствовать связыванию S-белка с гепарансульфатом на клетках организма-хозяина и подавлять вирусную инфекцию [25]. Предполагается, что противовирусный эффект фукоиданов аналогичен ранее описанному действию гепаринов [51]. При этом полисахариды из Saccharina japonica эффективнее ингибировали связывание с S-белком SARS-CoV-2, чем гепарин, и не оказывали цитотоксического действия на клетки линии Vero [25].
Установлено, что противовирусная активность зависит от молекулярной массы и степени сульфатирования полисахаридов. Так, фукоиданы с более высокой молекулярной массой и уровнем сульфатирования проявляли более выраженную вирус-ингибирующую активность. Таким образом, молекулярная масса и уровень сульфатирования – это два важных фактора, определяющие противовирусную активность фукоиданов, что было продемонстрировано на примерах и других полисахаридов [26]. Противовирусная активность фукоиданов ранее была показана по отношению к другим возбудителям, таким как вирус гриппа A, вирус гепатита B, вирус чумы собак и вирус иммунодефицита человека [30, 52, 53].
ЛЕЧЕНИЕ И ПРОФИЛАКТИКА ИММУНОСУПРЕССИИ ПРИ COVID-19
При тяжелых формах COVID-19, как и при других инфекциях и сепсисе, обычно наблюдается глубокая иммунная дисрегуляция, характеризующаяся переходом от гипервоспалительных состояний к иммуносупрессии. Аналогичные механизмы были описаны для тяжелой формы COVID-19 с присоединением вторичной инфекции [54]. Тяжелая форма COVID-19 характеризуется появлением предшественников нейтрофилов, что свидетельствует об экстренном миелопоэзе (emergency myelopoiesis) [55]. Этот процесс характеризуется мобилизацией незрелых миелоидных клеток, что приводит к иммуносупрессии и, соответственно, к резкому снижению противоинфекционной функции иммунитета [56]. При COVID-19 отмечается тесная корреляция тяжести заболевания и выраженности лимфопении. У инфицированных детей редко наблюдается лимфопения и смертность близка к нулю, в то время как у лиц пожилого возраста лимфопения встречается чаще, особенно в тяжелых случаях, и смертность от COVID-19 высокая. Было обнаружено, что повышенное отношение нейтрофилов к лимфоцитам, соотношение моноцитов и лимфоцитов и повышенные уровни цитокинов, таких как растворимый рецептор интерлейкина-2 (IL-2R), а также отношение IL-2R к количеству лимфоцитов коррелируют с тяжестью заболевания и неблагоприятным прогнозом [57]. У пациентов с тяжелой формой COVID-19 отмечали истощение лимфоидных клеток-предшественников костного мозга и накопление незрелых клеток. Эти данные свидетельствуют о том, что тяжелые формы COVID-19 приводят к нарушению регуляции кроветворения в костном мозге [58].
Лимфопения на фоне тяжелых форм COVID-19 сопровождается резким снижением числа естественных киллеров (NK) и активированных CD8+-Т-клеток – основных эффекторов противоинфекционного иммунитета [59]. В частности, NK-клетки проявляют противовирусную активность, снижая количество клеток, инфицированных SARS-CoV-2, а также продуцируют противовирусный цитокин IFN-γ.
Помимо противовирусной активности, IL-2-активированные NK-клетки также ограничивают фиброз тканей, снижая экспрессию генов профибротических маркеров COL1A1 и ACTA2 в фибробластах легких человека [60]. Функция NK- и CD8+-Т-клеток истощена у пациентов с COVID-19, а у выздоравливающих количество NK- и CD+-Т-клеток восстанавливается. Эти факты позволяют предположить, что функциональное истощение цитотоксических лимфоцитов связано с инфекцией SARS-CoV-2. Следовательно, инфекция SARS-CoV-2 может нарушить противовирусный иммунитет уже на ранней стадии [61, 62]. Было высказано предположение, что SARS-CoV-2 вследствие взаимодействия с рецепторами ACE2, CD147 и CD26 эритроцитов вызывает гемолиз и, соответственно, гипохромную анемию [63, 64]. Дисфункция гемопоэза в виде снижения числа лимфоидных предшественников и накопления незрелых и дисфункциональных фагоцитов в костном мозге, а также признаки тромбоцитопении и анемии требуют проведения коррекции несбалансированной дифференцировки клеток костного мозга.
Перспективным кандидатом на роль иммунокорректоров могут быть сульфатированные полисахариды и олигосахариды, большинство из которых безопасны, о чем свидетельствуют данные острой и хронической токсичности [65]. Ряд исследований продемонстрировал иммуностимулирующий эффект пероральных полисахаридов у взрослых людей. Например, при потреблении здоровыми взрослыми фукоиданов из бурой водоросли Undaria pinnatifida наблюдались как иммуностимулирующий, так и подавляющий эффекты, включая увеличение содержания стромального фактора-1, IFN-γ, CD34+-клеток и CXCR4-экспрессирующих CD34+-клеток, а также снижение числа лейкоцитов и лимфоцитов в крови [66].
Фукоидан из водоросли Chordaria flagelliformis активирует поглощение бактерий и дрожжей нейтрофилами (начальная фаза фагоцитоза), но не опосредованную кислородзависимыми механизмами деструкцию фагоцитированных микроорганизмов (завершение фагоцитоза). Эту особенность действия полисахарида на нейтрофилы можно рассматривать как стимулирующее влияние на клеточный противоинфекционный иммунитет, исключающее избыточное выделение активных радикалов кислорода, которые способны вызывать повреждение органов и тканей [67]. В данных условиях также отмечена стимуляция цитотоксической активности NK-клеток. Молекулярный механизм стимулирующего действия фукоидана из C. flagelliformis на эффекторы противоинфекционного иммунитета реализуется с участием интегрина CD11c. Способность стимулировать активность NK-клеток, как и в случае нейтрофилов, опосредована активацией экспрессии мембраносвязанных молекул CD11c в NK-клетках, обеспечивающих контакт эффекторов с клетками-мишенями.
Ряд исследований показал, что сульфатированные полисахариды обладают, наряду с низкой токсичностью, способностью стимулировать кроветворение. Недавно было обнаружено, что фукан, выделенный из морского огурца Holothuria polii, ускорял восстановление количества лейкоцитов (в том числе нейтрофилов) у мышей после воздействия циклофосфамида [68]. Авторы также отмечают тенденцию к восстановлению числа эритроцитов. Ранее мы наблюдали аналогичные эффекты для фукоидана из бурой водоросли C. flagelliformis [10] и фукозилированного хондроитинсульфата из морского огурца Massinium magnum [69], а также для их модифицированных производных [70, 71]. Кроме того, показано, что исследуемые полисахариды способны восстанавливать пролиферативный потенциал гемопоэтических стволовых клеток костного мозга. Учитывая способность фукоиданов и фукозилированных хондроитинсульфатов стимулировать гемопоэз и уменьшать проявления иммуносупрессии, а также их способность снижать уровень IL-6, представляется целесообразным изучение этих полисахаридов и их производных с точки зрения потенциала данных соединений в комплексной профилактике и иммуносупрессивной терапии у больных COVID-19 [41].
АНТИКОАГУЛЯНТНЫЕ СВОЙСТВА СУЛЬФАТИРОВАННЫХ ПОЛИСАХАРИДОВ
Тромботические осложнения – одна из основных причин неблагоприятных исходов COVID-19 [72]. Гиперкоагуляция связана с прямым действием вируса SARS-CoV-2 и развитием цитокинового шторма [73]. У пациентов с COVID-19 наблюдается тромбоцитоз, повышенный уровень D-димера, продукта деградации фибрина, что коррелирует с тяжестью заболевания и плохим прогнозом [74]. Показано, что частота тромботических осложнений у пациентов с тяжелым течением COVID-19, находящихся в отделениях интенсивной терапии, может достигать 79% [75, 76]. Кроме того, патоморфологическое исследование пациентов, умерших от COVID-19, показало, что у 58% были недиагностированные тромбозы глубоких вен, при этом непосредственной причиной смерти в ряде случаев была массивная легочная эмболия [77]. Поэтому тромбопрофилактика стала неотъемлемой частью терапевтического метода лечения COVID-19. Однако до настоящего времени окончательно не решен вопрос о выборе антикоагулянта, дозы и длительности антикоагулянтной терапии для пациентов с COVID-19. Кроме того, до конца не ясно, необходима ли антикоагулянтная терапия для амбулаторных пациентов и выздоравливающих больных [78].
Вместе с тем у пациентов с постковидным синдромом нередко развивается коагулопатия в виде тромботических явлений, что требует длительного применения антикоагулянтов [79]. Хотя такие препараты снижают риск органной и полиорганной недостаточности и смерти при коронавирусной инфекции, у критически больных пациентов гепарин в терапевтических дозах не улучшал исходы заболевания и с высокой вероятностью вызывал развитие побочных эффектов [80, 81]. Наиболее значимое нежелательное последствие антикоагулянтной терапии – индуцируемая гепарином тромбоцитопения (heparin-induced thrombocytopenia, HIT) – иммуноопосредованное осложнение, приводящее к транзиторной тромбоцитопении, сопровождающейся протромботическим состоянием [82].
Применение нефракционированного гепарина (unfractionated heparin, UFH) или низкомолекулярного гепарина (low-molecular-weight heparin, LMWH) показано госпитализированным пациентам с COVID-19, однако их широкое применение может привести к увеличению частоты HIT из-за гиперстимуляции иммунитета, связанной с COVID-19 [83]. Однако до настоящего времени нет четкого представления о необходимости продолжительной антикоагулянтной терапии у выздоравливающих больных. На этом этапе лечения пероральные антикоагулянты предпочтительнее парентеральных антикоагулянтов для удобства пациента. Вместе с тем предлагается избегать длительной антикоагулянтной терапии для снижения риска развития кровотечений [84]. Растущая частота тромбозов во время и после инфекции COVID-19 требует дальнейшего изучения предполагаемых механизмов тромбозов и поиска новых методов лечения.
Многочисленные исследования свидетельствуют о том, что сульфатированные полисахариды, подобно гепарину, обладают антикоагулянтной и антитромботической активностью, что позволяет рассматривать этот класс соединений в качестве перспективных препаратов для профилактики тромбозов [85]. Механизмы антикоагулянтной и антитромботической активности сульфатированных фукоиданов из морских водорослей включают воздействие на факторы внешнего и внутреннего путей свертывания крови [86]. Несмотря на сходство эффектов, механизм антитромботического действия фукоидана отличается от такового у гепарина и включает воздействие на завершающий этап свертывания – превращение фибриногена в фибрин под влиянием тромбина. При этом важная особенность низкомолекулярных фракций фукоиданов, обладающих антитромботическим эффектом при венозном и артериальном тромбозе, – низкий геморрагический риск [87]. Эта особенность фукоиданов может иметь большое значение для проведения длительной антикоагулянтной терапии при COVID-19 и у пациентов с постковидным синдромом, склонных к геморрагическим реакциям. Установлено, что низкомолекулярный фукоидан оказывает заметное ингибирующее действие на индуцированную тромбином агрегацию тромбоцитов in vivo и in vitro, в то время как эти полисахариды со средней молекулярной массой могут стимулировать агрегацию тромбоцитов человека in vitro и не оказывают значительного ингибирующего действия на индуцированную тромбином агрегацию тромбоцитов у крыс. Это свидетельствует о перспективности низкомолекулярных фукоиданов и родственных синтетических олигосахаридов [88, 89] в качестве потенциальных антитромботических агентов при терапии COVID-19 и постковидного синдрома.
ПРОТИВОФИБРОЗНАЯ АКТИВНОСТЬ СУЛЬФАТИРОВАННЫХ ПОЛИСАХАРИДОВ
Фиброз легких – одно из основных осложнений у пациентов с COVID-19. Патогенез постинфекционного легочного фиброза включает повреждение легочного эпителия и эндотелия сосудов с неконтролируемой фибропролиферацией, а также нарушение регуляции высвобождения матричных металлопротеиназ во время воспалительной фазы ОРДС. Существует также сосудистая дисфункция, выступающая ключевым моментом перехода от ОРДС к фиброзу, с вовлечением фактора роста эндотелия сосудов (VEGF) и цитокинов, таких как IL-6 и TNF-α. Пораженный вирусом эпителий способствует высвобождению медиаторов воспаления посредством активации нейтрофилов и макрофагов, которые управляют активацией, миграцией, пролиферацией и дифференцировкой фибробластов, что приводит к продукции компонентов внеклеточного матрикса и разрушению легочной архитектуры [87]. Кроме того, наблюдается трансдифференцировка эпителиальных клеток в фибробластоподобные клетки – эпителиально-мезенхимальный переход [90, 91]. Его основной индуктор – трансформирующий фактор роста-β1 (TGF-β1), хотя различные цитокины, хемокины и факторы роста также вовлечены в этот процесс [92]. Несмотря на то что в настоящее время существуют антифибротические препараты (пирфенидон и нинтеданиб), их эффективность при COVID-19 требует дальнейших исследований [93, 94].
В целом ряде работ было показано, что фукоиданы обладают способностью предотвращать развитие фиброза легких. В частности, в одном из первых исследований в данном направлении было продемонстрировано, что фракция сульфатированных олигосахаридов MS80 со средней молекулярной массой 8 кДа, выделенная из морских водорослей, ингибировала развитие фиброза легких у крыс, индуцированного блеомицином, без признаков токсичности. Применение MS80 приводило к уменьшению патологических параметров и снижению содержания коллагена в легких за счет конкурентного ингибирования взаимодействия с TGF-β1 и угнетения активности матриксной металлопротеиназы [95].
При использовании низкомолекулярной фракции фукоидана из бурых водорослей Saccharina japonica также наблюдалось значительное ингибирование блеомицин-индуцированного легочного фиброза у мышей линии C57BL/6 за счет снижения уровня экспрессии TGF-β1, ингибирования эпителиально-мезенхимального перехода, снижения экспресии E-кадгерина и фибронектина [96]. Фукоидан, выделенный из Sargassum hemiphyllum, ингибировал проявление постлучевого фиброза легких у мышей линии C57BL/6, получавших облучение (10 Гр/выстрел) [91]. Введение этого фукоидана значительно ослабляло отложение коллагена 1α, инфильтрацию ткани легких нейтрофилами и макрофагами, а также вызывало снижение экспрессии провоспалительных цитокинов и хемокинов (TIMP-1, CXCL1, MCP-1, MIP-2, IL-1RA, TREM-1, SDF-1/CXCL12, IL-16) в плевральном выпоте, индуцированном облучением [97].
Необходимо отметить, что легочные макрофаги экспрессируют несколько фиброзных медиаторов и играют важную роль в развитии фиброза. Их в настоящее время подразделяют на два фенотипа: классически активированные макрофаги (M1) с секрецией Th1-связанных цитокинов (включая TNF-α, IL-1β и IL-6) и альтернативно активированные макрофаги (M2) с высвобождением Th2-связанных цитокинов, таких как IL-10 и IL-13. При этом способность к миграции и инвазии макрофагов M1 и M2 поддерживается хемотаксическим белком 1 моноцитов (MCP-1), хемокин в основном экспрессируется в альвеолярных макрофагах и участвует в хемотаксисе клеток [98]. Введение фукоидана, выделенного из Sargassum hemiphyllum, мышам с лучевым пневмонитом значительно снижало продукцию активированными макрофагами провоспалительных цитокинов (TNF-α, IL-1β, IL-6) и продукцию коллагена фибробластами, что коррелировало со снижением инфильтрации нейтрофилами и макрофагами ткани легких. Низкомолекулярный фукоидан, выделенный из Laminaria japonica, нивелировал проявления фиброза и воспалительных факторов в легочной ткани у мышей, стимулированных блеомицином, за счет снижения экспрессии β-катенина, TGF-β, TNF-α и IL-6. Кроме того, этот фукоидан блокировал развитие эпителиально-мезенхимального перехода, индуцированное TGF-β1, посредством ингибирования сигнальных путей TGF-β/Smad и PI3K/AKT.
Таким образом, многочисленные экспериментальные исследования свидетельствуют о том, что фукоиданы воздействуют на все основные звенья патогенеза фиброза легких, нивелируя воспалительный каскад и ослабляя процесс формирования межклеточного матрикса. Эти данные позволяют рассматривать фукоиданы как основу для создания многообещающего терапевтического агента для лечения и профилактики постковидного фиброза легких [99, 100].
ПРОТИВОВОСПАЛИТЕЛЬНЫЙ ЭФФЕКТ СУЛЬФАТИРОВАННЫХ ПОЛИСАХАРИДОВ
В патогенезе COVID-19 значительную роль играет чрезмерная реакция иммунного ответа, называемая цитокиновым штормом. Цитокиновый шторм характеризуется гиперпродукцией провоспалительных цитокинов, приводящей к развитию острого респираторного дистресс-синдрома и полиорганной недостаточности, выступающих основными причинами смерти [101, 102]. Критическая роль цитокинового шторма согласуется с благоприятным исходом при введении стероидов, а также ингибиторов или блокаторов рецепторов IL-6 у пациентов на фоне инфекции SARS-CoV-2 [103]. Однако использование стероидов и ингибиторов IL-6 или его рецепторов у пациентов с COVID-19 может вызывать иммуносупрессию, а следовательно, способствовать угнетению противовирусного иммунитета и приводить к развитию вторичных бактериальных и грибковых инфекций [104, 105]. При этом у пациентов с COVID-19 и вторичной инфекцией в несколько раз увеличивается вероятность летального исхода.
Другой механизм чрезмерной воспалительной реакции – оксидативный стресс, индуцируемый продукцией свободных радикалов фагоцитами в ответ на вирусную инфекцию. Это, в свою очередь, стимулирует макрофаги продуцировать цитокин IL-6, формируя “порочный круг” [106]. Высокий уровень IL-6 и других воспалительных маркеров, включая C-реактивный белок, ферритин, D-димер и лактатдегидрогеназу, коррелирует с высоким риском летального исхода [107]. Появляются новые данные, указывающие на то, что тяжелое течение инфекции SARS-CoV-2 вызывает нарушение кишечного барьера вследствие инфицирования вирусом энтероцитов и активации врожденного и адаптивного иммунитета, способствуя системному распространению бактерий и/или микробных продуктов. Транслокация микробных продуктов из желудочно-кишечного тракта в периферическую кровь может усиливать гипервоспалительное состояние и тяжесть течения COVID-19 [108–110] за счет активации макрофагов в инфицированной ткани и поддержания цитокинового шторма во время инфекции SARS-CoV-2 [111]. Это положение подтверждается тем, что у больных COVID-19 в критических состояниях наблюдалось значительное увеличение количества бактериального липополисахарида (LPS) и растворимого рецептора sCD14, связанное с повышенными системными уровнями IL-6, TNF-α, CCL5/RANTES и CCL2/MCP-1 [112].
Таким образом, нарушение функции кишечного барьера может быть одним из механизмов, которые способствуют присутствию бактериального токсина и бактериальной ДНК в крови пациентов с тяжелой формой COVID-19 [112]. Кишечная бактериальная транслокация может играть аддитивную/синергетическую роль в синдроме высвобождения цитокинов, лежащего в основе неблагоприятного развития COVID-19 [113].
Фукоиданы обладают выраженной противовоспалительной активностью [114] и действуют на различные стадии воспалительного процесса. Один из возможных механизмов действия фукоидана – подавление сигнальных путей MAPK и NF-κB, последующее снижение продукции провоспалительных цитокинов и ингибирование активности селектинов [115]. Фукоиданы снижают секрецию провоспалительных медиаторов макрофагами в ответ на действие LPS. Так, было показано, что фракции фукоидана из Fucus vesiculosus угнетают секрецию TNF-α и IL-1β и ингибируют нейтрофильную инфильтрацию, что свидетельствует о способности фукоиданов подавлять ранние стадии воспаления [116]. Другое исследование показало, что фукоидан снижает LPS-индуцированную продукцию оксида азота макрофагами по типу действия противовоспалительного цитокина IL-10 [117].
Фукоиданы могут конкурировать с бактериальным эндотоксином за связывание с Toll-подобными рецепторами и снижать эффект стимуляции LPS [118–120], а также ингибировать синтез PGE2 и провоспалительных медиаторов, таких как TNF-α, IL-1β и IL-6 [121]. В частности, фракционированные фукоиданы из Ecklonia cava значительно снижали продукцию NO и уровни TNF-α, IL-1β и IL-6 LPS-стимулированными макрофагами [122]. Показано, что фукоиданы из бурой водоросли Sargassum horneri снижают продукцию NO, PGE2 и провоспалительных цитокинов TNF-α и IL-6 макрофагами мыши, обработанными LPS [123, 124]. Другие авторы [125] сообщили об ингибировании рекомбинантной циклооксигеназы человека COX-1 фукоиданом из Fucus vesiculosus in vitro. Фукоидан, полученный из Undaria pinnatifida, уменьшал воспаление при экспериментальном артрите, вызванном введением адъюванта Фрейнда у крыс [126].
Противовоспалительная активность фукоидана из бурых водорослей in vitro может быть связана с угнетением синтеза NO и экспрессии iNOS, снижением секреции PGE2, TNF-α, IL-1β, IL-6 и IL-8. Исследования in vivo показали, что противовоспалительный эффект фукоидана может быть связан со снижением уровней сывороточных IL-1α, IL-1β, IL-6, IL-10, TNF-α, IFN-γ, PGE2, TGF-β1, миелопероксидазы, уменьшением продукции свободных радикалов, ингибированием миграции нейтрофилов и повышением уровня IL-10 [127]. Фукоиданы из Macrocystis pyrifera снижали экспрессию провоспалительных цитокинов, индуцированных LPS. Примечательно, что полисахарид с наименьшей молекулярной массой был наиболее мощным ингибитором TNF-α и IL-1β при стимуляции LPS лимфоидных клеток человека. При пероральном введении фукоиданы, как показано в опытах на мышах с экспериментальным колитом, могут снижать уровни провоспалительных цитокинов, включая TNF-α, IL-1β и IL-6 [128, 129]. Ингибирование воспалительного каскада подтверждает потенциальную терапевтическую роль фукоиданов в качестве противовоспалительных препаратов при терапии больных COVID-19.
ЗАКЛЮЧЕНИЕ
Сульфатированные высоко- и низкомолекулярные полисахариды, содержащие значительное количество фукозных звеньев, обладают широким спектром биологических свойств, включая противовирусную, противофиброзную, антикоагулянтную, гемостимулирующую, противовоспалительную и иммуннокоррегирующую активность, что позволяет рассматривать этот класс биополимеров в качестве основы для создания лекарственных средств лечения и профилактики COVID-19 и постковидного синдрома. Наиболее перспективны низкомолекулярные фукоиданы и другие полисахариды, поскольку они демонстрируют высокую скорость абсорбции и биодоступность, что подтверждает их биологический потенциал [30, 130]. Данные о строении этих полисахаридов позволяют провести дизайн структурно родственных олигосахаридов строго определенного строения, которые с использованием имеющихся на сегодняшний день методов [88, 89, 131] могут быть произведены в промышленных масштабах с соблюдением стандартов качества фармацевтического производства.
Ключевой вопрос, который пока еще ждет своего решения, связан с необходимостью детального выяснения механизма биологического действия рассматриваемых полисахаридов. Очевидно, что он связан с их способностью выступать в роли миметиков биологически значимых сиалилированных и сульфатированных олигосахаридных цепей, представленных на поверхности клеток человека. Отметим, что ферментативное получение [132] и химический синтез такого рода соединений, особенно сиалилированных, представляют достаточно сложную задачу [132–135]. Это делает сульфатированные фукоолигосахариды, которые более доступны для препаративного получения, чем названные выше клеточные олигосахариды, перспективной основой в создании лекарственных средств для лечения и профилактики COVID-19 и постковидного синдрома.
Список литературы
Pomin V.H. // Mar. Drugs. 2014. V. 12. P. 232–254. https://doi.org/10.3390/md12010232
Ustyuzhanina N.E., Bilan M.I., Dmitrenok A.S., Shashkov A.S., Kusaykin M.I., Stonik V.A., Nifantiev N.E., Usov A.I. // Glycobiology. 2016. V. 26. P. 449–459. https://doi.org/10.1093/glycob/cwv119
Ustyuzhanina N.E., Bilan M.I., Dmitrenok A.S., Nifantiev N.E., Usov A.I. // Carbohydr. Polym. 2017. V. 165. P. 7–12. https://doi.org/10.1016/j.carbpol.2017.02.003
Ustyuzhanina N.E., Bilan M.I., Dmitrenok A.S., Nifantiev N.E., Usov A.I. // Carbohydr. Polym. 2017. V. 164. P. 8–12. https://doi.org/10.1016.j.carbpol.2017.01.034
Ustyuzhanina N.E., Bilan M.I., Nifantiev N.E., Usov A.I. // Pure Appl. Chem. 2019. V. 91. P. 1065–1071. https://doi.org/10.1515/pac-2018-1211
Pereira M.S., Mulloy D., Mourão P.A.S. // J. Biol. Chem. 1999. V. 274. P. 7656–7667. https://doi.org/10.1074/jbc.274.12.7656
Ustyuzhanina N.E., Bilan M.I., Dmitrenok A.S., Borodina E.Yu., Nifantiev N.E., Usov A.I. // Carbohydr. Res. 2018. V. 456. P. 5–9. https://doi.org/10.1016/j.carres.2017.12.00
Ma Y., Gao N., Zuo Z., Li S., Zheng, W., Shi X., Liu Q., Ma T., Yin R., Li X., Zhao J. // Int. J. Biol. Macromol. 2021. V. 186. P. 535–543. https://doi.org/10.1016/j.ijbiomac.2021.07.049
Usov A.I., Bilan M.I. // Russ. Chem. Rev. 2009. V. 78. P. 785–799. https://doi.org/10.1070/RC2009v078n08ABEH004063
Bilan M.I., Vinogradova E.V., Tsvetkova E.A., Grachev A.A., Shashkov A.S., Nifantiev N.E., Usov A.I. // Carbohydr. Res. 2008. V. 343. P. 2605–2612. https://doi.org/10.1016/j.carres.2008.06.001
Bilan M.I., Grachev A.A., Ustuzhanina N.E., Shashkov A.S., Nifantiev N.E., Usov A.I. // Carbohydr. Res. 2002. V. 337. P. 719–730. https://doi.org/10.1016/S0008-6215(02)00053-8
Bilan M.I., Grachev A.A., Shashkov A.S., Kelly M., Sanderson C.J., Nifantiev N.E., Usov A.I. // Carbohydr. Res. 2010. V. 345. P. 2038–2047. https://doi.org/10.1016/j.carres.2010.07.009
Casu B., Naggi A., Torri G. // Carbohydr. Res. 2015. V. 403. P. 60–68. https://doi.org/10.1016/j.carres.2014.06.023
Fitton J.H. // Mar. Drugs. 2011. V. 9. P. 1731–1760. https://doi.org/10.3390/md9101731
Fitton J.H., Stringer D.N., Karpiniec S.S. // Mar. Drugs. 2015. V. 13. P. 5920–5946. https://doi.org/10.3390/md13095920
Fitton J.H., Stringer D.N., Park A.Y., Karpiniec S.S. // Mar. Drugs. 2019. V. 17. P. 571. https://doi.org/10.3390/md17100571
Luthuli S., Wu S.Y., Cheng Y., Zheng X.L., Wu M.J., Tong H.B. // Mar. Drugs. 2019. V. 17. P. 487. https://doi.org/10.3390/md17090487
Yangt J.-Y., Lim S.Y. // Mar. Drugs. 2021. V. 19. P. 436. https://doi.org/10.3390/md19080436
Fonseca R.J.C., Mourão P.A.S. // Mar. Drugs. 2021. V. 19. P. 425. https://doi.org/10.3390/md19080425
Xu Y., Zhou Q., Liu B., Chen F., Wang M. // Carbohydr. Polym. 2022. V. 275. P. 118691. https://doi.org/10.1016/j.carbpol.2021.11869
Mourão P.A.S. // Mar. Drugs. 2015. V. 13. P. 2770–2784. https://doi.org/10.3390/md13052770
Li H., Yuan Q., Lv K., Ma H., Gao C., Liu Y., Zhang S., Zhao L. // Carbohydr. Polym. 2021. V. 251. P. 117034. https://doi.org/10.1016/j.carbpol.2020.117034
Ustyuzhanina N.E., Ushakova N.A., Zyuzina K.A., Bilan M.I., Elizarova A.L., Somonova O.V., Madzhuga A.V., Krylov V.B., Preobrazhenskaya M.E., Usov A.I., Kiselevskiy M.V., Nifantiev N.E. // Mar. Drugs. 2013. V. 11. P. 2444–2458. https://doi.org/10.3390/md11072444
Kim S.Y., Jin W., Sood A., Montgomery D.W., Grant O.C., Fuster M.M., Fu L., Dordick J.S., Woods R.J., Zhang F. // Antiviral Res. 2020. V. 181. P. 104873. https://doi.org/10.1016/j.antiviral.2020.104873
Kwon P.S., Oh H., Kwon S.-J., Jin W., Zhang F., Fraser K., Hong J.J., Linhardt R.J., Dordick J.S. // Cell Discovery. 2020. V. 6. P. 50. https://doi.org/10.1038/s41421-020-00192-8
Jin W., Zhang W., Mitra D., McCandless M.G., Sharma P., Tandon R., Zhang F., Linhardt R.J. // Int. J. Biol. Macromol. 2020. V. 163. P. 1649–1658. https://doi.org/10.1016/j.ijbiomac.2020.09.184
Lu W.J., Yang Z.F., Chen J., Wang D., Zhang Y. // Carbohydr. Polym. 2021. V. 272. P. 118526. https://doi.org/10.1016/j.carbpol.2021.118526
Salih A.E.M., Thissera D., Yaseen M., Hassane A.S.I., El-Seedi H.R., Sayed A.M., Rateb M.E. // Mar. Drugs. 2021. V. 19. P 406. https://doi.org/10.3390/md19080406
Yim S.K., Kim K., Kim I.H., Chun S.H., Oh T.H., Kim J.U., Kim J.W., Jung W.H., Moon H.S., Ku B.S., Jung K.J. // Mar. Drugs. 2021. V. 19. P. 219. https://doi.org/10.3390/md19040219
Fitton J.H., Park A.Y., Karpiniec S.S., Stringer D.N. // Mar. Drugs. 2021. V. 19. P. 4. https://doi.org/10.3390/md19010004
Dwivedi R., Samanta P., Sharma P., Zhang F., Mishra S.K., Kucheryavy P., Kim S.B., Aderibigbe A.O., Linhardt R.J., Tandon R., Doerksen R.J., Pomin V.H. // J. Biol. Chem. 2021. V. 297. P. 101207. https://doi.org/10.1016/j.jbc.2021.101207
Eljaaly K., Malibary H., Alsulami S., Albanji M., Badawi M., Al-Tawfiq J.A. // Pathogens. 2021. V. 10. P. 692. https://doi.org/10.3390/pathogens10060692
Hamed D.M., Belhoul K.M., Al Maazmi N.A., Ghayoor F., Moin M., Al Suwaidi M., Narainen M., Makki M., Rahman A.M. // J. Infect. Public Health. 2021. V. 14. P. 985–989. https://doi.org/10.1016/j.jiph.2021.06.003
Tay M.Z., Poh C.M., Rénia L., MacAry P.A., Ng L.F.P. // Nat. Rev. Immunol. 2020. V. 20. P. 36–374. https://doi.org/10.1038/s41577-020-0311-8
Cao X. // Nat. Rev. Immunol. 2020. V. 20. P. 269–270. https://doi.org/10.1038/s41577-020-0308-3
Tan L., Wang Q., Zhang D., Ding J., Huang Q., Tang Y.-Q., Wang Q., Miao H. // Target. Ther. 2020. V. 5. P. 33. https://doi.org/10.1038/s41392-020-0148-4
Liao M., Liu Y., Yuan J., Wen Y., Xu G., Zhao J., Cheng L., Li J., Wang X., Wang F., Liu L., Amit I., Zhang S., Zhang Z. // Nat. Med. 2020. V. 26. P. 842–844. https://doi.org/10.1038/s41591-020-0901-9
Lippi G., Plebani M., Henry B.M. // Clin. Chim. Acta. 2020. V. 506. P. 145–148. https://doi.org/10.1016/j.cca.2020.03.022
Chen N., Zhou M., Dong X., Qu J., Gong F., Han Y., Qiu Y., Wang J., Liu Y., Wei J., Xia J., Yu T., Zhang X., Zhang L. // Lancet. 2020. V. 395. P. 507–513. https://doi.org/10.1016/S0140-6736(20)30211-7
Tahir ul Qamar M., Maryam A., Muneer I., Xing F., Ali Ashfaq U., Khan F. A., Anwar F., Geesi M.H., Khalid R.R., Rauf S.A., Siddiqi A.R. // Sci. Rep. 2019. V. 9. P. 1–16. https://doi.org/10.1038/s41598-018-38450-1
Ustyuzhanina N.E., Anisimova N.Y., Bilan M.I., Donenko F.V., Morozevich G.E., Yashunsky D.V., Usov A.I., Siminyan N.G., Kirgisov K.I., Varfolomeeva S.R., Kiselevskiy M.V., Nifantiev N.E. // Pharmaceuticals. 2021. V. 14. P. 1074. https://doi.org/10.3390/ph14111074
Yoo H.J., You D.J., Lee K.W. // Mar. Drugs. 2019. V. 17. P. 447. https://doi.org/10.3390/md17080447
Jin W., Wu W., Tang H., Wei B., Wang H., Sun J., Zhang W., Zhong W. // Mar. Drugs. 2019. V. 17. P. 52. https://doi.org/10.3390/md17010052
Pradhan B., Nayak R., Patra S., Bhuyan P.P., Behera P.K., Mandal A.K., Behera C., Ki J.-S., Adhikary S.P., Ali D.M., Jena M. // Carbohydr. Polym. 2022. V. 291. P. 119551. https://doi.org/10.1016/j.carbpol.2022.119551
Letko M., Marzi A., Munster V. // Nat. Microbiol. 2020. V. 5. P. 562–569. https://doi.org/10.1038/s41564-020-0688-y
Walls A.C., Park Y.J., Tortorici M.A., Wall A., Mc‑Guire A.T., Veesler D. // Cell. 2020. V. 181. P. 281–292. https://doi.org/10.1016/j.cell.2020.02.058
Xu X., Chen P., Wang J. // Sci. China Life Sci. 2020. V. 63. P. 457–460. https://doi.org/10.1007/s11427-020-1637-5
Clausen T.M., Sandoval D.R., Spliid C.B., Pihl J., Perrett H.R., Painter C.D., Narayanan A., Majowicz S.A., Kwong E.M., McVicar R.N., Thacker B.E., Glass C.A., Yang Z., Torres J.L., Golden G.J., Bartels P.L., Porell R.N., Garretson A.F., Laubach L., Feldman J., Yin X., Pu Y., Hauser B.M., Caradonna T.M., Kellman B.P., Martino C., Gordts P.L.S.M., Chanda S.K., Schmidt A.G., Godula K., Leibel S.L., Jose J., Corbett K.D., Ward A.B., Carlin A.F., Esko J.D. // Cell. 2020. V. 183. P. 1043–1057. https://doi.org/10.1016/j.cell.2020.09.033
Zhou P., Yang X.-L., Wang X.-G., Hu B., Zhang L., Zhang W., Si H.-R., Zhu Y., Li B., Huang C.-L., Chen H.D., Chen J., Luo Y., Guo H., Jiang R.D., Liu M.Q., Chen Y., Shen X.R., Wang X., Zheng X.S., Zhao K., Chen Q.J., Deng F., Liu L.L., Yan B., Zhan FX., Wang Y.Y., Xiao G.F., Shi Z.L. // Nature. 2020. V. 579. P. 270–273. https://doi.org/10.1038/s41586-020-2012-7
Daly J.L., Simonetti B., Klein K., Chen K.-E., Williamson M.K., Antón-Plágaro C., Shoemark D.K., Simón-Gracia L., Bauer M., Hollandi R., Greber U. F., Horvath P., Sessions R.B., Helenius A., Hiscox J.A., Teesalu T., Matthews D.A., Davidson A.D., Collins B.M., Cullen P.J., Yamauchi Y. // Science. 2020. V. 370. P. 861–865. https://doi.org/10.1126/science.abd3072
Mycroft-West C.J., Su D., Pagani I., Rudd T.R., Elli S., Gandhi N.S., Guimond S.E., Miller G.J., Meneghetti M.C.Z., Nader H.B., Li Y., Nunes Q.M., Procter P., Mancini N., Clementi M., Bisio A., Forsyth N.R., Ferro V., Turnbull J.E., Guerrini M., Fernig D.G., Vicenzi E., Yates E.A., Lima M.A., Skidmore M.A. // Thromb. Haemost. 2020. V. 120. P. 1700–1715. https://doi.org/10.1055/s-0040-1721319
Kuznetsova T., Ivanushko L., Persiyanova E.V., Shutikova A.L., Ermakova S.P., Khotimchenko M.Y., Besednova N.N. // Biomed. Khim. 2017. V. 63. P. 553–558. https://doi.org/10.18097/pbmc20176306553
Li H.F., Li J., Tang Y., Lin L., Xie Z. // Virol. J. 2017. V. 14. P. 178. https://doi.org/10.1186/s12985-017-0848-8
Giamarellos-Bourboulis E.J., Netea M.G., Rovina N., Akinosoglou K., Antoniadou A., Antonakos N., Damoraki G., Gkavogianni T., Adami M.E., Katsaounou P. // Cell Host Microbe. 2020. V. 27. P. 992–1000. https://doi.org/10.1016/j.chom.2020.04.009
Schulte-Schrepping J., Reusch N., Paclik D., Baßler K., Schlickeiser S., Zhang B., Krämer B., Krammer T., Brumhard S., Bonaguro L., De Domenico E., Wendisch D., Grasshoff M., Kapellos T.S., Beckstette M., Pecht T., Saglam A., Dietrich O., Mei H.E., Schulz A.R., Conrad C., Kunkel D., Vafadarnejad E., Xu C.J., Horne A., Herbert M., Drews A., Thibeault C., Pfeiffer M., Hippenstiel S., Hocke A., Müller-Redetzky H., Heim K.M., Machleidt F., Uhrig A., Bosquillon de Jarcy L., Jürgens L., Stegemann M., Glösenkamp C.R., Volk H.D., Goffinet C., Landthaler M., Wyler E., Georg P., Schneider M., Dang-Heine C., Neuwinger N., Kappert K., Tauber R., Corman V., Raabe J., Kaiser K.M., Vinh M.T., Rieke G., Meisel C., Ulas T., Becker M., Geffers R., Witzenrath M., Drosten C., Suttorp N., von Kalle C., Kurth F., Händler K., Schultze J.L., Aschenbrenner A.C., Li Y., Nattermann J., Sawitzki B., Saliba A.E., Sander L.E. // Cell. 2020. V. 182. P. 1419–1440. https://doi.org/10.1016/j.cell.2020.08.001
Schultze J.L., Mass E., Schlitzer A. // Immunity. 2019. V. 50. P. 288–301. https://doi.org/10.1016/j.immuni.2019.01.019
Tavakolpour S., Rakhshandehroo T. // Immunol. Lett. 2020. V. 225. P. 31–32. https://doi.org/10.1016/j.imlet.2020.06.013
Wang X., Wen Y., Xie X., Liu Y., Tan X., Cai Q., Zhang Y., Cheng L., Xu G., Zhang S., Wang H., Wei L., Tang X., Qi F., Zhao J., Yuan J., Liu L., Zhu P., Ginhoux F., Zhang S., Cheng T., Zhang Z. // Cell Discov. 2021. V. 7. P. 60. https://doi.org/10.1038/s41421-021-00296-9
Prager I., Watzl C. // J. Leukoc. Biol. 2019. V. 105. P. 1319–1329. https://doi.org/10.1002/JLB.MR0718-269R
Krämer B., Knoll R., Bonaguro L., ToVinh M., Raabe J., Astaburuaga-García R., Jonas Schulte-Schrepping J., Kaiser K.M., Rieke G.J., Bischoff J., Monin M.B., Hoffmeister C., Schlabe S., De Domenico E., Reusch N., Händler K., Reynolds G., Blüthgen N., Hack G., Finnemann C., Nischalke H., Strassburg C.P., Stephenson E., Su Y., Gardner L., Yuan D., Chen D., Goldman J., Rosenstiel P., Schmidt S.V., Latz E., Hrusovsky K., Ball A.J., Johnson J.M., Koenig P.-A., Schmidt F.I. // Immunity. 2021. V. 54. P. 2650–2669. https://doi.org/10.1016/j.immuni.2021.09.002
Zheng M., Gao Y., Wang G., Song G., Liu S., Sun D. // Mol. Immunol. 2020. V. 17. P. 533–535. https://doi.org/10.1038/s41423-020-0402-2
Bi J. // Cell Mol. Immunol. 2022. V. 13. P. 1–3. https://doi.org/10.1038/s41423-021-00825-2
Foy B.H., Carlson J.C.T., Reinertsen E., Padros I Valls R., Pallares Lopez R., Palanques-Tost E., Mow C., Westover M.B., Aguirre A.D., Higgins J.M. // JAMA Netw Open. 2020. V. 3. P. e2022058. https://doi.org/10.1001/jamanetworkopen.2020.22058
Horiuchi Y., Hayashi F., Iwasaki Y., Matsuzaki A., Nishibe K., Kaniyu K., Marutani S., Saito K., Matsuoka S., Uchihashi K., Miida T., Ai T., Tabe Y. // Int. J. Lab. Hematol. 2021. V. 43. P. 1309–1318. https://doi.org/10.1111/ijlh.13696
Ramberg J.E., Nelson E.D., Sinnott R.A. // Nutr. J. 2010. V. 9. P. 54. https://doi.org/10.1186/1475-2891-9-54
Irhimeh M.R., Fitton J.H., Lowenthal R.M. // Exp. Hematol. 2007. V. 35. P. 989–994. https://doi.org/10.1016/j.exphem.2007.02.009
Anisimova N.Y., Ustyuzhanina N.E., Donenko F.V., Bilan M.I., Ushakova N.A., Usov A.I., Nifantiev N.E., Kiselevskiy M.V. // Biochemistry (Moscow). 2015. V. 80. P. 925–933. https://doi.org/10.1134/S0006297915070111
Li C., Niu. Q., Li S., Zhang X., Liu C., Cai C., Li G., Yu G. // Int. J. Biol. Macromol. 2020. V. 154. P. 1123–1131. https://doi.org/10.1016/j.ijbiomac.2019.11.036
Ustyuzhanina N.E., Bilan M.I., Dmitrenok A.S., Borodina E.Y., Stonik V.A., Nifantiev N.E., Usov A.I. // Carbohydr. Polym. 2017. V. 167. P. 20–26. https://doi.org/10.1016/j.carbpol.2017.02.101
Anisimova N., Ustyuzhanina N., Donenko F., Bilan M., Usov A., Nifantiev N., Kiselevskiy M. // Mar. Drugs. 2017. V. 15. P. 301. https://doi.org/10.3390/md15100301
Anisimova N.Y., Ustyuzhanina N.E., Bilan M.I., Donenko F.V., Ushakova N.A., Usov A.I., Kiselevskiy M.V., Nifantiev N.E. // Mar. Drugs. 2018. V. 16. P. 333. https://doi.org/10.3390/md16090333
Klok F.A., Kruip M.J.H.A., Van der Meer N.J.M., Arbous M.S., Gommers D.A.M.P.J., Kant K.M., Kaptein F.H.J., van Paassen J., Stals M.A.M., Huisman M.V., Endeman H. // Thromb. Res. 2020. V. 191. P. 145–147. https://doi.org/10.1016/j.thromres.2020.04.013
Pessoa M.S.L., Lima C.F.C., Pimentel A.C.F., Costa J.C.G., Holanda J.L.B. // Eur. J. Case Rep. Intern. Med. 2020. V. 7. P. 1747. https://doi.org/10.12890/2020_001747
Tang N., Li D., Wang X., Sun Z. // J. Thromb. Haemost. 2020. V. 18. P. 844–847. https://doi.org/10.1111/jth.14768
Nahum J., Morichau-Beauchant T., Daviaud F., Echegut P., Fichet J., Maillet J.-M., Thierry S. // JAMA Netw. Open. 2020. V. 3. P. e2010478. https://doi.org/10.1001/jamanetworkopen.2020.10478
Middeldorp S., Coppens M., van Haaps T.F., Foppen M., Vlaar A.P., Müller M.C.A., Bouman C.C.S., Beenen L.F.M., Kootte R.S., Heijmans J., Smits L.P., Bonta P.I., van Es N. // J. Thromb. Haemost. 2020. V. 18. P. 1995–2002. https://doi.org/10.1111/jth.14888
Wichmann D., Sperhake J.P., Lütgehetmann M., Steurer S., Edler C., Heinemann A., Heinrich F., Mushumba H., Kniep I., Schröder A.S., Burdelski C., de Heer G., Nierhaus A., Frings D., Pfefferle S., Becker H., Bredereke-Wiedling H., Weerth A., Paschen H.-R., Sheikhzadeh-Eggers S., Stang A., Schmiedel S., Bokemeyer C., Addo M.M., Aepfelbacher M., Püschel K., Kluge S. // Ann. Intern. Med. 2020. V. 73 (4). P. 268–277. https://doi.org/10.7326/M20-2003
Begic E., Naser N., Begic N. // e-J. Cardiol. Practice. 2021. V. 21. https://www.escardio.org/Journals/E-Journal-of-Cardiology-Practice/Volume-21/hypercoagulability-in-covid-19-and-post-covid-patients-characteristics-and-cur
Fan B.E., Umapathi T., Chua K., Chia Y.W., Wong S.W., Tan G.W.L., Chandrasekar S., Lum Y.H., Vasoo S., Dalan R. // J. Thromb. Thrombolysis. 2021. V. 51. P. 971–977. https://doi.org/10.1007/s11239-020-02332-z
Goligher E.C., Bradbury C.A., McVerry B.J., Lawler P.R., Berger J.S., Gong M.N., Carrier M., Reynolds H.R., Kumar A., Turgeon A.F., Kornblith L.Z., Kahn S.R., Marshall J.C., Kim K.S., Houston B.L., Derde L.P.G., Cushman M., Tritschler T., Angus D.C., Godoy L.C., McQuilten Z., Kirwan B.A., Farkouh M.E., Brooks M.M., Lewis R.J., Berry L.R., Lorenzi E., Gordon A.C., Ahuja T., Al-Beidh F., Annane D., Arabi Y.M., Aryal D., Baumann Kreuziger L., Beane A., Bhimani Z., Bihari S., Billett H.H., Bond L., Bonten M., Brunkhorst F., Buxton M., Buzgau A., Castellucci L.A., Chekuri S., Chen J.T., Cheng A.C., Chkhikvadze T., Coiffard B., Contreras A., Costantini T.W., de Brouwer S., Detry M.A., Duggal A., Džavík V., Effron M.B., Eng H.F., Escobedo J., Estcourt L.J., Everett B.M., Fergusson D.A., Fitzgerald M., Fowler R.A., Froess J.D., Fu Z., Galanaud J.P., Galen B.T., Gandotra S., Girard T.D., Goodman A.L., Goossens H., Green C., Greenstein Y.Y., Gross P.L., Haniffa R., Hegde S.M., Hendrickson C.M., Higgins A.M., Hindenburg A.A., Hope A.A., Horowitz J.M., Horvat C.M., Huang D.T., Hudock K., Hunt B.J., Husain M., Hyzy R.C., Jacobson J.R., Jayakumar D., Keller N.M., Khan A., Kim Y., Kindzelski A., King A.J., Knudson M.M., Kornblith A.E., Kutcher M.E., Laffan M.A., Lamontagne F., Le Gal G., Leeper C.M., Leifer E.S., Lim G., Gallego Lima F., Linstrum K., Litton E., Lopez-Sendon J., Lother S.A., Marten N., Saud Marinez A., Martinez M., Mateos Garcia E., Mavromichalis S., McAuley D.F., McDonald E.G., McGlothlin A., McGuinness S.P., Middeldorp S., Montgomery S.K., Mouncey P.R., Murthy S., Nair G.B., Nair R., Nichol A.D., Nicolau J.C., Nunez-Garcia B., Park J.J., Park P.K., Parke R.L., Parker J.C., Parnia S., Paul J.D., Pompilio M., Quigley J.G., Rosenson R.S., Rost N.S., Rowan K., Santos F.O., Santos M., Santos M.O., Satterwhite L., Saunders C.T., Schreiber J., Schutgens R.E.G., Seymour C.W., Siegal D.M., Silva D.G., Jr., Singhal A.B., Slutsky A.S., Solvason D., Stanworth S.J., Turner A.M., van Bentum-Puijk W., van de Veerdonk F.L., van Diepen S., Vazquez-Grande G., Wahid L., Wareham V., Widmer R.J., Wilson J.G., Yuriditsky E., Zhong Y., Berry S.M., McArthur C.J., Neal M.D., Hochman J.S., Webb S.A., Zarychanski R. // N. Engl. J. Med. 2021. V. 385. P. 777–789. https://doi.org/10.1056/NEJMoa210341
Sadeghipour P., Talasaz A.H., Rashidi F., Sharif-Kashani B., Beigmohammadi M.T., Farrokhpour M., Sezavar S.H., Payandemehr P., Dabbagh A., Moghadam K.G., Jamalkhani S., Khalili H., Yadollahzadeh M., Riahi T., Rezaeifar P., Tahamtan O., Matin S., Abedini A., Lookzadeh S., Rahmani H., Zoghi E., Mohammadi K., Abri H., Tabrizi S., Mousavian S.M., Shahmirzaei S., Bakhshandeh H., Amin A., Rafiee F., Baghizadeh E., Mohebbi B., Parhizgar S.E., Aliannejad R., Eslami V., Kashefizadeh A., Kakavand H., Hosseini S.H., Shafaghi S., Ghazi S.F., Najafi A., Jimenez D., Gupta A., Madhavan M.V., Sethi S.S., Parikh S.A., Monreal M., Hadavand N., Hajighasemi A., Maleki M., Sadeghian S., Piazza G., Kirtane A.J., Van Tassell B.W., Dobesh P.P., Stone G.W., Lip G.Y.H., Krumholz H.M., Goldhaber S.Z., Bikdeli B. // JAMA. 2021. V. 325. P. 1620–1630. https://doi.org/10.1001/jama.2021.4152
Greinacher A. // N. Engl. J. Med. 2015. V. 373. P. 252–261. https://doi.org/10.1056/NEJMcp1411910
Uaprasert N., Tangcheewinsirikul N., Rojnuckarin P., Patell R., Zwicker J.I., Chiasakul T. // Blood Adv. 2021. V. 5. P. 4521–4534. https://doi.org/10.1182/bloodadvances.2021005314
Patell R., Bogue T., Koshy A., Bindal P., Merrill M., Aird W.C., Bauer K.A., Zwicker J.I. // Blood. 2020. V. 136. P. 1342–1346. https://doi.org/10.1182/blood.2020007938
Cumashi A., Ushakova N.A., Preobrazhenskaya M.E., D’Incecco A., Piccoli A., Totani L., Tinari N., Morozevich G.E., Berman A.E., Bilan M.I., Usov A.I., Ustyuzhanina N.E., Grachev A.A., Sanderson C.J., Kelly M., Rabinovich G.A., Iacobelli S., Nifantiev N.E. // Glycobiology. 2007. V. 17. P. 541–552. https://doi.org/10.1093/glycob/cwm014
Kuznetsova T.A., Andryukov B.G., Makarenkova I.D., Zaporozhets T.S., Besednova N.N., Fedyanina L.N., Kryzhanovsky S.P., Shchelkanov M.Y. // Molecules. 2021. V. 26. P. 2618. https://doi.org/10.3390/molecules26092618
Durand E., Helley D., Ayman H.Z., Dujols C., Bruneval P., Colliec-Jouault S., Fischer A.-M., Antoine L. // J. Vasc. Res. 2008. V. 45. P. 529–537. https://doi.org/10.1159/000129687
Krylov V.B., Kaskova Z.M., Vinnitskiy D.Z., Ustyuzhanina N.E., Grachev A.A., Chizhov A.O., Nifantiev N.E. // Carbohydr. Res. 2011. V. 346. P. 540–550. https://doi.org/10.1016/j.carres.2011.01.005
Khatuntseva E.A., Ustuzhanina N.E., Zatonskii G.V., Shashkov A.S., Usov A.I., Nifant’ev N.E. // J. Carbohydr. Chem. 2000. V. 19. P. 1151–1173. https://doi.org/10.1080/07328300008544140
Kalluri R., Weinberg R.A. // J. Clin. Invest. 2009. V. 119. P. 1420–1428. https://doi.org/10.1172/JCI39104
Guan S., Zhou J. // Mol. Biosyst. 2017. V. 13. P. 2116–2124. https://doi.org/10.1039/c7mb00247e
King T.J., Pardo A., Selman M. // Lancet. 2011. V. 378. P. 1949–1961. https://doi.org/10.1016/S0140-6736(11)60052-4
Tale S., Ghosh S., Meitei S.P., Kolli M., Garbhapu A.K., Pudi S. // Post QJM. 2020. V. 113. P. 837–838. https://doi.org/10.1093/qjmed/hcaa25
George P.M., Wells A.U., Jenkins R.G. // Lancet Respir. Med. 2020. V. 8. P. 807–815. https://doi.org/10.1016/S2213-2600(20)30225-3
Jiang H.D., Guan H.S. // Acta Pharmacologica Sinica. 2009. V. 30. P. 973–979. https://doi.org/10.1038/aps.2009.86
Wang J., Geng L.H., Yue Y., Zhang Q.B. // Prog. Mol. Biol. Transl. Sci. 2019. V. 163. P. 95–111. https://doi.org/10.1016/bs.pmbts.2019.03.011
Yu H.H., Chengchuan Ko. E., Chang C.L., Yuan K.S., Wu A.T.H., Shan Y.S., Wu S.Y. // Mar. Drugs. 2018. V. 16. P. 392. https://doi.org/10.3390/md16100392
Zhou S.B., Zhou Y.C., Yu J.J., Du Y.X., Tan Y., Ke Y.M., Ge F. // Biomed. Pharmacother. 2020. V. 126. P. 110058. https://doi.org/10.1016/j.biopha.2020.110058
Wu N., Li Z., Wang J., Geng L., Yue Y., Deng Z., Wang Q., Zhang Q. // Carbohydr. Polym. 2021. V. 273. P. 118567. https://doi.org/10.1016/j.carbpol.2021.118567
Wang L., Zhang P., Li X., Zhang Y., Zhan Q., Wang C. // Am. J. Transl. Res. 2019. V. 11. P. 2590–2602.
Huang C., Wang Y., Li X., Li X., Ren L., Zhao J., Hu Y., Zhang L., Fan G., Xu J., Gu X., Cheng Z., Yu T., Xia J., Wei Y., Wu W., Xie X., Yin W., Li H., Liu M., Xiao Y., Gao H., Guo L., Xie J., Wang G., Jiang R., Gao Z., Jin Q., Wang J., Cao B. // Lancet. 2020. V. 395. P. 497–506. https://doi.org/10.1016/S0140-6736(20)30183-5
Moore J.B., June C.H. // Science. 2020. V. 368. P. 473–474. https://doi.org/10.1126/science.abb8925
Mahase E. // BMJ. 2020. V. 369. P. m2512. https://doi.org/10.1136/bmj.m2512
van Paassen J., Vos J.S., Hoekstra E.M., Neumann K.M.I., Boot P.C., Arbous S.M. // Crit. Care. 2020. V. 24. P. 696. https://doi.org/10.1186/s13054-020-03400-9
World Health Organization. Clinical Management of COVID-19: Interim Guidance, 27 May 2020. https://apps.who.int/iris/handle/10665/332196
Shankar-Hari M., Vale C.L., Godolphin P.J., Fisher D., Higgins J.P.T., Spiga F., Savovic J., Tierney J., Baron G., Benbenishty J.S., Berry L.R., Broman N., Cavalcanti A.B., Colman R., de Buyser S.L., Derde L.P.G., Domingo P., Omar S.F., Fernandez-Cruz A., Feuth T., Garcia F., Garcia-Vicuna R., Gonzalez-Alvaro I., Gordon A.C., Haynes R., Hermine O., Horby P.W., Horick N.K., Kumar K., Lambrecht B.N., Landray M.J., Leal L., Lederer D.J., Lorenzi E., Mariette X., Merchante N., Misnan N.A., Mohan S.V., Nivens M.C., Oksi J., Perez-Molina J.A., Pizov R., Porcher R., Postma S., Rajasuriar R., Ramanan A.V., Ravaud P., Reid P.D., Rutgers A., Sancho-Lopez A., Seto T.B., Sivapalasingam S., Soin A.S., Staplin N., Stone J.H., Strohbehn G.W., Sunden-Cullberg J., Torre-Cisneros J., Tsai L.W., van Hoogstraten H., van Meerten T., Veiga V.C., Westerweel P.E., Murthy S., Diaz J.V., Marshall J.C., Sterne J.A.C. // JAMA. 2021. V. 326. P. 499–518. https://doi.org/10.1001/jama.2021.11330
Mushtaq M.Z., Mahmood S.B.Z., Almas A., Ather Wasti S., Ahsan Ali S. // Int. Immunopharmacol. 2022. V. 102. P. 108384. https://doi.org/10.1016/j.intimp.2021.108384
Kipkorir V., Cheruiyot I., Ngure B., Misiani B., Munguti J. // J. Med. Virol. 2020. V. 92. P. 2328–2331. https://doi.org/10.1002/jmv.26007
Sirivongrangson P., Kulvichit W., Payungporn S., Pisitkun T., Chindamporn A., Peerapornratana S., Pisitkun P., Chitcharoen S., Sawaswong V., Worasilchai N., Kampunya S., Putcharoen O., Thawitsri T., Leelayuwatanakul N., Kongpolprom N., Phoophiboon V., Sriprasart T., Samransamruajkit R., Tungsanga S., Tiankanon K., Lumlertgul N., Leelahavanichkul A., Sriphojanart T., Tantawichien T., Thisyakorn U., Chirathaworn C., Praditpornsilpa K., Tungsanga K., Eiam-Ong S., Sitprija V., Kellum J.A., Srisawat N. // Intensive Care Med. Exp. 2020. V. 8. P. 72. https://doi.org/10.1186/s40635-020-00362-8
Zuo T., Zhang F., Lui G.C.Y., Yeoh Y.K., Li A.Y.L., Zhan H., Lui G.C.Y., Wan Y., Chung A.C.K., Cheung C.P., Chen N., Lai C.K.C., Chen Z., Tso E.Y.K., Fung K.S.C., Chan V., Ling L., Joynt G., Hui D.S.C., Chan F.K.L., Chan P.K.S., Ng S.C. // Gastroenterology. 2020. V. 159. P. 944–955. https://doi.org/10.1053/j.gastro.2020.05.048
Hoel H., Heggelund L., Reikvam D.H., Stiksrud B., Ueland T., Michelsen A.E., Otterdal K., Muller K.E., Lind A., Muller F., Dudman S., Aukrust P., Dyrhol-Riise A.M., Holter J.C., Trøseid M. // J. Int. Med. 2021. V. 289. P. 523–531. https://doi.org/10.1111/joim.13178
Teixeira P.C., Dorneles G.P., Santana Filho P.C., da Silva I.M., Schipper L.L., Postiga I.A.L., Neves C.A.M., Rodrigues Junior L.C., Peres A., Souto J.T., Fonseca S.G., Eller S., Oliveira T.F., Rotta L.N., Thompson C.E., Romão P.R.T. // Int. Immunopharmacol. 2021. V. 100. P. 108125. https://doi.org/10.1016/j.intimp.2021.108125
Cardinale V., Capurso G., Ianiro G., Gasbarrini A., Arcidiacono P.G., Alvarod D. // Dig. Liver Dis. 2020. V. 52. P. 1383–1389. https://doi.org/10.1016/j.dld.2020.09.009
Preobragenskaja M.E., Berman A.E., Mikhajlov V.I., Ushakova N.A., Mazurov A.V., Semenov A.V., Usov A.I., Nifant’ev N.E., Bovin N.V. // Biochem. Mol. Biol. Int. 1997. V. 43. P. 443–451. https://doi.org/10.1080/15216549700204231
Zhang X.W., Liu Q., Thorlacius H. // Scand. J. Gastroenterol. 2001. V. 36. P. 270–275. https://doi.org/10.1080/003655201750074555
Jeong J.W., Hwang S.J., Han M.H., Lee D.S., Yoo J.S., Choi I.W., Cha H.J., Kim S., Kim H.S., Kim G.Y., Jeon Y.-J., Lee H.-J., Park H.T., Yoo Y.H., Choi Y.H. // Mol. Cell. Toxicol. 2017. V. 13. P. 405–417. https://doi.org/10.1007/s13273-017-0045-2
Amin M.L., Mawad D., Dokos S., Koshy P., Martens P.J., Sorrell C.C. // Carbohydr. Polym. 2020. V. 230. P. 115691. https://doi.org/10.1016/j.carbpol.2019.115691
Biondo P.D., Goruk S., Ruth M.R., O’Connell E., Field C.J. // Int. Immunopharmacol. 2008. V. 8. P. 1134–1142. https://doi.org/10.1016/j.intimp.2008.04.003
Neyrinck A.M., Mouson A., Delzenne N.M. // Int. Immunopharmacol. 2007. V. 7. P. 1497–1506. https://doi.org/10.1016/j.intimp.2007.06.0
Makarenkova I.D., Logunov D.Y., Tukhvatulin A.I., Semenova I.B., Zvyagintseva T.N., Gorbach V.I., Ermakova S.P., Besednova N.N. // Biomed. Khim. 2012. V. 58. P. 318–325. https://doi.org/10.18097/pbmc20125803318
Ni L., Wang L., Fu X., Duan D., Jeon Y.J., Xu J., Gao X. // Int. J. Biol. Macromol. 2020. V. 156. P. 717–729. https://doi.org/10.1016/j.ijbiomac.2020.04.012
Lee S.H., Ko C.I., Ahn G., You S., Kim J.S., Heu M.S., Kim J., Jee Y., Jeon Y.J. // Carbohydr. Polym. 2012. V. 89. P. 599–606. https://doi.org/10.1016/j.carbpol.2012.03.056
Sanjeewa K.K.A., Fernando I.P.S., Kim E.A., Ahn G., Jee Y., Jeon Y.J. // Nutr. Res. Pract. 2017. V. 11. P. 3–10. https://doi.org/10.4162/nrp.2017.11.1.3
Sanjeewa K.A., Fernando I.P.S., Kim S.Y., Kim H.S., Ahn G., Jee Y., Jeon Y.J. // Int. J. Biol. Macromol. 2018. V. 107. P. 803–807. https://doi.org/10.1016/j.ijbiomac.2017.09.050
Pozharitskaya O.N., Obluchinskaya E.D., Shikov A.N. // Mar. Drugs. 2020. V. 18. P. 275. https://doi.org/10.3390/md18050275
Phull A.R., Kim S.J. // J. Funct. Foods. 2017. V. 38. P. 415–426. https://doi.org/10.1016/j.jff.2017.09.05
Apostolova E., Lukova P., Baldzhieva A., Katsarov P., Nikolova M., Iliev I., Peychev L., Trica B., Oancea F., Delattre C., Kokova V. // Polymers (Basel). 2020. V. 12. P. 2338. https://doi.org/10.3390/polym1210233
Ahmad T., Eapen M.S., Ishaq M., Park A.Y., Karpiniec S.S., Stringer D.N., Sohal S.S., Fitton J.H., Guven N., Caruso V., Eri R. // Mar. Drugs. 2021. V. 19. P. 702. https://doi.org/10.3390/md19120702
Lean Q.Y., Eri R.D., Fitton J.H., Patel R.P., Gueven N. // PLoS One. 2015. V. 10. P. e0128453. https://doi.org/10.1371/journal.pone.0128453
Matsubara K., Xue C., Zhao X., Mori M., Sugawara T., Hirata T. // Int. J. Mol. Med. 2005. V. 15. P. 695–699. https://doi.org/10.3892/ijmm.15.4.695
Vinnitskiy D.Z., Ustyuzhanina N.E., Dmitrenok A.S., Shashkov A.S., Nifantiev N.E. // Carbohydr. Res. 2017. V. 438. P. 9–17. https://doi.org/10.1016/j.carres.2016.11.015
Gambaryan A.S., Tuzikov A.B., Byramova N.E., Bovin N.V., Piskarev V.E., Nifant’ev N.E., Matrosovich M.N. // FEBS Lett. 1995. V. 366. P. 57–60. https://doi.org/10.1016/0014-5793(95)00488-U
Nifant’ev N.E., Tsvetkov Y.E., Shashkov A.S., Kononov L.O., Menshov V.M., Tuzikov A.B., Bovin N.V. // J. Carbohydr. Chem. 1996. V. 15. P. 939–953. https://doi.org/10.1080/07328309608005700
Sherman A.A., Yudina O.N., Menshov V.M., Shashkov A.S., Nifant’ev N.N. // Carbohydr. Res. 2001. V. 330. P. 445–458. https://doi.org/10.1016/S0008-6215(01)00002-7
Sherman A.A., Yudina O.N., Mironov Y.V., Sukhova E.V., Shashkov A.S., Menshov V.M., Nifantiev N.E. // Carbohydr. Res. 2001. V. 336. P. 13–46. https://doi.org/10.1016/S0008-6215(01)00213-0
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия