Биоорганическая химия, 2022, T. 48, № 6, стр. 648-676
Синтез и биологическая активность N-ацилгидразонов
Э. Р. Беляева 1, *, Ю. В. Мясоедова 1, Н. М. Ишмуратова 1, Г. Ю. Ишмуратов 1
1 Уфимский Институт химии – обособленное структурное подразделение
ФГБНУ “Уфимский федеральный исследовательский центр” РАН
450054 Уфа, просп. Октября, 71, Россия
* E-mail: ern_lbrn@bk.ru
Поступила в редакцию 16.02.2022
После доработки 08.04.2022
Принята к публикации 31.05.2022
- EDN: PFFZKG
- DOI: 10.31857/S0132342322060082
Аннотация
Синтез гибридных молекул, содержащих фрагменты природных соединений и фармакофорные группы, дает возможность получения широкого спектра новых потенциально биологически активных веществ. Ацилгидразоновые фрагменты присутствуют во многих биологически активных молекулах и придают им разнообразные виды фармакологической активности: антибактериальную, противотуберкулезную, противогрибковую, противоопухолевую, противовоспалительную, противосудорожную, противовирусную и антипротозойную. В обзоре рассмотрены примеры синтеза N-ацилгидразонов различного строения на основе природных и синтетических соединений, приведены данные по их фармакологическим свойствам: противотуберкулезной активности (против Mycobacterium tuberculosis H37Rv), противомикробной и антибактериальной активности, противовирусной (вирусы гриппа, простого герпеса 1-го типа, Эпштейна–Барр, иммунодефицита человека) и противовоспалительной (в том числе анальгетической) активности, противоопухолевой активности (против линий клеток рака легких, груди, желудка, печени, толстой кишки и др.), а также пестицидной активности (фунгициды, ларвициды, инсектициды и регуляторы роста).
СОДЕРЖАНИЕ
ВВЕДЕНИЕ.......................................................648
N-АЦИЛГИДРАЗОНЫ С ПРОТИВОТУБЕРКУЛЕЗНОЙ АКТИВНОСТЬЮ.............................................650
N-АЦИЛГИДРАЗОНЫ С ПРОТИВОМИКРОБНОЙ И АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ.............................................655
N-АЦИЛГИДРАЗОНЫ C ПРОТИВОВИРУСНОЙ И ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЬЮ.............................................659
N-АЦИЛГИДРАЗОНЫ С ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ.............................................664
N-АЦИЛГИДРАЗОНЫ С ПЕСТИЦИДНОЙ АКТИВНОСТЬЮ..........667
ЗАКЛЮЧЕНИЕ................................................672
СПИСОК ЛИТЕРАТУРЫ................................672
ВВЕДЕНИЕ
В настоящее время поиск химических соединений, обладающих биологической активностью, проводят на основании научных принципов и количественных подходов, позволяющих прогнозировать структуру соединений и проводить их целенаправленный синтез. В развитии научных исследований в этой области прослеживается несколько тенденций, одна из которых – введение в структуру искомой молекулы фармакофорных фрагментов. К таким фрагментам можно отнести гидразидную группу [1, 2].
Ацилгидразоны – перспективный класс органических соединений, который привлекает внимание ученых благодаря наличию в молекуле связанных азометиновой (–NH–N=CH–) и карбонильной групп [3, 4]. Подобное сочетание функциональных групп обусловливает разнообразие фармацевтических свойств гидразонов [5–14], позволяющих использовать их для лечения онкологических заболеваний [15, 16], туберкулеза [17, 18], аллергических проявлений [19], и определяет перспективность их применения для синтеза координационных соединений [20], а также использование в синтезе различных гетероциклических каркасов [21], таких как 1,3,4-оксадиазолины [22], азетидин-2-оны [23], кумарины [24], 1,3-тиазолидин-4-оны [25, 26] и 1,3-бензотиазин-4-оны [27].
Основной способ синтеза ацилгидразонов – конденсация соответствующих гидразидов карбоновых или гетерокарбоновых кислот с различными альдегидами или кетонами в органических растворителях, чаще всего спиртового типа [28–36].
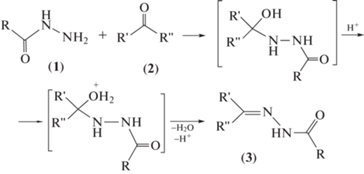
Производные гидразина, в том числе гидразиды кислот (1), за счет содержания хотя бы одной первичной аминной группы способны присоединяться к карбонильным соединениям (2). Механизм образования гидразонов включает в себя атаку свободной электронной парой конечного атома азота поляризованного карбонила и последующее отщепление воды. Первая стадия – перенос протона от атома азота гидразина к кислороду карбонильной группы, вторая стадия – элиминирование второго протона (схема 1 ).
Схема 1 . Общая схема синтеза ацилгидразонов.
Данная реакция обратима, однако равновесие в обычных условиях смещено в сторону образования гидразона (3). У гидразонов с плохой растворимостью обратимость реакции не наблюдается. Кислоты катализируют дегидратацию карбинола, при этом кислота превращает карбонильное соединение в сопряженную кислоту, облегчая и дальнейшее присоединение.
Оптимальное значение рН реакционной среды подбирается для каждой пары “гидразин – карбонильное соединение”, обычно оно близко к значению рКа исходного гидразина.
Основные различия в синтезе гидразонов заключаются в использовании различных растворителей, катализаторов, температурных условий, продолжительности реакции. Подбор условий диктуется свойствами исходных соединений и образующихся гидразонов [37, 38].
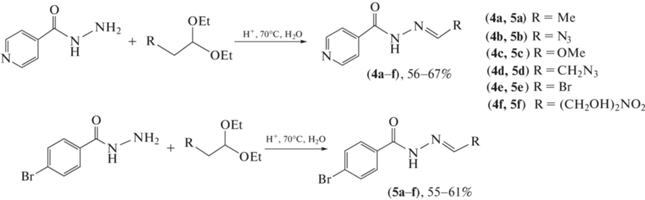
Применение ацеталей как объекта конденсации с гидразидами кислот обусловлено тем, что многие альдегиды нестабильны и могут быть получены только с защищенной карбонильной группой. Так, был предложен синтез гидразонов (4а–f) и (5а–f) [39], в котором в качестве объектов конденсации с гидразидом изоникотиновой кислоты и гидразидом пара-бромбензойной кислоты использовали ацетали замещенного уксусного, пропионового и некоторых других альдегидов. Для этого гидразиды, воду и соляную кислоту нагревали при 70°С до полного растворения и при перемешивании добавляли ацетали. Конденсация протекает в течение 30 мин в две стадии в одном реакторе без выделения и очистки промежуточных продуктов. Авторы отмечают, что метод имеет достаточно общий характер и может быть применен для синтеза широкого круга подобных соединений с незначительной корректировкой условий (схема 2 ).
Схема 2 . Синтез ацилгидразонов на основе изоникотиновой и пара-бромбензойной кислот.
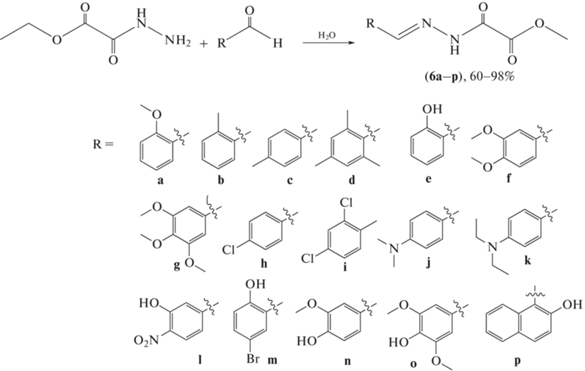
Традиционные методы синтеза ацилгидразонов предполагают использование органических растворителей и длительное нагревание. В 2018 г. Zhao et al. [40] сообщили о разработке нового “зеленого” синтеза ряда ацилгидразонов (6а–р) реакцией производных бензальдегида с гидразидом этилоксалата в воде. Для большинства соединений реакцию проводили при 25°С, выход целевых соединений составил 60–98% (схема 3 ).
Схема 3 . “Зеленый” синтез ацилгидразонов.
Изучив влияние природы заместителей и их положения в ароматическом кольце, авторы отмечают, что стерическое препятствие оказывает очевидное воздействие на скорость реакции, в то время как электронный эффект менее существенен: ароматические альдегиды без орто-стерических помех были более реакционноспособны, чем орто-замещенные.
В зависимости от своего строения N-ацилгидразоны проявляют самые разнообразные биологические свойства. Установлено, что среди них есть соединения с противомикробным, противотуберкулезным, антибактериальным, противовоспалительным, противоопухолевым, противовирусным, фунгицидным и инсектицидным действием. Далее в обзоре рассмотрены конкретные примеры синтеза такого рода соединений за последние 15 лет и приведены данные по их биологической активности.
N-АЦИЛГИДРАЗОНЫ С ПРОТИВОТУБЕРКУЛЕЗНОЙ АКТИВНОСТЬЮ
Многие гидразиды и гидразоны нашли широкое применение в терапии и профилактике туберкулеза. Туберкулостатическим действием обладает ряд препаратов, таких как Фтивазид, Тубазид, Изониазид, Флуренизид, Салюзид и др. Однако лечение туберкулеза остается проблемой, требующей новых противотуберкулезных препаратов из-за появления штаммов микобактерий с множественной лекарственной устойчивостью, в связи с чем ведется поиск соединений, обладающих туберкулостатической активностью наряду с низкой токсичностью.
Рифампицин, Амикацин, ПАСК, Теризидон, Офлоксацин, Ципрофлоксацин, Пиразинамид, Ломефлоксацин – широко известные препараты, применяемые в профилактике и лечении туберкулеза, в структуре которых содержатся ароматические фрагменты. Исследованию активности соединений, содержащих ароматические заместители, посвящен целый ряд работ.
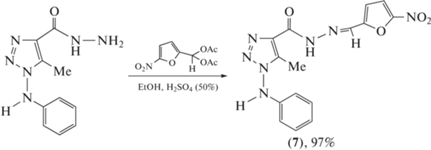
Так, в статье Jordão et al. [41] описаны синтез и изучение противотуберкулезной активности N-замещенных фениламино-5-метил-1Н-1,2,3-триазол-4-карбогидразидов. Среди нитрофурановых производных соединение (7) оказывало наиболее сильный эффект и показало значение MIC (2.5 мкг/мл), сопоставимое с другими применяемыми в терапии препаратами, такими как этамбутол (MIC = 2 мкг/мл) (схема 4 ).
Схема 4 . Синтез нитрофуранового производного (7).
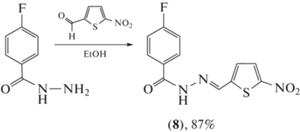
C целью получения новых антимикобактериальных соединений Bedia et al. [42] синтезировали серию ацилгидразонов на основе гидразидов галоген- и нитрозамещенных бензойных кислот и провели скрининг противотуберкулезной активности против Mycobacterium tuberculosis H37Rv – наиболее изученного штамма туберкулеза в исследовательских лабораториях [43]. Наибольшее ингибирование (99%) M. tuberculosis H37Rv при постоянном уровне концентрации (6.25 мкг/мл) в этой серии ацилгидразонов показало фторпроизводное (8) (схема 5 ).
Схема 5 . Синтез фторпроизводного (8).
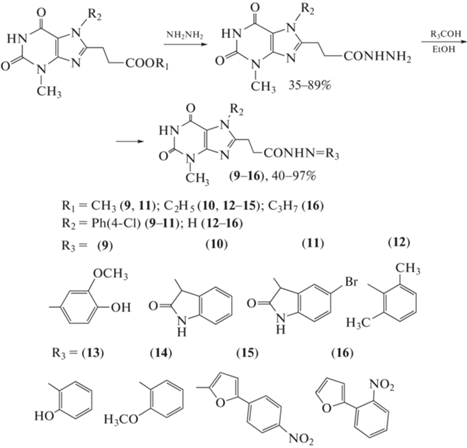
В работе Казунина и Прийменко [44] сообщается о синтезе гидразоновых производных ксантина с использованием гидразидов, содержащих в ароматическом кольце атомы галогенов, гидрокси-, нитро- и метоксигруппы, и изучении их противотуберкулезной активности (схема 6 ). При исследовании противотуберкулезной активности соединений (9–16) было установлено, что исследуемый штамм M. tuberculosis Н37Rv проявляет чувствительность к большинству синтезированных ацилгидразонов: к производным (15) и (16), содержащим нитрогруппу в бензольном и фурановом циклах, он показал 100%-ную восприимчивость. Этот штамм M. tuberculosis Н37Rv не проявил чувствительности к гидразонам (9), (11) и (13), содержащим в ароматическом кольце галогены, гидрокси- и метоксигруппы.
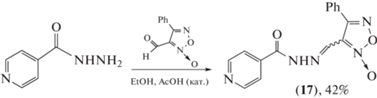
На основе гидразидов пиридинкарбоновых кислот и фуроксанила были синтезированы ацилгидразоны и изучена их активность в отношении штамма M. tuberculosis H37Rv. Гибридное соединение N'-(4-фенил-3-фуроксанилметилиден)изониазид (17) в виде смеси изомеров E : Z (98 : 2) показало лучший антибактериальный профиль со значением MIC в 4.5 меньшим, чем для эталонного изониазида, против мультирезистентных штаммов (схема 7 ) [45].
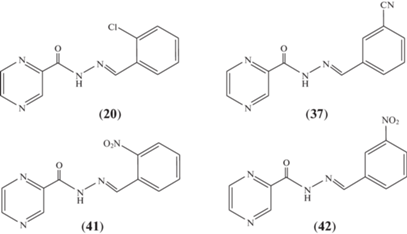
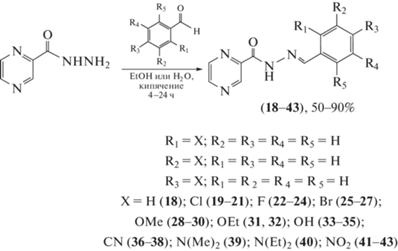
В статье Vergara et al. [46] описаны синтез серии 26 N-[(E)-(монозамещенных бензилиден)]-2-пиразинкарбогидразидов (18–43) и исследование влияния этих соединений на жизнеспособность клеток – неинфицированных макрофагов и макрофагов, инфицированных Mycobacterium bovis bacillus Calmette–Guerin (BCG) (схема 8 ). Не проявившие цитотоксическую активность соединения (18), (20), (22), (29), (35), (37), (38), (41) и (42) испытали в отношении M. tuberculosis ATCC 27294. Ацилгидразоны (20), (37), (41) и (42) проявили значительную активность (50–100 мг/мл) по сравнению с препаратами первого ряда, такими как пиразинамид, и не были цитотоксичны при соответствующих значениях MIC (рис. 1).
Схема 8 . Синтез серии 26 N-[(E)-(монозамещенных бензилиден)]-2-пиразинкарбогидразидов (18–43).
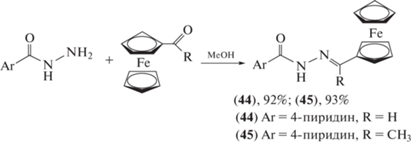
Растущая проблема множественной лекарственной устойчивости туберкулеза привлекла внимание к разработке новых препаратов, которые не только активны, но и сокращают длительность терапии [47–49]. Одно из перспективных направлений – использование металлоценов. Среди металлоценов особое внимание привлекает ферроцен – химически стабильная и нетоксичная молекула [50]. Многие ферроценильные соединения проявляют значительную цитотоксическую [51, 52], противомалярийную [53–55], противогрибковую [56], антитоксоплазматическую [57] и ДНК-расщепляющую активность [58]. С целью создания новых противотуберкулезных препаратов из-за развития устойчивых к изониазиду штаммов M. tuberculosis были синтезированы изоникотиноилгидразоны (44) и (45) с ферроценильными фрагментами, однако по сравнению с изониазидом соединения (44) и (45) оказались менее эффективными (схема 9 ) [59].
Схема 9 . Синтез изоникотиноилгидразонов (44) и (45) с ферроценильными фрагментами.
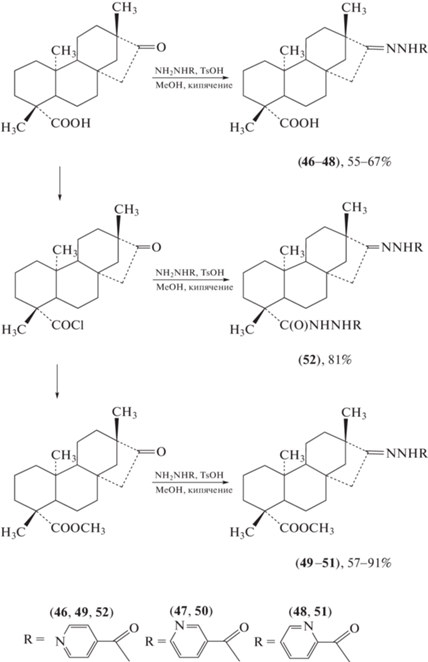
Катаев с соавт. [60] установили, что изостевиол ингибирует рост M. tuberculosis (штамм H37Rv in vitro) (MIC = 50 мкг/мл). В работе Андреевой с соавт. [61] структура этого природного метаболита противотуберкулезного действия была скомбинирована с известными синтетическими микостатиками (схема 10 ). Показано, что ацилгидразоны (46), (48), (49) и (52) ингибируют рост M. tuberculosis при MIC = 20 мкг/мл, а соединения (47), (50) и (51) – при MIC = 10 мкг/мл.
Схема 10 . Синтез ацилгидразонов на основе изостевиола.
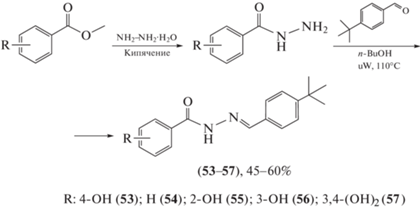
Пространственно затрудненные фенолы, как и ацилгидразоны, – это известные фармакофоры, обладающие различными видами биологической активности, что обусловливает интерес к синтезу гибридных соединений, сочетающих эти фрагменты. Опираясь на собственные исследования о взаимосвязи “структура–активность”, Lin et al. [62] синтезировали ацилгидразоны с фенольными группами, проявившие противотуберкулезную и антибактериальную активность. Для этого сложные эфиры обрабатывали гидразином с получением гидразидов, которые затем обрабатывали альдегидами в н-бутиловом спирте при микроволновом нагревании с получением ацилгидразонов (53–57), выход которых составил 45–60% (схема 11 ).
Схема 11 . Синтез ацилгидразонов (53–57).
N-АЦИЛГИДРАЗОНЫ С ПРОТИВОМИКРОБНОЙ И АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ
В научной литературе имеется огромное количество работ, посвященных поиску соединений с противомикробной и антибактериальной активностью среди производных гидразидов карбоновых кислот. Интерес исследователей к синтезу таких соединений связан с появлением большого количества устойчивых к антибиотикам штаммов бактерий, вызванным нерациональным использованием противомикробных и антибактериальных препаратов. Сенная, кишечная и синегнойная палочки, кандида альбиканс, аспергилл черный, золотистый стафилококк, пневмококки – болезнетворные биологические агенты, известные виды бактерий и грибков, которые вызывают сильнейшие инфекционные заболевания в организме человека, приводящие к серьезным последствиям, даже к летальному исходу. Поэтому существует острая необходимость в разработке новых антибактериальных агентов.
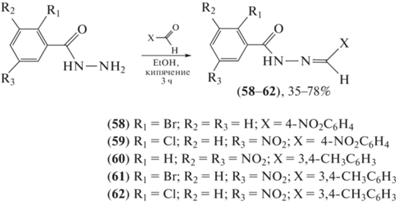
Синтезирован ряд производных гидразидов ароматических кислот и изучена их антимикробная активность in vitro против пяти репрезентативных микроорганизмов (Bacillus subtilis, Escherichia coli, Candida albicans, Aspergillus niger, Staphylococcus aureus) (схема 12 ) [63]. Присутствие электроноакцепторных групп в остатке бензойной кислоты увеличивало антимикробную активность. Кроме того, присутствие гетероциклического фуранового кольца не улучшало антимикробную активность замещенных гидразидов. В случае S. aureus наиболее активными были соединения (58) и (62) (MIC = 2.65 и 2.67 мкг/мл соответственно). Против B. subtilis наиболее эффективными кандидатами оказались соединения (58) и (59). В случае E. coli самая высокая активность была выявлена у динитропроизводного (60) и соединения с хлор- и нитро-заместителями (62). Соединение (60) также наиболее эффективно ингибировало C. albicans. Соединения (60) и (61) оказались наиболее эффективными противогрибковыми агентами относительно A. niger.
Схема 12 . Синтез ряда производных гидразидов ароматических кислот (58–62).
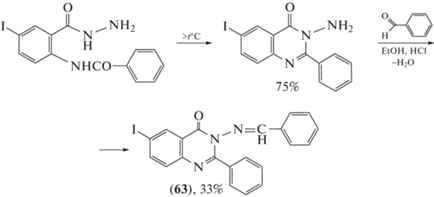
Противомикробное действие проявил 3-бензилиденамино-6-иод-2-фенилхиназолин-4(3H)-он (63), активность которого в отношении штаммов S. aureus и E. сoli составила 250 мкг/мл (схема 13 ) [64].
Схема 13 . Синтез 3-бензилиденамино-6-иод-2-фенилхиназолин-4(3H)-она (63).
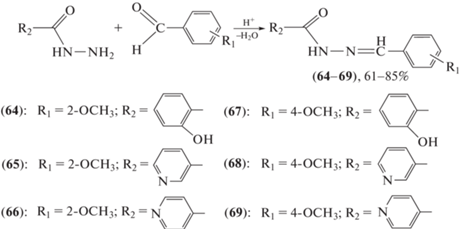
В работе Шматковой с соавт. [65] синтезированы пиридиноилгидразоны (64–69) ряда R-бензальдегидов (R = H, 4-N(CH3)2, 2-OH) (схема 14 ). Также проведен сравнительный анализ влияния полученных ацилгидразонов на рост условно-патогенных бактерий S. aureus, E. coli и B. subtilis. Высокую активность проявили соединения (67) и (69) (100%-ное подавление роста).
Схема 14 . Синтез пиридиноилгидразонов (64–69).
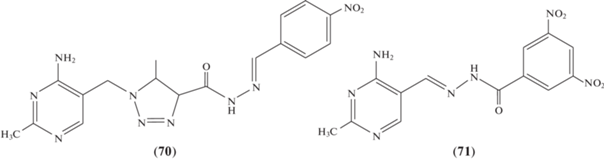
Получены ацилгидразоны пиримидина, два из которых – соединения (70) и (71) – проявили активность в качестве ингибиторов E. coli PDHc-E1 (рис. 2) [66, 67].
Рис. 2.
Структуры 1-[(4-амино-2-метилпиримидин-5-ил)метил]-5-метил-N'-[(1E)-(4-нитрофенил)метилен]-4,5-дигидро-1H-1,2,3-триазол-4-карбогидразида (70) и N'-[(1E)-(4-амино-2-метилпиримидин-5-ил)метилен]-3,5-динитробензогидразида (71).
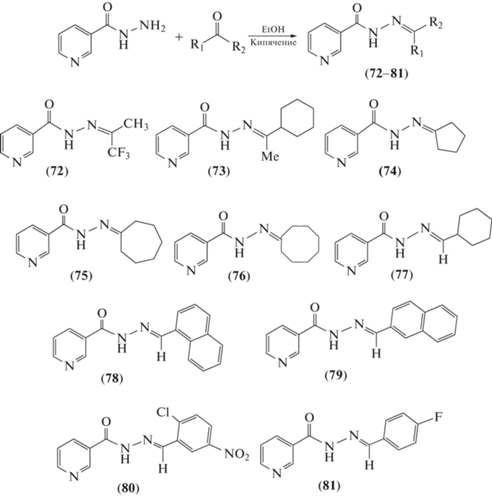
Описан [68] синтез ряда новых N-ацилгидразонов (72–81) с выходом 80–90% конденсацией гидразида никотиновой кислоты с соответствующими альдегидами и кетонами в этаноле в условиях кислого катализа (схема 15 ). Проведена оценка антибактериальной активности серии соединений (72–81) in vitro в отношении двух грамотрицательных (Pseudomonas aeruginosa и Klebsiella pneumoniae) и двух грамположительных (Streptococcus pneumoniae и Staphylococcus aureus) бактерий. Установлено, что гидразоны (72) и (76) эффективны против P. aeruginosa (MIC = 0.220 и 0.195 мкг/мл соответственно).
Схема 15 . Синтез ряда новых N-ацилгидразонов на основе никотиновой кислоты (72–81).
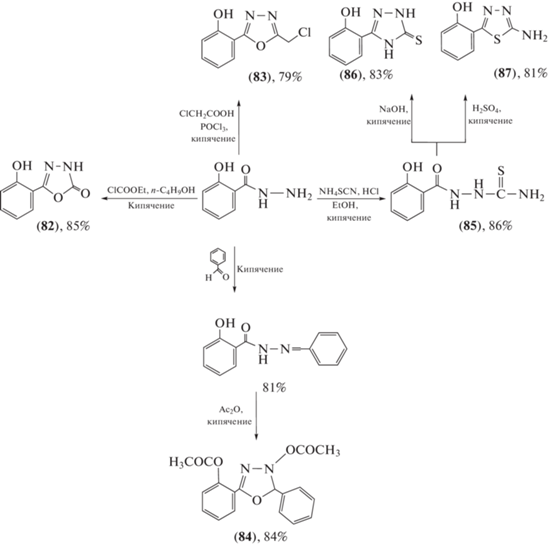
При использовании гидразида салициловой кислоты были получены гетероциклические соединения различного строения и природы (схема 16 ) [69, 70]. Их активность против S. aureus изменялась следующим образом: (82) > (85–87) > (83), в то время как соединение (84) вовсе не проявило активности. Наблюдаемый ряд активности против C. albicans был следующим: (83) > (82) > (84) > (86) > (85).
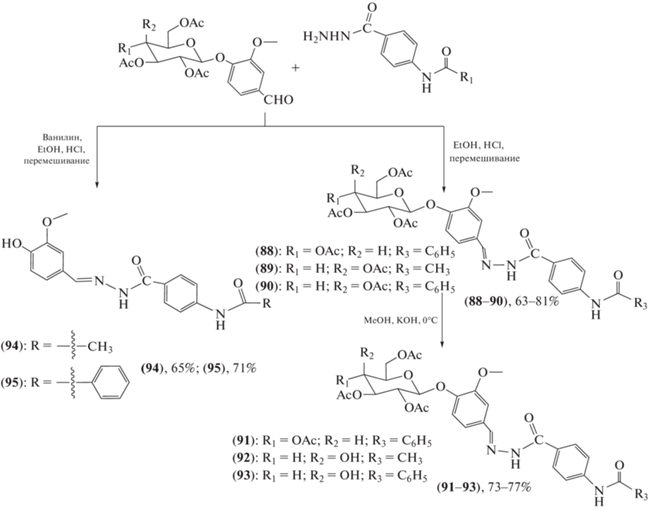
Синтезирована новая серия гликозилированных ацилгидразонов (88–95) и выполнен скрининг их антибактериальной, противогрибковой и противовирусной активности (схема 17 ) [71]. При этом пять соединений (соединения (88–91) и (94)) проявили умеренную противогрибковую активность против оцениваемых штаммов Staphylococcus aureus, Bacillus subtilis, Salmonella typhimurium, Escherichia coli и Candida albicans. У производного (90) выявлена фунгицидная активность в отношении Candida glabrata в концентрации 173.8 мкМ, причем углеводный остаток способствовал увеличению противогрибкового потенциала в отношении этого штамма. Дополнительные химические манипуляции с производным (90) могут привести к получению новых потенциально антимикробных агентов.
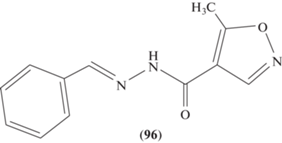
Новый бифункциональный ацилгидразон (96) (рис. 3) был синтезирован реакцией 5-метилизоксазол-4-карбоилгидразина с бензальдегидом. Соединение обладает умеренной антибактериальной активностью, а также вызывает бактериостаз широкого спектра действия [72].
N-АЦИЛГИДРАЗОНЫ C ПРОТИВОВИРУСНОЙ И ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЬЮ
Исследование противовирусной активности соединений, содержащих в своем составе фрагмент ацилгидразона, проводили на различных вирусных объектах. Было установлено, что данные соединения оказывают влияние на вирусы гриппа, простого герпеса 1-го и 2-го типов, вирус Эпштейна–Барр, цитомегаловирус, вирусы гепатита А и вирус иммунодефицита человека [73–78].
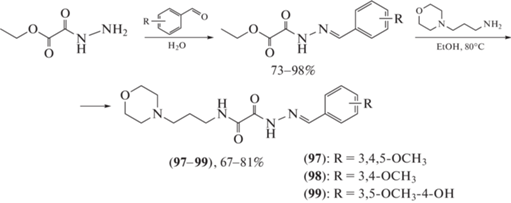
Так, в работе Zhao et al. [73] получены ацилгидразоны с амидным и морфолиновым фрагментами для лечения гриппа A и B (схема 18 ). Соединения (97) (IC50 = 2.61 мкМ), (98) (IC50 = 2.37 мкМ) и (99) (IC50 = 3.15 мкМ) проявляют более высокую ингибирующую активность, чем известный лекарственный препарат осельтамивир карбоксилат (IC50 = 3.84 мкМ).
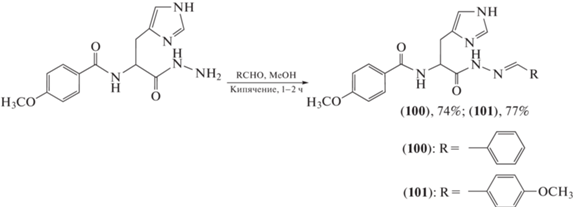
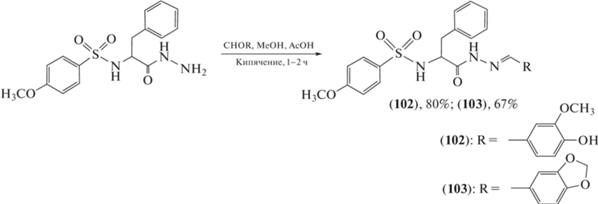
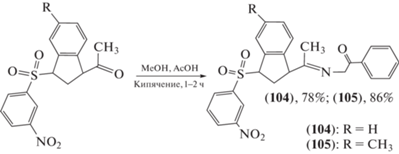
Заражение вирусом иммунодефицита человека (ВИЧ) стало причиной смерти почти 33 млн человек, поиск эффективных схем лечения ВИЧ остается серьезной глобальной проблемой общественного здравоохранения. Проведены эксперименты по синтезу противовирусных агентов (схемы 19–21 ) [74–76]. Установлено, что синтезированные ацилгидразоновые соединения могут ингибировать сборку капсида (капсидный белок ВИЧ-1 играет важную роль в цикле репликации вируса) и обладают противовирусными свойствами, из которых соединения (100–105) проявляли высокую противовирусную активность со значениями IC50, равными 0.21–0.56 мкг/мл.
Схема 19 . Синтез ацилгидразонов (100) и (101).
Схема 20 . Синтез ацилгидразонов (102) и (103).
Схема 21 . Синтез ацилгидразонов (104) и (105).
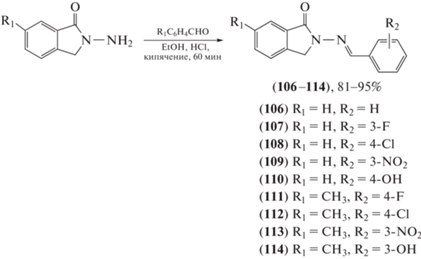
Показано, что в классе ацилгидразонов бензотиазола бензо[d]изотиазол-3(2H)-оновый фрагмент (соединения (106–114)) крайне важен для проявления антиретровирусной активности (схема 22 ) [77].
Схема 22 . Синтез производных с бензо[d]изотиазол-3(2H)-оновым фрагментом (106–114).
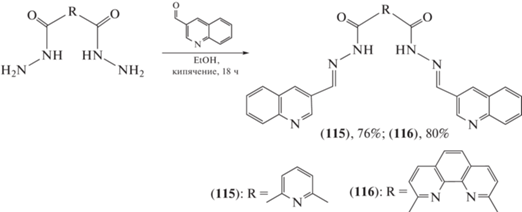
Гидразоны (115) и (116), содержащие пиридиновый, фенантроминовый и хинолиновый фрагменты (схема 23 ) и используемые в концентрации 5 мкМ, были способны значительно снизить экспрессию вируса Эпштейна–Барр в тестируемых клетках in vitro [78].
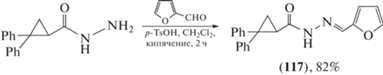
Циклопропилкарбоксиацилгидразон (117) (схема 24 ) проявлял активность против вируса простого герпеса 1-го типа [79].
Схема 23 . Синтез гидразонов (115) и (116).
Схема 24 . Синтез циклопропилкарбоксиацилгидразона (117).
В лечении острых вирусных инфекций важная роль отводится использованию противовоспалительных и анальгетических препаратов, т.к. они снижают температуру тела, облегчают симптомы вирусной инфекции за счет жаропонижающего и обезболивающего эффектов. Почти все нестероидные противовоспалительные препараты (НПВП), такие как ибупрофен, диклофенак и фенопрофен, проявляют клиническую токсичность в отношении желудочно-кишечного тракта из-за прямого контакта присутствующих свободных карбоксильных групп со слизистой оболочкой и ингибирования фермента циклооксигеназы [80]. Поэтому поиск безопасных и малотоксичных препаратов крайне актуален. Обширная база структур для исследований в этой области молекул включает фрагмент C=N–NH–C(C=O).
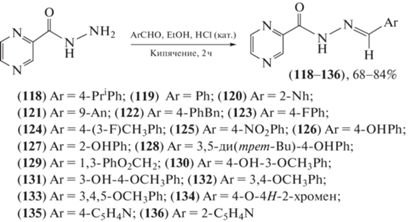
Фармакологическая оценка на различных моделях боли и воспаления синтезированных производных пиразин-N-ацилгидразона (118–136) (схема 25 ) в качестве новых анальгетиков и противовоспалительных препаратов-кандидатов приведена в работе da Silva et al. [81]. Обнаружено, что все полученные производные обладают антиноцицептивной (обезболивающей) и противовоспалительной активностью, особенно соединение (133) (2-N-[(E)-(3,4,5-триметоксифенил)метилиден]-2-пиразинкарбогидразид), которое предлагается авторами как новое обезболивающее и противовоспалительное средство для разработки лекарств.
Схема 25 . Синтез производных пиразин-N-ацилгидразона (118–136).
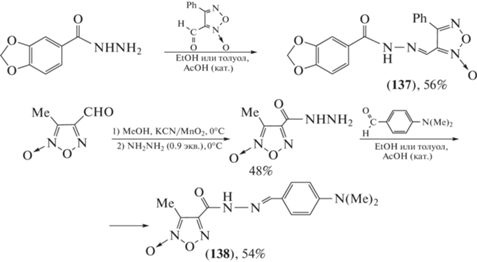
Данный вид активности выявлен также у фуроксанил-N-ацилгидразонов [82]. Среди синтезированных соединений (схема 26 ) фуроксанил-N-ацилгидразоны (137) и (138) проявляли как анальгетическую, так и противовоспалительную активность. Отсутствие мутагенности активных производных (137) и (138) позволяет рассматривать их в качестве кандидатов для дальнейших клинических исследований.
Схема 26 . Синтез производных пиразин-N-ацилгидразона (118–136).
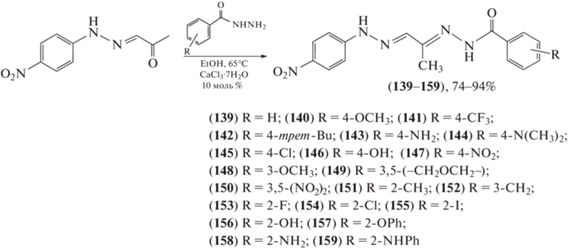
В работе Meira et al. [83] продемонстрирован синтез, выявлены структурные требования и механизм, лежащий в основе противовоспалительной активности нового семейства гидразон-N-ацилгидразонов (139–159). Производные 4-(нитрофенил)-N-ацилгидразона (139–159) были синтезированы (схема 27 ) и подвергнуты скринингу для подавления пролиферации лимфоцитов и ингибирования нитритов в макрофагах. Противовоспалительная активность соединений достигается за счет модулирования секреции IL-1β, синтеза простагландина Е2 в макрофагах и ингибирования активности кальциневринфосфатазы в лимфоцитах. Взаимосвязь “структура–активность” изучали изменением положения заместителей, а также присоединением структурно-связанных заместителей. Показано, что изменение положения заместителя оказывает существенное влияние на противовоспалительную активность соединения. Отмечено также, что N-метильная группа, присоединенная к фрагменту 4-(нитрофенил)гидразона, снижает активность. Соединение (150) значительно уменьшало миграцию воспалительных клеток на модели перитонита, вызванного каррагинаном.
Схема 27 . Синтез производных 4-(нитрофенил)-N-ацилгидразонов (139–159).
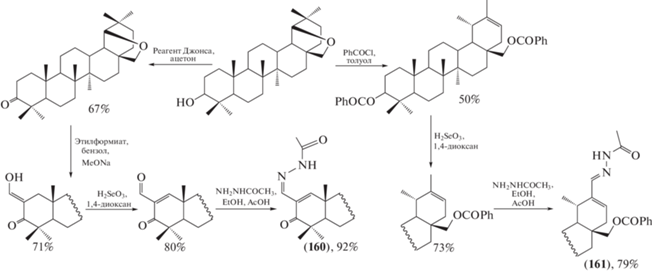
Известные антиангиогенные и противовирусные активности гидразонов бетулиновой и бетулоновой кислот обусловили синтез гидразонов (160) и (161). Для получения целевых соединений (160) и (161) [84] на основе аллобетулина окислением селенистой кислотой промежуточных алкенов синтезированы 18a,19bH-урсановый и 19b,28-эпокси-18aН-олеанановый альдегиды соответственно, вовлеченные далее во взаимодействие по стандартной методике с ацетилгидразином в этаноле в присутствии уксусной кислоты (схема 28 ).
Схема 28 . Синтез гидразонов на основе аллобетулина.
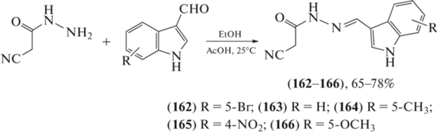
Целью работы Moraes et al. [85] были синтез и оценка противовоспалительного потенциала in vitro, in vivo и in silico новых производных индол-N-ацилгидразона (162–166), полученных конденсацией эквимолярных количеств гидразида α-цианоуксусной кислоты и различных 3-индольных карбоксальдегидных производных (схема 29 ). Реакцию проводили в условиях кислотного катализа, необходимого для образования иона оксония (карбоксальдегида), подвергающегося далее нуклеофильной атаке гидразидным азотом. Последующая дегидратация привела к получению целевых гидразонов (162–166) с выходом 61–98%. Проведены испытания полученных соединений in vitro и in vivo, производное (163) предлагается авторами в качестве соединения-лидера для разработки противовоспалительных препаратов.
Схема 29 . Синтез новых производных индол-N-ацилгидразона (162–166).
N-АЦИЛГИДРАЗОНЫ С ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ
Онкологические заболевания – это широкий и разнообразный класс болезней. Рак – вторая ведущая причина смерти во всем мире, вследствие онкологических заболеваний в 2018 г. умерло ~10 млн человек. У мужчин наиболее распространены рак легких, простаты, толстой кишки, желудка и печени, тогда как у женщин – рак груди, колоректальный рак, рак легких, шейки матки и щитовидной железы.
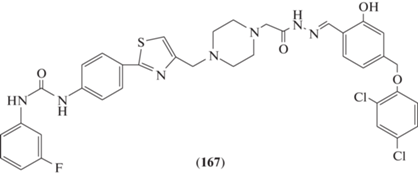
Гидразоны стали важным объектом исследований в поиске противоопухолевых агентов, т.к. производные на основе гидразона обладают активностью против клеточных линий различных опухолей. Так, N-ацилгидразон диарилмочевины (167) (рис. 4) проявил наиболее сильную антипролиферативную активность против трех клеточных линий: линии лейкемии человека (HL-60), линии эпителиальных клеток аденокарциномы легкого человека (A549) и линии клеток рака молочной железы человека (MDA-MB-231) со значениями IC50, равными 0.13, 0.7 и 0.5 мМ соответственно [86].
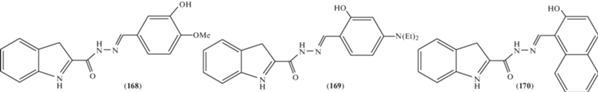
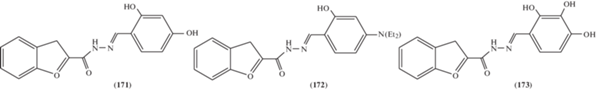
Арилиден-1Н-индол-2-карбогидразоны (168–170) (рис. 5) [87] и бензофурангидразоны (171–173) (рис. 6) [88] продемонстрировали высокую степень антипролиферативного эффекта на клеточных линиях эритролейкемии человека K562 и меланомы Colo-38.
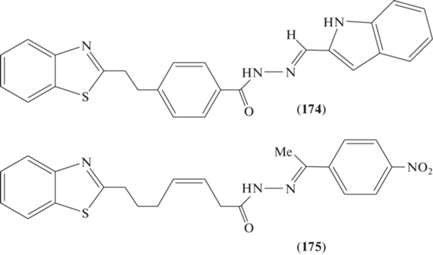
Соединения на основе катапкаса (174) и (175) (рис. 7) [88] проявили явно селективную цитотоксическую активность против клеточных линий гепатокарциномы Huh-7 in vitro ((174), IC50 = 7.74 ± ± 2.18 мкг/мл; (175), IC50 = 4.46 ± 1.05 мкг/мл) по сравнению с противоопухолевым препаратом 5-FU (IC50 = 10.41 ± 3.41 мкг/мл).
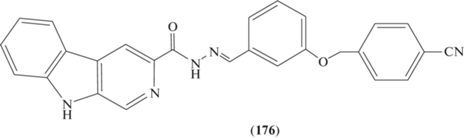
Ацилгидразон с β-карболиновым фрагментом (176) (рис. 8) [89] проявлял наиболее высокую противоопухолевую активность со значениями IC50, равными 1–2 мкМ, против клеточных линий MCF-7, MCF-7/ADR (рака молочной железы) и сохранял значительную активность в раковых клетках со множественной лекарственной устойчивостью.
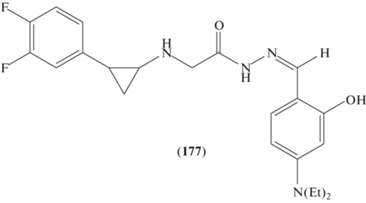
Производное фенилаланилгидразона (177) (рис. 9) [90] может служить потенциальным соединением для клеточных “мишеней” гиперэкспрессированного рака желудка LSD1.
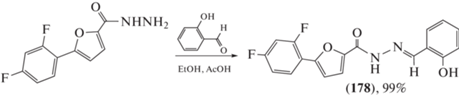
Ацилгидразон (178), полученный при кипячении салицилальдегида и 5-(2,4-дифторфенил)-2-фурангидразида в этаноле в присутствии катализатора AcOH (схема 30 ), проявил активность против клеточных линий промиелоцитарного лейкоза человека HL-60 (IC50 = 16.4 мМ), в 3 раза превосходящую активность известного цитостатического препарата доксорубицина (IC50 = 53.3 мМ) [91].
Схема 30 . Ацилгидразон (178), полученный при кипячении салицилальдегида и 5-(2,4-дифторфенил)-2-фурангидразида.
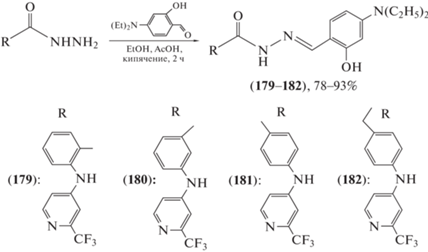
Производные 2-гидроксибензилиденовых производных гидразида N-(2-трифторметилпиридин-4-ил)антраниловой кислоты и некоторые аналоги, содержащие (2-трифторметил)пиридин-4-иламиногруппу в 3-м или 4-м положениях бензогидразида или 4-м положении фенилацетогидразида, были получены (схема 31 ) и изучены в качестве потенциальных противоопухолевых агентов [92]. Соединения (179–182), несущие 4-(диэтиламино)салицилиденовую группу, проявляли сильную цитотоксичность со средними значениями IC50 в субмикромолярном диапазоне и различную клеточную селективность при наномолярных концентрациях.
Схема 31 . Синтез ацилгидразонов (179–182).
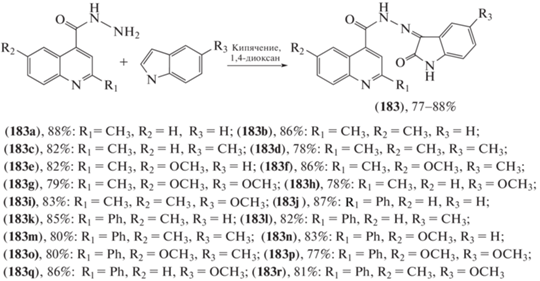
Интерес использования производных изатина в реакции конденсации с гидразидами карбоновых кислот обусловлен их известностью в качестве лекарственных противоопухолевых препаратов и биологически активных веществ (триптофан, серотонин, грамин, тиосемикарбазоны изатина) [93, 94]. С целью поиска новых высокоэффективных биологически активных веществ осуществлен синтез 2R,6R'-(5-X-2-оксо-1,2-дигидро-3Н-индол-3-илиден)хинолин-4-карбоксигидразидов (183а–о) кипячением гидразидов 2R,6R'-хинолинкарбоновых кислот с замещенными 5-изатинами в течение 24 ч в 1,4-диоксане, выход продуктов составил 77–88% (схема 32 ) [95]. Соединения показали значительную антипролиферативную активность в отношении тестируемых линий раковых клеток человека – почечной аденокарциномы (769-P) и гепатоцеллюлярной карциномы (HepG2).
Схема 32 . Синтез 2R,6R'-(5-X-2-оксо-1,2-дигидро-3Н-индол-3-илиден)хинолин-4-карбоксигидразидов (183а–о).
N-АЦИЛГИДРАЗОНЫ С ПЕСТИЦИДНОЙ АКТИВНОСТЬЮ
Помимо проявления различных видов фармакологической активности, гидразоны широко используются в сельском хозяйстве с целью обеспечения защиты растений от насекомых-вредителей, грибов-паразитов и др.
Термин “пестицид” охватывает широкий спектр соединений, включая инсектициды, фунгициды, гербициды, родентициды, моллюскоциды, нематоциды, регуляторы роста растений. Среди них хлорорганические инсектициды, успешно используемые для борьбы с рядом заболеваний, таких как малярия и тиф, были запрещены или ограничены в применении после 1960-х гг. в большинстве технологически развитых стран. Внедрение фосфорорганических инсектицидов в 1960-х, карбаматов в 1970-х и пиретроидов в 1980-х, а также гербицидов и фунгицидов в 1970–1980-х гг. в значительной степени способствовало борьбе с вредителями в сельскохозяйственном производстве [96]. Длительное использование инсектицидов вызывает резистентность вредителей к ним, поэтому поиск новых соединений, обладающих инсектицидной активностью, актуален для развития сельскохозяйственной отрасли.
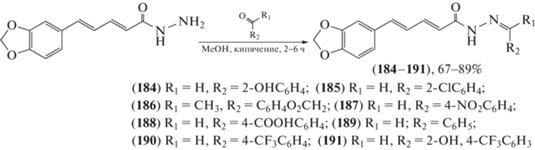
Был предложен и синтезирован ряд производных диенегидразида (184–191) (схема 33 ) на основе пиперина для использования в качестве инсектицидов против комара обыкновенного Culex pipiens [97]. Инсектицидная активность соединений (184–191) была испытана против личинок С. pipiens в диапазоне концентраций 0.1‒1.2 мг/мл. Конечная смертность при концентрации 0.75 мг/мл после 48 ч обработки варьировала в диапазоне 80.00–83.33%, а значения LC50 составляли 0.221–0.094 мг/мл. В итоге эти соединения продемонстрировали более высокую ларвицидную (против личинок и гусениц насекомых) активность, чем пиперин и дельтаметрин.
Схема 33 . Синтез ряда производных диенегидразида (184–191).
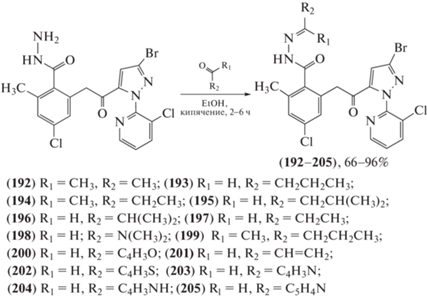
Производные пиразола и гидразона обладают высокой инсектицидной активностью, их субструктурные единицы широко используются при разработке пестицидов. В попытке создать новые молекулы с высокой инсектицидной активностью был синтезирован (схема 34 ) и подвергнут биологическому анализу ряд производных пиразоламида, содержащих гидразоновые фрагменты [98]. Тесты in vivo показали, что некоторые из соединений (192–205) обладают высокой активностью против капустной моли (Plutella xylostella), хлопковой совки (Helicoverpa armigera), комара обыкновенного (Culex pipiens pallens), мелкого муравья (Laemodonta exigua), азиатской хлопковой совки (Spodoptera litura), бурой рисовой цикадки (Nilaparvata lugens) и тли кукурузного листа (Rhopalosiphum maidis). Конъюгат (198) проявлял 100%-ную активность против H. armigera в концентрации 25 мг/л. Соединения, содержащие фрагменты алкена (203), пиррола (204) и пиридина (205), полностью уничтожали C. pipiens pallens в концентрации 0.5 мг/л. Ацилгидразон (199) проявил 100%-ную активность против L. exigua (200 мг/л), а соединения (196–198) полностью подавляли S. litura в концентрации 20 мг/л.
Схема 34 . Синтез ряда производных пиразоламида, содержащих гидразоновые фрагменты.
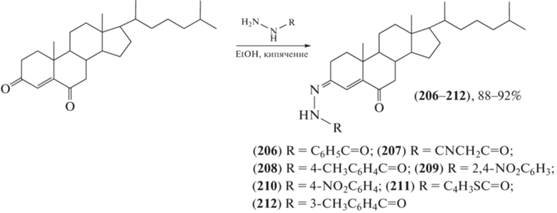
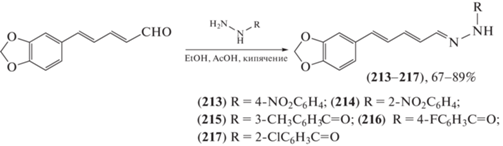
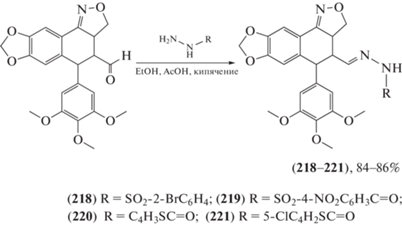
Восточная луговая совка (Mythimna separata) – вид бабочек из семейства совок, гусеницы которых – опасные вредители в сельском хозяйстве: они повреждают овес, пшеницу, ячмень, озимую рожь, кукурузу, сою, кормовые травы, реже рис, зерновое сорго. Были синтезированы [99–102] новые гидразоны, перспективные пестицидные агенты против M. separata на основе холестерина (206–212) (схема 35 ), пиперина (213–217) (схема 36 ) и лигнанового подофиллотоксина (218–221) (схема 37 ). Сделаны предположения о взаимосвязи “структура – инсектицидная активность”: все производные (206–212) проявляли более высокую инсектицидную активность, чем их предшественник холестерин. Это может послужить основой для дальнейшей структурной модификации и развития холестерина как инсектицидного агента. Введение заместителей в положение С-2 фенильного кольца производных гидразона (213–217) имеет большее значение для проявления инсектицидной активности, а введение в положение С-9 подофиллотоксина гидразидов, содержащих различные гетероциклы, необходимо для получения гидразонов в качестве инсектицидных агентов. Некоторые производные проявляли более выраженную инсектицидную активность в концентрации 1 мг/мл по сравнению с тоосенданином, коммерческим ботаническим (полученным из растений) инсектицидом, выделенным из Melia azedarach.
Схема 35 . Синтез гидразонов на основе холестерина.
Схема 36 . Синтез гидразонов на основе пиперина.
Схема 37 . Синтез гидразонов на основе лигнанового подофиллотоксина.
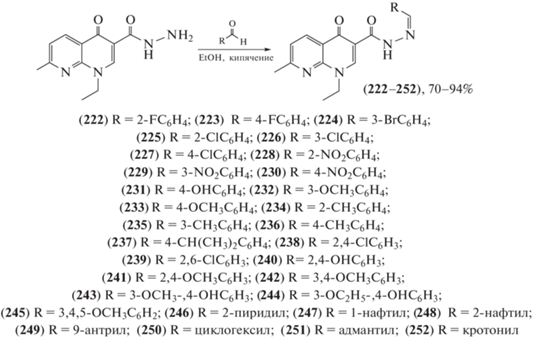
Ряд замещенных гидразонов (222–252) был синтезирован (схема 38 ) из гидразида налидиксовой кислоты [103]. Эти соединения оценивали на предмет различной биологической активности – фунгицидной и инсектицидной. Фунгицидную активность определяли для пяти видов патогенных грибов (Rhizoctonia bataticola, Sclerotium rolfsii, Rhizoctonia solani, Fusarium oxysporum и Alternaria porii). Ацилгидразоны показали максимальное ингибирование A. porii (ED50 = 34.2–151.3 мкг/мл). Активность была сопоставима с таковой для коммерческого фунгицида гексаконазола (ED50 = 25.4 мкг/мл). Соединения также тестировали на инсектицидную активность против личинок третьего поколения азиатской хлопковой совки (Spodoptera litura) и взрослых особей четырехпятнистой зерновки (Callosobruchus maculatus) и хрущака малого булавоусого (Tribollium castaneum). При применении большинства исследуемых соединений смертность S. litura достигала 70–100% при введении в дозе 0.1%.
Схема 38 . Синтез ряда замещенных гидразонов (222–252) из гидразида налидиксовой кислоты.
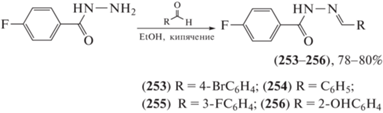
Галогенсодержащие гидразоны проявляют высокую инсектицидную активность. Так, синтезирован ряд N-ацилгидразонов (253–256) [104] на основе гидразида 4-фторбензойной кислоты и бензальдегида или его Br-, F- и OH-замещенных производных (схема 39 ). Исследованы репеллентные и ларвицидные свойства галогенсодержащих гидразонов (253–256) против комара желтолихорадочного (Aedes aegypti). Соединение (255) проявило самую высокую репеллентную активность (BDI (индекс сдерживания укусов) = 1.025). В ларвицидных крининговых биотестах ацилгидразоны (253–256) вызывали 100%-ную смертность личинок комара при самой низкой скрининговой дозе 0.01%. Инсектицидная и репеллентная активность коррелировали с присутствием атома галогена в фенильном заместителе гидразоновой части.
Схема 39 . Синтез ряда N-ацилгидразонов (253–256) на основе гидразида 4-фторбензойной кислоты и бензальдегида или его Br-, F- и OH-замещенных производных.
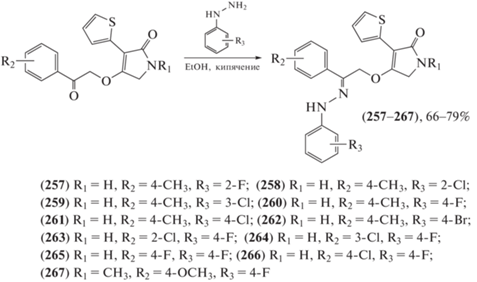
Фунгициды используются в сельском хозяйстве и способны полностью или частично подавлять рост болезнетворных паразитарных грибков. Было обнаружено, что тетрамовая кислота, производные тиофена и гидразона проявляют высокую фунгицидную активность. С целью создания новых молекул-матриц с высокой противогрибковой активностью была синтезирована и испытана серия новых производных 3-(тиофен-2-ил)-1,5-дигидро-2H-пиррол-2-она (257–267) (схема 40 ), содержащих гидразоновую группу, на противогрибковую активность против Fusarium graminearum, Rhizoctorzia solani, Botrytis cinerea и Colletotrichum capsici in vitro [105–109]. Полученные результаты свидетельствуют о том, что производные 3-(тиофен-2-ил)-1,5-дигидро-2H-пиррол-2-она (257–267), содержащие гидразоновую группу, могут служить потенциальными структурными матрицами в поисках новых и высокоэффективных фунгицидов.
Схема 40 . Синтез серии новых производных 3-(тиофен-2-ил)-1,5-дигидро-2H-пиррол-2-она.
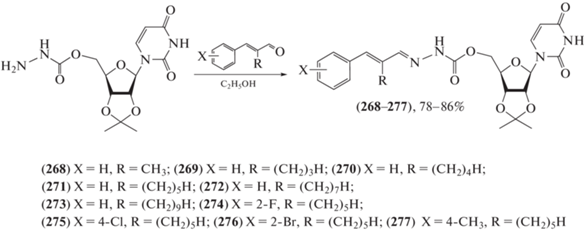
В основе создания новых противогрибковых препаратов лежит поиск соединений – ингибиторов хитинсинтазы, т.к. хитин – структурный компонент грибковых клеточных стенок, отсутствующий у позвоночных. Синтезирован ряд соединений (268–277) (схема 41 ), которые проявляли противогрибковую активность против грибов-паразитов в сельском хозяйстве: Fusarium graminearum, Botrytis cinerea и Colletotrichum lagenarium [110–112]. Наиболее мощное из них – соединение (274) – продемонстрировало высокую ингибирующую активность по отношению к хитинсинтазе (IC50 = 64.5 мкМ).
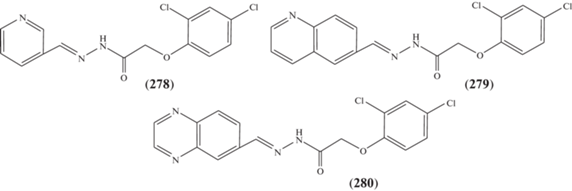
Гидразоны (278–280) (рис. 10) [113–115] также проявляют фунгицидную активность, вызывающую 2–3-кратное подавление развития Fusarium sporotrichiella var. poae.
Схема 41 . Синтез ряда ацилгидразоновых соединений, проявляющих противогрибковую активность.
ЗАКЛЮЧЕНИЕ
Рассмотрены примеры синтеза N-ацилгидразонов различного строения на основе природных и синтетических соединений и исследований их биологических свойств. Отмечено, что наиболее широко применяемый метод их получения – конденсация карбонильных соединений (альдегидов и кетонов) с соответствующими гидразидами органических кислот различной природы. Показано, что N-ацилгидразоны обладают широким спектром фармакологических свойств (противотуберкулезное, антибактериальное, противомикробное, противовирусное, противовоспалительное, противоопухолевое действие) и пестицидной активностью, что открывает перспективы их использования в медицине для создания лекарственных препаратов, а также в сельском хозяйстве для разработки пестицидов.
Список литературы
Нуркенов О.А., Сатпаева Ж.Б., Кулаков И.В., Ахметова С.Б., Жаугашева С.К. // Журн. общ. химии. 2012. Т. 82. С. 582–585. https://doi.org/10.1134/S107036321204010X
Колотова Н.В., Старкова А.В., Чащина С.В. // Вопросы обеспечения качества лекарственных средств. 2016. № 3(13). С. 15–23.
Smith M.B., Jerry M. // March’s Advanced Organic Chemistry, 6th edition. John Wiley & Sons, Milton, Australia, 2007.
Lazny R., Nodzewska A. // Chem. Rev. 2010. V. 110. P. 1386–1434. https://doi.org/10.1021/cr900067y
Belkheiri N., Bouguerne B., Bedos-Belval F., Duran H., Bernis C., Salvayre R., Nègre-Salvayre A., Baltas M. // Eur. J. Med. Chem. 2010. V. 45. P. 3019–3026. https://doi.org/10.1016/j.ejmech.2010.03.031
Radwan M.A., Ragab E.A., Sabry N.M., El-Shenawy S.M. // Bioorg. Med. Chem. 2007. V. 15. P. 3832–3841. https://doi.org/10.1016/j.bmc.2007.03.024
Almasirad A., Tajik M., Bakhtiari D., Shafiee A., Abdollahi M., Zamani M.J., Khorasani R., Esmaily H. // J. Pharm. Pharm. Sci. 2005. V. 8. P. 419–425.
Sridhar S.K., Pandeya S.N., Stables J.P., Ramesh A. // Eur. J. Pharm. Sci. 2002. V. 16. P. 129–132. https://doi.org/10.1016/s0928-0987(02)00077-5
Kaushik D., Khan S.A., Chawla G., Kumar S. // Eur. J. Med. Chem. 2010. V. 45. P. 3943–3949. https://doi.org/10.1016/j.ejmech.2010.05.049
Duarte C.D., Barreiro E.J., Fraga C.A. // Mini Rev. Med. Chem. 2007. V. 7. P. 1108–1119. https://doi.org/10.2174/138955707782331722
Salgin-Gökşen U., Gökhan-Kelekçi N., Göktaş O., Köysal Y., Kiliç E., Işik S., Aktay G., Ozalp M. // Bioorg. Med. Chem. 2007. V. 15. P. 5738–5751. https://doi.org/10.1016/j.bmc.2007.06.006
Deeb A., El-Mariah F., Hosny M. // Bioorg. Med. Chem. Lett. 2004. V. 4. P. 5013–5017. https://doi.org/10.1016/j.bmcl.2004.06.102
Rasras A.J.M., Al-Tel T.H., Al-Aboudi A.F., Al-Qawasmeh R.A. // Eur. J. Med. Chem. 2010. V. 45. P. 2307–2313. https://doi.org/10.1016/j.ejmech.2010.02.006
Ozkay Y., Tunali Y., Karaca H., Işikdağ I. // Eur. J. Med. Chem. 2010. V. 45. P. 3293–3298. https://doi.org/10.1016/j.ejmech.2010.04.012
Kumar D., Maruthi Kumar N., Ghosh S., Shah K. // Bioorg. Med. Chem. Lett. 2012. V. 22. P. 212–215. https://doi.org/10.1016/j.bmcl.2011.11.031
Effenberger K., Breyer S., Schobert R. // Eur. J. Med. Chem. 2010. V. 45. P. 1947–1954. https://doi.org/10.1016/j.ejmech.2010.01.037
Jordão A.K., Sathler P.C., Ferreira V.F., Campos V.R., de Souza M.C., Castro H.C., Lannes A., Lourenco A., Rodrigues C.R., Bello M.L., Lourenco M.C., Carvalho G.S., Almeida M.C., Cunha A.C. // Bioorg. Med. Chem. 2011. V. 19. P. 5605–5611. https://doi.org/10.1016/j.bmc.2011.07.035
Mahajan A., Kremer L., Louw S., Guérardel Y., Chibale K., Biot C. // Bioorg. Med. Chem. Lett. 2011. V. 21. P. 2866–2868. https://doi.org/10.1016/j.bmcl.2011.03.082
Зеленин К.Н. // Соросовский образовательный журнал. 1998. Т. 42. № 5. С. 59–65.
Stoica A.-I., Vinas C., Texidor F. // Chem. Commun. 2008. V. 48. P. 6492–6494. https://doi.org/10.1039/B813285B
Rollas S., Küçükgüzel Ş.G. // Molecules. 2007. V. 12. P. 1910–1939. https://doi.org/10.3390/12081910
Dogan H.N., Duran A., Rollas S., Şener G., Armutak Y., Keyer-Uysal M. // Med. Sci. Res. 1998. V. 26. P. 755–758.
Kalsi R., Shrimali M., Bhalla T.N., Barthwal J.P. // Indian J. Pharm. Sci. 2006. V. 41. P. 353–359.
Mohareb R.M., Fleita D.H., Sakka O.K. // Molecules. 2011. V. 16. P. 16–27. https://doi.org/10.3390/molecules16010016
Popiołek Ł., Biernasiuk A., Malm A. // Phosphorus Sulfur. 2015. V. 190. P. 251–260. https://doi.org/10.1080/10426507.2014.919293
Popiołek Ł., Stefańska J., Kiełczykowska M., Musik I., Biernasiuk A., Malm A., Wujec M. // J. Heterocycl. Chem. 2016. V. 53. P. 393–402. https://doi.org/10.1002/jhet.2418
Popiołek Ł., Biernasiuk A., Malm A. // J. Heterocycl. Chem. 2016. V. 53. P. 479–486. https://doi.org/10.1002/jhet.2429
Bala S., Uppal G., Kajal A., Kamboj S., Sharma V. // Int. J. Pharm. Sci. Rev. Res. 2013. V. 18. P. 65–74.
Popiołek Ł., Biernasiuk A., Malm A. // Phosphorus Sulfur. 2015. V. 190. P. 251–260. https://doi.org/10.1080/10426507.2014.919293
Gawrońska‑Grzywacz M., Popiołek Ł., Natorska‑Chomicka D., Piątkowska‑Chmiel I., Izdebska M., Herbet M., Wujec M. // Oncology Rep. 2019. V. 41. P. 693–701. https://doi.org/10.3892/or.2018.6800
Popiołek Ł., Biernasiuk A. // J. Enzym. Inhib. Med. Chem. 2016. V. 31. P. 62–69. https://doi.org/10.3109/14756366.2016.1170012
Popiołek Ł., Biernasiuk A. // Chem. Biol. Drug Des. 2016. V. 88. P. 873–883. https://doi.org/10.1111/cbdd.12820
Муковоз П.П., Козьминых В.О. // Известия высших учебных заведений. Поволжский регион. 2013. № 2. С. 88–101.
Тарадейко Т.И., Галашева С.Н., Кутькина Д.Н., Щенникова О.Б., Иозеп А.А. // Разработка и регистрация лекарственных средств. 2018. № 2. С. 86–90.
Губаева Р.А., Шабалина Ю.В., Халиуллин Ф.А. // Башкирский химический журнал. 2011. Т. 18. С. 109–110.
Мясоедова Ю.В., Беляева Э.Р., Гарифуллина Л.Р., Просвирнина Д.А., Ишмуратов Г.Ю. // Журн. общ. химии. 2022. Т. 51. С. 96–101. https://doi.org/10.31857/S0514749222010104
Китаев Ю.П., Бузыкин Б.И. // Гидразоны. Москва: Наука, 1974. 416 с.
Verma G., Marella A., Shaquiquzzaman M., Akhtar M., Ali M.R., Alam M.M. // J. Pharm. BioAllied Sci. 2014. V. 6. P. 69–80. https://doi.org/10.4103/0975-7406.129170
Колено Д.И. // Наука и современность. Химические науки. 2012. № 17. С. 241–244.
Zhao Z.X., Cheng L.P., Pang W. // Tetrahedron Lett. 2018. V. 59. P. 2079–2081. https://doi.org/10.1016/j.tetlet.2018.04.047
Jordão A.K., Sathler P.C., Ferreira V.F., Campos V.R., de Souza M.C., Castro H.C., Lannes A., Lourenco A., Rodrigues C.R., Bello M.L., Lourenco M.C., Carvalho G.S., Almeida M.C., Cunha A.C. // Bioorg. Med. Chem. 2011. V.19. P. 5605–5611. https://doi.org/10.1016/j.bmc.2011.07.035
Bedia K.K., Elçin O., Seda U., Fatma K., Nathaly S., Sevim R., Dimoglo A.S. // Eur. J. Med. Chem. 2006. № 41. P. 1253–1261. https://doi.org/10.1016/j.ejmech.2006.06.009
Camus J.C., Pryor M.J., Médigue C., Cole S.T. // Microbiology. 2002. V. 148. P. 2967–2973. https://doi.org/10.1099/00221287-148-10-2967
Казунин М.С., Прийменко Б.А. // Актуальные проблемы медицины. 2013. Т. 25. № 24. С. 226–231.
Hernández P., Rojas R., Gilman R.H., Sauvain M., Lima L.M., Barreiro E.J., González M., Cerecetto H. // Eur. J. Med. Chem. 2013. V. 59. P. 64–74. https://doi.org/10.1016/j.ejmech.2012.10.047
Vergara F.M., Lima C.H., Henriques M., Candéa A.L., Lourenço M.C., Ferreira M. de L., Kaiser C.R., de Souza M.V. // Eur. J. Med. Chem. 2009. V. 44. P. 4954–4959. https://doi.org/10.1016/j.ejmech.2009.08.009
Rivers E.C., Mancera R.L. // Drug Discov. Today. 2008. V. 13. P. 1090–1098. https://doi.org/10.1016/j.drudis.2008.09.004
Barry P.J., O’Connor T.M. // Curr. Med. Chem. 2007. V. 14. P. 2000–2008. https://doi.org/10.2174/092986707781368496
Boogaard J., Kibiki G.S., Kisanga E.R., Boeree M.J., Aarnoutse R.E. // Antimicrob. Agents Chemother. 2009. V. 53. P. 849–862. https://doi.org/10.1128/AAC.00749-08
Ludwig B.S., Correia D.G., Kühn F.E. // Coord. Chem. Rev. 2019. V. 396. P. 22–48. https://doi.org/10.1016/j.ccr.2019.06.004
Hillard E., Vessières A., Thouin L., Jaouen G., Amatore C. // Angew. Chem. Int. Ed. Engl. 2006. V. 45. P. 285–290. https://doi.org/10.1002/anie.200502925
Payen O., Top S., Vessières A., Brulé E., Plamont M.A., McGlinchey M.J., Müller-Bunz H., Jaouen G. // J. Med. Chem. 2008. V. 51. P. 1791–1799. https://doi.org/10.1021/jm701264d
Dubar F., Anquetin G., Pradines B., Khalife J., Biot C. // J. Med. Chem. 2009. V. 52. P. 7954–7957. https://doi.org/10.1021/jm901357n
Biot C., Daher W., Chavain N. // J. Med. Chem. 2006. V. 49. P. 2845–2849. https://doi.org/10.1021/jm0601856
Blackie M.A., Beagley P., Croft S.L., Kendrick H., Moss J.R., Chibale K. // Bioorg. Med. Chem. 2007. V. 20. P. 6510–6516. https://doi.org/10.1016/j.bmc.2007.07.012
Biot C., François N., Maciejewski L., Brocard J., Poulain D. // Bioorg. Med. Chem. Lett. 2000. V. 10. P. 839–841. https://doi.org/10.1016/s0960-894x(00)00120-7
Baramee A., Coppin A., Mortuaire M., Pelinski L., Tomavo S., Brocard J. // Bioorg. Med. Chem. 2006. V. 14. P. 1294–1302. https://doi.org/10.1016/j.bmc.2005.09.054
Higgins P.J., Gellett A.M. // Bioorg. Med. Chem. Lett. 2009. V. 19. P. 1614–1617. https://doi.org/10.1016/j.bmcl.2009.02.023
Maguene G.M., Jakhlal J., Ladyman M., Vallin A., Ralambomanana D.A., Bousquet T., Maugein J., Lebibi J., Pélinski L. // Eur. J. Med. Chem. 2011. V. 46. P. 31–38. https://doi.org/10.1016/j.ejmech.2010.10.004
Катаев В.Е., Милицина О.И., Стробыкина И.Ю., Ковыляева Г.И., Мусин Р.З., Федорова О.В., Русинов Г.Л., Зуева М.Н., Мордовской Г.Г., Толстиков А.Г. // Хим.-фарм. журнал. 2006. Т. 40. № 9. С. 12–27.
Андреева О.В., Шарипова Р.Р., Стробыкина И.Ю., Лодочникова О.А., Добрынин А.Б., Бабаев В.М., Честнова Р.В., Миронов В.Ф., Катаев В.Е. // Журн. общ. химии. 2011. Т. 81. №. 8. С. 1298–1305.
Lin H., Doebelin C., Patouret R. Garcia-Ordonez R., Chang M., Dharmarajan V., Bayona C., Cameron M., Griffin P., Kamenecka T. // Bioorg. Med. Chem. Lett. 2018. V. 28. P. 1313–1319. https://doi.org/10.1016/j.bmcl.2018.03.019
Kumar P., Narasimhan B., Sharma D., Judge V., Narang R. // Eur. J. Med. Chem. 2009. V. 44. P. 1853–1863. https://doi.org/10.1016/j.ejmech.2008.10.034
Власова Н.А., Курбатов Е.Р., Коркодинова Л.М., Одегова Т.Ф., Визгунова О.Л. // Вестн. Воронеж. гос. ун-та. Серия: Химия. Биология. Фармация. 2013. № 2. С. 27–30.
Шматкова Н.В., Сейфуллина И.И., Зинченко О.Ю., Линенко И.С. // Вісник Одеського національного університету. Хімія. 2016. Т. 21. № 1. С. 36–49.
He J.B., Feng L.L., Li J., Tao R.J., Ren Y.L., Wan J., He H.W. // Bioorg. Med. Chem. 2014. V. 22. P. 89–94. https://doi.org/10.1016/j.bmc.2013.11.051
He H., Xia H., Xia Q., Ren Y., He H. // Bioorg. Med. Chem. 2017. V. 25. P. 5652–5661. https://doi.org/10.1016/j.bmc.2017.08.038
Morjan R.Y., Mkadmh A.M., Beadham I., Elmanama A.A., Mattar M.R., Raftery J., Pritchard R.G., Awadallah A.M., Gardiner J.M. // Bioorg. Med. Chem. Lett. 2014. V. 24. P. 5796–5800. https://doi.org/10.1016/j.bmcl.2014.10.029
Sarshira E.M., Hamada N.M., Moghazi Y.M., Abdelrahman M.M. // J. Heterocycl. Chem. 2016. V. 53. P. 1970–1982. https://doi.org/10.1002/JHET.2516
Plech T., Paneth A., Kaproń B., Kosikowska U., Malm A., Strzelczyk A., Stączek P. // Chem. Biol. Drug Des. 2015. V. 85. P. 315–325. https://doi.org/10.1111/cbdd.12392
El-Mahdy K., El-Kazak A., Abdel-Megid M., Seada M., Farouk O. // Acta Chim. Slov. 2016. V. 63. P. 18–25. https://doi.org/10.17344/acsi.2015.1555
Alam M.S., Liu L., Lee Y.E., Lee D.U. // Chem. Pharm. Bull. (Tokyo). 2011. V. 59. P. 568–573. https://doi.org/10.1248/cpb.59.568
Zhao Z.X., Cheng L.P., Li M., Pang W., Wu F.H. // Eur. J. Med. Chem. 2019. V. 173. P. 305–313. https://doi.org/10.1016/j.ejmech.2019.04.006
Jin Y., Tan Z., He M., Tian B., Tang S., Hewlett I., Yang M. // Bioorg. Med. Chem. 2010. V. 18. P. 2135–2140. https://doi.org/10.1016/j.bmc.2010.02.003
Tian B., He M., Tang S., Hewlett I., Tan Z., Li J., Jin Y., Yang M. // Bioorg. Med. Chem. Lett. 2009. V. 19. P. 2162–2167. https://doi.org/10.1016/j.bmcl.2009.02.116
Che Z.P., Tian Y., Liu S.M., Chen G.Q. // Brazil. J. Pharm. Sci. 2018. V. 54. P. e17543. https://doi.org/10.1590/s2175-97902018000417543
Vicini P., Incerti M., La Colla P., Loddo R. // Eur. J. Med. Chem. 2009. V. 44. P. 1801–1807. https://doi.org/10.1016/j.ejmech.2008.05.030
Ammal P.R., Prasad A.R., Joseph A. // Heliyon. 2020. V. 6. P. e05144. https://doi.org/10.1016/j.heliyon.2020.e05144
McNulty J., Babu Dokuburra C., D’Aiuto L., Demers M., McClain L., Piazza P., Williamson K., Zheng W., Nimgaonkar V.L. // Bioorg. Med. Chem. Lett. 2020. V. 30. P. 127559. https://doi.org/10.1016/j.bmcl.2020.127559
Карасёва Г.А. // Медицинские новости. 2012. № 8. С. 697–702.
da Silva Y.K., Augusto C.V., de Castro Barbosa M.L., de Albuquerque Melo G.M., de Queiroz A.C., de Lima Matos Freire Dias T., Júnior W.B., Barreiro E.J., Lima L.M., Alexandre-Moreira M.S. // Bioorg. Med. Chem. 2010. V. 18. P. 5007–5015. https://doi.org/10.1016/j.bmc.2010.06.002
Hernández P., Cabrera M., Lavaggi M.L., Celano L., Tiscornia I., Rodrigues da Costa T., Thomson L., Bollati-Fogolín M., Miranda A.L., Lima L.M., Barreiro E.J., González M., Cerecetto H. // Bioorg. Med. Chem. 2012. V. 20. P. 2158–2171. https://doi.org/10.1016/j.bmc.2012.01.034
Meira C.S., Dos Santos Filho J.M., Sousa C.C., Anjos P.S., Cerqueira J.V., Dias Neto H.A., da Silveira R.G., Russo H.M., Wolfender J.L., Queiroz E.F., Moreira D.R.M., Soares M.B.P. // Bioorg. Med. Chem. 2018. V. 26. P. 1971–1985. https://doi.org/10.1016/j.bmc.2018.02.047
Назаров М.А., Жикина Л.А., Толмачева И.А., Гришко В.В. // Башкирский хим. журн. 2017. Т. 24. № 4. С. 28–32.
Moraes A.D.T.O., Miranda M.D.S., Jacob Í.T.T., Amorim C.A.D.C., Moura R.O., Silva S.Â.S.D., Soares M.B.P., Almeida S.M.V., Souza T.R.C.L., Oli-veira J.F., Silva T.G.D., Melo C.M.L., Moreira D.R.M., Lima M.D.C.A. // Bioorg. Med. Chem. 2018. V. 26. P. 5388–5396. https://doi.org/10.1016/j.bmc.2018.07.024
Zhang B., Zhao Y.F., Zhai X., Fan W.J., Ren J.L., Wu C.F., Gong P. // Chem. Pharm. Bull. 2012. V. 60. P. 1046–1054. https://doi.org/10.1016/j.cclet.2012.06.009
Demurtas M., Baldisserotto A., Lampronti I., Moi D., Balboni G., Pacifico S., Vertuani S., Manfredini S., Onnis V. // Bioorg. Chem. 2019. V. 85. P. 568–576. https://doi.org/10.1016/j.bioorg.2019.02.007
Yu X., Shi L., Ke S. // Bioorg. Med. Chem. Lett. 2015. V. 25. P. 5772–5776. https://doi.org/10.1016/j.bmcl.2015.10.069
Li Y., Yan W., Yang J., Yang Z., Hu M., Bai P., Tang M., Chen L. // Eur. J. Med. Chem. 2018. V. 152. P. 516–526. https://doi.org/10.1016/j.ejmech.2018.05.003
Sun K., Peng J.D., Suo F.Z., Zhang T., Fu Y.D., Zheng Y.C., Liu H.M. // Bioorg. Med. Chem. Lett. 2017. V. 27. P. 5036–5039. https://doi.org/10.1016/j.bmcl.2017.10.003
Солдатенков А.Т., Колядина Н.М., Шендрик И.В. // Основы органической химии лекарственных веществ. Москва: Химия, 2001.
Машковский М.Д. // Лекарственные средства. Медицина: Москва, 1978. Т. 2.
Кашаев А.Г., Зимичев А.В., Миронов М.С. // Башкирский хим. журн. 2009. Т. 16. № 3. С. 65–66.
Cui Z., Li Y., Ling Y., Huang J., Cui J., Wang R., Yang X. // Eur. J. Med. Chem. 2010. V. 45. P. 5576–5584. https://doi.org/10.1016/j.ejmech.2010.09.007
Congiu C., Onnis V. // Bioorg. Med. Chem. 2013. V. 21. P. 6592–6599. https://doi.org/10.1016/j.bmc.2013.08.026
Aktar M., Sengupta D., Chowdhury A. // Interdiscip. Toxicol. 2009. V. 2. P. 1–12. https://doi.org/10.2478/v10102-009-0001-7
Tantawy A.H., Farag S.M., Hegazy L., Jiang H., Wang M.Q. // Bioorg. Chem. 2020. V. 94. P. 1034–1064. https://doi.org/10.1016/j.bioorg.2019.103464
Wu J., Song B.A., Hu D.Y., Yue M., Yang S. // Pest. Manag. Sci. 2012. P. 801–810. https://doi.org/10.1002/ps.2329
Huang J., Lv M., Thapa S., Xu H. // Bioorg. Med. Chem. Lett. 2018. V. 28. P. 1753–1757. https://doi.org/10.1016/j.bmcl.2018.04.029
Yang C., Shao Y., Zhi X., Huan Q., Yu X., Yao X., Xu H. // Bioorg. Med. Chem. Lett. 2013. V. 23. P. 4806–4812. https://doi.org/10.1016/j.bmcl.2013.06.099
Qua H., Yu X., Zhi X., Lv M., Xu H. // Bioorg. Med. Chem. Lett. 2013. V. 23. P. 5552–5557. https://doi.org/10.1016/j.bmcl.2013.08.053
Wang Y., Yu X., Zhi X., Xiao X., Yang C., Xu H. // Bioorg. Med. Chem. Lett. 2014. V. 24. P. 2621–2624. https://doi.org/10.1016/j.bmcl.2014.04.074
Aggarwal N., Kumar R., Srivastva C., Dureja P., Khurana J.M. // J. Agric. Food Chem. 2010. V. 58. P. 3056–3061. https://doi.org/10.1021/jf904144e
Tabanca N., Ali A., Bernier U.R., Khan I.A., Kocyigit-Kaymakcioglu B., Oruç-Emre E.E., Unsalan S., Rollas S. // Pest. Manag. Sci. 2013. V. 69. P. 703–708. https://doi.org/10.1002/ps.3424
Wang X., Ren Z., Wang M., Chen M., Lu A., Si W., Yang C. // Chem. Centr. J. 2018. V. 83. P. 1–12. https://doi.org/10.1186/s13065-018-0452-z
Chen Q., Zhang J.-W., Chen L.-L., Yang J., Yang X.-L., Ling Y., Yang Q. // Chin. Chem. Lett. 2017. V. 28. P. 1232–1237. https://doi.org/10.1016/j.cclet.2017.03.030
Русакова М.Ю., Галкин Б.Н., Филиппова Т.О., Вострова Л.Н., Гренадёрова М.В. // Микробиология и технология. 2009. № 6. С. 69–74.
Zhang Y., Chen W., Yang C., Fan Q., Wu W., Jiang X. // J. Controll. Release. 2016. V. 237. P. 115–124. https://doi.org/10.1016/j.jconrel.2016.07.011
Sonawane S.J., Kalhapure R.S., Govender T. // Eur. J. Pharm. Sci. 2017. V. 99. P. 45–65. https://doi.org/10.1016/j.ejps.2016.12.011
Thota S., Rodrigues D.A., Pinheiro P.S.M., Lima L.M., Fraga C.A.M., Barreiro E.J. // Bioorg. Med. Chem. Lett. 2018. V. 28. P. 2797–2806. https://doi.org/10.1016/j.bmcl.2018.07.015
Wang X.L., Zhang Y.B., Tang J.F., Yang Y.S., Chen R.Q., Zhang F., Zhu H.L. // Eur. J. Med. Chem. 2012. V. 57. P. 373–382. https://doi.org/10.1016/j.ejmech.2012.09.009
Xia L., Xia Y.F., Huang L.R., Xiao X., Lou H.Y., Liu T.J., Pan W.D., Luo H. // Eur. J. Med. Chem. 2015. V. 97. P. 83–93. https://doi.org/10.1016/j.ejmech.2015.04.042
Jacomini A.P., Silva M.J.V., Silva R.G.M., Gonçalves D.S., Volpato H., Basso E.A., Paula F.R., Nakamura C.V., Sarragiotto M.H., Rosa F.A. // Eur. J. Med. Chem. 2016. V. 124. P. 340–349. https://doi.org/10.1016/j.ejmech.2016.08.048
Dos Santos Filho J.M., de Queiroz E., Silva D.M.A., Macedo T.S. // Bioorg. Med. Chem. 2016. V. 24. P. 5693–5701. https://doi.org/10.1016/j.bmc.2016.09.013
Duarte S.S., de Moura R.O., da Silva P.M. // Exp. Parasitol. 2018. V. 192. P. 25–35. https://doi.org/10.1016/j.exppara.2018.07.004
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия