Биоорганическая химия, 2023, T. 49, № 1, стр. 32-40
Перспективы использования катионов металлов для разработки противомикробных комплексов
А. В. Кадомцева 1, *, Г. М. Мочалов 2, И. В. Жданович 1, М. С. Пискунова 1
1 ФГБОУ ВО “Приволжский исследовательский медицинский университет” Минздрава России
603005 Нижний Новгород, пл. Минина и Пожарского, 10/1, Россия
2 ФГБОУ ВО “Нижегородский государственный технический университет им. Р.Е. Алексеева”
603950 Нижний Новгород, ул. Минина, 24, Россия
* E-mail: kadomtseva@pimunn.ru
Поступила в редакцию 30.07.2022
После доработки 10.08.2022
Принята к публикации 23.08.2022
- EDN: GGJKEO
- DOI: 10.31857/S0132342323010128
Аннотация
Известно, что антибактериальные препараты при длительном применении вызывают антибиотикорезистентность у бактерий. Быстрое формирование устойчивости микроорганизмов к современным антибактериальным препаратам требует поиска новых методов терапии. Альтернативным направлением выступает использование наночастиц металлов и их оксидов в качестве основы для создания противомикробных средств нового поколения, поэтому представляется перспективным изучение методов синтеза наночастиц металлов, их физико-химических и фармакологических свойств. В обзоре рассмотрены механизмы формирования антибиотикорезистентности в биопленке и возможные пути их преодоления для наноразмерных частиц металлов, описаны синтез и механизм действия наночастиц, содержащих катионы серебра, меди и цинка, приведены результаты исследований по оценке влияния наночастиц металлов на чувствительность к антибиотикам у грамположительных и грамотрицательных бактерий, а также грибов в сравнении с действием известных лекарственных форм. Катионы Cu2+ и Zn2+ обладают выраженным антибактериальным действием против Staphylococcus aureus и Pseudomonas aeruginosa. Катионы Ag+ продемонстрировали наибольшую активность в отношении S. aureus, Escherichia coli, Klebsiella pneumoniae, а также Candida albicans.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ.........................................................32
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ НАНОЧАСТИЦ МЕТАЛЛОВ............................33
Катионы серебра..................................................33
Катионы цинка.....................................................33
Катионы меди......................................................34
СИНТЕЗ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ МЕТАЛЛОВ......34
Соединения серебра...............................................34
Соединения цинка.................................................35
Соединения меди...................................................35
ЗАКЛЮЧЕНИЕ..................................................38
СПИСОК ЛИТЕРАТУРЫ..................................39
ВВЕДЕНИЕ
Важная проблема терапии инфекционных заболеваний – устойчивость микроорганизмов к антибиотикам. Быстрое формирование устойчивости микроорганизмов к современным антибактериальным препаратам требует поиска новых методов терапии. Один из способов решения проблемы антибиотикорезистентности – разработка противомикробных средств нового поколения, содержащих наночастицы металлов. Благодаря особым свойствам наночастиц, таким как повышенное поглощение лекарственного средства и высокое отношение площади поверхности к объему, а также выявленной антимикробной активности (включая грамположительные, грамотрицательные бактерии и грибы) [1] актуально использование катионов металлов со сравнительно низкой токсичностью при разработке противомикробных комплексов. Представляется перспективным изучение методов синтеза наночастиц металлов, их физико-химических и фармакологических свойств.
Наночастицы металлов начинают антибактериальное действие с цитоплазматических мембран бактерий. Катионы металлов притягиваются к отрицательно заряженным клеточным мембранам бактерий. Таким образом, прилипшие ионы нарушают баланс заряда и начинают взаимодействие с фосфолипидным бислоем на поверхности клеточных мембран, что вызывает изменение проницаемости бактериальных мембран. Происходит высвобождение ионов металлов, а некоторые наночастицы металлов проникают в бактерии, вследствие чего происходят повреждения клеточных мембран – как структурные, так и функциональные [2].
Аналитический обзор современных литературных данных актуален при разработке методов синтеза новых биологически активных соединений катионов различных металлов и изучении их физико-химических и фармакологических свойств. В обзоре описаны синтез и механизм действия наночастиц, содержащих катионы серебра, меди и цинка, приведены результаты исследований по оценке влияния наночастиц металлов на грамположительные и грамотрицательные бактерии, а также грибы в сравнении с действием известных лекарственных форм.
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ НАНОЧАСТИЦ МЕТАЛЛОВ
Синтезированные лекарственные субстанции из биометаллов, в зависимости от способа получения, могут быть не только высокоэффективными, но и высокотоксичными. Широкий круг неизученных свойств обусловливает необходимость исследования токсикологических и терапевтических параметров этих соединений. Следует отметить, что биологическая активность наночастиц металлов зависит от физико-химических свойств, таких как форма, размер и др. Для разработки противомикробных комплексов наиболее перспективны катионы серебра, цинка и меди.
Катионы серебра
Катионы серебра наиболее изучены, обладают выраженными антибактериальными свойствами при низкой токсичности и отсутствием отрицательного влияния на индигенную микрофлору. Основная сфера применения препаратов – лечение заболеваний, вызываемых условно-патогенной микрофлорой (маститы, желудочно-кишечные и гинекологические болезни).
Петрицкая с соавт. [3] установили, что коллоидные растворы серебра (50 и 100 мг/л) не влияют на рост микроорганизмов (штаммы Staphylococcus aureus, Escherichia coli, Klebsiella pneumoniae, а также полученные из клинического материала штаммы Candida albicans), а растворы сравнения, содержащие нитраты других металлов (Со, Zn, Na), проявляют выраженный антибактериальный эффект.
Segura et al. [4] синтезировали комплексные соединения серебра [{Ag(phen)(μ-tu)}2](NO3)2, [{Ag(phen)(μ-tu)}2](CF3SO3)2, [{Ag(bpy)(μ-tu)}2](NO3)2 (phen – 1,10-фенантролин, bpy – 2,2'-бипиридин, tu – тиомочевина), которые проявили активность в отношении бактерий (Mycobacterium tuberculosis, S. aureus, E. coli, Pseudomonas aeruginosa), лейшманий (Leishmania amazonensis) и грибов (C. albicans, C. tropicalis, C. krusei). Авторами отмечается, что путем варьирования количества и типов лигандов, присутствующих в координационной сфере, можно изменять физико-химические и биологические свойства полученных соединений.
Ronconi et al. [5] отмечают, что биологические свойства соединений могут быть усилены координацией с металлическим центром.
Катионы цинка
Чекнёвым с соавт. при нанесении на диск катионов цинка с антибиотиком проведена оценка чувствительности бактерий S. aureus к стандартному набору антибиотиков [6]. На чашки Петри с питательным агаром газоном засевали суспензию бактерий S. aureus, содержавшую 108 КОЕ/мл. Далее на поверхность газона по стандартному шаблону помещали диски с антибиотиками. Катионы Zn2+ применяли в виде ZnSO4 ⋅ 7H2O с концентрацией 0.15 М в растворе NaCl. После предварительной обработки газона катионами Zn2+ защита бактерий от последующего воздействия антибиотиков выявлена в 27.3–45.5% наблюдений. Таким образом, можно сделать вывод, что обработка газона катионами Zn2+ оказывает выраженное протективное действие на бактерии S. aureus, которые становятся более устойчивыми к действию антибиотиков, чем в отсутствие катиона Zn2+.
Одна из перспективных сфер применения катионов металлов – стоматологические препараты. Проведены микробиологические исследования воздействия на микрофлору зубного налета водных растворов наночастиц (10–100 нм) железа, олова, цинка, серебра и меди (Fe3O4, SnO, ZnO, Ag, Cu). Исследования показали, что химический состав частиц дисперсной фазы напрямую влияет на антибактериальные свойства. Так, наиболее эффективными оказались дисперсные системы, содержащие оксид цинка с исходной концентрацией 7.03 мг/л, медь (2.07 мг/л), серебро (2.39 мг/л), а также Fe3O4 (2.11 мг/л) [7].
Катионы меди
В настоящее время во всех сферах заметно увеличился спрос на оксид одновалентной меди, применение которой перспективно благодаря таким характеристикам, как ширина запрещенной зоны (разница энергии электрона), которая обеспечивает поглощение большей части солнечного спектра, а также низкая себестоимость, и главное, отсутствие токсичности. Однако следует отметить, что не только физико-химические свойства соединений меди зависят от способа получения, но и активность. На сегодняшний день существует большое количество методов, позволяющих получать наноразмерные порошки металлов.
Из литературных данных известно, что наиболее перспективными считаются электрохимические методы получения высокодисперсных порошков (нанопорошков оксидов и гидроксидов меди из водных растворов щелочей) [8] за счет возможности получения очень чистых порошков и управления их структурой путем варьирования электрических параметров процесса. Преимущество заключается в том, что использование постоянного и переменного тока позволяет существенно интенсифицировать процесс.
В работе Коробочкина с соавт. [9] приведены экспериментальные данные разрушения металлов в щелочных растворах. Опубликованные материалы содержат опытные данные по скорости растворения металлов в зависимости от различных факторов или только на основе снятия циклических поляризационных кривых приводятся возможные механизмы образования тех или иных продуктов электролиза.
Абраменко [10] в зависимости от времени электролиза, плотности тока и концентрации катиона определил скорость разрушения (растворения) меди в условиях электролиза. Использовали бездиафрагменную ячейку, все исследования проведены в водных растворах щелочей. Рабочим электродом была предварительно подготовленная медная фольга (прошла шлифование, обезжиривание, промывку и сушку). Сделан вывод о том, что скорость окисления меди определяется количеством прошедшего электричества и не зависит от плотности тока.
Доказано, что биметаллические наночастицы медь–серебро обладают антибактериальной активностью и могут применяться для придания бактерицидных свойств полимерным материалам [11].
Чекнёв с соавт. [12] изучили антибактериальное действие катионов Cu2+ и Zn2+ в миллимолярных концентрациях хлоридов и сульфатов в культурах S. aureus и P. aeruginosa. При концентрации металлов 50–500 мМ ингибирующее действие ZnSO4 в отношении бактерий S. aureus в 1.3–1.6 раза (р < 0.001–0.050) превосходило эффекты CuSO4. При увеличении концентрации катионов металлов до 100 и 500 мМ действие ZnCl2 в культуре S. aureus в 1.2–1.6 раза (р < 0.02) превосходило эффекты CuCl2. В культуре P. aeruginosa антибактериальное действие CuSO4 было сопоставимо с эффектами ZnSO4. При концентрации металла 500 мМ действие CuCl2 на клетки P. aeruginosa было в 1.2 раза (р < 0.05) выраженным, чем эффекты ZnCl2. Сделан вывод о том, что в миллимолярных концентрациях катионы Cu2+ и Zn2+ обладают выраженным антибактериальным действием в культурах S. aureus и P. aeruginosa. Таким образом, в присутствии катионов цинка проявляется бактериостатическое действие, а катионов меди — бактерицидное. Задержка роста бактерии S. aureus при действии катионов цинка более значительна, чем у P. aeruginosa, проявляющего более высокую, чем S. aureus, толерантность к меди и цинку.
СИНТЕЗ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ МЕТАЛЛОВ
В настоящее время актуальны синтез и исследование комплексных соединений переходных металлов с биологически активными лигандами. Разработка условий синтеза новых высокоэффективных биологически активных соединений – одна из задач не только современной медицины, но и сельского хозяйства, а также других отраслей.
Учеными разработаны надежные физико-химические экспериментальные методы синтеза металлических наночастиц с заданной морфологией, размерами и свойствами.
Соединения серебра
Блинова с соавт. [13] изучили влияние параметров синтеза препарата на основе наночастиц серебра, стабилизированных бромидом дидецилдиметиламмония, который проводили постадийно. Для предотвращения процессов агрегации наночастиц Ag и интенсификации перемешивания использовали обработку реакционной системы ультразвуком. Были выявлены параметры (объемная скорость подачи, массовая доля, массовое/мольное соотношение), оказывающие наиболее значимое влияние на процесс формирования наночастиц серебра в водных растворах четвертичного аммониевого соединения. В качестве восстановителя использовали боргидрид натрия (NaBH4).
Ranoszek-Soliwoda et al. [14] разработали методику синтеза (реакция восстановления) монодисперсных частиц серебра с растительным экстрактом из листьев Mimusops elengi (AgNP). В качестве источников полифенолов были выбраны экстракт какао-бобов и виноградных косточек. Показана антибактериальную активность синтезированных соединений серебра в отношении полирезистентных изолятов, таких как Klebsiella pneumonia, Micrococcus luteus и S. aureus.
Биоактивные соединения, которые содержатся в растительном экстракте и участвуют в восстановлении серебра, действуют как блокирующие агенты для AgNP и тем самым оказывают бактериостатическое действие на грамположительные и грамотрицательные патогенные бактерии [15].
Соединения цинка
Ёрмамадова с соавт. [16] синтезировали координационные соединения цинка с водным раствором меркозолила. Подобраны оптимальные условия для синтеза соединений с заданными физико-химическими, а главное, биологическими свойствами.
В полученных координационных соединениях цинка активными компонентами выступают комплексообразователи и координированные лиганды (катионы металлов), например [ZnHL(H2O)3]2+, [Zn(HL)OH]+, где L – меркозолил. В статье приведен качественный состав соединений цинка, который установлен методами элементного анализа, оксредметрии и ИК-спектроскопии.
Довнар с соавт. [17] получили наночастицы серебра и оксида цинка методом лазерной абляции в жидкости. В работе использованы патогенные штаммы, обладающие множественной антибактериальной резистентностью. Минимальные ингибирующие концентрации составили 7.81–31.25 и 125–500 мкг/мл, минимальные бактерицидные – 31.25–62.50 и 250–1000 мкг/мл для наночастиц серебра и оксида цинка соответственно.
Ачиловой [18] синтезированы комплексные соединения цинка на основе глутаминовой кислоты (Глут-2Н), которые различались не только формой кристаллов, но и физико-химическими свойствами, например, были получены растворимая и нерастворимая формы соединения Zn[Сu(Глут-2Н)2].
Объектами исследования Горбацевич с соавт. [19] выступали производные 1,2-дигидроксибензола и комплексные соединения цинка(II). Авторы создали перевязочные материалы на основе комплексов цинка(II) с производными дигидроксибензолов, которые обладают антибактериальной активностью, противогрибковым действием широкого спектра, а также ускоряют заживление ран. Установлено, что образование в водно-этанольном растворе комплексов производных 1,2-дигидроксибензола с ионами цинка(II) происходит в соотношении Zn(II)/лиганд 1 : 2. В статье приведена информация о физико-химических свойствах комплексных соединений: элементный состав, геометрия образуемых координационных полиэдров, константы устойчивости (общие и ступенчатые). Также была выявлена противогрибковая активность комплексных соединений цинка(II), разработана технология нанесения их на бинты и на модели полнослойной инфицированной раны, изучена ранозаживляющая способность перевязочного материала.
Соединения меди
Кудрявцева и Буринская [20] в реакциях восстановления аскорбиновой кислоты в растворе получили биметаллические наночастицы медь/серебро (Cu/Ag) с использованием CuSO4 ⋅ 5Н2О, AgNO3, NaOH и поливинилового спирта (C2H4O)x. Также за счет разности окислительных потенциалов катионов серебра и меди были получены наночастицы без добавления восстановителя. Способ приготовления биометаллических наночастиц заключался в следующем: в 40 мл 1%-ного раствора поливинилового спирта готовили раствор CuSO4 ⋅ ⋅ 5Н2О (20–500 мкМ), далее нагревали до кипения на водяной бане, добавляли 40 мл раствора AgNO3 в 1%-ном (C2H4O)x (30–500 мкМ). После закипания раствора вводили 20 мл раствора аскорбиновой кислоты. Для подщелачивания в колбу по каплям добавляли раствор NaOH. В работе приведены ИК-спектры поглощения коллоидных растворов. Установлено, что рН среды оказывает влияние на получение наночастиц – при рН 10.0–11.0 наблюдается наибольшая скорость реакции.
Оптическая плотность коллоидных растворов медь-серебро в реакциях восстановления аскорбиновой кислотой при концентрациях сульфата меди и нитрата серебра, равных 20 и 30 мкМ соответственно, приведена на рис. 1 [20] (соотношение соль : восстановитель 1 : 30; 1 : 50; 1 : 100). В диапазоне длин волн 395–400 наблюдается наибольшая экстинкция, что свидетельствует о наличии в растворе биметаллических наночастиц медь(ядро)–серебро(оболочка) Cucore – Agshell. Самое высокое значение экстинкции показано при соотношении металл : восстановитель 1 : 100.
Рис. 1.
Оптическая плотность коллоидных растворов сульфата меди и нитрата серебра (медь–серебро), восстановленных аскорбиновой кислотой при соотношениях соли металлов : восстановитель, равных 1 : 30 (1), 1 : 50 (2) и 1 : 100 (3) [20].

Ерохина с соавт. [21] разработали химический способ получения биметаллических наночастиц медь-серебро методом восстановления в растворе желатина тетрагидроборатом натрия (среда щелочная). Установлено антибактериальное воздействие биметаллических наночастиц на грамположительные бактерии S. aureus и культуру дрожжеподобного гриба C. albicans.
Харитоновой с соавт. [22] разработаны новые подходы, не только теоретические, но и экспериментальные, необходимые для изучения комплексообразования меди(II) с органическими соединениями (доноры – атомы кислорода и азота).
Уринов с соавт. [23] провели комплексообразование олигомера (лиганда) с медью в водной среде: к водному раствору олигомера на основе морфолина с эпихлоргидрином объемом 2.5 мл (10–3–10–5 М) добавляли 2.5 мл раствора нитрата меди (10–3–10–5 М) при постоянной температуре и перемешивании, анализировали спектры поглощения. Анализ зависимости оптической плотности при постоянной концентрации нитрата меди от длины волны показал, что увеличение оптической плотности происходит при увеличении концентрации олигомера, максимум смещается в длинноволновую область (рис. 2).
Рис. 2.
Зависимость оптической плотности (А) от длины волны (λ) олигомера (лиганда) с медью в водной среде: 1 – олигомер на основе морфолина с эпихлоргидрином, 2 – нитрат меди, 3 – смесь олигомера с нитратом меди(II) [23].

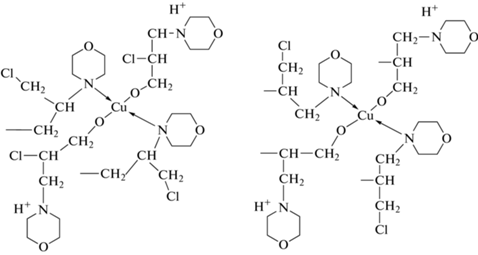
На основе результатов ИК-спектроскопии авторами предложена предполагаемая структура синтезированного комплексного соединения меди (схема 1 [23]).
Схема 1 . Структура комплекса на основе олигомера морфолина и эпихлоргидрина с нитратом меди [23].
Разработанный метод получения олигомерных соединений на основе морфолина с нитратом меди может использоваться в промышленности для получения антибактериального препарата для обработки каракулевых кожевенных изделий.
Пулатова с соавт. [24] синтезировали комплексное соединение меди(II) с серином:
В раствор аминокислоты приливали раствор гидроксида натрия (среда нейтральная, рН 7.0). Затем в образовавшийся прозрачный раствор добавляли раствор металла (0.01 г/моль CuCl2 · 2H2O). Получившийся коллоидный раствор зелено-бирюзового цвета ставили на магнитную мешалку. Выпавший осадок голубого цвета помещали в воронку Бюхнера и фильтровали, далее промыли спиртом и оставляли на воздухе. Выход соединения составил 70%, т. пл. 168°С, Мr 307.5 г/моль.
Далее была проведена качественная и количественная характеристика соединения: зарегистрированы ИК-спектры (νNH2 = 3344.4; δ NH2 = 1656.7, 1687.9; νCO = 1720; νOH связ. = = 3283.3; ν${\text{NH}}_{2}^{ + }$ = 2224.4, 2348.1; νСН2 = = 2923.2870; δСН2 = 1402–1408; νСН = 2900; δСН = 1338–1340; νCOО– = 1554.1536), проведен химический анализ, азот определяли по методу Кьельдаля. Предполагаемая структура полученного соединения представлена на схеме 2 [24].
Схема 2 . Предполагаемая структура комплексного соединения меди с серином [24].
Определены [25] оптимальные условия синтеза координационных соединений Cu(II) с 4-аллилтиосемикарбазонами 2,4-дигидроксибензальдегида (H2L1), 3,5-дибромсалицилового альдегида (H2L2) и 2-гидрокси-1-нафтальдегида (H2L3) (рис. 3), содержащих в своем составе амины, а также установлен состав, изучены физико-химические и биологические свойства. Выявлена высокая противомикробная активность полученных соединений меди в отношении S. aureus и E. coli, а также установлено их противигрибковое действие.
Рис. 3.
Строение 4-аллилтиосемикарбазонов 2,4-дигидроксибензальдегида (H2L1), 3,5-дибромсалицилового альдегида (H2L2) и 2-гидрокси-1-нафтальдегида (H2L3) [25].

Следует отметить, что аминсодержащие координационные соединения Cu(II), которые проявляют более высокую активность, чем комплексы без аминов и исходные тиосемикарбазоны, были синтезированы в несколько этапов. Для определения способа координации лиганда с центральными атомами был проведен сравнительный анализ ИК-спектров тиосемикарбазонов замещенных салицилового альдегида и синтезированных комплексов.
Комплекс Cu(II) с 4-аллилтиосемикарбазоном 3,5-дибромсалицилового альдегида и пиридином был наиболее активен в отношении грамположительным бактерий (S. aureus) и грибов (C. albicans), введение метильной группы в пиридиновый фрагмент снижало активность синтезированных комплексов.
ЗАКЛЮЧЕНИЕ
В настоящее время при разработке антимикробных комплексов актуально использование соединений биометаллов, таких как цинк, медь, с аминокислотами. Их взаимодействие приводит к изменению биохимических свойств соединения, обеспечивает противомикробную активность полученных комплексов. Ионы металлов, входящих в состав природных ферментов, выступают в качестве поляризующих факторов. Таким образом, синтезируют соединения, которые моделируют и имитируют активные центры ферментов и ведут себя как активированные и модифицированные аминокислоты.
Наиболее перспективно использование катионов переходных металлов, таких как Со2+, Zn2+ и Сu2+, которые способны к образованию донорно-акцепторных связей за счет переполненных d-орбиталей. В свою очередь, устойчивые координационные соединения с ионами металлов могут образовывать именно биолиганды с активными донорными атомами (атомами кислорода, азота, серы и др.), такие как аминокислоты, пептиды, белки.
Ранее было доказано, что координационно связанный биометалл обладает меньшей токсичностью, чем его неорганическая соль. Сочетание микроэлементов и биоактивного органического вещества приводит к синергизму действия.
Установлена зависимость антимикробного действия различных катионов металлов от окислительной способности: антибактериальная эффективность увеличивается с ростом окислительно-восстановительного потенциала. Отсутствие бактерицидной активности показали катионы Mn2+, Ni2+ и Co2+, умеренным действием обладают катионы Zn2+, а наиболее выраженным бактерицидным действием обладают катионы Ag+, Cu2+ и Fe2+.
Таким образом, ингибирующее действие катионов тяжелых металлов (двухвалентных) с большой вероятностью включает бактериостатический и бактерицидный компоненты, проявление активности которых определяется первичными механизмами реализации токсических свойств катионов.
В настоящее время наночастицы металлов применяются при синтезе лекарственных форм, обладающих биоцидным, противомикробным действием широкого спектра по отношению к патогенным микроорганизмам. Эффективное применение катионов металлов обусловлено прежде всего механизмом взаимодействия с клетками организма (способностью осаждать белки и другие органические соединения). Также к преимуществам применения наночастиц металлов можно отнести адресную доставку, скорость высвобождения лекарства, снижение токсичности, биосовместимость, повышение эффективности лечения.
Противомикробное действие катионов металлов зависит от природы солей и состава среды. Выраженный антибактериальный эффект демонстрируют катионы Cu2+ и Zn2+ в отношении S. aureus и P. aeruginosa, а также катионы Ag+ в отношении S. aureus, E. coli, K. pneumoniae и условно-патогенного гриба C. albicans.
Список литературы
Turner R.J. // Microb. Biotechnol. 2017. V. 10. P. 1062–1065. https://doi.org/10.1111/1751-7915.12785
Palza H. // Int. J. Mol. Sci. 2015. V. 19. P. 2099–2116. https://doi.org/10.3390/ijms16012099
Петрицкая Е.Н., Рогаткин Д.А., Русанова Е.В. // Альманах клин. мед. 2016. Т. 44. С. 221–226. https://doi.org/10.18786/2072-0505-2016-44-2-221-226
Segura D.F., Netto A.V.G., Frem R.C.G., Mauro A.E., da Silva P.B., Fernandes J.A., Paz F.A.A., Dias A.L.T., Silva N.C., de Almeida E.T., Marques M.J., de Almeida L., Alves K.F., Pavan F.R., de Souza P.C., de Barros H.B., Leite C.Q.F. // Polyhedron. 2014. V. 79. P. 197–206. https://doi.org/10.1016/j.poly.2014.05.004
Ronconi L., Sadler P.J. // Coord. Chem. Rev. 2007. V. 251. P. 1633–1648. https://doi.org/10.1016/j.ccr.2006.11.017
Чекнёв С.Б., Вострова Е.И., Сарычева М.А., Востров А.В. // Журн. микробиол. эпидемиол. иммунобиол. 2019. № 6. С. 5–12. https://doi.org/10.36233/0372-9311-2019-6-5-12
Леонтьев В.К., Погорельский И.П., Фролов Г.А., Карасенков Я.Н., Гусев А.А., Латута Н.В., Бороздкин Л.Л., Стефанцова Д.С. // Рос. нанотехнологии. 2018. Т. 13. № 3-4. С. 88–91.
Демьян В.В., Демьян Е.М., Беспалова Ж.И., Фесенко Л.Н. // Вестник Донского гос. аграр. ун-та. 2015. Т. 16. № 2-2. С. 130–138.
Коробочкин В.В., Усольцева Н.В., Горлушко Д.А., Балмашнов М.А. // Изв. Томского политехнич. ун-та. 2010. Т. 317. № 3. С. 13–16.
Абраменко Ю.А. // Молодой исследователь Дона. 2018. № 4 (13). С. 2–6.
Буринская А.А., Газизуллина А.Р., Кудрявцева Е.В. // Известия высш. учеб. завед. Технол. легк. промышл. 2020. Т. 47. № 1. С. 83–88. https://doi.org/10.46418/0021-3489_2020_47_1_15
Чекнёв С.Б., Вострова Е.И., Апресова М.А., Писковская Л.С., Востров А.В. // Журн. микробиол. эпидемиол. иммунобиол. 2015. № 2. С. 9–17.
Блинова А.А., Блинов А.В., Серов А.В., Храмцов А.Г. // Вестник Северо-Кавказского федер. ун-та. 2014. №. 6 (45). С. 9–14.
Ranoszek-Soliwoda K., Tomaszewska E., Małek K., Celichowski G., Orlowski P., Krzyzowska M., Grobelny J. // Colloids Surf. B Biointerfaces. 2019. V. 177. P. 19–24. https://doi.org/10.1016/j.colsurfb.2019.01.037
Ahmed M.J., Murtaza G., Mehmood A., Bhatti T.M. // Mater. Lett. 2015. V. 153. P. 10–13. https://doi.org/10.1016/j.matlet.2015.03.143
Ёрмамадова С.Г., Камолова И.У., Раджабов У.Р. // Наука и инновация. 2018. Т. 1. № 1. С. 133–140.
Довнар Р.И., Смотрин С.М., Ануфрик С.С., Соколова Т.Н., Анучин С.Н., Иоскевич Н.Н. // Журн. Гродненского гос. мед. ун-та. 2022. Т. 20. С. 98–107. https://doi.org/10.25298/2221-8785-2022-20-1-98-107
Aчилoвa Д.A. // Forcipe. 2020. T. 3. № 3. C. 432–433. https://cyberleninka.ru/article/n/sintez-i-issledovanie-geometricheski-izomernyh-koordinatsionnyh-soedineniy-medi-i-tsinka-s-glyutaminovoy-kislotoy
Горбацевич Г.И., Стахевич С.И., Ковальчук-Рабчинская Т.В. // Свиридовские чтения: сб. ст. Вып. 14. Минск: Изд. центр БГУ, 2018. С. 53–63.
Кудрявцева Е.В., Буринская А.А. // Sci. Heritage. 2021. № 58. Вып. 14. С. 39–45. https://doi.org/10.24412/9215-0365-2021-58-1-39-45
Ерохина Е.В., Галашина В.Н., Дымникова Н.С., Морыганов А.П. // Рос. хим. журн. 2016. Т. 60. № 5-6. С. 9–16.
Харитонова Е.В., Журавлев О.Е., Червинец В.М., Ворончихина Л.И. // Хим.-фарм. журн. 2012. № 5. С. 6–8.
Уринов У.К., Ирисбеков Б.Б., Хазраткулов Ш.Ш., Комолов Р.И., Юсупбаев К.П., Бахранова Д.Р. // Universum: хим. биол. 2021. № 4 (82). С. 81–85. https://7universum.com/ru/nature/archive/item/11504
Пулатова З.М., Сарымзакова Б.К., Эралиева М.Г., Сарымзакова Р.К. // Сб. статей международ. научно-практич. конфер. “Приоритетные направления развития науки и образования”. Пенза: МЦНС “Наука и просвещение”, 2018. С. 26–29.
Улькинa Я. // In: Conferința Stiințifică Națională cu Participare Internațională “Integrare Prin Cercetare și Inovare”, 10–11 Noiembrie 2021, USM. P. 176–178.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия