Биоорганическая химия, 2023, T. 49, № 2, стр. 216-220
Способ получения ионизируемого липида ALC-0315 – ключевого компонента липидной матрицы мРНК-вакцины
И. А. Болдырев 1, В. П. Шендриков 1, 2, А. Г. Вострова 1, Е. Л. Водовозова 1, *
1 ФГБУН “Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова” РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
2 Российский химико-технологический университет имени Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
* E-mail: elvod@lipids.ibch.ru
Поступила в редакцию 06.09.2022
После доработки 11.09.2022
Принята к публикации 12.10.2022
- EDN: GHQWWK
- DOI: 10.31857/S0132342323020069
Аннотация
Ионизируемый липид ALC-0315 – ((4-гидроксибутил)азандиил)бис(гексан-6,1-диил)бис(2-гексилдеканоат) – входит в состав липидной матрицы мРНК-вакцины для профилактики заражения вирусом SARS-CoV-2 производства фирмы Pfizer/BioNTech. Этот липид обеспечивает эффективную сборку вакцинной конструкции, защиту мРНК от преждевременной деградации, а после эндоцитоза способствует выходу нуклеиновой кислоты в цитоплазму для дальнейшего процессинга. В данной работе предложен упрощенный и экономичный способ получения липида ALC-0315, который может быть использован при производстве мРНК-вакцин.
ВВЕДЕНИЕ
Пандемия коронавируса SARS-CoV-2, охватившая мир в конце 2019 г., способствовала интенсивной разработке, стремительной коммерциализации и внедрению в клиническую практику высокоэффективных профилактических вакцин на основе липидных наночастиц (ЛНЧ) и мРНК полноразмерного белка шипа вируса (S-белка) производства фирм Moderna [1, 2] и Pfizer/BioNTech [3]. Эти вакцинные конструкции представляют собой супрамолекулярные системы – наночастицы, построенные из множества молекул липидов и молекул(ы) мРНК (например, см. обзоры [4, 5]). Структурно-функциональная роль молекул липидов заключается в обеспечении компактизации длинноцепочечных молекул нуклеиновой кислоты, ее защите от деградации под действием внеклеточных ферментов, обеспечении транспорта наночастицы в клетку за счет эндоцитоза (фагоцитоза или пиноцитоза) и последующего выхода мРНК из эндосомы (фагосомы) в цитоплазму для осуществления трансляции и экспрессии белка с иммуногенными эпитопами. Предположительно, выход мРНК в цитоплазму осуществляется благодаря переходу липидов ЛНЧ в условиях закисления среды в эндосомах в катионную форму, что способствует их контакту с анионными липидами периплазматического монослоя мембраны эндосом и дестабилизации мембраны за счет формирования небислойных липидных структур (гексагональной фазы) [6]. В связи с разнообразием функций, липидная платформа ЛНЧ с мРНК должна включать несколько классов липидов. Ключевой компонент – ионизируемые липиды, которые обеспечивают как компактизацию мРНК при формировании ЛНЧ, так и выход мРНК в цитоплазму. Структуры ионизируемых липидов в вакцинах обоих производителей очень близки, схемы их синтеза описаны в соответствующих патентах [7–9].
Коммерческий успех мРНК-вакцин на основе ионизируемых липидов привел к взрывному росту интереса к разработкам в данной области и, как следствие, к поиску упрощенных способов синтеза доказавших свою эффективность липидов, в частности липида ALC-0315 – ((4-гидроксибутил)азандиил)бис(гексан-6,1-диил)бис(2-гексилдеканоата). На сегодня известны два способа получения этого липида, исходя из 2-гексилдекановой кислоты (рис. 1a, 1б). Предлагаемый в данной работе альтернативный вариант представлен на рис. 1в.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Первый способ синтеза ALC-0315 (рис. 1а) запатентован [8, 9]. Стадия а1 – ацилирование избытка гександиола в стандартных условиях этерификации по Штеглиху [10] (конденсация с дициклогексилкарбодиимидом в присутствии катализатора 4-диметиламинопиридина). Продукт реакции используют далее без очистки. Стадия а2 – окисление пиридинхлорхроматом; продукт экстрагируют гексаном или петролейным эфиром, выделяют хроматографией на колонке с силикагелем в системе гексан–хлористый метилен. Заключительная стадия а3 – восстановительное аминирование. Ключевой реагент для этой реакции – натрия триацетоксиборгидрид, можно использовать коммерческий реагент либо получить его in situ реакцией натрия боргидрида с ледяной уксусной кислотой в бензоле или в диметилацетамиде [11]. Целевой продукт ALC-0315 выделяют хроматографией на колонке с силикагелем в градиенте метанола в хлористом метилене. Описанный путь синтеза обладает двумя недостатками: 1) последовательно используются стадии окисления и восстановления концевого атома углерода (стадии а2 и а3), в результате которых степень окисления углерода остается такой, как и была исходно (+1), что свидетельствует о возможности замены стадии окисления и восстановления на стадию конденсации; 2) в ходе первой стадии (стадия а1) – этерификации по Штеглиху – появляется побочный продукт, производное мочевины, который усложняет очистку конечного продукта.
Альтернативный путь синтеза (рис. 1б) был недавно предложен в патенте [12]. В данной схеме проблема окисления–восстановления была решена за счет использования бромгексанола вместо гександиола. Это позволило уменьшить количество стадий, однако этерификация в присутствии водоотнимающего агента осталась.
Мы предлагаем дальнейшее усовершенствование схемы получения ALC-0315 (рис. 1в) за счет использования на первой стадии дибромгексана. Простота очистки и возможность рецикла дибромгексана, наряду с использованием K2CO3 в качестве конденсирующего реагента вместо более дорогостоящих и опасных для организма карбодиимидных производных, делают такой путь синтеза экономически привлекательным.
Синтез липида ALC-0315 проведен нами в две стадии (рис. 1в). 2-Гексилдекановую кислоту вводили в реакцию с четырехкратным избытком 1,6‑дибромгексана в ДМФА в присутствии поташа. Через 3 сут перемешивания реакционной смеси при комнатной температуре продукт конденсации выделяли хроматографией на силикагеле с выходом 85%. При этом регенерация дибромгексана составила 52%. Целевой продукт ALC-0315 получали конденсацией 2-гексилдекановой кислоты 6-бромгексилового эфира с 4-аминобутанолом в тех же мягких условиях, что и при проведении предыдущей стадии. При всего лишь 10%-ном избытке 6-бромгексил-2-гексилдеканоата по стехиометрическому соотношению реагентов выход целевого продукта после выделения хроматографией на силикагеле составил 62%. Кроме того, выделяли смесь целевого продукта с продуктом моноалкилирования, которую подмешивали к 6-бромгексил-2-гексилдеканоату при последующих повторных загрузках синтеза. С учетом рецикла и регенерации колонки с силикагелем (последовательная промывка изопропанолом и хлороформом) выход целевого продукта достигал 80%. Структура полученного целевого соединения подтверждена спектром 1H-ЯМР.
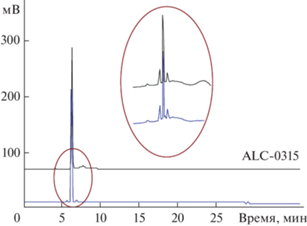
Чистоту продукта контролировали ВЭЖХ. Хроматограммы свидетельствуют о более высоком уровне чистоты синтезированного целевого соединения по сравнению с коммерческим препаратом ALC-0315 (рис. 2).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали декановую кислоту, гексилбромид, 1,6-дибромгексан, 4-аминобутанол (Реахим, Россия); бутиллитий (Acros Organics, США); диизопропиламин, 4-диметиламинопиридин (Merck, ФРГ); сульфат натрия, гексан, этилацетат, тетрагидрофуран, хлороформ, хлористый метилен, метанол, ледяную уксусную кислоту (ООО ТД “ХИММЕД”, Россия). Очистку растворителей проводили по стандартным методикам. Растворы упаривали на роторном испарителе (Heidolph, ФРГ). Высушивание в вакууме масляного насоса проводили на лиофильной сушке Иней-4 (Институт биологического приборостроения РАН, Пущино, Россия).
2-Гексилдекановую кислоту получали, как описано в работе Ramishetti et al. [13]. ТСХ выполняли на пластинках Kieselgel 60 (Merck, Германия); для обнаружения соединений опрыскивали пластинки раствором Родамина-6G в этаноле (0.16 мМ), при просматривании под УФ-лампой проявлялись оранжевые пятна на розовом фоне. Для колоночной хроматографии использовали силикагель КСКГ 0.063–0.2 мм (ООО “ХромЛаб”, Россия). Газовую хроматографию выполняли на газовом хроматографе Кристаллюкс (ООО “Метахром”, Россия), капиллярная колонка Zebron-ZB-1 (Phenomenex, США). ВЭЖХ проводили с использованием хроматографической системы JETchrom (ПортЛаб, Россия), состоящей из двух насосов и динамического смесителя, инжектора Rheodyne 7125 (IDEX, США) и детектора светорассеяния Sedex-LC LT-ELSD (Sedere, Франция). Сбор и обработку хроматографических данных осуществляли при помощи программы МультиХром 3.4 (ООО “Амперсенд”, Россия). 1H-ЯМР-спектры регистрировали на спектрометре Avance 700 (Bruker, США) с рабочей частотой 700 МГц при постоянной температуре образца 303 К. Растворитель – СDCl3. Химические сдвиги в спектрах ЯМР приведены в миллионных долях (м.д.), в качестве внутреннего стандарта использовали остаточные сигналы протонов растворителя (7.27 м.д.).
2-Гексилдекановой кислоты 6-бромгексиловый эфир. В круглодонной колбе на 50 мл смешивали 9.74 г (4 экв., 39.9 ммоль) 1,6-дибромгексана, 2.56 г (1 экв., 9.98 ммоль) 2-гексилдекановой кислоты, 20 мл сухого ДМФА. Добавляли 2.05 г K2CO3 (х.ч.; предварительно поташ растирали в ступке и просушивали при 100°С в течение 30 мин). Перемешивали в течение 72 ч, наблюдали образование бесцветного мелкодисперсного осадка KBr. Ход реакции контролировали ТСХ в системе петролейный эфир–этилацетат–уксусная кислота, 39 : 1 : 0.05. Rf 1,6-дибромгексана, целевого соединения, диэфира гексана и 2-гексилдекановой кислоты 0.98, 0.59, 0.38 и 0.11 соответственно. В реакционную смесь добавляли 200 мл воды, тщательно перемешивали и экстрагировали этилацетатом (3 × 100 мл). Объединенные экстракты промывали водой, сушили над Na2SO4 и упаривали на роторном испарителе. Остаток хроматографировали на колонке с силикагелем в ступенчатом градиенте: в петролейном эфире элюировали исходный дибромгексан, в системе петролейный эфир–этилацетат (3 : 1) выделяли продукт. Выход 3.58 г (85%), бесцветная прозрачная жидкость. Регенерировали 5.08 г дибромгексана.
Спектр 1H-ЯМР (CDCl3, δ, м.д.; КССВ – J, Гц): 4.15 (т, J 6.7, 2H), 3.47 (т, J 6.8, 2H), 2.42–2.35 (уш. м, 1H), 1.91 (квинтет, J 7.0, 2H), 1.71 (квинтет, J 7.0, 2H), 1.69–1.61 (м, 2H), 1.58–1.43 (м, 6H), 1.40–1.27 (уш. м, 20H), 0.95 (два перекрывающихся т, J 7.2, 6H).
4-Гидроксибутил-бис-(6-(2-гексилдеканоат)гексил)амин (систематическое название [(4-гидроксибутил)азандиил]ди(гексан-6,1-диил)бис(2-гексилдеканоат)). В круглодонной колбе на 50 мл смешивали 3 г (7.15 ммоль) 6-бромгексил-2-гексилдеканоата, 0.286 г (3.21 ммоль) 4-бутаноламина, 1 г K2CO3 (приготовлен, как описано выше) и 20 мл сухого ДМФА. Перемешивали в течение 72 ч. Ход реакции контролировали ТСХ в системе хлороформ–метанол–триэтиламин, 95 : 5 : 0.1. Rf целевого продукта и продукта моноалкилирования 0.35 и 0.1 соответственно. Реакционную смесь обрабатывали, как описано выше для 6-бромгексил-2-гексилдеканоата. Остаток хроматографировали на колонке с силикагелем в системе хлороформ–метанол, 97 : 3. Выход чистого целевого продукта составил 1.54 г (62%). В следующей фракции собирали смесь продуктов моно- и диалкилирования 4-бутаноламина (1.6 г), которую использовали в повторном синтезе.
ВЭЖХ целевого продукта и стандарта ALC-0315 (BroadPharm, США) выполняли на колонке C18 Gravity, 150 × 4.6 мм, 5 мкм (Macherey-Nagel GmbH & Co. KG, ФРГ) в градиенте растворителей: элюент A – 0.1%-ная TФУ в H2O, элюент B – метанол; скорость потока 1.2 мл/мин.
Спектр 1H-ЯМР (CDCl3, δ, м.д.; КССВ – J, Гц): 4.12 (т, J 6.7, 4H), 3.62 (уш. т, J 5.5, 2H), 2.53–2.47 (уш. м, 4H), 2.40–2.34 (м, 2H), 1.75–1.60 (м, 12H), 1.59–1.52 (м, 4H), 1.52–1.41 (м, 10H), 1.39–1.27 (уш. м, 46H), 0.94 (два перекрывающихся т, J 7.2, 12H).
Список литературы
Baden L.R., El Sahly H.M., Essink B., Kotloff K., Frey S., Novak R., Diemert D., Spector S.A., Rouphael N., Creech C.B., McGettigan J., Khetan S., Segall N., Solis J., Brosz A., Fierro C., Schwartz H., Neuzil K., Corey L., Gilbert P., Janes H., Follmann D., Marovich M., M.D., Mascola J., Polakowski L., Ledgerwood J., Graham B.S., Bennett H., Pajon R., Knightly C., Leav B., Deng W., Zhou H., Han S., Ivarsson M., Miller J., Zaks T. // N. Engl. J. Med. 2021. V. 384. P. 403–416. https://doi.org/10.1056/NEJMoa2035389
Anderson E.J., Rouphael N.G., Widge A.T., Jackson L.A., Roberts P.C., Makhene M., Chappell J.D., Denison M.R., Stevens L.J., Pruijssers A.J., McDermott A.B., Flach B., Lin B.C., Doria-Rose N.A., O’Dell S., Schmidt S.D., Corbett K.S., Swanson P.A., Padilla M., Neuzil K.M., Bennett H., Leav B., Makowski M., Albert J., Cross K., Edara V.V., Floyd K., Suthar M.S., Martinez D.R., Baric R., Buchanan W., Luke C.J., Phadke V.K., Rostad C.A., Ledgerwood J.E., Graham B.S., Beigel J.H. // N. Engl. J. Med. 2020. V. 383. P. 2427–2438. https://doi.org/10.1056/NEJMoa2028436
Polack F.P., Thomas S.J., Kitchin N., Absalon J., Gurtman A., Lockhart S., Perez J.L., Pérez Marc G., Moreira E.D., Zerbini C., Bailey R., Swanson K.A., Roychoudhury S., Koury K., Li P., Kalina W.V., Cooper D., Frenck R.W., Jr., Hammitt L.L., Türeci Ö., Nell H., Schaefer A., Ünal S., Tresnan D.B., Mather S., Dormitzer P.R., Şahin U., Jansen K.U., Gruber W.C. // N. Engl. J. Med. 2020. V. 383. P. 2603–2615. https://doi.org/10.1056/NEJMoa2034577
Schoenmaker L., Witzigmann D., Kulkarni J.A., Verbeke R., Kersten G., Jiskoot W., Crommelin D.J.A. // Int. J. Pharm. 2021. V. 601. P. 120586. https://doi.org/10.1016/j.ijpharm.2021.120586
Hou X., Zaks T., Langer R., Dong Y. // Nat. Rev. Mater. 2021. V. 6. P. 1078–1094. https://doi.org/10.1038/s41578-021-00358-0
Szoka F.C., Xu Y., Zelphati O. // Adv. Drug Deliv. Rev. 1997. V. 24. P. 291. https://doi.org/10.1016/S0169-409X(96)00470-X
Benenato K.E., Kumarasinghe E.S., Cornebise M. // Patent Application US 20170210697 A1, 2017.
Ansell S.M., Du X. // Patent US 10166298 B2, 2019.
Ansell S.M., Du X. // Int. Application WO 2017075531 A1, 2017.
Neises B., Steglich W. // Angew. Chem. Int. Ed. 1978. V. 17. P. 522–524. https://doi.org/10.1002/anie.197805221
Gribble G.W., Abdel-Magid A.F. // Sodium Triacetoxyborohydride / In: Encyclopedia of Reagents for Organic Synthesis. https://onlinelibrary.wiley.com/doi/abs/10.1002/9780-470842898.rs112.pub2
Yan D., Xueming T. // Patent CN 114249662 A, 2022.
Ramishetti S., Hazan-Halevy I., Palakuri R., Chatterjee S., Naidu Gonna S., Dammes N., Freilich I., Kolik Shmuel L., Danino D., Peer D. // Adv. Mater. 2020. V. 32. P. e1906128. https://doi.org/10.1002/adma.201906128
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия