Биоорганическая химия, 2023, T. 49, № 2, стр. 207-215
Влияние гуанидиновых производных хиназолина на Na+/H+-обменник и внутриглазное давление у крыс
А. С. Таран 1, 2, *, Л. В. Науменко 1, Ю. А. Говорова 1, Н. А. Гурова 1, А. А. Спасов 1, 2, А. А. Озеров 1, 2, Д. В. Мережкина 1
1 ФГБОУ ВО “Волгоградский государственный медицинский университет” Минздрава России
400131 Волгоград, пл. Павших Борцов, 1, Россия
2 ГБУ “Волгоградский медицинский научный центр”
400131 Волгоград, пл. Павших Борцов, 1, Россия
* E-mail: taran-a.s@yandex.ru
Поступила в редакцию 23.06.2022
После доработки 10.07.2022
Принята к публикации 12.07.2022
- EDN: PGNDUV
- DOI: 10.31857/S0132342323020215
Аннотация
На основании данных о роли Na+/H+-обменника (NHE) в модуляции внутриглазного давления, выступающего основным фактором развития глаукомы, и ранее проведенных разными авторами исследований, доказывающих наличие ингибирующей NHE-1 активности у производных хиназолина, было синтезировано девять новых соединений этого класса. Изучено влияние полученных производных хиназолина на ингибирование Na+/H+-обменника и внутриглазное давление (ВГД) крыс в сравнении с зонипоридом (ингибитор NHE) и тимололом (препарат для снижения ВГД, используемый в клинической практике). Среди исследованных соединений in vitro все производные хиназолина в концентрации 1 нМ угнетали активность NHE-1, наиболее активным было производное хиназолинацетилгуанидина. Однако не все соединения проявили ВГД-снижающую активность in vivo на крысах. Так, наиболее активными из хиназолиновых производных выступают 4-оксохиназолинацетилгуанидин, его бромированное в положении С6 производное и хиназолинпропионилгуанидин. Анализ структура–активность показал, что наличие атома Br в положении С6 производного 4-оксохиназолинацетилгуанидина приводит к максимальному снижению ВГД при инстилляции раствора исследуемого соединения.
ВВЕДЕНИЕ
Глаукома – одна из наиболее тяжелых форм офтальмопатологии, характеризующаяся постоянным или периодическим повышением внутриглазного давления (ВГД), без должного лечения приводящая к слепоте и слабовидению. На данный момент ВГД – единственный контролируемый фактор прогрессирования глаукомы. В связи с этим актуальным остается поиск соединений, которые способны понижать внутриглазное давление, препятствуя развитию нейропатии зрительного нерва и сопряженных с этим явлением состояний [1]. В последнее время в литературе обсуждается появление новых мишеней для офтальмогипотензивных соединений, одна из которых – Na+/H+-обменник-1 (NHE-1) [2, 3].
NHE-1 контролирует внутриклеточный рН и активность гликолитических ферментов – гексокиназы, фосфофруктокиназы и пируваткиназы, а его экспрессия и активность повышаются, например, при сахарном диабете. NHE-1-зависимая регуляция гликолиза, в условиях ингибирования (хрусталик) или недостаточной активации (сетчатка) глицеральдегид-3-фосфатдегидрогеназы, лежит в основе отвода избыточного гликолитического потока в сторону нескольких путей, способствующих окислительному стрессу, причинному фактору диабетического катарактогенеза и ретинопатии. Доказано, что активация NHE-1 способствует формированию диабетической катаракты, а также окислительно-нитратному стрессу и апоптозу сетчатки [4].
Многочисленные доклинические испытания, проведенные на крысах, кроликах и обезьянах, а также клинические испытания на людях подтверждают снижение ВГД при применении ингибиторов Na+/H+-обменника (NHE) [5, 6]. Так, в исследовании блокирования Na+/H+- и Cl–/HCO3-обменников карипоридом, амилоридом и этил-изопропил-амилоридом было показано, что данные воздействия в культуре клеток бычьего пигментного и беспигментного эпителия цилиарного тела препятствуют поглощению этими клетками ионов Na+, необходимых для секреции внутриглазной жидкости. В ранее проведенных исследованиях на кафедре фармакологии и биоинформатики Волгоградского государственного медицинского университета [6, 7] были выявлены соединения, ингибирующие NHE.
NHE-1 экспрессируется и активен в цилиарном пигментированном эпителии цилиарного тела, где он вместе с антипортером Cl–/HCO3 AE2 способствует поглощению NaCl из стромы цилиарного отростка, что выступает решающим этапом для образования водянистой влаги. Кроме того, натрийуретические пептиды, которые локально синтезируются в цилиарном теле, ингибируют активность NHE-1, что, возможно, приводит к снижению ВГД. Кроме того, было показано, что активность NHE-1 регулируется соматостатином, который вырабатывается в этом эпителии и активирует PI3K/AKT и эндотелиальный NO-синтазный путь. В непигментированном эпителии базолатеральные NHEs (возможно, NHE-1 и NHE-4) ингибируются NO, который, вероятно, действует через cGMP и протеинкиназу G [8]. Взятые вместе, эти результаты указывают на возможную роль ингибирования NHE1 в снижении внутриглазного давления. Соответственно, ингибиторы NHE снижают ВГД и могут рассматриваться как потенциальные фармакологические агенты.
Цель настоящего исследования – получение новых гуанидиновых производных хиназолина и изучение их возможного влияния на Na+/H+-обменник и внутриглазное давление у крыс.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтез гетероциклических производных хиназолинового ряда. Производные хиназолина представляют собой биоизостеры мелатонина, который, согласно многочисленным исследованиям [9], не только корректирует нарушенные циркадные ритмы, сон и настроение, но и выступает перспективным соединением для патогенетической терапии глаукомы [6].
N-Алкилирование исходных оснований бензиловым эфиром хлоруксусной кислоты и изопропиловым эфиром α-хлорпропионовой кислоты, а также аминирование промежуточных сложных эфиров хиназолинилкарбоновых кислот гуанидином и аминогуанидином осуществляли по разработанной ранее методике [10]. В результате было синтезировано девять новых пиримидиновых производных хиназолина (I–IX).
Фармакологические свойства синтезированных соединений. NHE-ингибирующая активность in vitro. При физиологическом значении pH NHE-1 имеет низкую активность. Во время возникновения внутриклеточного ацидоза происходит накопление внутриклеточных протонов, которые выводятся из клеток через сарколеммный NHE-1 в обмен на вход ионов Na+. Возрастание внутриклеточного содержания ионов Na+ активирует 3Na+/Ca2+-реверсивный обмен через сарколемму, инициируя вход ионов Са2+ в кардиомиоциты. Возникает “Са2+-перегрузка” [11, 12].
В контрольной серии экспериментов при добавлении к 200 мкл плазмы, богатой тромбоцитами (ПБогТ), раствора Кребса наблюдали увеличение светопропускания в среднем на 30–40% от исходного уровня калибровки. При добавлении к 200 мкл ПБогТ для снижения внутриклеточного рН 600 мкл пропионатного буфера (контрольная серия) происходила активация NHE-1, увеличивался приток Na+, связанный с выделением цитозольного H+, что приводило к отеку (сферуляции) тромбоцита в результате аккумуляции воды в цитоплазме. При этом наблюдали облегчение светопропускания до 60–70%.
В опытных исследованиях после предварительной инкубации ПБогТ с новыми соединениями или препаратом сравнения зонипоридом происходило снижение уровня светопропускания по отношению к контрольным исследованиям только с натрий-пропионатным буфером. Это свидетельствует о том, что исследуемые соединения ингибируют NHE-1 и уменьшают вероятность сферуляции тромбоцитов. Полученные результаты согласуются с литературными данными [11, 13, 14].
В исследовании in vitro все производные хиназолина в концентрации 1 нМ статистически значимо по отношению к контрольным исследованиям (р < 0.05) вызывали угнетение активности NHE-1. Соединения (II), (IV–VI) и (VIII) превосходили препарат сравнения зонипорид, однако статистически значимые различия с зонипоридом были только в отношении соединения (VIII) (табл. 1).
Таблица 1.
Влияние новых соединений и препаратов сравнения на активность Na+/Н+-обменника и показатели внутриглазного давления у интактных крыс
| Соеди-нение/ препарат | NHE-ингибирую-щая активность в дозе 1 нМ (Δ%), M ± m | Максимальное изменение ВГД, % | Время максималь-ного снижения ВГД, ч | Влияние на ВГД коллате- рального глаза | R1 | R2 | R3 |
|---|---|---|---|---|---|---|---|
| Производные хиназолина с линейным гуанидиновым фрагментом | |||||||
| Группа 1 | |||||||
 |
Базовая структура 4-оксохиназолинацетилгуанидина | ||||||
| (I) | 34.2 ± 11.8 | –26.2* | 2 | – | – | – | – |
| (III) | 48.3 ± 3.8* | 6.5 | ВГД не снижалось | + | CH3 | – | – |
| (IX) | 47.1 ± 9.2* | 8.6 | ВГД не снижалось | – | – | CH3 | – |
| (VII) | 46.1 ± 8.6* | 5.3 | ВГД не снижалось | + | – | Cl | – |
| (IV) | 57.6 ± 8.9* | –41.0*, # | 2 | – | – | Br | – |
| (VIII) | 74.5 ± 7.1*, ** | –2.6 | 2 | – | CH3 | Br | – |
| (VI) | 56.7 ± 12.0* | –15.8* | 2 | – | – | Br | Br |
| Группа 2 | |||||||
 |
Базовая структура 4-оксохиназолинпропионилгуанидина | ||||||
| (II) | 56.2 ± 12.91* | –21.1* | 1 | – | – | – | – |
| (V) | 68.9 ± 10.9* | 2.9 | ВГД не снижалось | + | – | Br | – |
| Препараты сравнения | |||||||
| Тимолол | Не исследовали | –24.4* | 2 | + |  (S)-1-(трет-Бутиламино)-3-[(4-морфолино-1,2,5-тиадиазол-3-ил)окси]-2-пропанол (гемигидрат или
малеат)
(S)-1-(трет-Бутиламино)-3-[(4-морфолино-1,2,5-тиадиазол-3-ил)окси]-2-пропанол (гемигидрат или
малеат)
|
||
| Зонипорид | 41.5 ± 8.1* | –46.5*, # | 3 | – |  [1-(Хинолин-5-ил)-5-циклопропил-1Н-пиразол-4-карбонил]гуанидина гидрохлорид моногидрат |
||
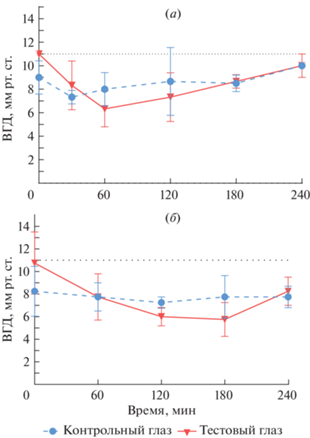
Офтальмогипотензивные свойства. Офтальмогипотензивную активность исследуемых соединений и препаратов сравнения изучали методом тонометрии на белых беспородных интактных крысах. Животные были разделены на опытные группы, которым в правый (тестовый) глаз инстиллировали (вводили в конъюктивальный мешок) исследуемые соединения, и группы препаратов сравнения, которым в тестовый глаз инстиллировали тимолол и зонипорид. Левый (контрольный, коллатеральный) глаз служил для оценки возможного резорбтивного действия исследуемых соединений. Так, тимолол при инстилляции снижал офтальмотонус через 30 мин на 24% и достигал максимального эффекта через 1 ч (рис. 1а), ВГД-снижающий эффект сохранялся в течение 3 ч, что соответствует литературным данным и подтверждается в терапии. Зонипорид проявлял ВГД-снижающую активность через 60 мин (–27.9%) и достигал максимального эффекта к третьему часу (–46.5%) (рис. 1б).
Рис. 1.
Влияние тимолола (а) и зонипорида (б) на внутриглазное давление у крыс при однократной инстилляции в концентрации 0.2%.
При изучении влияния ингибиторов NHE на ВГД было выявлено, что из девяти синтезированных пиримидиновых производных хиназолина в различной степени снижали ВГД только четыре соединения – производные (I), (II), (IV) и (VI), остальные пять соединений не проявляли активность.
Соединение (VI) снижало ВГД максимально на 15.8% по отношению к исходному значению ко второму часу исследования, без тенденции к дальнейшему снижению ВГД. У соединения (II) максимальный офтальмогипотензивный эффект был достигнут к первому часу, ВГД было снижено на 21.1%, с последующим уменьшением оказываемого эффекта. Высокую активность, превосходящую препарат сравнения тимолол, проявили соединения (IV) и (I), максимум ВГД-снижающего эффекта в обоих случаях достигался к началу второго часа исследования и составлял 41.0 и 26.3% соответственно. В ходе исследования зонипорида установлено, что ВГД к третьему часу снижается на 46.5%, превосходя препарат сравнения тимолол.
Влияние исследуемых соединений на ВГД коллатерального глаза исследовали с целью выявления системного действия при попадании в кровоток и в дальнейшем прогнозирования возможных побочных эффектов. Таким образом, наиболее активные соединения (IV), (I), (II) и (VI) не вызывают изменения ВГД коллатерального глаза, в отличие от препарата сравнения тимолола, а значит, не проявляют резорбтивный эффект.
Для наиболее активных соединений определяли продолжительность изучаемого эффекта. Так, соединение (IV) через 60 мин после инстилляции снижало ВГД относительно исходного уровня на 36%, через 120 мин – на 41%, но к 180 мин исследуемый показатель возвращался к исходному значению (рис. 2а). Соединение (I) через 60 мин после инстилляции снижало ВГД на 16% относительно исходного уровня, к 120 мин эффективность возрастала до 26%, а к 180 мин гипотензивный эффект не наблюдался (рис. 2б). При инстилляции соединения (II) максимальное снижение ВГД наступало через 60 мин (21%), в дальнейшем активность снижалась: через 2 ч – до 15%, а через 3 ч – до 10% (рис. 2в).
Рис. 2.
Влияние соединений (IV) (а), (I) (б) и (II) (в) на внутриглазное давление у крыс при однократной инстилляции в концентрации 0.2%.
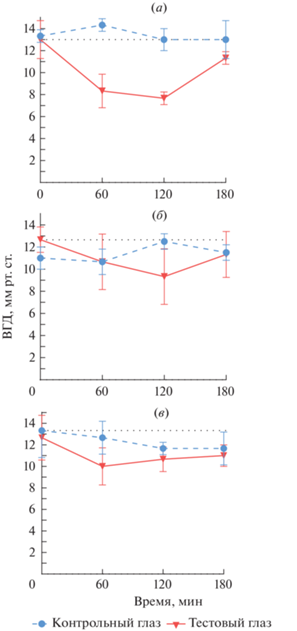
Влияние на коллатеральный глаз у исследуемых соединений (I), (II) и (IV) не было обнаружено и находилось в пределах уровня ошибки.
Зависимость проявляемых фармакологических эффектов от химической структуры исследуемых соединений. По результатам исследования был проведен анализ зависимости ВГД-снижающей активности от химической структуры изучаемых соединений. Все исследуемые производные хиназолина были разделены на две группы (табл. 1): группа 1 включает в себя ацетилгуанидиновые производные хиназолина, группа 2 – пропионилгуанидиновые производные хиназолина.
В группу 1 входят производные хиназолина, в которых гетероцикл соединен с линейным гуанидиновым фрагментом посредством ацетильного линкера. Соединение (I), проявляющее среднюю активность и снижающее ВГД на 26.32%, представляет собой базовую структуру для всех изучаемых в данном исследовании соединений. Замещение атома H на атом Br в положении С6 (IV) приводит к увеличению активности и наибольшему снижению ВГД (–41%), тогда как дальнейшее бромирование в положение С8 (VI), создающее дополнительные электронные и стерические эффекты, снижает изучаемую активность (до ‒15.79%). В то же время наличие одного, но более электроотрицательного атома Cl в положении С6 (VII) приводит к обратному эффекту – незначительному повышению ВГД на 5.26%. Такой же эффект обеспечивает и введение метильной группы в положения С2 (III) и С6 (IX) – ВГД возрастает на 6.45 и 8.57% соответственно. Модификация структуры (IX) и последующее введение атома Br в положение C6 (VIII) приводит к незначительному проявлению активности и снижению офтальмотонуса.
В группу 2 входят гуанидиновые производные хиназолина, у которых линкер представлен пропионильным фрагментом. Обнаружено, что включение в ацетильный линкер базового соединения (I) дополнительной метильной группы (II) почти не влияет на снижение ВГД (–21.1%). Однако дальнейшее бромирование в положение С6 (V), так же как и в случае С2-метилирования, приводит к инверсии эффекта, и это соединение, наоборот, повышает офтальмотонус на 2.94%.
По результатам NHE-ингибиторной активности также был проведен анализ, отображающий связь химических структур изучаемых соединений и проявления фармакологического эффекта. Так, среди производных 4-оксохиназолинацетилгуанидина соединение (I), выступающее базовой структурой для всех изучаемых в данном исследовании соединений, проявляло наименьшую NHE-ингибирующую активность (34.21%). Электроотрицательный атом хлора в положении С6 (VII) приводит к увеличению NHE-ингибирующего действия до 46.12%, а замена Cl• на метильную группу (IX) повышает активность до 47.05%. Наличие метильного заместителя в положении С2 (III) повышает изучаемую активность до 48.31%. Если же ввести два атома Br в положения С6 и С8 (VI), NHE-ингибиторная активность повышается до 56.70%, сопоставимым эффектом (57.56%) обладает соединение (IV) только с одним атомом Br в положении C6, а замещение атома H• на метильную группу в положении С2 (VIII) приводит к максимальному среди исследуемых соединений увеличению NHE-ингибирующей активности – до 74.50%.
Среди производных 4-оксохиназолинпропионилгуанидина соединение (II), не имеющее заместителей в хиназолиновом скаффолде, проявляет высокую NHE-ингибирующую активность (56.23%), но введение атома Br в положение С6 (V) повышает активность до 68.85%.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез гетероциклических производных хиназолинового ряда. Все реагенты получали от компаний Sigma-Aldrich (США), AcrosOrganics (Бельгия) и использовали без дополнительной очистки. ЯМР-спектры регистрировали на спектрометре Avance 400 (Bruker, Германия; 400 МГц для 1H и 100 МГц для 13C) в DMSO-d6 с тетраметилсиланом в качестве внутреннего стандарта. Температуру плавления определяли в стеклянных капиллярах на приборе Mel-Temp 3.0 (Laboratory Devices Inc., США).
Исходные основания – хиназолин-4(3Н)-он и 2-метилхиназолин-4(3Н)-он – коммерчески доступные соединения. 6-Бромхиназолин-4(3Н)-он, 2-метил-6-бромхиназолин-4(3Н)-он и 6,8-дибромхиназолин-4(3Н)-он получали в соответствии с опубликованными методиками [15, 16].
N-[2-[4-Оксохиназолин-3(4Н)-ил]ацетил]гуанидин (I). А. Бензиловый эфир [хиназолин-3(4Н)-ил]уксусной кислоты. Перемешивали 2.00 г (13.7 ммоль) хиназолин-4(3Н)-она и 4.00 г (28.9 ммоль) безводного карбоната калия в 40 мл безводного диметилформамида при 80–85°С в течение 15 мин, добавляли раствор 3.25 г (14.2 ммоль) бензилового эфира бромуксусной кислоты в 10 мл диметилформамида и перемешивали при той же температуре в течение 1 ч. Реакционную массу охлаждали, фильтровали, фильтрат упаривали на роторном испарителе при остаточном давлении 10 мм рт. ст. при температуре бани 90–95°С, остаток охлаждали, растирали с 25 мл воды, фильтровали, промывали на фильтре холодной водой (2 раза по 10 мл), сушили на воздухе в течение суток и кристаллизовали из 50 мл изопропилового спирта. Получили 3.30 г (82%) светло-желтого кристаллического вещества. Т. пл. 116–117°С.
Б. N-[2-[4-Оксохиназолин-3(4Н)-ил]ацетил]гуанидин (I). К кипящему раствору 2.00 г (6.80 ммоль) бензилового эфира [хиназолин-3(4Н)-ил]уксусной кислоты и 0.75 г (7.85 ммоль) гуанидина гидрохлорида в 50 мл безводного метилового спирта добавляли в один прием 0.50 г (8.04 ммоль) гранулированного калия гидроксида и кипятили в течение 30 мин. Горячий раствор фильтровали, отделяя образовавшийся осадок калия хлорида, фильтрат охлаждали и выдерживали в течение суток при комнатной температуре. Выделившийся осадок отфильтровывали, промывали холодным метиловым спиртом (2 раза по 10 мл), 10 мл диэтилового эфира, сушили на воздухе в течение суток при комнатной температуре. Получили 1.45 г (87%) белого кристаллического вещества. Т. пл. 240–242°С. Спектр 1Н-ЯМР (δ, м.д.; J, Гц): 4.39 (с, 2H, CH2), 7.50 (т, 1Н, J 8, Н6), 7.54 (уш. с, 4Н, NH), 7.65 (д, 1Н, J 8, Н8), 7.78 (т, 1Н, J 8, Н7), 8.12 (д, 1Н, J 8, Н5), 8.22 (с, 1Н, Н2). Спектр 13С-ЯМР (δ, м.д.): 49.50, 121.95, 126.32, 127.05, 127.27, 134.37, 148.31, 149.29, 158.95, 160.59, 171.65.
Остальные соединения получали аналогичным образом.
N-[2-[2-Метил-4-оксо-3(4Н)-хиназолинил]ацетил]гуанидин (III). Белое кристаллическое вещество, выход 80%. Т. пл. 262–264°С. Спектр 1Н‑ЯМР (δ, м.д.; J, Гц): 2.46 (с, 3Н, СН3), 4.69 (с, 2Н, СН2), 6.80 (уш. с, 4Н, NH), 7.45 (т, 1Н, J 8, Н6), 7.58 (д, 1Н, J 8, Н8), 7.76 (т, 1Н, J 8, Н7), 8.07 (д, 1Н, J 8, Н5). Спектр 13С-ЯМР (δ, м.д.): 26.23, 52.62, 123.22, 129.44, 129.58, 129.84, 137.58, 150.60, 159.02, 164.51, 165.83, 180.77.
N-[2-[6-Метил-4-оксо-3(4Н)-хиназолинил]-ацетил]гуанидин (IX). Белое кристаллическое вещество, выход 81%. Т. пл. 267–270°С. Спектр 1Н‑ЯМР (δ, м.д.; J, Гц): 2.44 (с, 3Н, СН3), 4.35 (с, 2Н, СН2), 7.55 (д, 1Н, J 8, Н8), 7.61 (д, 1Н, J 8, Н7), 7.62 (уш. с, 4Н, NH), 7.92 (с, 1Н, Н5), 8.16 (с, 1Н, Н2). Спектр 13С-ЯМР (δ, м.д.): 21.16, 49.40, 121.87, 125.64, 127.20, 135.49, 136.53, 146.49, 148.62, 159.14, 160.41, 171.48.
N-[2-[6-Хлор-4-оксо-3(4Н)-хиназолинил]ацетил]гуанидин (VII). Белое кристаллическое вещество, выход 76%. Т. пл. 244–247°С. Спектр 1Н‑ЯМР (δ, м.д.; J, Гц): 4.36 (с, 2Н, СН2), 7.56 (уш. с, 4Н, NH), 7.67 (д, 1Н, J 8, Н8), 7.80 (д, 1Н, J 8, Н7), 8.04 (с, 1Н, Н5), 8.26 (с, 1Н, Н2). Спектр 13С-ЯМР (δ, м.д.): 52.61, 126.30, 128.33, 132.71, 134.29, 137.44, 150.23, 152.93, 162.16, 162.53, 174.33.
N-[2-[6-Бром-4-оксо-3(4Н)-хиназолинил]ацетил]гуанидин (IV). Белое кристаллическое вещество, выход 89%. Т. пл. 242–244°С. Спектр 1Н‑ЯМР (δ, м.д.; J, Гц): 4.37 (с, 2Н, СН2), 7.47 (уш. с, 4Н, NH), 7.60 (д, 1Н, J 8, Н8), 7.90 (д, 1Н, J 8, Н7), 8.17 (с, 1Н, Н2), 8.28 (с, 1Н, Н5). Спектр 13С-ЯМР (δ, м.д.): 52.66, 122.47, 126.60, 131.44, 132.83, 140.17, 150.44, 152.98, 162.08, 162.41, 174.31.
N-[2-[2-Метил-6-бром-4-оксо-3(4Н)-хиназолинил]ацетил]гуанидин (VIII). Белое кристаллическое вещество, выход 83%. Т. пл. 281–284°С. Спектр 1Н-ЯМР (δ, м.д.; J, Гц): 2.46 (с, 3Н, СН3), 4.47 (с, 2Н, СН2), 7.51 (д, 1Н, J 8, Н8), 7.60 (уш. с, 4Н, NH), 7.88 (д, 1Н, J 8, Н7), 8.13 (с, 1Н, Н5). Спектр 13С-ЯМР (δ, м.д.): 23.24, 47.76, 118.44, 121.86, 128.56, 129.20, 137.14, 146.53, 156.98, 159.13, 160.22, 170.91.
N-[2-[6,8-Дибром-4-оксо-3(4Н)-хиназолинил]ацетил]гуанидин (VI). Светло-желтое кристаллическое вещество, выход 81%. Т. пл. 313–316°С. Спектр 1Н-ЯМР (δ, м.д.; J, Гц): 4.36 (с, 2Н, СН2), 7.58 (уш. с, 4Н, NH), 8.18 (с, 1Н, Н7), 8.30 (с, 1Н, Н5), 8.38 (с, 1Н, Н2). Спектр 13С-ЯМР (δ, м.д.): 52,80, 122.24, 126.55, 127.46, 131.41, 142.56, 148.20, 153.87, 161.91, 162.21, 173.70.
N-[2-[4-Оксо-3(4Н)-хиназолинил]пропионил]-гуанидин (II). Белое кристаллическое вещество, выход 78%. Т. пл. 268–270°С. Спектр 1Н-ЯМР (δ, м.д.; J, Гц): 1.57 (д, 3Н, J 8, СН3), 5.17 (кв, 1Н, J 8, СН), 7.50 (т, 1Н, J 8, Н6), 7.61 (уш. с, 4Н, NH), 7.66 (д, 1Н, J 8, Н8), 7.80 (т, 1Н, J 8, Н7), 8.13 (д, 1Н, J 8, Н5), 8.29 (с, 1Н, Н2). Спектр 13С-ЯМР (δ, м.д.): 21.30, 56.91, 124.82, 129.56, 129.94, 130.29, 137.36, 150.74, 151.00, 162.14, 163.36, 177.08.
N-[2-[6-Бром-4-оксо-3(4Н)-хиназолинил]пропионил]гуанидин (V). Белое кристаллическое вещество, выход 84%. Т. пл. 264–267°С. Спектр 1Н‑ЯМР (δ, м.д.; J, Гц): 1.56 (д, 3Н, J 8, СН3), 5.13 (кв, 1Н, J 8, СН), 7.58 (уш. с, 4Н, NH), 7.60 (д, 1Н, J 8, Н8), 7.92 (д, 1Н, J 8, Н7), 8.20 (с, 1Н, Н5), 8.23 (с, 1Н, Н2). Спектр 13С-ЯМР (δ, м.д.): 21.24, 57.28, 122.33, 126.38, 131.65, 132.78, 140.23, 150.02, 151.40, 162.20, 162.28, 176.56.
Фармакологические свойства синтезированных соединений. NHE-ингибирующая активность in vitro. Влияние соединений на активность Na+/H+-обменника изоформы 1 (NHE-1) изучали in vitro по методу D. Rosskopfetal. (1991) [13] и K. Kusumoto (2002) [14] с модификациями [11] с использованием лазерного анализатора агрегации тромбоцитов АЛАТ-2 (ООО НПФ “БИОЛА”, Россия; программное обеспечение AGGR 2.00, Россия). Для эксперимента были выбраны тромбоциты кролика (исследования выполнены на пяти кроликах-самцах весом 3.0–4.0 кг (Филиал “Электрогорский” ФГБУН НЦБМТ ФМБА, ветеринарное свидетельство 250 № 36969458 от 08.09.2015), поскольку на них активно экспрессирует NHЕ-1. В основу метода положены изменения светопропускания при изменении формы тромбоцита в условиях, имитирующих ишемию. Светопропускание ПБогТ принимали за 0%, раствора Кребса – за 100%.
Из краевой вены уха кролика забирали кровь в пробирки с 3.8%-ным раствором цитрата натрия (в соотношении 1 : 10). Кровь центрифугировали в течение 12 мин (Multi Centrifuge CM 6M, Латвия) при 1000 об/мин. Забирали надосадочную жидкость – плазму, богатую тромбоцитами (ПБогТ).
Контрольные измерения изменений светопропускания проводили без соединений. В условиях отсутствия активности NHЕ-1 (рН 7.4) к 200 мкл ПБогТ добавляли 600 мкл раствора Кребса (в мМ: NaCl – 120, KCl – 4.8, KH2PO4 – 1.2, MgSO4 – 2.5, NaHCO3 – 25, CaCl2 – 2.6, глюкоза – 5.4; pH 7.4, 37°С). Для активации NHЕ-1 снижали pH: к 200 мкл ПБогТ добавляли 600 мкл буферного раствора, содержащего натрия пропионат (в мМ: натрия пропионат – 135, HEPES – 20, СaCl2 – 1, МgCl2 – 1, глюкоза – 10; pH 6.7, 37°С).
В опытных измерениях изменений светопропускания в кювету к 200 мкл ПБогТ предварительно добавляли изучаемые соединения или препарат сравнения в концентрации 1 нМ и объеме 10 мкл, предварительно инкубировали 5 мин до добавления раствора пропионатного буфера. Все пробы инкубировали при постоянном перемешивании с помощью магнитной мешалки (800 об/мин, 37°С). В качестве препарата сравнения использовали селективный ингибитор NHE-1 зонипорид (Sigma, США).
Дельта % ингибирования рассчитывали по формуле:
Статистические расчеты проводили в программе Microsoft Excel (Microsoft, США).
Офтальмогипотензивные свойства. Изучение влияние на внутриглазное давление проводили на беспородных интактных крысах обоих полов массой 220–400 г, возрастом 2 месяца (питомник “Рапполово”, Ленинградская область). Все животные были разделены на опытные группы и группы препаратов сравнения по шесть животных в каждой. В 9:00 утра у животных всех групп измеряли исходное ВГД в обоих глазах. Для определения ВГД использовали ветеринарный тонометр ICARE TonoVet (Финляндия) для ранней диагностики глаукомы в ветеринарии [6, 17]. После измерения животным опытных групп проводили инстилляцию 0.2%-ных водных растворов изучаемых соединений в объеме 50 мкл в правый глаз (тестовый). Животным групп препаратов сравнения в тестовый глаз инстиллировали тимолол (лекарственное средство, снижающее ВГД, применяемое в клинической практике; Тимолол-СОЛОфарм 0.5%, Гротекс, Россия) и 0.2%-ный раствор зонипорида (стандартный ингибитор NHE; Sigma, США). Левый глаз (контрольный, коллатеральный) служил для определения возможного резорбтивного эффекта. ВГД в тестовом и коллатеральном глазах измеряли через 30, 60, 120, 180 и 240 мин.
Статистическую обработку данных проводили с помощью программного обеспечения Microsoft Office и Graph Pad Prizm (GraphPad Software, США).
ЗАКЛЮЧЕНИЕ
Синтезировано девять новых пиримидиновых производных хиназолина, изучено их влияние на ингибирование Na+/H+-обменника и внутриглазное давление (ВГД) крыс в сравнении с зонипоридом (ингибитор NHE) и тимололом (препарат для снижения ВГД, используемый в клинической практике). Показано, что соединение (IV) – бромированное в положении С6 производное 4‑оксохиназолинацетилгуанидина – выступает ингибитором NHE-1 и обладает высокой офтальмогипотензивной активностью у крыс, превосходящей препарат сравнения тимолол, что свидетельствует о перспективности дальнейшего изучения его возможных антиглаукомных свойств, а также детализации механизма действия в отношении внутриглазного давления.
Список литературы
Балалин С.В., Фокин В.П. // Клиническая офтальмология. 2019. Т. 19. С. 43–48. https://doi.org/10.21689/2311-7729-2019-19-1-43-48
Avila M.Y., Seidler R.W., Stone R.A., Civan M.M. // Invest. Ophthalmol. Vis. Sci. 2002. V. 43. P. 1897–1902.
Mandal A., Shahidullah M., Delamere N.A., Terán M.A. // Am. J. Physiol. Cell Physiol. 2009. V. 297. P. C111–C120. https://doi.org/10.1152/ajpcell.00539.2008
Lupachyk S., Stavniichuk R., Komissarenko J., Drel V., Obrosov A., El-Remessy B., Pacher P., Obrosova I. // Int. J. Mol. Med. 2012. V. 29. P. 989–998. https://doi.org/10.3892/ijmm.2012.933
Fidzinski P., Salvador-Silva M., Choritz L., Geibel J., Coca-Prados M. // Am. J. Physiol. Cell Physiol. 2004. V. 287. P. C655–C663. https://doi.org/10.1152/ajpcell.00552.2003
Spasov A., Ozerov A., Vassiliev P., Kosolapov V., Gurova N., Kucheryavenko A., Naumenko L., Babkov D., Sirotenko V., Taran A., Litvinov R., Borisov A., Klochkov V., Merezhkina D., Miroshnikov M., Uskov G., Ovsyankina N. // Sci. Rep. 2021. V. 11. P. 1–13. https://doi.org/10.1038/s41598-021-03722-w
Спасов А.А., Гурова Н.А., Тимофеева А.С., Сорокин С.М. // Эксперим. и клинич. фармакология. 2014. Т. 77. № 6. С. 13–17.
Pedersen S.F., Counillon L. // Physiol. Rev. 2019. V. 99. P. 2015–2113. https://doi.org/10.1152/physrev.00028.2018
Gubin D., Neroev V., Malishevskaya T., Cornelissen G., Astakhov S., Kolomeichuk S., Yuzhakova N., Kabitskaya Y., Weinert D. // J. Pineal Res. 2021. V. 70. P. e12730. https://doi.org/10.1111/jpi.12730
Озеров А.А., Новиков М.С., Глухова Е.Г. // Усп. соврем. естествознания. 2016. № 2. С. 53–56.
Гурова Н.А., Спасов А.А., Питерсен А.С. // Вестник Волгоград. гос. мед. ун-та. 2011. № 2. С. 70–72.
Спасов А.А., Гурова Н.А., Харитонова М.В. // Эксперим. и клинич. фармакология. 2013. Т. 76. № 1. С. 43–48.
Rosskopf D., Morgenstern E., Scholz W., Osswald U., Siffert W. // J. Hypertens. 1991. V. 9. № 3. P. 231–238.
Kusumoto K., Igata H., Abe A., Ikeda S., Tsuboi A., Imamiya E., Fukumoto S., Shiraishi M., Watanabe T. // Br. J. Pharmacol. 2002. V. 135. P. 1995–2003. https://doi.org/10.1038/sj.bjp.0704647
Солодунова Е.А., Новиков М.С., Озеров А.А. // Волгоград. научно-мед. журн. 2015. № 3. С. 36–38.
Солодунова Г.Н., Волкова А.О., Коршенинникова А.С., Кучеренко А.Р., Скороход Е.Д., Толкачева В.И., Турченкова К.В., Турченкова Л.В. // Волгоград. научно-мед. журн. 2018. № 2. С. 20–22.
Marcus A.J., Iezhitsa I., Agarwal R., Vassiliev P., Spasov A., Zhukovskaya O., Anisimova V., Ismail N.M. // Data Brief. 2018. V. 18. P. 523–554. https://doi.org/10.1016/j.dib.2018.03.019
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


