Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 1, стр. 3-14
Внеклеточные везикулы и перспективы их использования для регенерации тканей
О. Н. Шевелева a, Е. И. Домарацкая a, О. В. Паюшина a, *
a Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
* E-mail: payushina@mail.ru
Поступила в редакцию 30.04.2018
После доработки 10.05.2018
Принята к публикации 07.05.2018
Аннотация
Внеклеточные везикулы – важный компонент секретомов различных клеток, обеспечивающий комплексную передачу биологически активных молекул и горизонтальный перенос генетической информации. Они различаются по происхождению, составу и функциям. Выбор протокола выделения везикул, изменение условий культивирования клеток, их продуцирующих, а также генетическая модификация позволяют изменять состав получаемых везикул. Стволовые клетки продуцируют везикулы, несущие широкий спектр факторов роста, хемокинов, цитокинов, микроРНК, которые могут влиять на окружающие клетки и оказывать терапевтический эффект при различных патологиях. Изучение механизмов биогенеза внеклеточных везикул, а также их действия на клетки-мишени является важной общебиологической задачей, а совершенствование методов получения везикул определенного состава открывает широкие перспективы их использования в клинической практике.
ВВЕДЕНИЕ
Фундаментальные исследования в области регенерации служат теоретической и практической основой регенеративной медицины, усилия которой направлены на полное структурно-функциональное восстановление поврежденных тканей. В последнее время наметились новые перспективные подходы, позволяющие повысить эффективность восстановительной терапии. Применение технологий, базирующихся на достижениях в области биологии стволовых клеток, делает активацию собственных восстановительных потенций поврежденных тканей реально выполнимой задачей ближайшего будущего. Уникальные свойства стволовых клеток – потенции к дифференцировке в разные типы соматических клеток и способность оказывать регуляторное влияние на региональные клетки-предшественники – породили надежду на появление эффективной терапии ранее неизлечимых заболеваний. В доклинических исследованиях показан положительный эффект введения стволовых клеток при инфаркте миокарда, инсульте, повреждениях спинного мозга, печени, заболеваниях сетчатки и других; более того, имеются обнадеживающие данные клинических испытаний [1–4]. Однако существует ряд проблем, ограничивающих широкое применение стволовых клеток в медицинской практике. В частности, они могут претерпевать опухолевую трансформацию [5, 6], быть иммунологически несовместимыми с организмом реципиента [7] и плохо выживать в поврежденных тканях [8]. Поиск новых терапевтических стратегий, позволяющих избежать трансплантации клеток, выявил участие их секреторных продуктов в восстановлении тканей [9]. При этом регуляторные эффекты стволовых клеток опосредованы продукцией ими не только растворимых факторов роста, цитокинов и т.п., но и внеклеточных везикул, обеспечивающих комплексную передачу биоактивных молекул и горизонтальный перенос генетической информации между клетками.
В обзоре рассмотрены состав и механизмы образования внеклеточных везикул, методы их выделения из кондиционированных сред, подходы к получению везикул с необходимыми свойствами, а также регенеративный потенциал внеклеточных везикул, продуцируемых различными типами стволовых клеток.
КЛАССИФИКАЦИЯ И БИОГЕНЕЗ ВНЕКЛЕТОЧНЫХ ВЕЗИКУЛ
Внеклеточные везикулы были открыты в середине XX века при исследовании свертываемости крови [10]. Позднее показали, что при культивировании ретикулоцитов в среду выделяются везикулы, названные экзосомами, мембрана которых по своему составу и присутствующим на ней рецепторам близка к мембране продуцирующих клеток. Предположили, что основная роль экзосом заключается в удалении лишних мембранных белков в ходе созревания ретикулоцитов [11]. В настоящее время внеклеточные везикулы вызывают большой интерес в связи с обнаружением их участия во многих биологических процессах таких, в частности, как межклеточные взаимодействия в ходе эмбрионального развития и иммунных реакций, клеточная адгезия, рост и метастазирование опухолей [10, 12].
Номенклатура везикул остается недостаточно разработанной. Большинство исследователей пытаются классифицировать их, основываясь на способе образования, физико-химических характеристиках (размеру, плотности и т.п.) и маркерах [10]. Выделяют несколько типов внеклеточных везикул:
(1) экзосомы, образующиеся внутри мультивезикулярных эндосомальных телец (диаметр около 40–100 нм, основные маркеры – CD63, CD9, Alix, TSG101);
(2) микровезикулы, или эктосомы, образующиеся путем выпячивания и отпочкования участков плазматической мембраны (диаметр 20–1000 нм, основные маркеры – CD40, CD62);
(3) микрочастицы, также образующиеся за счет выпячивания плазматической мембраны (диаметр 50–80 нм, СD 133+/CD 63–);
(4) апоптозные тельца, образующиеся в результате фрагментации клеток при апоптозе (диаметр 1000–5000 нм, основной маркер – аннексин 5) [12–14].
В одной из последних работ предложена упрощенная классификация внеклеточных везикул, согласно которой под общим названием “микровезикулы” объединены все разновидности везикул, происходящие из плазматической мембраны, включая эктосомы, микрочастицы и апоптозные тельца; для везикул, образующихся из эндосом, сохранено название “экзосомы” [15]. В настоящем обзоре рассматриваются экзосомы и микровезикулы в узком смысле, иначе называемые эктосомами.
Первоначально полагали, что все внеклеточные везикулы образуются отпочкованием плазматической мембраны клетки. Однако позднее было установлено, что такой механизм характерен для микровезикул, экзосомы же образуется более сложным путем из мультивезикулярных эндосомальных телец [16] (рис. 1). Хотя биогенез микровезикул полностью не выяснен, известно, что важную роль в этом процессе играют мембранные фосфолипиды и белки цитоскелета [17]. Фактор АDP-рибозилирования 6 запускает сигнальный каскад, начинающийся с активации фосфолипазы D и заканчивающийся активацией легких цепей миозина, что приводит в итоге к высвобождению микровезикул. Избыточная экспрессия этого фактора в клетках меланомы вызывает усиление продукции микровезикул, но не влияет на продукцию экзосом, что подтверждает различия в механизмах формирования этих типов внеклеточных везикул [18].
Рис. 1.
Биогенез внеклеточных везикул. РЭ – ранняя эндосома, МВТ – мультивезикулярное тельце, ИЛВ – интралюминальные везикулы, Я – ядро. Воспроизведено из [14] с изменениями.
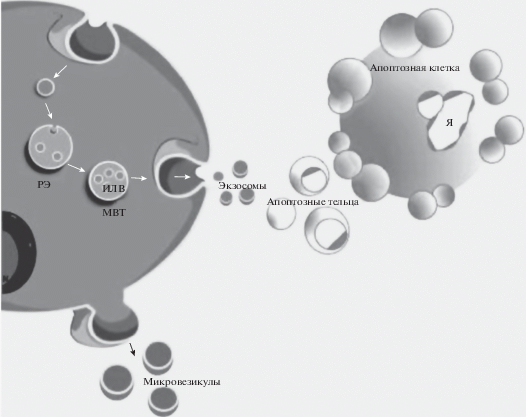
Согласно современным представлениям, экзосомы образуются путем эндоцитоза, который осуществляется двумя альтернативными способами. Первый из них требует участия эндосомальных сортировочных комплексов (ESRT), второй является ESRT-независимым. Формирование экзосом начинается с инвагинации участков плазмалеммы, содержащих связанные с убиквитином рецепторы. В результате этой инвагинации образуются ранние эндосомы. Сливаясь с другими эндосомами и двигаясь постепенно от поверхности клетки к ядру, ранние эндосомы становятся поздними эндосомами, из которых формируются мультивезикулярные тельца, содержащие интралюминальные везикулы – результат впячивания мембраны эндосомы в ее просвет с последующим отпочкованием участков цитоплазмы. Затем мультивезикулярные тельца сливаются либо с лизосомами с последующей деградацией их содержимого, либо с плазматической мембраной для высвобождения во внеклеточное пространство экзосом [19–21]. Эндосомальные сортировочные комплексы необходимы на этапах формирования экзосом, их транспортировки и выхода из клетки. В их состав входят около 20 консервативных белков, непосредственно участвующих в образовании комплексов (ESCRT-0, -I, -II и –III) или ассоциированных с ними (VPS4, VTA1, Alix). ESCRT-0 участвует в инициации мультивезикулярного пути, ESCRT-I и -II способствуют стабилизации формирующихся везикул, а ESCRT-III обеспечивает их отпочкование и высвобождение [22]. Для ESCRT-независимого образования экзосом необходимо присутствие сфинголипидов – церамидов, которые синтезируются при участии сфингомиелиназы. Если синтез сфингомиелиназы снижается, то уровень выхода экзосом из клетки падает [21]. Важную роль в биогенезе экзосом играют GTP-азы семейства Rab, задействованные на разных этапах формирования этих везикул. В частности, Rab5 участвует в образовании ранних эндосом, а Rab7 в их созревании и сортинге [20].
ХИМИЧЕСКИЙ СОСТАВ ЭКЗОСОМ И МИКРОВЕЗИКУЛ
Состав внеклеточных везикул варьирует в зависимости от их источника и способа выделения, однако существуют определенные типы белков и нуклеиновых кислот, входящие в состав большинства из них. Мембрана, окружающая внеклеточные везикулы, по своему липидному составу близка к плазмалемме, однако не идентична последней. Несмотря на различия между экзосомами разных клеток, большинство исследователей указывают на обогащенность их мембран сфингомиелином, фосфатидилсерином, холестерином, насыщенными жирными кислотами, церамидом и его производными [23]. В мембранах экзосом обнаружены липидные рафты, в состав которых входят специфические белки, например, флотилин. По-видимому, регулируя баланс между разными путями биогенеза, клетка может контролировать липидный состав экзосом. Например, при созревании ретикулоцитов в составе экзосом от этих клеток увеличивается количество церамидов [24]. Мембрана микровезикул содержит в основном такие липиды, как фосфатидилхолин, сфингомиелин и фосфатидилэтаноламин [25]. Изучение липидного состава мембран экзосом и микровезикул важно для понимания роли этих веществ в их биогенезе и для создания искусственных везикул, несущих различные терапевтические агенты. Кроме того, влияя на липидный обмен клетки, можно усиливать или уменьшать продукцию экзосом. Например, с помощью сапозина С, взаимодействующего с лизобисфосфатидной кислотой, можно ингибировать образование мультивезикулярных телец, тем самым уменьшая продукцию экзосом фибробластами [26].
Белковый состав внеклеточных везикул хорошо изучен, поскольку первоначально белки считались их основным действующим компонентом. Он еще более вариабелен, чем липидный состав, зависит от типа продуцирующих клеток и включает различные мембранные и цитозольные белки. Сведения о протеомном составе везикул собраны в базе данных Vesiclepedia (http://microvesicles.org) и постоянно пополняются. Кроме того, данные о белковом составе экзосом, а также о присутствующих в них РНК и липидах, содержатся в базе ExoCarta (http://www.exocarta.org). К мембранным белкам, часто встречающимся на экзосомах, относят тетраспанины (CD9, CD63, CD81 и другие), компоненты ESCRT (TSG101, Alix и другие), а также белки, участвующие в биогенезе экзосом (в частности, клатрин и убиквитин), адгезии (ICAM, интегрины), слиянии мембран и везикулярном транспорте (аннексины, Rab-белки) и прочие [25, 27]. Тетраспанины и белки ESRT являются универсальными маркерами экзосом и играют важную роль в их образовании, сортировке и выходе из клеток. Например, фибробласты, создающие микроокружение клеток опухоли молочной железы, образуют несколько типов экзосом, различающихся по экспрессии тетраспанинов – CD81+ экзосомы, которые несут Wnt, способствуя тем самым миграции раковых клеток и метастазированию, и CD63+ или CD82+ экзосомы, не обладающие такими свойствами [28]. Показано, что делеция тетраспанина CD81 в лимфоцитах мыши ухудшает селективный отбор и включение в состав экзосом многих белков, например, молекул MHC, ICAM 1, Rac и других [29]. К цитозольным белкам, обнаруженным в экзосомах, относятся белки теплового шока (например, Hsp70, Hsp90), различные ферменты, цитокины и ростовые факторы (АТP-азы, пируваткиназы, TNF-α, TGF-β и другие), белки, участвующие в сигнальной трансдукции и апоптозе (белки семейства 14-3-3, синтенин), белки цитоскелета (актин, тубулин и другие) [30]. По своему содержимому экзосомы, даже произошедшие от одних и тех же клеток, крайне гетерогенны. Например, экзосомы, отделяющиеся от базолатеральной мембраны клеток карциномы толстой кишки человека, содержат такие белки, как клатрин и молекулы MHC I, а в состав другой популяции экзосом, отделяющихся от апикальной части этих клеток, входят муцин и дипептидилпептидаза-4 [31].
Микровезикулы по белковому составу в целом близки к экзосомам. Есть данные о содержании в них различных белков клеточной адгезии, компонентов цитоскелета, матриксных металлопротеиназ, гликопротеинов, митохондриальных, центросомных и рибосомных белков [25]. При этом в микровезикулах отсутствуют обязательные компоненты экзосом – тетраспанины, флотилины, аннексины и белки ESRT. В качестве маркеров микровезикул обычно используют костимулирующий белок (CD40) и селектин (CD62) [14]. Проведенные на клетках нейробластомы исследования показали, что экзосомы и микровезикулы, полученные от одних и тех же клеток, отличаются по своему белковому составу и, по-видимому, играют разную роль в развитии патологического процесса. Для экзосом характерно присутствие большего количества онкогенных белков и влияние на пролиферацию и миграцию клеток в большей степени, чем для микровезикул [32].
В последние годы внимание привлекают нуклеиновые кислоты в составе внеклеточных везикул. Полагают, что именно они, а не белки, определяют высокую биологическую активность экзосом и микровезикул. Во внеклеточных везикулах обнаружены мРНК, микроРНК, другие некодирующие РНК, а также небольшое количество рРНК (впрочем, не исключено, что она выделяется из мертвых клеток и загрязнет фракцию везикул при центрифугировании) и ДНК. Экспортируемые экзосомами микроРНК могут влиять на функционирование клеток-реципиентов. Анализ содержания микроРНК в экзосомах подтверждает участие этого типа внеклеточных везикул в дифференцировке стволовых клеток (РНК let-7), в органогенезе (miR-1), кроветворении (miR-18), в образовании опухолей и метастазировании (miR-17, miR-18, miR-19a, miR-20, miR-19b-1, miR-93-1) [23]. Везикулы с повышенным содержанием определенных микроРНК могут быть использованы в качестве биомаркеров для диагностики различных заболеваний [33]. В частности, у больных сердечно-сосудистыми заболеваниями при повреждении миокарда в циркулирующих в крови экзосомах повышается уровень микроРНК-133a [34]. Профиль экзосомных микроРНК изменяется также при злокачественных опухолях [35, 36]. Качественный состав микроРНК, присутствующих в секретомах клеток, может существенно отличаться во внеклеточных везикулах разного типа. Так, показано, что в клетках меланомы некоторые микроРНК встречаются только в составе экзосом, например miR-199a-3p, miR-150-5p, miR-142-3p, miR-486-5p и miR-223-3p. Для микровезикул характерно присутствие некоторых микроРНК, обнаруженных в целых клетках и апоптозных тельцах, но они отсутствуют в экзосомах (miR-301b, miR-7d-3p, miR-378a5p и других) [37].
МЕТОДЫ ВЫДЕЛЕНИЯ ВНЕКЛЕТОЧНЫХ ВЕЗИКУЛ
В настоящее время наиболее распространенным способом выделения внеклеточных везикул является дифференциальное центрифугирование, время и скорость которого в каждом случае подбирают эмпирически. Основные принципы центрифугирования следующие: на первых этапах из кондиционированной среды либо биологической жидкости удаляют клетки (при 300 g и 2000 g), затем для осаждения клеточного дебриса и крупных везикул применяют центрифугирование при 10000–20000 g и, наконец, везикулы размером менее 1000 нм осаждают с помощью ультрацентрифугирования (при 100 000–120 000 g) [18, 38–40]. Этот подход требует больших затрат времени (4–5 ч) и наличия ультрацентрифуги; кроме того, он дает сравнительно небольшой выход внеклеточных везикул, а соосаждение белковых агрегатов, апоптозных телец и нуклеосомных фрагментов может снижать чистоту получаемых образцов [39]. Для получения более чистой фракции внеклеточных везикул применяют такие методы, как центрифугирование в градиенте плотности, ультрафильтрация, аффинная и гель-хроматография, метод фракционирования наночастиц в асимметричных потоках (flow field-flow fractionation) и использование специальных коммерческих наборов, например, ExoQuick/System Biosciences, обеспечивающего осаждение экзосом с помощью полиэтиленгликоля, и ExoCap/JSR Life Sciences, включающего магнитные бусы, покрытые антителами к поверхностным белкам экзосом [40–44]. Перспективным является метод, основанный на агрегации везикул с лектинами [45]. Однако несмотря на очевидные преимущества, протоколы, связанные с использованием магнитных бус, лектинов и коммерческих наборов, основанных на осаждении с полиэтиленгликолем, малопригодны для выделения внеклеточных везикул из больших объемов жидкости; в этом случае их можно применять в сочетании с ультрацентрифугированием [39]. Разнообразие условий выделения везикул затрудняет сравнение результатов, полученных разными исследователями, поэтому необходима разработка оптимального стандартного протокола выделения.
ПОЛУЧЕНИЕ ВНЕКЛЕТОЧНЫХ ВЕЗИКУЛ С РАЗЛИЧНЫМИ СВОЙСТВАМИ
Везикулы рассматриваются как перспективный носитель генетического материала, поскольку они участвуют в межклеточных взаимодействиях в норме в организме и обладают мембраной, обеспечивающей сохранность переносимых ими “грузов”. В последние годы активно ведется поиск методик, позволяющих влиять на состав получаемых везикул (рис. 2). Одной из таких методик является трансфекция внеклеточных везикул с помощью электропорации. В частности, показано, что экзосомы из плазмы крови, в которые методом электропорации были введены гетерологические малые интерферирующие РНК (siRNA), обеспечивают эффективную доставку этих молекул в мононуклеарные клетки крови. Транспортировка соответствующих siRNA в составе экзосом в моноциты и лимфоциты приводила к подавлению экспрессии MAPK-1 в клетках-реципиентах [46]. Однако метод электропорации, используемый для загрузки во внеклеточные везикулы крупных молекул ДНК для доставки генов в клетки-мишени, имеет ряд ограничений [47].
Рис. 2.
Терапевтические эффекты внеклеточных везикул и подходы к направленному изменению их свойств.
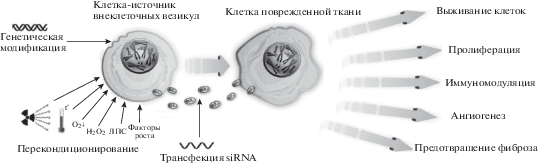
В связи с перспективами использования внеклеточных везикул при различных заболеваниях разрабатываются подходы к повышению их терапевтической эффективности. С этой целью применяют такие методы воздействия на продуцирующие их клетки, как культивирование в стрессовых условиях (тепловой шок или переохлаждение, окислительный стресс, гипоксия), трансфекция клеток, культивирование в присутствии различных цитокинов, факторов роста или бактериальных липополисахаридов (ЛПС) [27, 48–51]. Физические и химические воздействия на клетки могут влиять как на количество, так и на состав получаемых внеклеточных везикул. Показано, что культивирование мезенхимных стромальных клеток (МСК) из плаценты в условиях гипоксии (3 и 1% кислорода) приводит к увеличению числа продуцируемых экзосом (примерно в 3 и 6 раз соответственно) по сравнению с контрольной культурой клеток, содержащейся при 8% кислорода. Кроме того, такие экзосомы обладают повышенной ангиогенной активностью [52]. При облучении МСК рентгеновскими лучами наблюдалось увеличение содержания белков в экзосомах на 78% [53]. Показано участие экзосом в формировании “эффекта свидетеля”, при котором сигнал от облученных клеток передается необлученным [54]. Культивирование тучных клеток в условиях окислительного стресса (инкубация в течение суток с 125 мкМ H2O2) приводило к продукции ими экзосом с повышенным содержанием мРНК, которые при добавлении к другим клеточным культурам обеспечивали увеличение выживаемости клеток в условиях окислительного стресса [55]. Стресс-индуцированные изменения в экзосомах могут свидетельствовать об их биологической роли в организме, связанной с уменьшением негативных последствий при повреждениях отдельных клеток. Например, гипоксическое повреждение эпителиальных клеток влечет за собой усиление образования экзосом оставшимися клетками, которые в свою очередь стимулируют ангиогенез и восстановление ткани [56].
Следующий подход, направленный на изменение состава экзосом – генетическая модификация клеток, обеспечивающая сверхэкспрессию определенных генов. Например, протеинкиназа В, кодируемая геном Akt, участвует в ангиогенезе и способствует кардиопротекции. Показано, что трансфекция геном Akt МСК из пуповинной крови человека приводит к продукции ими экзосом, которые ускоряют миграцию и пролиферацию эндотелиальных клеток, способствуют ангиогенезу и улучшают функционирование сердца после инфаркта [51].
И, наконец, немаловажное влияние на состав и количество образующихся везикул оказывает среда, в которой растут клетки. Известно, что при добавлении в среду фактора роста из тромбоцитов (PDGF) увеличивается количество продуцируемых везикул, возрастает содержание в них проангиогенных белков (тромбопоэтина, различных матриксных металлопротеиназ), и усиливается их ангиогенная активность [49]. Культивирование клеток меланомы с добавлением белка Wnt5А, влияющего на Cа-зависимое высвобождение везикул, приводит к продукции экзосом, содержащих иммуномодулирующий цитокин интерлейкин (IL) -6 и проангиогенные факторы IL-8, VEGF, MMP2 [57]. Согласно другим данным, на содержание белков и РНК в экзосомах может повлиять предварительная инкубация клеток с провоспалительным цитокином TNFα. Экзосомы, полученные от таких прекондиционированных эндотелиальных клеток, отличаются от экзосом, произведенных клетками в обычных условиях культивирования, по экспрессии мРНК CCL2, IL-8, TNIP1, SOD2, VCAM, IL-32 [58]. Обработка клеток интерфероном-α или ЛПС позволяет получить экзосомы с противовоспалительной и соответственно противовирусной или противобактериальной активностью [50, 59]. Показано также, что МСК, предварительно культивированные с бактериальным ЛПС, обладают большей секреторной активностью и эффективнее устраняют воспаление, чем клетки, не подвергнутые прекондиционированию [60, 61]. Это может быть связано с влиянием ЛПС на продукцию экзосом, которые, по-видимому, играют важную роль в создании МСК противовоспалительной среды и в паракринном действии этих клеток на восстановление тканей. Полученные от прекондиционированных ЛПС МСК экзосомы отличаются от экзосом, образуемых МСК в обычных условиях, в первую очередь, по содержанию микроРНК. Такие экзосомы участвуют в поляризации макрофагов, снижают воспалительные реакции и облегчают заживление кожных ран при диабете [50].
ВНЕКЛЕТОЧНЫЕ ВЕЗИКУЛЫ, ПРОДУЦИРУЕМЫЕ СТВОЛОВЫМИ КЛЕТКАМИ, И ИХ РЕГЕНЕРАТИВНЫЙ ПОТЕНЦИАЛ
Везикулы продуцируются различными типами стволовых клеток – эмбриональными стволовыми клетками (ЭСК), индуцированными плюрипотентными стволовыми клетками (ИПСК), МСК, нейральными, кроветворными и другими стволовыми клетками. Они во многом сходны по фенотипу с образующими их клетками и в экспериментах на животных демонстрируют высокий терапевтический потенциал [62], что позволяет надеяться на их успешное применение в регенеративной медицине.
Внеклеточные везикулы от плюрипотентных стволовых клеток. Плюрипотентные стволовые клетки могут быть выделены из внутренней клеточной массы зародышей (ЭСК) или получены из соматических клеток путем генетического репрограммирования (ИПСК). Полагают, что внеклеточные везикулы играют важную роль во взаимодействии клеток внутренней клеточной массы бластоцисты и трофобласта и в имплантации эмбриона [63]. Плюрипотентные стволовые клетки выделяют большое количество внеклеточных везикул, в том числе содержащих молекулы, участвующие в самоподдержании клеток [64]. Особенностью экзосом из ЭСК является содержание в них большого количества различных мРНК и микроРНК. По некоторым данным экзосомы из ЭСК несут не менее 169 микроРНК, которых нет в экзосомах, полученных от эмбриональных фибробластов мыши – MEF. Кроме того, в составе экзосом из ЭСК присутствуют микроРНК, уровень экспрессии которых более чем в 104 раз превышает экспрессию аналогичных микроРНК в клетках MEF. В основном к ним относятся микроРНК семейства 290, экспрессия которых характерна и для ЭСК в целом. При обработке клеток-предшествеников сердечной мышцы этими микроРНК наблюдается увеличение числа клеток в S-фазе, как и при действии экзосом от ЭСК [65]. О микровезикулах от ЭСК известно, что по качественному составу они сходны с клетками, их продуцирующими, а при трансфекции ЭСК геном зеленого флуоресцентного белка (GFP) способны передавать GFP клеткам-реципиентам [66]. В этой связи возникает вопрос: могут ли везикулы от плюрипотентных клеток эпигенетически влиять на соматические клетки, перенося белки, микроРНК и мРНК, и перепрограммировать их? В пользу такой возможности свидетельствуют данные об изменениях в морфологии Мюллеровых клеток человека при добавлении в культуральную среду микровезикул от ЭСК мыши. Показано, что появление морфологического разнообразия в культуре этих клеток стало следствием изменения экспрессии таких генов, как Oct4, Pax6 и Rax. При этом в Мюллеровых клетках не только наблюдалась экспрессия принесенных везикулами РНК, но и под их воздействием изменялась экспрессия собственных генов. Обработка микровезикулами из ЭСК усиливала экспрессию 801 гена и снижала экспрессию 1093, при этом более 60% изменений в экспрессии наблюдали уже после 8-часовой обработки. Среди генов с усиленной экспрессией были гены плюрипотентности Oct4, Lin28, Klf4 и LIF, ранние гены клеток сетчатки (Bmp7, OLIG2, FoxN4, Dll1, Рах6), гены IL-6 и CSF2, индукторы регенерации сетчатки (Fgf2, Igf2, GDNF), гены, продукты которых участвуют в модификации внеклеточного матрикса (например, MMP3). В то же время экспрессия генов, стимулирующих дифференцировку, – Dnmt3a и GATA4 – была подавлена [67]. Сообщалось также, что микровезикулы от ЭСК способствуют повышению пролиферативного потенциала кроветворных родоначальных клеток мыши. При этом в клетках-мишенях усиливается экспрессия основных генов, участвующих в поддержании плюрипотентности, таких как Oct4, Sox2 и Nanog [64].
Схожими свойствами обладают микровезикулы, полученные от ИПСК. Они содержат мРНК факторов транскрипции, ассоциированных с плюрипотентностью (Oct4, Sox2, Nanog), а при инкубации с МСК, выделенными из сердца, активируют в них внутриклеточные сигнальные пути, стимулируя выживание и пролиферацию клеток и усиливая их способность к регенерации за счет горизонтального переноса генетической информации от ИПСК к МСК [68]. В экспериментах на животных показано, что внутрисердечное введение экзосом от ЭСК повышает выживаемость кардиомиоцитов, уменьшает фиброз и улучшает функционирование сердца при инфаркте миокарда [65]. Таким образом, есть основания предполагать, что внеклеточные везикулы от плюрипотентных клеток могут стать терапевтическими агентами, осуществляющими передачу белков и РНК и стимуляцию клеток-предшественников различных тканей при регенерации, хотя этот вопрос требует дальнейшего изучения.
Внеклеточные везикулы от мезенхимных стромальных клеток. Одним из наиболее перспективных для регенеративной медицины источников внеклеточных везикул являются МСК, которые распространены практически повсеместно – в костном мозге, жировой ткани, мышцах, костях, пуповинной крови и т.д. По данным многочисленных исследований МСК секретируют широкий спектр факторов роста, хемокинов и цитокинов, влияющих на окружающие клетки, и представляют собой один из самых продуктивных по образованию внеклеточных везикул тип стволовых и родоначальных клеток [69]. В экзосомах и микровезикулах, полученных от МСК, обнаружено около 700 различных белков, более 200 мРНК и множество микроРНК. Содержащиеся в них белки и нуклеиновые кислоты разнообразны по своим функциям: они участвуют в воспалении, клеточной адгезии, регуляции клеточного цикла, морфогенезе, репарации тканей и обмене веществ [69–71]. Сейчас появляется множество работ, направленных на изучение возможного применения везикул от МСК в восстановлении различных тканей. В частности, на различных модельных системах показано, что экзосомы и микровезикулы, полученные от МСК, могут способствовать регенерации почек при остром повреждении, обладают кардиопротекторными свойствами, демонстрируют выраженный терапевтический эффект при повреждении легких эндотоксином, стимулируют заживление кожных ран и костно-хрящевых дефектов, способствуют восстановлению скелетных мышц при ишемии конечностей, оказывают иммуномодулирующее действие (в частности, стимулируют образование регуляторных T-лимфоцитов и улучшают приживление аллогенных трансплантатов кожи), снижают эффекты радиационного поражения у облученных мышей [72–79]. Внеклеточные везикулы, продуцируемые МСК, усиливают ангиогенез и пролиферацию клеток в поврежденных органах, снижают клеточную гибель, уменьшают фиброз, способствуя полноценной регенерации ткани. Например, при введении животным с поврежденной печенью экзосом от МСК наблюдали значительное улучшение биохимических показателей крови, свидетельствующих о нормальном функционировании органа, уменьшение отложения коллагенов типа I и III и площади фиброза, повышение экспрессии различных транскрипционных факторов и усиление пролиферации гепатоцитов [80, 81]. При этом различные популяции внеклеточных везикул могут оказывать неодинаковое влияние на поврежденную ткань. Так, на модели ишемического повреждения почечного эпителия in vitro фракция внеклеточных везикул от МСК, обогащенная экзосомами, наиболее эффективно предотвращала апоптоз [82]. В экспериментах на мышах с индуцированной легочной гипертензией свою терапевтическую эффективность также показали экзосомы, но не микровезикулы, полученные от МСК [83].
Внеклеточные везикулы от тканеспецифических стволовых и родоначальных клеток. Везикулы, продуцируемые другими типами стволовых и родоначальных клеток, изучены слабее, чем везикулы от МСК, однако имеющиеся экспериментальные данные позволяют предполагать, что в перспективе они тоже могут быть использованы в качестве ресурса для восстановления тканей. Нейральные стволовые и родоначальные клетки, дифференцирующиеся во все типы клеток центральной нервной системы, выделяют экзосомы, содержащие более 100 различных типов белков, среди которых VEGF, интерферон-γ, белки теплового шока, коннексин 43 и другие [84, 85]. В настоящее время изучается роль внеклеточных везикул в нормальном функционировании нервной системы и развитии нервно-дегенеративных заболеваний [62, 85]. Микровезикулы, полученные от кроветворных родоначальных клеток, содержат мРНК нескольких антиапоптотических и проангиогенных факторов и стимулируют ангиогенез in vitro [86]. Микровезикулы от эндотелиальных предшественников содержат большое количество микроРНК miR-126 и miR-296, обладающих проангиогенным и антиапоптоточеским действием, благодаря чему защищают почки от острого повреждения в модели ишемии-реперфузии [87] и усиливают васкуляризацию ишемизированной конечности [88]. Экзосомы, продуцируемые сердечными клетками-предшественниками, культивируемыми в условиях гипоксии, способствуют выживанию кардиомиобластов при окислительном стрессе и улучшают функции сердца, одновременно уменьшая площадь фиброза в модели инфаркта миокарда [62, 89]. Показана способность микровезикул, полученных от стволовых клеток печени, индуцировать пролиферацию и подавлять апоптоз гепатоцитов in vitro, а также стимулировать регенерацию печени после частичной гепатэктомии [90].
ЗАКЛЮЧЕНИЕ
Таким образом, внеклеточные везикулы, которые могут быть получены из различных типов стволовых клеток, способны оказывать влияние на другие клеточные популяции и в экспериментах на животных вызывают многообещающие терапевтические эффекты (см. рис. 2). Тем не менее для успешного использования экзосом и микровезикул в клинической практике необходимо детальное исследование механизма их действия. Такое исследование затруднено сложным химическим составом везикул, которые содержат множество белков, липидов и нуклеиновых кислот, способных оказывать разнонаправленное влияние на клетки. Кроме того, к настоящему моменту накоплено недостаточно знаний о различных фракциях везикул, получаемых от одних и тех же клеток. Сравнительный анализ свойств этих фракций даст важную информацию, которая будет способствовать повышению эффективности применения везикул в терапии. Безопасное и эффективное клиническое использование внеклеточных везикул требует также преодоления ряда технических сложностей, связанных с их получением. Во-первых, необходима разработка универсальных и легко воспроизводимых протоколов выделения везикул, обеспечивающих их высокий выход при минимальной загрязненности примесями, а также совершенствование способов хранения. Во-вторых, несмотря на относительную безопасность при введении внеклеточных везикул по сравнению с введением стволовых клеток, необходимо внимательно относиться к условиям культивирования клеток, образующих эти везикулы, в частности, к присутствию в среде компонентов животного происхождения. Например, есть данные, что микровезикулы способны включать в свой состав белки от клеток мыши, применяемых в качестве фидерного слоя при культивировании человеческих ЭСК, и белки из среды. Такие микровезикулы могут оказаться иммуногенными [91]. Помимо этих проблем, до решения которых клинические испытания внеклеточных везикул могут подвергать пациентов серьезному риску, остаются и другие неясные вопросы. В частности, как клетка формирует состав внеклеточных везикул? Каким образом определяется путь секреции для тех или иных белков и нуклеиновых кислот? Каков конкретный механизм действия везикул в различных случаях? Изучение механизмов биогенеза и высвобождения внеклеточных везикул, а также их влияния на клетки-мишени является важной общебиологической задачей и создает теоретическую основу их применения для регенерации тканей, а совершенствование методов воздействия на состав везикул открывает широкие перспективы для их использования в клинической практике.
Обзор подготовлен в рамках Программы Президиума РАН № 41 “Фундаментальные исследования для разработки медицинских технологий”, раздел Государственного задания № 0108-2018-0013.
Список литературы
Tibbetts M.D., Samuel M.A., Chang T.S., Ho A.C. 2012. Stem cell therapy for retinal disease. Curr. Opin. Ophthalmol. 23 (3), 226–234.
Martínez-Morales P.L., Revilla A., Ocana I., González C., Sainz P., McGuire D., Liste I. 2013. Progress in stem cell therapy for major human neurological disorders. Stem Cell Rev. 9 (5), 685–699.
Sanganalmath S.K., Bolli R. 2013. Cell therapy for heart failure: a comprehensive overview of experimental and clinical studies, current challenges, and future directions. Circ. Res. 113 (6), 810–834.
Angelos M.G., Kaufman D.S. 2015. Pluripotent stem cell applications for regenerative medicine. Curr. Opin. Organ Transplant. 20 (6), 663–670.
Tolar J., Nauta A.J., Osborn M.J., Panoskaltsis Mortari A., McElmurry R.T., Bell S., Xia L., Zhou N., Riddle M., Schroeder T.M., Westendorf J.J., McIvor R.S., Hogendoorn P.C., Szuhai K., Oseth L., Hirsch B., Yant S.R., Kay M.A., Peister A., Prockop D.J., Fibbe W.E., Blazar B.R. 2007. Sarcoma derived from cultured mesenchymal stem cells. Stem Cells. 25 (2), 371–379.
Tang D.Q., Wang Q., Burkhardt B.R., Litherland S.A., Atkinson M.A., Yang L.J. 2012. In vitro generation of functional insulin-producing cells from human bone marrow-derived stem cells, but long-term culture running risk of malignant transformation. Am. J. Stem Cells. 1 (2), 114–127.
de Almeida P.E., Ransohoff J.D., Nahid A., Wu J.C. 2013. Immunogenicity of pluripotent stem cells and their derivatives. Circ. Res. 112 (3), 549–561.
Zhu K., Wu Q., Ni C., Zhang P., Zhong Z., Wu Y., Wang Y., Xu Y., Kong M., Cheng H., Tao Z., Yang Q., Liang H., Jiang Y., Li Q., Zhao J., Huang J., Zhang F., Chen Q., Li Y., Chen J., Zhu W., Yu H., Zhang J., Yang H.T., Hu X., Wang J. 2018. Lack of remuscularization following transplantation of human embryonic stem cell-derived cardiovascular progenitor cells in infarcted nonhuman primates. Circ. Res. doi 10.1161/ CIRCRESAHA.117.311578
Tran C., Damaser M.S. 2015. Stem cells as drug delivery methods: Application of stem cell secretome for regeneration. Adv. Drug Deliv. Rev. 82–83, 1–11.
van der Pol E., Boing A.N., Harrison P., Sturk A., Nieuwland R. 2012. Classification, functions, and clinical relevance of extracellular vesicles. Pharmacol. Rev. 64 (3), 676–705.
Johnstone R.M., Adam M., Hammond J.R., Orr L., Turbide C. 1987. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). J. Biol. Chem. 262 (19), 9412–9420.
Théry C., Ostrowski M., Segura E. 2009. Membrane vesicles as conveyors of immune responses. Nat. Rev. Immunol. 9 (8), 581–593.
Gould S.J., Raposo G. 2013. As we wait: coping with an imperfect nomenclature for extracellular vesicles. J. Extracell. Vesicles. 2. doi 10.3402/jev.v2i0.20389
Yáñez-Mó M., Siljander P.R., Andreu Z., Zavec A.B., Borràs F.E., Buzas E.I., Buzas K., Casal E., Cappello F., Carvalho J., Colás E., Cordeiro-da Silva A., Fais S., Falcon-Perez J.M., Ghobrial I.M., Giebel B., Gimona M., Graner M., Gursel I., Gursel M., Heegaard N.H., Hendrix A., Kierulf P., Kokubun K., Kosanovic M., Kralj-Iglic V., Krämer-Albers E.M., Laitinen S., Lässer C., Lener T., Ligeti E., Linē A., Lipps G., Llorente A., Lötvall J., Manček-Keber M., Marcilla A., Mittelbrunn M., Nazarenko I., Nolte-’t Hoen E.N., Nyman T.A., O’Driscoll L., Olivan M., Oliveira C., Pállinger É., Del Portillo H.A., Reventós J., Rigau M., Rohde E., Sammar M., Sánchez-Madrid F., Santarém N., Schallmoser K., Ostenfeld M.S., Stoorvogel W., Stukelj R., Van der Grein S.G., Vasconcelos M.H., Wauben M.H., De Wever O. 2015. Biological properties of extracellular vesicles and their physiological functions. J. Extracell. Vesicles. 4. doi 10.3402/jev.v4.27066
van Niel G., D’Angelo G., Raposo G. 2018. Shedding light on the cell biology of extracellular vesicles. Nat. Rev. Mol. Cell Biol. 19 (4), 213–228.
Harding C., Heuser J., Stahl P. 1983. Receptor-mediated endocytosis of transferrin and recycling of the transferrin receptor in rat reticulocytes. J. Cell Biol. 97 (2), 329–339.
Akers J.C., Gonda D., Kim R., Carter B.S., Chen C.C. 2013. Biogenesis of extracellular vesicles (EV): Exosomes, microvesicles, retrovirus-like vesicles, and apoptotic bodies. J. Neurooncol. 113 (1), 1–11.
Muralidharan-Chari V., Clancy J., Plou C., Romao M., Chavrier P., Raposo G., D’Souza-Schorey C. 2009. ARF6-regulated shedding of tumor cell-derived plasma membrane microvesicles. Curr. Biol. 19 (22), 1875–1885.
Чевкина Е.М., Щербаков А.М., Журавская А.Ю., Семина С.Е., Комельков А.В., Красильников М.А. Экзосомы и передача (эпи)генетической информации опухолевыми клетками. 2015. Усп. молек. онкологии. 2 (3), 8–20.
Тамкович С.Н., Тутанов О.С., Лактионов П.П. 2016. Экзосомы: механизмы возникновения, состав, транспорт, биологическая активность, использование в диагностике. Биол. мембраны. 33 (3), 163–175.
Frydrychowicz M., Kolecka-Bednarczyk A., Madejczyk M., Yasar S., Dworacki G. 2015. Exosomes – structure, biogenesis and biological role in non-small-cell lung cancer. Scand. J. Immunol. 81 (1), 2–10.
Colombo M., Moita C., van Niel G., Kowal J., Vigneron J., Benaroch P., Manel N., Moita L.F., Théry C., Raposo G. 2013. Analysis of ESCRT functions in exosome biogenesis, composition and secretion highlights the heterogeneity of extracellular vesicles. J. Cell. Sci. 126 (Pt 24), 5553–5565.
Colombo M., Raposo G., Thery C. 2014. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annu. Rev. Cell Dev. Biol. 30, 255–289.
Carayon K., Chaoui K., Ronzier E. 2011. Proteolipidic composition of exosomes changes during reticulocyte maturation. J. Biol. Chem. 286 (39), 34 426–3439.
Kalra H., Drummen G.P., Mathivanan S. 2016. Focus on extracellular vesicles: introducing the next small big thing. Int. J. Mol. Sci. 17 (2), 170.
Subra C., Laulagnier K., Perret B., Record M. 2007. Exosome lipidomics unravels lipid sorting at the level of multivesicular bodies. Biochimie. 89 (2), 205–212.
Iraci N., Leonardi T., Gessler F., Vega B., Pluchino S. 2016. Focus on extracellular vesicles: physiological role and signalling properties of extracellular membrane vesicles. Int. J. Mol. Sci. 17 (2), 171.
Luga V., Zhang L., Viloria-Petit A.M., Ogunjimi A.A., Inanlou M.R., Chiu E., Buchanan M., Hosein A.N., Basik M., Wrana J.L. 2012. Exosomes mediate stromal mobilization of autocrine Wnt-PCP signaling in breast cancer cell migration. Cell. 151 (7), 1542–1556.
Andreu Z., Yanez-Mo M. 2014. Tetraspanins in extracellular vesicle formation and function. Front. Immunol. 5, 442.
Simpson R.J., Jensen S.S., Lim J.W. 2008. Proteomic profiling of exosomes: current perspectives. Proteomics. 8 (19), 4083–4099.
Tauro B.J., Greening D.W., Mathias R.A. 2013. Two distinct populations of exosomes are released from LIM1863 colon carcinoma cell-derived organoids. Mol. Cell Proteomics. 12 (3), 587–598.
Keerthikumar S., Gangoda L., Liem M., Fonseka P., Atukorala I., Ozcitti C., Mechler A., Adda C.G., Ang C.S., Mathivanan S. 2015. Proteogenomic analysis reveals exosomes are more oncogenic than ectosomes. Oncotarget. 6 (17), 15375–15396.
Ahadi A., Khoury S., Losseva M. 2016. A comparative analysis of lncRNAs in prostate cancer exosomes and their parental cell line. Genom Data. 9, 7–9.
Kuwabara Y., Ono K., Horie T., Nishi H., Nagao K., Kinoshita M., Watanabe S., Baba O., Kojima Y., Shizuta S., Imai M., Tamura T., Kita T., Kimura T. 2011. Increased microRNA-1 and microRNA-133a levels in serum of patients with cardiovascular disease indicate myocardial damage. Circ. Cardiovasc. Genet. 4 (4), 446–454.
Gheytanchi E., Madjd Z., Janani L., Rasti A., Ghods R., Atyabi F., Asadi-Lari M.H., Babashah S. 2017. Exosomal microRNAs as potential circulating biomarkers in gastrointestinal tract cancers: a systematic review protocol. Syst. Rev. 6 (1), 228.
Goto T., Fujiya M., Konishi H., Sasajima J., Fujibayashi S., Hayashi A., Utsumi T., Sato H., Iwama T., Ijiri M., Sakatani A., Tanaka K., Nomura Y., Ueno N., Kashima S., Moriichi K., Mizukami Y., Kohgo Y., Okumura T. 2018. An elevated expression of serum exosomal microRNA-191, -21, -451a of pancreatic neoplasm is considered to be efficient diagnostic marker. BMC Cancer. 18 (1), 116.
Lunavat T.R., Cheng L., Kim D.K. 2015. Small RNA deep sequencing discriminates subsets of extracellular vesicles released by melanoma cells–Evidence of unique microRNA cargos. RNA Biol. 12 (8), 810–823.
Théry C., Amigorena S., Raposo G. 2006. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. In: Curr. Protoc. Cell Biol. Chapter 3, Unit 3.22.
Momen-Heravi F., Balaj L., Alian S., Mantel P.Y., Halleck A.E., Trachtenberg A.J., Soria C.E., Oquin S., Bonebreak C.M., Saracoglu E., Skog J., Kuo W.P. 2013. Current methods for the isolation of extracellular vesicles. Biol. Chem. 394 (10), 1253–1262.
Greening D.W., Xu R., Ji H., Tauro B.J., Simpson R.J. 2015. A protocol for exosome isolation and characterization: evaluation of ultracentrifugation, density-gradient separation, and immunoaffinity capture methods. Methods Mol. Biol. 1295, 179–209.
Korgel B.A., van Zanten J.H., Monbouquette H.G. 1998. Vesicle size distributions measured by flow field-flow fractionation coupled with multiangle light scattering. Biophys. J. 74 (6), 3264–3272.
Rekker K., Saare M., Roost A.M. 2014. Comparison of serum exosome isolation methods for microRNA profiling. Clin. Biochem. 47 (1–2), 135–138.
Gudbergsson J.M., Johnsen K.B., Skov M.N. 2016. Systematic review of factors influencing extracellular vesicle yield from cell cultures. Cytotechnology. 68 (4), 579–592.
Muntión S., Ramos T.L., Diez-Campelo M., Rosón B., Sánchez-Abarca L.I., Misiewicz-Krzeminska I., Preciado S., Sarasquete M.E., de Las Rivas J., González M., Sánchez-Guijo F., Del Cañizo M.C. 2016. Microvesicles from mesenchymal stromal cells are involved in HPC-microenvironment crosstalk in myelodysplastic patients. PLoS One. 11 (2), e0146722.
Штам Т.А., Бурдаков В.С., Ланда С.Б., Нарыжный С.Н., Байрамуков В.Ю., Малек А.В., Орлов Ю.Н., Филатов М.В. 2017. Агрегация лектинами как способ выделения экзосом из биологических жидкостей: апробация для протеомных исследований. Цитология. 59 (1), 5–12.
Wahlgren J., De L Karlson T., Brisslert M., Vaziri Sani F., Telemo E., Sunnerhagen P., Valadi H. 2012. Plasma exosomes can deliver exogenous short interfering RNA to monocytes and lymphocytes. Nucl. Acids Res. 40 (17), e130.
Lamichhane T.N., Raiker R.S., Jay S.M. 2015. Exogenous DNA loading into extracellular vesicles via electroporation is size-dependent and enables limited gene delivery. Mol. Pharm. 12 (10), 3650–3657.
Clayton A., Turkes A., Navabi H., Mason M.D., Tabi Z. 2005. Induction of heat shock proteins in B-cell exosomes. J. Cell. Sci. 118 (Pt 16), 3631–3638.
Lopatina T., Bruno S., Tetta C., Kalinina N., Porta M., Camussi G. 2014. Platelet-derived growth factor regulates the secretion of extracellular vesicles by adipose mesenchymal stem cells and enhances their angiogenic potential. Cell. Commun. Signal. 12, 26.
Ti D., Hao H., Tong C., Liu J., Dong L., Zheng J., Zhao Y., Liu H., Fu X., Han W. 2015. LPS-preconditioned mesenchymal stromal cells modify macrophage polarization for resolution of chronic inflammation via exosome-shuttled let-7b. J. Transl. Med. 13, 308.
Ma J., Zhao Y., Sun L., Sun X., Zhao X., Sun X., Qian H., Xu W., Zhu W. 2017. Exosomes derived from akt-modified human umbilical cord mesenchymal stem cells improve cardiac regeneration and promote angiogenesis via activating platelet-derived growth factor D. Stem Cells Transl. Med. 6 (1), 51–59.
Salomon C., Ryan J., Sobrevia L., Kobayashi M., Ashman K., Mitchell M., Rice G.E. 2013. Exosomal signaling during hypoxia mediates microvascular endothelial cell migration and vasculogenesis. PLoS One. 8 (7), e68451.
Alcayaga-Miranda F., Varas-Godoy M., Khoury M. 2016. Harnessing the angiogenic potential of stem cell-derived exosomes for vascular regeneration. Stem Cells Int. 2016, 3409169.
Xu S., Wang J., Ding N., Hu W., Zhang X., Wang B., Hua J., Wei W., Zhu Q. 2015. Exosome-mediated microRNA transfer plays a role in radiation-induced bystander effect. RNA Biol. 12 (12), 355–1363.
Eldh M., Ekström K., Valadi H., Sjöstrand M., Olsson B., Jernås M., Lötvall J. 2010. Exosomes communicate protective messages during oxidative stress; possible role of exosomal shuttle RNA. PLoS One. 5 (12), e15353.
Borges F.T., Melo S.A., Özdemir B.C., Kato N., Revuelta I., Miller C.A., Gattone V.H. 2nd, LeBleu V.S., Kalluri R. 2013. TGF-β1–containing exosomes from injured epithelial cells activate fibroblasts to initiate tissue regenerative responses and fibrosis. J. Am. Soc. Nephrol. 24 (3), 385–392.
Ekström E.J., Bergenfelz C., von Bülow V., Serifler F., Carlemalm E., Jönsson G., Andersson T., Leandersson K. 2014. WNT5A induces release of exosomes containing pro-angiogenic and immunosuppressive factors from malignant melanoma cells. Mol. Cancer. 13, 88.
de Jong O.G., Verhaar M.C., Chen Y., Vader P., Gremmels H., Posthuma G., Schiffelers R.M., Gucek M., van Balkom B.W. 2012. Cellular stress conditions are reflected in the protein and RNA content of endothelial cell-derived exosomes. J. Extracell. Vesicles. 1. doi 10.3402/jev.v1i0.18396
Li J., Liu K., Liu Y., Xu Y., Zhang F., Yang H., Liu J., Pan T., Chen J., Wu M., Zhou X., Yuan Z. 2013. Exosomes mediate the cell-to-cell transmission of IFN-α-induced antiviral activity. Nat. Immunol. 14 (8), 793–803.
Crisostomo P.R., Wang Y., Markel T.A., Wang M., Lahm T., Meldrum D.R. 2008. Human mesenchymal stem cells stimulated by TNF-alpha, LPS, or hypoxia produce growth factors by an NF kappa B- but not JNK-dependent mechanism. Am. J. Physiol. Cell Physiol. 294 (3), 675–682.
Yao Y., Zhang F., Wang L., Zhang G., Wang Z., Chen J., Gao X. 2009. Lipopolysaccharide preconditioning enhances the efficacy of mesenchymal stem cells transplantation in a rat model of acute myocardial infarction. J. Biomed. Sci. 16 (1), 74.
Han C., Sun X., Liu L., Jiang H., Shen Y., Xu X., Li J., Zhang G., Huang J., Lin Z., Xiong N., Wang T. 2016. Exosomes and their therapeutic potentials of stem cells. Stem Cells Int. 2016, 7653489.
Desrochers L.M., Bordeleau F., Reinhart-King C.A., Cerione R.A., Antonyak M.A. 2016. Microvesicles provide a mechanism for intercellular communication by embryonic stem cells during embryo implantation. Nat. Commun. 7, 11958.
Ratajczak J., Miekus K., Kucia M. 2006. Embryonic stem cell-derived microvesicles reprogram hematopoietic progenitors: evidence for horizontal transfer of mRNA and protein delivery. Leukemia. 20 (5), 847–856.
Khan M., Nickoloff E., Abramova T., Johnson J., Verma S.K., Krishnamurthy P., Mackie A.R., Vaughan E., Garikipati V.N., Benedict C., Ramirez V., Lambers E., Ito A., Gao E., Misener S., Luongo T., Elrod J., Qin G., Houser S.R., Koch W.J., Kishore R. 2015. Embryonic stem cell-derived exosomes promote endogenous repair mechanisms and enhance cardiac function following myocardial infarction. Circ. Res. 117 (1), 52–64.
Yuan A., Farber E.L., Rapoport A.L., Tejada D., Deniskin R., Akhmedov N.B., Farber D.B. 2009. Transfer of microRNAs by embryonic stem cell microvesicles. PLoS One. 4 (3), e4722.
Katsman D., Stackpole E.J., Domin D.R., Farber D.B. 2012. Embryonic stem cell-derived microvesicles induce gene expression changes in Müller cells of the retina. PLoS One. 7 (11), e50417.
Bobis-Wozowicz S., Kmiotek K., Sekula M., Kedracka-Krok S., Kamycka E., Adamiak M., Jankowska U., Madetko-Talowska A., Sarna M., Bik-Multanowski M., Kolcz J., Boruczkowski D., Madeja Z., Dawn B., Zuba-Surma E.K. 2015. Human induced pluripotent stem cell-derived microvesicles transmit RNAs and proteins to recipient mature heart cells modulating cell fate and behavior. Stem Cells. 33 (9), 2748–2761.
Lai R.C., Yeo R.W., Lim S.K. 2015. Mesenchymal stem cell exosomes. Semin. Cell Dev. Biol. 40, 82–88.
Kim H.S., Choi D.Y., Yun S.J., Choi S.M., Kang J.W., Jung J.W., Hwang D., Kim K.P., Kim D.W. 2012. Proteomic analysis of microvesicles derived from human mesenchymal stem cells. J. Proteome Res. 11 (2), 839–849.
Xie L., Mao M., Zhou L., Jiang B. 2016. Spheroid mesenchymal stem cells and mesenchymal stem cell-derived microvesicles: two potential therapeutic strategies. Stem Cells Dev. 25 (3), 203–213.
Zhou Y., Xu H., Xu W., Wang B., Wu H., Tao Y., Zhang B., Wang M., Mao F., Yan Y., Gao S., Gu H., Zhu W., Qian H. 2013. Exosomes released by human umbilical cord mesenchymal stem cells protect against cisplatin-induced renal oxidative stress and apoptosis in vivo and in vitro. Stem Cell Res. Ther. 4 (2), 34.
Bian S., Zhang L., Duan L. Wang X., Min Y., Yu H. 2014. Extracellular vesicles derived from human bone marrow mesenchymal stem cells promote angiogenesis in a rat myocardial infarction model. J. Mol. Med. (Berl). 92 (4), 387–397.
Zhang B., Yin Y., Lai R.C., Tan S.S., Choo A.B., Lim S.K. 2014. Mesenchymal stem cells secrete immunologically active exosomes. Stem Cells Dev. 23 (11), 1233–1244.
Zhu Y.G., Feng X.M., Abbott J. 2014. Human mesenchymal stem cell microvesicles for treatment of Escherichia coli endotoxin-induced acute lung injury in mice. Stem Cells. 32 (1), 116–125.
Akyurekli C., Le Y., Richardson R.B., Fergusson D., Tay J., Allan D.S. 2015. A systematic review of preclinical studies on the therapeutic potential of mesenchymal stromal cell-derived microvesicles. Stem Cell Rev. 11 (1), 150–160.
Zhang J., Guan J., Niu X., Hu G., Guo S., Li Q., Xie Z., Zhang C., Wang Y. 2015. Exosomes released from human induced pluripotent stem cells-derived MSCs facilitate cutaneous wound healing by promoting collagen synthesis and angiogenesis. J. Transl. Med. 13, 49.
Zhang S., Chu W.C., Lai R.C., Lim S.K., Hui J.H., Toh W.S. 2016. Exosomes derived from human embryonic mesenchymal stem cells promote osteochondral regeneration. Osteoarthritis Cartilage. 24 (12), 2135–2140.
Wen S., Dooner M., Cheng Y., Papa E., Del Tatto M., Pereira M., Deng Y., Goldberg L., Aliotta J., Chatterjee D., Stewart C., Carpanetto A., Collino F., Bruno S., Camussi G., Quesenberry P. 2016. Mesenchymal stromal cell-derived extracellular vesicles rescue radiation damage to murine marrow hematopoietic cells. Leukemia. 30 (11), 2221–2231.
Li T., Yan Y., Wang B., Qian H., Zhang X., Shen L., Wang M., Zhou Y., Zhu W., Li W., Xu W. 2012. Exosomes derived from human umbilical cord mesenchymal stem cells alleviate liver fibrosis. Stem Cells Dev. 22 (6), 845–854.
Tan C.Y., Lai R.C., Wong W., Dan Y.Y., Lim S.K., Ho H.K. 2014. Mesenchymal stem cell-derived exosomes promote hepatic regeneration in drug-induced liver injury models. Stem Cell Res. Ther. 5 (3), 76.
Collino F., Pomatto M., Bruno S., Lindoso R.S., Tapparo M., Sicheng W., Quesenberry P., Camussi G. 2017. Exosome and microvesicle-enriched fractions isolated from mesenchymal stem cells by gradient separation showed different molecular signatures and functions on renal tubular epithelial cells. Stem Cell Rev. 13 (2), 226–243.
Aliotta J.M., Pereira M., Wen S., Dooner M.S., Del Tatto M., Papa E., Goldberg L.R., Baird G.L., Ventetuolo C.E., Quesenberry P.J., Klinger J.R. 2016. Exosomes induce and reverse monocrotaline-induced pulmonary hypertension in mice. Cardiovasc. Res. 110 (3), 319–330.
Kang D., Oh S., Ahn S.M., Lee B.H., Moon M.H. 2008. Proteomic analysis of exosomes from human neural stem cells by flow field-flow fractionation and nanoflow liquid chromatography-tandem mass spectrometry. J. Proteome Res. 7 (8), 3475–3480.
Bátiz L.F., Castro M.A., Burgos P.V, Velásquez Z.D., Muñoz R.I., Lafourcade C.A., Troncoso-Escudero P., Wyneken U. 2015. Exosomes as novel regulators of adult neurogenic niches. Front. Cell Neurosci. 9, 501.
Ratajczak J., Kucia M., Mierzejewska K., Marlicz W., Pietrzkowski Z., Wojakowski W., Greco N.J., Tendera M., Ratajczak M.Z. 2013. Paracrine proangiopoietic effects of human umbilical cord blood-derived purified CD133+ cells–implications for stem cell therapies in regenerative medicine. Stem Cells Dev. 22 (3), 422–430.
Cantaluppi V., Gatti S., Medica D., Figliolini F., Bruno S., Deregibus M.C., Sordi A., Biancone L., Tetta C., Camussi G. 2012. Microvesicles derived from endothelial progenitor cells protect the kidney from ischemia-reperfusion injury by microRNA-dependent reprogramming of resident renal cells. Kidney Int. 82 (4), 412–427.
Ranghino A., Cantaluppi V., Grange C., Vitillo L., Fop F., Biancone L., Deregibus M.C., Tetta C., Segoloni G.P., Camussi G. 2012. Endothelial progenitor cell-derived microvesicles improve neovascularization in a murine model of hindlimb ischemia. Int. J. Immunopathol. Pharmacol. 25 (1), 75–85.
Chen L., Wang Y., Pan Y., Zhang L., Shen C., Qin G., Ashraf M., Weintraub N., Ma G., Tang Y. 2013. Cardiac progenitor-derived exosomes protect ischemic myocardium from acute ischemia/reperfusion injury. Biochem. Biophys. Res. Commun. 431 (3), 566–571.
Herrera M. B., Fonsato V., Gatti S., Deregibus M.C., Sordi A., Cantarella D., Calogero R., Bussolati B., Tetta C., Camussi G. 2010. Human liver stem cell-derived microvesicles accelerate hepatic regeneration in hepatectomized rats. J. Cell. Mol. Med. 14 (6), 1605–1618.
Kubikova I., Konecna H., Sedo O., Zdrahal Z., Rehulka P., Hribkova H., Rehulkova H., Hampl A., Chmelik J., Dvorak P. 2009. Proteomic profiling of human embryonic stem cell-derived microvesicles reveals a risk of transfer of proteins of bovine and mouse origin. Cytotherapy. 11 (3), 330–340.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


