Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 2, стр. 137-146
Изменение характера связи между компонентами белкового спектра мембраны эритроцитов у больных гипертонической болезнью
И. В. Аникиенко (Бабушкина) a, b, *, Ю. И. Пивоваров a, А. С. Сергеева a, Г. Б. Боровский c
a Иркутский научный центр хирургии и травматологии
664003 Иркутск, ул. Борцов Революции, 1, Россия
b Иркутский государственный аграрный университет имени А.А. Ежевского
664038 Иркутская обл., Иркутский р-н, пос. Молодежный, Россия
c Сибирский институт физиологии и биохимии растений СО РАН
664033 Иркутск, ул. Лермонтова, 132, а/я 317, Россия
* E-mail: babushcinai@mail.ru
Поступила в редакцию 07.11.2018
После доработки 07.11.2018
Принята к публикации 25.11.2018
Аннотация
Изучены особенности изменения содержания периферических и интегральных белков мембраны эритроцитов и характер множественной связи между исследованными белками у больных артериальной гипертензией. Определен спектр мембранных белков эритроцитов у больных эссенциальной артериальной гипертензией I–II степени (n = 51) и у клинически здоровых мужчин (n = 29). Уровни α-спектрина, β-спектрина и анион-транспортного белка у пациентов с артериальной гипертензией были статистически значимо ниже, а уровни белков полосы 4.1, глицеральдегид-3-фосфат-дегидрогеназы и глутатион-S-трансферазы выше, чем в контрольной группе. Анализ канонической корреляции между двумя множествами белков: анкирином, анион-транспортным белком, белком полосы 4.1, глицеральдегид-3-фосфат-дегидрогеназой, глутатион-S-трансферазой, с одной стороны, и α-спектрином, β-спектрином, транспортером глюкозы, актином, тропомиозином, с другой, позволил выявить определенную взаимосвязь между ними как у лиц контрольной группы, так и у больных артериальной гипертензией. При этом наибольший вклад в каноническую корреляцию у здоровых лиц вносили анион-транспортный белок и актин, а также глицеральдегид-3-фосфат-дегидрогеназа и тропомиозин, тогда как у пациентов с артериальной гипертензией наибольший вклад вносили анион-транспортный белок и транспортер глюкозы. Полученные данные свидетельствуют о структурно-функциональной перестройке мембраны эритроцитов при артериальной гипертензии, сопровождающейся также увеличением пула сфероцитарных клеток. С использованием регрессионного анализа только у пациентов с артериальной гипертензией выявлена связь между показателем сфероцитарности и белками мембраны эритроцитов (β-спектрином, тропомиозином, глицеральдегид-3-фосфат-дегидрогеназой, анион-транспортным белком).
ВВЕДЕНИЕ
Функции эритроцитов не исчерпываются их способностью переносить кислород из легких к тканям, эти клетки участвуют в тромбообразовании, регуляции кислотно-основного баланса, в иммунных реакциях, в связывании и переносе разнообразных веществ. Красные клетки крови вовлечены в патологические процессы при болезнях разного генеза, при этом наблюдаются серьезные изменения их структуры и функции [1, 2]. Мембрана эритроцитов, с одной стороны, достаточно стабильна, что позволяет красным клеткам крови сохранять свою целостность в условиях высокого давления и турбулентных токов в крупных сосудах, а с другой, способна обратимо менять свой размер в сосудах микроциркуляторного русла. Эти свойства эритроцитов зависят от взаимодействия белков в мембране. Регуляция связей между белками мембраны осуществляется за счет разных механизмов, в том числе путем фосфорилирования/дефосфорилирования, при этом основными мишенями считаются белки полос 3, 4.1, 4.9, спектрин, анкирин и аддуцин [3].
Опубликованные данные подтверждают мнение о том, что фосфорилирование/дефосфорилирование белков мембраны и цитоскелета эритроцитов способствует изменению пластичности и стабильности мембраны, и это отражается на микрореологическом поведении клеток в целом [4, 5]. В частности, гликилирование мембранных белков эритроцитов (подтвержденное высоким уровнем гликилированного гемоглобина) при метаболическом синдроме связано с увеличением количества деформированных эритроцитов, а также сопровождается появлением эритроцитарно-тромбоцитарных агрегатов [6]. Изучение изменений основных структурных мембранных белков показало, что при гипертонической болезни (артериальной гипертензии) независимо от тяжести заболевания снижаются уровни анкирина и спектрина [7].
Нами исследованы особенности изменения содержания периферических и интегральных белков мембраны эритроцитов и характер множественной связи между изученными белками у больных артериальной гипертензией.
МАТЕРИАЛЫ И МЕТОДЫ
В исследовании принимали участие больные эссенциальной артериальной гипертензией (АГ) I–II степени (n = 51) мужчины, средний возраст которых составил 42 ± 1.5 лет, и клинически здоровые доноры (n = 29), средний возраст которых составил 36 ± 1.6 лет.
Диагноз АГ устанавливали по данным анамнеза и клинико-инструментального обследования. Дифференциальную диагностику для исключения симптоматической АГ проводили в соответствии с рекомендациями Всероссийского научного общества кардиологов (ВНОК, 2004, 2008).
Критериями исключения было наличие хронической сердечной недостаточности выше III–IV стадии по классификации Нью-Йоркской кардиологической ассоциации (NYHA), острый инфаркт миокарда или нарушение мозгового кровообращения в предшествующие 6 месяцев, нарушения ритма сердца, обострение интеркуррентных заболеваний. У больных АГ особое внимание обращали на отсутствие приступов стенокардии напряжения, хронические заболевания почек, печени и легких.
Оценивали получаемую больными АГ медикаментозную терапию и при необходимости проводили ее коррекцию с соответствующими рекомендациями. На момент включения в исследование пациенты не получали гипохолестеринемической терапии.
Все пациенты были ознакомлены с целями и протоколами исследования. Письменное соглашение было обязательным критерием включения в исследование.
Показатель сферичности эритроцитов (ПСЭ) определяли по общепринятой формуле:
где D – средний диаметр эритроцитов (7.35 мкм), Т – средняя толщина эритроцитов, V – средний объем эритроцитов и S – средняя площадь основания эритроцитов. Диаметр эритроцитов (D) определяли как полусумму максимальной длины и ширины эритроцитов, измеренных с помощью гематологического анализатора XT-4000i (Sysmex, Япония). Толщину эритроцита (Т) определяли, деля его объем на площадь основания (S), измеренные с использованием программы гематологического анализатора (T = MCV/S).В норме ПСЭ составляет 3.4–3.9. Показатель ниже 3.4 означал наличие пула сфероцитарных, шаровидных клеток, выше 3.9 – развитие планоцитоза или приближение формы эритроцитов к плоскому диску.
Кровь для исследования набирали в пробирку с гепарином. Затем осаждали эритроцитарную массу, отмывая ее 3 раза от сыворотки. Для получения препаратов мембран эритроциты разрушали осмотическим шоком по методу Dodge [8]. Гемолиз эритроцитов и отмывку “теней” проводили 3 раза в 10 мМ Na-фосфатном буфере (рН 7.4). По окончании гемолиза “тени” эритроцитов осаждали центрифугированием при 20 000g. Конечный осадок мембран ресуспендировали в изотоническом 155 мМ растворе NaCl в соотношении 1 : 1 и хранили при температуре не выше 4°С.
Все операции по выделению и очистке водорастворимой фракции белков проводили на центрифугах Allegratm 64R (Beckman Coulter, Англия) с охлаждением (–5°С). Замороженные в жидком азоте мембраны гомогенизировали с добавлением фенилметилсульфонилфторида (PMSF) в 0.1 М Трис-HCl-буфере с 0.1% додецилсульфатом натрия (SDS) (pH 7.6). Полученный экстракт центрифугировали при 17 000g. Суммарный белок осаждали четырехкратным объемом ацетона, промывали двукратным объемом охлажденного ацетона и растворяли в 0.5 М Tрис-HCl-буфере pH 6.8, содержащем 1 мМ этилендиаминтетраацетат натрия (EDТА), 0.001% бромфеноловый синий, 2.3% SDS (Sigma, США), 20% глицерин, 0.1 М 2-меркаптоэтанол (Merck, Германия). Концентрацию белка определяли с использованием набора Qubit Protein Assay Kit (Invitrogen, США) на приборе Qubit согласно инструкции фирмы-изготовителя.
Электрофорез проводили по методу Лэммли [9] в полиакриламидном геле (ПААГ) с концентрацией разделяющего геля 7.5 и 15% в присутствии SDS с использованием аппаратуры и реактивов фирмы Bio-Rad. Использовали Трис-глициновый буфер рН 8.3 (0.025 М Трис и 0.192 М глицин). На дорожки наносили по 10 мкг суммарного белка. Гели окрашивали раствором Кумасси R-250 (Sigma, США). Молекулярную массу белков определяли с использованием набора маркеров фирмы Bio-Rad (#161-0363).
В результате анализа 255 электрофореграмм (7.5 и 15% ПААГ) оценили содержание (мкг/мг общего белка) 10 мембранных белков эритроцитов: α-спектрина, β-спектрина, анкирина, анион-транспортного белка (АТБ), белков полосы 4.1, транспортера глюкозы, актина, глицеральдегид-3-фосфат-дегидрогеназы (Г-3-ФДГ), тропомиозина и глутатион-S-трансферазы.
Содержание белков в каждой полосе определяли по интенсивности окраски Кумасси R-250, с использованием компьютерной программы [10, 11].
Статистическую обработку проводили с помощью пакета программ “Statistica 6.0”. Осуществляли проверку на нормальность распределения каждой переменной. В зависимости от характера распределения данные в сравниваемых группах анализировали либо с помощью t-теста, либо непараметрического U-критерия Манна–Уитни. Различия считали статистически значимыми при р < 0.05. Кроме того, характер взаимосвязей переменных исследовали с использованием многомерных методов дискриминантного, канонического и регрессионного анализа.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ средних данных, полученных у больных АГ и здоровых лиц, выявил существенное различие в количестве ряда мембранных белков эритроцитов (табл. 1). Так, у больных АГ уровни α-спектрина, β-спектрина и АТБ были значимо ниже, чем в контрольной группе. В тоже время уровни белков полосы 4.1, Г-3-ФДГ и глутатион -S-трансферазы в мембране больных АГ были выше. Изменение количества белковых компонентов мембраны красных кровяных клеток может играть важную роль в патогенезе АГ. Известно, что наследственные мутации, связанные с изменением структуры спектринов и АТБ и вызывающие дефицит этих белков, могут приводить к появлению патологических форм эритроцитов [12, 13]. По-видимому, у больных АГ низкий уровень спектринов и АТБ может носить приобретенный характер и приводить к выходу в кровоток измененных эритроцитов. Относительное увеличение количества мембранных белков Г-3-ФДГ и глутатион-S-трансферазы эритроцитов связано, вероятно, с компенсаторными реакциями в ответ на системную гипоксию. C одной стороны, происходит усиление гликолитических процессов в клетке и активация антиоксидантной защиты, а с другой, повышение уровня белков полосы 4.1 приводит к ускорению полимеризации актина [14].
Таблица 1.
Количество белков в мембране эритроцитов (мкг/мг общего белка) у лиц контрольной группы и больных артериальной гипертензией
| Мембранные белки эритроцитов | Контрольная группа, n = 29 | Больные АГ, n = 51 | p |
|---|---|---|---|
| α-Спектрин (1) | 89.3 (73.6–120.8) | 75.0 (40.6–106.8) | pU = 0.009 |
| β-Спектрин (2) | 98.3 ± 5.9 | 74.3 ± 5.69 | pt = 0.007 |
| Анкирин (2.1) | 40.1 (32.9-60.2) | 41.1 (20.0–55.9) | pU > 0.05 |
| АТБ (3) | 120.4 (115.9–131.3) | 79.9 (64.4–104.5) | pU = 0.0000 |
| Полоса 4.1 | 46.2 ± 1.71 | 75.9 ± 3.36 | pt = 0.0000 |
| Транспортер глюкозы (4.5) | 72.2 ± 3.89 | 68.1 ± 3.32 | pt > 0.05 |
| Актин (5) | 69.9 (59.6–105.6) | 76.9 (65.6–109.0) | pU > 0.05 |
| Г-3-ФДГ (6) | 33.7 ± 2.2 | 53.1 ± 3.06 | pt = 0.0000 |
| Тропомиозин (7) | 72.1 (52.2–107.6) | 87.0 (58.4–105.3) | pU > 0.05 |
| Глутатион-S-трансфераза (8) | 38.8 (32.4–46.2) | 67.9 (52.9–81.6) | pU = 0.0000 |
Для определения белков, оказывающих максимальное влияние на структурно-функциональное состояние мембраны эритроцитов обеих групп, был использован дискриминантный анализ. Выяснилось, что такими белками были: анкирин (белок полосы 2.1), АТБ (белок полосы 3), белки полосы 4.1, Г-3-ФДГ (белок полосы 6) и глутатион-S-трансфераза (белок полосы 8) (табл. 2), а каноническое уравнение для исследуемых групп имело следующий вид:
(3)
$\begin{gathered} {\text{K}} = - 2.05 + 0.02{\text{Б П }}\,{\text{2}}{\text{.1}} + {\text{0}}{\text{.087Б П }}\,{\text{3}} - \\ - \,\,{\text{0}}{\text{.076Б П }}\,{\text{4}}{\text{.1}} - {\text{0}}{\text{.035}}\,{\text{Б П 6}} - {\text{0}}{\text{.019}}\,{\text{Б П 8,}} \\ \end{gathered} $Таблица 2.
Анализ дискриминантной функции белков мембраны эритроцитов у лиц контрольной группы и больных артериальной гипертензией
| Общие показатели дискриминантной функции | Собственное значение |
R каноническое |
Общая лямбда |
χ2 критерий |
p |
|---|---|---|---|---|---|
| 12.8 | 0.96 | 0.07 | 198 | 0.0000 | |
| Переменные, включенные в модель | Частная лямбда | F | p | Стандартизованные коэффициенты |
|
| Анкирин | 0.80 | 18.9 | 0.0000 | 0.547 | |
| АТБ | 0.13 | 492.7 | 0.0000 | 2.306 | |
| Полоса 4.1 | 0.56 | 59.1 | 0.0000 | –1.525 | |
| Г-3-ФДГ | 0.90 | 8.4 | 0.049 | –0.653 | |
| Глутатион-S-трансфераза | 0.92 | 6.1 | 0.016 | –0.472 | |
На рис. 1 видно, что концентрации вышеперечисленных белков являются параметрами, разделяющими группы здоровых лиц и больных в 100% случаев (D 2 = 55.5, p = 0.0000). При этом АТБ обеспечивал наибольший дискриминантный эффект – стандартизированный коэффициент = 2.306 (см. табл. 2). Важно отметить, что уровень спектринов в целом не влиял существенно на дискриминацию исследуемых групп.
Рис. 1.
Диаграмма распределения лиц контрольной группы и больных артериальной гипертензией по данным дискриминантной функции мембранных белков эритроцитов и канонического анализа.
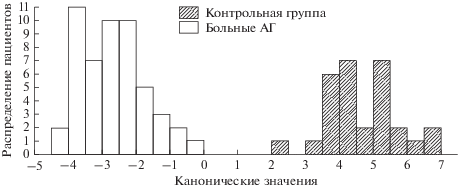
Для нахождения меры корреляционной связи между белками, которые участвовали в дискриминации групп здоровых лиц и больных ГБ, и остальными белками мембраны эритроцитов (не вносящими вклад в дискриминацию) использовали канонический анализ.
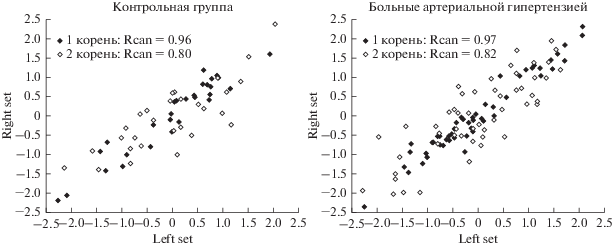
Анализ канонической корреляции между двумя множествами белков: анкирином, АТБ, белком полосы 4.1, Г-3-ФДГ, глутатион-S-трансферазой, с одной стороны, и α-спектрином, β-спектрином, транспортером глюкозы, актином, тропомиозином, с другой, позволил установить определенный характер взаимосвязи между ними как у лиц контрольной группы, так и у больных АГ. Так, приведенные в табл. 3 данные, полученные у лиц контрольной группы, показывают, что между двумя списками переменных существует сильная зависимость (по первому корню – R = 0.96, а по второму – R = 0.80). При этом наибольший вклад в эту зависимость вносили АТБ и актин (по 1-му корню) и Г-3-ФДГ и тропомиозин (по 2-му корню), поскольку вес этих переменных в каждом из множеств имел наибольшее значение.
Таблица 3.
Показатели статистически значимых корней и канонических весов двух множеств нормированных переменных у лиц контрольной группы
| Значимые корни | R канонический | R2 канонический | χ2-критерий | p | Лямбда |
|---|---|---|---|---|---|
| Корень 1 | 0.96 | 0.92 | 112 | 0.0000 | 0.007 |
| Корень 2 | 0.80 | 0.64 | 55 | 0.0000 | 0.089 |
| Правое множество | Корень 1 | Корень 2 | Левое множество | Корень 1 | Корень 2 |
| Анкирин | 0.167 | –0.703 | α-Спектрин | 0.100 | –1.073 |
| АТБ | –0.571 | –0.363 | β-Спектрин | –0.225 | 0.577 |
| Полоса 4.1 | –0.164 | 0.304 | Транспортер глюкозы | –0.188 | –0.397 |
| Г-3-ФДГ | –0.246 | –0.867 | Актин | –0.782 | –0.811 |
| Глутатион-S-трансфераза | –0.104 | 0.751 | Тропомиозин | –0.182 | 1.304 |
В то же время анализ канонической корреляции между описанными выше белками у больных АГ выявил лишь одно принципиальное различие. В отличие от контрольной группы наибольший вклад в эту зависимость по 1-му корню вносили не АТБ и актин, а АТБ и транспортер глюкозы (табл. 4). Диаграммы рассеяния канонических переменных у лиц контрольной группы и больных АГ показаны на рис. 2. При этом статистически значимыми были два корня канонической корреляции. На диаграммах отчетливо видно отсутствие выраженных отклонений от воображаемой линии регрессии, следовательно, не выявлено нарушений основных допущений канонического анализа.
Таблица 4.
Cтатистически значимые корни и канонические веса двух множеств нормированных переменных у больных артериальной гипертензией
| Значимые корни | R канонический | R2 канонический | χ2 критерий | p | Лямбда |
|---|---|---|---|---|---|
| Корень 1 | 0.97 | 0.95 | 204 | 0.0000 | 0.01 |
| Корень 2 | 0.82 | 0.68 | 72 | 0.0000 | 0.20 |
| Правое множество | Корень 1 | Корень 2 | Левое множество | Корень 1 | Корень 2 |
| Анкирин | 0.132 | –0.453 | α-Спектрин | –0.196 | 0.025 |
| АТБ | 0.347 | 0.290 | β-Спектрин | 0.515 | –0.071 |
| Полоса 4.1 | 0.194 | 0.178 | Транспортер глюкозы | 0.739 | –0.527 |
| Г-3-ФДГ | 0.297 | –1.450 | Актин | –0.095 | –0.134 |
| Глутатион-S-трансфераза | 0.136 | 1.378 | Тропомиозин | 0.417 | 1.130 |
Рис. 2.
Характер рассеяния значений канонических переменных левого (left set) и правого множеств (right set) в соответствии с двумя найденными корнями у лиц контрольной группы и больных артериальной гипертензией.
Данные канонической корреляции были проверены с помощью регрессионного анализа, который использовали для изучения предикторных свойств изучаемых мембранных белков эритроцитов, связанных АТБ и Г-3-ФДГ. Для выполнения условий применимости метода признаки, не удовлетворяющие условиям нормального распределения и отмеченные в контрольной группе, были математически преобразованы. Результаты этого анализа представлены в табл. 5. Выяснилось, что у лиц контрольной группы уровни АТБ и Г-3-ФДГ были связаны с изменением количества актина, причем АТБ это касалось в большей степени (R2 = 0.83), чем Г-3-ФДГ (R2 = 0.58). Объяснить данный факт помогут специальные исследования как белкового, так и липидного спектра у лиц контрольной группы, а также значительное увеличение исследуемой выборки.
Таблица 5.
Характер множественной регрессионной связи АТБ и Г-3-ФДГ с изучаемыми белками мембраны эритроцитов у лиц контрольной группы и больных артериальной гипертензией
| Зависимые переменные | Контрольная группа | Больные АГ | ||||||
|---|---|---|---|---|---|---|---|---|
| независимые переменные |
R12 | R2 | R | независимые переменные | R12 | R2 | R | |
| ln(АТБ)* –
контрольная группа АТБ – больные АГ |
Св. член: 4.05 | Св. член: –17.82 | ||||||
| (0.769) | ||||||||
| Транспортер | 0.75 | |||||||
| 0.83 | 0.91 | глюкозы | 0.87 | 0.93 | ||||
| (0.089) | (0.213) | |||||||
| √Актин** | 0.83 | β-Спектрин (0.283) |
0.07 | |||||
| Тропомиозин | 0.05 | |||||||
| Г-3-ФДГx | Св.член: –47.5 | Св.член: –8.78 | ||||||
| (7.30) | (0.80) | |||||||
| √Актин** | 0.58 | 0.71 | 0.84 | Транспортер | 0.83 | 0.86 | 0.93 | |
| (0.167) | глюкозы | |||||||
| (0.093) | ||||||||
| β-Спектрин | 0.13 | β-Спектрин | 0.03 | |||||
Примечание: *– Преобразование переменной извлечением натурального логарифма, **– преобразование переменной извлечением квадратного корня. R12 – частный коэффициент детерминации; R2 – общий коэффициент детерминации; R – множественный коэффициент корреляции. Значимость всех R12 – p ≤ 0.003, R2 и R – p = 0.0000. В скобках – регрессионные коэффициенты независимых переменных. Значимость свободных членов и регрессионных коэффициентов независимых переменных – p < 0.05. Подчеркнуты наиболее значимые переменные регрессионного уравнения.
У больных АГ выявлена тесная регрессионная связь не только АТБ, но и белка Г-3-ФДГ с уровнем белка-переносчика глюкозы. Остальные же мембранные белки играли значительно меньшую роль в изменении содержания АТБ и Г-3-ФДГ о чем свидетельствуют частные коэффициенты детерминации.
Очевидно, что такая перестройка в мембране эритроцитов больных АГ обусловлена либо относительной недостаточностью синтеза белка-переносчика глюкозы в процессе кроветворения, либо его дисфункцией, связанной с действием патогенных факторов эндогенного происхождения.
Изменения структурно-функционального состояния мембранных белков эритроцитов нередко приводят к образованию шаровидных или сфероцитарных клеток, что, несомненно, ухудшает их деформируемость и текучесть мембран. Учитывая данное обстоятельство, в каждой из изучаемых групп была проведена табуляция по показателю сферичности эритроцитов (ПСЭ). В норме ПСЭ составляет 3.4–3.9. Показатель ниже 3.4 означает наличие пула сфероцитарных или шаровидных клеток.
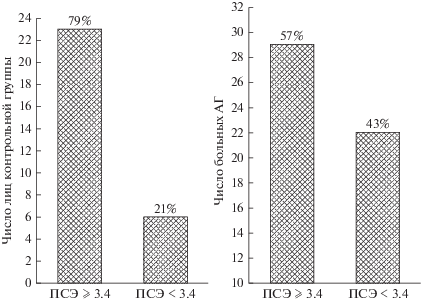
Как видно из рис. 3, у подавляющего числа лиц контрольной группы отмечался нормальный ПСЭ (79%), в то время как такого рода ПСЭ встречался лишь у 57% больных АГ (p = 0.036, точный критерий Фишера). У остальных 43% больных данный показатель был ниже 3.4 усл. ед., т.е. наблюдалась склонность к развитию сфероцитоза.
Рис. 3.
Распределение лиц контрольной группы и больных АГ по показателю сферичности эритроцитов (ПСЭ).
Чтобы выяснить, какие белки наиболее существенно влияют на развитие сфероцитоза, мы провели анализ множественной регрессии у больных АГ и лиц контрольной группы. В контрольной группе мы не определили адекватной регрессионной модели, связанной с отклонением ПСЭ, в то время как подобная регрессионная связь ПСЭ с белками эритроцитов выявлена у больных АГ (табл. 6). Из полученной модели множественной регрессии следует, что основными предикторами отклонения ПСЭ были такие мембранные белки, как β-спектрин, АТБ, тропомиозин и Г-3-ФДГ. Поскольку взаимосвязь переменных ПСЭ и Г-3-ФД носила нелинейный характер, то переменная Г-3-ФДГ подвергалась математическому преобразованию, чтобы использовать регрессионную модель как линейную.
Таблица 6.
Модель множественной регрессионной связи между показателем сферичности эритроцитов (ПСЭ) и белками мембраны эритроцитов у больных артериальной гипертензией
| Описательная статистика (n = 51) | |||
|---|---|---|---|
| переменные | средняя | стандартное отклонение | p * |
| ПСЭ | 3.44 | 0.14 | p > 0.20 |
| х1 – β-Спектрин | 74.3 | 40.7 | p > 0.20 |
| х2 – АТБ | 85.2 | 28.6 | p > 0.20 |
| х3 – Тропомиозин | 87.6 | 37.5 | p > 0.20 |
| ln(х4) – Г-3-ФДГ** | 3.97 | 0.44 | p > 0.20 |
| Описание модели | Стандартная ошибка | p | |
| R | 0.83 | 0.082 | 0.0000 |
| R2 | 0.70 | ||
| Свободный член | 2.6114 | 0.149 | 0.0000 |
| Переменные | Регрессионные коэффициенты | Стандартная ошибка | p |
| β-Спектрин (0.14) | 0.0033 | 0.0004 | 0.0000 |
| АТБ (0.14) | –0.0087 | 0.001 | 0.0000 |
| Тропомиозин (0.23) | 0.0032 | 0.0005 | 0.0000 |
| ln(Г-3-ФДГ) (0.19) | 0.2639 | 0.05 | 0.0000 |
| Статистика Дарбина–Уотсона | 1.97 | Сериальная корреляция между остатками: –0.005 | |
Примечание: * – Критерий согласия Колмогорова–Смирнова на нормальность распределения; ** – преобразование переменной извлечением натурального логарифма; R – коэффициент множественной корреляции; R2 – общий коэффициент детерминации. Цифры в скобках – частные коэффициенты детерминации. Средняя погрешность регрессионной модели относительно фактических значений ПСЭ –1.97 ± 0.16%.
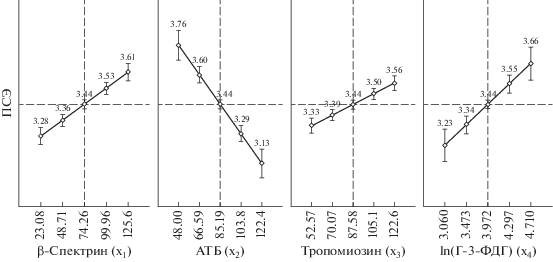
Из представленного на рис. 4 графика видно, что низкий уровень β-спектрина, тропомиозина и Г-3-ФДГ может приводить к снижению ПСЭ и, следовательно, развитию сфероцитоза. Расчеты показали, что если у больных АГ величина β-спектрина, тропомиозина, Г-3-ФДГ будет ниже их среднего уровня более чем на 23, 13.3, 26% соответственно, а АТБ выше на 14.5%, то вероятность развития сфероцитоза у таких больных возрастет скорее всего до 70% и более, поскольку при данных уровнях мембранных белков значения ПСЭ будут менее 3.38 усл. ед.
Рис. 4.
Характер отклонения величины переменной ПСЭ при различном количестве белков мембраны эритроцитов у больных артериальной гипертензией по данным модели множественной регрессии. По оси абсцисс – величина предиктора (от минимальных до максимальных значений). Пунктирные линии – средние величины зависимой и независимых переменных. Вертикальные линии при маркерах – доверительные интервалы (±0.95).
Полученные нами результаты подтверждаются опубликованными данными. Как уже сказано, генетически обусловленный дефицит β-спектрина приводит к развитию наследственного сфероцитоза. Предполагается, что тропомиозин, локализуясь на коротких актиновых филаментах, может регулировать длину и стабильность актиновых филаментов [15]. Также показано, что тропомиозин способствует усилению актиновых филаментов, делая их более устойчивыми к деполимеризации и фрагментации [16]. Поэтому мы предполагаем, что снижение количества тропомиозина будет негативно влиять на устойчивость актиновых филаментов, что особенно важно в условиях прохождения эритроцитов через капиллярное русло. Недостаток мембранного белка Г-3-ФДГ может быть связан, по всей видимости, с недостатком поступления в эритроциты глюкозы из-за относительной несостоятельности транспортеров данного субстрата. При этом следует отметить, что повышение пула сфероцитарных клеток при увеличении уровня АТБ в модельном плане, возможно, обусловлено высоким сродством этого белка к холестерину [17]. Поскольку у больных АГ изменяется и липидный состав мембраны, она становится менее текучей и более жесткой. Повышенный уровень данного белка может приводить к образованию агрегатов, вследствие чего нарушается взаимодействие с ферментными системами клетки [18, 19]. Кроме того, не исключено, что повышение уровня АТБ может быть обусловлено компенсаторной реакцией на гипоксию и связанный с ней ацидоз. Тем не менее наши предложения требуют специальных исследований.
Таким образом, вся совокупность полученных данных свидетельствует о значительной структурно-функциональной перестройке мембраны эритроцитов у больных АГ. Она заключалась прежде всего в снижении уровня как структурных, так и интегральных белков и ферментов, взаимодействие и функция которых, возможно, нарушались из-за недостатка их энергетического обеспечения в результате уменьшения образования АТР, необходимого для формирования адекватного комплекса цитоскелета эритроцитов. Это подтверждается преобладанием сфероцитарных клеток в крови больных АГ. Кроме того, установлено, что у больных АГ установлено наличие множественной корреляции между показателем сфероцитарности и белковым профилем эритроцита.
Список литературы
Новицкий В.В., Рязанцева Н.В., Степовая Е.А. 2004. Физиология и патофизиология эритроцита. Томск: Изд-во Томского ун-та. 202 с.
Бабушкина И.В., Пивоваров Ю.И., Курильская Т.Е., Сергеева А.С., Ильина О.П., Боровский Г.Б. 2015. Белковый спектр мембраны эритроцитов и его изменения при патологии. Биол. мембраны. 32 (3), 168–174.
Сторожок С.А., Санников А.Г., Белкин А.В. 2009. Зависимость стабильности деформабельности мембран эритроцитов от межмолекулярных взаимодействий белков цитоскелета. Научный вестник ТГУ. 3, 3–10.
Маймистова А.А. 2009. Роль внутриклеточных эффекторных путей эритроцитов в изменении их микрореологических свойств в норме и на фоне атеросклероза. Дис. канд. биол. наук. Ярославль. 149 с.
Муравьев А.В., Маймистова А.А., Тихомирова И.А., Булаева С.В., Михайлов П.В., Муравьев А.А. 2012. Роль протеинкиназ мембраны эритроцитов человека в изменениях их деформируемости и агрегации. Физиология человека. 2, 94–100.
Шилов А.М., Авшалумов А.Ш., Марковский В.Б., Синицина Е.Н., Полещук О.И. 2008. Изменения реологических свойств крови у больных с метаболическим синдромом. Рус. мед. журн. 4, 200–204.
Анохин А.Ю., Быстрова Н.А., Гаврилюк Е.В. 2014. Изменения белково-липидного спектра эритроцитов при гипертонической болезни. Успехи соврем. естествознания. 6, 19–21.
Dodge J., Mitchell C., Hanahan D. 1963. The preparation and chemical characteristics of hemoglobin free ghosts of erythrocytes. J. Arch. Biochem. Biophys. 100 (1), 119–130.
Laemmli U.K. 1970. Cleavege of structural proteins during the assembly of the head bacteriophage T4. Nature. 227 (5259), 680–685.
Пивоваров Ю.И. Свидетельство о государственной регистрации программы для ЭВМ № 2 014 610 233 от 09.01.2014 “Математическая обработка электрофореграммы белковых фракций”.
Пивоваров Ю.И., Сергеева А.С., Курильская Т.Е. 2014. Способ математической обработки набора белковых полос, полученных с помощью электрофореза. Бюлл. ВСНЦ СО РАМН. 3 (97), 101–104.
Gimsa J., Cianci C.D., Gallagher P.G., Morrow J.S. 2001. Spectrin oligomerization is cooperatively coupled to membrane assembly: a linkage targeted by many hereditary hemolytic anemias? J. Exp. Mol. Pathol. 70 (3), 215–230.
Quilty J.A., Reithmeier R.A.F. 2000. Trafficking and folding defects in hereditary spherocytosis mutants of the human red cell anion exchanger. Traffic. 1, 987–998.
Гончарова Е.И., Пинаев Г.П. 1988. Белки цитоскелета эритроцитов. Цитология. 30 (1), 5–18.
Ursitii J.A., Fowler V.M. 1994. Immunolocalization of tropomodulin, tropomyosin and actin in spread human erythrocyte skeleton. J. Cell Sci. 107 (6), 1633–1639.
Sung L.A., Gao K.-M., Yee L.J., Temm-Grove C.J., Helfman D.M., Lin J.J.-C., Mehrpouryan M. 2000. Tropomyosin isoform 5b is expressed in human erythrocytes: implications of tropomodulin-TM5 or tropomodulin-TM5b complexes in the protofilament and hexagonal organization of membrane skeletons. Blood. 95 (4), 1473–1480.
Заводник И.Б., Пилецкая Т.П., Степуро И.И. 1995. Осмотический и механический лизис эритроцитов человека. Биол. мембраны. 12 (4), 400–407.
Молчанова Т.П. 1987. Основы молекулярной организации белков мембраны эритроцитов и их дефекты, приводящие к гемолитическим анемиям. Гематология и трансфузиология. 32 (7), 32–41.
Трикуленко А.В., Пинишко У.В. 1999. Кинетика кислотного лизиса эритроцитов разновозрастных популяций в присутствии лигандов некоторых интегральных белков плазматических мембран. Гематология и трансфузиология. 44 (1), 16–18.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


