Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 2, стр. 125-136
Пространственно-конформационные модификации белков мембранно-цитоскелетного комплекса криоконсервированных эритроцитов
Н. Г. Землянских a, *, Л. А. Бабийчук a
a Институт проблем криобиологии и криомедицины НАН Украины,
61016 Харьков, ул. Переяславская, 23, Украина
* E-mail: nzemliansky@gmail.com
Поступила в редакцию 26.07.2018
Принята к публикации 12.10.2018
Аннотация
Селективность защитного действия криопротекторных агентов (КПА) может быть обусловлена особенностями модификации клеточных элементов в процессе замораживания-оттаивания. Пространственно-конформационные изменения белков мембранно-цитоскелетного комплекса эритроцитов человека при криоконсервировании в присутствии различных КПА исследовали с помощью белок-сшивающего реагента диамида. Уровень индуцированных диамидом высокомолекулярных полипептидных комплексов (ВПК) и изменения профиля белков теней определяли с помощью SDS-ПААГ-электрофореза. Экспонирование эритроцитов в растворе с высокой ионной силой и замораживание без КПА повышало количество ВПК вследствие увеличения доступности сульфгидрильных групп белков для реагента. Основной вклад в увеличение уровня ВПК в данных условиях вносили спектрин и белок полосы 3. Образование ВПК в эритроцитах, замороженных под защитой глицерина, диметилсульфоксида (DMSO), сахарозы, декстрана и ПЭГ, в значительной мере отражало эффективность их действия. Более высокий уровень гемолитических повреждений в присутствии сахарозы и декстрана в сравнении с DMSO, ПЭГ и глицерином на этапе размораживания клеток соответствовал значимому увеличению количества ВПК. Перенос клеток в физиологические условия после удаления КПА показал, что только в эритроцитах, замороженных под защитой глицерина, распределение белковых фракций и количество ВПК соответствовали показателям контрольных клеток. Модификации белков мембранно-цитоскелетного комплекса под влиянием экстремальных факторов среды также связаны, по-видимому, с развитием окислительного стресса при нарушении структуры гемоглобина, что подтверждается изменением содержания пероксиредоксина в белковом профиле теней. Таким образом, в условиях криоконсервирования эффективная защита клеток может быть обусловлена ограничением пространственно-конформационной модификации белков мембранно-цитоскелетного комплекса и обратимостью их изменений в физиологических условиях после удаления КПА.
ВВЕДЕНИЕ
В ходе замораживания–оттаивания клетки подвергаются воздействию экстремальных факторов, сопровождающих сдвиги температуры (37 → (–196) → 37°С). Основные причины криоповреждений связаны с формированием кристаллов льда, которые механически разрушают структурные элементы клеток, и высокими концентрациями солей, вызывающими нарушения межмолекулярных связей в сложных упорядоченных комплексах, в том числе в плазматических мембранах [1–3]. Криопротекторные агенты (КПА) по-разному проявляют защитные свойства в зависимости от типов клеток. Селективность их действия, по-видимому, обусловлена особенностями модификации клеточных элементов и/или изменений геометрических параметров клеток, которые, в свою очередь, накладывают “отпечаток” на структуру и функции компонентов плазматической мембраны [4].
Глицерин и полиэтиленгликоль с мол. массой 1500 (ПЭГ), представляющие эндо- и экзоцеллюлярный тип КПА соответственно, обеспечивают самый высокий уровень сохранности эритроцитов человека при замораживании [5, 6] и механическом стрессе [4]. Анализ взаимосвязи между изменениями физико-химических свойств растворов КПА и развитием гемолитических повреждений клеток при механическом стрессе позволил заключить, что защитный эффект КПА определяется модификацией механических характеристик плазматической мембраны [4]. Очевидно, присутствие глицерина и ПЭГ влияет на сродство и динамику белок-белковых взаимодействий в мембранно-цитоскелетном комплексе, повышая устойчивость эритроцитов в стрессовых условиях, поскольку ключевая роль в ответе клеток на механические воздействия принадлежит плазматической мембране [7] и белкам связанного с ней цитоскелета [7, 8].
Для исследования взаимодействий между белками применяют различные “сшивающие” реагенты, в том числе диамид [9–11], который окисляет сульфгидрильные (SH) группы белков с образованием дисульфидных мостиков между отдельными молекулами, вследствие чего формируются высокомолекулярные полипептидные комплексы (ВПК). Анализ распределения диамид-индуцированных дисульфидных связей среди различных белковых фракций теней эритроцитов (изолированный мембранно-цитоскелетный комплекс) показал, что данный реагент действует не только на спектриновые полипептиды [12], но и на актин [13], белки полос 3 [14], 4.1 [14] и 4.2 [13]. При более высоких концентрациях диамид может “сшивать” субъединицы гемоглобина [15]. Таким образом, индуцированные диамидом ВПК могут состоять из ковалентно сшитых субъединиц, принадлежащих одному или различным типам белков и, соответственно, отличаться по молекулярной массе. В SDS-ПААГ ВПК локализуются в зоне между стартовой позицией и самым крупным полипептидом (α-субъединицей спектрина) теней эритроцитов.
В настоящее время методы криоконсервирования эритроцитов человека для практического применения основаны на использовании глицерина [5, 16], существенным недостатком которого является трудоемкая и сложная процедура его удаления из клеток перед трансфузией. Альтернативой глицерину могут быть нетоксичные экзоцеллюлярные КПА, которые не проникают в клетки и, следовательно, не требуют удаления. Однако предлагаемые методы криоконсервирования эритроцитов на основе экзоцеллюлярных КПА еще не позволяют обеспечить приемлемый уровень жизнеспособности клеток при переносе в физиологические условия [5, 6]. Поэтому изучение особенностей модификации белков мембранно-цитоскелетного комплекса эритроцитов человека под влиянием КПА с разными защитными свойствами и процессов замораживания-оттаивания могут быть полезными для выявления закономерностей модификации субклеточных систем, определяющих устойчивость клеток к действию стрессовых факторов, и способствовать поиску путей стабилизации клеток в условиях криоконсервирования.
Цель исследования заключалась в оценке пространственно-конформационной модификации белков мембранно-цитоскелетного комплекса эритроцитов человека под влиянием криоконсервирования в присутствии КПА на основе определения уровня индуцированных диамидом ВПК и анализа изменений белкового профиля теней эритроцитов с помощью SDS-ПААГ-электрофореза.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали следующие реактивы: диамид, фенилметилсульфонилфторид (PMSF), азид натрия (NaN3), Трис, HEPES, EDTA, додецилсульфат натрия (SDS), β-меркаптоэтанол, краситель Coomassie BB G-250, акриламид, бис-акриламид, сахарозу, (Sigma, США), бромфеноловый синий (Serva, Германия), ПЭГ 1500, декстран 40 кДа (Fluka, США), диметилсульфоксид (DMSO), гицерин, маннитол, ТХУ, NaCl, NaH2PO4, Na2HPO4 (х.ч. или ос.ч.) и другие реактивы производства России и Украины.
Объектом исследования служили эритроциты крови доноров, полученной из Центра службы крови г. Харькова. Эритроциты осаждали центрифугированием при 1200 g в течение 10 мин при комнатной температуре, удаляли плазму и лейкоцитарный слой. К осадку добавляли раствор (150 мМ NaCl, 10 мМ Трис-HCl pH 7.4), объем которого в 5–7 раз превышал объем клеточной массы, и отмывали от остатков плазмы и белых клеток трехкратным центрифугированием в аналогичном режиме.
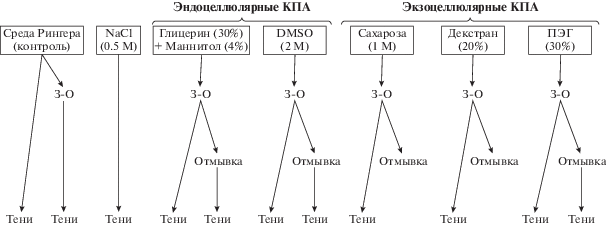
Перед замораживанием эритроциты инкубировали в течение 30 мин при 37°С в криопротекторных средах: ПЭГ (30%), сахарозе (1 М), декстране (20%), DMSO (2 М), а также в растворе, содержащем глицерин (30%) и маннитол (4%). Все среды дополнительно включали 150 мМ NaCl, 10 мМ Трис-НCl (рН 7.4). Эритроциты, инкубируемые в Рингер-глюкозной среде (125 мМ NaCl, 5 мМ КCl, 1 мМ MgCl2, 1 мМ CaCl2, 32 мМ HEPES (pH 7.4), 5 мМ глюкоза), служили контролем. Замораживание проводили путем быстрого погружения образцов в жидкий азот (–196°С). Оттаивание выполняли на водяной бане при 37°С c интенсивным покачиванием. Основная схема исследований представлена на рис. 1.
Размороженные эритроциты делили на две части (по 2 мл), одну из которых использовали для анализа модификаций белков, вызванных процессами замораживания-оттаивания, а вторую – для оценки обратимости изменений в клетках после удаления КПА и переноса в физиологические условия. Для этого одну часть эритроцитов осаждали центрифугированием (5 мин, 1200 g), тщательно удаляли супернатант и разрушенные клетки. Аликвоты осажденных эритроцитов из каждого образца (150 мкл) ресуспендировали в соответствующих растворах КПА, добавляли диамид (конечная концентрация 2.5 мМ) и инкубировали в течение 1 ч при 37°С.
Удаление криопротекторов из размороженных образцов выполняли в зависимости от типа КПА. В процессе отмывки экзоцеллюлярных КПА (сахарозы, декстрана и ПЭГ) эритроциты осаждали центрифугированием (5 мин, 1200 g), супернатант и разрушенные клетки тщательно удаляли. К осадку (~1 мл) добавляли 8 мл раствора 150 мМ NaCl, 10 мМ Трис-HCl (pH 7.4) и центрифугировали (5 мин, 1200 g). К осажденным клеткам (150 мкл), отмытым от КПА, добавляли Рингер-глюкозный раствор (150 мкл) и обрабатывали диамидом (1 ч, 37°С). Для удаления эндоцеллюлярных КПА (глицерин, DMSO) использовали серийные отмывки. К предварительно осажденным эритроцитам (центрифугирование 5 мин, 1200 g) на первом этапе добавляли равный объем 0.6 М NaCl и центрифугировали в аналогичном режиме. Вторую и третью отмывки выполняли с использованием 150 мМ NaCl. В завершение к 150 мкл отмытых клеток добавляли 150 мкл Рингер-глюкозного раствора и обрабатывали диамидом (1 ч, 37°С). Кроме того, нативные эритроциты, не подвергавшиеся замораживанию, инкубировали в 0.5 М NaCl в течение 15 мин при 37°С, после чего аналогичным образом обрабатывали диамидом.
После завершения инкубации из эритроцитов с помощью гипотонического шока получали тени [17]. Эритроциты лизировали при 2–5°С раствором, содержащим 10 мМ натрий-фосфатный буфер, рН 8.0 и 0.1 мМ PMSF (соотношение объемов клеточной суспензии и раствора составляло ~1 : 30), а затем центрифугировали при 20 000 g в течение 10 мин при 4°С. Отмывку теней от гемоглобина повторяли дважды с использованием лизирующей среды, не содержащей PMSF. Аликвоты осажденных теней эритроцитов, инкубированных с диамидом, растворяли в Sample-буфере: 0.05 М Трис-НСl (рH 6.8), 2% SDS, 20% глицерин, 0.7 мг/мл PMSF, 0.4 мг/мл NaN3, 0.01% бромфеноловый синий. Образцы, инкубированные без диамида, растворяли в Sample-буфере аналогичного состава с включением 5% β-меркаптоэтанола.
Электрофорез проводили в камере Bio Rad Protein II Multi-Gel Casting chamber в плоских вертикальных SDS-ПААГ по системе Лэммли [17]. В качестве разделяющего геля использовали градиентный гель с концентрацией полимеризуемых веществ (акриламида и бис-акриламида) 5–20%. Белки в геле окрашивали Coomassie BB G-250 при комнатной температуре в течение 1 ч. Избыток красителя отмывали раствором 7% уксусной кислоты. Для идентификации белков использовали набор стандартных маркерных белков Fermentas life sciences Rage Ruler SM0661. Количественный анализ белкового спектра (относительные изменения содержания полипептидов) выполняли с помощью программного обеспечения Gel (Свідоцтво № 23 683, Держдепартамент інтелектуальної власності Міністерства освіти і науки України, 12.02.2008).
Гемолиз определяли спектрофотометрически (СФ-4А, Россия) с проточной кюветой при λ = = 543 нм по количеству вышедшего из клеток гемоглобина. Количество гемоглобина выражали в процентах, принимая за 100% гемолиз эритроцитов в присутствии 0.1% детергента Тритона Х-100.
Статистическую обработку результатов выполняли с использованием программного пакета “Statgraphics plus 2.1 for Windows” (Statistical Graphics Corp.). Данные были протестированы на нормальность распределения с помощью теста Колмагорова–Смирнова и представлены в виде M ± SD (среднее значение ± стандартное отклонение). Выборки являются зависимыми, эксперименты проведены на крови четырех разных доноров (n = 4). Статистическую значимость различий между экспериментальными группами оценивали с помощью множественного рангового теста Фишера по процедуре группировки выборок с наименьшей значимой разницей. При р < < 0.05 данные считали статистически значимыми.
РЕЗУЛЬТАТЫ
Образование ВПК определяется концентрацией и продолжительностью инкубации клеток с диамидом [10]. В выбранных условиях лишь небольшая часть белков мембранно-цитоскелетного комплекса контрольных эритроцитов вовлекалась в формирование ВПК (рис. 2а, дорожки 2 и 4), которое происходило, главным образом, за счет спектрина, белка с мол массой 60 кДа, и белка полосы 8, а также небольшого количества белков полосы 3 и 5 (актина), что подтверждалось денситограммами, полученными при количественном анализе изображений (рис. 2б, 2в, табл. 1). Для оценки изменений белков мембранно-цитоскелетного комплекса под влиянием высоких концентраций солей и кристаллов льда, как основных повреждающих факторов, эритроциты инкубировали в растворе с высокой ионной силой и замораживали в среде, не содержащей КПА.
Рис. 2.
Изменения белкового профиля теней эритроцитов, инкубированных в контрольной среде и растворе с высокой ионной силой под влиянием диамида. а – SDS-ПААГ-электрофорез белков теней эритроцитов человека: 1 – маркеры; 2 – контрольные эритроциты, экспонированные в Рингер-глюкозной среде в присутствии диамида; 3 – эритроциты, экспонированные в растворе 0.5 М NaCl в присутствии диамида; 4 – нативные эритроциты, экспонированные в Рингер-глюкозной среде без диамида. Денситограммы теней: б – нативные эритроциты, экспонированные в Рингер-глюкозной среде без диамида (дорожка 4); в – контрольные эритроциты, экспонированные в Рингер-глюкозной среде в присутствии диамида (дорожка 2); г – эритроциты, экспонированные в растворе 0.5 М NaCl в присутствии диамида (дорожка 3). Здесь и на рис. 3, 4 бп – белок полосы. Представлены данные типичного эксперимента.
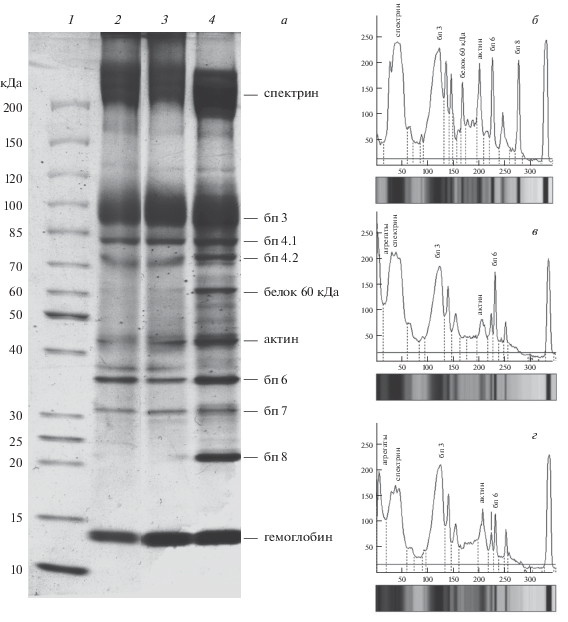
Таблица 1.
Изменения содержания белковых фракций теней эритроцитов в гиперосмотических условиях и при замораживании
| Белок | Нативные эритроциты (среда Рингера) | Эритроциты, обработанные диамидом | ||
|---|---|---|---|---|
| среда Рингера (контроль) |
0.5 М NaCl | замораживание без КПА | ||
| ВПК | – | 7.4 ± 0.6 | 10.5 ± 0.5* | 11.7 ± 0.9* |
| Спектрин | 22.7 ± 0.6 | 18.5 ± 0.8# | 13.8 ± 1.2#, * | 15.6 ± 1.1#, * |
| Белок полосы 3 | 21.1 ± 1.4 | 17.1 ± 0.9# | 15.1 ± 0.7#, * | 14.4 ± 1.3#, * |
| Белок полосы 4.1 | 4.3 ± 0.6 | 4.2 ± 0.9 | 4.0 ± 0.6 | 2.9 ± 0.4#, * |
| Белок полосы 6 | 4.2 ± 1.0 | 2.9 ± 0.1 | 2.3 ± 0.2 | 1.8 ± 0.3#, * |
| Белок полосы 8 | 3.5 ± 0.6 | – | – | 1.3 ± 0.4#, * |
Примечание. Представлено содержание индивидуальных белковых фракций по отношению к общему количества белка в пробе (%). Значками #, * показаны величины, статистически достоверно отличающиеся от соответствующего параметра для нативных эритроцитов (#) и контрольных эритроцитов, обработанных диамидом (*), при р < 0.05, n = 4.
Действие высокой ионной силы (0.5 М NaCl) приводило к увеличению количества ВПК относительно контрольных клеток (рис. 2а, дорожки 2 и 3; рис. 2в, 2г, табл. 1). И хотя влияние диамида на белки эритроцитов, инкубированных в 0.5 М NaCl, качественно не отличалось от его действия в контрольных клетках, количественная оценка выявила более существенное снижение содержания спектрина и белка полосы 3. Кроме того, инкубация эритроцитов в 0.5 М NaCl приводила к снижению содержания белка полосы 6, который мог вовлекаться в формирование ВПК или отделяться от белка полосы 3 вследствие структурной модификации, ведущей к потере сайтов связывания.
Замораживание эритроцитов в отсутствие КПА, как и инкубация в 0.5 М NaCl, приводило к увеличению содержания ВПК по сравнению с содержанием в контроле благодаря повышению доступности SH-групп основных белков мембранно-цитоскелетного комплекса (спектрина и белка полосы 3) для диамида (рис. 3 дорожка 2, табл. 1). Вместе с тем, ряд изменений белкового профиля теней замороженных эритроцитов указывал на различие механизмов нарушения структуры в условиях высокой ионной силы и замораживания-оттаивания. Во-первых, в тенях замороженных эритроцитов обнаруживался белок полосы 8, хотя и в меньшем количестве, чем в нативных клетках, не подвергавшихся обработке диамидом (см. рис. 2а, дорожка 4). Во-вторых, отмечено заметное снижение содержания белка полосы 4.1 (табл. 1) и появление дополнительной белковой фракции в зоне между полосами 3 и 4.1. Третья особенность белкового спектра замороженных без КПА эритроцитов связана с отчетливым проявлением дополнительных белковых фракций в зоне между полосами 5 и 6.
Рис. 3.
Изменения белкового профиля теней эритроцитов, замороженных в присутствии различных КПА, под влиянием диамида. 1 – контрольные эритроциты в Рингер-глюкозной среде; 2 – эритроциты, замороженные в отсутствие КПА; 3 – маркеры; 4 – эритроциты, замороженные под защитой глицерина (30%) в комбинации с маннитолом (4%); 5 – эритроциты, замороженные под защитой DMSO (2 М); 6 – эритроциты, замороженные под защитой сахарозы (1 М); 7 – эритроциты, замороженные под защитой декстрана (20%); 8 – эритроциты, замороженные под защитой ПЭГ (30%). Представлены данные типичного эксперимента.
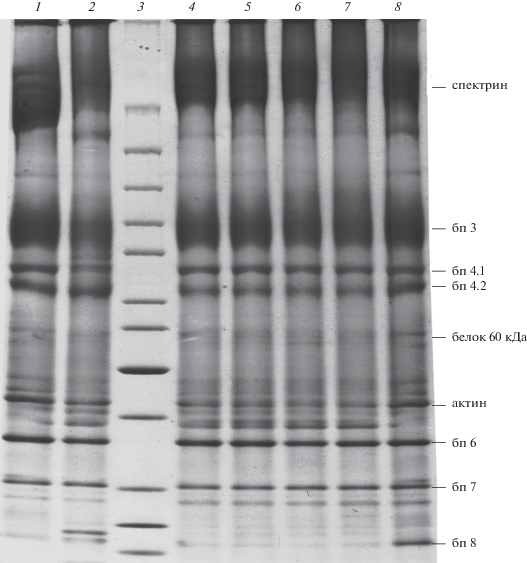
Процессы замораживания эритроцитов человека под защитой глицерин-содержащей среды, а также DMSO, сахарозы, декстрана и ПЭГ сопровождались структурными модификациями белков, которые в значительной мере отражали эффективность защитного действия КПА, о чем свидетельствовал уровень ВПК, индуцированных диамидом. Оценка гемолиза эритроцитов после размораживания показывала, что глицерин, DMSO и ПЭГ обеспечивали лучшую сохранность клеток, чем сахароза и декстран в использованных концентрациях (табл. 2), а количество ВПК в таких клетках после размораживания было сопоставимо с их содержанием в контроле (рис. 3, табл. 1, 2). В то же время количество ВПК в клетках, замороженных в присутствии сахарозы и декстрана, не отличалось статистически достоверно от количества в эритроцитах, замороженных в отсутствие КПА. Увеличение содержания ВПК в данном случае также было связано с нарушениями структуры спектрина и белка полосы 3, поскольку выявлено значимое снижение их содержания в белковом спектре соответствующих образцов. Следовательно, глицерин (в сочетании с маннитолом), а также DMSO и ПЭГ способны достаточно эффективно защищать белки мембранно-цитоскелетного комплекса от стрессовых влияний, сопровождающих действие сверхнизкой температуры, в отличие от сахарозы и декстрана.
Таблица 2.
Образование ВПК в тенях эритроцитов и гемолитические повреждения клеток под влиянием замораживания–оттаивания в присутствии КПА и при обработке диамидом
| Параметр | Обработка диамидом | ||||
|---|---|---|---|---|---|
| глицерин (30%), маннитол (4%) | DMSO (2 М) | сахароза (1 М) | декстран (20%) | ПЭГ (30%) | |
| ВПК | 9.1 ± 0.8 | 9.3 ± 0.5 | 13.2 ± 3.2* | 11.8 ± 1.2* | 9.0 ± 1.6 |
| Спектрин | 17.8 ± 1.0 | 14.9 ± 3.8 | 12.4 ± 3.7* | 12.9 ± 3.4* | 15.3 ± 1.9 |
| Белок полосы 3 | 17.0 ± 2.1 | 16.4 ± 1.9 | 15.7 ± 1.5 | 14.4 ± 1.1* | 15.7 ± 2.0 |
| Гемолиз после размораживания | 6.3 ± 1.8 | 9.6 ± 3.1 | 15.2 ± 4.1 | 13.3 ± 2.7 | 2.0 ± 0.5 |
| Гемолиз при удалении КПА | 17.2 ± 3.5 | 28.7 ± 3.8 | 44.5 ± 6.0 | 47.3 ± 5.7 | 34.0 ± 3.9 |
Примечание: Содержание индивидуальных белковых фракций представлено относительно общего количества белка в пробе (%). Гемолиз определяли спектрофотометрически, за 100% принят гемолиз эритроцитов в присутствии 0.1% Тритона Х-100. Звездочкой (*) показаны величины, достоверно отличающиеся от соответствующего параметра для контрольных эритроцитов, обработанных диамидом (см. табл. 1), р < 0.05, n = 4.
Сравнительная оценка профилей белков теней эритроцитов, замороженных в присутствии КПА, показала, что использование ПЭГ, обеспечивающее самый высокий уровень сохранности (гемолиз 2%) на этапе оттаивания, также позволяет сохранить характер распределения белковых фракций в геле, близкий к распределению в контроле (рис. 3, дорожки 1 и 8). Более того, в их белковом профиле можно видеть фракции белка 60 кДа и полосы 8, хотя и в меньшем количестве, чем в нативных клетках (см. рис. 2, дорожка 4), а также более высокий уровень актина (3.6 ± 0.4%), сопоставимый с его содержанием (4.8 ± 0.7%) в нативных эритроцитах. Вместе с тем, изменения белкового профиля эритроцитов, замороженных в присутствии глицерина, DMSO, сахарозы и декстрана (рис. 3, дорожки 4–7), имели одну общую черту с клетками, замороженными без КПА, а именно, присутствие в их спектре неизвестных белков, расположенных в зоне между актином и белком полосы 6.
Важным этапом процесса криоконсервации является подготовка клеток к возвращению в физиологические условия, что предполагает удаление эндоцеллюлярных КПА из эритроцитов для предотвращения осмотического шока [6]. Экзоцеллюлярные соединения можно не удалять из клеточной суспензии, поскольку они не проникают в клетки, и их концентрация может уменьшаться в результате разведения в плазме. Однако и в данном случае важно представлять насколько обратимы модификации белков мембранно-цитоскелетного комплекса, обусловленные процессами замораживания-оттаивания клеток в присутствии КПА. Поэтому ПЭГ, сахарозу и декстран также удаляли из клеточных суспензий, и эритроциты переносили в Рингер-глюкозный раствор. Однако получение теней оказалось затруднительным из-за высокого уровня гемолиза в процессе удаления сахарозы и декстрана (табл. 2). В итоге оценка обратимости модификаций белков мембранно-цитоскелетного комплекса криоконсервированных эритроцитов после возвращения в физиологические условия была выполнена для эритроцитов, замороженных в глицеринсодержащем растворе, DMSO и ПЭГ (рис. 4).
Рис. 4.
Изменения белкового профиля теней размороженных эритроцитов после удаления КПА и переноса в физиологические условия. а – эритроциты, обработанные диамидом; б – эритроциты, не обработанные диамидом. Образцы дорожек (а и б) представляют: 2 – эритроциты в среде Рингера; 3 – размороженные эритроциты после удаления глицерин-маннитольной смеси; 4 – размороженные эритроциты после удаления DMSO; 5 – размороженные эритроциты после удаления ПЭГ. Представлены данные типичного эксперимента.
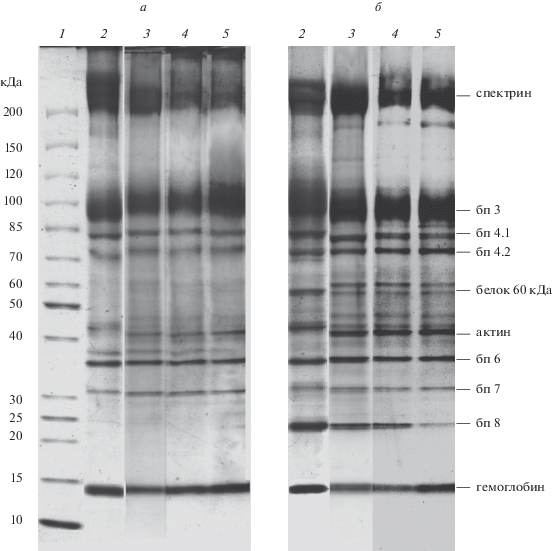
Обнаружено, что только в эритроцитах, замороженных в глицеринсодержащем растворе, после удаления КПА распределение белковых фракций не отличалось от белкового профиля контрольных клеток (рис. 4а, дорожки 2 и 3). В то время как в тенях эритроцитов, замороженных в присутствии DMSO и ПЭГ (рис. 4а, дорожки 4 и 5), после удаления КПА было выявлено значимое увеличение количества ВПК (10.5 ± 0.4 и 11.9 ± 1.4 соответственно) относительно контроля, сопровождаемое уменьшением содержания спектрина и белка полосы 3 (только для DMSO).
Для более детальной оценки модификаций белков мембранно-цитоскелетного комплекса размороженных эритроцитов после удаления КПА был выполнен электрофоретический анализ с применением β-меркаптоэтанола и без обработки эритроцитов диамидом (рис. 4б, дорожки 2–5). Общей чертой белковых профилей теней таких эритроцитов было удвоение полос зоны белка 60 кДа. Вместе с тем были обнаружены различия, обусловленные эффективностью использованных КПА. В частности, распределение белков в профиле клеток, замораживаемых под защитой глицеринсодержащей среды, было сходным с распределением в нативных клетках, за исключением выше отмеченной особенности. В эритроцитах, замораживаемых под защитой DMSO и ПЭГ, отмечено снижение содержания спектрина. Кроме того, в этих условиях в эритроцитах, замораживаемых под защитой ПЭГ, наблюдалось снижение содержания белка полосы 8.
Таким образом, в условиях криоконсервирования эффективная защита клеток может быть связана в значительной мере с ограничением пространственно-конформационной модификации белков мембранно-цитоскелетного комплекса и обратимостью данных изменений после удаления КПА и переноса клеток в физиологические условия. Из всех исследованных КПА только глицерин в сочетании с маннитолом обеспечивал стабильность криоконсервированных эритроцитов в физиологических условиях, а электрофоретический профиль теней таких эритроцитов был приближен к контрольным образцам.
ОБСУЖДЕНИЕ
Белки мембранно-цитоскелетного комплекса эритроцитов формируют единую сеть [18, 19], поэтому модификация структуры отдельных компонентов может повлечь за собой изменение стабильности всей системы в стрессовых условиях. Экспонирование эритроцитов в растворе с высокой ионной силой и замораживание в отсутствие КПА вызывают увеличение количества индуцированных диамидом ВПК и снижение содержания спектрина и белка полосы 3 в электрофоретическом профиле, что указывает на повышение доступности SH-групп данных белков для реагента вследствие нарушений их пространственно-конформационной упаковки. Таким образом, изменения белкового спектра теней эритроцитов, подвергнутых экстремальным воздействиям, определяют критические точки нарушений структурно-функционального состояния белковой сети.
Нарушения в системе мембранно-цитоскелетного комплекса могут инициироваться изменениями в α- и β-субъединицах спектрина, значительная часть молекулярной структуры которых представлена множественными трехспиральными повторяющимися сегментами [19–21]. Некоторые из них нестабильны и подвергаются частичному анфолдингу даже в физиологических условиях [22]. Вероятность нарушений резко увеличивается при действии высоких концентраций солей, температурных сдвигах и образовании кристаллов льда, что ведет к изменению белок-белковых взаимодействий, поскольку некоторые из этих повторяющихся доменов вовлечены во взаимодействия с другими белками. В частности, повтор 4 α-субъединицы участвует в формировании вертикальных контактов с молекулами адгезии Lu/BCAM [23], входящими в состав макрокомплекса, включающего белки полос 3, 4.2 и другие компоненты. Кроме того, нестабильность повтора 13 β-субъединицы, который примыкает к анкиринсвязывающиму сайту, образованному взаимодействием сегментов 14 и 15 [24], может повлиять на связь спектрина с белком полосы 3.
Исходя из того, что белки мембранно-цитоскелетного комплекса эритроцитов реагируют на экстремальные условия нарушениями пространственно-конформационной упаковки макромолекул, можно предположить, что присутствие КПА в среде ограничивает возможность структурных изменений макромолекул под влиянием стрессовых факторов. Однако эффективность защитного действия КПА, по-видимому, зависит от определенных соответствий между физико-химическими свойствами раствора и поверхностными характеристиками белков [25]. В частности, реакция спектрина на диамид в эритроцитах после замораживания-оттаивания в присутствии глицерина, DMSO и ПЭГ была сходна с реакцией белка на реагент в контрольных клетках. В то же время замораживание-оттаивание эритроцитов под защитой сахарозы и декстрана сопровождалось повышением уровня ВПК вследствие нарушений структуры спектрина и/или белка полосы 3, о чем свидетельствует снижение их содержания в белковом спектре. Изучение защитного действия гидроксиэтилкрахмала, еще одного экзоцеллюлярного КПА, при криоконсервировании эритроцитов также выявило возможность структурных изменений β-спектрина, которые могут приводить к нарушению белок-белковых взаимодействий и влиять на реологические и биохимические свойства криоконсервированных клеток [26].
Следует отметить, что сохранность клеток после размораживания в значительной степени определяется состоянием актиновых протофиламентов, которые являются центром узловых соединений цитоскелетной сети, и посредством белков-партнеров, в том числе белка полосы 4.1, формируют связи с интегральными белками мембраны [27]. Более высокий, чем в других экспериментальных группах, уровень сохранности криоконсервированных в присутствии ПЭГ эритроцитов на этапе размораживания, по-видимому, обусловлен специфическим состоянием актиновых протофиламентов, которое может быть обусловлено повышением уровня внутриклеточного Са2+ вследствие ингибирования активности Са2+-АТР-азы [28, 29], а также влиянием физико-химических свойств раствора ПЭГ на другие компоненты мембраны, реализуемым на фоне потери клеткой воды.
Дополнить информацию о характере модификации белков мембранно-цитоскелетного комплекса эритроцитов при замораживании могут данные о проявлении новых фракций в зоне между полосами 5 и 6, а также 3 и 4.1 в электрофоретическом белковом профиле. Эти фракции могут быть представлены индивидуальными полипептидами, которые связываются с мембранно-цитосклетным комплексом при изменении параметров среды, или продуктами частичного протеолиза макромолекул с большой исходной молекулярной массой [30]. Однако наиболее вероятной причиной появления данных белковых фракций может быть сшивание двух низкомолекулярных полипептидов диамидом. В частности, можно допустить, что при замораживании структура части молекул гемоглобина нарушается, в результате чего отдельные субъединицы могут сшиваться между собой или с белком мембранно-цитоскелетного комплекса. Известно, что нарушения структуры гемоглобина при некоторых патологиях или при длительном гипотермическом хранении могут приводить к связыванию гемоглобина с белками мембранно-цитоскелетного комплекса, что, как правило, сопровождается негативными изменениями физических свойств мембраны эритроцитов [31, 32].
В этой связи следует также обратить внимание на изменения уровня белка полосы 8 в эритроцитах, подвергнутых замораживанию. Белок полосы 8 – пероксиредоксин 2 [33] – содержит функциональную SH-группу цистеина и участвует в защите клеток от окислительного стресса [34]. Очевидно, что его удаление из электрофоретического профиля контрольных эритроцитов обусловлено реакцией диамида с SH-группами. Если при замораживании эритроцитов без КПА в структуре гемоглобина, содержащего металл с переменной валентностью, происходят нарушения, то в условиях высокого содержания кислорода в клетках возможно образование активных форм кислорода, в частности Н2О2. Пероксиредоксин первым отвечает на такие изменения, поскольку SH-группы других белков реагируют с Н2О2 на несколько порядков величины медленнее [35]. Окисление части молекул общего пула пероксиредоксина делает их недоступными для действия диамида и позволяет обнаружить белок в электрофоретическом профиле теней. Кроме того, присутствие пероксиредоксина в электрофоретическом профиле теней эритроцитов, замороженных под защитой ПЭГ, может быть связано с аналогичными причинами и объясняет почему, несмотря на высокий уровень сохранности размороженных клеток, значительная часть эритроцитов разрушается в процессе удаления КПА. Важно также отметить, что пероксиредоксин участвует в путях сигнальной трансдукции окисления белков [36], а также выполняет шаперонную функцию [37]. Все это может быть важным для модификации белков мембранно-цитоскелетного комплекса в условиях криоконсервирования. Таким образом, повреждения клеток в процессе замораживания–оттаивания могут быть вызваны не только непосредственным нарушением пространственно-конформационного состояния белков мембранно-цитоскелетного комплекса под влиянием экстремальных факторов среды, но, возможно, и вторичными изменениями белков, связанными с развитием окислительного стресса при нарушении структуры гемоглобина.
Непременным условием эффективности действия КПА должна быть обратимость изменений клеточных компонентов, вызванных процессами замораживания-оттаивания, при возвращении клеток в физиологические условия. Анализ электрофоретических профилей белков показал, что после удаления КПА только в эритроцитах, замороженных под защитой глицерина, распределение белковых фракций и содержание ВПК не отличались от контрольных клеток. В эритроцитах, замороженных в присутствии DMSO и ПЭГ, после удаления КПА обнаружено снижение содержания спектрина и белка полосы 3 (для DMSO). Аналогичное заключение позволяет сделать также анализ данных электрофореза белков теней криоконсервированных клеток с удаленными КПА без обработки диамидом. Более того, при таких условиях проведения электрофореза выявлено снижение содержания белка полосы 8 при замораживании эритроцитов в присутствии ПЭГ, что может свидетельствовать об окислительном стрессе.
Для эффективной защиты клеток важно, чтобы сами КПА при инкубации и замораживании-оттаивании не вызывали дополнительных изменений структуры и функционирования белков. В частности, воздействие КПА на Са2+-регулирующие мембранные системы может иметь негативные последствия для стабильности криоконсервированных клеток в физиологических условиях. Подтверждением этого может быть ранее обнаруженное влияние глицерина и ПЭГ на Са2+-АТР-азу. В отличие от глицерина, действие которого на эритроциты сопровождается относительно небольшими изменениями активности Са2+-ATP-азы [38] и уровня внутриклеточного Са2+ [39], ПЭГ вызывает резкое падение ферментативной активности Са2+-насоса [28, 29] и 10-кратное увеличение уровня внутриклеточного Са2+ при инкубации эритроцитов даже в изотонической ПЭГ-содержащей среде [40]. Очевидно, что рост его концентрации в клетках при использовании гипертонического раствора ПЭГ будет еще более существенным, что позволит индуцировать эриптоз при их возвращении в физиологические условия, о чем свидетельствует экстернализация фосфатидилсерина у значительной доли криоконсервированных эритроцитов [41].
В заключение необходимо отметить, что из всех исследованных вариантов экзоцеллюлярных КПА только ПЭГ оказался способным обеспечивать структурную стабильность белков на этапе размораживания эритроцитов. Следовательно, разработка новой криопротекторной среды на основе этого экзоцеллюлярного соединения может иметь перспективу, учитывая незначительный уровень гемолиза, после размораживания клеток, и обеспечение стабильности эритроцитов, замороженных в глицеринсодержащем растворе, сочетанием эндо- и экзоцеллюлярного КПА (глицерин и маннитол соответственно). Кроме того, коррекция биохимических последствий влияния КПА на мембранно-цитоскелетный комплекс с помощью фармацевтических специфических ингибиторов, блокирующих вход Са2+ в клетки, и антиоксидантов может способствовать повышению стабильности эритроцитов, криоконсервированных в присутствии ПЭГ.
Список литературы
Gao D., Critser J.K. 2000. Mechanisms of cryoinjury in living cells. ILAR J. 41, 187–196.
Wolfe J., Bryant G. 1999. Freezing, drying, and/or vitrification of membrane – solute-water systems. Cryobiology. 39 (2), 103–129.
Ragoonanan V., Hubel A., Aksan A. 2010. Response of the cell membrane – cytoskeleton complex to osmotic and freeze/thaw stresses. Cryobiology. 61 (3), 335–344.
Zemlianskykh N.G. 2018. The effects of cryoprotective substances on the mechanical stability and geometric parameters of human erythrocytes. Biophysics. 63 (1), 66–76.
Scott K.L., Lecak J., Acker J.P. 2005. Biopreservation of red blood cells: past, present, and future. Transfus. Med. Rev. 19 (2), 127–142.
Babijchuk L.A., Zemlianskykh N.G. 2001. Optimization and advantages of washing-out method of erythrocyte cryopreservation with PEO-1500. Probl. Cryobiol. (1), 35–44.
Mohandas N., Evans E. 1994. Mechanical properties of the red cell membrane in relation to molecular structure and genetic defects. Annu. Rev. Biophys. Biomol. Struct. 23, 787–818.
Svetina S., Kuzman D., Waugh R.E., Ziherl P., Zeks B. 2004. The cooperative role of membrane skeleton and bilayer in the mechanical behaviour of red blood cells. Bioelectrochemistry. 62 (2), 107–113.
Becker P.S., Cohen C.M., Lux S.E. 1986. The effect of mild diamide oxidation on the structure and function of human erythrocyte spectrin. J. Biol. Chem. 261 (10), 4620–4628.
Gaffney B.J. 1985. Chemical and biochemical crosslinking of membrane components. Biochim. Biophys. Acta. 822 (3-4), 289–317.
Haest C.W., Kamp D., Plasa G., Deuticke B. 1977. Intra- and intermolecular cross-linking of membrane proteins in intact erythrocytes and ghosts by SH-oxidizing agents. Biochim. Biophys. Acta. 469 (2). 226–230.
Fischer T.M., Haest C.W., Stöhr M., Kamp D., Deuticke B. 1978. Selective alteration of erythrocyte deformabiliby by SH-reagents: Evidence for an involvement of spectrin in membrane shear elasticity. Biochim. Biophys. Acta. 510 (2), 270–282.
Green F.A., Jung C.Y., Cuppoletti J., Owens N. 1981. Hypertonic cryohemolysis and the cytoskeletal system. Biochim. Biophys. Acta. 648 (2), 225–230.
Johnson G.J., Allen D.W., Flynn T.P., Finkel B., White J.G. 1980. Decreased survival in vivo of diamide-incubated dog erythrocytes. A model of oxidant-induced hemolysis. J. Clin. Invest. 66 (5), 955–961.
Maeda N., Kon K., Imaizumi K., Sekiya M., Shiga T. 1983. Alteration of rheological properties of human erythrocytes by crosslinking of membrane proteins. Biochim. Biophys. Acta. 735 (1), 104–112.
Henkelman S., Noorman F., Badloe J.F., Lagerberg J.W. 2015. Utilization and quality of cryopreserved red blood cells in transfusion medicine. Vox Sang. 108 (2). 103–112.
Fairbanks G., Steck T.L., Wallach D.F. 1971. Electrophoretic analysis of the major polypeptides of the human erythrocyte membrane. Biochemistry. 10 (13), 2606–2617.
Lux 4th. S.E. 2016. Anatomy of the red cell membrane skeleton: Unanswered questions. Blood. 127 (2), 187–199.
Bennett V., Baines A.J. 2001. Spectrin and ankyrin-based pathways: Metazoan inventions for integrating cells into tissues. Physiol. Rev. 81 (3), 1353–1392.
Yan Y., Winograd E., Viel A., Cronin T., Harrison S.C., Branton D. 1993. Crystal structure of the repetitive segments of spectrin. Science. 262 (5142), 2027–2030.
Menhart N., Mitchell T., Lusitani D., Topouzian N., Fung L.W. 1996. Peptides with more than one 106-amino acid sequence motif are needed to mimic the structural stability of spectrin. J. Biol. Chem. 271 (48), 30410–30416.
An X., Guo X., Zhang X., Baines A.J., Debnath G., Moyo D., Salomao M., Bhasin N., Johnson C., Discher D., Gratzer W.B., Mohandas N. 2006. Conformational stabilities of the structural repeats of erythroid spectrin and their functional implications. J. Biol. Chem. 281 (15), 10527–10532.
An X., Gauthier E., Zhang X., Guo X., Anstee D.J., Mohandas N., Chasis J.A. 2008. Adhesive activity of Lu glycoproteins is regulated by interaction with spectrin. Blood. 112 (13), 5212–5218.
Ipsaro J.J., Mondragón A. 2010. Structural basis for spectrin recognition by ankyrin. Blood. 115 (20), 4093–4101.
Abriata L.A., Spiga E., Peraro M.D. 2016. Molecular effects of concentrated solutes on protein hydration, dynamics, and electrostatics. Biophys. J. 111 (4), 743–755.
Singbartl K., Langer R., Henrich A. 1998. Altered membrane skeleton of hydroxyethylstarch-cryopreserved human erythrocytes. Cryobiology. 36 (2), 115–123.
Gauthier E., Guo X., Mohandas N., An X. 2011. Phosphorylation-dependent perturbations of the 4.1R-associated multiprotein complex of the erythrocyte membrane. Biochemistry. 50 (21), 4561–4567.
Землянских Н.Г., Хоменко М.В. 2006. Активность Ca2+-ATP-азы эритроцитов человека в гипертонических средах при низкой и физиологической температуре. Биол. мембраны. 23 (6), 484–492.
Zemlianskykh N.G., Babiychuk L.A. 2017. The changes in erythrocyte Ca2+-ATPase activity induced by PEG-1500 and low temperatures. Cell Tissue Biol. 11 (2), 104–110.
Rinalducci S., Ferru E., Blasi B., Turrini F., Zolla L. 2012. Oxidative stress and caspase-mediated fragmentation of cytoplasmic domain of erythrocyte band 3 during blood storage. Blood Transfus. 10 (Suppl. 2), S55–S62.
Welbourn E.M., Wilson M.T., Yusof A., Metodiev M.V., Cooper C.E. 2017. The mechanism of formation, structure and physiological relevance of covalent hemoglobin attachment to the erythrocyte membrane. Free Radic. Biol. Med. 103, 95–106.
Kanias T., Acker J.P. 2010. Biopreservation of red blood cells – the struggle with hemoglobin oxidation. FEBS J. 277 (2), 343–356.
Sharma S., Punjabi V., Zingde S.M., Gokhale S.M. 2014. A comparative protein profile of mammalian erythrocyte membranes identified by mass spectrometry. J. Membr. Biol. 247 (11), 1181–1189.
Rhee S.G. 2016. Overview on peroxiredoxin. Mol. Cells. 39 (1), 1–5.
Peskin A.V., Dickerhof N., Poynton R.A., Paton L.N., Pace P.E., Hampton M.B., Winterbourn C.C. 2013. Hyperoxidation of peroxiredoxins 2 and 3: rate constants for the reactions of the sulfenic acid of the peroxidatic cysteine. J. Biol. Chem. 288 (20), 14170–14177.
Sies H. 2014. Role of metabolic H2O2 generation: redox signaling and oxidative stress. J. Biol. Chem. 289 (13), 8735–8741.
Jang H.H., Lee K.O., Chi Y.H., Jung B.G., Park S.K., Park J.H., Lee J.R., Lee S.S., Moon J.C., Yun J.W., Choi Y.O., Kim W.Y., Kang J.S., Cheong G.W., Yun D.J., Rhee S.G., Cho M.J., Lee S.Y. 2004. Two enzymes in one; two yeast peroxiredoxins display oxidative stress-dependent switching from a peroxidase to a molecular chaperone function. Cell. 117 (5), 625–635.
Kofanova O.A., Zemlyanskikh N.G., Ivanova L., Bernhardt I. 2008. Changes in the intracellular Ca2+ content in human red blood cells in the presence of glycerol. Bioelectrochemistry. 73 (2), 151–154.
Zemlyanskikh N.G., Kofanova O.A. 2006. Modulation of human erythrocyte Ca2+-ATPase activity by glycerol: the role of calmodulin. Biochemistry (Mosc.). 71 (8), 900–905.
Kucherenko Y.V., Bernhardt I. 2006. The study of Ca2+ influx in human erythrocytes in isotonic polyethylene (glycol) 1500 (PEG-1500) and sucrose media. Ukr. Biokhim. Zh. 78 (6), 46–52.
Zemlianskykh N.G., Babiychuk L.A. 2015. Cryopreservation in presence of PEG-1500 affects erythrocyte surface characteristics. Probl. Cryobiol. Cryomed. 25 (2), 104–113.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии