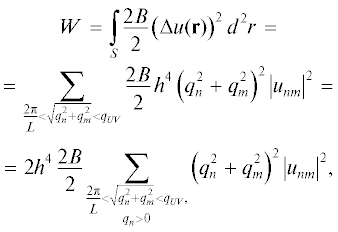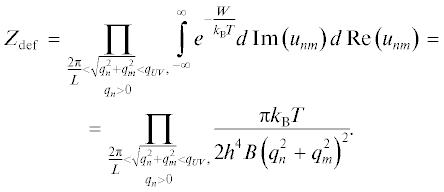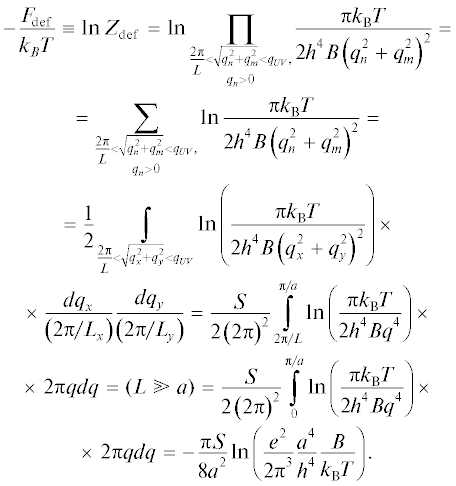Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 3, стр. 184-191
Нормальные флуктуации формы биологических мембран как фактор сопряжения упорядоченных монослойных доменов
Т. Р. Галимзянов a, b, М. А. Калуцкий a, b, О. В. Кондрашов a, c, К. В. Пинигин a, c, Р. Ю. Молотковский a, П. И. Кузьмин a, О. В. Батищев a, c, С. А. Акимов a, b, *
a Институт физической химии и электрохимии им. А. Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, стр. 5, Россия
b Национальный исследовательский технологический университет “МИСиС”
119049 Москва, Ленинский просп., 4, Россия
c Московский физико-технический институт (государственный университет)
141700 Московская обл., г. Долгопрудный, Институтский пер., 9, Россия
* E-mail: akimov@misis.ru
Поступила в редакцию 09.02.2019
После доработки 14.02.2019
Принята к публикации 15.02.2019
Аннотация
Считается, что разделение липидного матрикса биологических мембран на упорядоченную и неупорядоченную фазы играет важную роль в латеральном распределении белков и трансмембранной передаче клеточных сигналов. В модельных липидных мембранах с симметричным составом по монослоям такое фазовое разделение всегда приводит к формированию бислойных доменов. Однако липидный состав внешнего и внутреннего монослоев плазматических мембран клеток различен, т.е. эти мембраны асимметричны. Механизм сопряжения монослойных доменов в бислойные структуры в клетках до сих пор остается невыясненным. Упорядоченный липидный домен толще окружающей мембраны, вследствие чего на его границе возникают упругие деформации. Упругая часть граничной энергии оказывается минимальной, когда монослойные домены располагаются один над другим. Тем не менее, этой движущей силы оказывается недостаточно для обеспечения сопряжения доменов: при некоторой доле площади мембраны, занимаемой доменами, упругая энергия может достигать минимума при антисимметричных конфигурациях (упорядоченный домен в верхнем монослое сопрягается с неупорядоченным монослоем окружающей мембраны). В качестве альтернативного фактора сопряжения мы рассмотрели тепловые изгибные флуктуации формы мембраны. Проведенный нами теоретический анализ упругих деформаций в асимметричном по составу монослоев липидном бислое показывает, что более жесткие липидные домены имеют тенденцию распределяться в области с меньшей кривизной монослоя; эти области естественным образом совпадают в противоположных монослоях. Таким образом, сопряжение упорядоченных доменов в разных монослоях обеспечивается их большей изгибной жесткостью по сравнению с окружающей мембраной. Одновременно большая упорядоченность приводит к латеральной конденсации: уменьшению средней площади, приходящейся на липидную молекулу. Различие в площади на молекулу липида в сосуществующих фазах мембраны, напротив, стремится разъединить бислойные домены на их монослойные составляющие части. Для количественной оценки энергии сопряжения упорядоченных доменов необходимо учитывать оба этих эффекта.
ВВЕДЕНИЕ
Клеточные мембраны крайне латерально неоднородны. Различными методами установлено, что в них существуют липид-белковые домены, или кластеры, состав которых значительно отличается от среднего состава клеточной мембраны. Такие домены, обогащенные сфингомиелином, иногда называются “рафтами” [1]. По-видимому, они играют существенную роль в передаче клеточных сигналов [2–4], апоптозе [5–7], эндоцитозе [1] и т.д. В настоящее время имеются довольно противоречивые сведения о характерном времени жизни таких доменов, их локализации с различными белками, а также липидном составе [8–12]. Трудность изучения доменов in vivo связана с их чрезвычайно малым размером (<200 нм) [9, 11], меньшим дифракционного предела видимого света. Это приводит к тому, что практически все экспериментальные данные о свойствах доменов в клеточных мембранах являются в большей или меньшей степени косвенными. В искусственных мембранах, содержащих основные липидные компоненты внешнего монослоя плазматической мембраны, при понижении температуры могут быть сформированы липидные домены микронных размеров [12–15]. Эти домены используются в качестве модели доменов клеточных мембран. В таких модельных системах было установлено, что липиды в доменах находятся в жидко-упорядоченном (Lo) состоянии, притом, что окружающая мембрана жидко-неупорядоченная (Ld).
В бислойных системах упорядоченные домены в противоположных монослоях практически всегда располагаются один над другим [12–15]. О природе сил, ответственных за сопряжение монослойных доменов в бислойные структуры, имеется несколько гипотез. В работах [16, 17] предполагалось, что сопряжение происходит за счет трансбислойной димеризации холестерина. Однако в более поздних работах показано, что жидко-упорядоченные домены необязательно обогащены холестерином по сравнению с окружающей мембраной [10, 11], и его трансбислойная димеризация не может приводить к сопряжению доменов. Высказывались предположения, что в клеточных мембранах сопряжение доменов может быть связано с наличием трансмембранных белков, но это не объясняет бислойность доменов в модельных мембранах, не содержащих белки. В подавляющем большинстве работ эффективное трансбислойное отталкивание жидко-упорядоченной и жидко-неупорядоченной фаз просто постулируется без указания его физических причин [18, 19].
Недавно нами был предложен возможный механизм сопряжения монослойных доменов, связанный с так называемым гидрофобным несоответствием [20, 21]. Экспериментально показано, что толщина бислоя Lo-фазы на 0.5–2 нм превосходит толщину Ld мембраны [22, 23]. Если бы сосуществующие фазы мембраны оставались плоскими и однородными вплоть до их границы, на границе был бы скачок толщины бислоя амплитудой 0.5–2 нм, обладающий высокой энергией вследствие неизбежного экспонирования гидрофобной части мембраны в воду. Предполагается, что на межфазной границе возникают упругие деформации, направленные на сглаживание такого скачка толщины. Показано, что энергия деформаций минимальна, если домены находятся не точно один над другим, а их границы сдвинуты друг относительно друга на несколько нанометров [20, 21]. Такой равновесный сдвиг границ трудно наблюдать экспериментально, однако возможность его существования продемонстрирована в ряде работ методами молекулярной динамики [24–26]. При этом удаление границ монослойных доменов на большие расстояния друг от друга энергетически невыгодно. Таким образом, упругие деформации мембраны вблизи границы монослойных доменов могут обеспечивать их сопряжение в бислойную структуру с точностью до небольшого относительного сдвига границ.
В серии работ [18, 19] показано, что за счет сложной пространственной организации фаз Lo и Ld можно добиться того, что на большей части площади мембраны “симметричная” бислойная конфигурация Lo-фазы будет менее энергетически выгодна, чем “антисимметричная” конфигурация, в которой бислой состоит из монослоя Lo-фазы и монослоя Ld-фазы. Согласно нашим оценкам, при физически разумных значениях параметров системы это может происходить в диапазоне площади Lo-фазы от 47 до 53% от общей площади мембраны [27]. В то же время, насколько нам известно, экспериментально наблюдаемые домены Lo-фазы бислойны во всем диапазоне их относительных площадей. Переход в “антисимметричную” конфигурацию связан с масштабными перестройками мембраны и, в принципе, может быть затруднен кинетически. Однако критерий термодинамической стабильности при любой доли площади мембраны, занимаемой Lo-фазой, предполагает наличие альтернативного механизма сопряжения, не связанного с гидрофобным несоответствием монослоев Lo- и Ld-фаз на границе доменов.
В настоящей работе предложен механизм сопряжения монослойных доменов, основанный на различии упругих свойств Lo- и Ld-фаз, а именно, на различии их модулей изгиба. В ряде работ экспериментально установлено, что изгибная жесткость Lo-фазы в 2–5 раз превосходит изгибную жесткость Ld-фазы [28, 29]. Это означает, что изгибные тепловые флуктуации формы мембраны будут подавлены в области Lo-фазы. Стремление системы максимизировать площадь, доступную флуктуациям, должно приводить к совмещению монослойных доменов Lo-фазы, расположенных в разных монослоях, в бислойную структуру. Предлагаемая модель основана на простых физических принципах и не ограничена особенностями структуры границы упорядоченных доменов.
Ранее мы рассмотрели такой механизм сопряжения упорядоченных монослойных доменов в симметричной по липидному составу мембране, в которой физические свойства упорядоченных доменов одинаковы в обоих монослоях [30]. Однако два монослоя биологических мембран, как правило, имеют различный липидный состав [31]. В частности, наружный монослой плазматической мембраны обогащен сфингомиелином, в нем преобладают фосфолипиды с насыщенными углеводородными цепями. Во внутреннем монослое больше липидов с ненасыщенными углеводородными цепями и отрицательно заряженных липидов [31]. Соответственно, предположение об одинаковости свойств упорядоченных доменов, расположенных в различных монослоях биологических мембран, по-видимому, не выполняется. В настоящей работе мы обобщили разработанную ранее модель на случай асимметричной по липидному составу мембраны.
ПОСТАНОВКА И РЕШЕНИЕ ЗАДАЧИ
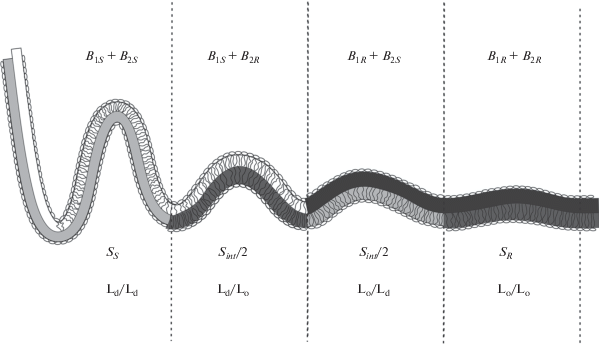
Рассмотрим асимметричную по составу мембрану общей площади S0, каждый монослой которой содержит NR доменов приблизительно одинаковой площади sR каждый, так что при трансбислойном совмещении монослойных доменов в мембране может образоваться всего NR бислойных доменов. Площадь Lo-фазы в каждом монослое равна S0R = NRsR; предполагается, что S0R меньше, чем половина общей площади мембраны S0, т.е. S0R < S0/2. Это условие важно лишь для простоты математических выкладок, однако расчеты легко обобщаются и на обратный случай. Площадь Ld-фазы в каждом монослое, соответственно, равна S0S = S0 – NRsR. Пусть часть монослойных Lo-доменов перекрывается с Ld-фазой в противоположном монослое. Обозначим количество таких перекрытий Nint, среднюю площадь каждого перекрытия – sint. Таким образом, общая площадь всех перекрывающихся участков Lo/Ld равна Sint = Nintsint (рис. 1). Мы будем рассматривать мембрану в приближении Хельфриха [32], согласно которому мембрана считается бесконечно тонкой пленкой, характеризующейся модулем изгиба и не имеющей внутренней структуры. Асимметрия липидного состава мембраны по монослоям моделируется различными упругими характеристиками монослоев: модули изгиба Lo-фазы в верхнем и нижнем монослоях обозначим B1R и B2R соответственно; модули изгиба верхнего и нижнего монослоев Ld-фазы обозначим B1S и B2S. В рамках приближения Хельфриха модуль изгиба бислоя равен сумме модулей изгиба составляющих его монослоев. Таким образом, в рассматриваемой мембране имеются участки со следующими модулями упругости (рис. 1): 1) 2BR = = B1R + B2R в области совмещенных монослойных доменов Lo-фазы (площадь такой области SR = = S0R – Sint/2); 2) 2Bs = B1S + B2S в области совмещенных монослоев Ld-фазы (площадь этой области SS = S0 – S0R – Sint/2); 3) 2B1int = B1R + B2S в области, где бислой состоит из верхнего монослоя Lo-фазы и нижнего монослоя Ld-фазы (площадь области Sint/2); 4) 2B2int = B2R + B1S в области, где бислой состоит из нижнего монослоя Lo-фазы и верхнего монослоя Ld-фазы (площадь области Sint/2). Для общности введем также феноменологическое взаимодействие между монослоями Lo- и Ld-фаз, Lo и Lo, Ld и Ld в составе бислоя.
Рис. 1.
Возможные комбинации монослоев упорядоченной и неупорядоченной фаз в асимметричной липидной мембране. Lo- и Ld-домены обладают различной изгибной жесткостью в верхнем и нижнем монослоях мембраны. Всего возможны четыре величины эффективного модуля изгиба бислоя; слева направо: (1) 2Bs = B1S + B2S в области совмещенных монослоев Ld-фазы (площадь этой области SS); (2) 2B2int = B1S + B2R в области, где бислой состоит из нижнего монослоя Lo-фазы и верхнего монослоя Ld-фазы (площадь области Sint/2); (3) 2B1int = B1R + B2S в области, где бислой состоит из верхнего монослоя Lo-фазы и нижнего монослоя Ld-фазы (площадь области Sint/2); (4) 2BR = B1R + B2R в области совмещенных монослойных доменов Lo-фазы (площадь такой области SR).
Введем декартову систему координат так, чтобы в основном состоянии мембрана совпадала с плоскостью xy (z = 0). Форма возмущенной мембраны описывается функцией u(x, y) – отклонением формы мембраны от основного состояния. В приближении Хельфриха деформации считаются малыми [32], хотя для липидных мембран линейная теория упругости хорошо работает и при больших деформациях [33–38]. Полная энергия системы с точностью до слагаемых второго порядка по деформациям запишется следующим образом:
(1)
$\begin{gathered} {{W}_{{{\text{total}}}}} = \int\limits_{{{S}_{R}}} {\frac{{2{{B}_{R}}}}{2}{{{\left( {\Delta u} \right)}}^{2}}dS} + \int\limits_{{{S}_{S}}} {\frac{{2{{B}_{S}}}}{2}{{{\left( {\Delta u} \right)}}^{2}}} dS + \\ + \,\,\int\limits_{{{S}_{{{\text{int}}}}}/2} {\frac{{2{{B}_{{{\text{1int}}}}}}}{2}{{{\left( {\Delta u} \right)}}^{2}}} dS\, + \,\int\limits_{{{\operatorname{S} }_{{{\text{int}}}}}/2} {\frac{{2{{B}_{{{\text{2int}}}}}}}{2}{{{\left( {\Delta u} \right)}}^{2}}dS} \, + \,{{S}_{{{\text{int}}}}}{{W}_{{{\text{int}}}}}, \\ \end{gathered} $Разложим функцию отклонения формы мембраны от плоского состояния u(r) в ряд Фурье по координатам x и y: $u({\mathbf{r}}) = \frac{{{{h}^{2}}}}{{\sqrt S }}\sum\limits_{}^{} {\left( {{{u}_{{nm}}}} \right){{e}^{{ - i{{{\mathbf{q}}}_{{nm}}}{\mathbf{r}}}}}} $, где h – некоторый пространственный масштаб; qmn – вектор с координатами $\left( {\frac{{2\pi n}}{{{{L}_{x}}}},\frac{{2\pi m}}{{{{L}_{y}}}}} \right)$; Lx, Ly – размер рассматриваемой области мембраны по направлениям x и y соответственно; S = LxLy – площадь рассматриваемой области, а сумма берется по всем векторам qmn, таким, что $\left| {{{q}_{{nm}}}} \right| < {{q}_{{UV}}} = \frac{\pi }{a}$, где a – характерный размер, определяющий ультрафиолетовый предел волновых векторов, т.е. задающий максимально возможный волновой вектор, при котором еще можно использовать для мембраны модель сплошной среды. В используемых приближениях функционал деформационной энергии рассматриваемой области в представлении Фурье запишется в следующем виде:
где qn = $\frac{{2\pi n}}{{{{L}_{x}}}}$, qm = $\frac{{2\pi m}}{{{{L}_{y}}}}$; здесь и ниже B = BS, BR, B1int, B2int. Во втором равенстве учтено, что функция u(x, y) – вещественная. Для нахождения полной площади перекрытия Lo- и Ld-фаз необходимо вычислить среднее по всем возможным формам поверхности мембраны и площадям перекрытия фаз:(3)
$\left\langle {{{S}_{{{\text{int}}}}}} \right\rangle = \frac{{\int\limits_0^{\min \{ 2{{S}_{{0R}}},2{{S}_{{0S}}}\} } {{{e}^{{ - W/{{k}_{{\text{B}}}}T}}}{{s}_{{{\text{int}}}}}Du({\mathbf{r}})d{{s}_{{{\text{int}}}}}} }}{{\int\limits_0^{\min \{ 2{{S}_{{0R}}},2{{S}_{{0S}}}\} } {{{e}^{{ - W/{{k}_{{\text{B}}}}T}}}Du({\mathbf{r}})d{{s}_{{{\text{int}}}}}} }},$Двойное произведение можно вычислить, взяв от него логарифм, перейдя от произведения под логарифмом к суммированию соответствующих логарифмов, и затем от суммирования к интегрированию. Проделав это, получим эффективную свободную энергию флуктуаций мембраны:
Заметим, что параметр a имеет порядок латерального размера липидной молекулы, и a2 пропорционально средней площади молекулы липида в соответствующей области мембраны. Поэтому мы будем различать этот параметр в различных областях мембраны, обозначая его соответствующими индексами. Закон сохранения полного числа частиц (липидных молекул) накладывает следующее ограничение:
(6)
$\frac{1}{{a_{R}^{2}}} + \frac{1}{{a_{S}^{2}}} = \frac{1}{{a_{{{\text{1int}}}}^{2}}} + \frac{1}{{a_{{{\text{2int}}}}^{2}}}.$Для простоты записей введем некоторый средний характерный латеральный размер липидный молекулы a0 и будем считать, что a1int = a2int = aint. Перенормируем модули упругости следующим образом: $\tilde {B} = {{k}_{{\text{B}}}}T{{\left( {\frac{{2{{\pi }^{3}}}}{{{{e}^{2}}}}\frac{{{{h}^{4}}}}{{{{a}^{4}}}}\frac{B}{{{{k}_{{\text{B}}}}T}}} \right)}^{{\frac{{\pi a_{0}^{2}}}{{8{{a}^{2}}}}}}}$ для каждой из областей. Выражение (5) позволяет записать энергию системы Wtotal в виде:
(7)
$\begin{gathered} {{W}_{{{\text{total}}}}} = \alpha - \beta {{k}_{{\text{B}}}}T\frac{{{{S}_{{{\text{int}}}}}}}{{2a_{0}^{2}}},\quad {\text{г д е }} \\ \beta {{k}_{{\text{B}}}}T = - 2a_{0}^{2}{{W}_{{{\text{int}}}}} + {{k}_{{\text{B}}}}T\ln \left( {\frac{{{{{\tilde {B}}}_{r}}{{{\tilde {B}}}_{s}}}}{{{{{\tilde {B}}}_{{{\text{1int}}}}}{{{\tilde {B}}}_{{{\text{2int}}}}}}}} \right). \\ \end{gathered} $Параметр α не входит в итоговое выражение для площади перекрытия монослоев Lo- и Ld-фаз Sint, поэтому здесь в явном виде не приводится. Уравнение (7) позволяет вычислить среднюю площадь перекрытия монослоев Lo- и Ld-фаз в явном виде.
(8)
$\begin{gathered} \left\langle {{{S}_{{{\text{int}}}}}} \right\rangle = \frac{{\int\limits_0^{\min \{ 2{{S}_{{0R}}},2{{S}_{{0S}}}\} } {{{S}_{{{\text{int}}}}}{{e}^{{ - {{W}_{{{\text{total}}}}}{\text{/}}({{k}_{{\text{B}}}}T)}}}d{{S}_{{{\text{int}}}}}} }}{{\int\limits_0^{\min \{ 2{{S}_{{0R}}},2{{S}_{{0S}}}\} } {{{e}^{{ - {{W}_{{{\text{total}}}}}{\text{/}}({{k}_{{\text{B}}}}T)}}}d{{S}_{{{\text{int}}}}}} }} = \\ = \frac{{\min \{ 2{{S}_{{0R}}},2{{S}_{{0S}}}\} }}{{1 - {{e}^{{ - \beta \min \{ 2{{S}_{{0R}}},2{{S}_{{0S}}}\} {\text{/}}2a_{0}^{2}}}}}} - \frac{{2a_{0}^{2}}}{\beta }. \\ \end{gathered} $Поскольку рассматриваются только макроскопические домены, то площадь домена, отнесенная к латеральной площади одной молекулы липида, является большой величиной, т.е. $\min \left\{ {{{S}_{{0R}}},{{S}_{{0R}}}} \right\}/{{a}^{2}} \gg 1$, и выражение (8) можно переписать в следующем виде:
т.е. при β < 0 перекрытие монослоев Lo- и Ld-фаз пренебрежимо мало по сравнению с площадью доменов (Sint ⪡ min{SR, SS}), а при β > 0, Lo- и Ld-фазы перекрываются полностью.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Приравнивая β нулю и используя условие сохранения числа частиц (6), мы окончательно находим критическую плотность энергии индуцированного взаимодействия W* монослоев Lo- и Ld-фаз, при которой домены будут существовать исключительно в бислойном состоянии:
(10)
$\begin{gathered} W{\text{*}} = - {{W}_{{{\text{int}}}}}\left( {\beta = 0} \right) = - \frac{{{{k}_{{\text{B}}}}T}}{{2a_{0}^{2}}}\ln \left( {\frac{{{{{\tilde {B}}}_{r}}{{{\tilde {B}}}_{s}}}}{{{{{\tilde {B}}}_{{{\text{1int}}}}}{{{\tilde {B}}}_{{{\text{2int}}}}}}}} \right) = \\ = - \frac{{{{k}_{{\text{B}}}}T}}{{2a_{0}^{2}}}\ln \left( {\frac{{{{{\left( {\frac{{a_{0}^{4}{{B}_{R}}}}{{a_{R}^{4}{{k}_{{\text{B}}}}T}}} \right)}}^{{\frac{{\pi a_{0}^{2}}}{{8a_{R}^{2}}}}}}{{{\left( {\frac{{a_{0}^{4}{{B}_{S}}}}{{a_{S}^{4}{{k}_{{\text{B}}}}T}}} \right)}}^{{\frac{{\pi a_{0}^{2}}}{{8a_{S}^{2}}}}}}}}{{{{{\left( {\frac{{a_{0}^{4}{{B}_{{{\text{1int}}}}}}}{{a_{{{\text{int}}}}^{4}{{k}_{{\text{B}}}}T}}} \right)}}^{{\frac{{\pi a_{0}^{2}}}{{8a_{{{\text{int}}}}^{2}}}}}}{{{\left( {\frac{{a_{0}^{4}{{B}_{{{\text{2int}}}}}}}{{a_{{{\text{int}}}}^{4}{{k}_{{\text{B}}}}T}}} \right)}}^{{\frac{{\pi a_{0}^{2}}}{{8a_{{{\text{int}}}}^{2}}}}}}}}} \right) \\ \end{gathered} $.В случае, когда упругие характеристики фаз одинаковы в противоположных монослоях (B1R = B2R = = BR, B1S = B2S = BS, a1R = a2R = a1S = a2S = a), из формулы (10) следует уточненный нами, полученный ранее результат [30]:
(11)
$W{\text{*}} = \frac{\pi }{{16}}\frac{{{{k}_{{\text{B}}}}T}}{{{{a}^{2}}}}\ln \left( {\frac{{{{{\left( {{{B}_{S}} + {{B}_{R}}} \right)}}^{2}}}}{{4{{B}_{R}}{{B}_{S}}}}} \right).$Выражение под логарифмом всегда больше единицы, поэтому W* > 0, и, следовательно, Wint < 0; это означает, что Lo- и Ld-фазы в противоположных монослоях отталкиваются, что эквивалентно эффективному притяжению доменов Lo-фазы в противоположных монослоях. В случае одинаковых параметров ультрафиолетовых пределов у всех фаз (a1R = a2R = a1S = a2S = a), получим выражение (10) в виде
(12)
$W* = \frac{\pi }{{16}}\frac{{{{k}_{{\text{B}}}}T}}{{{{a}^{2}}}}\ln \left( {\frac{{\left( {{{B}_{{1R}}} + {{B}_{{2S}}}} \right)\left( {{{B}_{{2R}}} + {{B}_{{1S}}}} \right)}}{{\left( {{{B}_{{1R}}} + {{B}_{{2R}}}} \right)\left( {{{B}_{{1S}}} + {{B}_{{2S}}}} \right)}}} \right).$Упорядоченная фаза в каждом из монослоев по своему определению имеет более высокий модуль изгиба, чем неупорядоченная фаза в том же монослое, т.е. B1R > B1S, B2R > B2S. Если считать, что разные фазы в противоположных монослоях лишь слабо напрямую взаимодействуют друг с другом, т.е. |Wint| ⪡ kBT, то β > 0, и Lo-домены всегда будут бислойными. Таким образом, при слабом прямом взаимодействии между монослоями в мембране не могут образовываться макроскопические области, в которых один монослой находится в жидко-упорядоченном, а другой – в жидко-неупорядоченном состоянии. Учет асимметричности липидного состава мембраны не приводит к качественному изменению критической плотности энергии взаимодействия, а лишь к количественному уточнению величины этой энергии.
Рассмотрим эффект различия параметров ультрафиолетовых пределов в различных областях мембраны. Для упрощения анализа положим модули изгиба монослоев всех фаз равными некоторой величине B. Тогда выражение (10) с учетом условия сохранения числа частиц (6) преобразуется к следующему виду:
(13)
$W{\text{*}} = - \frac{{\pi {{k}_{{\text{B}}}}T}}{4}\left( {\frac{1}{{a_{R}^{2}}}\ln \left( {\frac{{{{a}_{{{\text{int}}}}}}}{{{{a}_{R}}}}} \right) + \frac{1}{{a_{S}^{2}}}\ln \left( {\frac{{{{a}_{{{\text{int}}}}}}}{{{{a}_{S}}}}} \right)} \right).$Раскладывая выражение (13) в ряд по малой разности aR – aS, получим:
(14)
$W{\text{*}} = - \frac{{\pi {{k}_{{\text{B}}}}T}}{8}\frac{{{{{\left( {{{a}_{R}} - {{a}_{S}}} \right)}}^{2}}}}{{{{{\left( {\frac{{{{a}_{R}} + {{a}_{S}}}}{2}} \right)}}^{4}}}}.$Таким образом, видно, что из-за разности δ = aR – aS характерных размеров, определяющих ультрафиолетовые пределы в Lo- и Ld-фазах, могут возникать силы, направленные на разделение бислойных упорядоченных доменов на монослойные, т.е. различие параметров ультрафиолетовых пределов имеет обратный эффект по сравнению с разностью модулей изгиба монослоев упорядоченной и неупорядоченной фаз.
Таким образом, мы показали, что изгибные флуктуации формы мембраны индуцируют сопряжение монослойных жидко-упорядоченных доменов в бислойные структуры. Это связано с тем, что оба монослоя имеют почти одинаковую локальную кривизну при любых флуктуациях формы межмонослойной (средней) поверхности мембраны. Для минимизации полной энергии системы жидко-упорядоченные домены, имеющие большую изгибную жесткость, склонны распределяться в участки с наименьшей кривизной, совпадающие в противоположных монослоях. Это приводит к тому, что монослойные Lo-домены, отличающиеся по изгибной жесткости от фоновой Ld-фазы, сопрягаются друг с другом в противоположных монослоях. Движущая сила сопряжения – различие изгибных жесткостей участков мембраны – является общей, в том смысле, что проявляется независимо от природы возникновения доменов, их состава и т.д. Предложенный механизм позволяет также объяснить сопряжение полипептидов, адсорбированных на разных поверхностях мембраны [39]. Однако существенное различие площади на молекулу для липидов, составляющих Lo- и Ld-фазу, может индуцировать обратное разделение бислойных доменов на их монослойные части. Таким образом, в реальных системах оба эти фактора необходимо учитывать при количественной оценке энергии сопряжения монослойных доменов.
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации, а также при частичной финансовой поддержке Российского фонда фундаментальных исследований (гранты № 17-00-00488 и № 18-04-01363).
Список литературы
Simons K., Ikonen E. 1997. Functional rafts in cell membranes. Nature. 387, 569–572.
Bocharov E.V., Mineev K.S., Pavlov K.V., Akimov S.A., Kuznetsov A.S., Efremov R.G., Arseniev A.S. 2017. Helix-helix interactions in membrane domains of bitopic proteins: Specificity and role of lipid environment. Biochim. Biophys. Acta. 1859, 561–576.
Kabouridis P.S., Janzen J., Magee A.L., Ley S.C. 2000. Cholesterol depletion disrupts lipid rafts and modulates the activity of multiple signaling pathways in T lymphocytes. Eur. J. Immunol. 30, 954–963.
Grassme H., Jekle A., Riehle A., Schwarz H., Berger J., Sandho K., Kolesnick R., Gulbins E. 2001. CD95 signaling via ceramide rich membrane rafts. J. Biol. Chem. 276, 20589–20596.
Burek C., Roth J., Koch H.G., Harzer K., Los M., Shlutze-Osthoff K. 2001. The role of ceramide in receptor- and stress-induced apoptosis studied in acidic ceramidase Farber desease cells. Oncogene. 20, 6493–6502.
Hueber A.O., Bernard A.M., Herincs Z., Couzinet A., He H.T. 2002. An essential role for membrane rafts in the initiation of Fas/CD95-triggered cell death in mouse thymocytes. EMBO Rep. 3, 190–196.
Молотковская И.М., Свирщевская Е.В., Литвинов И.С., Михалев И.И., Дятловицкая Э.В., Молотковский Ю.Г., Бергельсон Л.Д. 1992. Исследование иммуносупрессорных свойств гликосфинголипидов. Изучение взаимодействия интерлейкина-2 с ганглиозидами на клетках и в модельных системах. Биол. мембраны. 9, 143–151.
Honerkamp-Smith A.R., Cicuta P., Collins M.D., Veatch S.L., den Nijs M., Schick M., Keller S.L. 2008. Line tensions, correlation lengths, and critical exponents in lipid membranes near critical points. Biophys. J. 95, 236–246.
Lillemeier B.F., Pfeiffer J.R., Surviladze Z., Wilson B.S., Davis M.M. 2006. Plasma membrane-associated proteins are clustered into islands attached to the cytoskeleton. Proc. Natl. Acad. Sci. USA. 103, 18992–18997.
Ayuyan A.G., Cohen F.S. 2008. Raft composition at physiological temperature and pH in the absence of detergents. Biophys. J. 94, 2654–2666.
Frisz J.F., Klitzing H.A., Lou K., Hutcheon I.D., Weber P.K., Zimmerberg J., Kraft M.L. 2013. Sphingolipid domains in the plasma membranes of fibroblasts are not enriched with cholesterol. J. Biol. Chem. 288, 16 855–16 861.
Veatch S.L., Polozov I.V., Gawrisch K., Keller S.L. 2004. Liquid domains in vesicles investigated by NMR and fluorescence microscopy. Biophys. J. 86, 2910–2922.
Samsonov A.V., Mihalyov I., Cohen F.S. 2001.Characterization of cholesterol-sphingomyelin domains and their dynamics in bilayer membranes. Biophys. J. 81, 1486–1500.
Baumgart T., Hess S.T., Webb W.W. 2003. Imaging coexisting fluid domains in biomembrane models coupling curvature and line tension. Nature. 425, 821–824.
Ayuyan A.G., Cohen F.S. 2006. Lipid peroxides promote large rafts: Effects of excitation of probes in fluorescence microscopy and electrochemical reactions during vesicle formation. Biophys. J. 91, 2172–2183.
Rukmini R., Rawat S.S., Biswas S.C., Chattopadhyay A. 2001. Cholesterol organization in membranes at low concentrations: Effects of curvature stress and membrane thickness. Biophys. J. 81, 2122–2134.
Harris J.S., Epps D.E., Davio S.R., Kezdy F.J. 1995. Evidence for transbilayer, tail-to-tail cholesterol dimers in dipalmitoylglycerophosphocholine liposomes. Biochemistry 34, 3851–3857.
Williamson J.J., Olmsted P.D. 2015. Registered and antiregistered phase separation of mixed amphiphilic bilayers. Biophys. J. 108, 1963–1976.
Williamson J.J., Olmsted P.D. 2015. Nucleation of symmetric domains in the coupled leaflets of a bilayer. Soft Matter. 11, 8948–8959.
Галимзянов Т.Р., Молотковский Р.Ю., Кузьмин П.И., Акимов С.А. 2011. Стабилизация бислойной структуры рафтов за счет упругих деформаций мембраны. Биол. мембраны. 28, 307–314.
Galimzyanov T.R., Molotkovsky R.J., Bozdaganyan M.E., Cohen F.S., Pohl P., Akimov S.A. 2015. Elastic membrane deformations govern interleaflet coupling of lipid-ordered domains. Phys. Rev. Lett. 115, 088101.
Rinia H.A., Snel M.M., van der Eerden J.P., de Kruijff B. 2001. Visualizing detergent resistant domains in model membranes with atomic force microscopy. FEBS Lett. 501, 92–96.
Galimzyanov T.R., Lyushnyak A.S., Aleksandrova V.V., Shilova L.A., Mikhalyov I.I., Molotkovskaya I.M., Akimov S.A., Batishchev O.V. 2017. Line activity of ganglioside GM1 regulates the raft size distribution in a cholesterol-dependent manner. Langmuir. 33, 3517–3524.
Risselada H.J., Marrink S.J. 2008. The molecular face of lipid rafts in model membranes. Proc. Natl. Acad. Sci. USA. 105, 17 367–17 372.
Perlmutter J.D., Sachs J.N. 2011. Interleaflet interaction and asymmetry in phase separated lipid bilayers: Molecular dynamics simulations. J. Am. Chem. Soc. 133, 6563–6577.
Pantano D.A., Moore P.B., Klein M.L., Discher D.E. 2011. Raft registration across bilayers in a molecularly detailed model. Soft Matter. 7, 8182–8191.
Galimzyanov T.R., Molotkovsky R.J., Cohen F.S., Pohl P., Akimov S.A. 2016. Comment on “Elastic membrane deformations govern interleaflet coupling of lipid-ordered domains” Reply. Phys. Rev. Lett. 116, 079 802.
Pan J., Tristram-Nagle S., Nagle J.F. 2009. Effect of cholesterol on structural and mechanical properties of membranes depends on lipid chain saturation. Phys. Rev. E. 80, 021 931.
Baumgart T., Das S., Webb W.W., Jenkins J.T. 2005. Membrane elasticity in giant vesicles with fluid phase coexistence. Biophys. J. 89, 1067–1080.
Galimzyanov T.R., Kuzmin P.I., Pohl P., Akimov S.A. 2017. Undulations drive domain registration from the two membrane leaflets. Biophys. J. 112, 339–345.
Ingólfsson H.I., Melo M.N., Van Eerden F.J., Arnarez C., Lopez C.A., Wassenaar T.A., Periole X., de Vries A.H., Tieleman D.P., Marrink S.J. 2014. Lipid organization of the plasma membrane. J. Am. Chem. Soc. 136, 14 554–14 559.
Helfrich W. 1973. Elastic properties of lipid bilayers: Theory and possible experiments. Z. Naturforsch. C 28, 693–703.
Harmandaris V.A., Deserno M. 2006. A novel method for measuring the bending rigidity of model lipid membranes by simulating tethers. J. Chem. Phys. 125, 204 905.
Башкиров П.В., Чекашкина К.В., Акимов С.А., Кузьмин П.И., Фролов В.А. 2011. Изменение состава липидной мембраны при сильном изгибе. Биол. мембраны. 28, 145–152.
Akimov S.A., Volynsky P.E., Galimzyanov T.R., Kuzmin P.I., Pavlov K.V., Batishchev O.V. 2017. Pore formation in lipid membrane I: Continuous reversible trajectory from intact bilayer through hydrophobic defect to transversal pore. Sci. Rep. 7, 12152.
Akimov S.A., Volynsky P.E., Galimzyanov T.R., Kuzmin P.I., Pavlov K.V., Batishchev O.V. 2017. Pore formation in lipid membrane II: Energy landscape under external stress. Sci. Rep. 7, P. 12509.
Акимов С.А., Александрова В.В., Галимзянов Т.Р., Башкиров П.В., Батищев О.В. 2017. Механизм формирования пор в мембранах из стеароилолеоилфосфатидилхолина под действием латерального натяжения. Биол. мембраны. 34, 270–283.
Leikin S., Kozlov M.M., Fuller N.L., Rand R.P. 1996. Measured effects of diacylglycerol on structural and elastic properties of phospholipid membranes. Biophys. J. 71, 2623–2632.
Horner A., Antonenko Y.N., Pohl P. 2009. Coupled diffusion of peripherally bound peptides along the outer and inner membrane leaflets. Biophys. J. 96, 2689–2695.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии