Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 3, стр. 218-228
Анализ связи изменений фотохимического индекса отражения (PRI) и закисления люмена хлоропластов листьев гороха и герани в условиях кратковременного освещения
Е. М. Сухова a, Л. М. Юдина a, В. А. Воденеев a, В. С. Сухов a, *
a Нижегородский государственный университет им. Н.И. Лобачевского
603950 Нижний Новгород, просп. Гагарина, 23, Россия
* E-mail: vssuh@mail.ru
Поступила в редакцию 08.02.2019
После доработки 18.02.2019
Принята к публикации 19.02.2019
Аннотация
Измерение фотохимического индекса отражения (photochemical reflectance index, PRI) является простым и неинвазивным методом оценки фотосинтетических процессов у высших растений. В то же время связь между фотосинтетическими показателями и PRI может существенно модифицироваться на начальных этапах освещения; таким образом, исследование механизмов развития PRI после начала освещения является весьма актуальной задачей. Целью настоящей работы стал анализ связи между закислением люмена хлоропластов, для оценки которого использовали возрастание абсорбции света листовой пластинкой на длине волны 535 нм (light scattering, LS), и изменениями PRI в условиях кратковременного освещения у листьев гороха и герани. Было показано, что освещение вызывало возрастание LS и снижение PRI у обоих исследованных объектов. При этом достоверные различия были выявлены для амплитуды снижения фотохимического индекса отражения, в то время как отличия абсолютных величин PRI на различных этапах освещения не имели достоверного характера. Корреляционный анализ показал, что возрастание LS в течение первых 2 мин освещения, отражающее светоиндуцированное закисление люмена хлоропластов, было достоверно связано с амплитудой снижения PRI; в то же время на более поздних этапах освещения такая связь отсутствовала. Дополнительный анализ, проведенный на герани, показал, что прекращение освещения вызывало противоположенную динамику: снижение LS сопровождалось увеличением PRI. Полученные результаты показывают, что изменения PRI в первые минуты после начала освещения, по-видимому, обусловлены закислением люмена хлоропластов.
ВВЕДЕНИЕ
Спектральные индексы представляют собой показатели, рассчитанные на основе интенсивностей отраженного света на определенных длинах волн, которые широко используются в дистанционном мониторинге состояния растений. Важную роль среди них играет фотохимический индекс отражения (photochemical reflectance index, PRI), который традиционно рассчитывается на основе уравнения (1) [1–4]:
где R531 и R570 – интенсивности отраженного света на длинах волн 531 и 570 нм. В основе этого метода лежит снижение отражения света на 531 нм в условиях светового стресса. Предполагается, что оно связано с рН-зависимыми процессами: деэпоксидацией виолоксантина в ходе ксантофиллового цикла [1] и, возможно, сжатием хлоропластов [3]. Кроме того, в случае длительного действия факторов окружающей среды [4–7] и, вероятно, для различных растений, PRI может также зависеть от величины общего пула хлорофиллов и пигментов ксантофиллового цикла.
Связь PRI со световым стрессом позволяет предположить, что этот показатель должен сильно коррелировать с нефотохимическим тушением флуоресценции хлорофилла (NPQ), которое является одним из ключевых ответов фотосинтеза на неблагоприятные воздействия и также связано с деэпоксидацией виолоксантина [8, 9]. Это означает, что PRI может, потенциально, использоваться для дистанционного мониторинга NPQ. Действительно, в ряде работ показано, что снижение PRI может быть тесно связано с увеличением NPQ в условиях непосредственного действия стрессоров на растение [10–12] и при развитии связанных с электрическими сигналами системных фотосинтетических ответов [13]. В то же время мета-анализ больших массивов экспериментальных работ показывает, что величина связи NPQ и PRI существенно варьирует в различных исследованиях и сильно зависит от условий измерения, включая пространственный масштаб регистрации, тип освещения, выраженность светового стресса и другие факторы [3, 4].
В частности, ранее нами было показано [14], что на начальных этапах освещения динамика возрастания NPQ слабо связана с динамикой снижения PRI. Одной из возможных причин [14] такого эффекта может быть быстрая индукция NPQ в условиях закисления люмена хлоропластов. Такая индукция способна развиваться непосредственно за счет протонирования белков фотосинтетического аппарата, в то время как деэпоксидация виолоксантина в ходе ксантофиллового цикла не является необходимым условием для ее развития [9]. С другой стороны, в отдельных работах [10] показано, что светоиндуцированные изменения градиента рН могут приводить к быстрым изменениям PRI; это означает, что PRI способен реагировать на быстрые изменения рН в хлоропласте и несоответствие между изменениями NPQ и фотохимического индекса отражения может иметь другую природу. Таким образом, вопрос о связи закисления люмена и снижения PRI на ранних этапах освещения является весьма актуальным для выявления условий использования PRI для мониторинга NPQ.
Анализ связи индуцированного светом закисления люмена хлоропластов и PRI требует использования методов, позволяющих быстро и прижизненно оценить динамику изменений рН люмена. Одним из таких методов является измерение изменений светорассеяния в диапазоне длин волн 530–546 нм на временном интервале от нескольких секунд до нескольких минут после включения/выключения освещения (light scattering, LS) [15–21]. Следует отметить, что в работах с использованием целых листьев термин LS применяют при измерениях изменений поглощения света в отмеченном диапазоне длин волн [18–21]. При этом использование временного интервала от нескольких секунд до минут позволяет отделить LS от электрохромного сдвига, который также сопровождается изменениями абсорбции света в исследуемом спектральном диапазоне, однако развивается в пределах нескольких секунд [20]. В основе LS лежит агрегация светособирующих комплексов в тилакоидах, обусловленная их протонированием [22–24], которая позволяет использовать LS как полуколичественный показатель закисления люмена хлоропластов [20].
Таким образом, целью настоящей работы стал анализ связи изменений фотохимического индекса отражения (PRI) с закислением люмена, которое оценивалось по изменениям LS у листьев гороха и герани в условиях кратковременного освещения.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы. В качестве объекта исследования использовали двух-трехнедельные проростки гороха (Pisum sativum L., сорт “Альбумен”) и приблизительно двухмесячные растения герани (Pelargonium zonale). Проростки гороха были выращены на гидропонике в климатической камере (KBW-240, Binder, Германия), при температуре 24°С и 16-часовом световом периоде. Герань выращивали в комнатных условиях. Выбор объектов опирался на наши предварительные исследования: на проростках гороха был получен ряд результатов по связи между PRI и NPQ [13, 14]; с другой стороны, важной особенностью листьев герани является высокий уровень нефотохимического тушения даже в условиях умеренного освещения [25].
Измерение светорассеяния на 535 нм. Изменение светорассеяния оценивали по поглощению света с максимумом на длине волны 535 нм [20]; такую абсорбцию измеряли с использованием эмиттер-детекторного модуля P515/535 в составе Dual-PAM-100 (Walz Gmb, Германия), состоящего из эмиттера освещения DUAL-EP515 и детектора освещения DUAL-DP515 (рис. 1а). В приборе использовали два стандартных источника слабого измерительного света – с максимумом на 535 нм (для измерения LS) и с максимумами на 515 и 550 нм (для измерения электрохромного сдвига). Оценка электрохромного сдвига не входила в задачи настоящей работы; однако второй источник измерительного света участвовал в формировании светового потока на длинах волны, необходимых для регистрации PRI. В качестве актиничного света использовали красный свет (максимум на 630 нм) с интенсивностью 1036 мкмоль м–2 с–1.
Рис. 1.
Схема регистрации абсорбции света на длине волны 535 нм и фотохимического индекса отражения листа растения (а) и примеры индуцированных освещением изменений абсорбции света на 535 нм у листа гороха (б) и герани (в). AL – актиничный свет (630 нм, 1036 мкмоль м–2 с–1), ML – слабый измерительный свет (535 нм), RL – отраженный свет. LS – величина медленных изменений абсорбции света на длине волны 535 нм при различных временах освещения листа. Пустыми кружочками обозначены точки, значения LS которых были использованы для сопоставления со значениями фотохимического индекса отражения; значение абсорбции света в первой точке принималось за нулевой уровень для медленных изменений. Точкой “ноль” обозначен момент включения света. Измерения проводились с использованием Dual-PAM-100 с P515/535 эммитер-детекторным модулем (DUAL-EP515 и DUAL-DP515) и спектрометра S-100.
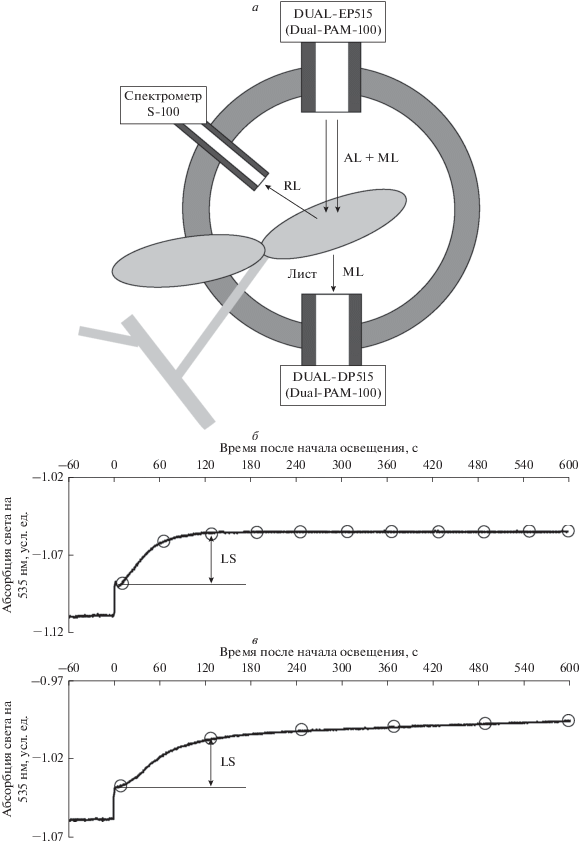
В ходе измерения листья исследованных растений предварительно адаптировали к темноте в течение 10 мин [26–28]; регистрация абсорбции начиналась в течение последней минуты темновой адаптации, что позволяло определить исходный уровень (рис. 1б, 1в). Динамика изменения абсорбции на 535 нм исследовалась в течение 10 мин после включения актиничного света. Для анализа компоненты изменения абсорбции, связанной с рН люмена [21], первая временная точка усреднялась на интервале 5–10 с после начала освещения и принималась за нулевой уровень для медленных изменений LS. Последующие временные точки оценивали с минутным (горох) или двухминутным (герань) временным шагом. В отдельной серии экспериментов герань предварительно освещали актиничным светом в течение получаса, после этого измеряли кривую снижения абсорбции на 535 нм в условиях затемнения. При этом были использованы аналогичные временные интервалы.
Измерение фотохимического индекса отражения. PRI измеряли с помощью спектрометра S-100 (Солар ЛС, Беларусь) с диапазоном регистрации света от 190 до 1000 нм и спектральным разрешением около 1 нм; свет на спектрометр подавался с использованием световода, вход которого располагался на расстоянии 1.5 см от поверхности листа [13, 14]. В качестве источника освещения использовали стандартные осветители в составе эмиттер-детекторного модуля P515/535. При этом измерительный свет с максимумом на 515 нм обеспечивал достаточную интенсивность светового потока для измерения R531, а измерительный свет с максимумом на 550 нм и актиничный свет с максимумом на 630 нм обеспечивали достаточную интенсивность светового потока для измерения R570. Для калибровки использовали белую калибровочную поверхность QPcard 101 Calibration Card ver. 3 (Argraph Corp., США). При измерении усреднение осуществляли по пятисекундной экспозиции. Первое измерение начиналось через 5 с после начала освещения актиничным светом. Последующие измерения осуществляли с минутным (горох) или с двухминутным (герань) временным шагом. В отдельной серии экспериментов аналогичным образом анализировали релаксацию PRI у листьев герани после получасового освещения актиничным светом.
В анализе использовали абсолютную величину фотохимического индекса отражения (PRI) и разность между его величиной после освещения различной длительности и при первом измерении (ΔPRI). Такая разность показывала изменения PRI, развивающиеся в минутном диапазоне после начала освещения или затемнения.
Статистическая обработка результатов. Биологическая повторность экспериментов составляла от 5 – до 11 растений. В работе рассчитывали средние значения и стандартные отклонения среднего исследованных величин. Для корреляционного анализа использовали показатели фотохимического индекса отражения и LS у индивидуальных растений. Сравнение проводилось на двух временных интервалах: в течение первых 2 мин освещения или затемнения, которые соответствовали зависящим от рН люмена изменениям LS [18–21], и в течение последующего времени эксперимента.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
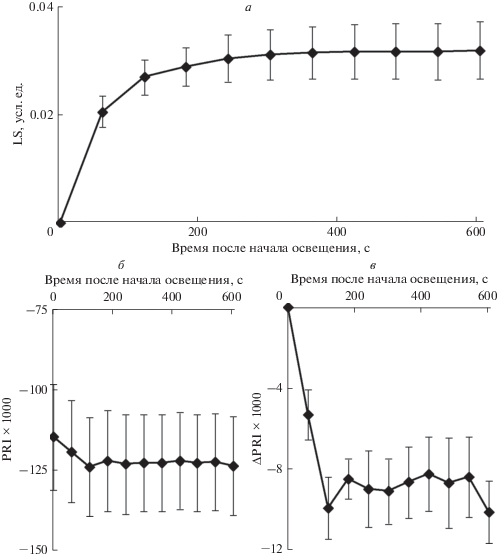
Рисунок 2а показывает, что включение света вызывало медленное возрастание LS; при этом основная часть изменений LS происходила в пределах 2 мин после включения света. В соответствии с представленными в литературе работами [15, 19, 20] такие изменения показывают формирование светоиндуцированного возрастания градиента рН на тилакоидной мембране и закисление люмена хлоропластов. Достоверные отличия между абсолютными величинами PRI при различной длительности освещения отсутствовали (рис. 2б). Однако анализ величины медленных изменений PRI показал (рис. 2в), что ΔPRI достоверно возрастало по модулю по мере увеличения длительности освещения. При этом основные изменения ΔPRI наблюдались в течение 2 мин после начала освещения, т.е. изменения LS и ΔPRI были сходными.
Рис. 2.
Зависимость возрастания абсорбции света на длине волны 535 нм (LS) (а), абсолютной величины фотохимического индекса отражения (PRI) (б) и величины его изменения (ΔPRI) (в) от времени после начала освещения листа гороха (n = 11). ΔPRI рассчитывали как изменение по отношению к первой точке, в которой осуществлялось измерение (усреднение по 5–10 с); значение ΔPRI в первой точке принимали равным нулю. Учитывались только медленные изменения абсорбции света; LS в первой точке принимали равным нулю. В качестве актиничного света использовали красный свет (630 нм, 1036 мкмоль м–2 с–1).
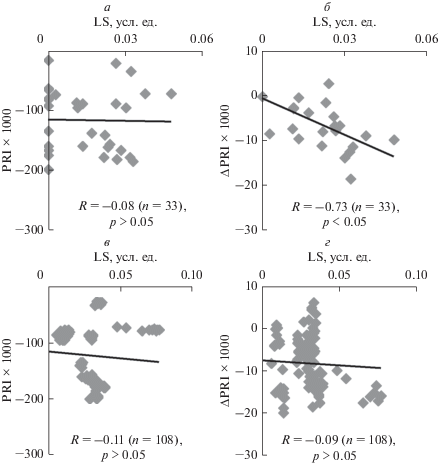
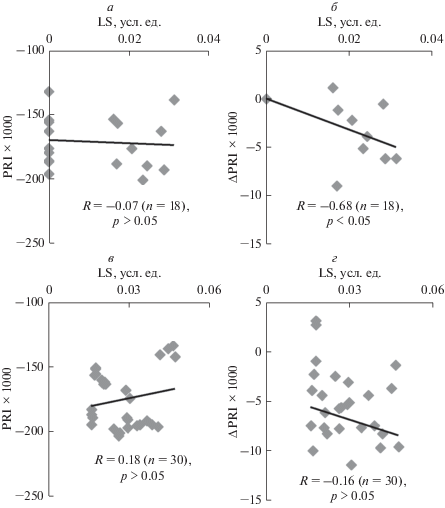
Для более строгого анализа связи величин PRI и ΔPRI с LS был проведен корреляционный анализ между индивидуальными значениями этих показателей в течение первых 2 мин после начала освещения (зависящие от рН люмена изменения LS [18–21]) и в течение оставшегося периода освещения (3–10 мин). Рисунок 3а показывает, что между абсолютными значениями PRI и LS у листьев гороха отсутствовала какая-либо корреляция. Этот результат согласуется с отсутствием достоверных изменений при анализе динамики средних величин. С другой стороны, между ΔPRI и LS (рис. 3б) наблюдается достаточно высокая отрицательная корреляция: сдвиг ΔPRI в отрицательную сторону более выражен при большем возрастании абсорбции света на длине волны 535 нм. При анализе связи между показателями, определенными на временном интервале с 3-й по 10-ю мин освещения, коэффициенты корреляции были малы и имели недостоверный характер (рис. 3в, 3г).
Рис. 3.
Диаграммы рассеяния между величинами возрастания абсорбции света на длине волны 535 нм (LS) и значениями фотохимического индекса отражения или его изменения у листьев гороха. а – Диаграмма рассеяния между LS и PRI в течение первых 2 мин освещения (n = 33), б – между LS и ΔPRI в течение первых 2 мин освещения (n = 33), в – между LS и PRI с 3-й по 10-ю мин освещения (n = 108), г – между LS и ΔPRI с 3-й по 10-ю мин освещения (n = 108). ΔPRI рассчитывали как изменение по отношению к первой точке, в которой осуществлялось измерение (усреднение по 5–10 с); значение ΔPRI в первой точке принимали равным нулю. Учитывались только медленные изменения абсорбции света; LS в первой точке принимали равным нулю. R – коэффициент линейной корреляции между величинами.
Аналогичный анализ, проведенный с использованием листьев герани, показал сходные результаты. Прежде всего следует отметить, что динамика возрастания LS на свету у герани практически не отличалась от аналогичного возрастания у гороха: в течение первых 2 мин наблюдалось существенное возрастание LS, после чего изменения были слабо выражены (рис. 4а). Как и у гороха, у герани не были выявлены какие-либо достоверные различия абсолютной величины фотохимического индекса отражения при различной длительности освещения (рис. 4б). ΔPRI возрастало по модулю во время освещения (рис. 4в). При этом, большая часть изменений развивалась в течение 2 мин после включения актиничного света, в то же время недостоверное увеличение абсолютной величины ΔPRI происходило и между 2-й и 4-й мин измерения. Корреляционный анализ (рис. 5) подтвердил достоверный характер отрицательной линейной связи между величиной LS и ΔPRI, при анализе параметров в течение первых 2 мин освещения, в то время какая-либо связь между LS и абсолютной величиной фотохимического индекса у листа герани отсутствовала. Коэффициенты корреляции между исследованными величинами, определенными с 4-й по 10-ю мин освещения были малы и не имели достоверного характера (рис. 5в, 5г).
Рис. 4.
Зависимость возрастания абсорбции света на длине волны 535 нм (LS) (а), абсолютной величины фотохимического индекса отражения (PRI) (б) и величины его изменения (ΔPRI) (в) от времени после начала освещения листа герани (n = 6–9). ΔPRI рассчитывали как изменение по отношению к первой точке, в которой осуществлялось измерение (усреднение по 5–10 с); значение ΔPRI в первой точке принимали равным нулю. Учитывались только медленные изменения абсорбции света; LS в первой точке принимали равным нулю. В качестве актиничного света использовали красный свет (630 нм, 1036 мкмоль м–2 с–1).
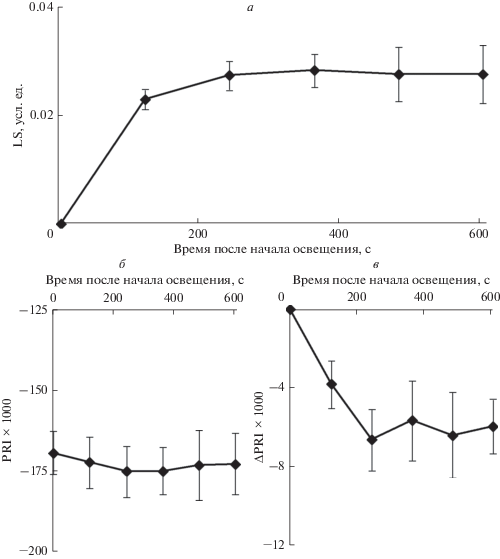
Рис. 5.
Диаграммы рассеяния между величинами возрастания абсорбции света на длине волны 535 нм (LS) и значениями фотохимического индекса отражения или его изменения у листьев герани. а – Диаграмма рассеяния между LS и PRI в течение первых 2 мин освещения (n = 18), б – между LS и ΔPRI в течение первых 2 мин освещения (n = 18), в – между LS и PRI с 4-й по 10-ю мин освещения (n = 30), г – между LS и ΔPRI с 4-й по 10-ю мин освещения (n = 30). ΔPRI рассчитывали как изменение по отношению к первой точке, в которой осуществлялось измерение (усреднение по 5–10 с); значение ΔPRI в первой точке принимали равным нулю. Учитывались только медленные изменения абсорбции света; LS в первой точке принимали равным нулю. R – коэффициент линейной корреляции между величинами.
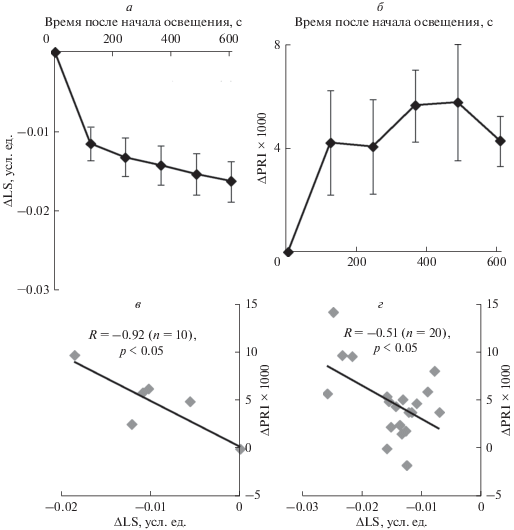
Дополнительный блок исследований показал (рис. 6а), что выключение актиничного света вызывало быстрое снижение LS у листа герани; при этом основная часть изменения происходила в первые 2 мин после начала освещения. Аналогичная динамика наблюдалась для ΔPRI, которое достоверно возрастало после 2 мин освещения, после чего оставалось приблизительно постоянным (рис. 6б). Корреляционный анализ показал достаточно высокую и достоверную отрицательную корреляцию между изменениями в первые 2 мин после выключения освещения (рис. 6в). Интересно отметить, что достоверная, хотя и достаточно небольшая корреляция наблюдалась между LS и ΔPRI и на последующем временном интервале с 4-й по 10-ю мин освещения (рис. 6г).
Рис. 6.
Зависимость снижения абсорбции света на длине волны 535 нм (ΔLS) (а) и величины изменения фотохимического индекса отражения (ΔPRI) (б) от времени после окончания освещения листа герани (n = 5), а также диаграммы рассеяния между ΔLS и ΔPRI на 2-минутном временном интервале (в) и на интервале с 4-й по 10-ю мин (г). ΔPRI рассчитывали как изменение по отношению к первой точке, в которой осуществлялось измерение после прекращения освещения (усреднение по 5–10 с); значение ΔPRI в первой точке принимали равным нулю. ΔLS рассчитывали как разность текущего значения и усредненного значения абсорбции через 5–10 с после прекращения освещения; значение ΔLS в первой точке (5–10 с) принимали равным нулю. Перед началом затемнения лист герани был в течение получаса освещен красным актиничным светом (630 нм, 1036 мкмоль м–2 с–1). R – коэффициент линейной корреляции между величинами.
В целом, полученные результаты показывают, что изменения рН люмена при включении/выключении света, определенные по изменениям LS во временном интервале от 5–10 секунд до 2 мин [15–17, 20], тесно связаны с изменениями PRI. Этот вывод дополнительно подтверждается отсутствием значительной корреляции между LS и изменениями PRI на больших временных диапазонах (более 2 мин), так как это показывает, что изменения фотохимического индекса отражения не являются простым следствием изменения абсорбции света на 535 нм. Таким образом, закисление люмена хлоропластов является, по-видимому, основным механизмом изменения фотохимического индекса отражения на начальных этапах освещения.
Из результатов работы вытекает два важных следствия. Во-первых, они свидетельствуют скорее против выдвинутой нами ранее гипотезы [14], объясняющей слабую корреляцию между изменениями NPQ и PRI в первые минуты освещения. В соответствии с ней предполагалось, что на начальных этапах освещения NPQ зависит, прежде всего, от рН люмена [9]; в то же время, изменения PRI определяются деэпоксидацией виолоксантина [1–4], которая развивается значительно медленнее [19, 29, 30]. Однако новые результаты показывают близкий характер изменения рН люмена (оцененного по LS) и PRI. Известно, что NPQ зависит не только от pH люмена, но и от величины градиента рН на тилакоидной мембране [31, 32]. Различие в динамике изменения рН люмена и градиента рН на тилакоидной мембране потенциально может являться причиной выявленных нами ранее различий между динамикой NPQ и PRI [14]. Однако такое предположение нуждается в дальнейшем анализе.
Во-вторых, полученные результаты являются аргументом в пользу недостаточности деэпоксидации виолоксантина в ксантофилловом цикле в качестве основного механизма изменений PRI в минутном диапазоне. Так, светоиндуцированное возрастание концентрации зеаксантина развивается в пределах от нескольких минут [19] до десятков минут [30]; причем у гороха это происходит в пределах 10–15 мин [29]. Однако в настоящей работе основное снижение PRI у гороха и герани происходило в течение 2 мин после начала освещения (рис. 2 и 4); сходное время снижения (2-3 мин) наблюдалось и в нашей предыдущей работе [14]. Против участия ксантофиллового цикла в выявленных изменениях свидетельствует также сильная корреляция изменений PRI с LS (динамика LS существенно отличается от динамики деэпоксидации виолоксантина [19]) и быстрая темновая релаксация PRI (темновая релаксация ксантофиллового цикла требует более 10 мин [29, 30]).
В литературе представлены отдельные работы [10], в которых отмечается возможность быстрых изменений PRI на свету и выдвигается гипотеза, что такие изменения могу быть связаны с рН-зависимым сжатием хлоропластов [3, 10]. Наши результаты подтверждают такую возможность; в то же время они позволяют предположить некоторые другие механизмы быстрых изменений PRI. Как уже было отмечено, в исследованиях на целом листе LS определяется по изменениям абсорбции света листовой пластинкой [18–21]. Такие изменения достаточно выражены в диапазоне 530–546 нм [18–20, 33]. Как следствие, можно ожидать, что индуцированное закислением люмена возрастание LS может быть непосредственной причиной снижения PRI (за счет возрастания абсорбции на 531 нм и уменьшения R531 в уравнении (1)), а механизмы, лежащие в основе LS, могут быть одновременно механизмами PRI. Важно отметить, что среди подобных механизмов рассматривается светоиндуцированное сжатие хлоропластов [18], что соответствует гипотезе об одном из механизмов снижения PRI [3, 10]. Другими возможными механизмами являются индуцированная закислением люмена агрегация светособирающих комплексов [23, 24], изменение толщины тилакоидных мембран [16, 17] и т.д. Результаты нашей работы позволяют предположить, что аналогичные механизмы могут, потенциально, участвовать и в формировании быстрых изменений фотохимического индекса отражения.
Исследование динамики PRI и анализ ее связи с изменениями LS выполнены при финансовой поддержке Российского научного фонда (проект № 17-76-20032). Исследование динамики LS в условиях освещения выполнено при финансовой поддержке Российского фонда фундаментальных исследований (проект № 18-44-520009-р_а).
Список литературы
Gamon J.A., Peñuelas J., Field C.B. 1992. A narrow-waveband spectral index that tracks diurnal changes in photosynthetic efficiency. Remote Sens. Environ. 41, 35–44.
Garbulsky M.F., Peñuelas J., Gamon J., Inoue Y., Filella I. 2011. The photochemical reflectance index (PRI) and the remote sensing of leaf, canopy and ecosystem radiation use efficiencies. A review and meta-analysis. Remote Sens. Environ. 115, 281–297.
Zhang C., Filella I., Garbulsky M.F., Peñuelas J. 2016. Affecting factors and recent improvements of the photochemical reflectance index (PRI) for remotely sensing foliar, canopy and ecosystemic radiation-use efficiencies. Remote Sens. 8, 677.
Sukhova E., Sukhov V. 2018. Connection of the photochemical reflectance index (PRI) with the photosystem II quantum yield and nonphotochemical quenching can be dependent on variations of photosynthetic parameters among investigated plants: A meta-analysis. Remote Sens. 10, 771.
Porcar-Castell A., Garcia-Plazaola J.I., Nichol C.J., Kolari P., Olascoaga B., Kuusinen N., Fernández-Marín B., Pulkkinen M., Juurola E., Nikinmaa E. 2012. Physiology of the seasonal relationship between the photochemical reflectance index and photosynthetic light use efficiency. Oecologia. 170, 313–323.
Porcar-Castell A., Tyystjärvi E., Atherton J., van der Tol C., Flexas J., Pfündel E.E., Moreno J., Frankenberg C., Berry J.A. 2014. Linking chlorophyll a fluorescence to photosynthesis for remote sensing applications: mechanisms and challenges. J. Exp. Bot. 65, 4065–4095.
Wong C.Y., Gamon J.A. 2015. Three causes of variation in the photochemical reflectance index (PRI) in evergreen conifers. New Phytol. 206, 187–195.
Müller P., Li X.-P., Niyogi K.K. 2001. Non-photochemical quenching. A response to excess light energy. Plant. Physiol. 125, 1558–1566.
Ruban A.V. 2015. Evolution under the sun: optimizing light harvesting in photosynthesis. J. Exp. Bot. 66, 7–23.
Evain S., Flexas J., Moya I. 2004. A new instrument for passive remote sensing: 2. Measurement of leaf and canopy reflectance changes at 531 nm and their relationship with photosynthesis and chlorophyll fluorescence. Remote Sens. Environ. 91, 175–185.
Rahimzadeh-Bajgiran P., Munehiro M., Omasa K. 2012. Relationships between the photochemical reflectance index (PRI) and chlorophyll fluorescence parameters and plant pigment indices at different leaf growth stages. Photosynth. Res. 113, 261–271.
Magney T.S., Eusden S.A., Eitel J.U.H., Logan B.A., Jiang J., Vierling L.A. 2014. Assessing leaf photoprotective mechanisms using terrestrial LiDAR: Towards mapping canopy photosynthetic performance in three dimensions. New Phytol. 201, 344–356.
Sukhov V., Sukhova E., Gromova E., Surova L., Nerush V., Vodeneev V. 2019. The electrical signal-induced systemic photosynthetic response is accompanied by changes in the photochemical reflectance index in pea. Funct. Plant Biol. doihttps://doi.org/10.1071/FP18224
Сухов В.С., Громова Е.Н., Сухова Е.М., Сурова Л.М., Неруш В.Н., Воденеев В.А. 2019. Анализ связи показателей световой стадии фотосинтеза с фотохимическим индексом отражения (PRI) в условиях кратковременного освещения листа гороха. Биол. мембраны. 36 (1), 32–43.
Deamer D.W., Crofts A.R., Packer L. 1967. Mechanisms of light-induced structural changes in chloroplasts I. Light-scattering increments and ultrastructural changes mediated by proton transport. Biochim. Biophys. Acta. 131, 81–96.
Murakami S., Packer L. 1970. Protonation and chloroplast membrane structure. J. Cell Biol. 47, 332–351.
Murakami S, Packer L. 1970. Light-induced changes in the conformation and configuration of the thylakoid membrane of Ulva and Porphyra chloroplasts in vivo. Plant Physiol. 45, 289–299.
Heber U. 1969. Conformational changes of chloroplasts induced by illumination of leaves in vivo. Biochim. Biophys. Acta. 180, 302–319.
Bilger W., Björkman O., Thayer S.S. 1989. Light-induced spectral absorbance changes in relation to photosynthesis and the epoxidation state of xanthophyll cycle components in cotton leaves. Plant Physiol. 91, 542–551.
Schreiber U., Klughammer C. 2008. New accessory for the DUAL-PAM-100: The P515/535 module and examples of its application. PAM Application Notes. 1, 1–10.
Sukhov V., Surova L., Morozova E., Sherstneva O., Vodeneev V. 2016. Changes in H+-ATP synthase activity, proton electrochemical gradient, and pH in pea chloroplast can be connected with variation potential. Front. Plant Sci. 7, 1092.
Horton P., Ruban A.V., Rees D., Pascal A.A., Noctor G., Young A.J. 1991. Control of the light-harvesting function of chloroplast membranes by aggregation of the LHCII chlorophyll-protein complex. FEBS Lett. 292, 1–4.
Horton P., Wentworth M., Ruban A. 2005. Control of the light harvesting function of chloroplast membranes: the LHCII-aggregation model for non-photochemical quenching. FEBS Lett. 579, 4201–4206.
Ruban A.V., Pascal A.A., Robert B., Horton P. 2002. Activation of zeaxanthin is an obligatory event in the regulation of photosynthetic light harvesting. J. Biol. Chem. 277, 7785–7789.
Sukhov V., Orlova L., Mysyagin S., Sinitsina J., Vodeneev V. 2012. Analysis of the photosynthetic response induced by variation potential in geranium. Planta 235, 703–712.
Sukhov V., Surova L., Sherstneva O., Vodeneev V. 2014. Influence of variation potential on resistance of the photosynthetic machinery to heating in pea. Physiol. Plant., 152, 773–783.
Sukhov V., Surova L., Sherstneva O., Katicheva L., Vodeneev V. 2015. Variation potential influence on photosynthetic cyclic electron flow in pea. Front. Plant. Sci. 5, 766.
Sukhov V., Surova L., Sherstneva O., Bushueva A., Vodeneev V. 2015. Variation potential induces decreased PSI damage and increased PSII damage under high external temperatures in pea. Funct. Plant. Biol. 42, 727–736.
Jahns P. 1995. The Xanthophyll cycle in intermittent light-grown pea plants. Possible Functions of chlorophyll a/b-binding proteins. Plant Physiol. 108, 149–156.
Kress E., Jahns P. 2017. The dynamics of energy dissipation and xanthophyll conversion in arabidopsis indicate an indirect photoprotective role of zeaxanthin in slowly inducible and relaxing components of non-photochemical quenching of excitation energy. Front. Plant Sci. 8, 2094.
Goss R., Opitz C., Lepetit B., Wilhelm C. 2008. The synthesis of NPQ-effective zeaxanthin depends on the presence of a transmembrane proton gradient and a slightly basic stromal side of the thylakoid membrane. Planta. 228, 999–1009.
Zaks J., Amarnath K., Kramer D.M., Niyogi K.K., Fleming G.R. 2012. A kinetic model of rapidly reversible nonphotochemical quenching. Proc. Natl. Acad. Sci. USA. 109, 15757–15762.
Kramer D.M., Sacksteder C.A. 1998. A diffused-optics flash kinetic spectrophotometer (DOFS) for measurements of absorbance changes in intact plants in the steady-state. Photosynth. Res. 56, 103–112.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


