Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 4, стр. 262-270
Микродоменная организация интернодального миелина
Г. В. Максимов a, d, *, Н. П. Кутузов b, В. В. Шутова c, С. Н. Орлов a
a Московский государственный университет имени М. В. Ломоносова,
119892 Москва, ул. Ленинские горы, 1 стр. 12, Россия
b Университет в Копенгагене, факультет здоровья и медицинских наук,
кафедра биомедицины,
2200 Copenhagen, Blegdamsvej 3, Denmark
c Национальный исследовательский Мордовский государственный университет
им. Н.П. Огарёва,
430005 Саранск, ул. Большевистская, 68, Россия
d Национальный исследовательский технологический университет “МИСиС”,
119049 Москва, Ленинский просп., 4, Россия
* E-mail: gmaksimov@mail.ru
Поступила в редакцию 12.02.2019
После доработки 17.02.2019
Принята к публикации 20.02.2019
Аннотация
C помощью метода спектроскопии комбинационного рассеяния исследовали ориентацию и упорядоченность молекул каротиноидов и жирных кислот фосфолипидов миелина нервного волокна. Разработан метод количественного описания молекулярной упорядоченности молекул липидного бислоя миелина. Установлено, что различия в распределении молекул каротиноидов и фосфолипидов связаны с морфологией миелина и волокна. Молекулы каротиноидов расположены преимущественно перпендикулярно к поверхности липидного бислоя миелина, а фосфолипидов – под углом 45°. Предполагается, что микродоменная организация интернодального миелина обусловлена наличием участков, обладающих более высокой степенью насыщенности и упорядоченности жирнокислотных кислот фосфолипидов миелина.
ВВЕДЕНИЕ
Исследование изменений структуры и свойств миелина при проведении нервным волокном возбуждения является важным направлением молекулярной физиологии. Известно, что миелин изолирует паранодальную область волокна, снижая ее эффективную электрическую емкость и тем самым обеспечивая более высокую общую скорость проведения возбуждения по миелинизированному волокну. При проведении возбуждения или активации ряда рецепторов Шванновских клеток (ШК) меняется не только структура миелина, но и содержание в его компартментах ионов калия и кальция [1]. С помощью электронной микроскопии доказано, что структура миелина характеризуется чередующимися плотными (контрастными) и неплотными слоями: период составляет 16–18.5 нм (периферическая нервная система) и 15–17 нм (центральная нервная система), а длина интернодального сегмента варьирует от 150–200 мкм (в ЦНС) до 1 мм (в ПНС) [2–4]. С помощью сканирующей рентгеновской дифракционной микроскопии показано, что в интернодальной области ламеллы миелина характеризуются периодом порядка 200 Å [2]. Вероятно, одной из причин микрогетерогенности миелина может быть различная ориентация липидных бислоев (ЛБ) относительно друг друга вдоль нервного волокна. Важно, что направление упаковки ламелл миелина не является радиальным [2, 4]. Структурами, приводящими к локальной дезорганизации миелина, являются насечки Шмитта–Лантермана (НШЛ), которые вызывают нерегулярное расширение цитоплазмы между слоями миелина.
Спектроскопия комбинационного рассеяния (КР) позволяет исследовать колебательные энергетические спектры молекул, благодаря чему можно производить анализ химической структуры и конформации молекулы [5]. КР использовали для исследования состояния липидов миелина нервных волокон при проведении серии ПД [6–14]. Однако при регистрации КР от различных отделов миелинового волокна (миелин, перехват ШК) возникает целый ряд вопросов. Например, размер фокального объема (объем пространства при регистрации КР) сравним с размером части объекта. Кроме того, наличие в миелине нервного волокна каротиноидов представляет собой не только научный интерес [9], но и предоставляет возможность создания технологии тестирования состояния ЛБ. Например, в зависимости от химической структуры каротиноидов, молекулы могут быть ориентированы в ЛБ различным образом: молекулы неполярных каротиноидов (бета-каротин) могут быть ориентированы как перпендикулярно, так и параллельно ЛБ. Важно, что ориентация молекулы каротиноидов может влиять на упорядоченность “хвостов” жирных кислот мембранных фосфолипидов в ЛБ и, соответственно, на физико-химические свойства миелина [15, 16]. В связи с этим мы использовали метод поляризационной спектроскопии КР (ПКР) для исследования ориентационной упорядоченности каротиноидов и липидов [17, 18].
Цель данной работы состояла в разработке подхода к количественному описанию упорядоченности молекул в ЛБ и выявлению микродоменной организации миелина нервного волокна.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования служили миелиновые нервы травяной лягушки (Rana temporaria). Животных анестезировали пропофолом (50 мг/кг). Одиночные нервные волокна размещали в пластиковой камере с раствором Рингера (NaCl (Sigma) 100 мМ, KCl (Sigma) 2 мМ, CaCl2 (Sigma) 1.08 мМ, HEPES (Sigma) и покрывали стеклом (0.17 мм). В эксперимент отбирали нервные волокна, контактирующие с поверхностью покровного стекла, что позволяло контролировать угол наклона объекта и минимизировать аберрации.
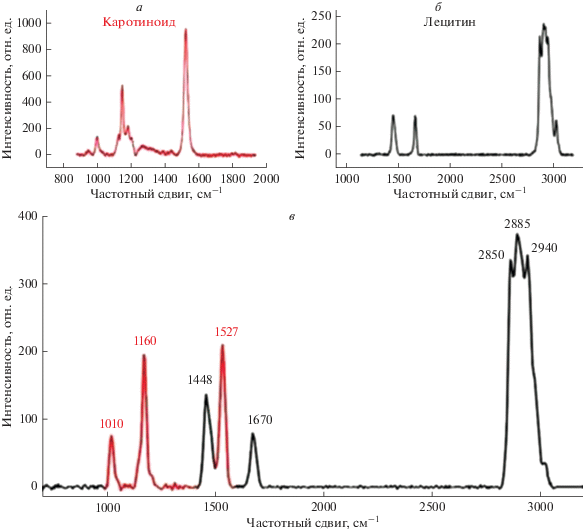
Микроспектроскопия КР. КР регистрировали с помощью системы WITec alpha–300, используя ND: YAG непрерывный твердотельный лазер (длина волны 532 нм). Линейно поляризованный свет фокусировали на объекте с помощью 20× (NA = 0.4) или 50× (NA = 0.8) объективов. Средняя мощность лазера на выходе из объектива составляла около 0.5 мВт. Время накопления одиночных спектров варьировало от 10 с до 2 мин. Для измерения анизотропии КР анализатор помещали перед пинхолом микроскопа, что позволяло регистрировать плоскополяризованный свет. Измерения КР включали в себя одиночные КР-спектры, КР-спектры, зарегистрированные вдоль линии, или двумерные изображения. Величины латерального и аксиального разрешения составляли 1.2 и 9.7 мкм для 20× и 0.9 и 7.5 мкм для 50× объективов. [10–14]. Для выявления вклада колебания характерных связей молекулы каротиноида и жирных кислот фосфолипидов миелинового нервного волокна использовали ряд соотношений спектра КР (см. ниже). Полосы КР-спектра миелинового нервного волокна идентифицировали, используя спектры каротиноидов и лецитина [5].
Лазерная интерференционная микроскопия. Измерения оптической разности хода светового луча (ОРХ) проводили с помощью автоматического интерференционного микропрофилометра МИА-1, собранного на базе МИИ-4 интерферометра Линника (ЛОМО, Санкт-Петербург, Россия). Объекты освещали неполяризованным светом от светодиодного лазера длиной волны 650 нм и мощностью 5 мВт. Мощность излучения на исследуемой клетке составляла не более 3 мВт. Фокусировку изображения проводили с помощью 30× объектива с числовой апертурой NA = 0.65, а регистрацию изображения – с помощью черно-белой 12-битной видеокамеры VS-415U (NPK Videoscan, Россия). Разрешение получаемых изображений составляло 512 × 512 пикселей [19].
Статистическая обработка результатов. Все полученные данные разделяли на две группы. К первой относятся отношения интенсивностей полос спектра КР, ко второй – параметры упорядоченности ⟨P2⟩ и ⟨P4⟩. Нормальное распределение выборочных средних позволило использовать t-тест Стьюдента для сравнения математических ожиданий двух генеральных совокупностей, соответствующих контролю и опыту. Таким образом, t-тест Стьюдента с неравными дисперсиями был использован для сравнения отношений интенсивностей полос КР с уровнем значимости 5%.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Установлено, что КР-спектр миелинового нервного волокна представляет собой суперпозицию спектров β-каротина и лецитина (рис. 1). В области сканирования 900–1700 см−1 выявлены полосы, характеризующие: изгибные колебания боковых метильных групп –CH3 в молекулах каротиноидов (1004 см−1); колебания –С–С–связей каротиноидов (1160 см−1); вращательные колебания –CH2–алкильных радикалов в составе липидов (1300 см−1); изгибные колебания –CH2– алкильных радикалов в составе липидов (1440 см−1); колебания –С=С–связей каротиноидов (1527 см−1); колебания –С=С–связей алкильных радикалов ненасыщенных жирных кислот в составе фосфолипидов (1655 см−1). В области 2800–3000 см−1 обнаружены симметричные колебания метиленовых групп липидов –CH2– (2850 см−1); несимметричные колебания метиленовых групп липидов –CH2– и – CH2– (2884–2885 см−1); колебания метиленовых групп липидов –CH2– и симметричных колебаний –CH-групп (2932–2940 см−1) [19, 20]. Из всего набора перечисленных выше полос для анализа состояния липидов миелина использовали следующие соотношения интенсивностей (рис. 1): 1) I1527/I1160 (конформация каротиноидов ЛБ) – отношение возрастает при увеличении упорядоченности липидов (обозначается как I1); 2) I1655/I1440 – отношение возрастает при увеличении степени ненасыщенности жирных кислот фосфолипидов ЛБ (обозначается как I2); 3). I2884/I2932 (конформация “хвостов” жирных кислот фосфолипидов в ЛБ), отношение возрастает при увеличении упорядоченности липидов ЛБ (обозначается как I3).
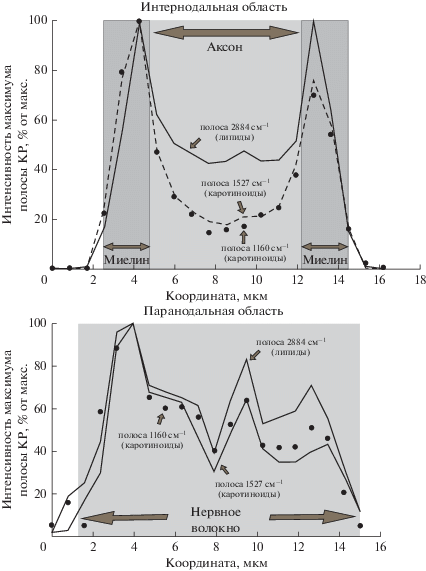
Установлено, что спектр КР интернодальной области миелинового нервного волокна симметричен относительно центра c выраженными максимумами у края волокна (рис. 2). Неоднородное распределение интенсивности КР в паранодальной области волокна обусловлено неупорядоченной упаковкой ЛБ, участвующих в формировании так называемых паранодальных петель – концевых фрагментов миелина. Отметим, что распределение интенсивностей полос КР-спектра каротиноидов повторяют форму распределения амплитуд полосы КР-спектра жирных кислот фосфолипидов, что свидетельствует о локализации этих молекул в ЛБ.
Рис. 2.
Распределение величины интенсивности полос КР-спектра в интернодальной и паранодальной области миелинового нервного волокна.
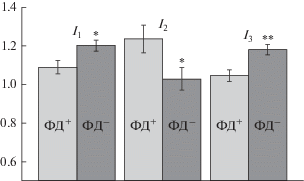
В ходе регистрации распределения величины интенсивности фокального дублета (ФД) была выявлена гетерогенность в распределении данных молекул в ЛБМ: на некоторых участках миелина (ФД– тип) ФД отсутствовали (рис. 3б), а на других участках миелина (ФД+ тип) регистрировали ФД на противоположной стороне волокна (рис. 3а). Промежуточные значения интенсивности ФД не учитывали, например, второй максимум (рис. 3в). Вероятно, возникновение ФД связано с “потерями” света в миелине: если структура миелина была идеальным оптическим резонатором, то световые волны циркулировали бы внутри. ФД+ тип связан с тем, что при данной кривизне поверхности миелина угол падения световой волны может не соответствовать углу полного внутреннего отражения, а также с рассеянием света на неоднородных структурах миелина. Таким образом, с помощью данного подхода можно исследовать структуру ЛБ в различных участках миелинового нервного волокна. В этих опытах при регистрации КР плоскость поляризации возбуждающего лазера была параллельна оси нервного волокна. Из спектров КР каротиноидов и жирных кислот фосфолипидов рассчитывали I1, I2 и I3 (рис. 4). Установлено, что мембраны миелина в составе участков ФД+ типа характеризуются более высокой степенью разупорядоченности и ненасыщенности жирных кислот фосфолипидов. Вероятно, для ЛБ с высокой степенью разупорядоченности липидов формирование плотных контактов между соседними слоями миелина затруднено по сравнению с более упорядоченными мембранами ФД– типа. Известно, что для структуры миелина свойственны различные локальные неоднородности, такие как, например, насечки Шмидта–Лантермана (НШЛ), которые формируют “каналы” цитоплазмы ШК внутри миелина. Как отмечалось ранее, результаты рентгеновской дифракционной микроскопии также свидетельствуют о наличии структурных гетерогенностей миелина в пределах интернодальной области нервного волокна. Чтобы связать микроскопические различия в структуре ЛБ с плотностью их упаковки, использовали метод лазерной интерференционной микроскопии (ЛИМ) [19]. В данной серии экспериментов выявлена гетерогенность распределения ОРХ вдоль нервного волокна: минимальное значение ОРХ соответствует перехвату Ранвье. Таким образом, в пределах интернодальной области некоторые свойства миелина (распределение жирных кислот по степени их насыщенности и конформация каротиноидов) могут варьировать.
Рис. 3.
Распространение луча лазера в разных областях ЛБ миелина (а, б). Профиль распределения интенсивности фокального дублета (ФД) вдоль волокна (в). Профиль ОРХ по длине волокна (г). Стрелки (черные) и квадраты обозначают место фокусировки лазера, стрелки (серые) и белые квадраты – ожидаемое место регистрации ФД. По оси ординат – интенсивность полосы КР-спектра (в) и величина ОРХ (г, м–9); по оси абсцисс – расстояние вдоль волокна, мкм.
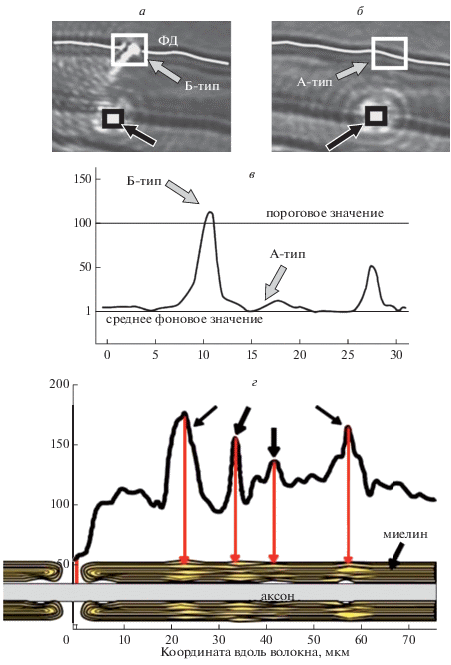
Рис. 4.
Сравнение отношений интенсивностей основных полос спектра КР для участков ФД– и ФД+ типов. Данные представлены как среднее ± стандартная ошибка.
При исследовании ориентации молекул каротиноидов и жирных кислот фосфолипидов миелина регистрировали КР нервных волокон при различных положениях плоскости поляризации луча лазера относительно волокна и фиксированной плоскости поляризации при регистрации полученного сигнала (рис. 5). Полосы КР-спектра каротиноидов (1160 и 1527 см−1) и полосу 2885 см−1 липидов использовали для расчета отношений интенсивностей: ⟨Jzz⟩/⟨Jzy⟩ и ⟨Jyy⟩/⟨Jyz⟩ и построения ориентационной функции распределения (ОФР) (доля частиц, ориентированных с определенным углом) (рис. 6). В случае симметричной объемной фазы (растянутый полимер или мембрана) с молекулами, обладающими цилиндрической симметрией, их ОФР (N(θ, φ, ψ) является функцией только одного аргумента – угла θ между осью молекулы и нормалью к мембране. Основываясь на выводах теории Bower, подобную ОФР можно разложить в ряд по полиномам Лежандра [20]:
Рис. 5.
Спектры КР миелина в области 900–1700 см−1 при различных ориентациях поляризатора и анализатора относительно нервного волокна: поляризатор и анализатор параллельны (1) или перпендикулярны друг другу (2). По оси абсцисс – частотный сдвиг (см–1); по оси ординат – интенсивность, отн. ед.
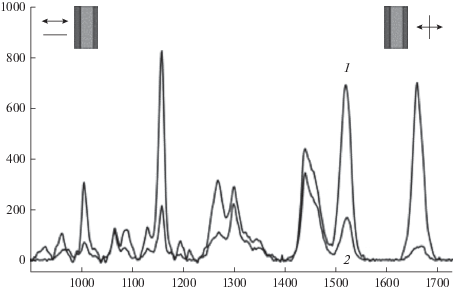
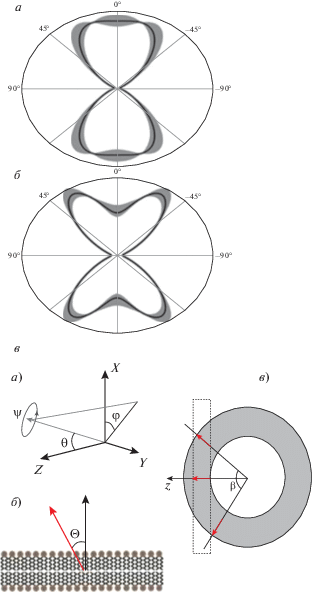
Рис. 6.
Ориентационные функции распределения (ОФР) для каротиноидов (а) и фосфолипидов (б) миелина. Нулевой угол соответствует направлению, перпендикулярному мембране. ОФР рассчитана с помощью средних значений параметров упорядоченности (в виде сплошной линии). Серым фоном обозначен диапазон изменения ОФР при варьировании параметров упорядоченности в пределах стандартной ошибки среднего. в – Ориентация молекул, рассчитанная с помощью пространственных углов (а, б). Ввиду конечной кривизны мембран миелина в пределах фокального объема (обозначен пунктиром) идеально ориентированные молекулы (стрелки) будут казаться располагающимися в пределах угла β (в).
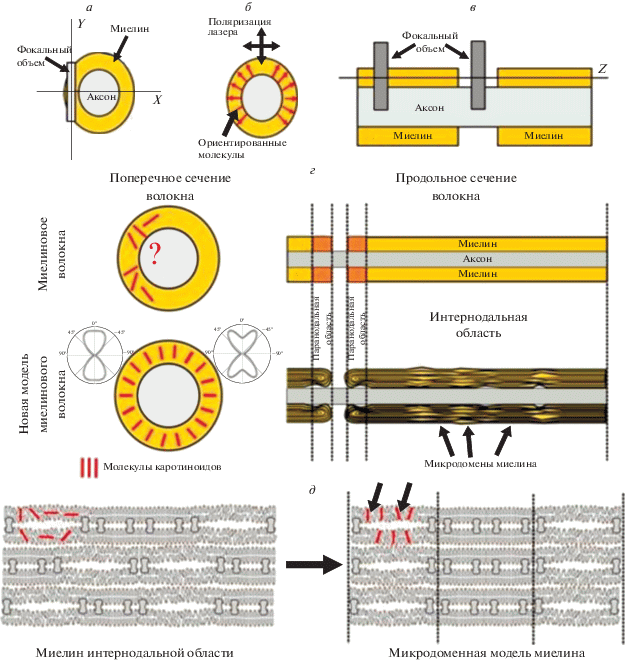
Ранее в качестве неоднородностей интернодальной области миелина рассматривали только НШЛ (рис. 7). Мы установили, что микродоменная структура миелина включает и радиальные области плотного миелина, занимающие определенный участок вдоль волокна (рис. 7д). Подобная организация структуры миелина подразумевает локальную корреляцию со свойствами соседних ЛБМ. Отметим, что в отличие от НШЛ подобные микродомены не могут быть выявлены с помощью стандартной оптической микроскопии, и для их исследования необходимо применение разработанного нами метода визуализации.
Рис. 7.
Основные особенности измерений спектров КР с одиночных нервных волокон (а–в, комментарии в тексте). Изменения в ЛБ миелина нервного волокна (г). Модель структуры миелина (д).
Настоящая работа поддержана грантом РНФ (проект № 19-79-30 062).
Список литературы
Trapp B.D., Kidd G. J. 2004. Structure of the myelinated axon. In: Myelin Biology and Disorders. San Diego: Academic Press, p. 3–27.
Kirschner D.A., Hollingshead C.J. 1980. Processing for electron microscopy alters membrane structure and packing in myelin. J. Ultrastructure Res. 73 (2), 211–232.
Suter U., Nave K.-A. 1999. Transgenic mouse models of CMT1A and HNPP. Ann. New York Acad. Sci. 883 (1), 247–253.
Schmitt F.O., Bear R.S., Palmer K.J. 1941. X-ray diffraction studies on the structure of the nerve myelin sheath. J. Cell. Compar. Physiol. 18 (1), 31–42.
Szalontai B., Bagyinka Cs., Horvath L.I. 1977. Changes in the raman spectrum of frog sciatic nerve during action potential propagation. Biochem. Biophys. Res. Comm. 76 (3), 660–665.
Maksimov G.V., Churin A.A., Paschenko V.Z., Rubin A.B. 1990. Raman spectroscopy of the “potential sensor” of potential-dependent channels. Gen. Physiol. Biophys. 9 (4), 353–360.
Максимов Г.В., Мусуралиева Г.Т., Чурин А.А., Пащенко В.З. 1989. Влияние состояния белок-липидных взаимодействий в возбудимых мембранах на конформацию каратиноидов. Биофизика. 34 (3), 420–424.
Максимов Г.В., Чурин А.А., Пащенко В.З., Рубин А.Б. 1985. Исследование природы регуляции потенциалзависимых каналов методом спектроскопии комбинационного рассеяния. Биофизика. 30, (4), 620–624.
Verdiyan E., Bibineyshvili E., Kutuzov N., Maksimov G. 2015. Role of Schwann cell in regulation of myelin sheath properties during nerve fiber excitation and activation of purinergic receptors. GLIA Bilbao 2015: Abstracts Oral Presentations, Posters, Indexes. 63, E76–E469.
Bulygin F.V., Dracheva O.E., Kutuzov N.P., Lyaskovskii V.L., Maksimov G.V., Nikolaev Yu A. 2014. Determination of the metrological characteristics of the near-field scanning optical microscope in the study of biological objects. Measurement techniques. 56 (10), 1173–1180.
Sarycheva A.S., Semenova A.A., Polyakov A.Y., Kozmenkova A.Y., Grigorieva A.V., Goodilin E.A., Parshina E.Y., Brazhe N.A., Maksimov G.V. 2014. Ultrasonic-silver-rain preparation of SERS substrates. Materials Lett. 121, 66–69.
Kutuzov N.P., Brazhe A.R., Maksimov G.V., Lyaskovskiy V.L. 2014. Orientational ordering of carotenoids in myelin membranes resolved by polarized Raman microspectroscopy. Biophys. J. 107 (4), 891–900.
Kutuzov N.P., Brazhe A.R., Lyaskovskiy V.L., Maksimov G.V. 2015. Laser beam coupling into nerve fiber myelin allows one to assess its structural membrane properties. J. Biomed. Optics. 20 (5), 050501.
Kutuzov N., Gulin A., Lyaskovskiy V., Natochenko N., Maksimov G. 2015. ATP-mediated compositional change in peripheral myelin membranes: A comparative Raman spectroscopy and time-of-flight secondary ion mass spectrometry study. PLoS ONE. 10 (11), e0142084.
van de Ven M., Kattenberg M., van Ginkel G., Levine Y. K. 1984. Study of the orientational ordering of carotenoids in lipid bilayers by resonance-Raman spectroscopy. Biophys. J. 45 (6), 1203–1209.
Mishra N.N., Liu G.Y., Yeaman M.R., Nast C.C., Proctor R.A., McKinnell J, Bayer A.S. 2011. Carotenoid-related alteration of cell membrane fluidity impacts Staphylococcus aureus susceptibility to host defense peptides. Antimicrobial Agents Chemother. 55 (2), 526–531.
Snyder R.G., Strauss H.L., Elliger C.A. 1982. Carbon-hydrogen stretching modes and the structure of n-alkyl chains. 1. Long, disordered chains. J. Phys. Chem. 86 (26), 5145–5150.
Cho Y., Kobayashi M., Tadokoro H. 1986. Raman band profiles and mobility of polymethylene chains. J. Chem. Phys. 84 (8), 4636–4642.
Berestovskaya Y.Y., Gerasimenko L.M., Yusipovich A.I., Maksimov G.V., Rubin A.B., Levin G.G., Shutova V.V. 2011. New possibilities of studying microbial objects by laser interference microscopy. Biophysics. 56 (6), 1063–1068.
Nobbs J.H., Bower D.I., Ward I.M. 1979. Comparison of polarized fluorescence with polarized raman and infrared dichroism measures of orientation in uniaxially drawn poly (ethylene terephthalate). J. Polymer Sci: Polymer Physics Edition. 17 (2), 259–272.
Everall N., Chalmers J., Mills P. 1996. Use of polarized resonance Raman spectroscopy of a polyene probe, and FT-IR dichroism, to probe amorphous-phase orientation in uniaxially drawn poly(ethylene). Appl. Spectroscopy. 50 (10), 1229–1234.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии