Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 4, стр. 242-254
рН-зависимая регуляция электронного и протонного транспорта в хлоропластах in situ и in silico
А. В. Вершубский a, А. Н. Тихонов a, b, *
a Московский государственный университет им. М.В. Ломоносова, физический факультет
119992 Москва, Ленинские горы, 1, стр. 2, Россия
b Институт биохимической физики имени Н.М. Эмануэля РАН
119334 Москва, ул. Косыгина, 4, Россия
* E-mail: an_tikhonov@mail.ru
Поступила в редакцию 21.03.2019
После доработки 01.04.2019
Принята к публикации 08.04.2019
Аннотация
Проведен анализ электронного и протонного транспорта в хлоропластах высших растений на основе математической модели, учитывающей рН-зависимую регуляцию электронного переноса и работу ATP-синтазы. Численные эксперименты по моделированию этих процессов в условиях псевдоциклического электронного транспорта (цикл “вода–вода”) показали хорошее согласие с экспериментальными данными по кинетике переноса электронов к фотосистеме 1 (ФС1) в хлоропластах класса Б в метаболических состояниях, соответствующих высокой (состояние 3) и низкой (состояние 4) активности АТР-синтазы. Моделирование электрон-транспортных процессов с учетом работы цикла Кальвина–Бенсона (ЦКБ), циклического транспорта электронов вокруг ФС1 и рН-зависимой диссипации энергии в фотосистеме 2 (ФС2) – нефотохимическое тушение (НФТ) – позволило оценить вклад этих факторов в кинетику индукционных явлений в хлоропластах in situ. Показано, что многофазная кинетика фотоокисления Р700 (первичный донор электронов в ФС1) отражает перераспределение электронных потоков между циклическим и нециклическим путями переноса электрона, обусловленное активацией ЦКБ вследствие защелачивания стромы, а также смену лимитирующей стадии в цепи переноса электрона, индуцированную уменьшением значений рН внутритилакоидного пространства (pHin). По мере снижения pHin поток электронов между ФС2 и ФС1 замедляется, что может быть вызвано замедлением скорости окисления пластохинола и ослаблением активности ФС2 вследствие НФТ.
ВВЕДЕНИЕ
У растений фотосинтез происходит в энергопреобразующих органеллах – хлоропластах. Хлоропласты имеют сложную структуру. Внешняя оболочка хлоропласта состоит из двух липидных мембран, а внутреннее пространство (строму) пронизывают удлиненные мембраны (ламеллы), которые образуют замкнутые уплощенные пузырьки – тилакоиды. Плотно примыкающие друг к другу тилакоиды образуют граны, которые соединяются друг с другом посредством межгранных тилакоидов, являющихся продолжением гранальных тилакоидов [1–3]. В мембране тилакоидов располагаются пигмент-белковые комплексы, которые поглощают свет и обеспечивают протекание первичных процессов фотосинтеза: поглощение света пигментами светособирающих антенн фотосистемы 1 (ФС1) и фотосистемы 2 (ФС2), миграцию энергии поглощенных квантов света к реакционным центрам. В реакционных центрах ФС1 и ФС2 происходит первичное разделение зарядов и инициируются процессы переноса электронов по цепи электронного транспорта (ЦЭТ) [4–6]. Фотоиндуцированный транспорт электронов сопряжен с трансмембранным переносом протонов. Транс-тилакоидная разность электрохимических потенциалов ионов водорода ($\Delta {{\tilde {\mu }}_{{{{{\text{H}}}^{ + }}}}}$) служит “движущей силой” для работы АТР-синтазного комплекса, обеспечивающего образование молекул ATP из ADP и неорганического фосфата (Pi). В строме расположены ферменты цикла Кальвина–Бенсона (ЦКБ), катализирующие реакции восстановления углерода [7].
Основу тилакоидных мембран хлоропластов составляет липидный бислой, в который встроены белковые комплексы. Одна из особенностей структурно-функциональной организации фотосинтетического аппарата в хлоропластах высших растений – неоднородное распределение электрон-транспортных и АТР-синтазных комплексов. Бóльшая часть комплексов ФС2 локализована в мембранах тесно примыкающих друг к другу тилакоидов гран [1–3]. Напротив, ФС1 и АТР-синтазные комплексы расположены в тех участках тилакоидной мембраны, которые экспонированы в область стромы (межгранные тилакоиды и торцевые участки тилакоидов гран). Цитохромные b6 f-комплексы распределены равномерно между гранальными и межгранными тилакоидами [8, 9].
Выяснение механизмов регуляции электронного и протонного транспорта в фотосинтетических системах – актуальная задача биофизики и биохимии фотосинтеза. Структурно-функциональная “гибкость” фотосинтетического аппарата обеспечивает его эффективную работу в изменчивых естественных условиях. В хлоропластах можно выделить два типа регуляторных процессов [10–16], которые включают в себя быстрые (секунды−минуты) и медленные (часы–сутки) механизмы регуляции. Быстрые механизмы связаны с активацией/деактивацией ферментов ЦКБ, перераспределением энергии поглощаемого света между ФС1 и ФС2 и ион-зависимой регуляцией электронного транспорта. Медленные механизмы обусловлены изменениями экспрессии белков фотосинтетического аппарата хлоропластов. Наряду с этим важную роль в регуляции фотосинтеза играют процессы светозависимого перемещения хлоропластов внутри растительной клетки [17].
Один из ключевых механизмов регуляции фотосинтетического транспорта электронов связан с изменениями pH внутритилакоидного пространства (pHin), которые влияют на скорость переноса электронов между ФС2 и ФС1. Лимитирующим звеном в ЦЭТ хлоропластов является стадия окисления пластохинола (QH2) цитохромным b6 f-комплексом [18, 19]. Окисление QH2 сопряжено с выделением протонов во внутритилакоидный объем: при уменьшении pHin скорость переноса электронов замедляется. Транстилакоидная разность рН (ΔрН), создаваемая за счет работы ЦЭТ хлоропластов, вносит основной вклад в величину “протон-движущей силы” $\Delta {{\tilde {\mu }}_{{{{{\text{H}}}^{ + }}}}}$ [20], обеспечивающей работу АТP-синтазы (ADP + + Pi → АТР). Поток протонов через АТP-синтазу (JATP) влияет на величину ΔрН. При избытке субстратов для реакции синтеза АТР поток JATP и, соответственно, скорость синтеза АТР будут высокими. При этом поддерживается высокая скорость переноса электронов между фотосистемами (метаболическое “состояние 3”). После уменьшения концентрации ADP вследствие работы АТР-синтазы поток протонов, сопряженный с синтезом АТР, ослабевает, происходит дополнительное уменьшение pHin, что вызывает торможение переноса электронов (метаболическое “состояние 4”) [15, 20–22].
В настоящей работе проведен теоретический анализ рН-зависимой регуляции электрон-транспортных процессов в хлоропластах в рамках математической модели, разработанной нами ранее [23–29]. Численное моделирование световых стадий фотосинтеза позволяет анализировать обратные связи в разветвленной сети внутриклеточных метаболических процессов [30, 31]. Использование математических методов оказывается плодотворным даже при том, что хлоропласты имеют сложную топологию – неоднородное распределение пигмент-белковых комплексов вдоль тилакоидных мембран [32, 33]. В данной работе основное внимание уделено анализу механизмов метаболического контроля в хлоропластах при функционировании ЦКБ и в условиях псевдоциклического транспорта электронов. Показано, что многофазная кинетика фотоокисления Р700 (первичный донор электронов в ФС1) отражает перераспределение электронных потоков между циклическим и нециклическим путями переноса электронов, обусловленное активацией ЦКБ вследствие защелачивания стромы, а также смену лимитирующей стадии в цепи переноса электронов, индуцированную уменьшением рН внутритилакоидного пространства (pHin). По мере снижения pHin поток электронов между ФС2 и ФС1 ослабевает вследствие замедления окисления пластохинола и ослабления активности ФС2 в результате нефотохимического тушения (НФТ) возбуждения молекул хлорофилла.
ОПИСАНИЕ МОДЕЛИ
В основу модели, использованной в настоящей работе, легла модель фотосинтетических процессов оксигенного типа, подробно описанная в [23–29, 34–39]. Схема рассматриваемых процессов электронного транспорта показана на рис. 1. Модель описывает альтернативные пути переноса электронов в хлоропластах: (1) нециклический перенос электронов от ФС2 к ФС1 и далее к NADP+, (2) псевдоциклический транспорт электронов с участием молекулярного кислорода в качестве акцептора электрона в ФС1, и (3) циклический перенос электронов вокруг ФС1. Наряду с этим рассматриваются процессы трансмембранного переноса протонов и синтеза АТР из ADP и неорганического фосфата (Pi). Описывается поведение следующих переменных: $[{\text{P}}_{{700}}^{ + }]$ – концентрация окисленных центров Р700 (первичный донор электронов в ФС1), $[{\text{P}}_{{680}}^{ + }]$ – концентрация окисленных центров Р680 (первичный донор электронов в ФС2), [Pc] – концентрация окисленных переносчиков – непосредственных доноров электронов для окисленных центров ${\text{P}}_{{700}}^{ + }$ (пластоцианин в хлоропластах и/или цитохром с6 у цианобактерий), [PQ] – концентрация окисленного пластохинона, [Fd] – концентрация окисленного ферредоксина, [N+] и [NH] – концентрации терминального акцептора ФС1 в окисленной и восстановленной формах – NADP+ и NADPH соответственно. Переменная [ATP] описывает изменения концентрации АТP. Переменные $[{\text{H}}_{{{\text{in}}}}^{ + }]$ и $[{\text{H}}_{{{\text{out}}}}^{ + }]$ описывают изменения концентраций ионов водорода во внутритилакоидном пространстве и в строме соответственно. При моделировании считается, что все переносчики электронов распределены однородно в мембране тилакоида и скорость переноса электронов не лимитируется диффузией мобильных переносчиков электрона (см. обоснование в [15, 22, 28]). Система обыкновенных дифференциальных уравнений, описывающих поведение переменных модели во времени, подробно описана нами ранее в [29].
Рис. 1.
Процессы электронного и протонного транспорта, рассматриваемые в модели. Обозначения: Fd – ферредоксин; FNR – ферредоксин-NADP-редуктаза; FQR – ферредоксин-хинон-редуктаза; Р700 и Р680 – первичные доноры электрона фотосистемы 1 (ФС1) и фотосистемы 2 (ФС2) соответственно; Рс – пластоцианин; РQ – пластохинон (окисленная форма); РQH2 – пластохинол (восстановленная форма); b6 f – цитохромный комплекс b6 f. ЦКБ – цикл Кальвина–Бенсона. Константы у стрелок характеризуют скорости соответствующих реакций (подробности в тексте). Цифрами обозначены моделируемые пути электронного транспорта от ферредоксина: 1 – в ЦКБ, 2 – на молекулярный кислород (реакция Мелера), 3 – циклический путь вокруг ФС1.
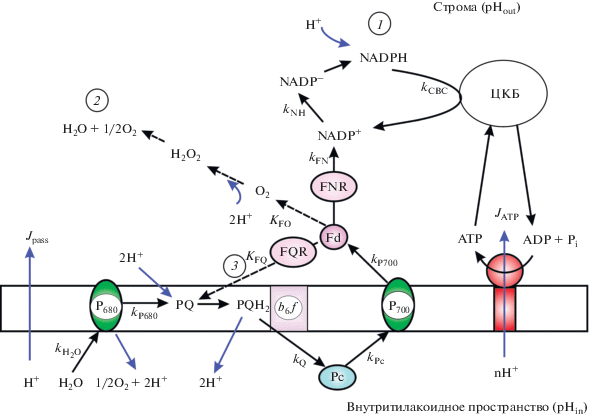
Процессы электронного транспорта. Поток электронов от ФС1 к NADP+ (JNADP) обеспечивает образование NADPH за счет электронов поступающих от ФС2 (нециклический транспорт электронов: Н2О → ФС2 → PQ → b6f → ФС1 → Fd → → NADP+). Акцептором электрона в ФС1 служит ферредоксин (Fd). Два электрона от двух восстановленных молекул Fd (Fd−) переносятся на NADP+ через ферредоксин-NADP-редуктазу (FNR). Восстановленная молекула NADP− протонируется за счет ионов водорода, поступающих из стромы (NADP− + Н+ → NADPН). Потребление NADPН и ATР описывается феноменологически с помощью функции kCBC([NADPН],[ATР],pHout), зависящей от концентраций [NADPН], [ATР] и рН стромы (pHout), как предложено в работах [23, 24]. В модели предусмотрено, что фотоиндуцированное защелачивание стромы (увеличение pHout) ускоряет потребление NADPН и ATР в ЦКБ (сигмоидная зависимость kCBC от pHout).
Второй путь оттока электронов от ФС1 – перенос электрона от ФС1 на молекулу О2 (реакция Мелера [40–42]). В результате этого образуются супероксидные радикалы ${\text{O}}_{2}^{{ \bullet - }}$, которые дисмутируют с образованием пероксида водорода (Н2О2) и молекулярного кислорода (2${\text{O}}_{2}^{{ \bullet - }}$+ 2Н+ → → Н2О2 + О2); молекулы Н2О2 разлагаются до О2 и воды. Таким образом, электроны от молекулы воды, разлагаемой в ФС2, переносятся к молекулам О2, при этом конечным продуктом оказывается молекула воды (так называемый цикл вода–вода, Н2О → ФС2 → ФС1 → Н2О). Как и в случае нециклического переноса электронов, функционирование цикла вода–вода приводит к накоплению протонов в люмене.
Циклический поток электронов вокруг ФС1, при котором электроны возвращаются от Fd через ферредоксин-хинон-редуктазу (FQR) в ЦЭТ между ФС2 и ФС1 (на уровне пластохинона), обычно называют коротким циклом [43, 44]. Возможен, в принципе, и длинный путь циклического переноса электронов вокруг ФС1, когда электроны от NADPH возвращаются в ЦЭТ (на пластохиноновый участок) через NAD(P)-оксидоредуктазу [45]. Однако эффективность работы длинного пути циклического транспорта электронов, как правило, незначительна и поэтому в данной работе этот путь не учитывали.
Процессы трансмембранного переноса протонов. В модели рассматривается накопление протонов внутри тилакоидов в результате разложения воды в ФС2 и окисления QH2 цитохромным b6 f-комплексом. Учитывается, что ионы водорода, локализованные внутри (люмен) и снаружи (строма) тилакоидов, могут связываться с протон-акцепторными (буферными) группами (Buf), концентрация которых значительно превышает концентрацию электронных переносчиков ([Buf]/[ФС1] ~ 100; подробнее см. [46]). Влияние буферных групп сказывается на скорости достижения стационарного состояния системы; однако, как отмечено ранее [46], стационарные значения переменных модели не должны зависеть от буферной емкости хлоропластов.
Выход протонов из тилакоидов в строму может происходить двумя путями: через АТР-синтазу (сопряженный с синтезом АТР поток протонов JATP) и путем пассивной утечки протонов, не связанной с синтезом АТР (поток протонов ${{J}_{{{{{\text{H}}}^{ + }}}}}$). В модели также учитывается обмен протонами между стромой и цитозолем (поток протонов Jcell, см. подробнее [23–25]). Мы предполагаем, что концентрации ионов водорода в строме и в люмене не зависят от пространственных координат, что эквивалентно условию “быстрого перемешивания”. Значение pHcyt в цитозоле (пространство между оболочкой хлоропласта и клеточной мембраной) считается постоянным за счет высокой буферной емкости цитоплазмы (pHcyt 8).
Параметры модели. Система кинетических уравнений и методология выбора эффективных констант скоростей процессов, обозначенных на рис. 1, подробно описаны в наших работах [23–29]. Ключевой стадией, определяющей скорость переноса электронов между ФС2 и ФС1, является окисление пластохинола (QH2) цитохромным b6 f-комплексом. Скорость этой реакции, как известно [15, 18–22], зависит от концентрации ионов водорода внутри тилакоидов, [${\text{H}}_{{{\text{in}}}}^{ + }$]. Скорость окисления QH2 характеризуется функцией kQ = f([Q],[Pc],[${\text{H}}_{{{\text{in}}}}^{ + }$]). Значение kQ обратно пропорционально величине ${{\tau }_{{\text{Q}}}}$ – характерному времени окисления QH2. Это время определяется скоростью взаимодействия QH2 с цитохромным b6 f-комплексом и переносом электрона на молекулу пластоцианина [46].
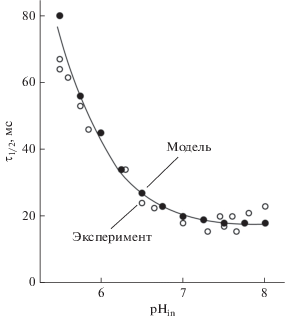
Выбор функции kQ = f([Q],[Pc],[${\text{H}}_{{{\text{in}}}}^{ + }$]) сделан на основании сравнения экспериментальной и теоретической зависимостей скорости восстановления окисленных центров ${\text{P}}_{{700}}^{ + }$ от pHin после выключения света. Адекватный выбор этой функции играет ключевую роль при моделировании явления фотосинтетического контроля в хлоропластах. Для построения функции kQ = f([Q],[Pc],[${\text{H}}_{{{\text{in}}}}^{ + }$]) мы использовали экспериментальную кривую, отражающую зависимость от рНin времени полувосстановления ${\text{P}}_{{700}}^{ + }$ после выключении белого света [47–49]. Рис. 2 показывает, что модельная рН-зависимость скорости восстановления ${\text{P}}_{{700}}^{ + }$ находится в хорошем согласии с экспериментом; при уменьшении рНin скорость переноса электрона к ${\text{P}}_{{700}}^{ + }$ замедляется. В качестве дополнительного критерия адекватного выбора функции kQ([Q],[Pc],[${\text{H}}_{{{\text{in}}}}^{ + }$]) мы использовали экспериментальные данные о значениях рНin в метаболических состояниях 3 (условия интенсивного синтеза АТР) и 4 (состояние “фотосинтетического контроля”). При этом мы исходили из того, что стационарные значения pH люмена равны рНin ≈ ≈ 6.0−6.25 (состояние 3) и рНin ≈ 5.5−5.75 (состояние 4) [47, 50, 51]. Для описания потребления АТР и NADPH в ЦКБ мы использовали функцию ${{k}_{{{\text{CBC}}}}}([{\text{ATP],[NADPH],p}}{{{\text{H}}}_{{{\text{out}}}}})$, которая описывает активацию реакций ЦКБ в зависимости от рН стромы (pHout). Подробное описание этой функции дано в наших работах [23–25].
Рис. 2.
Экспериментальная и теоретическая зависимости времени полувосстановления ${\text{P}}_{{700}}^{ + }$ после выключения белого света от рН внутритилакоидного пространства. Светлые точки – эксперимент, темные точки – расчет. Экспериментальные точки получены для суспензии разобщенных хлоропластов, по материалам работы [49].
Можно найти множество работ, посвященных моделированию работы АТР-синтазы (например, на основе кинетических моделей с несколькими состояниями; см., например, обзоры [52, 53]). Для описания работы АТР-синтазы нами использована сравнительно простая модель работы АТР-синтазы, предложенная в [54]. Для моделирования процессов трансмембранного переноса протонов мы использовали функции, описывающие активный (сопряженный с синтезом АТР, JATP) и пассивный (утечка протонов через мембрану, ${{J}_{{{{{\text{H}}}^{ + }}}}}$) потоки протонов, которые зависят от разности концентраций ионов водорода [${\text{H}}_{{{\text{in}}}}^{ + }$] и [${\text{H}}_{{{\text{out}}}}^{ + }$]. Поток протонов JATP зависит также от соотношения концентраций ADP и ATP – субстрата и продукта реакции, катализируемой АТР-синтазой. Обоснование того, как выбирается функция, описывающая трансмембранный перенос протонов через АТР-синтазу, а также описание функций и констант, определяющих потоки JATP и ${{J}_{{{{{\text{H}}}^{ + }}}}}$, дано в нашей работе [29]. Конкретные значения констант, входящих в формулы потоков JATP и ${{J}_{{{{{\text{H}}}^{ + }}}}}$, выбраны путем фитирования экспериментальных данных так, чтобы получить наилучшее согласие расчетных и экспериментальных величин pHin и скорости синтеза АТР при различных значениях pHout. Функция утечки протонов, описывающая обмен протонами между стромой и цитозолем (Jcell), выбрана аналогично функции JН+ [25, 27, 29].
Вариации в стехиометрии пигмент-белковых комплексов ФС1 и ФС2 учитывали, выбирая разные соотношения параметров L1 и L2, характеризующих число квантов света, попадающих в единицу времени к Р700 и Р680 соответственно. Принято, что дальний красный свет (ДКС), возбуждающий преимущественно ФС1, соответствует отношению L1/L2 = 10, а белый свет (БС), эффективно возбуждающий обе фотосистемы, соответствует отношению L1/L2 = 0.8. Такие соотношение L1/L2 выбрано нами, исходя из сравнения спектров действия ФС1 и ФС2 [55, 56]. Кроме этого, как показали результаты наших предыдущих исследований [24, 25, 38], выбирая данные соотношения параметров L1 и L2, удается получить вполне правдоподобное описание многофазной кинетики фотоиндуцированных превращений Р700 в листьях высших растений. Для моделирования НФТ возбуждения молекул хлорофилла в светособирающей антенне ФС2, которое, как известно [57], усиливается при закислении внутритилакоидного пространства, мы задавали L2 в виде функции L2(рНin), уменьшающейся по мере снижения рН внутритилакоидного пространства (см. подробнее [29]). Максимальное ослабление активности ФС2 за счет генерации НФТ (в модели этому соответствует уменьшение параметра L2) в результате снижения pHin принималось равным трем (при pHin ≤ 5.5).
В качестве начальных условий, если не оговорено специально, считали что пулы пластохинона и Fd окислены, а Р700, Р680 и пластоцианина восстановлены. Эти условия были приняты из следующих соображений. Пластоцианин − это высокопотенциальный переносчик электронов ($E_{{\text{m}}}^{{\text{'}}}$ ~ +380 мВ), который, как и Р700 ($E_{{\text{m}}}^{{\text{'}}}$ ~ +500 мВ), после адаптации хлоропластов к темноте находится в восстановленном состоянии. Действительно, эффективный редокс-потенциал стромы гораздо ниже (см., например, [58]), а потому практически все молекулы Р700 и Рс в начальном состоянии должны находиться в восстановленном состоянии. В соответствии с экспериментальными данными [18, 19, 59, 60] общую концентрацию молекул пластохинона (двухэлектронный переносчик) приняли в 10 раз больше [Р700], концентрации пластоцианина – в 1.5 раза, а Fd – в 7 раз больше [Р700].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Метаболический контроль в хлоропластах класса Б. В настоящем разделе представлены результаты моделирования процессов, связанных с переходами между метаболическими состояниями (состояние 3 → состояние 4) в условиях псевдоциклического транспорта электронов (H2O → → ФС2 → QH2 → b6 f → Pc → ФС1 → O2). В хлоропластах класса Б, лишенных оболочки, отсутствуют ферменты ЦКБ; однако при этом сохраняется целостность (замкнутость) тилакоидов, благодаря чему хлоропласты класса Б способны генерировать ΔpH и синтезировать АТР. Значение рН внешней среды принято равным рН 8. Этот выбор обусловлен тем, что мы моделируем рН-зависимые метаболические переходы в изолированных хлоропластах класса Б, суспендированных в буфере с рН 8, изученные ранее [15, 48]. Такой выбор рН определяется тем, что максимальная скорость синтеза АТР в хлоропластах класса Б наблюдается при рН 8 [33].
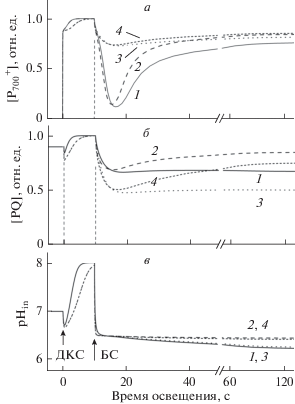
Основные закономерности фотосинтетического контроля, связанного с переходами между метаболическими состояниями 3 и 4, адекватно описываются в рамках нашей модели. На рис. 3 показаны результаты моделирования кинетики фотоиндуцированных окислительно-восстановительных превращений P700 (а) и PQ (б), а также изменений рНin (в) в хлоропластах класса Б. Предполагается, что в строме pHout 8 = const. В согласии с экспериментальными данными [48, 49] расчеты показали, что освещение хлоропластов ДКС, возбуждающим преимущественно ФС1, индуцирует окисление P700. При этом также окисляется PQ. После включения БС, эффективно возбуждающего обе ФС, происходит быстрое восстановление ${\text{P}}_{{700}}^{ + }$ за счет притока электронов по ЦЭТ от ФС2 к ФС1. Ход кинетической кривой зависит от метаболического состояния хлоропластов. В отсутствие ADP, когда не происходит синтеза АТР (состояние 4), наблюдается незначительный спад концентрации ${\text{P}}_{{700}}^{ + }$ (рис. 3а), что отражает торможение переноса электронов вследствие снижения значений рН люмена до рНin ≈ 5.8 при внешнем рНout 8 (рис. 3в). В условиях синтеза АТР (состояние 3) протоны из люмена выходят во внешнее пространство через активно функционирующие АТР-синтазные комплексы. При этом рНin снижается слабее, чем в состоянии 4, а потому поддерживается высокая скорость переноса электронов между ФС2 и ФС1 в состоянии 3. Более интенсивный поток электронов между ФС сопровождается заметным снижением [${\text{P}}_{{700}}^{ + }$] и некоторым увеличением [PQ].
Рис. 3.
Расчетная кинетика фотоиндуцированных изменений относительных концентраций окисленных реакционных центров ${\text{P}}_{{700}}^{ + }$ (а), окисленного пластохинона PQ (б) и фотоиндуцированных изменений внутритилакоидного рНin (в) в зависимости от метаболического состояния хлоропласта класса Б. Состояние 3 – активный синтез ATP (в исходном состоянии [ATP]0/[P700]0 = 150), состояние 4 – фотосинтетический контроль (АТР-синтаза неактивна), состояние 5 – разобщенные хлоропласты (ΔрН = 0).
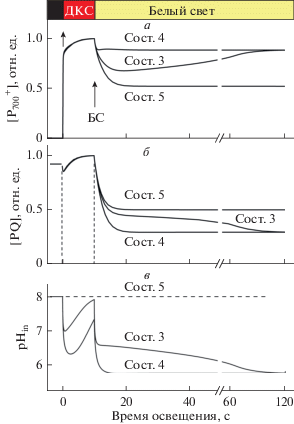
По мере истощения пула молекул ADP хлоропласты переходят в метаболическое состояние 4. При этом [${\text{P}}_{{700}}^{ + }$] возрастает и в конечном итоге достигает уровня, характерного для состояния 4. В то же время, концентрация окисленного пластохинона уменьшается из-за замедления скорости окисления QH2 в результате снижения pHin (рис. 3в). При моделировании разобщенных хлоропластов (состояние 5), когда pHin = pHout = = const, скорость переноса электронов сохраняется высокой на протяжении всего времени действия БС, при этом происходит более заметное снижение [${\text{P}}_{{700}}^{ + }$] и уменьшается концентрация восстановленного пластохинона.
О скорости переноса электронов между ФС можно судить по кинетике восстановления ${\text{P}}_{{700}}^{ + }$ после выключения света [48, 49]. Если $\tau _{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}^{{}}$ − суть время полувосстановления ${\text{P}}_{{700}}^{ + }$, то обратная величина $\tau _{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}^{{ - 1}}$ может служить параметром, характеризующим скорость переноса электронов к окисленным центрам ${\text{P}}_{{700}}^{ + }$. Рис. 4 иллюстрирует сказанное. На панели 4а показано, как происходит спад переменной [${\text{P}}_{{700}}^{ + }$] в ответ на выключение света после 20 с действия БС. Скорость спада [${\text{P}}_{{700}}^{ + }$] зависит от метаболического состояния хлоропластов: в состоянии 4 восстановление ${\text{P}}_{{700}}^{ + }$ происходит медленнее, чем в условиях синтеза АТР (состояние 3) или в состоянии 5 (разобщенные хлоропласты).
Рис. 4.
Кинетика спада переменной [${\text{P}}_{{700}}^{ + }$] после действовавшего в течение 20 с белого света, рассчитанная для различных состояний хлоропластов класса Б (панель а). Обозначения кинетических кривых соответствуют метаболическим состояниям 3в, 4 и 5 (см. определение в тексте). На панели б показаны расчетные зависимости скорости переноса электронов между ФС2 и ФС1 (параметр $\tau _{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}^{{ - 1}}$ ) от длительности действия белого света при различных метаболических состояниях хлоропласта класса Б. Кривые 3а, 3б, 3в относятся к состоянию 3 при различных исходных концентрациях АТP: а – [ATP]0/[P700]0 = 100, б – [ATP]0/[P700]0 = 150, в – [ATP]0/[P700]0 = 200.
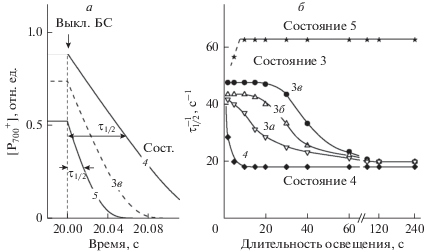
На рис. 4б показано как меняется значение кинетического параметра $\tau _{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}^{{ - 1}}$, характеризующего скорость восстановления ${\text{P}}_{{700}}^{ + }$, по мере действия БС. Зависимость параметра $\tau _{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}^{{ - 1}}$ от длительности действия БС свидетельствует, что скорость переноса электронов между ФС2 и ФС1 замедляется при переходе от метаболического состояния 3 в состояние “фотосинтетического контроля” (состояние 4). В отсутствие добавленного АТР торможение электронного транспорта наступает за время, равное ≈5 с, что обусловлено быстрым снижением рНin. В метаболическом состоянии 3 (при избытке ADP) скорость переноса электронов остается высокой в начальный период освещения, поскольку утечка протонов через CF0–CF1 предотвращает слишком сильное закисление люмена (pHin ~ 6.2 при pHout 8.0). Создаваемая в состоянии 3 разность рН (ΔpH = 1.8) достаточна, чтобы поддерживать интенсивный синтез АТР [50]. При этом вследствие умеренного закисления люмена поток электронов между ФС2 и ФС1 остается высоким. По мере истощения ADP и образования избытка АТР приток электронов к ${\text{P}}_{{700}}^{ + }$ замедляется. Это происходит вследствие дополнительного снижения рНin, что отражает смену метаболических состояний (состояние 3 → состояние 4). Результаты расчетов для разных исходных концентраций ADP хорошо согласуются с экспериментальными данными [15]. Как видно из рис. 4б, задержка, предшествующая торможению электронного транспорта (переход хлоропластов из состояния 3 в состояние 4), возрастает при увеличении исходной концентрации ADP, добавленного к хлоропластам, в согласии с измерениями скорости переноса электронов между ФС2 и ФС1 в хлоропластах класса Б [15]. В то же время, в состояниях 4 (ΔpH = 2.2 = const) и 5 (ΔpH = 0) скорости электронного транспорта остаются постоянными.
Сопоставление расчетных (рис. 4) и экспериментальных (рис. 5) данных показывает, что наша модель правильно отражает основные закономерности рН-зависимой регуляции псевдоциклического электронного транспорта. На рис. 5 приведены данные по динамике изменений кинетического параметра $\tau _{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}^{{ - 1}}$, полученные на основании исследования кинетики восстановления ${\text{P}}_{{700}}^{ + }$ в зависимости от длительности освещения изолированных хлоропластов бобов (Vicia faba) класса Б [15] и листьев китайской розы (Hibiscus rosa-sinensis) [61]. В отсутствие добавленного ADP (состояние 4) в хлоропластах бобов происходит быстрое замедление электронного транспорта, обусловленное достаточно сильным снижением рН внутритилакоидного пространства, характерным для состояния 4 (pHin ~ 5.5). В присутствии добавленного ADP (2 мМ) торможения электронного транспорта не наблюдалось до тех пор, пока спустя ≈20 с после начала освещения не происходило замедления переноса электронов, обусловленного дополнительным снижением pHin в результате ослабления работы АТР-синтезы из-за истощения АТР (переход в состояние 4). Длительность задержки Δt, которая характеризует нахождение хлоропластов в состоянии 3, зависела от концентрации добавленного ADP: лаг-фаза Δt возрастала по мере увеличения концентрации молекул ADP, добавленных в суспензию хлоропластов [15].
Рис. 5.
Динамика изменений кинетического параметра $\tau _{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}^{{ - 1}}$, построенная на основании результатов экспериментального исследования кинетики восстановления ${\text{P}}_{{700}}^{ + }$, в зависимости от длительности освещения изолированных хлоропластов бобов (Vicia faba) класса Б (по результатам работы [15]) и листьев китайской розы (Hibiscus rosa-sinensis) (по результатам работы [61]). В опытах с изолированными хлоропластами бобов, суспензия содержала 10 мкМ метилвиологен (медиатор переноса электронов от ФС1 к молекулярному кислороду). Кроме того, в суспензию хлоропластов добавлено 2 мМ ADP (темные точки) или 10 мкМ АТP (светлые ромбы), как отмечено на рисунке. Остальные условия (методики выделения хлоропластов и проведения кинетических измерений методом ЭПР) описаны ранее (см. подробнее [15] и цитированные там работы). Параметр Δt характеризует время перехода хлоропластов из метаболического состояния 3 в состояние 4.
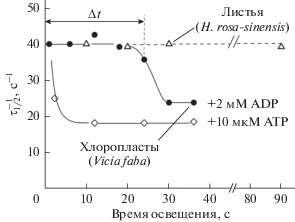
На рис. 5 также приведены данные по динамике изменений параметра $\tau _{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}^{{ - 1}}$, полученные для хлоропластов in situ в листьях китайской розы [61]. В этом случае постоянное значение $\tau _{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}^{{ - 1}}$ сохранялось при более длительном освещении листьев. Очевидно, это обусловлено тем, что в интактных хлоропластах, в отличие от изолированных хлоропластов класса Б, происходит регенерация ADP в результате гидролиза АТР при потреблении ADP в ЦКБ и других метаболических циклах.
рН-зависимая регуляция электронного транспорта в интактных хлоропластах. В интактных хлоропластах фотосинтетический транспорт электронов регулируется на двух участках ЦЭТ: (1) между ФС2 и ФС1, (2) на стадии оттока электронов от ФС1 в ЦКБ [21]. Кинетика фотоокисления Р700 определяется соотношением скоростей оттока и притока электронов к ФС1. Наблюдаемое в эксперименте увеличение концентрации ${\text{P}}_{{700}}^{ + }$ может быть обусловлено не только ускорением оттока электронов от ФС1 в результате активации ЦКБ, но и ослаблением притока электронов к ${\text{P}}_{{700}}^{ + }$ вследствие фотоиндуцированного закисления люмена [61, 62]. Уменьшение pHin может замедлять окисление QH2 цитохромным b6 f-комплексом [15, 19–21], а также ослаблять активность ФС2 вследствие усиления НФТ возбуждения молекул хлорофилла в светособирающей антенне ФС2 [52]. Все три фактора регуляции электронного транспорта − активация ЦКБ, замедление окисления QH2 и усиление НФТ − зависят от фотоиндуцированных изменений рН в строме и люмене. Светоиндуцированное защелачивание стромы (рНоut 7 → рНоut 8) способствует ускорению реакций ЦКБ, в то время как снижение pHin вызывает замедление притока электронов к ${\text{P}}_{{700}}^{ + }$. Фотоиндуцированные изменения рНоut и pHin проявляются в кинетике фотоокисления Р700 в интактных хлоропластах, адаптированных к темноте [61, 62]. Перераспределение электронных потоков между нециклическими и циклическими путями также может сказываться на кинетике окислительно-восстановительных превращений Р700.
Моделирование электрон-транспортных процессов с учетом ЦКБ и НФТ позволило нам описать вклад отмеченных выше факторов в кинетику фотоиндуцированных превращений Р700 в листьях высших растений. На рис. 6 приведены результаты численных экспериментов, моделирующих влияние рН-зависимой регуляции ЦКБ и электронного транспорта между ФС2 и ФС1 на кинетику фотоиндуцированных редокс-превращений Р700 (а), пластохинона (б), а также на изменения внутрилакоидного рНin (в). Расчеты выполнены для начальных условий, соответствующих окисленному пулу пластохинона и избытку АDP. Вначале “включали” ДКС, возбуждающий преимущественно ФС1, а затем БС, возбуждающий обе ФС. Из рис. 6а видно, что функционирование цепи циклического транспорта электронов вокруг ФС1 несколько замедляет окисление Р700 и PQ при действии ДКС. Заметно более сильное влияние циклического транспорта проявляется при действии БС. В случае, когда работает лишь цепь нециклического транспорта (кривые 1 и 2), происходит заметный спад [${\text{P}}_{{700}}^{ + }$] в ответ на включение БС. В этих условиях, когда циклический транспорт электронов пренебрежимо мал, кинетическая кривая имеет немонотонный вид с “провалом” в первое время после включения БС. Это обусловлено тем, что ЦКБ не активен в начальный период освещения, а потому отток электронов от ФС1 тормозит фотоокисление Р700. По мере активации ЦКБ отток электронов от ФС1 усиливается, благодаря чему происходит рост [${\text{P}}_{{700}}^{ + }$]. Интересно, что циклический транспорт электронов (кривые 3 и 4) способствует окислению Р700 в условиях низкой активности ЦКБ. Это происходит вследствие того, что отток электронов от ФС1 облегчается из-за окисления Fd− за счет работы цепи циклического транспорта электронов (ФС1 → Fd → PQ). Заметный вклад циклического транспорта четко проявляется в начальный период освещения БС, составляющий около 20 с (кривые 3 и 4). За счет перераспределения потоков на акцепторной стороне ФС1 провал на кинетической кривой ${\text{P}}_{{700}}^{ + }$ практически исчезает.
Рис. 6.
Кинетики фотоиндуцированных изменений относительных концентраций окисленных реакционных центров ${\text{P}}_{{700}}^{ + }$ (а), окисленного пластохинона PQ (б) и фотоиндуцированных изменений внутритилакоидного рНin (в), расcчитанные с учетом различных условий электронного транспорта в интактных хлоропластах. Кривая 1 – контроль (без учета НФТ при низкой интенсивности циклического транспорта электронов вокруг ФС1), 2 – нефотохимическое тушение (максимальное ослабление активности ФС2 3 раза), 3 – циклический транспорт вокруг ФС1 (константа kFQ увеличена в 10 раз по сравнению с кривыми 1 и 2), 4 – НФТ и циклический перенос электронов вокруг ФС1.
Форма кривой фотоокисления Р700 зависит также от того, учтено ли в расчетах влияние НФТ. Генерация НФТ приводит к тому, что ${\text{P}}_{{700}}^{ + }$ достигает стационарного состояния быстрее, чем без НФТ, при этом устанавливается более высокий стационарный уровень ${\text{P}}_{{700}}^{ + }$ (кривая 2). Это связано с тем, что при НФТ приток электронов от ФС2 к ФС1 уменьшается, поскольку активность ФС2 ослабевает вследствие усиления рассеяния энергии в светособирающей антенне ФС2.
Кинетические кривые для концентраций окисленного пластохинона ([PQ]) показаны на рис. 6б. Первоначально практически все молекулы PQ находятся в окисленном состоянии, что характерно для хлоропластов, адаптированных к темноте. После включения БС происходит быстрое восстановление части пластохинонового пула. Учет НФТ и цепи циклического транспорта существенно влияет на кинетику фотоиндуцированных изменений [PQ] (кривые 2 и 4). Если НФТ неактивно (кривые 1 и 3), то пул пластохинона восстановлен более заметно вследствие замедления окисления PQH2 из-за более сильного закисления люмена (рис. 6в). По сравнению с кинетикой фотоокисления ${\text{P}}_{{700}}^{{}}$, влияние НФТ на кинетику окислительно-восстановительных превращений пластохинона проявляется заметнее и приводит к повышению стационарного уровня PQ. Это объясняется тем, что PQ является акцептором электронов, донируемых ФС2, а НФТ ослабляет работу ФС2.
Динамика фотоиндуцированных изменений рНin показана на рис. 6в. Интересно, что кинетика изменений pHin практически не зависит от работы цепи циклического электронного транспорта вокруг ФС1 (ср. кривые 1 и 3). Это объясняется тем, что ЦЭТ влияет на перераспределение потоков на акцепторной стороне ФС1 во время индукционной фазы, но практически не затрагивает трансмембранные потоки протонов и работу АТР-синтазы. Как и следовало ожидать, в этом случае кинетические кривые, отражающие изменения pHin (рис. 6в) и [АТР] (рис. 7б), практически не изменяются при наличии ЦЭТ вокруг ФС1. С другой стороны, кинетика закисления люмена чувствительна к НФТ. Если не работает механизм активации НФТ (кривые 1 и 3, рис. 6в), то происходит более сильное снижение pHin, чем в случае генерации НФТ (кривые 2 и 4). Включение НФТ несколько ослабляет фотоиндуцированный спад pHin, что отражается на кинетике фотоиндуцированных изменений переменных [${\text{P}}_{{700}}^{ + }$] и [PQ]. Кинетика фотоиндуцированных изменений переменной [ATP] также оказалась чувствительной к НФТ: стационарный уровень, отражающий баланс производства-потребления АТР оказался при этом на 20% ниже (кривые 2 и 4, рис. 7б).
Рис. 7.
Расчетные зависимости скорости переноса электронов между ФС2 и ФС1 (параметр $\tau _{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}^{{ - 1}}$) от длительности действия белого света (а) и кинетические кривые, отражающие скорость производства-потребления АТР (б) с учетом факторов, влияющих на электронный транспорт; ослабление активности ФС2 вследствие усиления нефотохимического тушения возбуждения молекул хлорофилла в светособирающей антенне ФС2 и перераспределение электронных потоков между нециклическим и циклическими путями. Номера кривых соответствуют таковым на рис. 6. Для сравнения на панели (б) приведены расчетные кинетические кривые, моделирующие изменения [ATP] в хлоропластах класса Б в метаболических состояниях 3 и 4. Предполагается, что в состоянии 3 начальный уровень АТР составлял 10% от общей емкости пула нуклеотидов (ATP + ADP). В состоянии 4 синтез АТР не происходил, поскольку в этом случае было принято ΔpH = 0 (при pHout = 8 = const).
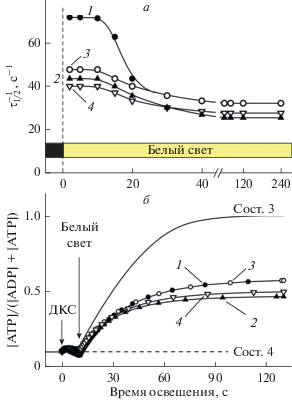
На рис. 7а представлены результаты расчетов кинетического параметра $\tau _{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}^{{ - 1}}$, характеризующего скорость восстановления ${\text{P}}_{{700}}^{ + }$, в зависимости от длительности действия БС на интактные хлоропласты. Зависимость $\tau _{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}^{{ - 1}}$ от длительности освещения показывает как скорость переноса электронов между ФС2 и ФС1 зависит от таких факторов регуляции электронного транспорта, как НФТ (кривые 2 и 4) и работа ЦЭТ вокруг ФС1 (кривые 3 и 4). Как и в случае хлоропластов класса Б, замедление потока электронов между ФС2 и ФС1 обусловлено снижением рНin люмена. Если генерации НФТ не происходит, то поток электронов остается высоким в течение первых 10 с освещения, затем наступает торможение электронного переноса. По мере дальнейшего действия БС различие между скоростями переноса электронов к ${\text{P}}_{{700}}^{ + }$ становится незначительным.
ЗАКЛЮЧЕНИЕ
Среди процессов регуляции фотосинтетического транспорта электронов в хлоропластах особый интерес представляют регуляторные механизмы, связанные с фотоиндуцированными изменениями рН стромы и люмена. Изменение внутритилакоидного рН является одним из главных факторов, контролирующих поток электронов между ФС2 и ФС1. Фотоиндуцированное уменьшение pHin вызывает замедление переноса электронов на участке ЦЭТ, связанном с b6 f-комплексом, и запускает механизм, способствующий увеличению рассеяния энергии в светособирающей антенне ФС2, препятствуя перевозбуждению реакционных центров ФС2 и чрезмерному закислению люмена. Эти механизмы обеспечивают стабильность работы фотосинтетического аппарата при изменении условий окружающей среды, например, при варьировании интенсивности освещенности и газового состава атмосферы [10–14].
Моделирование световых стадий фотосинтеза, учитывающее рН-зависимую регуляцию ключевых стадий фотосинтетического транспорта электронов, позволило адекватно описать ряд закономерностей сложной кинетики электрон-транспортных процессов в различных режимах работы хлоропластов. Показано, в частности, что многофазная кинетика фотоокисления Р700 определяется сменой лимитирующей стадии: переключение потоков электронов на акцепторном участке ФС1 и торможение электронного переноса между ФС2 и ФС1 за счет закисления люмена. Модель описывает переходы между метаболическими состояниями хлоропластов, обусловленные изменениями фосфатного потенциала за счет работы мембранной АТР-синтазы. При активном синтезе АТР в интактных хлоропластах соотношение [ATP]/[ADP] меняется от начального значения 0.1 до 0.5. При этом кинетическая кривая, отражающая скорость производства-потребления АТР не изменяется при варьировании циклического транспорта (см. рис. 7б, кривые 1 и 3), однако она оказалась чувствительной к работе НФТ: стационарный уровень, отражающий баланс производства-потребления АТР понижается (см. рис. 7б, кривые 1 и 2).
Одним из показателей адекватности нашей модели могут быть результаты расчетов и их сравнение с экспериментальными данными по динамике изменений кинетического параметра $\tau _{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}^{{ - 1}}$ в зависимости от длительности освещения изолированных хлоропластов бобов (V. faba) класса Б и листьев китайской розы (H. rosa-sinensis) (ср. рис. 4 и 5). Как показали численные эксперименты, многофазная кинетика фотоокисления Р700 отражает перераспределение электронных потоков между циклическим и нециклическим путями переноса электрона, обусловленное активацией ЦКБ вследствие защелачивания стромы, а также смену лимитирующей стадии в ЦЭТ, индуцированную уменьшением рН люмена. По мере снижения pHin поток электронов между фотосистемами ослабевает, что вызвано замедлением скорости окисления пластохинола и ослаблением активности ФС2 вследствие НФТ.
В заключение отметим, что дальнейшее развитие модели, направленное на детализацию процессов электронного переноса в ФС2 и ФС1, позволит расширить возможности описания взаимодействия хлоропластов с другими метаболическими системами растительной клетки. Развитие модели может идти по пути учета структурных перестроек тилакоидов, которые, в свою очередь, могут влиять на эффективность фотосинтетических процессов и регуляцию энергетического баланса в хлоропластах. Такие явления, как латеральная миграция белковых комплексов, фотоиндуцированное набухание–сжатие тилакоидов и изменение плотности упаковки тилакоидов в гранах, могут сказываться на переносе электронов между ФС2 и ФС1 и индукционных явлениях фотосинтеза. Кроме того, текучесть тилакоидной мембраны является одним из важнейших факторов, определяющих термоиндуцированные структурные перестройки в тилакоидных мембранах и влияющих на скорость процессов переноса электронов и протонов, синтеза АТР и других реакций фотосинтеза.
Работа выполнена при частичной финансовой поддержке Российского фонда фундаментальных исследований (№ 18-04-00214).
Список литературы
Albertsson P.-A. 2001. A quantitative model of the domain structure of the photosynthetic membrane. Trends Plant Sci. 6, 349–354.
Staehelin L.A. 2003. Chloroplast structure: From chlorophyll granules to supra-molecular architecture of thylakoid membranes. Photosynth. Res. 76, 185–196.
Dekker J.P., Boekema E.J. 2005. Supramolecular organization of thylakoid membrane proteins in green plants. Biochim. Biophys. Acta. 1706, 12–39.
Blankenship R.E. 2002. Molecular Mechanisms of Photosynthesis. Malden, MA: Blackwell Science Inc.
Nelson N., Yocum C.F., 2006. Structure and function of photosystems I and II. Annu. Rev. Plant. Biol. 57, 521–565.
Mamedov M., Govindjee, Nadtochenko V., Semenov A. 2015. Primary electron transfer processes in photosynthetic reaction centers from oxygenic organisms. Photosynth. Res. 125, 51–63.
Эдвардс Дж., Уокер Д. 1986. Фотосинтез С3 и С4 растений: механизмы и регуляция. М.: Мир. 598 с.
Anderson J.M. 1982. Distribution of the cytochromes of spinach chloroplasts between the appressed membranes of grana stacks and stroma-exposed thylakoid regions. FEBS Lett. 138, 62–66.
Dumas L., Chazaux M., Peltier G., Johnson X., Alric J. 2016. Cytochrome b6 f function and localization, phosphorylation state of thylakoid membrane proteins and consequences on cyclic electron flow. Photosynth. Res. 129, 307–320.
Horton P., Ruban A.V., Walters R.G. 1996. Regulation of light harvesting in green plants. Annu. Rev. Plant Physiol. Plant Mol. Biol. 47, 655–684.
Kramer D.M., Avenson T.J., Edwards G.E. 2004. Dynamic flexibility in the light reactions of photosynthesis governed by both electron and proton transfer reactions. Trends Plant Sci. 9, 349–357.
Rochaix J.-D. 2011. Regulation of photosynthetic electron transport. Biochim. Biophys. Acta. 1807, 375–383.
Horton P. 2012. Optimization of light harvesting and photoprotection: Molecular mechanisms and physiological consequences. Philos. Trans. Roy. Soc. B. 367, 3455–3465.
Kono M., Terashima I. 2014. Long-term and short-term responses of the photosynthetic electron transport to fluctuating light. J. Photochem. Photobiol. B. 137, 89–99.
Tikhonov A.N. 2013. pH-Dependent regulation of electron transport and ATP synthesis in chloroplasts. Photosynth. Res. 116, 511–534.
Balsera M., Schurmann P., Buchanan B.B. 2016. Redox regulation in chloroplasts. In: Chloroplasts: Current research and future trends. Ed. Kirchhoff H. Norfolk: Caister Acad. Press, pp. 187–207.
Wada M., Kagawa T., Sato Y. 2003. Chloroplast movement. Annu. Rev. Plant Biol. 54, 455–468.
Stiehl H.H., Witt H.T. 1969. Quantitative treatment of the function of plastoquinone in photosynthesis. Z. Naturforsch. B 24, 588–1598.
Siggel U., Renger G., Stiehl H.H., Rumberg B. 1972. Evidence for electronic and ionic interaction between electron transport chains in chloroplasts. Biochim. Biophys. Acta. 256, 328–335
Kramer D.M., Sacksteder C.A., Cruz J.A. 1999. How acidic is the lumen? Photosynth. Res. 60, 151–163.
Tikhonov A.N. 2015. Induction events and short-term regulation of electron transport in chloroplasts: An overview. Photosynth. Res. 125, 65–94.
Tikhonov A.N. 2018. The cytochrome b6 f complex: Biophysical aspects of its functioning in chloroplasts. In: Membrane Protein Complexes: Structure and Function, Subcellular Biochemistry. Eds Harris J.R., Boekema E.J. Singapore: Springer Nature, 87, 287—328.
Вершубский А.В., Приклонский В.И., Тихонов А.Н. 2001. Электронный и протонный транспорт в хлоропластах с учетом латеральной гетерогенности тилакоидов. Математическая модель. Биофизика. 46, 471–481.
Vershubskii A.V., Kuvykin I.V., Priklonsky V.I., Tikhonov A.N. 2011. Functional and topological aspects of pH-dependent regulation of electron and proton transport in chloroplasts in silico. Biosystems. 103, 164–179.
Вершубский А.В., Тихонов А.Н. 2013. Электронный транспорт и трансмембранный перенос протонов в фотосинтетических системах оксигенного типа in silico. Биофизика. 58, 75–89.
Tikhonov A.N., Vershubskii A.V. 2014. Computer modeling of electron and proton transport in chloroplasts. Biosystems. 121, 1–21.
Вершубский А.В., Мишанин В.И., Тихонов А.Н. 2014. Моделирование регуляции фотосинтетического транспорта электронов у цианобактерий. Биол. мембраны. 31, 110–128.
Tikhonov A.N. 2016. Modeling electron and proton transport in chloroplasts. In: Chloroplasts. Current research and future trends. Ed. Kirchhoff H. Poole: Caister Acad. Press, pp. 101–134.
Вершубский А.В., Невьянцев С.М., Тихонов А.Н. 2018. Моделирование электронного и протонного транспорта в мембранах хлоропластов с учетом тиоредоксин-зависимой активации цикла Кальвина–Бенсона и ATP-синтазы. Биол. мембраны. 35, 87–103.
Rubin A., Riznichenko G. 2014. Mathematical Biophysics. Series: Biological and Medical Physics, Biomedical Engineering, XV.
Ризниченко Г.Ю., Лебедева Г.В., Демин О.В., Беляева Н.Е., Рубин А.Б. 2000. Уровни регуляции процессов фотосинтеза. Биофизика. 45, 452–460.
Kovalenko I.B., Knyazeva O.S., Antal T.K., Ponomarev V.Y., Riznichenko G.Y., Rubin A.B. 2017. Multiparticle Brownian dynamics si mulation of experimental kinetics of cytochrome bf oxidation and photosystem I reduction by plastocyanin. Physiol. Plant. 161, 88–96.
Vershubskii A.V., Trubitsin B.V., Priklonskii V.I., Tikhonov A.N. 2017. Lateral heterogeneity of the proton potential along the thylakoid membranes of chloroplasts. Biochim. Biophys. Acta. 1859, 388–401.
Вершубский А.В., Приклонский В.И., Тихонов А.Н. 2004. Математическое моделирование электронного и протонного транспорта, сопряженного с синтезом АТФ в хлоропластах. Биофизика. 49, 57–71.
Вершубский А.В., Приклонский В.И., Тихонов А.Н. 2004. Влияние диффузионных и топологических факторов на эффективность энергетического сопряжения в хлоропластах с неоднородным латеральным распределением белковых комплексов в гранальных и межгранных тилакоидах. Математическое моделирование. Биохимия. 69, 1251–1260.
Вершубский А.В., Приклонский В.И., Тихонов А.Н. 2007. Взаимодействие фотосинтетической и дыхательной цепей электронного транспорта в клетках цианобактерий. Математическая модель. Химическая физика. 26, 54–64.
Кувыкин И.В., Вершубский А.В., Птушенко В.В., Тихонов А.Н. 2008. Кислород как альтернативный акцептор электрона в фотосинтетической цепи электронного транспорта С3-растений. Биохимия. 73, 1329–1343.
Кувыкин И.В., Вершубский А.В., Приклонский В.И., Тихонов А.Н. 2009. pH-зависимая регуляция электронного транспорта в хлоропластах. Компьютерное исследование. Биофизика. 54, 647–659.
Кувыкин И.В., Вершубский А.В., Тихонов А.Н. 2009. Альтернативные пути фотоиндуцированного электронного транспорта в хлоропластах. Химическая физика. 28, 64–76.
Heber U. 2002. Irrungen, wirrungen? The Mehler reaction in relation to cyclic electron transport in C3 plants. Photosynth. Res. 73, 223–231.
Ort D.R., Baker N.R. 2002. A photoprotective role for O2 as an alternative electron sink in photosynthesis? Curr. Opp. Plant Biol. 5, 193–197.
Черепанов Д.А., Милановский Г.Е., Петрова А.А., Тихонов А.Н., Семенов А.Ю. 2017. Перенос электрона на акцепторном участке фотосистемы 1: взаимодействие с экзогенными акцепторами и молекулярным кислородом. Биохимия. 82, 1593–1614.
Егорова Е.А., Бухов Н.Г. 2006. Механизмы и функции альтернативных путей переноса электронов в хлоропласте, связанных с фотосистeмой I. Физиология растений. 53, 645–657.
Puthiyaveetil S., Kirchhoff H., Hohner R. 2016. Structural and functional dynamics of the thylakoid membrane system. In: Chloroplasts: Current research and future trends. Ed. Kirchhoff H. Norfolk: Caister Acad. Press, pp. 59–87.
Burrows P.A., Sazanov L.A., Svab Z., Maliga P., Nixon P.J. 1998. Identification of a functional respiratory complex in chloroplasts through analysis of tobacco mutants containing disrupted plastid ndh genes. EMBO J. 17, 868–876.
Дубинский А.Ю., Тихонов А.Н. 1997 Математическая модель тилакоида как распределенной гетерогенной системы электронного и протонного транспорта. Биофизика. 42, 644–661.
Тихонов А.Н. 2012. Энергетическая и регуляторная роль протонного потенциала в хлоропластах. Биохимия. 77, 1155–1176.
Tikhonov A.N., Khomutov G.B., Ruuge E.K., Blumenfeld L.A. 1981. Electron transport control in chloroplasts. Effects of photosynthetic control monitored by the intrathylakoid pH. Biochim. Biophys. Acta. 637, 321–333.
Tikhonov A.N., Khomutov G.B., Ruuge E.K. 1984. Electron transport control in chloroplasts. Effects of magnesium ions on the electron flow between two photosystems. Photobiochem. Photobiophys. 8, 261–269.
Tikhonov A.N., Agafonov R.V., Grigor’ev I.A., Kiri-lyuk I.A., Ptushenko V.V., Trubitsin B.V. 2008. Spin-probes designed for measuring the intrathylakoid pH in chloroplasts. Biochim. Biophys. Acta. 1777, 285–294.
Kuvykin I.V., Ptushenko V.V., Vershubskii A.V., Tikhonov A.N. 2011. Regulation of electron transport in C3 plant chloroplasts in situ and in silico. Short-term effects of atmospheric СО2 and О2. Biochim. Biophys. Acta. 1807, 336–347.
Oster G., Wang H. 2000. Reverse engineering a protein: The mechanochemistry of ATP synthase. Biochim. Biophys. Acta. 1458, 482–510.
Романовский Ю.М., Тихонов А.Н. 2010. Молекулярные преобразователи энергии живой клетки. Протонная АТР-синтаза – вращающийся молекулярный мотор. Успехи физ. наук. 180, 931–956.
Дубинский А.Ю., Тихонов А.Н. 1995. Математическое моделирование фотоиндуцированного поглощения протонов хлоропластами для различных механизмов утечки протонов через тилакоидную мембрану. Биофизика. 40, 365−371.
Boichenko V.A. 1998. Action spectra and functional antenna sizes of photosystems I and II in relation to the thylakoid membrane organization and pigment composition. Photosynth. Res. 58, 163−174.
Laisk A., Oja V., Eichelmann H., Dall’Osto L. 2014. Action spectra of photosystems II and I and quantum yield of photosynthesis in leaves in State 1. Biochim. Biophys. Acta. 1837, 315−325.
Niyogi K.K., Truong T.B. 2013. Evolution of flexible non-photochemical quenching mechanisms that regulate light harvesting in oxygenic photosynthesis. Curr. Opin. Plant Biol. 16, 307–314.
Foyer C.H., Neukermans J., Queval G., Noctor G., Harbinson J. 2012. Photosynthetic control of electron transport and the regulation of gene expression. J. Exp. Bot. 63, 1637–1661.
Siggel U. 1976. The function of plastoquinone as electron and proton carrier in photosynthesis. Bioelectrochem. Bioenerg. 3, 302–318.
Hope A.B. 2000. Electron transfers amongst cytochrome f, plastocyanin and photosystem I: Kinetics and mechanisms. Biochim. Biophys. Acta. 1456, 5–26.
Рыжиков С.Б., Тихонов А.Н. 1988. Регуляция скорости переноса электрона в фотосинтетических мембранах высших растений. Биофизика. 33, 642–646.
Trubitsin B.V., Vershubskii A.V., Priklonskii V.I., Tikhonov A.N. 2015. Short-term regulation and alternative pathways of photosynthetic electron transport in Hibiscus rosa-sinensis leaves. J. Photochem. Photobiol. B. 152, 400–415.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


