Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 5, стр. 322-331
Низкомолекулярный агонист рецептора лютеинизирующего гормона стимулирует аденилатциклазу в тестикулярных мембранах и стероидогенез в семенниках крыс с диабетом 1 типа
А. А. Бахтюков a, К. В. Деркач a, Д. В. Дарьин b, А. М. Степочкина a, А. О. Шпаков a, *
a Институт эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук
194223 Санкт-Петербург, просп. Тореза, 44, Россия
b Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7/9, Россия
* E-mail: alex_shpakov@list.ru
Поступила в редакцию 12.04.2019
После доработки 06.05.2019
Принята к публикации 06.05.2019
Аннотация
Характерной чертой сахарного диабета 1-го типа (СД1) у человека и экспериментальных животных является андрогенная недостаточность, для компенсации которой обычно используют препараты гонадотропинов с активностью агонистов рецептора лютеинизирующего гормона (ЛГ), в том числе хорионический гонадотропин человека (ХГЧ). Однако применение гонадотропинов сопряжено с рядом побочных эффектов, а в условиях СД1 их стероидогенный эффект ослабляется. Альтернативой гонадотропинам могут стать низкомолекулярные агонисты рецептора ЛГ/ХГЧ на основе тиенопиримидинов, которые связываются с аллостерическим сайтом, локализованным в трансмембранном канале этого рецептора. В работе изучено стимулирующее влияние ХГЧ и разработанного нами ранее тиенопиримидинового производного ТП03 на активность аденилатциклазы (АЦ) в тестикулярных мембранах самцов крыс со среднетяжелой формой стрептозотоцинового СД1, а также влияние ХГЧ и ТП03 на уровни тестостерона в крови и экспрессию генов стероидогенных белков в семенниках диабетических крыс в условиях однократного и пятидневного введения препаратов. В условиях СД1 в тестикулярных мембранах снижались стимулирующие АЦ эффекты ХГЧ, ТП03 и гуаниновых нуклеотидов, возрастали значения EC50 для эффектов ХГЧ и ТП03, что указывает на ослабление чувствительности рецепторов ЛГ/ХГЧ к ХГЧ и ТП03 при СД1 и может быть связано со снижением функциональной активности гетеротримерных G-белков. У диабетических крыс со сниженным базальным уровнем тестостерона в значительной степени ослаблялись стероидогенные эффекты однократно вводимых ХГЧ и ТП03, но при этом эффект ХГЧ существенно превосходил эффект ТП03. При пятидневной обработке диабетических крыс ХГЧ и ТП03 снижался только стероидогенный эффект гонадотропина, в то время как соответствующий эффект ТП03 не менялся и становился сопоставимым с эффектом ХГЧ. При пятидневном введении в семенниках контрольных и диабетических крыс регуляторные эффекты ТП03 на экспрессию стероидогенных белков были сходными. Соединение ТП03, в отличие от ХГЧ, не снижало экспрессию гена Lhr, кодирующего рецептор ЛГ/ХГЧ, в контрольной и диабетической группах, предотвращая, тем самым, ослабление чувствительности семенников к гонадотропинам при СД1. Таким образом, низкомолекулярный агонист ТП03 является эффективным стимулятором синтеза тестостерона при тяжелом СД1 с характерной для него андрогенной недостаточностью.
ВВЕДЕНИЕ
Сахарный диабет 1-го типа (СД1), для которого характерны острый дефицит инсулина и сильно выраженная гипергликемия, сопровождается дисфункциями мужской и женской репродуктивных систем, дефицитом половых стероидных гормонов, нарушениями гаметогенеза и фолликулогенеза. В результате этого нарушается половое поведение, снижается фертильность и возникает бесплодие. Основными причинами репродуктивных дисфункций являются нарушения в различных звеньях гипоталамо-гипофизарно-гонадной оси, включая снижение секреции гонадолиберина, рилизинг-фактора лютеинизирующего (ЛГ) и фолликулостимулирующего гормонов гипоталамическими нейронами, ослабление регуляторных эффектов гонадотропинов на гонады и ингибирование в них процессов стероидогенеза и гаметогенеза [1, 2]. Для коррекции нарушений в гонадной оси необходимы как системная терапия СД1 с помощью инсулина, так и применение подходов, восстанавливающих функции репродуктивной системы. В наибольшей степени для этого подходят гонадотропины, поскольку использование гонадолиберина после мощной активации продукции гонадотропинов на начальном этапе в дальнейшем приводит к ингибированию их синтеза и дефициту половых стероидных гормонов, а заместительная терапия стероидными гормонами по механизму обратной отрицательной связи подавляет активность всей гонадной оси. Однако применяемые в клинике препараты гонадотропинов имеют ряд серьезных недостатков, что обусловлено их гетерогенностью, низкой селективностью по отношению к внутриклеточным сигнальным каскадам, быстрым снижением чувствительности к ним тканей-мишеней. При этом обычно используемые рекомбинантные формы гонадотропинов, хотя и являются относительно гомогенными препаратами, но существенно отличаются от природных гормонов по посттрансляционным модификациям, в первую очередь, по паттерну N-гликозилирования, что модифицирует их активность. В то же время выделяемый из мочи хорионический гонадотропин человека (ХГЧ), структурный и функциональный гомолог ЛГ, хотя и сохраняет структуру нативного ХГЧ, но содержит ряд нежелательных примесей [3].
Эффективность ЛГ и ХГЧ при коррекции репродуктивных функций и дефицита стероидных гормонов в условиях СД1 в значительной степени снижается, особенно при тяжелых и среднетяжелых формах заболевания [2, 4]. Одной из причин этого является снижение числа функционально активных рецепторов ЛГ/ХГЧ в репродуктивных тканях, а также нарушение передачи генерируемого гонадотропинами сигнала в клетках-мишенях вследствие усиления в них стресса эндоплазматического ретикулума, нарушения окислительно-восстановительного баланса и усиления активности факторов воспаления [5, 6]. Альтернативой ЛГ и ХГЧ являются низкомолекулярные агонисты рецептора ЛГ/ХГЧ, которые в отличие от гонадотропинов, с высоким сродством связывающихся с внеклеточным доменом, проникают в полость трансмембранного канала рецептора и специфично связываются с расположенным там аллостерическим сайтом. Наибольшие успехи достигнуты в разработке низкомолекулярных агонистов рецептора ЛГ/ХГЧ, имеющих структуру производных тиенопиримидина [7–11]. Ранее нами было показано, что 5-амино-N-трет-бутил-2-(метилсульфанил)-4-(3-(никотинамидо)фенил)тиено[2,3-d]пиримидин-6-карбоксамид (ТП03) с активностью агониста рецептора ЛГ стимулирует ответственные за стероидогенез cAMP-зависимые каскады в клетках Лейдига и усиливает продукцию ими тестостерона в условиях in vitro, а также повышает уровень этого гормона при внутрибрюшинном и пероральном способах введения самцам крыс [11, 12]. Молекулярные механизмы действия гонадотропинов и ТП03 на системы клетки, компетентные к ЛГ и ХГЧ, характеризуются рядом отличий, обусловленных различными сайтами их связывания и аллостерическими влияниями [12, 13]. Вследствие этого их восстанавливающий эффект на дефицит стероидных гормонов при СД1 может существенно различаться. С целью проверки этого предположения, проведено сравнительное исследование, в рамках которого изучали стимулирующее влияние ТП03 и ХГЧ на активность аденилатциклазной системы в тестикулярных мембранах самцов крыс со среднетяжелой формой стрептозотоцинового СД1 в условиях in vitro, а также регуляторные эффекты ТП03 и ХГЧ на уровень тестостерона в крови и на экспрессию генов стероидогенных белков в семенниках диабетических крыс в условиях in vivo.
МАТЕРИАЛЫ И МЕТОДЫ
В исследовании использовали самцов крыс Вистар (возраст 4–5 месяцев), которых содержали в стандартных условиях. Все эксперименты выполняли в строгом соответствии с требованиями Комитета по биоэтике ИЭФБ РАН и European Communities Council Directive 1986 (86/609/EEC). СД1 средней тяжести индуцировали у мышей однократным введением стрептозотоцина (в/б, 45 мг/кг). Развитие СД1 оценивали через 10 дней по уровню глюкозы в крови, отбирая крыс с постпрандиальным уровнем глюкозы выше 12 мМ. Концентрацию глюкозы измеряли в крови, взятой из хвостовой вены, с помощью тест-полосок “One Touch Ultra” (США). Контрольным животным вместо стрептозотоцина в том же объеме и в те же сроки вводили его растворитель – 0.1 М цитратный буфер (pH 4.5).
Через 5 недель после индукции СД1 часть диабетических животных (n = 5), декапитировали под наркозом, забирали у них ткани семенников и использовали их для выделения плазматических мембран и оценки функциональной активности аденилатциклазной системы. Параллельно те же процедуры проводили с контрольными животными (n = 5). Оставшиеся контрольные и диабетические крысы в течение 5 дней получали в 10.00 ХГЧ (Московский эндокринологический завод, Россия) в суточной дозе 100 МЕ/крысу (п/к) (группы КГ и ДГ, n = 5) или ТП03 в суточной дозе 15 мг/кг (в/б) (КТ и ДТ, n = 5). Контрольные (К, n=5) и диабетические крысы (Д, n = 5) без обработки ХГЧ и ТП03 вместо препаратов получали их растворители. В первый день эксперимента измеряли начальный уровень тестостерона (9.00) и оценивали его изменение через 1 (11.00), 3 (13.00) и 5 ч (15.00) после введения ХГЧ или ТП03, рассчитывая значения площади под кривыми “концентрация тестостерона (нМ) – время (ч)” (AUC). На пятый день оценивали уровень тестостерона через 3 ч после введения препаратов, декапитировали крыс под наркозом, забирали и взвешивали ткани семенников, которые далее использовали для оценки в них экспрессии целевых генов. В конце эксперимента в крови животных также оценивали уровни глюкозы, инсулина и лептина. Кровь забирали из хвостовой вены, концентрацию тестостерона определяли с помощью набора Тестостерон-ИФА (Алкор-Био, Россия), концентрацию инсулина и лептина – с помощью наборов Rat Insulin ELISA (Mercodia AB, Швеция) и ELISA Kit for Leptin (Cloud-Clone Corp., США).
Фракции плазматических мембран из семенников крыс выделялипроводили, как описано ранее [14]. Измельченные ткани семенников гомогенизировали при охлаждении на льду в 40 мМ Tрис-HCl-буфере (pH 7.5), содержащем 5 мМ MgCl2, 10% сахарозу и ингибиторы протеаз, после чего гомогенат центрифугировали (1500 g, 10 мин). Супернатант центрифугировали (20 000 g, 30 мин), осадок ресуспендировали в том же буфере без сахарозы, снова центрифугировали в тех же условиях. Осажденные мембраны ресуспендировали в 40 мМ Tрис-HCl-буфере (pH 7.5) и использовали для определения активности АЦ. Активность АЦ измерение, как описано ранее [15], для чего использовали инкубационную смесь, включающую 50 мМ Tрис-HCl (pH 7.5), 5 мМ MgCl2, 0.1 мМ cAMP, 1 мМ ATP, 20 мМ креатинфосфата, 0.2 мг/мл креатинфосфокиназы (Sigma, США), 37 кБк [α-32P]ATP (Всерегиональное объединение “Изотоп”, Россия). Реакцию начинали добавлением в пробу 50–100 мкг мембранного белка, проводили в течение 12 мин при 37°C, останавливали 100 мкл 0.5 M соляной кислоты, которую затем нейтрализовали имидазолом. Образовавшийся в результате ферментативной реакции [32P]cAMP отделяли с помощью адсорбционной хроматографии на нейтральном оксиде алюминия. Радиоактивность измеряли на счетчике LKB 1209/1215 RackBeta (LKB, Швеция). Активность АЦ выражали в пмоль cAMP/мин/мг мембранного белка.
Для проведения количественной ПЦР в реальном времени из семенников крыс выделяли суммарную РНК, используя реагент ExtraRNA (аналог TRIZol) (Evrogen, Россия). Обратную транскрипцию проводили, используя набор MMLV RT Kit (Evrogen, Россия). Амплификационный сигнал детектировали с помощью прибора 7500 Real-Time PCR System (Thermo Fisher Scientific Inc., США). Экспрессию генов, кодирующих рецептор ЛГ (Lhr), StAR-белок (Star), цитохромы Р450scc (Cyp11a1) и Р450-17α (Cyp17a1), дегидрогеназы 3β-HSD (Hsd3b) и 17β-HSD (Hsd17b), определяли с помощью следующих праймеров: Lhr – CTGCGCTGTCCTGGCC (For) и CGACCTCATTAAGTCCCCTGAA (Rev); Star – AAGGCTGGAAGAAGGAAAGC (For) и CACCTGGCACCACCTTACTT (Rev); Cyp11a1 – TATTCCGCTTTGCCTTTGAG (For) и CACGATCTCCTCCAACATCC (Rev); Hsd3b – AGGCCTGTGTCCAAGCTAGTGT (For) и CTCGGCCATCTTTTTGCTGTAT (Rev); Cyp17a1 – CATCCCCCACAAGGCTAAC (For) и TGTGTCCTTGGGGACAGTAAA (Rev); Hsd17b – CCTTTGGCTTTGCCATGAGA (For) и CAATCCATCCTGCTCCAACCT (Rev). В качестве рефересного использовали ген Actb, кодирующий β‑актин. Результаты анализировали с использованием метода ΔΔСt. Значения RQ рассчитывали по отношению к контрольной группе.
Статистический анализ проводили с помощью программы Microsoft Office Excel 2007 (“AtteStat 12.5” и “Daniel’s XL Toolbox 6.52”). Нормальность распределения проверяли с помощью критерия Шапиро-Уилка. Для сравнения двух выборок с нормальным распределением использовали t-критерий Стьюдента, для сравнения трех и более групп – дисперсионный анализ с поправкой Бонферрони. Статистически значимыми считали различия при P < 0.05.
РЕЗУЛЬТАТЫ
В группе Д отмечали снижение массы тела, сильно выраженную гипергликемию, сниженные уровни инсулина и лептина, а также тенденцию к снижению массы семенников (табл. 1). У животных с СД1 продолжительностью 5 недель в течение промежутка времени от 9.00 до 15.00 уровень тестостерона в крови был статистически значимо снижен в сравнении с контролем. Значение AUC9.00–15.00 для интегрированной площади под кривыми концентрация тестостерона (нМ)–время (ч) у крыс группы Д составило 34% от значения у контрольных животных (34 ± 9 усл.ед. в группе Д против 99 ± 28 усл.ед. в группе К, P = 0.001). Эти данные указывают на развитие отчетливо выраженного андрогенного дефицита у самцов крыс со среднетяжелой формой СД1.
Таблица 1.
Масса тела и семенников, уровни глюкозы, инсулина и лептина в крови крыс с СД1 и влияние на эти показатели пятидневной обработки ХГЧ и ТП03 (M ± SD)
| Показатель | К | Д | ДГ | ДТ |
|---|---|---|---|---|
| Масса тела, г | 321 ± 16 | 289 ± 20* | 286 ± 6* | 291 ± 8* |
| Масса семенников, г | 3.27 ± 0.16 | 3.15 ± 0.13 | 3.56 ± 0.33# | 3.29 ± 0.17 |
| Глюкоза, мМ | 5.5 ± 0.8 | 24.8 ± 4.9* | 25.2 ± 4.1* | 23.3 ± 5.3* |
| Инсулин, нг/мл | 0.73 ± 0.15 | 0.14 ± 0.04* | 0.16 ± 0.07* | 0.17 ± 0.05* |
| Лептин, нг/мл | 1.35 ± 0.42 | 0.83 ± 0.25* | 0.87 ± 0.30 | 0.93 ± 0.29 |
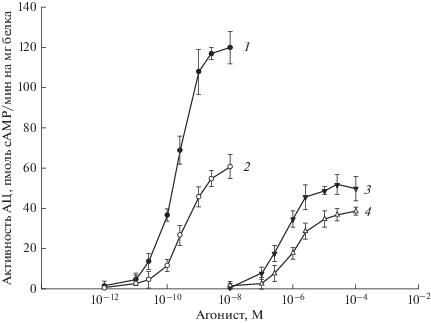
В тестикулярных мембранах диабетических крыс базальная активность АЦ, а также активность, стимулированная 5’-гуанилилимидодифосфатом (ГИДФ), негидролизуемым аналогом GTP, и дитерпеном форсколином, составили 17 ± 2, 185 ± 11 и 84 ± 4 пмоль cAMP/мин/мг мембранного белка, соответственно, и эти показатели были ниже, чем в контроле, где они составили 25 ± 2, 249 ± 9 и 157 ± 6 пмоль cAMP/мин/мг мембранного белка (P < 0.05). Эти данные свидетельствуют об ослаблении каталитической активности АЦ, на что указывают снижение базальной активности и стимулирующего эффекта форсколина, действующего на каталитический сайт фермента, а также об ослаблении сопряжения АЦ с Gs-белком, о чем свидетельствует снижение стимулирующего АЦ эффекта ГИДФ. Еще более заметно снижались стимулирующие АЦ эффекты ХГЧ и ТП03 (рис. 1). Так, при СД1 значения AUC, представляющие собой интегрированную площадь под кривыми прирост активности АЦ (пмоль сAMP/мин/мг белка)–концентрация агониста(M), для АЦ эффектов ХГЧ и ТП03 составили 508 ± 62 и 478 ± 46 усл.ед., в то время как у контрольных крыс они были существенно выше – 1208 ± 64 и 809 ± 53 усл.ед. соответственно (P < 0.0001). Снижение AUC обусловлено не только уменьшением максимального стимулирующего АЦ эффекта агонистов, но и снижением их сродства к рецептору ЛГ/ХГЧ. Так в семенниках контрольных и диабетических крыс значения EC50 для АЦ эффекта ХГЧ составили 0.207 ± 0.014 и 0.387 ± 0.056 нМ (P < 0.01), для АЦ эффекта ТП03 – 473 ± 80 и 1080 ± 227 нМ (P < 0.01).
Рис. 1.
Стимулирующий эффект ХГЧ и ТП03 на базальную активность АЦ в тестикулярных мембранах контрольных и диабетических крыс. 1 – Контроль, ХГЧ; 2 – диабет, ХГЧ; 3 – контроль, ТП03; 4 – диабет, ТП03. По оси ординат представлен прирост активности АЦ (пмоль сAMP/мин на 1 мг белка), по оси абсцисс – концентрация ХГЧ и ТП03 (M). Данные представлены как M ± SD, n = 5.
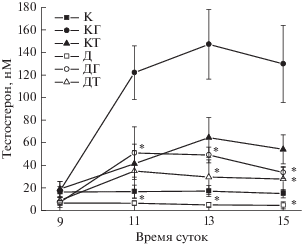
Однократная обработка контрольных и диабетических крыс ХГЧ и ТП03 приводила к повышению уровня тестостерона в крови, причем стероидогенный эффект обоих препаратов в группе Д был существенно ниже, чем в контроле, на что указывает снижение значений AUC9.00-15.00 для кривых концентрация тестостерона (нМ)–время (ч) у диабетических крыс, обработанных ХГЧ и ТП03 (рис. 2). Значения AUC9.00-15.00 в группах КГ и КТ составили 546 ± 105 и 224 ± 55 усл.ед., в то время как в группах ДГ и ДТ – 183 ± 39 и 117 ± 34 усл.ед, что на 66 и 48% ниже, чем в соответствующих контрольных группах. Уровни тестостерона во всех временных точках при обработке диабетических крыс ХГЧ и ТП03 статистически значимо отличались от значений в группах КГ и КТ, за исключением уровня гормона в группах КТ и ДТ через 1 ч после обработки ТП03 (рис. 2).
Рис. 2.
Стимулирующий эффект ХГЧ и ТП03 на уровень тестостерона в крови контрольных и диабетических крыс при однократном введении препаратов. К – Kонтроль; КГ – контроль + ХГЧ; КТ – контроль + + ТП03, Д – диабет; ДГ – диабет + ХГЧ; ДТ – диабет + + ТП03. * ‒ различия между группами К и Д, КГ и ДГ, КТ и ДТ статистически значимы при P < 0.05. Данные представлены как M ± SD, n = 5.
Обработка диабетических крыс с ХГЧ и ТП03 в течение 5 дней не влияла существенно на массу тела, уровни глюкозы, инсулина и лептина (табл. 1). Не выявлено влияния на эти показатели и обработки теми же препаратами контрольных животных (данные не представлены). Введение ХГЧ контрольным и диабетическим крысам приводило к статистически значимому повышению у них массы семенников. У контрольных крыс она повышалась в сравнении с необработанными животными на 12% (до 3.65 ± 0.13 г, P< 0.05 в сравнении с группой К), у диабетических крыс – на 13% (табл. 1). Обработка крыс с помощью ТП03 в небольшой степени повышала массу семенников у контрольных и диабетических крыс, но отличия от групп К и Д не были статистически значимыми.
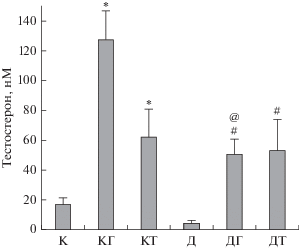
У контрольных животных стимулирующий эффект ХГЧ на продукцию тестостерона в пятый день (через 3 ч после обработки) немного снижался в сравнении с первым днем, а эффект ТП03 не менялся (рис. 2, 3). В группе диабетических крыс, которых 5 дней обрабатывали ХГЧ, стероидогенный эффект гонадотропина менялся незначительно, оставаясь существенно ниже, чем в группе КГ. В группе с ТП03 стероидогенный эффект низкомолекулярного агониста, оцениваемый по приросту уровня тестостерона в сравнении с группой Д, повышался в среднем в 2 раза и становился сопоставимым с группой КТ (рис. 2, 3). Таким образом, в отличие от ХГЧ, стимулирующий эффект ТП03 на продукцию тестостерона при его длительном введении диабетическим крысам возрастал, что не наблюдали у контрольных животных, и это указывает на кумулятивность стероидогенного эффекта этого низкомолекулярного агониста в условиях СД1.
Рис. 3.
Уровни тестостерона через 3 ч после обработки контрольных и диабетических крыс ХГЧ и ТП03 в пятый день эксперимента. Различия между контролем и группами КГ и КТ (*), между группой Д и группами ДГ и ДТ (#), а также между группами КГ и ДГ (@) статистически значимы при P < 0.05. Данные представлены как M ± SD, n = 5.
На заключительном этапе в семенниках крыс, получавших в течение 5 дней ХГЧ и ТП03, оценивали экспрессию генов, кодирующих рецептор ЛГ (Lhr), транспортный белок StAR (Star), осуществляющий перенос холестерина в митохондрии (скорость-лимитирующая стадия стероидогенеза), цитохром Р450scc (Cyp11a1), катализирующий конверсию холестерина в прегненолон, 3β-гидроксистероиддегидрогеназу 3β-HSD (Hsd3b), превращающую прегненолон в прогестерон, цитохром Р450-17α (Cyp17a1), превращающий прогестерон в 17-гидроксипрогестерон и далее в андростендион, и 17β-гидроксистероиддегидрогеназу 17β-HSD (Hsd17b), осуществляющую заключительную стадию синтеза тестостерона.
В семенниках крыс с СД1 экспрессия генов Lhr и Star в сравнении с контрольными животными статистически значимо снижалась, в то время как экспрессия генов, кодирующих ферменты стероидогенеза, существенно не менялась (рис. 4). Обработка ХГЧ здоровых крыс снижала экспрессию генов Lhr и Hsd17b и при этом в значительной степени повышала экспрессию других изученных генов. В условиях СД1 стимулирующий эффект ХГЧ на экспрессию генов Star, Cyp11a и Cyp17a сохранялся, но был выражен в меньшей степени, чем в контроле, в то время как эффект ХГЧ на экспрессию гена Hsd3b усиливался с 62 до 240%. При этом в группе ДГ не выявлено ингибирующего эффекта ХГЧ на экспрессию гена дегидрогеназы 17β-HSD, которая сохранялась на контрольном уровне. Необходимо отметить, что в группе ДГ экспрессия гена Lhr в значительной степени подавлялась ‒ до 11 и 16% от уровня в группах К и Д (рис. 4).
Рис. 4.
Экспрессия генов Lhr, Star, Cyp11a, Hsd3b, Cyp17a и Hsd17b в семенниках контрольных и диабетических крыс и влияние пятидневной обработки ХГЧ и ТП03. К – Kонтроль; КГ – контроль + ХГЧ; КТ – контроль + ТП03, Д – диабет; ДГ – диабет + ХГЧ; ДТ – диабет + ТП03. Различия между контролем и другими группами (*), между группой Д и группами ДГ и ДТ (#), а также между группами КГ и ДГ или КТ и ДТ (@) статистически значимы при P < 0.05. Данные представлены как M ± SD, n = 5.
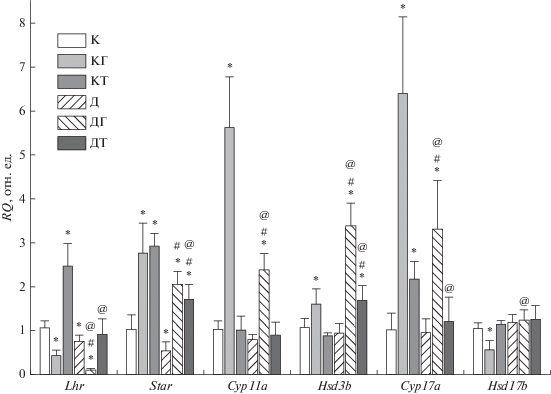
Обработка ТП03 контрольных крыс повышала экспрессию генов, кодирующих белок StAR и цитохром Р450-17α, слабо влияя на другие ферменты стероидогенеза. При этом ТП03 в 2.5 раза повышал экспрессию гена Lhr, вызывая эффект, противоположный таковому ХГЧ. В группе ДТ также не выявлено снижения экспрессии гена Lhr, которая имела тенденцию к повышению и не отличалась от этого показателя в группе К (рис. 4). При СД1 стимулирующие эффекты ТП03 на экспрессию генов Star и Cyp17a снижались, но статистически значимые отличия от групп Д и К отмечены только для гена Star. В то же время в группе ДТ значимо повышалась экспрессия гена Hsd3b (рис. 4). Таким образом, изменения экспрессии генов стероидогенеза при обработке контрольных и диабетических крыс ХГЧ и ТП03 в значительной степени зависят от природы агониста рецептора ЛГ/ХГЧ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Дефицит андрогенов у мужчин при СД1 влечет за собой ослабление репродуктивных функций, что выражается в снижении либидо, нарушении сперматогенеза и, в конечном итоге, приводит к бесплодию [1, 2]. Применение ЛГ и ХГЧ не может в полной мере компенсировать сниженную при СД1 продукцию половых стероидных гормонов. Это обусловлено ослаблением ответа семенников на гонадотропины с ЛГ-активностью в условиях СД1, как это показано при лечении пациентов с СД1 препаратами ХГЧ [16, 17]. Ранее нами в экспериментах in vitro выявлено снижение стимуляции гонадотропинами АЦ в тестикулярных мембранах крыс со стрептозотоциновыми моделями СД1 и СД2, а также ослабление стероидогенного ответа на ХГЧ у крыс с различными по тяжести формами стрептозотоцинового СД1 [18, 19].
В рамках предпринятого исследования при изучении функциональной активности ЛГ-компетентной аденилатциклазной системы в тестикулярных мембранах семенников диабетических крыс обнаружено значительное снижение ответа АЦ на стимуляцию ХГЧ и ТП03 в условиях среднетяжелого СД1. При этом снижался как максимальный АЦ-стимулирующий эффект гонадотропина и ТП03, так и их сродство к рецептору, оцениваемое по значениям EC50 для АЦ эффектов. Это указывает на ослабление передачи генерируемого ХГЧ и ТП03 сигнала с рецептора ЛГ/ХГЧ к АЦ в условиях диабетической патологии. Обнаружено также, что в тестикулярных мембранах диабетических крыс снижается стимуляция АЦ негидролизуемым аналогом GTP (ГИДФ), что свидетельствует о нарушении функционального взаимодействия Gs-белка, ключевого компонента сигнального пути ЛГ/ХГЧ, с ферментом АЦ. Установлено, что функциональная активность АЦ и нижележащих cAMP-зависимых эффекторных белков, в том числе cAMP-активируемого транскрипционного фактора CREB, играет определяющую роль в реализации стероидогенных эффектов гонадотропинов в клетках Лейдига, поскольку через аденилатциклазную сигнальную систему осуществляется регуляции активности и экспрессии транспортного белка StAR, контролирующего процесс переноса холестерина в митохондрии, где осуществляются начальные стадии стероидогенеза, а также регулируется экспрессия ряда других стероидогенных белков [20, 21]. Вследствие этого, выявленное нами ослабление передачи генерируемого ХГЧ и ТП03 сигнала через рецептор ЛГ/ХГЧ может быть одной из ключевых причин андрогенного дефицита, характерного для пациентов и экспериментальных животных с СД1.
Одними из причин снижения активности рецептора ЛГ/ХГЧ и его сродства к ХГЧ может быть изменение паттерна гликозилирования рецептора в условиях продолжительной и сильно выраженной гипергликемии, а также нарушение его посттрансляционного процессинга в условиях повышения содержания активных форм кислорода и ослабления системы антиоксидантной защиты в семенниках. В этой связи необходимо отметить, что в условиях диабетической патологии в семенниках в значительной степени усиливаются процессы воспаления, окислительный стресс и стресс эндоплазматического ретикулума [5, 6, 22]. Определенный вклад в ослабление функций рецептора ЛГ/ХГЧ может вносить и снижение его экспрессии в семенниках. Однако, несмотря на статистически значимые отличия от контроля, снижение экспрессии гена Lhr в семенниках диабетических крыс было не очень значительным и, по нашему мнению, не может быть определяющей причиной снижения чувствительности АЦ тестикулярных мембран диабетических животных к гонадотропину. Однако полностью исключать этот фактор нельзя, поскольку имеются данные о снижении эффективности связывания гонадотропинов с рецепторами ЛГ/ХГЧ в семенниках крыс со стрептозотоциновой моделью тяжелой формы СД1 [23].
Показанное нами ослабление стероидогенного ответа семенников на ХГЧ в условиях in vivo может быть обусловлено не только нарушением функций ЛГ-компетентной аденилатциклазной системы, но и ослаблением активности и экспрессии стероидогенных белков. Мы показали, что в наибольшей степени при СД1 снижается экспрессия гена, кодирующего белок StAR, ключевой для стероидогенной функции. Ранее китайские ученые показали, что в клетках Лейдига в условиях сильно выраженной гипергликемии и повышения содержания конечных продуктов гликирования снижается не только экспрессия гена Star, но и генов Cyp11a1 и Hsd3b, кодирующих цитохром Р450scc и дегидрогеназу 3β-HSD [22], которая в нашем случае, однако, менялась незначительно. С этими изменениями они связывают ослабление ответа клеток Лейдига на обработку ХГЧ, не исследуя функциональную активность самой ЛГ-компетентной сигнальной системы.
Низкомолекулярные агонисты рецептора ЛГ/ХГЧ в отличие от гонадотропинов связываются с расположенным в трансмембранном канале аллостерическим сайтом. Имеются основания полагать, что в отличие от высокоаффинного ортостерического сайта, который является мишенью для гонадотропинов и локализован в значительном по размеру внеклеточном домене, характеристики связывания аллостерического сайта не столь чувствительны к нарушениям посттрансляционных модификаций рецептора и его гипергликозилированию в условиях СД1. Необходимо также отметить, что тиенопиримидиновые производные, в том числе разработанное нами гидрофобное соединение ТП03, легко проникают через плазматическую мембрану в цитоплазматическое пространство клетки. Внутри клетки они способны связываться с еще “незрелыми” рецепторами ЛГ/ХГЧ и стабилизировать их активную конформацию, облегчая транслокацию в плазматическую мембрану и функционируя как низкомолекулярные шапероны рецепторных молекул [8].
Нами показано, что при введении диабетическим крысам ТП03 в полной мере сохраняет способность стимулировать продукцию тестостерона и интратестикулярную экспрессию генов стероидогенных белков. Этот эффект обусловлен особенностями активации тиенопиримидиновыми производными рецептора ЛГ/ХГЧ и шапероноподобной активностью, присущей этим соединениям [7–9, 12, 13]. Необходимо подчеркнуть, что в группе ДТ уровень экспрессии гена, кодирующего рецептор ЛГ/ХГЧ, был значимо ниже, чем в группе КТ, в то время как стероидогенный эффект ТП03 в этих группах был сопоставимымым (рис. 3, 4). Эти данные свидетельствуют о том, что ТП03 в условиях СД1 запускает молекулярные механизмы, позволяющие повысить эффективность стимуляции рецептора ЛГ/ХГЧ даже при отсутствии стимуляции экспрессии этого рецептора, как это происходит в группе КТ.
Анализ влияния пятидневной обработки крыс ТП03 показал, что паттерн экспрессии генов стероидогенных белков в семенниках контрольных и диабетических крыс меняется в небольшой степени. Так, в группе ДТ, в сравнении с группой КТ, разнонаправлено менялась экспрессия лишь двух генов – Hsd3b и Cyp17a, кодирующих два последовательно работающих стероидогенных фермента. При этом различия в экспрессии генов стероидогенеза в группах животных, обработанных ТП03 и гонадотропином, были более значимыми. Совпадение выявлено только в стимуляции экспрессии гена Star, причем как в контроле, так и при СД1. Эти данные свидетельствуют о специфичности стимуляции экспрессии генов ферментов стероидогенеза агонистами рецептора ЛГ/ХГЧ, которые различаются механизмами действия, причем вклад СД1 в такую специфичность сравнительно небольшой.
Исключительно важно то, что, не вызывая гиперактивации экспрессии генов стероидогенных белков и не ингибируя экспрессию гена Lhr, кодирующего рецептор ЛГ/ХГЧ, в условиях среднетяжелой формы диабета соединение ТП03 не уступало по величине стероидогенного эффекта ХГЧ, наиболее мощному из известных стимуляторов стероидогенной активности в репродуктивных клетках. На основании этого можно сделать обоснованный вывод, что при СД1 низкомолекулярные агонисты рецептора ЛГ/ХГЧ являются хорошей альтернативой гонадотропинам. При этом при увеличении продолжительности терапии диабетических крыс с помощью ТП03 отмечено парадоксальное усиление его стимулирующего эффекта на стероидогенез, что полностью противоположно стероидогенному эффекту гонадотропинов, который угасает при их длительном воздействии на клетки-мишени.
Таким образом, в условиях СД1 в тестикулярных мембранах в значительной степени снижаются стимулирующие АЦ эффекты ХГЧ, ТП03 и ГИДФ, негидролизуемого аналога GTP, а также возрастают значения EC50 для стимулирующих эффектов ХГЧ и ТП03. Это свидетельствует об ослаблении чувствительности рецепторов ЛГ/ХГЧ к обоим агонистам, ХГЧ и ТП03, в условиях среднетяжелой формы СД1 и указывает на возможную роль сниженной активности гетеротримерных G-белков. У диабетических крыс снижался как базальный уровень тестостерона, так и в значительной степени ослаблялись стероидогенные эффекты однократно вводимых ХГЧ и ТП03, причем эффект ХГЧ при этом существенно превышал эффект ТП03. При пятидневной обработке диабетических крыс ХГЧ и ТП03 снижался стероидогенный эффект гонадотропина, в то время как соответствующий эффект ТП03 практически не менялся и становился сопоставимым с эффектом ХГЧ. Наряду с этим при пятидневном введении регуляторные эффекты ТП03 на экспрессию стероидогенных белков в семенниках контрольных и диабетических крыс были сходными. Соединение ТП03, в отличие от ХГЧ, ни в контрольной, ни в диабетической группах не снижало экспрессию гена Lhr, кодирующего рецептор ЛГ/ХГЧ, предотвращая тем самым ослабление чувствительности семенников к гонадотропинам при СД1.
Полученные нами данные свидетельствуют о том, что низкомолекулярный агонист ТП03 можно рассматривать как эффективный стимулятор синтеза тестостерона при тяжелых формах СД1 с характерной для этого заболевания сильно выраженной андрогенной недостаточностью и нарушениями репродуктивных функций. Необходимо подчеркнуть, что пациенты с СД2 и метаболическим синдромом также часто имеют признаки гипогонадизма и дефицит стероидогенной функции яичек [24]. Среди причин репродуктивных дисфункций при этих метаболических расстройствах важную роль играют инсулиновая и лептиновая резистентность, негативно влияющая на чувствительность клеток Лейдига к гонадотропинам с ЛГ-активностью [25]. Вследствие этого низкомолекулярные агонисты рецептора ЛГ/ХГЧ в перспективе могут использоваться и для коррекции андрогенного дефицита, и лечения ассоциированного с ним бесплодия у пациентов с СД2 и метаболическим синдромом.
Работа выполнена при финансовой поддержке РНФ (проект № 19-75-20122).
Список литературы
Schoeller E.L., Schon S., Moley K.H. 2012. The effects of type 1 diabetes on the hypothalamic, pituitary and testes axis. Cell Tissue Res. 349 (3), 839–847.
Jangir R.N., Jain G.C. 2014. Diabetes mellitus induced impairment of male reproductive functions: a review. Curr. Diabetes Rev. 10 (3), 147–157.
Шпаков А.О. 2018. Гонадотропины – от теории к клинической практике. Санкт-Петербург: Политех-пресс, 347 c. [Shpakov A.O. 2018. Gonadotropins – from theory to clinic practice. St.-Petersburg: Polytech-press. 347 p. (In Russ.)].
Шпаков А.О. 2010. Функциональное состояние гипоталамо-гипофизарно-гонадной системы при сахарном диабете. Пробл. эндокринол. 56 (5), 23–29. [Shpakov A. O. 2010. The functional state of the hypothalamic-pituitary-gonad system in diabetes mellitus. Probl. Endocrinol. 56 (5), 23–29. (In Russ.)].
Carruthers M. 2013. Testosterone deficiency syndrome: cellular and molecular mechanism of action. Curr. Aging Sci. 6 (1), 115–124.
Liu H., Lin S., Lv Q., Yang Q., Wu G., Hu J., Yang J. 2017. Taurine recovers testicular steroidogenesis and spermatogenesis in streptozotocin-induced diabetic rats. Adv. Exp. Med. Biol. 975 (Pt 2), 801–811.
van Koppen C.J., Zaman G.J., Timmers C.M., Kelder J., Mosselman S., van de Lagemaat R., Smit M.J., Hanssen R.G. 2008. A signaling-selective, nanomolar potent allosteric low molecular weight agonist for the human luteinizing hormone receptor. Naunyn Schmiedebergs Arch. Pharmacol. 378 (5), 503–514.
Newton C.L., Whay A.M., McArdle C.A., Zhang M., van Koppen C.J., van de Lagemaat R., Segaloff D.L., Millar R.P. 2011. Rescue of expression and signaling of human luteinizing hormone G protein-coupled receptor mutants with an allosterically binding small-molecule agonist. Proc. Natl. Acad. Sci. USA. 108 (17), 7172–7176.
van de Lagemaat R., Raafs B.C., van Koppen C., Timmers C.M., Mulders S.M., Hanssen R.G. 2011. Prevention of the onset of ovarian hyperstimulation syndrome (OHSS) in the rat after ovulation induction with a low molecular weight agonist of the LH receptor compared with hCG and rec-LH. Endocrinology. 152 (11), 4350–4357.
Nataraja S.G., Yu H.N., Palmer S.S. 2015. Discovery and development of small molecule allosteric modulators of glycoprotein hormone receptors. Front Endocrinol (Lausanne). 6, 142. https://doi.org/10.3389/fendo.2015.00142
Derkach K.V., Dar’in D.V., Bakhtyukov A.A., Lobanov P.S., Shpakov A.O. 2016. In vitro and in vivo studies of functional activity of new low molecular weight agonists of the luteinizing hormone receptor. Biochem. Moscow. Suppl. Ser. A. 10 (4), 294–300.
Бахтюков А.А., Соколова Т.В., Дарьин Д.В., Деркач К.В., Шпаков А.О. 2017. Сравнительное изучение стимулирующего эффекта низкомолекулярного агониста рецептора лютеинизирующего гормона и хорионического гонадотропина на стероидогенез в клетках Лейдига крысы. Рос. физиол. журн. им. И.М. Сеченова. 103 (10), 1181–1192.
Derkach K.V., Bakhtyukov A.A., Shpakov A.A., Dar’in D.V., Shpakov A.O. 2017. Specificity of heterotrimeric G protein regulation by human chorionic gonadotropin and low-molecular agonist of luteinizing hormone receptor. Cell Tissue Biol. 11 (6), 475–482.
Shpakov A.O., Derkach K.V., Dar’in D.V., Lobanov P.S. 2014. Activation of adenylyl cyclase by thienopyrimidine derivatives in rat testes and ovaries. Cell Tissue Biol. 8 (5), 400–406.
Derkach K.V., Bondareva V.M., Chistyakova O.V., Berstein L.M., Shpakov A.O. 2015. The effect of long-term intranasal serotonin treatment on metabolic parameters and hormonal signaling in rats with high-fat diet/low-dose streptozotocin-induced type 2 diabetes. Int. J. Endocrinol. 2015, 245459.
Cicognani A., Zappulla F., Bernardi F., Capelli M., Mazzanti L., Turchi S., Radetti G., Pirazzoli P., Cacciari E. 1978. Hypophyso-gonadal function in the diabetic child. Acta Paediatr Scand. 67 (2), 151–155.
Mikhailichenko V.V., Tiktinskii O.L., Sil’nitskii P.A., Vorokhobina N.V., Aleksandrov V.P. 1993. The pathogenesis of sexual disorders in men with diabetes mellitus. Urol. Nefrol. (Mosk). 2, 47–50.
Shpakov A.O., Derkach K.V., Bondareva V.M. 2009. Changes in hormone sensitivity of the adenylate cyclase signaling system in the testicular tissue of rats with neonatal streptozotocin-induced diabetes. Bull. Exp. Biol. Med. 148 (3), 394–398.
Бахтюков А.А., Деркач К.В., Шпаков А.О. 2019. Взаимосвязь между андрогенным дефицитом и ослаблением чувствительности аденилатциклазы к гонадотропинам в семенниках крыс со стрептозотоциновым диабетом различной степени тяжести. Рос. физиол. журн. им. И.М. Сеченова. 105 (1), 100–110.
Casarini L., Lispi M., Longobardi S., Milosa F., La Marca A., Tagliasacchi D., Pignatti E., Simoni M. 2012. LH and hCG action on the same receptor results in quantitatively and qualitatively different intracellular signaling. PLoS One. 7, e46682. https://doi.org/10.1371/journal.pone.0046682
Riccetti L., De Pascali F., Gilioli L., Potì F., Giva L.B., Marino M., Tagliavini S., Trenti T., Fanelli F., Mezzullo M., Pagotto U., Simoni M., Casarini L. 2017. Human LH and hCG stimulate differently the early signalling pathways but result in equal testosterone synthesis in mouse Leydig cells in vitro. Reprod. Biol. Endocrinol. 15 (1), 2.
Zhao Y.T., Qi Y.W., Hu C.Y., Chen S.H., Liu Y. 2016. Advanced glycation end products inhibit testosterone secretion by rat Leydig cells by inducing oxidative stress and endoplasmic reticulum stress. Int. J. Mol. Med. 38 (2), 659–665.
Tanaka M., Nakaya S., Kumai T., Watanabe M., Matsumoto N., Kobayashi S. 2001. Impaired testicular function in rats with diet-induced hypercholesterolemia and/or streptozotocin-induced diabetes mellitus. Endocr. Res. 27 (1-2), 109–117.
Дедов И.И., Мельниченко Г.А., Шестакова М.В., Роживанов Л.В., Терехова А.Л., Зилов А.В., Ладыгина Д.О., Курбатов Д.Г. 2017. Рекомендации по диагностике и лечению дефицита тестостерона (гипогонадизма) у мужчин с сахарным диабетом. Ожирение и метаболизм. 14 (4), 83–92.
Shpakov A.O., Ryzhov Ju.R., Bakhtyukov A.A., Der-kach K.V. 2018. The regulation of the male hypothalamic-pituitary-gonadal axis and testosterone production by adipokines. Adv. Testosterone Action. Ed. M. Estrada. Rijeka, Croatia: Intech. Open Access Publ. P. 25–57. https://doi.org/10.5772/intechopen.76321
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


